اسید و باز لوییس چیست؟ – به زبان ساده + تعریف و مثال
شیمیدانها به منظور بررسی مواد از ابعاد گوناگون، به دنبال الگوهایی در رفتار شیمیایی آنها هستند. مبتنی بر این الگوها و قاعدههای مشخص، مواد را در گروههایی تعریف شده جای داده و با یکدیگر مقایسه میکنند. اسید و باز، دو گونه بنیادین و بحثبرنگیز، با پیشینهای طولانی از گروههای دستهبندی و هویتبخشی مواد قلمداد میشوند که بر مبنای نظریههای دانشمندان مختلف، با شاخصهایی متفاوت شناسایی و ارزیابی میشوند. از مهمترین نظریههای ارائه شده در این راستا، «نظریه لوییس»، منتسب به همت دانشمندی امریکایی، آقای «گیلبرت نیوتن لوییس» است که در نوشته پیش رو، از سیر تکامل این نظریه تا تعریف قلمرو و سازوکار آن در تشخیص، تحلیل و تشریح گونههای اسیدها و بازها به بررسی عمیق و دقیق این نظریه و اسید و باز لوییس میپردازیم.
از اینرو، در این مطلب از مجله فرادرس ابتدا با نظریه اسید و باز لوییس و تاریخچه آن آشنا میشویم. سپس نحوه تشخیص اسید و بازهای لوییس را فرا میگیریم. در ادامه به بررسی انواع واکنشها و کاربردهای این دو ماده میپردازیم. در پایان نیز با مرور مثالها و سوالات متداول، نکات کلیدی را جمعبندی میکنیم. پس اگر به شیمی علاقهمند هستید، حتما همراه ما باشید.
نظریه اسید و باز لوییس
به مانند بسیاری از مفاهیم نسبی در دنیای علم، اسید و باز نیز دو مفهوم سیال در تاریخ شیمی بوده و تعاریف آنها در بستر زمان مشمول تغییراتی شده است. طوریکه در برخی برههها، چند نظریه و تعاریف متکی بر آنها، به طور همزمان معتبر بوده است. امروزه، تعداد کمی از این نظریهها همچنان در حال استفادهاند.
ممکن است برخی مواد مبتنی بر معیارهای یک تعریف، اسیدی یا بازی در نظر گرفته شوند، در حالیکه در برخی تعاریف دیگر اینطور نباشد که یادآور این نکته است که اسید و باز مفاهیمی نسبی -و نه مطلق- هستند.
همانطور که در مقدمه عنوان شد، «نظریه لوییس» به افتخار دانشمند امریکایی، آقای «گیلبرت نیوتن لوییس» (Gilbert Newton Lewis) به این نام نامگذاری شده است. ایشان در عرصههای ترمودینامیک و فتوشیمی فعالیتهایی ماندگار داشتهاند.
نظریه ایشان، بعد از نظریههای آرنیوس و برونستد-لوری و نارساییهای این نظریهها در توجیه رفتاری اسیدها و بازها، در سال ۱۹۲۳، با هدف ارائه راهکاری کاملتر برای طبقهبندی اسیدها و بازها پیشنهاد شد.
اسید و باز لوییس چیست؟
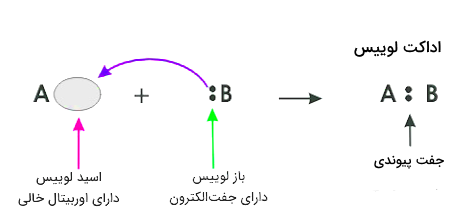
تعریف اسید و باز از منظر آقای لوییس، به نام «اسید و باز لوییس» را میتوانیم به شرح زیر بیاوریم:
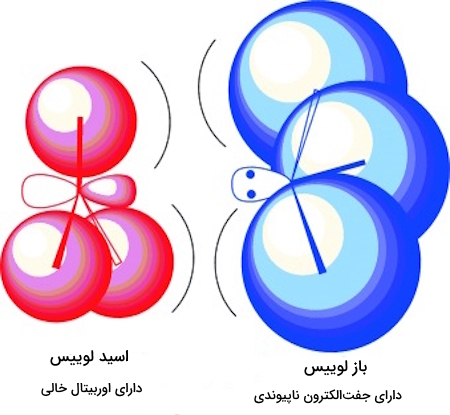
- اسید لوییس (Lewis Acic)، به اختصار (.L.A)، گیرنده (پذیرنده) جفتالکترون ناپیوندی و تشکیل دهنده پیوند است. یعنی دارای یک اوربیتال خالی است.
- باز لوییس (Lewis Base)، به اختصار (.L.B)، دهنده (اهداکننده) جفتالکترون ناپیوندی است.
اداکت یا محصول افزایشی اسید باز لوییس
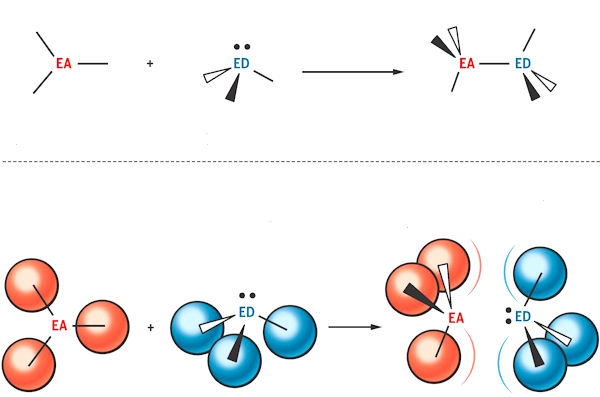
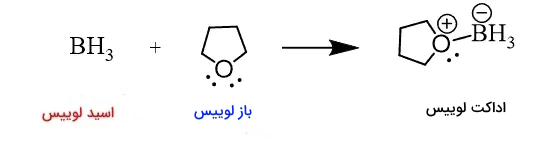
هنگامی که اسید لویس با باز لوییس واکنش میدهد، یعنی باز لوییس یک جفتالکترون به اسید لوییس داده و این جفتالکترون در اوربیتال خالی اسید جای گرفته و محصولی حاوی «پیوند کووالانسی کوردیناسی» (Coordinate Covalent Bond) یا «پیوند داتیو» (Dative Bond) تشکیل میدهد. این محصول به عنوان «محصول افزایشی» یا «ترکیب اضافی اسید-باز لوییس» (Lewis Acid–Base Adduct) و به اختصار «اداکت لوییس» (Lewis Adduct) شناخته میشود. همچنین این ترکیب در منابع با اسامی دیگری از جمله فزونورده، ترکیب اضافی و ... نیز ترجمه میشود.
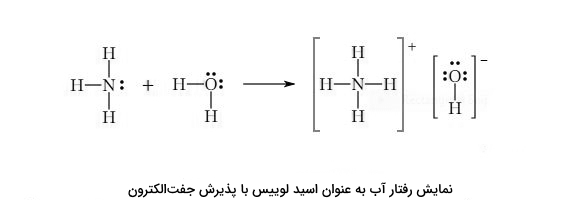
مثال: معادله شیمیایی زیر واکنش یک باز لوییس (آمونیاک) با اسید لوییس (بوران) را نشان میدهد:
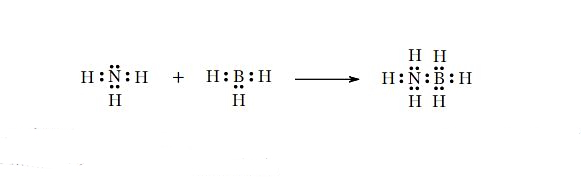
جفتالکترون نیتروژن در ترکیب شیمیایی آمونیاک میتواند با بور در ترکیب شیمیایی بوران پیوند ایجاد کند که محصول آنُ نمونه ای از ترکیب اضافی یا اداکت اسید-باز لوییس است.
ترکیب اضافی را میتوان با نشان دادن پیوند کووالانسی کوردیناسی بهصورت پیکان نمایش داد:
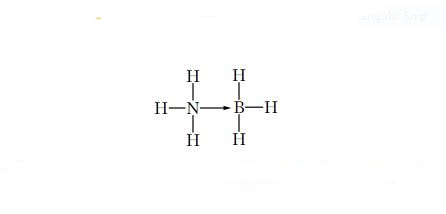
تفسیر واکنش بالا و نحوه شکلگیری اداکت: در مرکز مولکول $$BH_{3}$$، اتم بور قرار دارد که میتواند الکترونها را بپذیرد، از طرفی مولکول آمونیاک دارای یک جفت واکنشی روی نیتروژن است. پس میتوانیم پیشبینی کنیم که نیتروژن با بور پیوند ایجاد میکند.
مثال: تریمتیلبور (Trimethyl Boron)، یک گیرنده جفتالکترون یعنی اسید لوییس و آمونیاک غنی از الکترون (با نیتروژن)، یعنی باز لوییس است. حال وقتی جفتالکترون از «نیتروژن» در آمونیاک، به «بور» در تریمتیلبور منتقل میشود، اداکت لوییس مطابق شکل تشکیل میشود.

مثال: کدام یک از فرمول های شیمیایی زیر، اسید لوییس نیست؟
- $$H^{+}$$
- $$Mg^{+}$$
- $$NH_{3}$$
- $$AlCl_{3}$$
پاسخ: میدانیم اسید لوییس مادهای است که میتواند یک جفتالکترون را بپذیرد و پیوند تشکیل دهد. اگر گونهای دچار کمبودالکترون باشد، یعنی میتواند به عنوان اسید لوییس عمل کند. حال به سراغ تحلیل گزینهها میرویم:
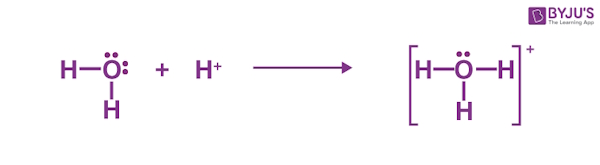
- یون هیدروژن ($$H^{+}$$) میتواند یک جفت ناپیوندی را از مولکول آب بگیرد و یونهای هیدرونیوم ($$H_{3}O^{+}$$) را تشکیل دهد.
- یون منیزیم ($$Mg^{2+}$$) میتواند در آب حل شود و یک جفت ناپیوندی را اهدا میکنند تا با آن پیوند ایجاد کنند. در این شرایط، ما مولکول های آب را لیگاند مینامیم.
- آمونیاک دارای یک جفت ناپیوندی است که نشان میدهد به جای کمبود الکترون، غنی از الکترون است. لایه ظرفیت اتمهای نیتروژن و هیدروژن کامل هستند و از این رو نمیتوانند یک جفت ناپیوندی از باز لوییس را بپذیرند.
- کلرید آلومینیوم (Aluminum Chloride) و تری فلوئوروبوران (Trifluoroborane)، هر دو دارای یک عنصر از گروه ۱۳ در مرکز خود هستند. اتمهای عناصر گروه ۱۳ فقط ۳ الکترون ظرفیت دارند. بنابراین حداکثر تعداد پیوندهای کووالانسی سادهای که میتوانند تشکیل دهند ۳ است، که در مجموع به آنها ۶ الکترون در لایه ظرفیت میدهد. اگر با باز لوییس پیوند برقرار کنند، میتوانند حتی پایدارتر نیز باشند.
و تنها گونهای از مجموعه داده شده که مانند اسید لوییس رفتار نمیکند آمونیاک ($$NH_{3}$$) است. پس پاسخ گزینه C است.
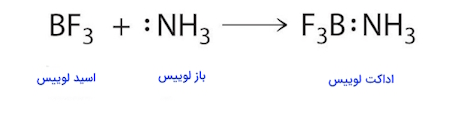
مثال: و مثال آخر در این راستا، واکنش بین $$BF_{3}$$ و $$NH_{3}$$ به عنوان اسید و باز لوییس و تشکیل اداکت لوییس است.
مواد آمفوتر لوییس
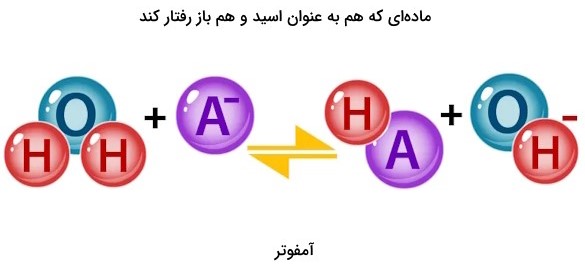
علاوه بر اسید و باز به طور اختصاصی، موادی هم هستند که برخی شرایط به عنوان اسید و در برخی شرایط دیگر در قالب باز ظاهر میشوند که تحت عنوان مواد آمفوتر لوییس (Lewis Amphoteric Substances) تعریف میشوند.
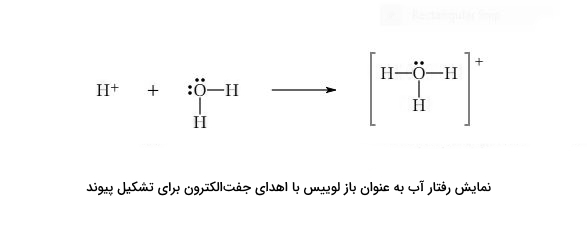
هنگامی که کلرید هیدروژن در آب حل میشود، مولکول آب با یون هیدروژن $$HCl$$ واکنش و تشکیل یون هیدرونیوم و یون کلرید میدهد. ما اغلب یون هیدرونیوم $$H_{3}O^{+}$$ را مانند $$H^{+}$$ تلقی میکنیم. با وجود این، هر زمانی $$H^{+}$$ ببینیم، در واقع با ترکیب اضافی اسید-باز لوییس مواجه هستیم. یکی از جفتهای ناپیوندی روی اکسیژن در آب اهدا میشود تا با $$H^{+}$$ پیوند برقرار کند.
در این مثال، آب به عنوان باز لوییس عمل میکند و جفت ناپیوندی را اهدا میکند. زمانی که آمونیاک به آب اضافه میشود، رفتار متفاوتی را از آب در تشکیل هیدروکسید آمونیوم میبینیم. در این مورد، این جفت ناپیوندی روی نیتروژن است که با یون $$H^{+}$$ پیوند ایجاد میکند. آنچه تشکیل میشود، یون آمونیوم ($$NH_4^+$$) و یون هیدروکسید ($$OH^{-}$$) است.
در این مثال، آب اسید لوییس است زیرا یکی از هیدروژنها جفتالکترون را از آمونیاک میپذیرد. بنابراین آب آمفوتریک است. یعنی آب میتواند در شرایطی اسید لوییس و در شرایط دیگر، باز لوییس باشد.
مقایسه کلیدی اسیدها و بازهای لوییس
جدول زیر، مشخصات کلی اسیدها و بازهای لوییس را در قالب مقایسهای طبقهبندی و توصیف میکند.
| مبنای مقایسه | اسید لوییس | باز لوییس |
| تعریف | پذیرنده جفتالکترون | اهداکننده جفتالکترون |
| ماهیت | الکتروفیل (الکتروندوست)* | نوکلئوفیل (هستهدوست)* |
| اوربیتالهای دخیل در ایجاد پیوند | استفاده از اوربیتال مولکولی $$LUMO$$* برای تشکیل پیوند | استفاده از اوربیتال مولکولی $$HOMO$$* برای تشکیل پیوند |
| ماهیت یونی | کاتیون | آنیون |
| نوع پیوند | مولکولهای دارای پیوند دوگانه قطبی | مولکولهای دارای پیوند چندگانه غیرقطبی |
| اوربیتالهای خالی $$d$$ | دارد (مولکولهایی که در آنها، اتم مرکزی، به دلیل اوربیتال خالی $$d$$، منبسط میشود. مانند $$FeCl_{3}$$) | ندارد (اکسیدهای فلزی فاقد اوربیتال $$d$$، مانند $$CaO$$، $$MgO$$) |
| سیستمهای $$\pi$$ | سیستمهای $$\pi$$ با کمبود الکترون | سیستمهای $$\pi$$ غنی از الکترون |
- الکتروفیل: الکتروفیلیا الکتروندوست (ترجمه عبارت Electrophile ، تلفیق دو کلمه Electro بر گرفته از الکترون و Phile به معنای دوست داشتن) گونههایی با کمبود الکترون هستند که میتوانند الکترون ها را بپذیرند، یعنی مانند اسید لوییس عمل میکنند.
- نوکلئوفیل: نوکلئوفیل یا هستهدوست (ترجمه عبارت Nucleophile، تلفیق دو کلمه Nucleo برگرفته از هسته و Phile به معنای دوست داشتن)، گونههای غنی از الکترون هستند که میتوانند الکترون اهدا بکنند، یعنی مانند باز لوییس عمل میکنند.
- اوربیتال مولکولی $$LUMO$$ یا لومو: «HOMO» مخفف (Highest Occupied Molecular Orbital) بالاترین اوربیتال مولکولی اشغال شده (پر شده) است.
- اوربیتال مولکولی $$HOMO$$ یا هومو: «LUMO» مخفف (Least Unoccupied Molecular Orbital) پایینترین اوربیتال مولکولی اشغال نشده (پر نشده) است.
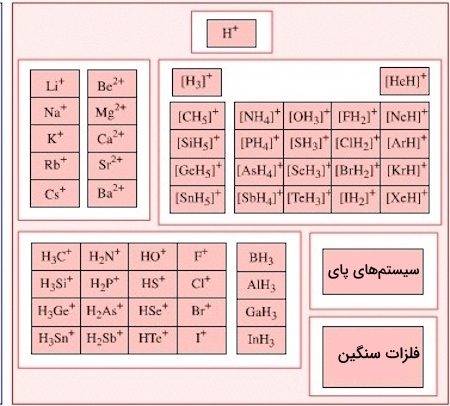
نمونههایی از اسیدهای لوییس
مثالهایی از گونههای دارای اوربیتال خالی یا به بیان دیگر، دارای کمبود الکترون که اسیدهای لوییس محسوب میشوند:
- یونهای $$H^{+}$$ (یا پروتونها) را میتوان به عنوان اسیدهای لوییس همراه با یونهای یونیوم مانند $$H_{3}O^{+}$$ در نظر گرفت.
- کاتیونهای عناصر دسته $$d$$، که حالتهای اکسیداسیون بالایی را نشان میدهند و میتوانند به عنوان گیرندههای جفتالکترون عمل کنند. نمونهای از چنین کاتیونی $$Fe^{3+}$$ است.
- کاتیونهای فلزاتی مانند $$Mg^{+}$$ و $$Li^{+}$$ میتوانند ترکیبات کوردینانتی (Coordination Compounds) را با آب به عنوان لیگاند (Ligand)، تشکیل دهند. این کمپلکسهای آبی میتوانند جفتالکترون را پذیرفته و مانند اسیدهای لوییس رفتار کنند.
- بورانها $$BH_{3}$$، $$R_{3}B$$
- تری هالیدهای آلومینیم (Aluminum Trihalides)
- $$Fe$$، $$Z$$ $$Zn$$ $$AlCl_{3}$$ و به طور کلی فلزات واسطه
- یونهای مختلف فلزات واسطه
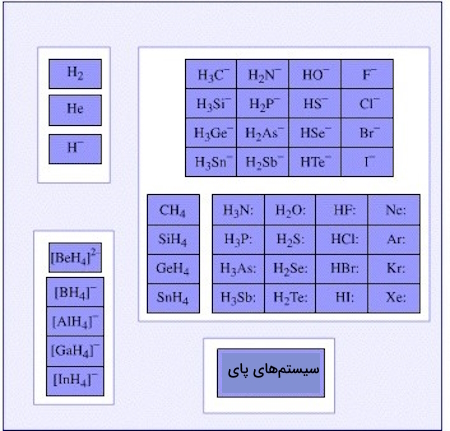
نمونههایی از بازهای لوییس
مثالهایی از گونههای دارای جفتالکترون ناپیوندی که بازهای لوییس محسوب میشوند:
- ترکیباتی که در آنها اکسیژن، گوگرد، سلنیوم و تلوریم (که به گروه ۱۶ جدول تناوبی تعلق دارند)، حالت اکسیداسیون $$2^{-}$$ را نشان میدهند، عموما بازهای لوییس هستند. نمونههایی از این ترکیبات عبارتاند از آب و کتونها (ketones).
- آنیونهای سادهای که دارای یک جفتالکترون هستند نیز میتوانند با اهدای این الکترونها به عنوان بازهای لوییس عمل کنند. نمونههایی از این آنیونها عبارتاند از: $$H^{-}$$ و $$F^{-}$$. حتی برخی از آنیونهای پیچیده، مانند آنیون سولفات ($$SO_4^-$$) میتوانند جفتالکترون اهدا کنند.
- π سیستمها، (π-systems) که غنی از الکترون هستند (مانند بنزن، اتین و اتن) قابلیت اهدای جفتالکترون بسیار خوبی را نشان میدهند.
- اسیدهای لوییس ضعیف که دارای بازهای لوییس مزدوج قوی هستند.
- بسیاری از ترکیبات شیمیایی که دارای یک جفتالکترون ناپیوندی هستند مانند $$CH_3^-$$ و $$OH^{-}$$، به دلیل قابلیت اهدای جفتالکترون به عنوان بازهای لوییس شناخته میشوند.
- هالیدها (halides) مانند $$I^{-}$$، $$Br^{-}$$، $$Cl^{-}$$، $$F^{-}$$
- اکسیدها
- هیدروکسید $$OH^{-}$$
- آب $$H_{2}O$$
- سیانید (Cyanide) $$CN^{-}$$
- گروههای سیانو (cyano groups) $$-C\equiv N$$
- آمینها ($$R_3N$$)
- آمونیاک ($$NH_3$$)
- پیریدین (Pyridine) و مشتقات پیریدین که این توانایی را دارند که به عنوان دهنده جفتالکترون عمل کنند.
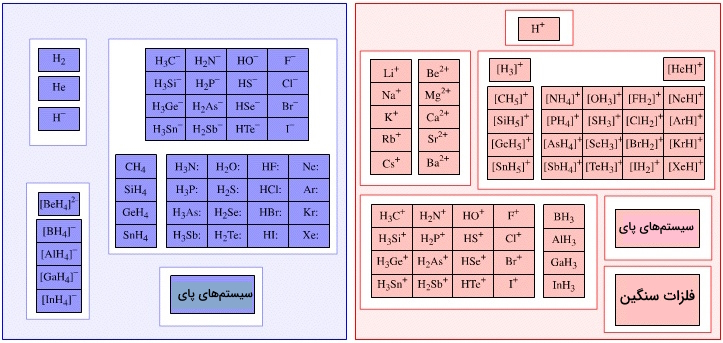
با نگاهی تطبیقی به دو جدول بالا در کنار هم از منظر لوییس، فرمتهای کلی اسیدها و بازها خود را نشان میدهد که در برای تشخیص سادهتر و سریعتر کمککننده خواهد بود.
مزایای نظریه اسید و باز لوییس
در اشاره به نقاط قوت این نظریه میتوان از موارد زیر نام برد:
- جامعتر از نظریه برونستد-لوری است و مواد بیشتری را پوشش میدهد.
- ویژگیهای اصلی اکسیدهای فلزی و اکسیدهای غیرفلزی را توضیح می دهد.
محدودیتهای نظریه اسید و باز لوییس
به مانند دیگر نظریهها، این نظریه نیز در کنار تمامی نقاط قوت خود، دارای محدودیتهایی هست که در این راستا میتوان به موارد زیر اشاره کرد:
- منطبق بر این نظریه، با ترکیب اسید و باز، معمولا پیوند کووالانسی کوردینانسی تشکیل میشود، ولی واکنشهای اسید و باز زیادی وجود دارد که در آنها پیوند کوالانسی غیرکوردینانسی تشکیل میشود، مانند:
$$HCl+NaOH\rightarrow Na+Cl^{-}+H_{2}O$$
- فرآیند یونیزاسیون و در نتیجه قدرت اسیدها و بازها را در بر نمیگیرد.
- واکنش اسید-باز خود به خود و پرسرعت رخ می دهد، اما بسیاری از واکنشهای اسید-باز لوییس بسیار کند هستند.
نگاهی مقایسهای به نظریه لوییس با نظریههای پیشین
پیش از ورود به مقایسه این سه نظریه شاخص در حیطه اسیدها و بازها، نگاهی میکنیم به تعاریف و تحلیلهای کلی دو نظریه دیگر، یعنی دو نظریه ماقبل نظریه لوییس و نارساییهای هریک که زمینهساز شکلگیری نظریه بعدی است.
نظریه اسید و باز آرنیوس
این نظریه، نخستین نظریه برای طبقهبندی و تفکیک اسیدها و بازها است که توسط دانشمند (فیزیکدان و شیمیدان) فاخر سوئدی، آقای «سوانت آرنیوس» (Svante Arrhenius)، بنیانگذار رشته جدید «شیمیفیزیک» (Physical Chemistry) در سال ۱۸۸۷ (قرن نوزدهم) ارائه شد.

بر اساس نظریه آرنیوس:
- اسیدها در محلولهای آبی پروتون ($$H^{+}$$) آزاد و تولید میکنند.
- بازها در محلولهای آبی یون هیدروکسید ($$OH^{-}$$) آزاد و تولید میکنند.
توجه شود که صحبت از محلولهای آبی است. یعنی اسیدهای آرنیوس، یون هیدروژن را به طور مشخص به آب میدهند. و مورد دیگر اینکه اشاره به واژههای آزاد و تولید بدین معناست که اگر در ساختار ماده، یونهای پروتون و هیدروکسید وجود داشته باشد، در محلول آبی آن را آزاد کرده است و اگر وجود نداشته باشد و در محصولات باشد، آن را تولید کرده است. حال اگر بخواهیم مفاهیم بالا را به زبان شیمی بازگو کنیم، خواهیم داشت:
$$HA(aq)\rightarrow H^{+}(aq)+ A^{-}(aq)$$
$$BOH(aq)\rightarrow B^{+}(aq)+ OH^{-}(aq)$$
در واکنشهای فوق، $$HA(aq)$$ نشاندهنده اسید آرنیوس و $$BOH(aq)$$، نشاندهنده باز آرنیوس است.
مثال: $$HCL$$ و $$NaOH$$ را به ترتیب، میتوانیم به عنوان نمونههایی از اسید و باز آرنیوس در نظر بگیریم.
$$HCl\rightarrow H^{+} + Cl^{-} $$
$$NaOH\rightarrow Na^{+} + OH^{-} $$
مزایای نظریه آرنیوس
نظریه آرنیوس از چندین جهت دارای نقاط قوت است که میتوان به شرح زیر به آنها اشاره داشت:
- پیشبینی خواص اسیدها و بازها
- پیشبینی قدرت اسیدها و بازها
- تبیین مفاهیم خنثیسازی* و هیدرولیز
خنثیسازی: وقتی مقدار مساوی اسید و باز با هم ترکیب میشوند، نمکی حاصل میشود که نه اسید و نه باز است و به این مفهوم خنثیسازی نیز گفته میشود که با نظریه آرنیوس کاملا توجیه میشود.
آب + نمک → باز آرنیوس + اسید آرنیوس
واکنش یونهای هیدروژن و یونهای هیدروکسید (آزاد یا تولید شده در اسید و بازهای آرنیوس) با یکدیگر، تشکیل آب میدهد.
محدودیتهای نظریه آرنیوس
چند چالش و به نوعی نارسایی در نظریه آرنیوس وجود دارد از جمله:
- کارایی نظریه محدود به محلولهای آبی است. یعنی تاکید بر آب به عنوان حلال و در حلالهای غیر آبی و گازی فاقد کارایی است.
- تاکید بر آزادسازی یا تولید یونهای پروتون و هیدروکسید
در حالیکه برخی مولکولها با اسیدها وارد واکنش شده و به عنوان باز عمل میکنند، اما هیدروکسید آزاد یا تولید نمیکنند.
مثال: واکنش بیکربناتسدیم (جوش شیرین) ($$NaHCO_{3}$$) یک باز است و با اسیدها بهصورت زیر واکنش نشان میدهد:
$$HCl + NaHCO_{3}\rightarrow NaCL +CO_{2} + H_{2}O $$
تبیین باز آرنیوس از زاویهای دیگر
شاید بتوانیم روش دیگری نیز برای تفسیر باز آرنیوس در نظر بگیریم: اجزایی که وقتی به آب اضافه میشوند، غلظت یونهای هیدروکسید را افزایش میدهند. این تعریف در مورد موادی نیز قابلیت اعمال دارد که شامل یون هیدروکسید نیستند، ولی در صورت واکنش با آب، غلظت یون هیدروکسید را در آن افزایش میدهند. مانند آمونیاک ($$NH_{3}$$)
یادآوری: این تفاوتهای نسبی و البته بعضا اساسی در تفسیر برخی نظریهها نشان میدهد که گاهی حتی تفسیرها از یک نظریه، میتواند تا حدی متفاوت باشد.
نظریه اسید و باز برونستد-لوری
در پی محدودیتهایی که در نظریه آرنیوس خود را نشان میدهد، در سال ۱۹۲۳، نظریه برونستد-لوری (Bronsted-Lowry) با هدف تعریفی با دامنه کاربردی وسیعتر از اسیدها و بازها، توسط دو دانشمند به نامهای «یوهانس برونستد» (Johannes Bronsted) و «توماس لوری» (Thomas Lowry)، به طور جداگانه ولی همزمان، ارائه شد. این نظریه موادی را نیز پوشش میدهد که در محلولها تولید یون هیدروکسید نمیکنند.

بر اساس نظریه برونستد-لوری:
- اسیدها در واکنش با بازها، اهداکننده (دهنده) پروتون
- بازها در واکنش با اسیدها، پذیرنده (جذبکننده، پذیرنده یا گیرنده) پروتون از دست رفته اسید، هستند.
یادآوری: منظور از پروتون، یون هیدروژن ($$H^{+}$$) است.
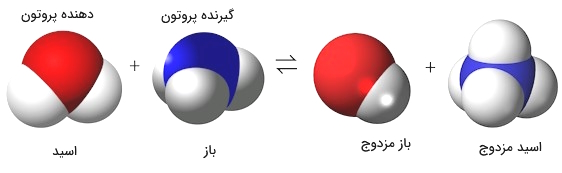
همانطور که مشخص است، محوریت نظریه برونستد-لوری، به واکنش بین اسید و باز است. یعنی نظریه در واکنشهای صورت گرفته بین این دو قابل تفسیر خواهد بود.
مثال: در زیر نمونههایی از واکنش بین اسید و باز برونستد-لوری را میبینیم.
$$HCl + NaHCO_{3}\rightarrow NaCL +CO_{2} + H_{2}O$$
$$HBr + NH_{3}\rightarrow NH_{4}Br$$
در واکنشهای بالا، $$HCl$$ و $$HBr$$، دهنده پروتون و اسید برونستد-لوری و $$NaHCO_{3}$$ و $$NH_{3}$$، پذیرنده پروتون و باز برونستد-لوری هستند.
یادآوری چند نکته در رابطه با دو نظریه برونستد-لوری و آرنیوس:
- در حالت کلی، اسید آرنیوس، اسید برونستد-لوری نیز هست. زیرا دارای یون هیدروژن است که میتواند اهدا کننده آن باشد. (دهنده پروتون)
- اسیدهای آرنیوس، آن دسته از گونههای شیمیایی تعریف میشوند که یون هیدروژن را به طور مشخص به آب میدهند.
- توجه به این نکته ضروری که بازهای ناپیوندی محدود به هیدروکسیدها نمیشوند. هر گونهای که بتواند پذیرنده پروتون باشد (با پروتون واکنش دهد)، (شامل $$OH^{-}$$ ولی نه محدود به آن)، باز محسوب میشود.
مزایای نظریه برونستد-لوری
برخی از مزایای نظریه برونستد را میتوان به شرح زیر نام برد:
- رفتار اسیدها و بازها را در حلال های آبی و غیرآبی تئوریزه میکند.
- میتواند ویژگی بازی موادی مانند $$Na_{2}CO_{3}$$ را تشخیص دهد که حاوی گروه $$OH$$ نیستند. (بر اساس نظریه، آرنیوس به این دلیل که نمیتواند پروتون بپذیرد، باز محسوب نمیشوند).
- محدود به مولکولها نبوده و گونههای یونی را نیز پوشش میدهد.
محدودیتهای نظریه برونستد-لوری
در اشاره به محدودیتهای نظریه برونستد-لوری، از موارد زیر میتوان نام برد.
- تاکید نظریه به واکنش بین اسید و باز است و توجهی به حلال ندارد. به عنوان مثال نمیتواند رفتار اسید-باز را در «حلالهای آپروتیک» (َAprotic Solvent)، مانند بنزن و دیاکسان* (Dioxane) تشخیص بدهد.
- در تشخیص واکنش بین اسیدها و بازهایی که در ساختار خود $$H^{+}$$ ندارند ناتوان است (به دلیل عدم «انتقال پروتون» که نظریه بر مبنای آن شکل گرفته است).
دیاکسان: مایعی شفاف که حلالیت بالایی در آب داشته و به عنوان حلال کاربردهای آزمایشگاهی و صنعتی بالایی دارد.
مثال: از جمله مواردی که مطابق نظریه برونستد-لوری قابل توجیه و تبیین نیست:
- در تشخیص واکنش بین اکسیدهای اسیدی ($$CO_{2}$$، $$SO_{3}$$، $$SO_{3}$$) و اکسیدهای بازی ($$BaO$$، $$CaO$$، $$Na_{2}O$$) که در ساختار خود $$H^{+}$$ ندارند.
- در تشخیص ماهیت اسیدی ترکیبات بدون پروتون مانند $$BF_{3}$$، $$AlCl_{3}$$، $$FeCl_{3}$$.
حال که دو نظریه پیش از نظریه لوییس را نیز مرور کردیم، میتوانیم به شباهتها و تفاوتهای نظریه لوییس با آنها نگاهی داشته باشیم. برای سهولت بررسیها، هر سه نظریه را در قالب جدول زیر پیادهسازی میکنیم.
| تعاریف گونهها | نظریه لوییس | نظریه آرنیوس | نظریه برونستد-لوری |
| اسید | پذیرنده جفتالکترون | تجزیه به پروتون $$OH^{-}$$ با انحلال در آب | اهداکننده پروتون |
| باز | اهداکننده جفتالکترون | تجزیه به یون هیدروکسید ($$OH^{-}$$) با انحلال در آب | پذیرنده پروتون |
تفاوت دیدگاه لوییس با آرنیوس و برونستد-لوری
همانطور که جدول بالا نیز به ما نشان میدهد، تفاوت نظریه لوییس با آرنیوس و برونستد-لوری که به در بعضی متون به اختصار برونستد آورده میشود، این است که در دیدگاه لوییس به جای تمرکز بر پروتون، از نقطهنظر الکترونها، به بررسی و تفکیک اسیدها و بازها پرداخته میشود.
شباهت دیدگاه لوییس با آرنیوس و برونستد-لوری
در مورد وجوه اشتراک دیدگاه لوییس با آرنیوس و برونستد-لوری، میتوانیم بگوییم: پروتونها ذراتی دارای بار مثبت و هیدروکسیدها دارای بار منفی هستند. بنابراین، میتوانیم اسیدها را بهصورت «+» و بازها را بهصورت «-» لحاظ کنیم. مانند تصویر زیر.
اکنون، بازهای لوییس یک جفت(های) ناپیوندی الکترون را اهدا میکنند. همان چیزی که آنها را باز میکند. اگر هر باز دیگری مانند $$OH^{-}$$ یا کربنات را نیز در نظر بگیریم، که طبق نظریههای آرنیوس و برونستد طبقهبندی کردیم، اینها نیز با یک جفت ناپیوندی به پروتون حمله میکنند. بنابراین، حتی اگر بار رسمی روی باز وجود نداشته باشد، باز هم گونهای با چگالی الکترونی بالا است و ما میتوانیم آن را به عنوان یک واحد «-» بدون در نظر گرفتن باز برونستد یا لوییس در نظر بگیریم.
ارتباط بین نظریه لوییس با نظریه برونستد-لوری
در این قسمت با دقت بیشتری به مقایسه مشخصا دو دیدگاه متوالی لوییس و برونستد-لوری میپردازیم. نخست برای سهولت بررسی، تعاریف اسید و باز را متناسب با هر نظریه در قالب جدول زیر پیادهسازی میکنیم.
| تعاریف گونهها | نظریه لوییس | نظریه برونستد-لوری |
| اسید | پذیرنده جفتالکترون | اهداکننده پروتون |
| باز | اهداکننده جفتالکترون | پذیرنده پروتون |
نکاتی شایان توجه که از جدول بالا در ارتباط با وجه تمایز تعاریف اسید و باز بر مبنای نظریه لوییس با نظریه برونستد-لوری دریافت میکنیم.
- اسیدها و بازهای لوییس، برحسب توانایی پذیرش یا اهدای «جفتالکترون» تعریف میشوند.
- اسیدها و بازهای برونستد-لوری، برحسب توانایی پذیرش یا اهدای «یون هیدروژن» (همان پروتون) تعریف میشوند.
- باز لوییس جفت الکترون را میدهد و اسید لوییس، جفت الکترون را میگیرد.
- اسید برونستد، یون هیدروژن را میدهد و باز برونستد یون هیدروژن را میگیرد.
در موارد بالا، به واژههای دهنده و گیرنده در اسیدها و بازها در هر نظریه، توجه شود.
و حال با بررسی این دو نظریه میتوان گفت:
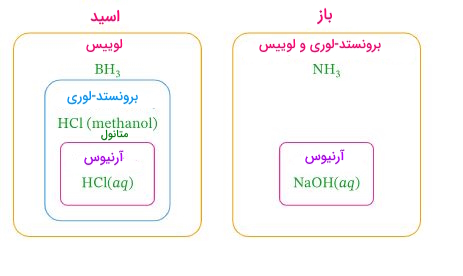
- همه بازها از جمله باز برونستد-لوری، باز لوییس است، اما هر باز لوییس را نمیتوان به عنوان یک باز برونستد طبقهبندی کرد زیرا طبق تعریف، باز برونستد-لوری یک پذیرنده پروتون است.
باز لوییس و برونستدبه طور مشابه، اسید لوییس باید بتواند یک جفت ناپیوندی را بپذیرد، کاری که پروتونها انجام میدهند. با این حال، اسیدهای لوییس فقط به پروتونها محدود نمیشوند. بهعنوانمثال، بور یک اسید لوییس معمولی است، زیرا فاقد اکتت (Octet) و دارای یک اوربیتال خالی $$p$$ است که از آن برای پذیرش یک جفت ناپیوندی استفاده میکند، بنابراین به عنوان اسید لوییس عمل میکند:
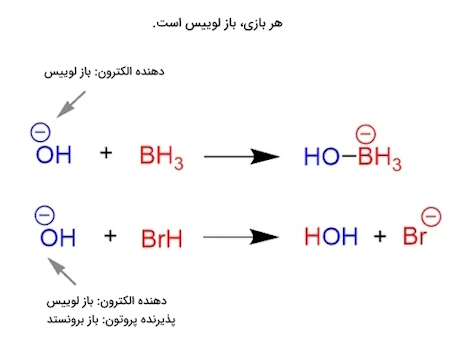
پس با توجه به اینکه، هر اسید لوییس یک گیرنده الکترون است، بنابراین هر اسید برونستد یک اسید لوییس است. با این حال، هر اسید لوییس یک اسید برونستد نیست، زیرا نظریه برونستد اسیدها را فقط به اهداکنندگان پروتون محدود میکند.
برای تمایز بین آنها، اصطلاح اسید به هر ترکیب دهنده پروتون و اسید لوییس به اسیدهایی گفته میشود که غیر پروتوندهنده هستند.
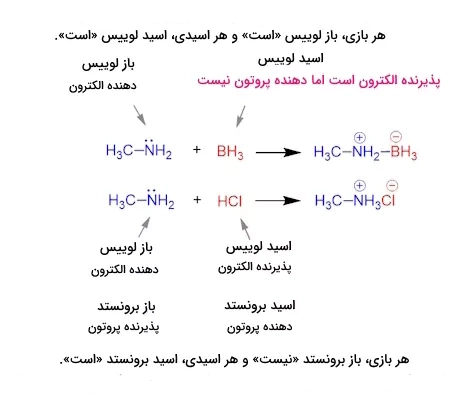
جمعبندی موارد بالا را میتوانیم بهصورت زیر بیان میکنیم:
- تمامی بازهای برونستد-لوری، بازهای لوییس هستند و بالعکس.
- تمامی بازهای لوییس، بازهای برونستد-لوری هستند.
- تمامی اسیدهای برونستد-لوری، اسیدهای لوییس هستند.
- تمامی اسیدهای لوییس، الزاما اسید برونستد-لوری نیستند.
مثال: کدام یک از گزینههای زیر توصیف بهتری از تفاوت بین باز برونستد-لوری و باز لوییس ارائه میدهد؟
- باز لوییس، دهنده پروتون است، در حالیکه باز برونستد-لوری گونهای است که میتواند یک جفتالکترون یا بیشتر را بپذیرد.
- باز لوییس یک گیرنده پروتون است، در حالیکه باز برونستد-لوری گونهای است که میتواند یک جفتالکترون یا بیشتر اهدا کند.
- باز برونستد-لوری دهنده پروتون است، در حالیکه باز لوییس گونهای است که میتواند یک جفتالکترون یا بیشتر را بپذیرد.
- باز برونستد-لوری گیرنده پروتون است، در حالیکه باز لوییس گونهای است که میتواند یک جفتالکترون یا بیشتر اهدا کند.
- باز برونستد-لوری گیرنده یون $$OH^{-}$$ است، در حالیکه باز لوییس گونهای است که میتواند یک جفتالکترون یا بیشتر اهدا کند.
پاسخ: قبل از پاسخ به سؤال، برای سهولت بررسی و تفسیر گزینهها میتوانیم، پاسخها را بهصورت جدول زیر تنظیم کنیم تا مقایسه سادهتر باشد.
| گزینهها | باز لوییس | باز برونستد-لوری |
| A | دهنده پروتون | گونهای که میتواند یک جفتالکترون یا بیشتر را بپذیرد |
| B | گیرنده پروتون | گونهای که میتواند یک جفتالکترون یا بیشتر اهدا کند |
| C | گونهای که میتواند یک جفتالکترون یا بیشتر را بپذیرد | دهنده پروتون |
| D | گونهای که میتواند یک جفتالکترون یا بیشتر اهدا کند | گیرنده پروتون |
| E | گونهای که میتواند یک جفتالکترون یا بیشتر اهدا کند | گیرنده یون $$OH^{-}$$ |
همانطور که در گزینهها نمایان است، میتوانیم چند روش پیشنهادی مختلف برای توصیف بازها داشته باشیم: از نظر یونهای $$OH^{-}$$، پروتونها (یونهای $$H^{+}$$)، یا جفتهای ناپیوندی.
- توصیف برونستد-لوری از اسید، «دهندهپروتون» است، مانند اسید هیدروکلریک. و یک باز برونستد-لوری «پذیرنده پروتون» است، مانند هیدروکسید سدیم
$$HCl + NaOH\rightarrow H_{2}O + NaCl$$
- توصیف لوییس از اسید «پذیرنده یک جفت ناپیوندی» و باز لوییس «اهداکننده یک جفت ناپیوندی» است. به بیان دیگر اسید لوییس یک جفت ناپیوندی از باز لوییس را میپذیرد و پیوند تشکیل میدهد.
حال به سراغ بررسی مجدد گزینهها میرویم:
- پاسخ $$A$$ میگوید که باز لوییس دهنده پروتون است که نادرست است. در اهدای پروتون اهدای جفت ناپیوندی مطرح نخواهد بود، پس این توصیف نادرستی از باز لوییس است.
- پاسخ $$B$$ میگوید که باز لوییس گیرنده پروتون است. پذیرش یک پروتون شامل اهدای یک جفتالکترون است. با این حال، راههای دیگری وجود دارد که باز لوییس میتواند رفتار کند. باز لوییس میتواند یک جفت ناپیوندی را به چیزهایی غیر از پروتون اهدا کند. در بهترین حالت، اگر به طور کامل نادرست نباشد، توصیف قوی و کاملی نیست.
- پاسخ $$C$$ میگوید که باز لوییس میتواند یک جفتالکترون را بپذیرد، اما در واقعیت، عکس این موضوع صادق است.
- پاسخهای $$D$$ و $$E$$ توصیف درستی از باز لوییس (دهنده جفتالکترون) دارند، بنابراین میتوانیم به توضیحات باز برونستد-لوری برای هر کدام نگاه کنیم:
- پاسخ $$D$$ میگوید که باز برونستد-لوری گیرنده پروتون است که درست است.
- پاسخ $$E$$ میگوید که باز برونستد-لوری گیرنده یون هیدروکسید است که صحیح نیست.
بنابراین، پاسخ گزینه $$D$$ است. بهترین توصیف در بین گزینهها که به درستی باز لوییس را به عنوان گونهای که میتواند یک جفتالکترون (یا بیشتر) اهدا کند، و باز برونستد-لوری را به عنوان گیرنده پروتون تعریف میکند.
نقاط قوت تعریف اسید و باز بر مبنای نظریه لوییس
نقطه قوت تعریف لوییس نسبت به تعاریف دیگر از جمله در این است که:
- جامعتر است. مجموعه دربرگیرنده اسیدها و بازهای لویس بزرگتر از موادی است که در مجموعه اسیدها و بازهای آرنیوس و برونستد-لوری قرار میگیرند.
- واکنش اسیدها و بازهای لویس قابل پیشبینی است.
- تعریف لویس به ما اجازه میدهد که به سادگی تعداد بالاتری از واکنشهای شیمیایی را باهم مقایسه کنیم.
- اگر ناحیهای از یک مولکول را ببینیم که دارای کمبود الکترون است، و ناحیهای دیگر غنی از الکترون است با یک جفت واکنشی، میتوانیم نحوه واکنش آنها را باهم پیشبینی کنیم. به این معنی که میتوانیم پیشبینی کنیم در کجاها امکان تشکیل پیوند وجود دارد. (البته در عمل به اطلاعات کمی بیشتری نیاز است ولی در همین حد هم اطلاعات بسیار خوبی بهدست میدهد).
مثال: در یک واکنش شیمیایی، گونهای که میتواند یک جفتالکترون اهدا کند .... است.
- باز لوییس
- باز برونستد-لوری
- اسید برونستد-لوری
- اسید لوییس
- باز آرنیوس
پاسخ: باز لوییس مادهای است که میتواند یک جفتالکترون ناپیوندی را به ماده دیگری بدهد و پیوند تشکیل دهد. حالت عکس، اسید لوییس مادهای است که میتواند یک جفتالکترون را بگیرد. در نتیجه، به نظر میرسد که پاسخ $$A$$ پاسخ صحیح و پاسخ $$D$$ نادرست است، اما برای اطمینان، بقیه گزینهها را بررسی میکنیم.
گزینه های $$B$$ و $$C$$ به اسیدها و بازهای برونستد-لوری اشاره دارد. این نوع اسیدها و بازها مبتنی بر دست دادن یا دریافت و افزایش پروتون ها و نه جفتهای تک الکترون تعریف میشوند، بنابراین پاسخ های $$B$$ و $$C$$ نادرست هستند.
گزینه $$E$$ به دنبال تعاریف اسید-باز آرنیوس است. با این حال، این تعاریف مربوط به یونهای هیدروژن و هیدروکسید است و نه جفتهای تک الکترون، پس گزینه $$E$$ نیز نادرست است. پاسخ صحیح، گزینه $$َA$$ است و پاسخ بهصورت زیر تکمیل میشود.
گونهای که میتواند یک جفتالکترون اهدا کند، باز لوییس است.
شناسایی اسیدها و بازهای لوییس در واکنشها
شناسایی اسیدها و بازهای لوییس در واکنشها یکی از مهمترین موارد در مبحث حاضر است. به عنوان مثال، اگر واکنش تری فلوئوروبوران ($$BF_{3}$$) و یون فلوراید ($$ F^{-}$$) را در نظر میگیریم:
$$BF_{3} + F^{-} \rightarrow BF_4^-$$
با رسم ساختارهای لوییس، میببینیم که جفت ناپیوندی که پیوند را تشکیل میدهد، از کجا آمده است:
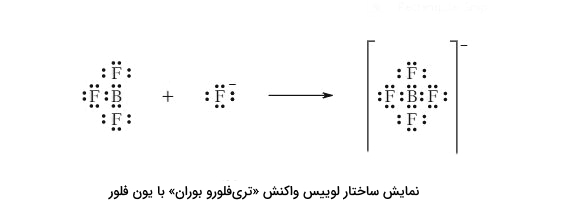
یون فلور با جفت واکنشپذیر خود، با اتم بور که کمبود الکترون دارد، پیوند برقرار میکند. در رسم، میتوان این را با پیوند کووالانسی کوردینانسی نیز نشان بدهیم، البته در واقعیت بار منفی به طور مساوی در $$BF_4^-$$ توزیع میشود.
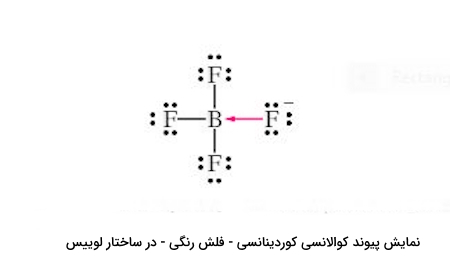
- یون فلور جفت ناپیوندی را برای تشکیل پیوند اهدا میکند - مانند باز لوییس عمل میکند.
- تری فلوئوروبوران جفت ناپیوندی را گرفته و پیوند ایجاد میکند – مانند اسید لوییس عمل میکند.
نحوه بهکارگیری نظریههای مختلف در تحلیل اسید یا باز بودن ترکیبات شیمیایی
برای تمرین استفاده از تعاریف اسیدها و بازها طبق نظریههایی که تا اینجا یاد گرفتیم، و تمییز آنها از هم، چند ترکیب شیمیایی را به لحاظ اسید یا باز بودن در نظریههای مختلف بررسی میکنیم.
بررسی $$HCl$$
به عنوان نخستین مثال ترکیب شیمیایی کلرید هیدروژن یا $$HCl$$ را بررسی میکنیم.
| آیا $$HCl$$ نوعی از اسید یا باز است؟ | بله/خیر | علت |
| اسید آرنیوس | بله | $$HCl$$ یون هیدروژن دارد که میتواند به آب بدهد. |
| اسید برونستد-لوری | بله | تمام اسیدهای آرنیوس، اسید برونستد-لوری نیز هستند. چون اسیدهای آرنیوس میتوانند دهنده پروتون باشند. |
| اسید لوییس | بله | همه اسیدهای برونستد-لوری، اسید لوییس هستند، چون یونهای هیدروژن میتوانندجفتالکترون را برای تشکیل پیوند بپذیرند. |
| باز آرنیوس | خیر | $$HCl$$ یون هیدروکسید ندارد، بنابراین نمیتواند در آب تجزیه شود و یون $$OH^{-}$$ بدهد. |
| باز برونستد-لوری | خیر | $$HCl$$ باز برونستد-لوری نیست زیرا به راحتی پروتونهای بیشتری را نمیپذیرد. |
| باز لوییس | خیر | $$HCl$$ باز لوییس نیست زیرا بهراحتی جفتالکترون خود را برای تشکیل یک پیوند نمیدهد. |
کلرید هیدروژن ($$HCl$$) را میتوان مبتنی بر هر سه تعریف اسید توصیف کرد.
بررسی $$BH_{3}$$
حال ترکیب شیمیایی بوران (تری هیدرید بور) با فرمول شیمیایی $$BH_{3}$$ را در نظر میگیریم. در تصویر زیر ساختار لوییس بوران را مشاهده میکنیم.
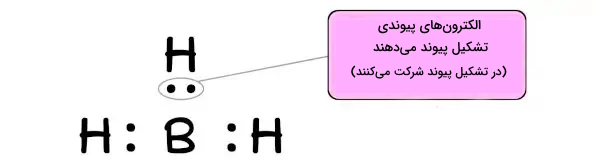
اتم بور (در وسط)، دو جای خالی در لایه ظرفیت خود دارد. در نتیجه به سادگی جفتالکترون را از جزء دیگر میپذیرد. حال مانند مثال قبل، به بررسی اسید و باز بودن $$BH_{3}$$ با تعاریف مختلف اسید و باز میپردازیم.
| آیا $$BH_{3}$$ نوعی از اسید یا باز است؟ | بله/خیر | علت |
| اسید آرنیوس | خیر | $$BH_{3}$$ به راحتی، هیدروژنهای خود را به عنوان یون هیدروژن نمیدهد. |
| اسید برونستد-لوری | خیر | $$BH_{3}$$ به راحتی، هیدروژنهای خود را به عنوان یون هیدروژن نمیدهد. |
| اسید لوییس | بله | $$BH_{3}$$ به راحتی جفت را از باز لوییس را گرفته و تشکیل پیوند میدهد. |
| باز آرنیوس | خیر | $$BH_{3}$$ یون هیدروکسید ندارد، بنابراین نمیتواند در آب تجزیه شده و یون $$OH^{-}$$ بدهد. |
| باز برونستد-لوری | خیر | $$BH_{3}$$ باز برونستد-لوری نیست زیرا به راحتی پروتونهای بیشتری را نمیپذیرد. |
| باز لوییس | خیر | $$BH_{3}$$ جفت برای اهدا ندارد. |
بررسیها در جدول بالا نشان میدهد که ترکیب شیمیایی بوران ($$BH_{3}$$ ) را میتوانیم به عنوان اسید لوییس در نظر بگیریم. اما نمیتوانیم به عنوان اسید و باز آرنیوس و اسید و باز برونستد-لوری در نظر بگیریم.
در تصویر زیر دریافت جفتالکترون باز توسط $$BH_{3}$$ نشان داده میشود.
بررسی $$NaOH$$
در این مثال به بررسی ترکیب شیمیایی هیدروکسید سدیم ($$NaOH$$) در تعاریف مختلف اسید و باز میپردازیم.
| $$NaOH$$ نوعی از اسید یا باز است؟ | بله/خیر | علت |
| اسید آرنیوس | خیر | $$NaOH$$ به راحتی، هیدروژنهای خود را به عنوان یون هیدروژن نمیدهد. |
| اسید برونستد-لوری | خیر | $$NaOH$$ به راحتی، هیدروژنهای خود را به عنوان یون هیدروژن نمیدهد. |
| اسید لوییس | خیر | $$NaOH$$ به راحتی جفت را از باز لوییس نمیگیرد. |
| باز آرنیوس | بله | $$NaOH$$ در آب تجزیه شده و یونهای $$OH^{-}$$ آزاد میکند. |
| باز برونستد-لوری | بله | $$NaOH$$ زیرا به راحتی یونهای $$H^{+}$$ را میپذیرد. |
| باز لوییس | بله | $$NaOH$$ جفتالکترون خود را برای تشکیل پیوند میدهد. |
با بررسی جدول بالا دیدیم که هیدروکسید سدیم $$NaOH$$ میتواند هم به عنوان باز برونستد-لوری و هم باز لویس رفتار کند. همانطور که در تصویر پایین نمایش داده شده است، اکسیژن یون هیدروکسید در ترکیب مذکور (هیدروکسید سدیم)، میتواند یکی از جفتالکترونهای خود را داده و با یون هیدروژن پیوند تشکیل دهد.
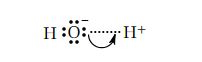
بررسی $$NH_{3}$$
در این مثال به عنوان آخرین مثال از این رده، به بررسی ترکیب شیمیایی آمونیاک، یعنی $$NH_{3}$$ میپردازیم.
| $$NH_{3}$$ نوعی از اسید یا باز است؟ | بله/خیر | علت |
| اسید آرنیوس | خیر | $$NH_{3}$$ به راحتی، هیدروژنهای خود را به عنوان یون هیدروژن نمیدهد. |
| اسید برونستد-لوری | خیر | $$NH_{3}$$به راحتی، هیدروژنهای خود را به عنوان یون هیدروژن نمیدهد. |
| اسید لوییس | خیر | $$NH_{3}$$ به راحتی جفت را از باز لوییس نمیگیرد. |
| باز آرنیوس | خیر | $$NH_{3}$$ در آب تجزیه نشده و یونهای $$OH^{-}$$ آزاد نمیکند. اما با آب واکنش داده و تولید هیدروکسید آمونیوم میکند که باز آرنیوس است. |
| باز برونستد-لوری | بله | $$NH_{3}$$ زیرا به راحتی یونهای $$H^{+}$$ را میپذیرد. |
| باز لوییس | بله | $$NH_{3}$$ جفتالکترون خود را برای تشکیل پیوند میدهد. |
با ارزیابیهای آمده در جدول بالا میبینیم با اینکه آمونیاک را به طور قطعی به عنوان باز برونستد-لوری و آرنیوس تعریف میکنیم، با این حال تعریف آن به عنوان باز آرنیوس از قطعیت کامل برخوردار نبوده و توضیحات دیگری نیز برای نتیجهگیری لازم است.
واکنشهای شیمیایی متداول بین اسیدها و بازهای لوییس
در این قسمت به برخی از واکنشهای شیمیایی متداول بین اسیدها و بازها میپردازیم.
واکنش بین یون فلوراید و تری فلوراید بور
این واکنش شامل تشکیل یک پیوند کوردینانسی بین آنیون فلور ($$F^{-}$$) و تری فلورید بور ($$BF_{3}$$) است.
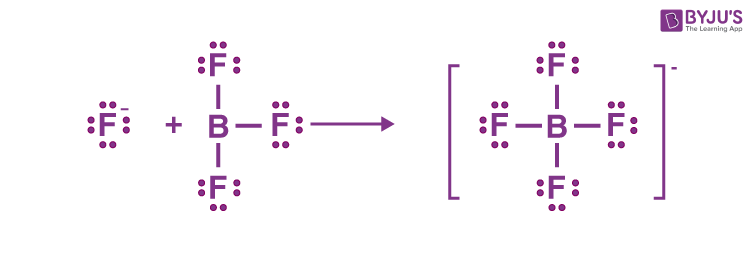
در اینجا $$F^{-}$$ به عنوان دهنده جفتالکترون عمل میکند در حالیکه $$BF_{3}$$جفتالکترون را میپذیرد. یعنی یونهای فلور به عنوان باز لوییس و تریفلورید بور به عنوان اسید لوییس عمل میکند. حال واکنش بین اسید و باز لوییس (حمله باز لوییس به اسید لوییس)، منجر به تشکیل یک ترکیب اداکت با فرمول شیمیایی $$BF_4^-$$ میشود.
واکنش بین پروتون (یون $$H^{+}$$) با آب
یون هیدروژن یا پروتون یا $$H^{+}$$، که فاقد الکترون است، به عنوان اسید لوییس وارد واکنش میشود.
در مورد گونه واکنشی دیگر یعنی آب، $$H_{2}O$$، اتم اکسیژن جفتالکترون خود را به پروتون می دهد. یعنی به عنوان یک باز لوییس عمل میکند. از واکنش بین مولکول آب و پروتون، یون هیدرونیوم ($$H_{3}O^{+}$$) به عنوان محصول به دست میآید که در تصویر زیر نشان داده شده است.
واکنش بین پروتون (یون $$H^{+}$$) با آمونیاک
نمونه دیگری از واکنشهایی که در آن یون $$H^{+}$$ به عنوان اسید لوییس عمل میکند، واکنش آن با آمونیاک ($$NH_{3}$$) برای تشکیل یون آمونیوم ($$NH_4^+$$) است که در تصویر نشان داده شده است.
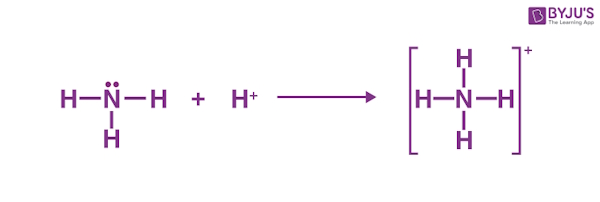
در این واکنش، اتم نیتروژن در آمونیاک، دارای جفتالکترون در زیرلایه $$p$$ خود بوده و به مانند باز لوییس عمل میکند. یعنی جفتالکترون خود را به پروتون میدهد، یا به تعبیری دیگر، پروتون یک جفتالکترون از اتم نیتروژن مولکول آمونیاک میگیرد. تشکیل یک پیوند کووالانسی کوردینانسی بین این دو منجر به تشکیل یک ترکیب اداکت لوییس (کاتیون آمونیوم-$$NH_4^+$$) میشود.
واکنش بین یون نقره ($$Ag^{+}$$) و آمونیاک
در این واکنش، که در زیر نشان داده شده است، دو باز لوییس با یک اسید لوییس یک ترکیب اضافی تشکیل میدهند.
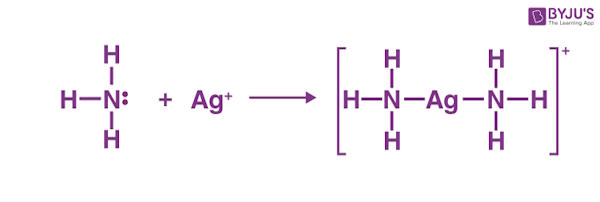
در اینجا آمونیاک به عنوان باز لوییس و یون نقره به عنوان اسید لوییس عمل میکند. هر اتم نیتروژن یک جفتالکترون به $$Ag^{+}$$ اهدا میکند که در نتیجه دو پیوند کووالانسی کوردینانسی جداگانه ایجاد میشود. ترکیب اضافی تشکیل شده از اسید و باز لوییس دارای فرمول شیمیایی $$Ag(NH_{3})_2^+$$ است.
واکنش شیمیایی بین آمونیاک و آب
آمونیاک به عنوان باز لوییس عمل می کند و هیدروژن آب به عنوان اسید لوییس عمل میکند. اتم هیدروژن جفتالکترون را از اتم نیتروژن میپذیرد و ترکیب اضافی تشکیل میشود.
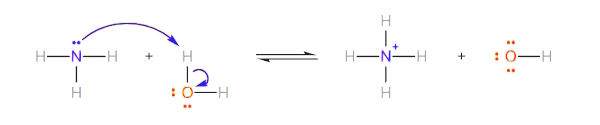
همانطور که واکنش نشان میدهد، یون آمونیوم ($$NH_4^+$$) و یون هیدروکسید به عنوان محصولات این واکنش تولید میشوند.
کاربردهای اسیدها و بازهای لوییس
برخی از کاربردهای مهم اسیدها و بازهای لوییس در زیر ارائه شده است:
کاربردهای اسیدهای لوییس
در اشاره به کاربردهای اسیدهای لوییس میتوانیم از موارد زیر نام ببریم.
- اسیدهای لوییس نقش حیاتی به عنوان کاتالیزور در واکنش «فریدل کرافتس» (Friedel-Crafts reaction) دارند - $$AlCl_{3}$$ یک جفتالکترون ناپیوندی متعلق به یون کلرید را میگیرد که منجر به تشکیل $$AlCl_{4}$$- در فرایند «آلکیلاسیون فریدل کرافتس» (Friedel-Crafts Alkylation) میشود. همچنین منجر به تشکیل یون کربنیوم بسیار الکتروفیل میشود که به عنوان یک اسید لوییس قوی عمل میکند. واکنش شیمیایی را میتوان بهصورت زیر نوشت.
$$RCl + AlCl_{3} \rightarrow R^{+} + AlCl_4^-$$
- در زمینه شیمی آلی، اسیدهای لوییس به طور گستردهای برای تشویق بسیاری از واکنشهای شیمیایی کاتیونی یا شبه کاتیونی (Cationic or Pseudo-Cationic Chemical Reactions) استفاده میشود.
کاربردهای بازهای لوییس
در اشاره به کاربردهای بازهای لوییس نیز میتوانیم از موارد زیر نام ببریم.
- در اصلاح فعالیت و گزینشپذیری و کاتالیزورهای فلزی (Metallic Catalysts) دارند.
- برای تولید داروهای شامل باز لوییس.
- کاتالیز نامتقارن (Asymmetric Catalysis) بخش مهمی از سنتز انانتیو انتخابی (Enantioselective Synthesis) است که شامل باز لوییس است.
- در فعالسازی کاتالیز نامتقارن، از بازهای کایرال لوییس اغلب برای دادن کایرالیته (Chirality) به کاتالیزورها استفاده میشود.
- چند باز لوییس، توانایی ایجاد پیوندهای بسیاری با اسیدهای لوییس را دارند. به این ترکیبات «بازهای لوییس چندگانه» (Multidentate Lewis Bases) یا «عوامل شلاته کننده» (Chelating Agents) نیز میگویند که کاربردهای صنعتی و کشاورزی گستردهای دارند.
سؤالات متداول
تعریف لوییس از اسیدها و بازها چیست؟
طبق تعریف لوییس از اسیدها و بازها:
- اسید لوییس را میتوان به عنوان یک ماده شیمیایی تعریف کرد که میتواند یک جفتالکترون را از یک باز لوییس بپذیرد تا یک پیوند کووالانسی کوردینانسی مشترک با آن ایجاد کند؛ یعنی دارای اوربیتال خالی است.
- یک باز لوییس را میتوان به عنوان یک گونه شیمیایی تعریف کرد که در آن بالاترین اوربیتال مولکولی اشغال شده ($$HOMO$$) localized و به آن توانایی اهدای جفتالکترون را میدهد.
آیا اسیدکلریدریک را میتوان اسید لوییس در نظر گرفت؟
اسیدکلریدریک (Hydrochloric Acid) را نمیتوان به عنوان اسید لوییس طبقهبندی کرد زیرا نمیتواند جفتالکترون را بپذیرد. با این حال، این ترکیب به یونهای تشکیلدهنده خود تجزیه میشود و یونهای $$H^{+}$$ را آزاد میکند (که به عنوان اسیدهای لوییس در نظر گرفته میشوند). به دلیل ناتوانی در پذیرش جفتالکترون، اسیدکلریدریک اغلب به عنوان «اسید کلاسیک»، بهجای اسید لوییس شناخته میشود. همچنین، هنگام واکنش با بازهای لوییس هیچ ترکیب اضافی تشکیل نمیدهد.
چند نمونه از بازهای لوییس را فهرست کنید.
به چند نمونه از بازهای لوییس به شرح زیر میتوان اشاره کرد:
- آمینهایی با فرمول عمومی $$R - NH_{3}$$ مانند متیل امین (Methylamine)
- یون فلوراید ($$F^{-}$$)
- آمونیاک ($$NH_{3}$$)
- آب ($$H_{2}O$$)
- استون Acetone و بسیاری کتونهای دیگر
- ترکیبات کالکوژنها (Chalcogens) (اکسیژن، گوگرد، سلنیوم و تلوریم) که در آنها حالت اکسیداسیون $$-2$$ را نشان میدهند، عموما به عنوان بازهای لوییس عمل میکنند.
آیا اتیل استات (Ethyl Acetate) باز لوییس است؟
بله، اتیل استات (اتیل اتانوات - Ethyl Ethanoate) یک باز لوییس است. زیرا این توانایی را دارد که به عنوان یک اهداکننده جفتالکترون عمل کند. باز لوییس یک ترکیب شیمیایی است که میتواند یک جفتالکترون را به یک گیرنده جفتالکترون مناسب (اسید لوییس) اهدا کند تا یک ترکیب اضافی لوییس ایجاد کند.
آیا اسیدها آنیون و بازها کاتیون هستند؟
اسیدها گیرنده جفتالکترون هستند که از ویژگیهای کاتیون است و بازها، اهداکننده جفتالکترون هستند، که از ویژگیهای آنیون است.
وجه مشترک اسید و باز چیست؟
اسیدها و بازها هر دو الکترولیت هستند. به این معنی که وقتی در آب حل می شوند، ایجاد یون کرده و جریان الکتریسیته را هدایت می کنند.
آب اسید است یا باز؟
آب خالص نه اسیدی و نه بازی است. وقتی دو مول آب جدا می شوند، یونهای هیدرونیوم ($$H_{3}O^{+}$$) و هیدروکسیل ($$OH^{-}$$) تشکیل میشود. یونهای هیدرونیوم دارای خاصیت اسیدی و یونهای هیدروکسیل دارای خاصیت بازی هستند. در آب خالص همواره مقدار یونهای ($$H_{3}O^{+}$$) و یونهای ($$OH^{-}$$)برابر است که اثر یکدیگر را خنثی میکند. در نتیجه آب خالص یک ماده خنثی محسوب میشود.
قدرت اسید لوییس به چه عواملی بستگی دارد؟
قدرت اسید لوییس به ماهیت الکتروفیلی یا هستهدوستی آن بستگی دارد. به این معنی که هر چه بار مثبت یون فلزی بیشتر باشد، خاصیت اسیدی آن نیز بیشتر است.
چه شرایطی نیاز داریم تا واکنش اسیدباز لوویس رخ دهد؟
اگر یک باز، جفتالکترون خود را به اسید بدهد، واکنش اسیدباز لوویس رخ داده است.
چه چیزی باز قوی لوویس را ایجاد میکند؟
قدرت بازی یک باز لوویس با ثابت تفکیک اسیدیِ اسید مزدوج آن مرتبط است. اسیدهایی با pKa بالا، باز لوویس مناسبی بهدست میدهند.
بررسی مثالهایی از اسید و باز لوییس
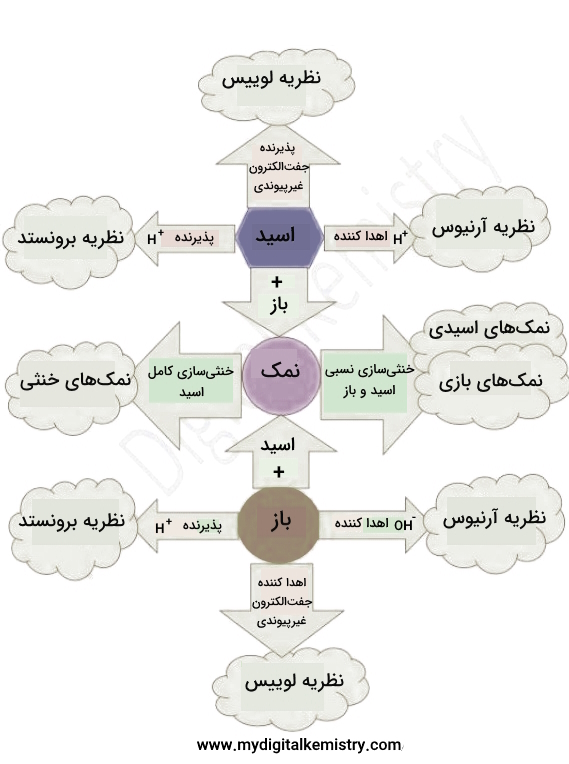
در این قسمت برای ارتقای مهارت، سرعت و دقت خودآزماییهایی در قالب مثال، و پرسشهای چندگزینهای نظر گرفته شده است. پیش از ورود به آنها برای مرور کلی نظریهها، چارت زیر را میآوریم.
مثال ۱
در هریک از واکنشهای زیر، اسید و باز لوییس را مشخص کنید.
- $$BH_{3} + (CH_{3})_{2}S \rightarrow H_{3}B:S(CH_{3})_{2}$$
- $$CaO +CO_{2} \rightarrow CaCO_{3}$$
- $$BeCl_{2} + 2Cl^{-} \rightarrow BeCl_4^2-$$
استراتژی حل مسئله
در بررسی مسائلی از این دست، ابتدا در هر واکنش، واکنشدهندهای را که کمبود الکترون دارد و واکنشدهندهای را که دهنده جفتالکترون است، مشخص میکنیم. حال ترکیبی که دارای کمبود الکترون است، اسید لوییس، و دیگری باز لوییس است.
حال با توجه به توضیحات بالا، به سراغ حل سوال میرویم.
در ترکیب $$BH_{3}$$، بور ناپیوندی شش الکترون ظرفیت (الکترون در لایه والانس خود) دارد. پس کمبود الکترون داشته و میتواند یک جفت ناپیوندی را بپذیرد. مانند اکسیژن، اتم گوگرد در $$(CH_{3})_{2}S$$ دو جفت ناپیوندی دارد. بنابراین $$(CH_{3})_{2}S$$ یک جفتالکترون روی سولفور را به اتم بور $$BH_{3}$$ میدهد. باز لوییس $$(CH_{3})_{2}S$$ و اسید لوییس $$BH_{3}$$ است.
همانطور که در واکنش نشان داده شده در معادله 8.21 میبینیم، $$CO_{2}$$ یک جفتالکترون از یون O2- در $$CaO$$ میپذیرد تا یون کربنات را تشکیل دهد. اکسیژن موجود در $$CaO$$ یک اهداکننده جفتالکترون است، بنابراین $$CaO$$ باز لوییس است. کربن یک جفتالکترون را میپذیرد، بنابراین $$CO_{2}$$ همان اسید لوییس است.
یون کلرید شامل چهار جفت ناپیوندی است. در این واکنش، هر یون کلرید یک جفت ناپیوندی به $$BeCl_{2}$$ اهدا میکند که ناپیوندی چهار الکترون در اطراف $$Be$$ دارد. بنابراین یونهای کلرید بازهای لوییس هستند و $$BeCl_{2}$$ اسید لوییس است.
مثال ۲
اسید و باز لوییس را مشخص کنید.
در هر واکنش، اسید و باز لوییس را مشخص و با نوشتن فرآوردهها در هر واکنش، آنها را کامل کنید.
- $$(CH_{3})_{2}O + BF_{3} \rightarrow (CH_{3})_{2}O:BF_{3}$$
- $$H_{2}O + SO_{3} \rightarrow H_{2}SO_{4}$$
پاسخ:
- باز لوییس: $$(CH_{3})_{2}O$$ و اسید لوییس: $$BF_{3}$$
- باز لوییس: $$H_{2}O$$ و اسید لوییس: $$SO_{3}$$
مثال ۳
در هر واکنش، اسید و باز لوییس را مشخص و با نوشتن فرآوردهها در هر واکنش، آنها را کامل کنید.
- $$(CH_{3})_{2}O + AlCl_{3}$$
- $$SnCl_{4} + 2Cl^{-}$$
پاسخ
- $$AlCl_{3}$$، اسید لوییس و اتر باز لوییس است. $$(CH_{3})_{2}O + AlCl_{3}\rightarrow AlCl_{3}O(CH_{3})_{2}$$
- $$SnCl_{4}$$، باز لوییس و کلرید باز لوییس است. $$SnCl_{4} + 2Cl^{-}\rightarrow SnCl_4^2-$$
مثال ۴
در واکنش زیر اسید و باز لوییس را مشخص کنید.
واکنش یون متانوات با آب
پاسخ
در واکنش بالا:
- اسید لوییس، آب است.
- هیدروژن مولکول آب، جفتالکترون را گرفته و یون $$OH^{-}$$ را آزاد میکند.
- اسید لوییس، یون متانوات یعنی $$HCOO^{-}$$ است.
- جفتالکترون ناپیوندی یون متانوات، با یکی از هیدروژنهای مولکول آب، تشکیل پیوند کوردیناسی میدهد.
- در قسمتهای پیشین، بررسی کردیم که آب میتواند بهعنوان اسید یا باز برونستد-لوری عمل کند (آمفوتر). بنابراین جای تعجب نیست که بتواند بسته به تمایل به واکنش با سایر اجزا، هم بهعنوان هم اسید لوییس یا باز، عمل کند.
مثال ۵
کدامیک از واکنشهای زیر، در طبقهبندی بر مبنای اسید و باز لوییس تعریف میشود اما در تعریف برونستد-لوری قرار نمی گیرد؟
$$NH_{3} + HCl \rightarrow NH_{4}Cl $$
$$F^{-}+ BF_{3} \rightarrow BF_4^- $$
$$NaOH+ HNO_{3} \rightarrow NaNO_{3}+ H_{2}O$$
$$H_{3}O^{+}+OH^{-} \rightarrow 2H_{2}O$$
طبق تعریف برونستد-لوری، در یک واکنشُ اسید ماده ای است که می تواند پروتون را از دست بدهد.
و باز ماده ای که می تواند پروتون ها را بپذیرد. با توجه به واکنش شیمیایی
$$F^{-}+ BF_{3} \rightarrow BF_4^- $$
می بینیم که این واکنش حاوی اتم هیدروژن نیست. بنابراین، هیچ یک از گونه های درگیر را نمی توان به عنوان اسید یا باز برونستد-لوری طبقه بندی کرد.
حال طبق طبقهبندی اسید-باز لوییس، اسید مادهای است که میتواند یک جفت الکترون را بپذیرد و یک پیوند ایجاد کند، و یک باز مادهای است که میتواند با اهدای یک جفت الکترون تنها پیوند ایجاد کند. در واکنش مذکورُ $$F^{-} $$ُ جفت الکترون را به $$ BF_{3}$$ میدهد. در نتیجه
- $$F^{-} $$ُ باز لوییس و
- $$ BF_{3}$$ اسید لوییس است و یک جفت الکترون به آن اهدا میکند.
مطابق واکنش زیر، کدام گزینه اسید لوییس را نشان میدهد؟
$$2NH_{3} + Ag^{+}\rightarrow [Ag(NH_{3})_{2}]^{+}$$
$$NH_{3}$$، زیرا دهنده جفتالکترون است.
$$NH_{3}$$، زیرا گیرنده جفتالکترون است.
$$ Ag^{+}$$، زیرا گیرنده جفتالکترون است.
$$ Ag^{+}$$، زیرا دهنده جفتالکترون است.
طبق تعریف اسید لوییس، جزئی است که جفتالکترون را دریافت کرده و تشکیل پیوند میدهد. با بررسی واکنش مذکور، میبینیم، هر مولکول آمونیاک، یک جفتالکترون به $$ Ag^{+}$$، جزئ باکمبود الکترون داده و تشکیل diamine complex میدهد.
از آنجاییکه $$ Ag^{+}$$ جفت الکترون را میگیرد، اسید لوییس است. گزینه ۳
با توجه به واکنش زیر، کدام گزینه توصیف دقیقتری از اسید و باز را بیان میکند؟
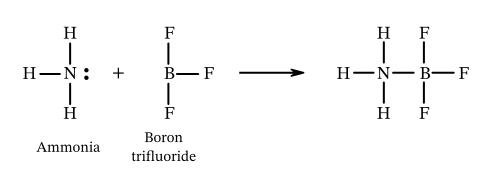
آمونیاک، اسید لوییس است، زیرا یک جفت الکترون را از دست می دهد، و تری فلوراید بور، باز لوییس است، زیرا جفت الکترون را می پذیرد.
آمونیاک، باز لوییس است، زیرا یک جفت الکترون را از دست می دهد، و تری فلوراید بور، اسید لوییس است، زیرا جفت الکترون را می پذیرد.
آمونیاک، اسید لوییس است، زیرا جفت الکترون را میگیرد، و تری فلوراید بور، باز لوییس است، زیرا جفت الکترون را می دهد.
آمونیاک، باز لوییس است، زیرا جفت الکترون را میگیرد، و تری فلوراید بور، اسید لوییس است، زیرا جفت الکترون را می دهد.
اسید لوییس، جفتالکترون را میگیرد. در حالیکه باز لوییس، جفتالکترون را میدهد.
حال با توجه به واکنش مطرح شده در صورت سوال، $$N$$ در $$NH_{3}$$، یک جفت الکترون دارد که با دادن آن می تواند پیوند تشکیل دهد.
$$B$$ در $$BF_{3}$$ کمبود الکترون دارد. بنابراین میتواند جفت الکترون را بپذیرد. در نتیجه:
- $$NH_{3}$$ بهعنوان باز لوییس و
- $$BF_{3}$$ بهعنوان اسید لوییس عمل میکند.
پس پاسخ صحیح گزینه سوم است.
با لحاظ واکنش
$$PH_{3}(g) + H_{2}O (l) \rightleftharpoons PH_{4}OH (aq)$$
کدام یک از عبارات زیر توصیف بهتری از این واکنش را ارائه میدهد؟
$$PH_{3}(g)$$ جفت الکترون به آب اهدا می کند، در نتیجه اسید است.
$$PH_{3}(g)$$ جفت الکترون به آب اهدا می کند، در نتیجه باز است.
$$PH_{3}(g)$$ جفت الکترون از آب میگیرد، در نتیجه اسید است.
$$PH_{3}(g)$$ جفت الکترون از آب میگیرد، در نتیجه باز است.
اسید لوییس مادهای است که میتواند جفتالکترون را بپذیرد و یک پیوند ایجاد کند و باز لوییس مادهای است که میتواند با اهدای یک جفت الکترون تنها پیوند ایجاد کند. حال در این واکنش، $$PH_{3}(g)$$، همان طور که در تصویر زیر نمایش داده میشود، جفت الکترون خود را اهدا می کند. در نتیجه باز در نظر گرفته می شود.
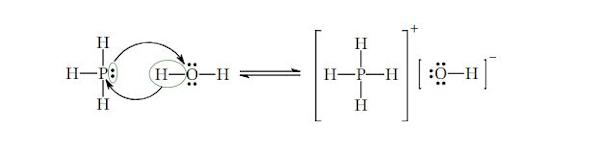
با توجه به واکنش
$$H^{+}(aq) + F^{-} (aq) \rightleftharpoons HF (aq)$$
کدام گزینه، استدلال و تشخیص درستی از اسید لوییس و باز لوییس ارائه میدهد؟
$$H^{+}$$ به عنوان اسید لوییس در نظر گرفته می شود چون یک پروتون اهدا می کند، و $$ F^{-}$$ باز لوییس در نظر گرفته می شود چون پروتون را می پذیرد.
$$H^{+}$$ اسید لوییس در نظر گرفته می شود چون جفت الکترون تنها را می پذیرد، در حالی که$$ F^{-}$$ باز لوییس در نظر گرفته می شود زیرا جفت الکترون تنها را اهدا می کند.
$$H^{+}$$ یک باز لوییس در نظر گرفته می شود چون حامل بار مثبت است، در حالی که$$ F^{-}$$ اسید لوییس در نظر گرفته می شود چون حامل بار منفی است.
$$H^{+}$$ اسید لوییس در نظر گرفته می شود چون حامل بار مثبت است، در حالی که$$ F^{-}$$ باز لوییس در نظر گرفته می شود چون حامل بار منفی است.
با توجه به نظریه اسید و باز لوییس میدانیم:
- اسیدهای لوییس گیرنده جفت الکترون و
- بازهای لوییس دهنده جفت الکترون هستند.
حال:
$$H^{+}$$ فاقد الکترون است. بنابراین، می تواند جفت الکترون را از $$ F^{-}$$ بپذیرد
بنابراین،
- $$H^{+}$$ اسید لوییس در نظر گرفته می شود زیرا جفت الکترون تنها را می پذیرد، و
- $$ F^{-}$$ باز لوییس در نظر گرفته می شود زیرا جفت الکترون تنها را اهدا می کند.
در واکنش زیر، اسید لوییس کدام است؟
$$2NH_{3} + Ag^{+}\rightarrow [Ag(NH_{3})_{2}]^{+}$$
$$NH_{3}$$ زیرا یک جفت الکترون اهدا می کند.
$$NH_{3}$$ زیرا یک جفت الکترون را می پذیرد.
$$ Ag^{+}$$ زیرا یک جفت الکترون را می پذیرد.
$$ Ag^{+}$$ زیرا یک جفت الکترون اهدا می کند.
اسید لوییس مادهای است که میتواند یک جفت الکترون را بپذیرد و یک پیوند تشکیل دهد. در طول واکنش، هر مولکول آمونیاک یک جفت الکترون به $$ Ag^{+}$$، گونه دارای کمبود الکترون داده، تشکیل کمپلکس دی آمین میدهد که در تصویر زیر نمایش داده شده است.
در نتیجه، $$ Ag^{+}$$ پذیرنده جفت الکترون در واکنش مذکور، اسید لوییس است.
آب می تواند با آمونیاک و کلرید هیدروژن بر اساس معادلات شیمیایی زیر واکنش دهد.
$$H_{2}O+NH_{3}\rightarrow NH_{4} + OH^{-}$$
$$H_{2}O+HCl\rightarrow H_{3}O^{+} + Cl^{-}$$
با توجه واکنشهای بالا، چگونه می توانیم آب را بر اساس نظریه لوییس تعریف کنیم؟
باز لوییس
اسید لوییس
هر دو، اسید لوییس و باز لوییس
گزینه مناسب برای تکمیل جمله زیر کدام است؟
با حل شدن هیدروژن فلوراید در آب، آب مانند............ رفتار میکند. چون.........
باز لوییس، پروتون را برای تشکیل یون هیدرونیوم می پذیرد
باز برونستد-لوری، پروتون را برای تشکیل یون هیدرونیوم می گیرد
اسید برونستد-لوری، پروتون را برای تشکیل یون هیدرونیوم می گیرد
باز برونستد-لوری، پروتون برای تشکیل یون هیدروکسید میدهد
اسید لوییس، پروتون را برای تشکیل یون هیدرونیوم می گیرد
با وجود اینکه آمونیاک دارای یون هیدروکسید نیست، اما به عنوان باز در نظر گرفته می شود. کدام گزینه این گزاره را مبتنی بر نظریه لوئیس و نظریه برونستد-لوری توضیح می دهد؟
طبق نظریه برونستد-لوری، هنگامی که با ماده دیگری واکنش می دهد، جفت الکترون تنها اهدا می کند و طبق نظریه لوئیس، هنگامی که با ماده دیگری واکنش می دهد، پروتون را می پذیرد.
طبق نظریه برونستد-لوری، هنگامی که با ماده دیگری واکنش می دهد، پروتون را می پذیرد و طبق نظریه لوئیس، هنگامی که با ماده دیگری واکنش می دهد، یک جفت الکترون تنها اهدا می کند.
طبق نظریه برونستد-لوری، هنگامی که با ماده دیگری واکنش می دهد، پروتون اهدا می کند، و طبق نظریه لوئیس، هنگامی که با ماده دیگری واکنش می دهد، جفت الکترون تنها اهدا می کند.
طبق نظریه برونستد-لوری، هنگامی که با ماده دیگری واکنش می دهد، پروتون را می پذیرد و طبق نظریه لوئیس، هنگامی که با ماده دیگری واکنش می دهد، یک جفت الکترون تنها را می پذیرد.
آب در حضور باز می تواند یک پروتون بدهد و در حضور یک اسید یک پروتون را دریافت کند.
با توجه به توصیف فوق آب ....... است.
کاتالیزور
آمفوتر
اسید قوی
بافر
باز آرنیوس
جمعبندی و نکات کلیدی
در مطلب ارائه شده، علاوه بر پرداختن به اسیدها و بازها از منظر نظریه لوییس، به سایر نظریهها و وجوه اشتراک و تمایز آنها با نظریه لوییس، و نیز نحوه بهکارگیری نظریهها در استدلال و تشخیص اسید و باز بودن ترکیبات شیمیایی نیز مورد بررسی قرار گرفت.
برخی از نکات کلیدی که در طول بحث به آنها پرداخته شد:
- لوییس و دانشمندان پیشین با نظریههای برجسته یعنی آرنیوس، برونستد و لوری، هر یک تعریف نسبتا متفاوتی از اسیدها و بازها ارائه کردهاند.
- تعریف لوییس بزرگترین گستره مواد را پوشش میدهد.
- اسید لوییس مادهای است که دارای اوربیتال خالی بوده و میتواند جفتالکترون را بپذیرد و تشکیل پیوند بدهد.
- باز لوییس مادهای است که میتواند جفتالکترون داده و تشکیل پیوند بدهد.
- اسیدها و بازهای لوییس با یکدیگر واکنش داده و اداکت یا ترکیبات اضافی اسید-باز لوییس را تشکیل میدهند.
- ترکیب اضافی، ترکیبی با پیوند کووالانسی کوردینانسی یا همان پیوند داتیو است که در آن هر دو الکترون ناپیوندی توسط یکی از اتمها تامین میشوند.
- ماده آمفوتریک یا آمفوتر مانند آب، در برخی شرایط نقش اسید و در برخی شرایط نقش باز را ایفا میکند.
- مفاهیم اسید و باز و تعاریف آنها نسبی و نه مطلق هستند.
و در انتها امیدواریم مطلب مورد مطالعه، نیازهای شما را در رابطه با این موضوع پوشش داده باشد.