فیزیولوژی کلیه – به زبان ساده + آناتومی و عملکرد

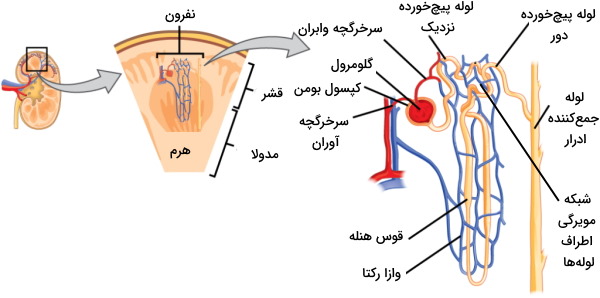
کلیهها دو اندام کوچک و لوبیاییشکل در حفره شکمی هستند و بهوسیله دو لوله باریک به نام میزنای به مثانه وصل میشود. بخش خارجی این اندام از چندلایه بافت فیبروزی و چربی تشکیل میشود و در بخش داخلی آن میلیونها ساختار لولهای به نام نفرون وجود دارد. هر نفرون از یک کپسول، لوله پیچ خورده نزدیک، قوس هنله، لوله پیچخورده دور و لوله جمعکننده ادرار تشکیل شده است و نقش مهمی در فیزیولوژی کلیه دارد.
وظیفه اصلی کلیه تصفیه خون و دفع مواد زائد در بدن است. این فرایند در کپسول کلیه شروع میشود. الکترولیتها، آب، مواد معدنی، گلوکز، آمینواسید، لیپید و پروتئینهای کوچک از شبکه مویرگی گلومرول به لومن کپسول ترشح میشود. در ادامه بخشی از این ترکیبات از لولههای نفرونی بازجذب شده و به خون برمیگردد. همچنین آب یا مواد معدنی بیشتری از شبکههای مویرگی اطراف لولهها در لولههای نفرونی ترشح میشود. در نهایت ادرار تشکیل شده بهوسیله لوله جمعکننده به مجاری و از مجاری به لگنچه کلیه تخلیه میشود. میزنای ادرار را از لگنچه به مثانه منتقل میکند. در این مطلب از مجله فرادرس فیزیولوژی کلیه را همراه چند اختلال این اندام توضیح میدهیم.
فیزیولوژی کلیه
سیستم کلیوی از کلیه، میزنایها، مثانه و میزراه تشکیل شده است. عملکرد کلی این سیستم دفع سمها، متابولیتهای زائد و یونهای اضافی از بدن است. کلیه بخشی از این سیستم است که اسمولاریته پلاسما را با کنترل دفع آب و الکترولیتها تنظیم میکند و نقش مهمی در تنظیم pH مایعات بدن دارد. کلیه علاوه بر تنظیم اسمولاریته با ترشح اریتروپویتین در تولید گلبولهای قرمز و با ترشح رنین در تنظیم فشار خون نقش دارد. همچنین تبدیل ویتامین D به ساختار فعال در سلولهای کلیه انجام میشود. این اندام به حدود ۲۵٪ اکسيژن جذب شده در ریهها برای انجام عملکرد خود نیاز دارد. سلولهای کلیوی از اکسيژن برای تولید ATP در تنفس سلولی و تامین انرژی لازم برای انتقال فعال استفاده میکنند.
کلیه از چه بخش هایی تشکیل شده است؟
قبل از بررسی فیزیولوژی کلیه بهتر است با اجزا و بافتهای کلیوی آشنا شویم. کلیهها یک جفت اندام لوبیایی شکل پشت کبد و در حفره شکمی هستند که بین مهره دوازده سینهای (T12) و مهره سوم کمری (L3)، دو طرف ستون فقرات قرار دارد. «غشای پیوندی» (Renal Fascia)، «کپسول چربی پیشکلیوی» (Perirenal Fat Capsule) و کپسول کلیوی سه لایه خارجی و قشر، «مدولا» (Medulla) و لگنچه کلیوی بخشهای سه لایه داخلی این اندام هستند. هیلوم کلیه بخش فرورفته ساختار لوبیایی شکل، و محل ورود رگهای خونی و عصبها به این اندام است. لگنچه کلیه در این قسمت قرار دارد و میزنای از این بخش ادرار را به مثانه منتقل میکند.
نفرونها واحدهای عملکردی کلیه هستند. این ساختارها از یک کپسول و لولههایی تشکیل شده که وظیفه آنها تشکیل ادرار است. نفرونها در قشر کلیه قرار دارد و ظاهری دانهدار یا گرانولی در این بخش ایجاد میکند. مدولا از تودههای بافتی هرمی تشکیل شده که راس یا «پاپیلای» (Papillae) آنها سمت لگنچه و قاعده آنها سمت قشر کلیه است. کالیکسهای فرعی و اصلی، مجراهایی هستند که ادرار را از پاپیلای هرم دریافت کرده و به لگنچه منتقل میکنند.
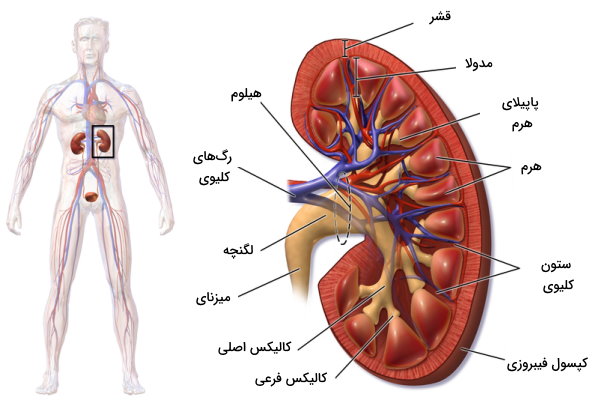
کالیکسهای فرعی نزدیک راس هرم قرار دارد و از به هم پیوستن چند کالیکس کوچک، کالیکس اصلی ایجاد میشود. فضای بافتی بین مخروطها، ستونهای کلیه نام دارد و محل عبور رگهای خونی است. به طور میانگین در هر کلیه ۸ مخروط وجود دارد که همراه قشر نزدیک خود، لوبهای کلیه را تشکیل میدهند.
رگ های کلیه
خون بهوسیله سرخرگ کلیوی (شاخهای از آئورت) وارد این اندام شده، به بافتهای مختلف آن خونرسانی کرده و متابولیتهای زائد را با نفرونها مبادله میکند. سپس بهوسیله سیاهرگ کلیوی به بزرگسیاهرگ زیرین و دهلیز راست منتقل میشود. هر سرخرگ کلیه به سرخرگهای سگمنتال تقسیم میشود. این رگها به سرخرگهای بین لوبی تقسیم شده و خون لوبهای کلیه را تامین میکند. سرخرگهای بین لوبی در مرز بین قشر و مدولا تقسیم شده و سرخرگهای قوسی در قاعده هرمها تشکیل میشود. سرخرگهای شعاعی، شاخههای سرخرگ قوسی هستند که کلیه به تعداد زیادی سرخرگچه آوران تقسیم میشوند. سرخرگچههای آوران، شبکه مویرگی نفرون را تشکیل میدهد. سیاهرگها کنار سرخرگها حرکت کرده و خون را از کلیه خارج میکند.
نفرون کلیه
در هر کلیه میلیونها نفرون وجود دارد که بخشی از آن در مدولا و بخشی از آن در قشر قرار میگیرد. هر نفرون از کپسول بومن و مویرگهای گلومرولی (کپسول کلیه)، لولهها و شبکه مویرگی اطراف لولهها تشکیل شده است.
کپسول نفرون
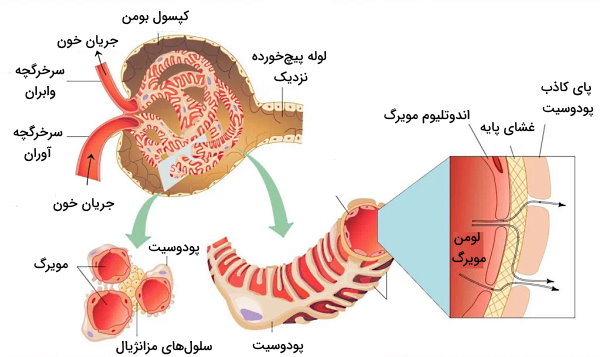
کپسول نفرون یا کپسول بومن، ساختاری جامیشکل با دیواره دولایه است که شبکه مویرگی به نام گلومرول در آن قرار دارد. لایه خارجی از سلولهای پوششی و لایه داخلی از سلولهای «پودوسیت» (Podocyte) تشکیل شده است. پروتئین نفرین، پودوسیتهای کناری را به هم وصل کرده و سدی در برابر ورود مولکولهای بزرگ به نفرون ایجاد میکند. گلومرول از مویرگهای منفذدار تشکیل شده است. ترکیبات پلاسما (پروتئینهای کوچک، آب، سدیم، پتاسیم، کلسیم، منیزیم، کلر، بیکربنات و متابولیتها) با قطر کمتر از ۱۰۰ نانومتر با عبور از این منافذ وارد نفرون میشود.
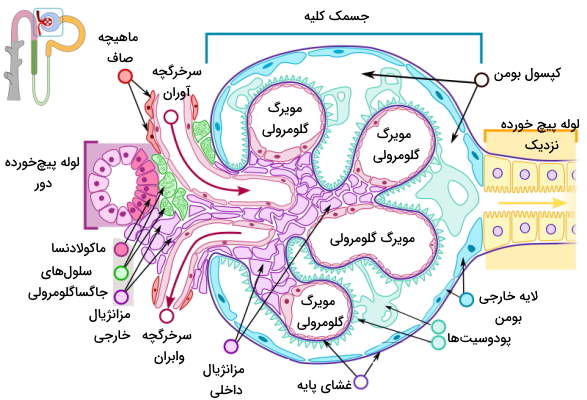
غشای پایه گلومرولها از یک لایه لامینا دنسا (لایه کلاژن نوع IV و پروتئینهای لامینین) تشکیل شده است که بین دو لایه گلایکوزآمینوگلایکان قرار دارد. هپارین سولفات گلایکوزآمینوگلایکان اصلی در غشای پایه بین گلومرول و سلولهای کپسول بومن است. بار منفی هپارین سولفات از ورود پروتئینهای بار منفی پلاسما ازجمله آلبومین و آنتیبادیها به کپسول بومن جلوگیری میکند. به علاوه سرعت عبور کاتیونها ($$Na^+$$) از غشای پایه بیشتر آنیونها ($$HCO_3^-$$) است. سلولهای مزانژیال خارجی سلولهای ماهیچهای مایزیافتهای هستند که بین سرخرگچههای آوران و وابران قرار دارند. انقباض این ماهیچهها جریان خون ورودی به گلومرول را تنظیم میکند.
لولههای نفرونی
لولههای نفرونی ساختارهای بلند و پیچخورده نفرون هستند که بر اساس عملکرد به سه نوع لوله پیچخورده نزدیک، لوپ هنله و لوله پیچخورده دور تقسیم میشود. لوله پیچخورده نزدیک در قشر کلیه و در امتداد کپسول بومن قرار دارد. قوس هنله از بخش بالارونده و پایینرونده تشکیل شده و در مدولا قرار دارد. لوله پیچخورده دور در قشر کلیه قرار دارد. ادرار تشکیل شده در نفرون از لوله پیچخورده دور به لوله جمعکننده در مدولا تخلیه میشود. ولوله جمعکننده نفرونهای مختلف در پاپیلای هرم با هم ادغام می شود.
شبکه مویرگی نفرون
خون بهوسیله سرخرگچه آوران وارد گلومرول شده و بهوسیله سرخرگچه وابران از این بخش نفرون خارج میشود. سرخرگچه وابران شبکه مویرگی اطراف لولههای پیچخورده نزدیک و دور را ایجاد میکند. در دیواره سرخرگچه آوران سلولهای ماهیچهای تمایزیافتهای به نام سلولهای «جاگساگلرومرولی» (Juxtaglomerular Cells) یا کنارگلومرولی با تعداد زیادی وزیکول سیتوپلاسمی وجود دارد. آنزیم رنین در این وزیکولها ذخیره میشود. این آنزیم نقش مهمی در تنظیم فشار خون و عملکرد کلیه دارد. «وازا رکتا» (vasa recta) بخشی از شبکه مویرگی است که اطراف قوس هنله قرار دارد.
تشکیل ادرار در فیزیولوژی کلیه
در بخشهای قبلی این مطلب از مجله فرادرس آناتومی و ساختارهای داخلی کلیه را توضیح دادیم. در این بخش نقش این هر بخش در فیزیولوژی کلیه را بررسی میکنیم. وظیفه اصلی کلیه تشکیل ادرار است. ادرار در سه فرایند فیلتراسیون، بازجذب و ترشح در لولههای نفرونی تشکیل میشود. فیلتراسیون مرحله ورود اولیه مواد زائد و الکترولیتها به نفرون، بازجذب برگشت مواد از نفرون به مویرگ و ترشح انتقال مواد از مویرگها به لولههای نفرونی است. هر یک از این مراحل در بخشهای مختلف نفرون انجام میشود.
فیلتراسیون گلومرولی در فیزولوژی کلیه
در فیلتراسیون گلومرولی الکترولیتها، آب، آمینواسیدها، گلوکز، کراتین، اوره و متابولیتها زائد (لاکتیکاسید، لیپیدها) از مویرگ به کپسول بومن منتقل میشود. اختلاف فشار هیدرواستاتیک مویرگ، فشار هیدرواستاتیک مایع داخل کپسول بومن و فشار اسمزی خون نیروی اصلی پیشبرنده فیلتراسیون گلومرولی است. فشار هیدرواستاتیک خون در گلومرولها تقریبا ۵۵ میلیمتر جیوه و در جهت خروج مواد از خون است. فشار هیدرواستاتیک مایع کپسول بومن حدود ۱۵ میلیمتر جیوه و در جهت خروج مواد از کپسول بومن است.
پروتئینهای بزرگ خون به ویژه آلبومین اسمولاریته خون را افزایش داده و مانع خروج آب از مویرگ میشود. فشار اسمزی ایجاد شده بهوسیله این پروتئینها حدود ۱۵ میلیمتر جیوه و در جهت خروج مواد از کپسول است. در نتیجه فشار ایجاد شده در جهت ورود مواد به نفرون ۵۵ میلیمتر جیوه و فشار ایجاد شده در جهت ورود مواد به مویرگ ۴۵ میلیمتر جیوه خواهد بود و سبب انتقال مواد از خون به نفرون میشود.
حجم پلاسمایی است که در هر دقیقه از مویرگهای گلومرولی وارد کپسول بومن میشود، نرخ فیلتراسیون گلومرولی (GFR) نام دارد و در یک بزرگسال بالغ حدود ۱۲۵ میلیلیتر در دقیقه است. مساحت سطح و نفوذپذیری مویرگهای گلومرولی دو عامل تعیینکننده GFR است. افزایش این دو عامل GFR را افزایش و کاهش آن GFR را کاهش میدهد. اسمولالیته ادراری که از کپسول بومن خارج میشود ۳۰۰ mOsmol/Kg است.
بازجذب و ترشح در لوله پیچ خورده نزدیک
اگر تا این بخش از مطلب با ما همراهی کرده باشید، متوجه شدید که لولههای نفرونی نقش مهمی در فیزیولوژی کلیه دارند. در غشای قاعدهای سلولهای دیواره لولههای پیچخورده نزدیک (PCT) تعداد زیادی پمپ سدیم/پتاسیم وجود دارد که با مصرف هر ATP سه یون سدیم را از سیتوپلاسم خارج و دو یون پتاسیم را به سیتوپلاسم منتقل میکند. در غشای لومنی این سلولها سیمپورترهای سدیم/گلوکز، سدیم/آمینواسید و سدیم/لاکتات وجود دارد. این ناقل پروتئینی، سدیم را در جهت شیب غلظت از لومن نفرون به سیتوپلاسم منتقل کرده و از انرژی آن برای انتقال گلوکز، آمینواسیدها یا لاکتات در جهت خلاف شیب غلظت از لومن به سیتوپلاسم سلول استفاده میکند. این متابولیتها بهوسیله ناقلهای پروتئینی در سطح قاعدهای سلولهای دیواره لوله پیچخورده نزدیک به مویرگ برمیگردد و بازجذب میشود. در شرایط فیزیولوژیک تمام گلوکز، آمینواسید و لاکتات ترشح شده در لولههای نفرونی بازجذب میشود.
آنتیپورتر سدیم/پروتون و آنزیم کربنیک انیدراز، دو پروتئین غشایی دیگر در سطح لومنی سلولهای دیواره لوله پیچخورده نزدیک است که به بازجذب بیکربنات و یون سدیم کمک میکند. دیاکسید کربن موجود در خون با عبور از غشای لیپیدی سلولهای اندوتلیال و غشای قاعدهای سلولهای PCT وارد سیتوپلاسم شده، بهوسیله آنزیم کربنیک انیدراز با آب واکنش داده و به اسید کربنیک تبدیل میشود. اسید کربونیک ترکیبی ناپایدار است که بلافاصله به بیکربنات و پروتون تجزیه میشود. آنتیپورتر سدیم/پروتون یون سدیم را به سیتوپلاسم و پروتون را به لومن PCT منتقل میکند.
در لومن بیکربنات بهوسیله آنزیم کربونیکانیدراز غشایی با پروتون واکنش داده و به دیاکسید کربن و آب تبدیل میشود. دیاکسید کربن از غشای لومنی سلولهای دیواره PCT عبور کرده و در سیتوپلاسم به بیکربنات تبدیل میشود. به این ترتیب ۸۵ تا ۹۰٪ بیکربنات ترشح شده در کپسول بومن به طور غیرمستقیم از لوله پیچخورده نزدیک بازجذب خواهد شد. بیکربنات بهوسیله سیمپورتر سدیم/بیکربنات در غشای قاعدهای سلولهای PCT به خون منتقل میشود.
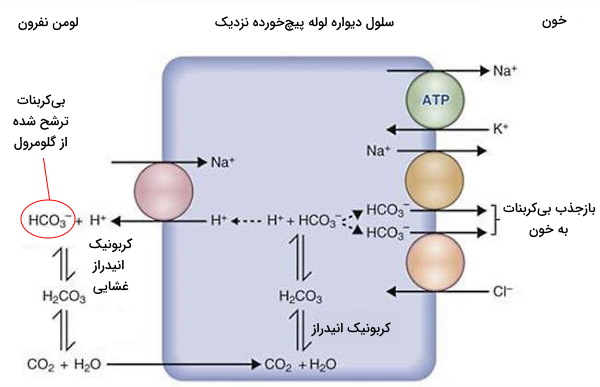
بازجذب سدیم در لوله پیچخورده نزدیک، اسمولاریتی ادرار در نفرون را کاهش داده و با بازجذب آب همراه است. حدود ۶۵٪ آب و سدیم ترشح شده در گلومرول در این بخش از نفرون بازجذب میشود. همچنین یون کلسیم، منیزیم و پتاسیم (حدود ۵۵٪) ترشح شده در کپسول بومن با عبور از فضای بین سلولهای PCT وارد خون و بازجذب میشود. بخشی از یون کلر بهوسیله سیمپورتر سدیم/کلر از این بخش لولههای نفرونی بازجذب میشود. به علاوه لیپیدها و بخش بسیار کمی از اوره با انتشار ساده از غشای سلولها عبور کرده و بازجذب میشود.
پروتئینهای کوچکی که از سد گلومرولی عبور کرده و وارد نفرون شده است بهوسیله اندوسیتوز وارد سلولهای PCT میشود. در لیزوزومها به زیرواحدهای آمینواسیدی تبدیل شده و آمینواسیدها به خون منتقل میشود. اختلاف ترشح و بازجذب مواد در این بخش از نفرون صفر و اسمولالیته ادراری که از این بخش خارج میشود ۳۰۰ mOsmol/L است.
جذب و بازجذب در لوپ هنله
در بخشهای قبلی این مطلب از مجله فرادرس توضیح دادیم که لوپ هنله از بخش پایینرونده و بالاروند تشکیل شده است. این بخشها عملکرد متفاوتی در فیزیولوژی کلیه دارد. بخش پایینرونده هنله نسبت به آب و بخش بالارونده آن نسبت به یونها نفوذپذیری بیشتری دارد. پروتئین همانتقال غشای سلولهای بخش بالارونده هنله با انتقال یون سدیم، پتاسیم و کلر از لومن نفرون به سیتوپلاسم سلول اسمولاریتی ادرار را افزایش میدهد. این یونها بهوسیله کانالهای یونی غشای قاعدهای سلولهای دیواره هنله به مایع میانبافتی منتقل میشود.
افزایش یونها در بافت مدولا کلیه با بازجذب آب از کانالهای آکوآپورین ۱ (AQP1) در بخش پایینرونده لوله هنله همراه است. بازجذب آب از بخش پایینرونده لوله هنله سبب افزایش اسمولاریتی ادرار به ۱۲۰۰ mOsmol/L میشود. اما در بخش بالارونده این لوله مقدار زیادی از یونها وارد مایع میانبافتی مدولای کلیه میشود و اسمولاریتی ادرار ورودی به لوله پیچخورده دور حدود ۲۰۰ mOsmol/L است. حدود ۱۵٪ آب و ۲۵٪ سدیم ترشح شده در گلومرول در لوله هنله بازجذب میشود.
جذب و بازجذب در لوله پیچ خورده دور
سیمپورترهای سدیم/کلر در غشای لومنی سلولهای بخش ابتدایی لوله پیچخورده دور (DCT) نقش مهمی در فیزیولوژی کلیه دارد. این ناقل پروتئینی یون سدیم (حدود ۵٪) و کلر را از لومن به سیتوپلاسم سلولها انتقال میدهد. این یونها بهوسیله ناقلهای غشای قاعدهای DCT به خون برمیگردد. بازجذب کلسیم در لوله پیچخورده دور و نزدیک بهوسیله هورمونهای غده پاراتیروئید کنترل میشود.
گیرنده هورمون پاراتیروئید در غشای سلولهای لوه پیچخورده نزدیک و دور سبب فعال شدن G پروتئین همراه گیرنده میشود. این پروتئین آنزیم آدنیلات سیکلاز را فعال کرده و افزایش cAMP در سلول سبب فعال شدن آنزیم کیناز A میشود. آنزیم کیناز A با اضافه کردن گروه فسفات به کانالهای کلسیمی غشای لومنی سلولها سبب فعال شدن کانال و ورود کلسیم از ادرار به سیتوپلاسم سلولها میشود. سیمپورتر سدیم/کلسیم در غشای قاعدهای این سلولها سدیم را در جهت شیب غلظت به سیتوپلاسم انتقال داده و کلسیم را خلاف جهت شیب غلظت از سلول به خون منتقل میکند. پمپ کلسیم/پروتون ناقل غشایی دیگری است که با مصرف ATP یون کلسیم را از غشای قاعدهای سلولهای PCT و DCP خارج میکند.
بازجذب آب و الکترولیتها در سلولهای بخش انتهایی لوله پیچخورده دور به ترشح آلدوسترن از غدد فوق کلیه و هورمون وازوپرسین از هیپوفیز وابسته است. اتصال این هورمون استروئیدی به گیرندههای سیتوپلاسمی سلولهای DCT با افزایش بیان ژن ناقلهای سدیم و پتاسیم در غشایی لومنی و پمپ سدیم/پتاسیم در غشای قاعدهای سلولهای بخش انتهایی DCT را افزایش میدهد. در این شرایط افزایش انتقال یون سدیم به خون بهوسیله پمپ سدیم/پتاسیم غلظت این یون در سیتوپلاسم سلول را نسبت به ادرار کاهش میدهد. در نتیجه سدیم در جهت شیب غلظت وارد سلولهای DCT میشود.

همچنین افزایش ورود پتاسیم به سیتوپلاسم بهوسیله پمپ قاعدهای ترشح پتاسیم از سلولها به بخش انتهایی لوله پیچخورده دور را افزایش میدهد. اتصال وازوپرسین به گیرندههای سلولهای بخش انتهای DCT رونویسی ژنهای آکوآپورین ۲ (AQP2) و بازجذب آب از این سلولها را افزایش میدهد.
وظیفه لوله جمع کننده چیست؟
دیواره لوله جمعکننده ادرار آخرین بخش نفرون است که از دو نوع سلول تشکیل شده که به تنظیم pH خون و ادرار کمک میکند. دیاکسید کربن از خون به سلولهای نوع A منتقل شده و در سیتوپلاسم سلول بهوسیله آنزیم کربنیک انیدراز با آب ترکیب میشود. اسید کربنیک حاصل از این واکنش به پروتون و بیکربنات تجزیه میشود. در اسیدوز (کاهش pH خون) خون، پروتون بهوسیله پمپ پروتون/پتاسیم از غشای لومنی سلولهای A به لومن ترشح و همراه ادرار دفع میشود. آمونیاک ترکیب دیگری است که غلظت آن در اسیدوز افزایش مییابد. آمونیاک بهوسیله سلولهای نوع A در نفرون ترشح شده و پس ترکیب شدن با پروتون به شکل آمونیوم از ادرار دفع میشود. به علاوه آنتیپورتر کلر/بیکربنات در غشای قاعدهای این سلولها با انتقال بیکربنات به خون در افزایش pH نقش دارد.
سلولهای نوع B در آلکالوز (افزایش pH خون) دیاکسید کربن را به بیکربنات و پروتون تبدیل میکند. بیکربنات بهوسیله سیمپورترهای کلر/بیکربنات در سطح لومنی این سلولها به نفرون ترشح میشود. کلر بهوسیله کانالهای آنیونی غشای قاعدهای به خون منتقل میشود. به علاوه پمپ پتاسیم/پروتون غشای قاعدهای پروتون حاصل از تجزیه بیکربنات را به خون و پتاسیم را به سیتوپلاسم سلولهای نوع B منتقل میکند. بازجذب آب از لوله جمعکننده مثل لوله پیچخورده دور به هورمون وازوپرسین وابسته است. اتصال این هورمون به سلولهای اصلی در لوله جمعکننده ادرار و لوله پیچخورده دور با انتقال کانالهای آکوآپورین ۲ به غشای لومنی سلول و افزایش بازجذب آب همراه است. در نتیجه حجم و فشار خون افزایش مییابد.
تنظیم فیزیولوژی کلیه
تا این بخش از مطلب آناتومی کلیه و عملکرد آن را توضیح دادیم. اما فیزولوژی کلیه چگونه تنظیم میشود؟ جریان خون کلیه و تشکیل ادرار بهوسیله انقباض ماهیچههای صاف سرخرگچهها، فیدبک توبولهای نفرون، اعصاب سمپاتیک و سیستم رنین-آنژیوتانسین تنظیم میشود. افزایش فشار خون، فشار هیدروستاتیک گلومرولها و GFR را افزایش میدهد. افزایش فشار سبب کشیدگی ماهیچههای صاف دیواره سرخرگچه آوران و باز شدن کانالهای مکانیکی سدیم میشود. ورود یون سدیم به سیتوپلاسم با افزایش خروج کلسیم از شبکه اندوپلاسمی و انقباض ماهیچهها همراه است. «کاهش قطر سرخرگ» (Vasoconstriction) به دلیل انقباض ماهیچهها GFR را کاهش داده و از آسیب کلیه جلوگیری میکند. کاهش فشار خون با کاهش کشش ماهیچههای صاف، کاهش ورود سدیم به سلول و کاهش انقباض ماهیچه همراه است. در این شرایط ماهیچهها در حالت استراحت قرار دارند و قطر رگ افزایش (Vasodilation) مییابد. در نتیجه GRF افزایش یافته و تشکیل ادرار از آسیب کلیه جلوگیری میکند.
افزایش فشار خون فیزیولوژی کلیه را تغییر داده و با افزایش ترشح سدیم کلرید در کپسول بومن همراه است. بخش زیادی از یون سدیم در لوله پیچخورده نزدیک بازجذب میشود و غلظت کمی از آن به لوله پیچخورده دور منتقل میشود. اما افزایش ترشح سدیم کلرید، غلظت این یون در لوله پیچ خورده دور را افزایش داده و ترشح آدنوزین از سلولهای «ماکولا دنسا» (Macula Densa) در لوله پیچ خورده دور را تحریک میکند. اتصال آدنوزین به گیرندههای سلولهای ماهیچه صاف در سرخرگچه آوران با انقباض ماهبچه و کاهش قطر رگ همراه است. در نتیجه جریان خون، فیلتراسیون گلومرولی و سدیم کلرید ترشحی در نفرون کاهش مییابد. اتصال این مولکول به گیرنده سلولهای جاگساگلومرولی با مهار ترشح رنین افزایش فشار خون، GFR و ترشح سدیم در نفرون را مهار میکند.
کاهش شدید فشار خون با کاهش ترشح سدیم در کپسول بومن همراه است. در این حالت سلولهای لوله پیچخورده نزدیک زمان کافی برای جذب بیشتر سدیم دارند. در نتیجه غلظت سدیم در لوله پیچخورده دور کاهش یافته، و ترشح نیتریک اکسید (NO) و پروستوگلاندین (PGI2) از سلولهای ماکولا دنسا را تحریک میکند. اتصال NO و PGI2 به گیرنده ماهیچه صاف سرخرگچه آوران انقباض ماهیچه را مهار کرده و قطر رگ را افزایش میدهد. در نتیجه جریان خون، GFR و ترشح سدیم کلرید در نفرون افزایش مییابد. اتصال این مولکولها به گیرنده سلولهای جاگساگلومرولی ترشح رنین از این سلولها را تحریک میکند. رنین فشار خون، GFR و ترشح سدیم کلرید در خون را افزایش میدهد.
کاهش فشار خون از مسیرهای مختلف مرکز کنترل ساقه مغز و اعصاب پاراسمپاتیک را فعال میکند. گیرندههای فشار در دیواره سرخرگهای کاروتید و آئورت، کاهش فشار جزئی اکسيژن را به شکل پیام عصبی و بهوسیله اعصاب کرانیال (۹ و ۱۰) به ساقه مغز منتقل میکند. پیام عصبی این مرکز بهوسیله اعصاب سمپاتیک به گره سینوسی-دهلیزی و ماهیچههای قلبی منتقل میشود. تحریک سمپاتیک ضربان قلب و قدرت انقباض ماهیچهها افزایش میدهد که با افزایش خروجی و حجم ضربهای قلب همراه است. در نتیجه فشار خون افزایش مییابد. اثر سمپاتیک بر گیرندههای آلفا ماهیچه صاف سرخرگچه آوران با انقباض این ماهیچه، قطر رگ و GFR را کاهش میدهد. در نتیجه خون بیشتری به اندامهای حیاتی مغز، قلب و ریه منتقل میشود. اتصال انتقالدهنده عصبی این اعصاب به گیرنده آلفا در ماهیچه رگهای محیطی بدن با انقباض ماهیچه، کاهش قطر رگ و افزایش فشار سیستمی همراه است. به علاوه تحریک سمپاتیک با افزایش ترشح رنین از سلولهای جاگساگلومرولی فشار خون را افزایش میدهد.
سیستم رنین-آنژیوتانسین-آلدوسترون یکی دیگر از مکانیسمهایی است فیزیولوژی کلیه را برای تنظیم فشار خون تغییر میدهد. کاهش فشار خون آزادشدن رنین از وزیکولهای سلولهای جاگساگلومری را تحریک میکند. این آنزیم با جدا کردن چند آمینواسید، پروتئین آنژیوتانسین کبدی را به آنژيوتانسین I تبدیل میکند. آنژیوتانسین I بهوسیله آنزیم آنژیوتانسین کانورتاز به آنژیوتانسین II تبدیل میکند. آنژیوتانسین II ترشح وازوپرسین از لوب پشتی هیپوفیز را تحریک میکند. اتصال وازوپرسین به گیرندههای سلولهای لوله جمعکننده ادرار با انتقال آکوآپورینها به غشای لومنی این سلولها بازجذب آب را افزایش میدهد. در نتیجه افزایش حجم خون به دلیل افزایش بازجذب آإ، فشار خون را افزایش میدهد.
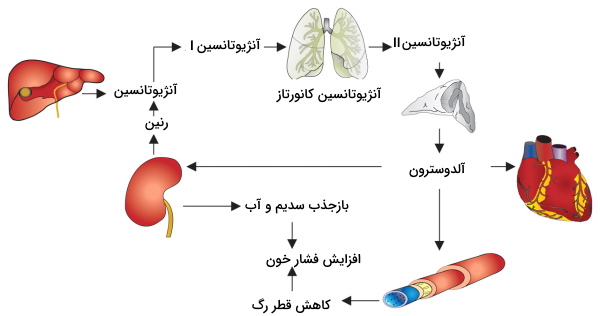
اتصال آنژیوتانسین II به سلولهای زوناگلومروسا در قشر کلیه ترشح هورمون آلدوسترون را تحریک میکند. این هورمون بازجذب آب و سدیم از لوله پیچخورده دور را افزایش میدهد. در نتیجه حجم خون و به دنبال آن فشار خون افزایش مییابد. اتصال آنژیوتانسین II به گیرندههای غشایی سلولهای ماهیچهای سرخرگچه وابران با انقباض ماهیچه و کاهش قطر این رگها همراه است. کاهش جریان خون سرخرگچه وابران سبب افزایش زمان تبادل مواد در مویرگهای گلومرولی شده و GFR افزایش مییابد. به علاوه آنژیوتانسین II بازجذب سدیم از لوله پیچخورده نزدیک را افزایش میدهد. افزایش بازجذب سدیم، بازجذب آب از این بخش نفرون را افزایش میدهد. در نتیجه حجم و فشار خون افزایش مییابد. افزایش فشار خون با ترشح «پپتید دفعکننده سدیم» (Atrial natriuretic peptide | ANP) از قلب همراه است. اثر این هورمون عکس آنژیوتانسین II است.
متابولیسم کلیه
کلیه ازجمله اندامهایی است که به ATP زیادی بر انجام فعالیتهای خود نیاز دارد. این اندام بخشی از گلوکز مورد نیاز خود برای سنتز ATP را از خون دریافت کرده و بخشی از آن را در فرایند گلوکونئوژنز سنتز میکند. لاکتات و گلوتامین ترمکیبات آلی اصلی هستند که در سلولهای قشر کلیه به گلوکز تبدیل میشود. اتصال هورمونهای انسولین و اپینفرین به گیرنده این سلولها سنتز گلوکز را افزایش میدهد. اما گیرنده گلوکاگون در این سلولها وجود ندارد. کلیه بخشی از گلوکز مورد نیاز اندامهای دیگر را به ویژه در شرایط نارسایی کبد، گرسنگی طولانی، هیپوگلایسمیا (کاهش گلوکز خون) و اسیدوز فراهم میکند.
فشار اکسیژن، تعداد میتوکندریها و آنزیمهای اکسیداز درمدولای کلیه کمتر از قشر کلیه است. به همین دلیل در این بخش محصول اصلی تجزیه گلوکز در سلولهای این بخش لاکتات است. اما تعداد میتوکندریها و آنزیمهای اکسیداز در سلولهای قشر بیشتر است. سلولهای قشر از اسید چرب، لاکتات، گلوتامات، سیترات و کتونها برای تامین انرژی استفاده میکنند و منبع اصلی انرژی آنها اسیدچرب است.
سنگ کلیه چطور تشکیل می شود؟
تغییر غلظت آب، pH و مواد معدنی در ادرار، فیزیولوژی کلیه را تغییر میدهد و منجر به ایجاد بلورهایی در لگنچه و مجاری این اندام میشود که به آن سنگ کلیه گفته میشود. به این بلورها سنگ کلیه گفته میشود. کاهش آب و افزایش غلظت ترکیبات محلول در ادرار (کلسیم، اگزالات، اوریکاسید و سیستین) احتمال رسوب ذرات و تشکیل بلور را افزایش میدهد. کاهش شدید pH ادرار احتمال رسوب اوریکاسید و افزایش شدید pH احتمال رسوب کلسیم فسفات و تشکیل بلور آنها را افزایش میدهد. تغییر غلظت سیترات یکی دیگر از عواملی است که در ایجاد سنگ کلیه نقش دارد. در نبود سیترات، کلسیم با اگزالات ترکیب شده و بلورهای آن در مجاری کلیه رسوب میکند.

حرکت بلورهای تشکیل شده در مجاری و انتقال آن به میزنای منجر به آسیب غشای مخاطی مجاری میشود. در این شرایط آسیب مویرگها منجر به خروج خون همراه با ادرار از بدن میشود. به علاوه تحریک گیرندههای کششی دیواره میزنای با ارسال پیام به مدولای مغز و احساس درد در پهلوها و کشاله ران همراه است. تحریک این مرکز در مغز، انعکاس استفراغ را نیز فعال میکند. بلورهای تشکیل شده ممکن است حرکت ادرار به سمت مثانه را مسدود کند. در نتیجه ادرار به کلیه برمیگردد. افزایش ادرار در نفرونها فشار هیدروستاتیک کپسول بومن را افزایش و GFR را کاهش میدهد. در نتیجه غلظت ترکیبات مختلف ازجمله اوره و کراتین در خون افزایش مییابد. مسدود شدن ادرار در مجاری و بازگشت آن به کلیه فرصت کافی برای رشد و تکثیر باکتریهای همراه ادرار ایجاد میکند و با عفونت کلیوی و مجاری ادراری همراه است.
جمعبندی فیزیولوژی کلیه
در این مطلب از مجله فرادرس توضیح دادیم که کلیهها اندامهایی در حفره شکمی، دو طرف ستون مهرهها هستند که وظیفه اصلی آنها دفع متابولیتها، آب و الکترولیتهای اتضافی بدن است و به تنظیم فشار خون کمک میکنند. این اندام از دو بخش قشر و مدولا با سلولهای متفاوت و لولههای نفرونی تشکیل شده است. در ادامه توضیح دادیم که نفرونهای به گلومرول، لوله پیچخورده نزدیک، لوله هنله، لوله پیچخورده دور و لوله جمعکننده ادرار تقسیم میشود که نقش اصلی در تشکیل ادرار را بر عهده دارند. ادرار در سه مرحله فیلتراسیون، بازجذب و ترشح تشکیل میشود. فیلتراسیون ورود آب و متابولیتها از مویرگهای گلومرولی به کپسول بومن، بازجذب ورود الکترولیتها، آب و متابولیتها از لولههای نفرونی به مویرگها و ترشح ورود مواد از مویرگها به لولههای نفرونی است. در نهایت ادرار تشکیل شده در این سه مرحله میزنایها از کلیه به مثانه منتقل میشود.