مدل اتمی بور و نتایج آن — به زبان ساده

مکانیک کوانتومی، فیزیک کوانتومی و نظریه نسبیت موضوعاتی مدرن، بسیار جذاب، تاثیر گذار و البته گیجکننده هستند. این موضوعات پایههای فیزیک مدرن را شکل دادهاند. نقطهی آغاز مکانیک کوانتومی، ارائه مدل اتمی بور محسوب میشود.
مدل بور
فیزیکدانی دانمارکی به نام «نیلز بور» (Niels Bohr) در سال ۱۹۱۳ مدلی از اتم را ارائه داد که تحت عنوان مدل اتمی بور شناخته میشود. در حقیقت او مدل اتمی رادرفورد را اصلاح کرد. پیشتر رادرفورد بیان کرده بود که اتم از هستهای با بار مثبت تشکیل شده که بارهای منفی یا همان الکترونها اطراف آن قرار دارند. نیلز بور با رفع کردن محدودیتهای توصیف رادرفورد از اتم، تصویری از اتم ارائه داد که امروزه در ذهن ما است.
طبق مدل اتمی بور، الکترونها در مسیرهای ثابتی اطراف هسته، تحت عنوان «اوربیتال» (Orbital) در حال حرکت هستند. در مطلبی جداگانه مفهوم اوربیتال را توضیح خواهیم داد.
مبتنی بر این مدل، هستهای با بار الکتریکی مثبت در مرکز قرار گرفته و الکترونهای با بار منفی در سطوح انرژی ثابتی اطراف آن در حال گردش هستند. این نظریه همچنین بیان میکند که الکترونهای قرار گرفته در فاصلهای دورتر از هسته دارای انرژی بیشتری هستند. این در حالی است که الکترونهای نزدیکتر به هسته از انرژی کمتری برخوردارند. در شکل زیر شماتیک مدل اتمی بور ترسیم شده است.
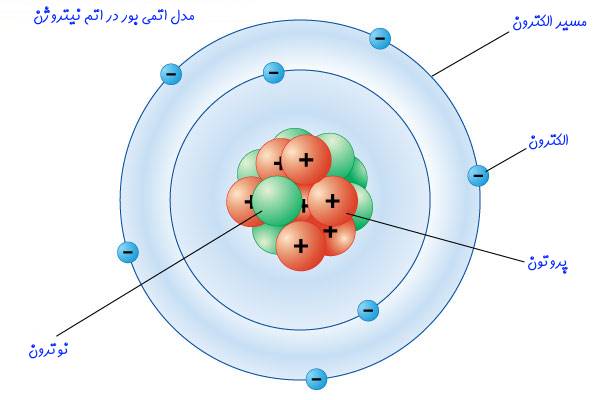
فرضیات و نتایج مدل اتمی بور
نیلز بور مدل خود را مبتنی بر فرضیاتی ارائه داد. این فرضیات به شرح زیر هستند:
فرضیات
- الکترونها در مسیرهای دایرهای ثابتی در اطراف هسته در حال حرکتاند. این مسیرها تحت عنوان اوربیتال شناخته میشوند.
- انرژی الکترونها در این مسیرها، مقداری ثابت است. چندین اوربیتال یک «پوسته» (Shell) را تشکیل میدهند. در شکل زیر اوربیتال، پوسته و دیگر اجزای اتم نشان داده شدهاند. تا زمانی که الکترون در مسیر ثابت خودش گردش کند، انرژیای تابش نخواهد کرد.
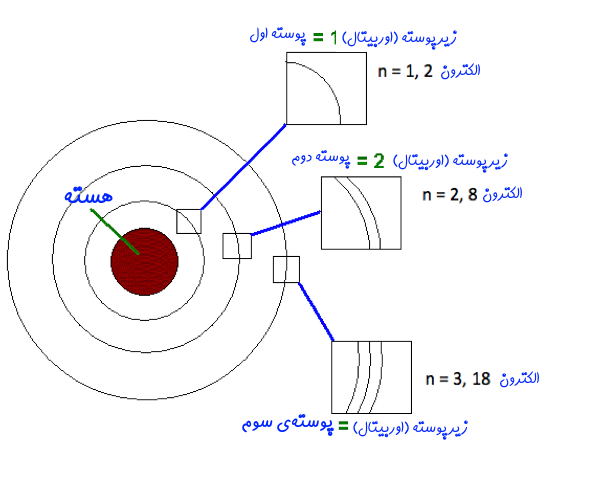
- سطوح انرژی متفاوت با اعداد n نشان داده میشوند. در حقیقت n=1، پوسته اول، n=2 پوستهی دوم و به همین شکل پوستهها -یا همان سطوح انرژی- با این اعداد نشان داده میشوند. به این مقادیر اعداد کوانتومی گفته میشود. این عدد از کمترین سطح (n=1) شروع شده و تا مقادیر صحیح بالاتر ادامه پیدا میکند.
- تغییرات انرژیِ یک الکترون زمانی رخ میدهد که سطح انرژیش تغیر کند. در یک اتم الکترون با گرفتن انرژی از n کم به n بیشتر منتقل میشود. از طرفی وقتی الکترونی انرژیش را از دست بدهد، سطح انرژی آن نیز کاهش مییابد. تغییرات انرژی الکترون در شکل زیر نشان داده شده است. در این شکل الکترون از لایهی سوم به سطح انرژی پایینتر در لایه دوم رفته و در نتیجه آن انرژی گسیل داده است. در مطلبی تحت عنوان اثر فوتوالکتریک در مورد مقدار و نحوه انرژی گسیل داده شده بحث شده است.

- بنابراین هر اتم تعدادی پوسته اطراف خود دارد که هرکدام از این پوستهها شامل چندین زیرپوسته (اوربیتال) است.
نتایج
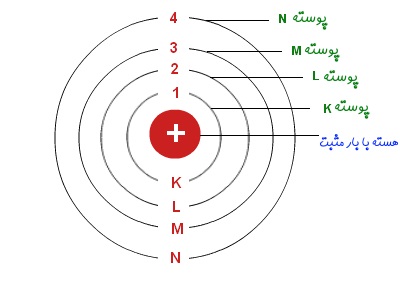
- پوسته اول (سطح انرژی اول) که با نماد K نشان داده میشود، میتواند حداکثر ۲ الکترون را در خود نگه دارد.
- پوسته دوم (سطح انرژی دوم) با نماد L نشان داده شده و در بیشترین حالت میتواند ۸ الکترون را در خود نگه دارد.
- پوسته سوم که با نماد M نشان داده میشود میتواند ماکزیمم ۱۸ الکترون را در خود جا دهد.
- جهت نشان دادن پوسته چهارم از نماد N استفاده شده و میتواند در بهترین حالت ۳۲ الکترون را در خود نگه دارد.
- به همین صورت با افزایش شماره پوسته، تعداد الکترونهای قرار گرفته در لایهها نیز افزایش مییابد.
در شکل زیر پوستههای مذکور به همراه ظرفیت آنها نشان داده شده است.
در ادامه نحوه محاسبه ظرفیت هر لایه را توضیح خواهیم داد.
توزیع الکترونها در پوستهها و اوربیتالها
ماکزیمم ظرفیت لایهی nام برای نگه داشتن الکترون در خود را میتوان با استفاده از فرمول 2n2 محاسبه کرد. برای نمونه بیشترین تعدادی از الکترون که میتواند در لایهی شماره ۱ قرار گیرد برابر با ۲=۱۲×۲ است.
مبتنی بر فرمول ۲n2 بیشترین تعدادی از الکترون که میتواند در پوسته شماره ۲ قرار گیرد نیز برابر با ۸=۲۲×۲ است.
محدودیتهای مدل اتمی بور
مدل اتمی بور دارای محدودیتهایی است. در زیر مهمترین این محدودیتها ذکر شدهاند.
- این مدل قادر به توجیه «اثر زیمان» (Zeeman Effect) نیست (اثر زیمان تاثیر میدان مغناطیسی بر طیف اتمی عناطر را بیان میکند).
- این مدل اصل عدم قطعیت هایزنبرگ را نقض میکند.
- مدل اتمی بور نمیتواند طیف اتمهای بزرگتر را توضیح دهد.
مثال
بیشترین تعداد الکترونی که میتواند در لایه O یک الکترون قرار گیرد، چند است؟
در بالا بیان کردیم که لایه اول، دوم، سوم و ... را با نماد M,L,K و ... نشان میدهیم. بنابراین n مربوط به لایه O برابر با ۵ است. در نتیجه با توجه به فرمول 2n2 تعداد الکترونی که میتواند در این لایه قرار گیرد برابر است با:
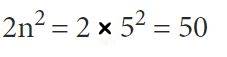
در بخشی جداگانه به بررسی بیشتر اوربیتالهای اتمی و نحوه قرار گرفتن الکترونها در آن خواهیم پرداخت. همچنین در صورت علاقهمندی به مباحث مرتبط در زمینه فیزیک پایه و اتمی، آموزشهای زیر نیز به شما توصیه میشوند:













عالی بود . چقدر خوب که بدون تبلیغاته
تشکر از اینکه تبلیغاتی در بین متن نداشتید و تشکر مجدد بابت توضیحات کاملتون…
سلام ممنون از شما،الکترون انرژی جنبشی خودش رواز کجا میاره ،واینکه چرا به هسته سقوط نمیکنه البته دلیل سقوط نکردن اون رو با نیروی گریز از مرکز توجیه میکنند
ساده ، کامل ، عالی
Thank you very much
سلام و تشکر فراوان هم از اینکه با انبوه تبلیغات بی ربط و بی معنی صفحه را بی ارزش نکرده اید و هم بابت دقت خوب مطالب تخصصی ارایه شده – خیلی متشکرم
سلام آقای عوض زاده خسته نباشید ببخشید من یک سوال ازتون داشتم. میخواستم بدونم محتوایی که تولید می کنید. حاصل مطالعات شخصی شما هستن یا تو دانشگاه به نوعی یاد گرفتید یا به هر حال قسمتی از درس های دانشگاهی تون بوده؟
باسلام مطالب بسیارمفیدی درسایت داریدوبسیارقابل استفاده ممنون