عدد اتمی، عدد جرمی و ایزوتوپ — به زبان ساده
اگر با جدول تناوبی عناصر آشنا باشید، خواهید دانست که این جدول ویژگی تمامی عناصر سازنده دنیای اطرافمان را به خوبی توضیح داده است. عناصری که در ستون اول این جدول قرار گرفتهاند، شدیدا با آب واکنش میدهند. یا اینکه ستون آخر جدول، گازهایی هستند که به سختی با دیگر عناصر واکنش میدهند. اما جالب است بدانید که هریک از این عناصر نیز به دستههای مختلفی تقسیم میشوند. در حقیقت برای هر عنصر مفهومی تحت عنوان ایزوتوپ تعریف میشود. در ادامه این مفهوم را به تفصیل توضیح خواهیم داد.
همچنین ساختار هر اتم، با استفاده از دو عدد اصلی تحت عنوان عدد اتمی و عدد جرمی توصیف میشود که در ادامه این مفاهیم نیز توضیح داده خواهند شد.
ایزوتوپ
یک اتم از هستهای با چگالی بالا و الکترونهای اطرافش تشکیل شده است. این تصویری است که مدل اتمی بور برای اولین بار، آن را ترسیم کرده است. هسته اتم نیز از دو جزء اصلی نوترون و پروتون تشکیل شده است.

پروتون و نوترون را میتوان دو مولفهی مشابه از یک اتم دانست. در حقیقت تنها یک ویژگی است که این دو اِلِمان را از یکدیگر مجزا میکند. این ویژگی بار الکتریکی آنها است. پروتون ذرهای با بار مثبت و نوترون ذرهای خنثی محسوب میشود. این تفاوت در بار الکتریکی باعث میشود تا پروتون میدان مغناطیسی و میدان الکتریکی را حس کند، ولی نوترون واکنشی نسبت به آنها نداشته باشد.
الکترون نیز که جرمی بسیار کمتر از پروتون و نوترون دارد، دارای باری برابر با پروتون ولی با اندازهی منفی است. بنابراین اتمی که اندازه الکترونها و نوترونها در آن برابر باشد، بارش نیز خنثی خواهد بود. توجه داشته باشید که این تعداد الکترونهای یک اتم است که رفتار شیمیایی یک عنصر خاص را تعیین میکند.
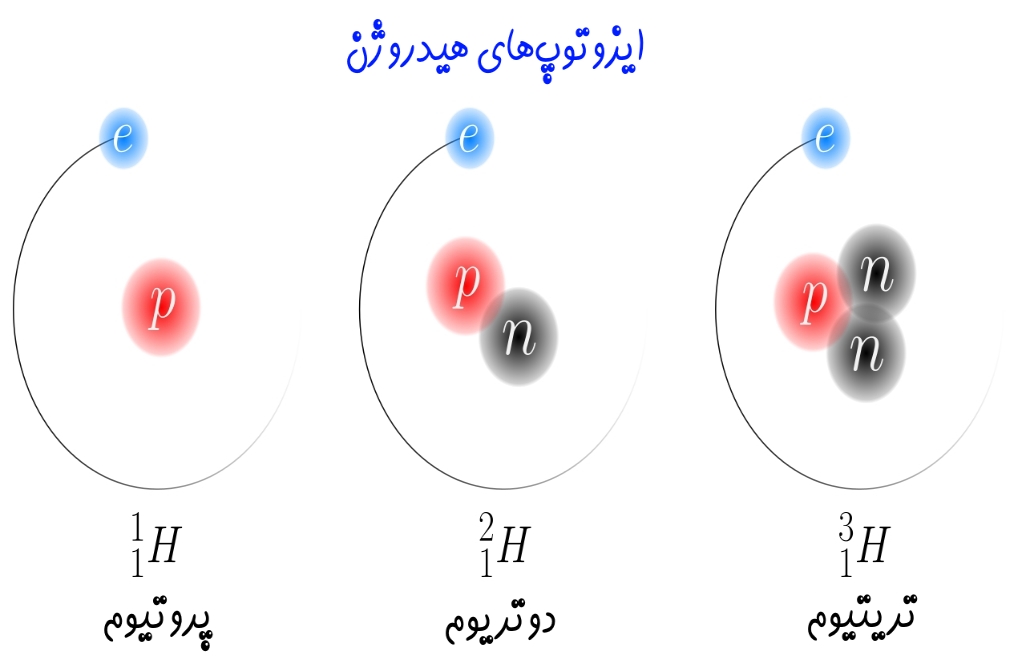
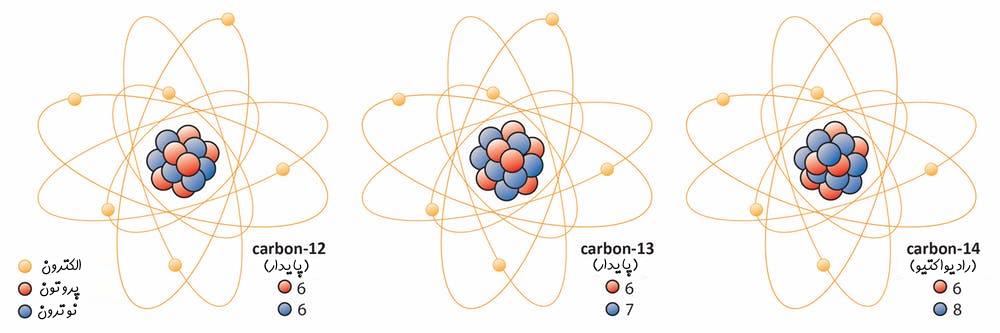
ایزوتوپهای یک عنصر دارای تعدادی برابر از پروتون بوده و تنها تعداد نوترونهای آنها با یکدیگر متفاوت است. بهمنظور بیان کردن ایزوتوپها کنار یکدیگر در ابتدا نام عنصر عنوان شده و پس از آن جرم اتمی آن را بیان میکنند. برای نمونه ایزوتوپهای کربن را در نظر بگیرید. تاکنون ۳ ایزوتوپ از کربن در طبیعت یافت شده است. کربنِ ۱۲، ۱۳ و ۱۴ ایزوتوپهای کربن هستند. اعداد بیان شده در جلوی نام کربن، بیان کننده جرم هریک از آنها است. هر ۳ این کربنها دارای تعدادی برابر از پروتون بوده ولی تعداد نوترونهای آنها متفاوت است. تعداد نوترونهای آنها به ترتیب برابر با ۶، ۷ و ۸ است.
از دیدگاه شیمیایی ویژگی هر ۳ ایزوتوپ کربن مشابه است، چرا که تعداد الکترون در آنها یکسان است. بنابراین ایزوتوپهای یک عنصر از نظر شیمیایی رفتاری یکسان دارند. جالب است بدانید برخی از عناصر با تغییر کامل به عنصری دیگر، این قانون را زیر پا میگذارند.
لازم به ذکر است درصورتیکه نیاز به مطالعه مطلب جامع و کاملی در خصوص ایزوتوپ دارید، میتوانید مطلب «ایزوتوپ چیست؟ — به زبان ساده» را مطالعه کنید.
پایداری
قابلیت تغییر ماهیت در اتمها منجر میشود تا ایزوتوپها را با ناپایداری مواجه کند. این مفهومی است که کشف آن، جایزه نوبل را در سال ۱۹۲۱ برای «فردریک سودی» (Frederick Soddy) به ارمغان آورد.
برخی از ایزوتوپها همچون کربنِ ۱۲، همواره وجود دارند و تنها در شرایطی خاص تغییر ماهیت میدهند. این در حالی است که کربن ۱۴ حالتی ناپایدار داشته و به ایزوتوپی پایدار از عنصری دیگر تبدیل میشود.
برای نمونه کربن ۱۴ با تغییر در تعداد پروتونهایش به نیتروژن ۱۴ تبدیل میشود. در این فرآیند که تحت عنوان «فروپاشی بتا» (Beta Decay) شناخته میشود، هستهی اتم امواجی از جنس الکترون و آنتی نوترون ساطع کرده و تعداد پروتونهایش افزایش مییابد. با افزایش یک پروتون در هسته، اتم تغییر ماهیت داده و به ایزوتوپی پایدار از عنصر نیتروژن تبدیل میشود. در شکل زیر شماتیکی از فرآیند فروپاشی بتا نشان داده شده است.
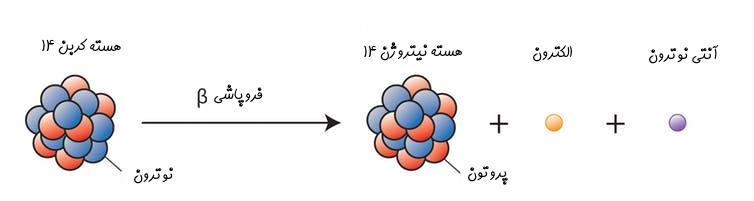
همچنین رابطه توصیف کنندهی فرآیند فروپاشی بتا در ادامه ارائه شده است.
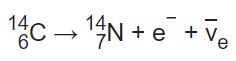
عوامل زیادی در فروپاشی هستهی یک اتم وجود دارد. یکی از مهمترینِ آنها، نسبت تعداد پروتونها به تعداد نوترونها در هسته اتم است. اگر یک هسته اتم، دارای تعداد زیادی نوترون باشد (تعریف اینکه منظور از تعداد زیاد چقدر است، وابسته به جرم هسته بوده و نمیتوان مرز مشخصی را تعریف کرد)، احتمال فروپاشی آن به سمت تبدیل شدن به ایزوتوپی پایدار، زیاد خواهد بود.
در حالتی که تعداد پروتونهای هسته نیز زیاد باشد، فرآیند فروپاشی میتواند رخ دهد. فروپاشی عاملی است که منجر به رادیوالکتیو شدن برخی از ایزوتوپهای یک عنصر میشود.
در حالت کلی حدود ۳۳۹ هسته اتمی متفاوت روی زمین وجود دارد که ۲۸۶ مورد از آنها «نوکلید دیرینه» (Primordial Nuclide) محسوب میشوند. نوکلویدها ایزوتوپهایی هستند که واپاشی آنها بسیار کند بوده به نحوی که عمر آنها از عمر زمین نیز بیشتر است. برای نمونه یکی از معروفترین ایزوتوپهای اورانیوم، $$U_{92}^{235}$$ بوده که در ساخت بمب اتم و نیروگاههای مبتنی بر انرژی هستهای کاربرد دارد.
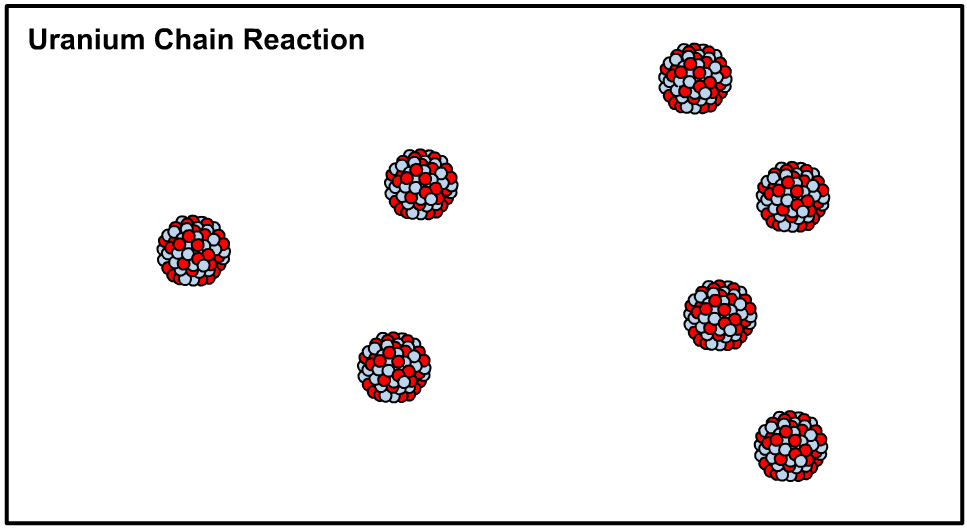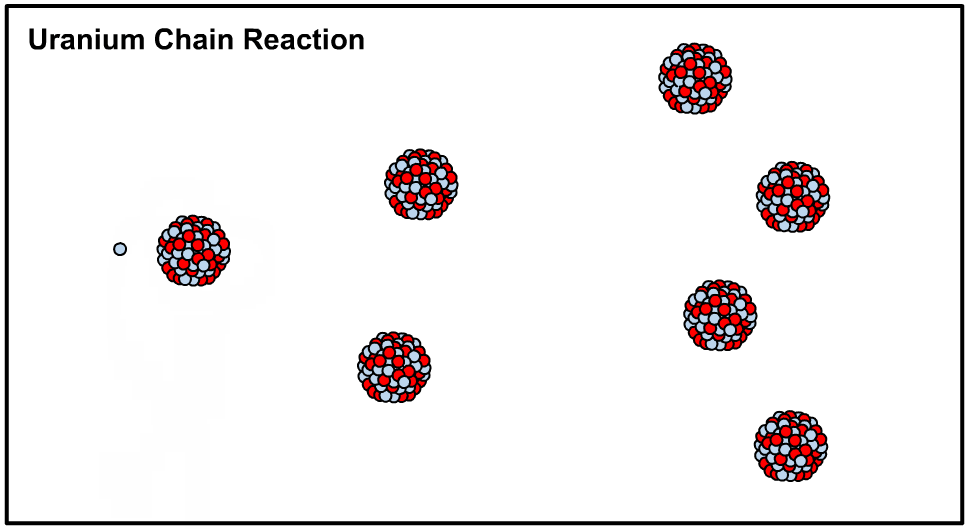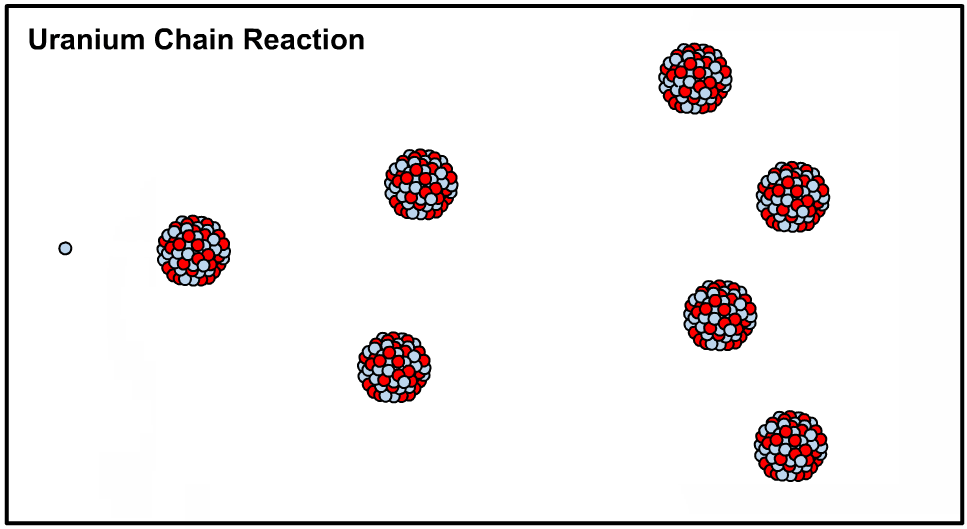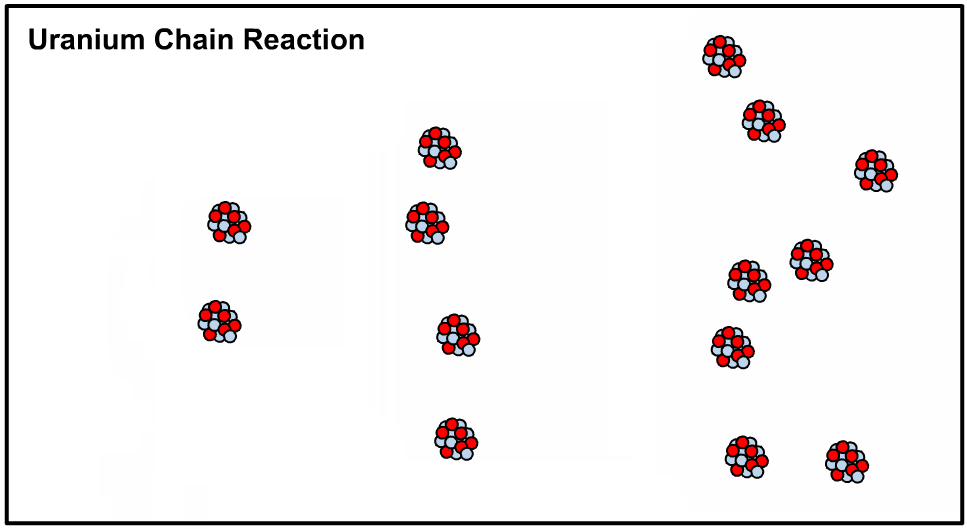
در حقیقت با اضافه کردن یک نوترون به هستهی اتم اورانیوم ۲۳۵ هسته آن ناپایدار شده و طی فرآیندی که تولید کننده انرژی است اتم شکافته میشود. در این حالت میگوییم که هسته متعلق به ایزوتوپی ناپایدار یا رادیو ایزوتوپ است. در نتیجهی شکافته شدن نوترون آزاد شده و این نوترون هستهی دیگری را میشکافد. اصطلاحا به نوع از فرآیند، واکنش زنجیرهای گفته میشود که در نتیجهی آن میلیونها هسته اورانیوم ۲۳۵ شکافته شده و انرژی بسیاری تولید میشود. در ادامه انیمیشن شکافت هستهای رخ داده در اورانیوم ۲۳۵ نشان داده شده است.
نماد استفاده شده برای اتم
معمولا هسته هر اتم را با استفاده از دو عدد توصیف میکنند. عدد اتمی که معیاری از پروتونها و عدد جرمی که با استفاده از آن میتوان میان ایزوتوپها تمایز قائل شد.
عدد اتمی
عدد اتمی نشان دهنده تعداد پروتونهای یک اتم است. با توجه به این تعریف، برای یک اتم خنثی میتوان عدد اتمی را برابر با تعداد الکترونها نیز در نظر گرفت؛ چرا که تعداد الکترونها و پروتونها در یک اتم خثنی با یکدیگر برابر است. بنابراین برای یک اتم خنثی میتوان گفت:
تعداد الکترونها = تعداد پروتونها = عدد اتمی
معمولا عدد اتمی را در سمت چپ و پایین عنصر نمایش میدهند. البته در ادامه نحوه نشان دادن اتم و اعداد آن را نشان خواهیم داد. توجه داشته باشید که در اکثر متون علمی، عدد اتمی را با نماد Z نمایش میدهند.
عدد جرمی
عدد جرمی معیاری از میزان جرم اتم است. با توجه به اینکه بخش بسیاری از جرم یک اتم در هسته آن قرار گرفته، بنابراین مجموع جرم نوترون و پروتون به عنوان عدد جرمی در نظر گرفته میشود. بنابراین میتوان گفت:
تعداد نوترونها + تعداد پروتونها = عدد جرمی
در بسیاری از موارد عدد جرمی با نماد A نشان داده میشود.
بار الکتریکی
یک اتم میتواند الکترون گرفته یا از دست بدهد. با توجه به این که بار یک اتم با استفاده از برآیند بار الکترونها و پروتونها تعیین میشود، لذا با تغییر تعداد الکترونها بار اتم نیز تغییر کرده و در سمت راست و بالای اتم نوشته میشود.
برای بدست آوردن بار الکتریکی یک اتم تعداد پروتونها از تعداد الکترونها کم میشود. در این صورت اگر تعداد الکترونهای یک اتم کم شود، بار اتم مثبت و اگر الکترونهای اتم افزایش یابد، بار اتم منفی خواهد شد. در نتیجه رابطه زیر در مورد بار یک اتم برقرار است.
تعداد الکترونها - تعداد پروتونها = بار اتم
توجه داشته باشید که اتم غیر خنثی معمولا با نام یون شناخته میشود. با توجه به سه عدد معرفی شده در بالا، مشخصات یک اتم را به صورت زیر نمایش میدهند.

برای نمونه با توجه به نماد زیر، عدد اتمی و عدد جرمی اتم مس به ترتیب برابر با ۲۹ و ۶۳ است. با توجه به این که اتم مذکور در حالت خنثی بوده بنابراین بار الکتریکی آن نیز برابر با صفر است.
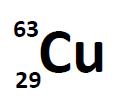
جرم اتمی میانگین
تا این جا مفاهیم عدد جرمی، عدد اتمی و ایزوتوپ بیان شدند. اگر توجه فرموده باشید، متوجه خواهید شد که عدد جرمی بایستی دو برابر عدد اتمی باشد، چراکه تعداد پروتونها و نوترونهای یک اتم در حالت پایدار معمولا برابر است. اگر به جدول تناوبی عناصر نگاه کنید خواهید فهمید که چنین بیانی برای اکثر عناصر صحیح نیست. برای نمونه عدد اتمی لیتیوم برابر با ۳ و عدد جرمی آن برابر با ۶.۹۴۱ است. به راستی چرا عدد جرمی دو برابر عدد اتمی نشده است؟
پاسخ در مفهوم ایزوتوپ است. همانطور که در ابتدای این مطلب نیز عنوان شد، یک اتم ممکن دارای چندین ایزوتوپ باشد. هریک از این ایزوتوپها دارای تعداد نوترونهای متفاوتی بوده و بنابراین عدد جرمی هریک از آنها نیز متفاوت است.
برای بیان جرم یک اتم از مفهوم «جرم اتمی میانگین» (Average Atomic Mass) استفاده میکنند. در این روش درصد هر ایزوتوپ موجود در طبیعت در عدد جرمی آن ایزوتوپ ضرب میشود.
مثال ۱
جرم اتمی میانگین اتم لیتیوم را بیابید. فرض کنید ۷۰ درصد لیتیوم موجود در طبیعت دارای عدد جرمی ۵ و مابقی دارای عدد جرمی ۸ باشد.
با توجه به صورت سوال لیتیوم دارای دو ایزوتوپ با اعداد جرمی ۵ و ۸ است. از طرفی از هر ۱۰۰ عدد اتم لیتیوم در طبیعت، ۷۰ مورد دارای عدد جرمی ۵ و ۳۰ مورد دیگر دارای عدد جرمی ۸ است. برای بدست آوردن جرم اتمی میانگین، درصد فراوانی هر ایزوتوپ را در عدد جرمی مرتبط با آن ضرب کنید و مقادیر بدست آمده را با یکدیگر جمع کنید. در ادامه جرم اتمی میانگین اتم لیتیوم محاسبه شده است.
توجه داشته باشید که عدد موجود در جدول تناوبی، بر حسب مول/گرم بیان میشود. به این واحد جرم مولی نیز گفته میشود.
مثال ۲
فرض کنید کربن از دو ایزوتوپ با اعداد جرمی ۱۳.003 و ۱۲ تشکیل شده باشد. همچنین درصد هریک از این ایزوتوپها را برابر با اعداد زیر در نظر بگیرید. با این فرضیات جرم اتمی میانگین کل کربنهای موجود در طبیعت را بدست آورید.
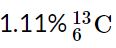

بنابراین درصد کربن ۱۲ برابر با ۹۸.۸۹ درصد و درصد کربن ۱۳.۰۰۳ برابر با ۱.۱۱ درصد است. با این فرض جرم اتمی میانگین اتم کربن برابر خواهد بود با:
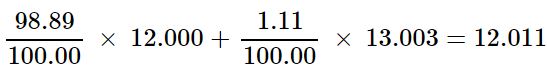
توجه داشته باشید که حاصل جمع ضرایب ایزوتوپها بایستی برابر با ۱ شود. اگر توجه فرمایید در هر دو مثال حاصل جمع مذکور برابر با ۱ است. در مواردی نیز میتوان با استفاده از عدد اتمی و عدد جرمی، تعداد نوترونهای موجود در یک ایزوتوپ را بدست آورد. در حقیقت تعداد نوترونها را میتوان با استفاده از رابطه زیر بدست آورد.
تعداد پروتونها - عدد جرمی = تعداد نوترونها
برای نمونه در زیر تعداد نوترونهای ایزوتوپهای اکسیژن بیان شدهاند.
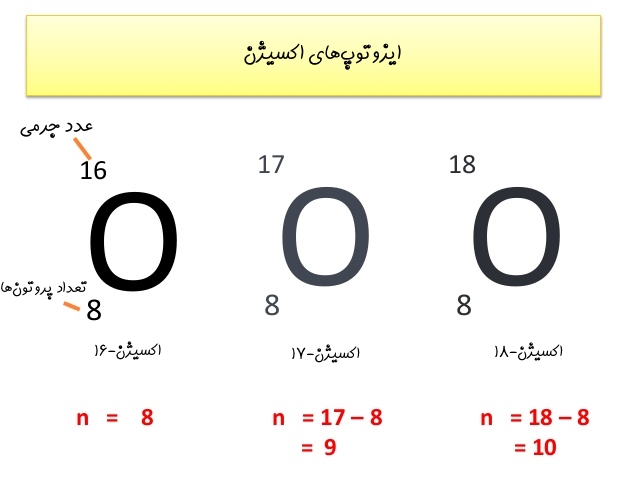
در صورت علاقهمندی به مباحث مرتبط در زمینه فیزیک و شیمی، آموزشهای زیر نیز به شما پیشنهاد میشوند:











جواب سوال منو بدید لطفا
ایزوتوپی از عنصر m دارای عدد جرمی ۲۰۸ است
اگر۶۲.۵درصد ذرات سازنده ی هسته آن نوترون تشکیل دهد
نسبت تعداد الکترون هاm به توان مثبت² به تعدادنوترون ان تقریبا چند است
۴۶.۸
ی سوال میتونیم با عدد اتمی و عدد جرمی نام ی اتم را مشخص کنیم ؟
با سلام؛
بله اصول مشخص شدن عناصر در جدول تناوبی نیز بر اساس عدد اتمی آنها است.
از همراهی شما با مجله فرادرس سپاسگزاریم
باسلام و ارادت،محتوا شما باعث انرژی خوبی در یادگیری بنده شد،اما در فیلم”آموزشی نمادهای استفاده شده برای اتم”شما در قسمت بارالکتریکی نیاز به اصلاح دارد لطفا برای یادگیری بهتر دوستان تصحیح گردد.
باسلام وخسته نباشیدعدد اتمی وعددجرمی بدون تغییر درهویت عنصر می توانند متفاوت باشندیاتغییر کنند???
چطور میشه با استفاده از الکترون و نوترون ، پروتون رو بدست بیارم؟
با سلام؛
از همراهی شما با مجله فرادرس سپاسگزازیم. نوع یک عنصر را عدد اتمی آن تعیین میکند اما عناصری وجود دارند که عدد اتمی یکسانی دارند اما عدد جرمی در آنها متفاوت است که این مورد با مفهوم «ایزوتوپ» بیان شده است. برای درک بیشتر این مفاهیم پیشنهاد میکنیم مطالب زیر را مطالعه کنید. چ
«عدد اتمی چیست ؟ — از صفر تا صد»
«ایزوتوپ چیست؟ — به زبان ساده»
با تشکر
داداش دستت درد نکنه والا مونده بودم خیلی بدردم خورد دستت درد نکنه
سلام وقت بخیر
اگه در محاسبه عدداتمی میانگین درصد فراوانی را به صورت تعدادی از کل یک مقدار مشخص به ما بدهند آیا باید در صد آن را حساب کنیم یا تعداد معین را تقسیم بر تعداد کل کنیم وسوال دوم اگه مانند نمونه داده شده ۱۱.۱۱را به ما بدهند باید در صد درآن حساب کنیم ؟ سپاس
سوال:عنصرAدارای سه ایزوتوپ با جرمهای اتمی ۸۴و۸۶و۸۸ میباشد اگر درصد فراوانی سبکترین ایزوتوپ آن ۲۰ درصد و جرم اتمی میانگین Aبرابربا. 26/4amu باشد درصد فراوانی دو ایزوتوپ دیگر را بدست آورید؟؟؟همراه با روش
n+p=46
+ (دستگاه)
n-p=4
————–
2n=50
n=25
p=21
این مساله رو باید با دستگاه حل کنی.
عالی بود خیلی به دردم خورد ممنون
ماهیت یک عنصر رو چه چیزی تعیین می کنه؟
با سلام؛
از شما به دلیل همراهی با مجله فرادرس سپاسگزاریم.
در حقیقت، دانشمندان همواره در تلاش برای پاسخ به این سوال هستند و این تلاش سبب توسعه جدول تناوبی شد. پس در ابتدا، این عدد اتمی و جایگاه آن در جدول تناوبی است که ماهیت یک عنصر را تعیین میکند. در مرحله بعد، با توجه به شعاعهای اتمی و اوربیتالها و الکترونهای آزاد و الکترونگاتیوی، خواص فلزی، شبهفلزی و نافلزی عناصر مشخص میشوند. علاوه بر این، وجود آلوتروپهای مختلف از یک عنصر، مشخصههای مختلفی را برای آن بوجود میآورد. همچنین، رفتار اتمها در میدان مغناطیسی نیز از جمله موارد دیگری است که ماهیت یک عنصر یا به عبارت بهتر، یک اتم را مشخص میکند که این امر به کمک علم طیفسنجی جرمی امکانپذیر است.
در نهایت، با مطالعه موارد گفته شده و توسعه سایر روشهای تشخیصی به ماهیت یک عنصر یا اتم پی میبریم. البته دانشمندان، از این مرحله نیز عبور کردهاند و با بررسی پاد ماده، مشخصههای دیگری را برای هر ذره و پاد ذره آن تعریف کردهاند که این علم در مطالعه ذرات بنیادی جای دارد.
با مطالعه بسیاری از مطالب مجله فرادرس، با این عوامل آشنا خواهید شد.
با تشکر
اگه میشه اینو حل کنین
عدد جرمی اتمی 46 و اختلاف نوترون ها و پروتون ها آن 4 است عدد اتمی را بدست اورید
خب فرمول داره
عدد اتمی=عدد جرمی_ (نوترون_پروتون)تقسیم بر ۲
میگیم ۴۶ رو منهای اختلافشون میکنیم میشه ۴۲.بعد میام ۴۲ رو تقسیم بر ۲ میکنیم که میشه ۲۱ پس عدد اتمی ما ۲۱ هستش
بسیار عالی مواردی رو که توی کتاب درسی یاد نگرفته بودیم رو از این مقاله یاد گرفتیم خدا خیرتون بده
عدداتمی گوگرد ۱۶ است بار الکتریکی هسته و اتم خنثی چند است
عالی توضیح دادی تو کتاب هشتم اصلا خوب توضیح نداده ولی با خوندن این مقاله کاملا متوجه شدم مرسی???
با سلام
عدد اتمی به ما داده بیشتری میدهد یا عدد جرمی ؟ چرا ؟
ساده و خوب توضیح دادید.راستی لطفا یه نگاه بکنید به پاراگراف دوم بخش بار الکتریکی همون جا که نوشته”اگر تعداد الکترون های یک اتم کم شود…” فکر می کنم یه غلط تایپی داشته باشه.
با سلام؛
از توجه شما سپاسگزاریم.
متن اصلاح شد.
با تشکر
سلام.
سوال گفته:
با توجه به این داده مقدار های نوترون و پروتون و الکترون و عدد اتمی این عنصر را بدست اورید.
74
Ge
با سلام
میتونید نشانی ایمیلتون رو بگذارید
چون ارتباط از اون طریق برای من راحت تره و میتونم سوالهام رو یکی پس از دیگری بپرسم
خیلی ممنون میشم
لطفا اگه کسی میتونه جواب این سوال برای من بگه :
در اتم xدارای عدد اتمی ۴۸ تفاوت پروتون ونوترون ۴ باشد ، عدد اتمی این عنصر چقدر است ؟
لطفا با راه حل بگید.
داداش عدد اتمی رو تو روی سوال داده دیگه
فرمول داره
z=A-(N-P)/2
پس میشه 48-4=44
44/2=22
فکر میکنم توی نوشتن سوال اشتباه تایپی داشتی ؛ چون عدد جرمی رو داده احتمالا عدد اتمی رو میخواسته
22 هم میشه عدد اتمی
52.
واقعا معرکه بود
خیلی عالی توضیح دادید و با یکبار خوندن هم مطلبو گرفتم هم کلی لذت بردم. ممنون
نحوه نشون دادن عدد اتمی رو نگفت
پایین سمت چپ نوشته میشه
عدد جرمی چون پروتون و نوترون روبهنشان میده چن هراتم 3 عنصر داره اگه تو یه جاشبگین 2 دوتاش رو میخوایا 1 اش کدومو میگی میگی 2 دو تا رو و این دوتا تویه عدد جرمی هستند جواب درست اینه اگهحالا نفهمدی میتونی بریتو سایت هاسوال کنی همن اینترنتم داره
با سلام و درود؛ نحوه بیان عدد اتمی، جرمی، نماد عنصر و همچنین بار یون در قسمت بارالکتریکی توضیح داده شده است.
فکر نکنم سایت های دیگه بتونن مثل این سایت توضیح بدن.موفق باشید.
عالی بود کاشکی به شکل فیلم هم بود توضیحی