شیمی فیزیک چیست؟ – به زبان ساده + مثال و تمرین
اگر به علم شیمی علاقهمند هستید، حتما عبارت «شیمیفیزیک» (Physical Chemistry) را تا به حال شنیدهاید. برخلاف دیگر شاخههای علم شیمی، در شیمیفیزیک با تمرکز روی قوانین فیزیکی حاکم بر واکنشهای شیمیایی (برای مثال قانون گازهای ایدهآل)، تلاش میشود تا جنبههای کمی واکنشهای شیمیایی مختلف اندازهگیری، جمعبندی و توضیح داده شود. در این مطلب از مجله فرادرس پس از اینکه توضیح دادیم شیمی فیزیک چیست، ابتدا بهطور مختصر در مورد تاریخچه آن صحبت میکنیم. سپس به معرفی و بررسی اصول و مفاهیم پایه در شیمیفیزیک مانند ساختار اتمی، مقدار ماده، پیوندها، انرژی و ترمودینامیک، سینتیک، تعادل، اکسایش کاهش و اسیدها و بازها خواهیم پرداخت و حل چند مثال و تمرین را نیز بررسی میکنیم. در انتها با زیرشاخههای شیمیفیزیک شامل الکتروشیمی، فتوشیمی و شیمی سطح آشنا خواهیم شد.
- یاد خواهید گرفت که چگونه شیمیفیزیک رفتار مواد را توضیح میدهد.
- اصول و مفاهیم پایه شیمیفیزیک مانند ساختار اتمها را میآموزید.
- اجزای هسته اتم و تفاوت عنصرها با ترکیبها را میشناسید.
- با انواع پیوندها و نیروهای بینذرهای آشنا میشوید.
- سینتیک واکنشها و عوامل موثر بر سرعت را یاد میگیرید.
- روشهای تعیین تعادل شیمیایی و اصل لوشاتلیه را میآموزید.


شیمی فیزیک چیست؟
شیمیفیزیک، شاخهای از علم شیمی است که با استفاده از قوانین و مفاهیم فیزیکی مانند حرکت، انرژی، نیرو، زمان، ترمودینامیک، مکانیک کوانتومی و مکانیک آماری، واکنشهای شیمیایی را توضیح میدهد. این بخش از شیمی شامل موضوعاتی نظیر ساختار اتمی، پیوندها و نرخ واکنش است و با دقیق شدن در سطح ماده، به سوالات زیر پاسخ میدهد:
- ماده در سطوح مولکولی و اتمی چگونه رفتار میکند؟
- واکنشهای شیمیایی چگونه رخ میدهند؟

فهرست موضوعات شیمی فیزیک
در این بخش ابتدا بهصورت خلاصه بیان میکنیم که عنوان مباحث مورد بررسی در شیمی فیزیک چیست و سپس در بخشهای بعد به توضیح هر کدام خواهیم پرداخت. موضوعات شیمیفیزیک عبارتاند از:
- ساختار اتمی
- مقدار ماده
- پیوندها
- انرژی و ترمودینامیک
- سینتیک و معادلات سرعت
- تعادل
- اکسایش کاهش
- اسیدها و بازها
مطالعه موضوعات مختلف شیمیفیزیک، اطلاعات متنوعی در اختیار ما قرار میدهد. برای مثال، پس از مطالعه ساختار اتم، قادر خواهیم بود شکل مولکولها را پیشبینی کنیم. همچنین شیمیفیزیک با معرفی مفهومی به نام «مول» (Mole) به ما کمک می کند تا یک واحد هماهنگ برای اندازهگیری اتمها و مولکولها یا مقدار ماده داشته باشیم. مطالعه مبحث پیوندها در شیمیفیزیک، به ما نشان میدهد که چگونه الکترونهای اتمهای مختلف پیوندها و در نتیجه ساختارهایی با خواص متفاوت را میسازند.
همچنین پس از کسب اطلاعات لازم راجعبه مفهوم انرژی و ترمودینامیک، تغییرات انرژی در واکنشهای شیمیایی را میتوانیم محاسبه کنیم. به علاوه، میتوانیم نرخ واکنشهای شیمیایی را پیشبینی کرده و تغییر دهیم و به این ترتیب، واکنشهای مختلف را جهت کاربرد در صنایع مختلف بهینه کنیم. در نهایت مطالعه تعادل در واکنشهای شیمیایی در کنار مبحث اکسایش کاهش، به ما کمک میکند تا بتوانیم ابزاری مانند «پیل الکتروشیمیایی» (Electrochemical Cell) بسازیم.

خیلی از شاخههای علم شیمی مانند «بیوشیمی» (Biochemistry)، «شیمی آلی» (Organic Chemistry) و «شیمی پلیمر» (Polymer Chemistry) روی گروههای خاصی از مواد که دارای ویژگیهای ساختاری و شیمیایی تقریبا مشترکی هستند، تمرکز دارند. از طرف دیگر، موضوع برخی دیگر از شاخههای علم شیمی گروه خاصی از مواد نیست و به بررسی فعل و انفعالات و تحولات در تمام گروههای مواد میپردازند. در همین زمینه، یکی از قدیمیترین شاخههای علم شیمی، شیمیفیزیک است که مطالعات در آن به جستجو، اندازهگیری و توضیح جنبههای کمی فرآیندهای شیمیایی اختصاص دارد.
پیشنیازهای شیمیفیزیک برای دانشآموزان با فرادرس
در بخش اول آموختید شیمی فیزیک چیست. پیش از اینکه به توضیحات بیشتر در این زمینه بپردازیم، در این بخش قصد داریم چند دوره آموزشی از مجموعه فرادرس را به دانشآموزانی معرفی کنیم که تمایل دارند در آینده وارد این شاخه یا بهطور کلی، وارد رشته شیمی شوند. همانطور که توضیح دادیم، در شیمیفیزیک مبنای کار استفاده از قوانین و اصول فیزیکی برای توضیح پدیدههای شیمیایی است.
بنابراین برای اینکه بتوانید در این شاخه از علم شیمی پیشرفت کنید، علاوه بر شیمی قوی لازم است پایه فیزیک خیلی خوبی نیز داشته باشید و مشاهده فیلمهای آموزشی زیر از مجموعه فرادرس میتواند به شما کمک کند:
- فیلم آموزش شیمی دبیرستان – نکته و حل تست کنکور فرادرس
- فیلم آموزش شیمی پایه دهم فرادرس
- فیلم آموزش فیزیک پایه دهم فرادرس
- فیلم آموزش فیزیک پایه دهم مرور و حل تمرین فرادرس
- فیلم آموزش رایگان الکتروشیمی در شیمی پایه دوازدهم فرادرس
- فیلم آموزش شیمی پایه دوازدهم فرادرس
اصول و مفاهیم پایه در شیمیفیزیک
برای اینکه بهتر یاد بگیریم شیمی فیزیک چیست، باید به مفاهیم پایه آن مسلط شویم. اما پیش از آن بهتر است به این نکته اشاره کنیم که فرادرس، یک دوره آموزشی جامع را با عنوان «فیلم آموزشی شیمی دبیرستان – نکته و حل تست کنکور» تهیه کرده است که میتواند مسیر یادگیری فرمولهای شیمی و تسلط شما بر حل مسائل مرتبط با این فرمولها را هموار کند. لینک مشاهده این فیلم آموزشی در ادامه آورده شده است:
در شیمیفیزیک، موضوعات مختلفی مطالعه میشوند، از مطالعه ساختار اتمی و کسب اطلاعات بیشتر در مورد ذرات داخل اتم گرفته تا سینتیک و مطالعه چگونگی رخ دادن برهمکنشها و در نتیجه نحوه دستکاری آنها با توجه به هدفی که مدنظر داریم. موضوعات دیگر شامل اسیدها و بازها، مقدار ماده و تعادل است. در ادامه چند مورد از مهمترین مباحث و مفاهیم کلیدی شیمیفیزیک را بهطور مختصر توضیح میدهیم تا بهتر متوجه شوید کدام تعاریف و توضیحات علم شیمی به بخش شیمیفیزیک مربوط میشوند. همچنین با حل مثال و ارائه تمرین در برخی مباحث به شما کمک میکنیم تا تسلط بهتری در این زمینه کسب کنید.
ساختار اتمی
میخواهیم ببینیم مفهوم ساختار اتمی در شیمی فیزیک چیست. اتم کوچکترین واحد سازنده مواد محسوب میشود، طوری که نمیتوان آن را توسط هیچ نوع واکنش شیمیایی به واحدهای کوچکتری شکست. این ذرات به قدری کوچکاند که قابل مشاهده با چشم انسان نیستند. فرض کنید توانایی این را دارید که یک اتم را باز کنید و داخل آن را تماشا کنید. در این صورت در مرکز آن، جرمی با چگالی بالا را میبینید که «هسته» (Nucleus) نامیده میشود. تصور کنید شش میلیون ماشین له شده را به شکل تودهای با عرض، طول و عمقی برابر با ۳۰ cm فشرده کردهایم. وقتی میگوییم هسته اتم دارای چگالی بسیار بالایی است، منظورمان چنین چیزی است.

اجزای هسته اتم چیست؟
هسته اتم شامل اجزایی به نام «پروتون» (Proton) و «نوترون» (Neutron) است. پروتونها دارای بار مثبت هستند، در حالی که نوترونها ذراتی بدون بار یا خنثی محسوب میشوند. دانشمندان علاقهمند هستند این دو عضو هسته را ذره بنامند، اما در حقیقت این اجزا در طول زمان مانند موج رفتار میکنند. بهترین تصوری که میتوانیم از این اجزا داشته باشیم، بهصورت چیزی شبیه به چرخش فرفره در مسیرهای دایرهای شکلی به نام مدار حول هسته است. شاید این چیدمان شلوغ بنظر برسد، اما واقعیت این است که بیشتر فضای اتم خالی است. اگر اتم را یک کلیسا در نظر بگیرید، اندازه هسته در این کلیسا معادل ابعاد یک مگس است!
متوجه شدیم هسته اتم از چه اجزایی با چه ابعادی ساخته شده است. اما رفتار اتمها تا حد زیادی به خصوصیات هسته بستگی ندارد، بلکه اجزای دیگری به نام «الکترونها» (Electrons) تعیینکننده رفتار اتمها و در نتیجه خواص ماده هستند. در واقع تمام برهمکنشها شامل حرکت الکترونها و درباره آنها هستند. حرکت الکترونها ممکن است از یک اتم به اتم دیگر یا از یک اتم به یک سیستم نامتمرکز باشد. در سیستمهای نامتمرکز الکترونها به اتم خاصی تعلق ندارند.
چرا خواص ماده به الکترونهای اتمهای سازنده آن وابسته است؟
چون هر چه اتمهای سازنده یک ماده راحتتر الکترون از دست بدهد یا الکترون بهدست آورد، احتمال برهمکنش آن ماده با سایر مواد بیشتر است.پاین برهمکنش اتمها است که موجب تشکیل انواع مختلفی از مولکولها و ساختارها میشود، از سادهترین مولکولهای دو اتمی تا شبکههای وسیع. حالا ممکن است این سوالات مطرح شوند که چرا اتمها الکترون میگیرند یا الکترون از دست میدهند؟ چرا پروتونهای داخل اتم مانند الکترونها حرکت نمیکنند؟ چه عاملی باعث کنار هم قرار گرفتن اجزای اتم میشود؟ چرا برخی از مواد خیلی سریع برهمکنش دارند، در حالی که برخی دیگر اصلا ممکن است واکنشی ندهند؟
پاسخدهی به تمام سوالات بالا در حوزه مطالعاتی شیمیفیزیک قرار میگیرد. شیمیفیزیک شاخهای از علم شیمی است که بررسی میکند چگونه مواد در سطوح اتمی یا مولکولی رفتار میکنند. در علومی مانند زیستشناسی موضوع بررسی و مطالعه این است که کل ارگانیسمها شامل بافتها، ارگانها و برهمکنش آنها با محیط چگونه کار میکنند. در فیزیک، مطالعات حول موضوعاتی مانند ماده، نیروها و انرژی است. عملکرد شیمیفیزیک ترکیبی از این دو نوع مطالعه است، به این معنا که در این شاخه تلاش میشود توضیح واضحی در مورد این مسئله داده شود که چگونه قوانین فیزیک حاکم بر جهان ما باعث میشوند اتمها و مولکولها رفتار خاصی نشان دهند یا با هم برهمکنش کنند تا ساختارهایی مانند مغز یا قلب ساخته شود.

تفاوت عنصر با ترکیب چیست؟
علاوه بر اتم، برخی کلمات دیگر هم هستند که دانستن معنا و مفهوم آنها جز ضروریات شیمیفیزیک است. برای نمونه، «عنصر» (Element)، «مولکول» (Molecule)، «ترکیب» (Compound) و «گونه» (Specie). یک عنصر عبارت است از ماده خالصی که فقط شامل اتمهایی است که دارای تعداد یکسانی پروتون در هسته خود هستند. به عبارت دیگر، اتمهای سازنده یک عنصر همگی داراری عدد اتمی برابر هستند. مثلا تمام اتمهای عنصر کربن (C) در هسته خود دقیقا شش پروتون دارند، نه بیشتر و نه کمتر. اگر بین دو اتم پیوند شیمیایی برقرار شود، یک مولکول تشکیل میشود. هر مولکول ممکن است از دو یا چندین اتم که به صورت شیمیایی با هم پیوند برقرار کردهاند، ساخته شود.
مولکولهایی که کنار هم قرار گرفتن عناصر مختلف ایجاد شدهاند، ترکیب نامیده میشوند. به زبان سادهتر، یک ترکیب از برقراری پیوند شیمیایی بین دو یا تعداد بیشتری از اتمهای عناصر مختلف ساخته میشود. در شیمی، اغلب کلمه گونه در مورد گروهی از اجزای یکسان بکار میرود. این گروه ممکن است متشکل از اتمها، یونها، مولکولها یا ذرات باشد.

«جدول تناوبی» (Periodic Table)، یکی از مهمترین ابزارهای شیمیفیزیک است که نشان میدهد چگونه عناصر مختلف بر اساس تعداد پروتونها و خواصشان در کنار هم چیده میشوند. معمولا ستونهای این جدول را گروه مینامیم. پس یکی دیگر از مهمترین بخشها در شیمیفیزیک، مطالعه ساختار اتمی است. پس از اینکه با اجزای زیراتمی آشنا شدید، با بررسی ساختار اتمی یاد خواهید گرفت که این اجزا چگونه در داخل اتم چیده میشوند. همچنین به کاویدن در این زمینه میپردازید که چگونه با تغییر دادن تعداد این اجزا میتوان اتم را تغییر داد و در نتیجه با مفاهیم جدیدی مانند یون، ایزوتوپ و انرژی یونیزاسیون آشنا خواهید شد.
یک یون عبارت است از اتمی که به ذره باردار دیگری، یک الکترون داده است یا از آن یک الکترون دریافت کرده است. ایزوتوپها اتمهایی عناصر یکسانی هستند که تعداد نوترونهای مختلفی دارند. برای نمونه، اگر بخواهیم بدانیم فرق بین اتم هیدروژن و اتم هلیم چیست، به دانستن این مفاهیم نیاز داریم. یا برای پاسخ دادن به این سوال که چگونه میتوان این دو نوع اتم را از هم تفکیک کرد؟
مقدار ماده
در دومین بخش بررسی میکنیم مفهوم مقدار ماده در شیمی فیزیک چیست و شامل چه مباحثی میشود. به محض اینکه در مورد اتمها و عناصر و تعاریف آنها اطلاعاتی کسب کردید، میتوانید مطالعه چگونگی برهمکنش این اجزا را شروع کنید. اما پیش از آن، لازم است اصول پایه حاکم بر انواع واکنشها را بدانید و اینکه شیمیدانها چگونه با آنها کار میکنند. یکی از اولین و سادهترین مفاهیم در این بخش، مفهوم «چگالی» (Density) است. چگالی به معنای جرم واحد حجم یک ماده است و با فرمول زیر نشان داده میشود:

که در آن ρ چگالی ماده بر حسب کیلوگرم بر متر مکعب (kg/m3)، m جرم بر حسب کیلوگرم (kg) و V حجم ماده بر حسب متر مکعب (m3) است. برای مثال در شکل بالا مشاهده میکنید که با ثابت ماندن حجم و افزایش جرم ذرات، چگالی افزایش یافته است. در ادامه این بخش، موضوعاتی مانند جرم مولکولی، فرمولهای تجربی و مول توضیح داده میشوند. جرم مولکولی برابر است با مجموع جرم اتمی تمام اتمهای سازنده یک مولکول. یک مول بیانگر مقدار مشخصی از اتمها یا مولکولها است. استفاده از مفهومی به نام مول باعث میشود کار کردن با معادلات حاکم بر واکنشها خیلی آسانتر شود.
برای مثال اگر در مورد مقادیر جرم یک نمونه و فرمول شیمیایی آن اطلاعاتی داشته باشیم، نه تنها میتوانیم تشخیص دهیم این نمونه شامل چند مول ماده است، بلکه میتوانیم پیشبینی کنیم در یک واکنش شیمیایی چند مول محصول تولید خواهد شد. البته ممکن است در یک واکنش، آن مقدار محصولی که پیشبینی کرده بودیم تولید نشود. در این صورت چنین واکنشی دارای درصد بازدهی پایینی است و یکی دیگر از مباحثی که در مطالعه مقدار ماده میآموزید، محاسبه همین درصد بازدهی در یک واکنش شیمیایی است و اینکه چرا در برخی مواقع کم میشود. در امورد مبحث این بخش، مطالعه مطلب «جرم مولی و نحوه محاسبه آن — به زبان ساده» از مجله فرادرس میتواند مفید باشد.
پیوندها
آموختیم دو جنبه مهم شیمی فیزیک چیست و گفتیم که واکنش اتمها نتیجه حرکت الکترونهای آنها است. اتمها همواره تمایل دارند در پایدارترین حالت ممکن قرار داشته باشند. به همین علت الکترون از دست میدهند یا الکترون دریافت میکنند تا با این روش به پایداری بیشتری برسند. در حقیقت اگر تعداد زیاد الکترونها در اتم باعث ناپایداری آن شده است، اتم سعی میکند الکترونهای اضافی را تا حد امکان از دست بدهد و در مقابل، اگر کافی نبودن تعداد الکترونها موجب ناپایداری اتم شود، اتم با گرفتن الکترون سعی میکند این کمبود را جبران کند.

در مبحث پیوندها، روشهایی را مطالعه میکنید که توسط آن، اتمها میتوانند الکترونهای خود را منتقل کنند. برای نمونه ممکن است اتمی الکترونهای خود را به اتم دیگر منتقل کند (پیوند یونی) یا ممکن است دو اتم الکترونهای خود را با هم به اشتراک بگذارند (پیوند کووالانسی). در واقع پیوندها بر اساس همین الکترونهای در حال حرکت شکل میگیرند. در مبحث پیوندها با انواع پیوندهای بین اتمی آشنا میشوید. همچنین مفهوم مهمی به نام «الکترونگاتیوی» (Electronegativity) را یاد میگیرید که عبارت است از توانایی یک اتم برای جذب یک جفت الکترون پیوندی.
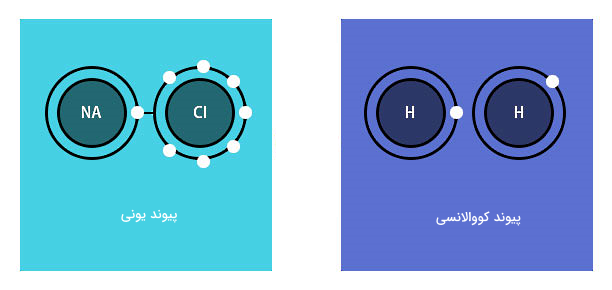
برای اینکه در مطالعه و یادگیری پیوندها موفق شوید، لازم است پیش از آن در مورد ساختار اتمی دانش خود را تکمیل کرده باشید. ممکن است این سوال مطرح شود که چه عاملی باعث میشود یک پیوند برقرار بماند؟ چرا برخی از پیوندها نسبت به بقیه قویتر هستند؟ یکی دیگر از مهمترین جنبههایی که در مطالعه پیوندها به آن پرداخته میشود، نیروهای جاذبه است که میتواند در پاسخدهی به سوالات بالا به شما کمک کند. پس از اینکه پیوندها را از نقطه نظر زیراتمی بررسی کردید، میتوانید در سطوح مولکولی نیز آنها را مطالعه کنید. همچنین با استفاده از دانش خود در زمینه نیروها، میتوانید توضیح دهید که برای مثال چرا مولکولهای مختلف شکلهای متفاوتی دارند یا اینکه چطور پیوند بین مولکولها موجب میشود مواد خواص متفاوتی داشته باشند.
انرژی و ترمودینامیک
تا اینجا یاد گرفتیم بخشی از مباحث مربوط به شیمی فیزیک چیست و شامل چه مفاهیم و تعریفهایی میشود. در این بخش به مبحث انرژی و ترمودینامیک در شیمیفیزیک میپردازیم و با مفاهیمی نظیر امکانسنجی واکنش، «آنتالپی» (Enthalpy)، «آنتروپی» (Entropy)، «انرژی آزاد گیبس» (Gibbs Free Energy)، انواع واکنشهای «گرماگیر» (Endothermic) و «گرماده» (Exothermic)، قوانین ترمودینامیک و قانون گازهای ایدهآل آشنا خواهیم شد.
امکانسنجی واکنش تعیین میکند در واکنش دو ماده با هم چه اتفاقی رخ میدهد. در امکانسنجی مطالعاتی روی تغییرات انرژی طی واکنش انجام میشود و یکی از مهمترین کمیتهایی که در این مطالعات محاسبه میشود، آنتالپی یا H است. تغییرات آنتالپی همان تغییرات گرمای واکنش در شرایط دما و فشار ثابت است که با فرمول زیر محاسبه میشود:
- : آنتالپی واکنش
- : مجموع آنتالپی محصولات
- : مجموع آنتالپی واکنشدهندهها

مبحث مهم دیگر آنتروپی است که با S نشان داده میشود و عبارت است از میزان بینظمی در یک سیستم. برای مثال زمانی که یک ماده در حالت فیزیکی مایع قرار دارد و طی فرآیند تبخیر بخار میشود و به حالت گازی در میآید، بینظمی در ساختار آن افزایش یافته است و میگوییم آنتروپی زیاد شده است. میدانیم که ذرات تشکیلدهنده ماده در حالت گازی آزادی عمل بیشتری نسبت به حالت مایع دارند.
یک پارامتر مهم دیگر در ترمودینامیک که با داشتن آنتالپی و آنتروپی بهدست میآید، کمیتی به نام انرژی آزاد گیبس یا به اختصار G است:
در رابطه بالا T نشان دهنده دما بر حسب کلوین است. اگر تغییرات انرژی آزاد گیبس یا منفی شود، واکنش شیمیایی خود به خودی داریم. بهعلاوه ممکن است دنبال این باشید که چرا در حین واکنش برخی از مواد، گرما ایجاد میشود و اینکه چطور میتوانیم مقدار این گرما را اندازهگیری کنیم. به فرآیند اندازهگیری گرمای واکنش، «گرماسنجی» (Calorimetry) گفته میشود.

بنابراین از جمله مباحث مهم دیگر در این بخش، نوع واکنشها از نظر جذب یا آزادسازی گرما است. بر این اساس، واکنشها به دو گروه گرماگیر و گرماده تقسیم میشوند. در بخش بعد ویژگیهای انواع واکنشهای گرماده و گرماگیر را بیان میکنیم. در مرحله بعد از گرماسنجی، میتوانید تغییرات انرژی واکنش را با رسم نمودارهای آنتالپی داشته باشید. در نهایت پس از مطالعه این مباحث، قادر خواهید بود امکانسنجی هر واکنشی را تنها با نگاه کردن به مقادیر آنتالپی و آنتروپی بررسی کنید.
واکنشهای گرماگیر و گرماده
برای اینکه بتوانیم نوع یک واکنش را از نظر گرماده یا گرماگیر بودن تعیین کنیم، ابتدا باید بدانیم ویژگیهای این دو نوع واکنش از منظر شیمی فیزیک چیست. ویژگیهای یک واکنش گرماگیر عبارتاند از:
- جذب انرژی از محیط اطراف در قالب گرما
- شکست پیوندهای شیمیایی با جذب انرژی
- سرد شدن محیط بهعلت از دست دادن گرما
- (آنتروپی محیط)
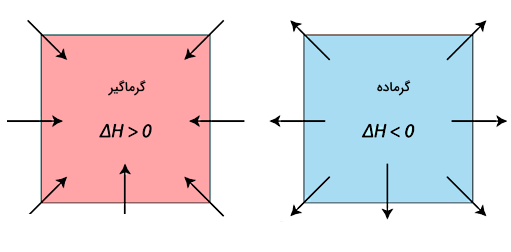
در مقابل، مشخصات واکنشهای گرماده شامل موارد زیر است:
- رهاسازی انرژی به محیط اطراف در قالب گرما
- گرم شدن محیط بهعلت آزادسازی گرما
- (آنتروپی محیط)
قوانین ترمودینامیک
یکی دیگر از مباحث مورد بررسی در این بخش، قوانین ترمودینامیک است. در ادامه میخواهیم ببینیم موضوع چهار قانون ترمودینامیک در شیمی فیزیک چیست:

- قانون صفرم: اگر دو سیستم مستقل هر کدام با سیستم مستقل سومی در تعادل ترمودینامیکی باشند، در این صورت این دو سیستم نیز با هم در تعادلاند.
- قانون اول: که همان اصل پایستگی انرژی است، بیان میکند انرژی نه ایجاد میشود و نه از بین میرود، بلکه از شکلی به شکل دیگر تبدیل میشود.
- قانون دوم: آنتروپی جهان بهعنوان یک سیستم ایزوله شده همواره در طول زمان افزایش مییابد.
- قانون سوم: در دمای صفر کلوین یا صفر مطلق، آنتروپی یک کریستال برابر با صفر است.
قانون گازهای ایدهآل
پس از اینکه متوجه شدیم قوانین ترمودینامیک در شیمی فیزیک چیست، به مبحث قانون گازهای ایدهآل میپردازیم تا با تعریف گاز ایدهآل و فرمول حاکم بر مشخصات این نوع گازها شامل حجم، دما و فشار آشنا شویم. اگر خاطرتان باشد در بخش قانون بویل رابطه حجم و فشار گازها را بررسی کردیم. قانون گازهای ایدهآل با وام گرفتن از قانون بویل به شکل کاملتری رابطه بین دما، فشار و حجم یک گاز کامل را نشان میدهد:
- فشار P بر حسب پاسکال (Pa)
- حجم V بر حسب متر مکعب (m۳)
- دمای T برحسب کلوین (K)
- n مقدار گاز بر حسب مول (mol)
- R ثابت جهانی گازها ()
حل مثال و تمرین از انرژی و ترمودینامیک
در این بخش حل دو مثال در مورد مباحث مرتبط با انرژی و ترمودینامیک را با هم بررسی میکنیم تا جزئیات و روابط این بخش را بهصورت مختصر مرور کنیم.
مثال ۱
فرض کنید احتراق گاز پروپان طبق واکنش زیر انجام شود:
با توجه به مقادیر آنتالپی استاندارد که بهصورت زیر در اختیار شما قرار داده شدهاند، آنتالپی واکنش احتراق برای یک مول پروپان چقدر است؟
پاسخ
با توجه به اینکه مقادیر آنتالپی واکنشدهندهها و محصولات مشخص هستند، میتوانیم آنتالپی واکنش را با معادله زیر محاسبه کنیم:
اما باید دقت کنیم که فراموش نشود هر مقدار آنتالپی باید در ضریب آن ترکیب طبق معادله واکنش احتراق ضرب شود. پس میتوانیم رابطه بالا را به شکل زیر بازنویسی کنیم:
از نوشتن آنتالپی اکسیژن صرفنظر کردیم، چون مقدار آن صفر است. بنابراین با قرار دادن مقادیر عددی در رابطه بالا خواهیم داشت:
مثال ۲
با توجه به مقادیر آنتالپی داده شده، آنتالپی واکنش سوختن اکتان به شکل زیر برابر با چه مقداری است؟
پاسخ
ابتدا معادله آنتالپی واکنش را مینویسیم:
حالا با توجه به واکنش شیمیایی و آنتالپیهای شکلگیری یا formation که با نماد f مشخص شدهاند، میتوانیم آنتالپی واکنش را به شکل زیر محاسبه کنیم. ابتدا آنتالپی کل را برای محصولات واکنش پیدا میکنیم:
سپس آنتالپی کل برای واکنشدهندهها را پیدا میکنیم:
رابطه بالا با در نظر گرفتن مقدار صفر برای آنتالپی تشکیل اکسیژن محاسبه شد. در نهایت با کم کردن دو مقدار بهدست آمده پاسخ سوال محاسبه میشود:
سینتیک و معادلات سرعت
پس از اینکه متوجه شدیم از نقطه نظر شیمیایی، چرا اتمها با هم برهمکنش دارند، به مطالعه دیدگاه علم فیزیک در این زمینه میپردازیم تا متوجه شویم در این زمینه سازوکار شیمی فیزیک چیست. سینتیک، حرکت ذرات را مطالعه میکند و اینکه چگونه این مسئله روی سیستمهای در حال تغییر تاثیرگذار است. برای نمونه، آهن و آب را در نظر بگیرید. اگر این دو ماده با هم واکنش دهند، اکسید آهن (III) تولید میشود. در دمای اتاق، چنین واکنشی بسیار آهسته است، اما اگر آهن با بخار واکنش دهد، سرعت واکنش بیشتر خواهد بود. علت این مسئله به سینتیک ربط دارد.

در سینتیک شما راجعبه نرخ واکنشهای مختلف و اینکه چگونه میتوانیم این واکنشها را دستکاری کنیم، یاد میگیرید. یکی از روشهای افزایش سرعت واکنش، گرمادهی است، اما عوامل دیگری مانند مساحت سطح یا غلطت نیز روی سرعت واکنش تاثیرگذار هستند. تقویت دانش معادلات سرعت در این زمینه میتواند کمککننده باشد. در انتهای فراگیری این مبحث، میدانید چگونه نرخ واکنشها را بهصورت نظری و آزمایشگاهی میتوان تعیین کرد.
تعادل
در این بخش یاد میگیریم مبحث تعادل در شیمی فیزیک چیست و شامل چه موضوعاتی میشود. اگر به یاد داشته باشید، در بخش ترمودینامیک توضیح دادیم که امکانسنجی یک واکنش به چه صورت انجام میشود. واکنشهایی هستند که ممکن است در هر دو جهت انجام شوند، یعنی اگر معادله واکنش را بنویسیم، هم از راست به چپ میتوان رسید و هم از چپ به راست. معمولا این دو نوع واکنش را مستقیم و معکوس مینامند. برای نمونه کلرید آمونیوم جامد با رنگ سفید را در نظر بگیرید که دارای فرمول شیمیایی NH4Cl است. در واکنش تجزیه این ماده محصولاتی مانند گاز آمونیاک و اسید هیدروکلریک تولید میشوند.

اگر این ماده را در یک محفظه بسته رها کنید، همیشه مقداری جامد با رنگ سفید باقی میماند، صرفنظر از اینکه این ماده برای چه مدتی در داخل محفظه قرار بگیرد. در حقیقت، این واکنش هیچگاه کامل انجام نمیشود. چنین واکنشی را برگشتپذیر مینامیم، چون با اینکه بخشی از کلرید آمونیوم تجزیه میشود، اما مقداری از آن با ترکیب آمونیاک و اسید هیدروکلریک مجددا تولید میشود. چنین وضعیتی معادل برقراری تعادل است.
پس تعادل شیمیایی معادل است با یک سیستم واکنشی شامل غلظتهای مساوی از محصولات و واکنشدهندهها، به این صورت که نرخ واکنش مستقیم و معکوس در آن با هم برابر هستند. اما اگر نخواهیم کلرید آمونیوم باقی بماند، چه کاری میتوانیم انجام دهیم؟ برای بهدست آوردن بیشترین بازدهی تولید آمونیاک و اسید هیدروکلریک، چه تاثیری میتوانیم روی واکنش ایجاد کنیم؟ با مطالعه تعادل، میآموزید چگونه تغییر شرایط واکنش باعث میشود واکنش به یک جهت سوق داده شود. در ادامه این مطالعات، یاد میگیرید که برای مثال چگونه از اصل «لوشاتلیه» (Le Châtelier) برای تولید اتانول استفاده کنید. همچنین با بکارگیری ثابتهای تعادلی مانند kp و kc میتوانید ترکیب یک مخلوط تعادلی را بهدست آورید
اکسایش کاهش یا Redox
در بخشهای قبل توضیح دادیم که اکسید آهن چگونه از واکنش اکسیژن و آهن بهدست میآید. اگر خاطرتان باشد، اکسید آهن را همراه با حروف رومی بهصورت III نمایش دادیم. معنای این حروف چیست؟ این حروف نشاندهنده حالتهای اکسایش هستند. برای یادیگیری جزئیات بیشتر در این زمینه باید به مبحث اکسایش کاهش مسلط شویم و ببینیم این مبحث در شیمی فیزیک چیست. حالتهای اکسایش نشان میدهند که چه تعداد الکترون از یک اتم در یک واکنش از دست رفتهاند یا بهدست آورده شدهاند. در واکنشهای اکسایش، اتمها الکترون از دست میدهند در حالی که در واکنشهای کاهش، اتمها الکترون به دست میآورند.

برای اینکه چنین مفهومی را بهتر متوجه شوید، باید به واقعیت حرکت الکترونها بازگردید و نیممعادلات مناسب در این زمینه را بنویسید. سپس سلولهای الکتروشیمیایی را بررسی کنید. موقعیتی را تصور کنید که در آن دو ماده فلزی مختلف را به یک سیم متصل کرده و آنها را در یک محلول نمکی غوطهور ساختهاید. انتظار دارید چه اتفاقی بیفتد؟ چرا جریان تولید میشود و چگونه میتوانیم پیشبینی کنیم که این جریان در چه جهتی جاری خواهد شد؟ برای پاسخ به چنین سوالاتی باید به دانش خود در مورد ساختار اتمی و مفهوم الکترونگاتیوی مراجعه نمایید.
اسیدها و بازها
بهعنوان آخرین مبحث، در این بخش در مورد اسیدها و بازها صحبت خواهیم کرد تا ببینیم ویژگیهای این گروه از مواد در شیمی فیزیک چیست. نکته قابل توجه در این زمینه این است که بهجای مبنا قرار دادن حرکت الکترونها، آن چنان که از ابتدای این مطلب در مورد آن صحبت کردیم، در این قسمت روی حرکت پروتونها تمرکز میکنیم. با توجه به آنچه که در مورد ساختار اتمی و تعریف یون گفتیم، یون هیدروژن +H فقط شامل یک پروتون است و هیچ الکترون یا نوترونی ندارد. در نتیجه میتوانیم این یون را پروتون بنامیم.

اسیدها و بازها عموما در قالب واکنشهایی به نام واکنشهای خنثیسازی با هم برهمکنش دارند. این واکنشها بر مبنای حرکت پروتونها هستند. نمونه واکنشهای خنثیسازی در زندگی روزمره زیاد دیده میشوند. برای مثال، خمیر دندان ترکیبات اسیدی تولید شده توسط باکتریها در دهان را خنثی میکند. یا یک ماده مهم در پخت کیکها با نام بکینگپودر که مخلوطی از چند اسید و باز است و با حل شدن در یک محلول، گازهایی تولید میکند که موجب پف کردن کیک میشوند.
در ادامه مبحث اسیدها و بازها، با مقیاس pH آشنا خواهید شد و اینکه چگونه میتوان pH مواد را قبل و بعد از خنثیسازی محاسبه کرد. در نهایت متوجه خواهید شد که چگونه pH در تیتراسیون تغییر میکند. به این ترتیب تا حدی متوجه شدیم که مهمترین مفاهیم و کمیتهای مورد مطالعه در شیمی فیزیک چیست. در بخش بعدی، به بررسی موضوع زیرشاخههای مختلف شیمیفیزیک مانند «الکتروشیمی» (Electrochemistry)، «فتوشیمی» (Photochemistry) و «شیمی سطح» (Surface Chemistry) میپردازیم.
زیرشاخههای شیمیفیزیک چه هستند؟
در این بخش میآموزیم که مهمترین زیرشاخههای شیمی فیزیک چیست. مباحث مهمی که در شیمیفیزیک بررسی و مطالعه میشوند، عبارتاند از:
- الکتروشیمی
- فتوشیمی
- شیمی سطح
برای مثال یکی از زیرشاخههای شیمیفیزیک، ترمودینامیک شیمیایی است که به بررسی رابطه بین گرما و فرمهای دیگر انرژی شیمیایی با سینتیک شیمیایی میپردازد تا نرخ انجام واکنشهای شیمیایی را اندازهگیری کند. بخشهای دیگری از شیمیفیزیک وجود دارند که با خواص کلی مواد و برهمکنشهای بین آنها سروکار دارند. یکی از این شاخهها، فتوشیمی است که به بررسی برهمکنش نور با ماده میپردازد. واکنشهای شیمیایی که از جذب نور نشات گرفتهاند، با سایر واکنشها خیلی متفاوت هستند. برای مثال، ویتامین دی در بدن انسان زمانی تولید میشود که تابش خورشید جذب بدن شود. بنابراین اگر بدن در تاریکی قرار داشته باشد، ویتامین دی در بدن تولید نخواهد شد.
الکتروشیمی
اگر بخواهیم بدانیم حوزه مربوط به تولید جریان الکتریکی از تغییرات شیمیایی در شیمی فیزیک چیست، بهتر است الکتروشیمی را مطالعه کنیم. عبور یک جریان الکتریکی از میان یک محلول شیمیایی باعث میشود تغییراتی در اجزای تشکیلدهنده مواد رخ دهد که اغلب قابل مشاهده نیستند. حتی ممکن است در شرایط خاصی، خود این مواد تغییر داده شده نیز جریان الکتریکی تولید کنند.
باتریهای مرسوم، یک نمونه از محصولات الکتروشیمی محسوب میشوند. باتریها شامل مواد شیمیایی هستند که وقتی کلید مدار بسته شود، در تماس با هم قرار میگیرند و ولتاژ ثابتی را ایجاد میکنند. این ولتاژ موجب جاری شدن جریان در مدار خواهد شد، تا زمانی که مواد داخل باتری کاملا مصرف شوند. در حال حاضر، تولید قطعات و ابزارهایی مانند باتریها، که از نوعی انرژی استفاده میکنند تا فرم دیگری از انرژی تولید شود، بسیار موردعلاقه و تقاضا است. برای مثال کاربرد انرژی حاصل از نور خورشید برای انجام فعل و انفعالات شیمیایی. چنین محصولاتی با بکار گرفتن انرژی خورشیدی به نوعی قابلیت ذخیرهسازی انرژی را ایجاد میکنند.
فتوشیمی
در این بخش یاد میگیریم یکی دیگر از زیرشاخههای شیمی فیزیک چیست. فتوشیمی یکی از زیرشاخههای شیمیفیزیک است که در آن به بررسی نقش نور در واکنشهای شیمیایی پرداخته میشود. مبنای مطالعات فتوشیمی حالتهای الکترونی برانگیخته در مولکولها است که در اثر برهمکنش ماده با نور ایجاد میشوند. با اینکه از سال ۱۸۰۰ رابطه بین نور خورشید و بیوسنتز کربوهیدراتهای گیاهی از دیاکسید کربن و آب شناخته شده است، اما روند پیشرفت فتوشیمی آلی کند بوده است. پیشرفت این روند نیازمند توسعه روشهای طیفسنجی جهت تعیین ساختار ماده است.

شیمی سطح
یکی دیگر از مباحثی که بهسرعت در حال پیشرفت است، شیمی سطح نام دارد که در این بخش میخواهیم ببینیم جایگاه این موضوع در شیمی فیزیک چیست. شیمی سطح خواص سطوح شیمیایی را ارزیابی میکند. کسب نتایج دقیق در این حوزه نیازمند بکارگیری ابزارهایی با دقت بالا است، به این صورت که پس از تست سطوح با این ابزارها، پروفایل شیمیایی درستی از مواد در اختیار محقق قرار داده شود. در این زمینه فرقی ندارد که یک جامد در معرض یک مایع قرار بگیرد یا یک گاز، مهم این است که واکنش ابتدا روی سطح جامد رخ دهد. واکنش اولیه روی سطح یک جامد باعث میشود خواص آن بسیار تغییر کند.
برای مثال آلومینیم را در نظر بگیرید. مقاومت آلومینیم در مقابل خوردگی به این خاطر است که سطح خالص این فلز جامد با اکسیژن بهعنوان یک گاز، واکنش میدهد. در نتیجه لایهای به نام اکسید آلومینیم روی آن تشکیل میشود که از اجزای داخلیتر فلز در مقال اکسید شدن جلوگیری میکند. عملکرد اغلب کاتالیستهای واکنش بهصورت تولید یک سطح واکنشدهنده است، به گونهای که مواد بتوانند روی آن واکنش دهند.
شیمی کوانتومی
شیمی کوانتومی یکی دیگر از زیر مجموعههای شیمیفیزیک محسوب میشود. همانطور که از اسم این بخش مشخص است، در شیمی کوانتومی برای حل مسائل مختلف در شیمی از مکانیک کوانتومی استفاده میشود. مکانیک کوانتومی اطلاعاتی شامل موارد زیر در اختیار یک شیمیدان قرار میدهد:
- شکل و قدرت پیوندها
- چگونگی حرکت هسته
- چگونگی جذب و گسیل نور توسط یک ترکیب شیمیایی
یکی از مهمترین ابزارهای شیمی کوانتومی تکنیک یا روشی به نام «طیفسنجی» (Spectroscopy) است. در انواع مختلف طیفسنجی ماده با یک تابش الکترومغناطیسی برهمکنش دارد که از تحلیل نتایج آن، اطلاعاتی در مورد ترکیب شیمیایی ماده بهدست خواهد آمد.
ترمودینامیک شیمیایی
در این بخش بررسی میکنیم بخش دیگری از سوالات مطرح شده در شیمی فیزیک چیست و کدام زیر مجموعه میتواند به آنها پاسخ دهد. اگر بخواهیم بدانیم کدام واکنشها خود به خودی رخ میدهند یا چه خواصی در مورد یک مخلوط شیمیایی مشخص ممکن است وجود داشته باشد، میتوانیم به شیمی کوانتومی مراجعه کنیم. در شیمی کوانتومی برای برخی از کمیتها محدودیتهای خاصی تعریف میشود، برای نمونه در یک ماشین احتراق داخلی چه مقدار انرژی ممکن است به کار تبدیل شود یا اینکه یک واکنش تا چه زمانی ممکن است ادامه داشته باشد. همچنین در این زیرشاخه رابطه بین خواصی مانند ضریب انبساط گرمایی و نرخ تغییرات آنتروپی با فشار برای یک گاز یا مایع داده شده ارائه میشود. نتایج حاصل از مطالعات در این زمینه کمک میکند تا اطمینان حاصل کنیم که آیا طراحی یک موتور یا راکتور امکانپذیر است یا آیا نیاز است اعتبار دادههای آزمایشگاهی مجددا چک شوند یا خیر.
سینتیک شیمیایی
اینکه چه واکنشی اتفاق میافتد و با چه سرعتی، موضوع زیرشاخه دیگری از شیمیفیزیک است که در این قسمت به آن میپردازیم. در سینتیک شیمیایی برای اینکه چند ماده شیمیایی بهعنوان واکنشدهنده با هم واکنش دهند و محصولاتی تولید کنند، معمولا لازم است گونههای شیمیایی حالتهایی به نام حالت گذار عبور کنند. این حالتها در انرژی بالاتری نسبت به هر دوی واکنشدهندهها و محصولات قرار دارند و در نتیجه این مسئله مانند یک سد یا مانع در مقابل واکنش عمل خواهد کرد. هر چه سد انرژی بیشتر باشد، واکنش آهستهتر است. سینتیک شیمیایی مباحث دیگری مانند چگونگی وابستگی نرخ واکنش به دما یا به غلظت واکنشدهندهها و کاتالیستهای موجود در مخلوط واکنش را پوشش میدهد. همچنین نحوه مهندسی شرایط واکنش و کاتالیستهای استفاده شده به منظور بهینه کردن نرخ واکنش در سینتیک شیمیایی مشخص میشود.
کار دانشمند شیمی فیزیک چیست؟
تمام دستاوردهای دانشمندان این حوزه بر پایه درک خواص شیمیایی و سپس توصیف آنها بر اساس نظریات فیزیکی و محاسبات ریاضیاتی قرار دارد. در حقیقت، آنها تلاش میکنند تا خواص فیزیکی اتمها و مولکولها را بفهمند و متوجه شوند که از نظر اصول حاکم بر علم فیزیک، یک واکنش شیمیایی چگونه کار میکند. همچنین پس از بررسی خواص فیزیکی، به این میپردازند که آثار این خواص روی شیمی فیزیک چیست.

محققین این حوزه تلاش میکنند تا با انجام آزمایش و دقت بالا، خواص فیزیکی سه حالت ماده شامل مایعات، گازها و جامدات را درک کنند. نیاز به دقت و توجه به جزئیات در این شاخه از اهمیت زیادی برخوردار است و همین مسئله باعث میشود تحقیقات و کارهایی که یک محقق این حوزه انجام میدهد، بسیار شبیه به تحقیقات یک شیمیدان در حوزه شیمی تجزیه باشد. محققین این شاخه با بکارگیری ابزارها و تجهیزات دقیقی مانند انواع لیزرها، «طیفسنجی جرم» (Mass Spectrometry)، «رزونانس مغناطیسی هستهای» (Nuclear Magnetic Resonance) یا NMR و «میکروسکوپهای الکترونی» (Electron Microscopy)، اهداف زیر را دنبال میکنند:
- تحلیل مواد
- توسعه روشهای جدیدی برای سنجش و مشخصهیابی خواص مواد
- توسعه نظریات جدیدی در مورد خواص مواد
- کشف پتانسیل کاربردی مواد
یکی دیگر از کارهایی که محقیق این بخش از علم انجام میدهند، استفاده گسترده از روابط ریاضیاتی است تا بتوانند تحلیل آماری درستی از مقادیر بالای دادههایی که در اختیار دارند، ارائه دهند. گاهی ممکن است چیزی در حدود میلیونها نقطه بهعنوان داده حاصل شود و لازم باشد با تحلیل این نقاط، اطلاعات پنهان در مورد ترکیبات، مواد و فرآیندهای مختلف استخراج شوند. در مواردی نیاز است با انجام شبیهسازیهایی که بر مبنای توسعه معادلات ریاضی قرار دارد، پیشبینی شود که ترکیبات مختلف چگونه در طول زمان واکنش میدهند. بنابراین بازه کاری یک دانشمند حوزه شیمیفیزیک به دو بخش تقسیم میشود، زمانی که برای انجام آزمایش و تست گرفتن صرف میشود و زمانی که اختصاص دارد به انجام محاسبات و تحلیل دادهها. چنانچه این شخص در مرتبه علمی بالاتری قرار داشته باشد، بسته به محیط آکادمیکی که در آن قرار دارد، معمولا وظایف دیگری مانند بررسی نیازها و اهداف دپارتمان، هدایت و راهنمایی سایر محققین و برگزاری جلسات با مدیران حوزه صنعت را نیز بر عهده دارد.
تاریخچه شیمی فیزیک
پس از اینکه یاد گرفتید کلیات شیمی فیزیک چیست، در این بخش تاریخچهای از مفاهیم و قوانین مهم در علم شیمی یا فیزیک را بیان میکنیم که در حوزه شیمیفیزیک بررسی شده و توسعه یافتهاند. با مطالعه این بخش بهتر متوجه خواهید شد که از شیمیفیزیک در چه زمینهای و به چه صورتی استفاده میشود.
همچنین با نقش پررنگ مکانیک کوانتومی نیز آشنا خواهید شد. استفاده از مکانیک کوانتومی بهعنوان یکی از مباحث مهم علم فیزیک، باعث شد شیمیدانها به درک عمیقتری از ساختار اتم دست پیدا کنند و در نتیجه شیمیفیزیک توسعه یافت. عبارت شیمیفیزیک، اولین بار توسط شخصی به نام «میخاییل لومونسف» (Mikhail Lomonosov) در سال ۱۷۵۲ مطرح شد. تعریفی که او در مورد شیمیفیزیک ارائه کرد به این صورت بود:
«شیمیفیزیک علمی است که از نتایج حاصل از آزمایشهای انجام شده در علم فیزیک استفاده میکند تا علت واکنشهای شیمیایی مختلف را توضیح دهد»

شیمیفیزیک مدرن در سالهای ۱۸۶۰ تا ۱۸۸۰ و با کار روی ترمودینامیک شیمیایی، الکترولیتها در محلولها، سینتیک شیمیایی و موضوعات دیگر توسعه یافت. در همین سالها یکی از اولین نقاط عطف در شیمیفیزیک اتفاق افتاد. دانشمندی به نام «جوسایا گیبس» (Josiah Gibbs) مقالهای با عنوان «تعادل مواد ناهمگن» منتشر کرد که در آن مفاهیم مهمی از شیمیفیزیک مانند انرژی گیبس، پتانسیل شیمیایی و قانون فازی گیبس مطرح شدند. این مفاهیم جزء موضوعات مهم زیرشاخهای از شیمیفیزیک به نام ترمودینامیک شیمیایی هستند که در ادامه بیشتر به آن خواهیم پرداخت.
اولین مقالهای که بهطور رسمی در حوزه شیمیفیزیک منتشر شد، کاری بود که توسط سه دانشمند به نامهای «ویلهلم اوستوالد» (Wilhelm Ostwald)، «یاکوبوس وانتهوف» (Jacobus Van 't Hoff) و «سوانته آرنیوس» (Svante Arrhenius) در اواخر قرن نوزدهم و اوایل قرن بیستم انجام شد. این مطالعه منجر به دریافت جایزه نوبل شیمی شد.

گسترش شیمیفیزیک در سالهای بعد همراه شد با کاربرد شاخهای از فیزیک به نام مکانیک آماری، کار روی شیمی سطح و کلوئیدها. نقطه عطف دیگر شیمیفیزیک، کاربرد مکانیک کوانتومی و توسعه زیرشاخهای به نام شیمی کوانتومی بود. با شروع از دهه ۱۹۳۰، نظریات کوانتومی در کنار هم قرار گرفتند و پس از پیشرفت در روشهای آزمایشگاهی نتایج جالبی بهدست آمد. مهمترین تکنیکهایی که در این دوره توسعه داده شدند و همچنان جزء مهمترین روشهای مشخصهیابی در شیمیفیزیک محسوب میشوند، عبارتاند از:
- انواع روشهای «طیفسنجی» (Spectroscopy) شامل طیفسنجی مادونقرمز، طیف سنجی میکروموج و طیفسنجی رزونانس مغناطیسی هسته
- «رزونانس پارامغناطیسی الکترون» ( Electron Paramagnetic Resonance)
پیشرفتهای بعد در شیمیفیزیک مربوط میشود به شیمی هسته، بهویژه مبحث جداسازی ایزوتوپها که با سالهای جنگ جهانی دوم و پس از آن همزمان بود. جدیدترین زیرمجموعههای شیمیفیزیک در زمینه «اخترشیمی» (Astrochemistry) است.
قانون بویل
اگر بخواهیم بدانیم یکی از اولین خدمات شیمی فیزیک چیست، بهتر است توسعه قانون بویل در قرن هفدهم را مطالعه کنیم. احتمالا میدانید که شیمیدان انگلیسی - ایرلندی به نام «رابرت بویل» (Robert Boyle) کشف کرد که در دمای اتاق، حجم یک مقدار مشخصی از یک گاز، متناسب با میزان افزایش فشار روی آن، کم میشود. بنابراین برای یک گاز در دمای ثابت، حاصلضرب حجم V و فشار P مساوی با عدد ثابتی خواهد شد (PV = عدد ثابت). چنین رابطه ریاضیاتی سادهای تقریبا در دمای اتاق و فشاری برابر یا کمتر از یک اتمسفر، برای تمام گازها برقرار است و قانون بویل نام دارد:

کارهای بعدی در این زمینه نشان داد این رابطه درستی خود را در فشارهای بالاتر از فشار جو از دست میدهد، اما همچنان میتوان عبارتهای پیچیدهتری را که بهطور دقیقتری هم با نتایج آزمایشگاهی مطابقت دارند، در این زمینه استخراج کرد. کشف و بررسی چنین قوانین شیمیایی که اغلب قوانین طبیعی هم نامیده میشوند، در قلمرو شیمیفیزیک قرار میگیرد. بنابراین در شرایطی که قانون بویل ممکن است بهدرستی کار نکند، شیمیفیزیک روابطی را ارائه میدهد که میتوان از آنها استفاده کرد.
فیزیک کوانتوم
در قرن هجدهم، بیشتر روابط ریاضیاتی حاکم بر سیستمهای شیمیایی بر مبنای نیروها و میدانهایی بود که اتمهای سازنده ترکیبات و عناصر را احاطه کردهاند. اما پیشرفتهای قرن بیستم نشان داد که بهترین تفسیر از رفتار شیمیایی یک ماده بر اساس مدل مکانیک کوانتومی ساختار اتمی و مولکولی آن بهدست میآید. عمده مطالعات نظری در شیمیفیزیک مربوط به این قسمت است.

در حقیقت یکی از شاخههای مهم علم فیزیک که در گسترش شیمیفیزیک نیز نقش پررنگی داشته است، «مکانیک کوانتومی» (Quantum Mechanics) است. نظریه کوانتومی با مدلسازی ذرات کوچکی به نام اتمها، شیمیدانان نظری را قادر ساخت تا با استفاده از کامپیوترها و حل معادلات ریاضیاتی پیچیده، بتوانند رفتار شیمیایی یک ماده را بهتر درک کنند.
مسیر یادگیری شیمیفیزیک با فرادرس
در انتهای این نوشته و پس از اینکه کاملا یاد گرفتید ابعاد و جنبههای مختلف شیمی فیزیک چیست، در این بخش یک مسیر یادگیری مفید جهت یادگیری موثر شیمیفیزیک در دانشگاه را به شما پیشنهاد میکنیم. در فیلمهای آموزشی تهیه شده توسط مجموعه فرادرس با مشاهده ویدئوها میتوانید نوعی یادگیری بصری هم داشته باشید و در نتیجه، تسلط بیشتری روی موضوعات مختلف در حوزه شیمیفیزیک خواهید داشت:
- مجموعه آموزش مکانیک کوانتومی فرادرس
- فیلم آموزش فیزیک پایه ۳ فرادرس
- فیلم آموزش شیمی عمومی فرادرس
- فیلم آموزش محلول سازی در آزمایشگاه فرادرس
- فیلم آموزش شیمیفیزیک فرادرس
- فیلم آموزش رایگان حل تمرین شیمیفیزیک فرادرس
- فیلم آموزش شیمیفیزیک ۱ مرور و حل تست کنکور ارشد فرادرس
- فیلم آموزش شیمیفیزیک حل مساله فرادرس
- فیلم آموزش شیمیفیزیک ۲ مرور و حل تست کنکور ارشد فرادرس
- فیلم آموزش شیمیفیزیک ۳ فرادرس
- فیلم آموزش شیمیفیزیک آلی فرادرس
آزمون شیمیفیزیک
در این مطلب یاد گرفتیم که شیمی فیزیک چیست و با زیرشاخههای آن نیز آشنا شدیم. شیمیفیزیک شاخهای از علم شیمی است که به بررسی رفتار مواد در سطوح اتمی و مولکولی میپردازد. همانطور که گفتیم، این شاخه از شیمی مباحث مهمی شامل مطالعه ساختار اتمی، مقدار ماده، پیوندها، انرژی و ترمودینامیک، سینتیک، تعادل، اکسایش کاهش و مبحث اسیدها و بازها را پوشش میدهد. در ادامه آزمونی برای شما تهیه شده است که با پاسخدهی به سوالات آن میتوانید دانش خود را در این زمینه بیازمایید. پس از اینکه به تمام سوالات جواب دادید، با کلیک روی گزینه «دریافت نتیجه آزمون» میتوانید نمره نهایی خود را مشاهده کنید.
تمرین و آزمون
در کدام یک از واکنشهای زیر داریم ؟
یخ زدن آب
بخار شدن آب
رسوب نمک در یک محلول اشباع شده
هیچکدام
گزینه دوم درست است. منظور از این است که تغییرات آنتروپی یا S مثبت بوده است. در واکنش یخ زدن آب، ماده از حالت مایع به جامد تبدیل میشود، در نتیجه انتظار داریم آنتروپی کم شود. در واکنش سوم نیز سیستم نهایی نظم بیشتری نسبت به سیستم اولیه دارد، در نتیجه آنتروپی یا بینظمی کاهش یافته است.
کدام گزینه جزء مشخصات یک واکنش گرماگیر محسوب نمیشود؟
جذب گرما از محیط
آزادسازی انرژی به محیط
شکستن یک پیوند شیمیایی
برآیند تغییرات آنتالپی مثبت
گزینه دوم درست است. همانطور که در بخشهای قبل گفتیم، سه گزینه دیگر همگی جزء ویژگیهای واکنشهای گرماگیر هستند.
کدام یک از شرایط زیر نشان میدهد که انجام واکنش شیمیایی مطلوب نیست؟
وقتی که منفی باشد.
وقتی که منفی باشد.
وقتی که منفی باشد.
همه گزینهها درست هستند.
گزینه اول صحیح است. علامت تعیینکننده جهت واکنش شیمیایی است. در واقع این علامت تعیین میکند که انجام یک واکنش شیمیایی خود به خودی است یا خیر. بنابراین زمانی که منفی باشد، انجام واکنش شیمیایی ما خود به خودی است، یعنی نیازی به مصرف انرژی نیست و در این حالت انجام واکنش مطلوب است.
حالا اگر به معادله حاکم بر انرژی آزاد گیبس بر حسب آنتالپی و آنتروپی دقت کنیم ()، اگر بخواهیم منفی شود، با توجه به اینکه طبق قانون دوم ترمودینامیک همیشه مثبت و در حال افزایش است، بهتر است منفی باشد. پس منفی هم جزء شرایط مطلوب برای انجام یک واکنش شیمیایی است.
اما اگر منفی باشد و در حال افزایش از نظر اندازه (با فرض برقرار نبودن قانون دوم ترمودینامیک)، در این حالت ممکن است مثبت شود، یعنی واکنش شیمیایی خود به خودی رخ ندهد. در این شرایط برای انجام آن نیاز داریم توسط یک منبع بیرونی انرژی مصرف کنیم. چنین شرایطی قطعا مطلوب نیست.
اگر آهن را تا نزدیکی دمای ذوباش گرم کنیم، چگالی آن ...
کاهش مییابد، چون جرم آن کم شده است.
افزایش مییابد، چون حجم آن کم شده است.
کاهش مییابد، چون حجم آن زیاد شده است.
افزایش مییابد، چون جرم آن زیاد شده است.
گزینه سوم درست است. اگر فرمول چگالی ماده را بنویسیم، متوجه میشویم که بین حجم و چگالی ماده ارتباط معکوسی برقرار است:
با افزایش دمای آهن تا نزدیکی دمای ذوب، در مرز تغییر حالت جامد به مایع قرار داریم. در چنین شرایطی حجم ماده افزایش یافته است، چون ذرات تشکیلدهنده ماده از حالت فشردهتر جامد به حالت آزادتر مایع تغییر چینش دادهاند. اما جرم ماده یا مقدار مولکولها تغییری نمیکند. بنابراین با افزایش حجم و ثابت ماندن جرم آهن، طبق فرمول بالا چگالی آن کم میشود.
کدام یک از دو فاکتور دما و فشار باعث تغییر چگالی خواهد شد؟
فقط فشار، چون جرم ماده را تغییر میدهد.
فقط دما، چون حجم ماده را تغییر میدهد.
هر دو، چون هر دو عامل حجم ماده را تغییر میدهند.
هر دو، چون دما حجم را و فشار جرم ماده را تغییر میدهد.
چنانچه اتمهای مختلف الکترونهای خود را با هم به اشتراک بگذارند، در این صورت میگوییم بین این اتمها ... برقرار شده است.
پیوند یونی
پیوند فلزی
پیوند کووالانسی
پیوند بینمولکولی
کدام قانون ترمودینامیک بیان میکند که آنتروپی یک کریستال در دمای صفر مطلق برابر با صفر است؟
قانون دوم
قانون اول
قانون صفرم
قانون سوم
در دمای ۲۵ C، واکنشی دارای تغییرات انرژی آزاد گیبس به اندازه ۴۵ kJ است. اگر آنتالپی این واکنش برابر با ۳۵ kJ باشد، تغییرات آنتروپی واکنش چقدر است؟
اگر آنتالپی یک واکنش دارای مقدار باشد، این واکنش با کدام گزینه بهتر توصیف میشود؟
گرماگیر
گرماده
مستقیم
معکوس
میدانیم تغییرات انرژی آزاد گیبس با معادله زیر مشخص میشود:
در کدام سناریوی زیر، انجام واکنش خود به خودی است؟
اگر هر دو مقدار و منفی باشند و دما پایین باشد.
اگر هر دو مقدار و مثبت باشند و دما بالا باشد.
اگر منفی باشد اما مثبت باشد.
تمام گزینهها به انجام واکنش خود به خودی منجر میشوند.












