زنگ آهن چیست؟ – به زبان ساده


زنگ آهن را میتوان یک اکسید آهن به شمار آورد که به طور معمول، بر اثر واکنش آهن و اکسیژن در حضور آب یا رطوبت هوا، اکسیدی به رنگ قرمز قهوهای ایجاد میکند. شکلهای مختلف زنگ آهن را میتوان به صورت ظاهری یا به کمک طیفسنجی مشاهده کرد. زنگ آهن شامل آهن (III) اکسید آبدار با فرمول و اکسید-هیدروکسید (III) آهن با فرمول است.
اگر به جرمی از آهن، به میزان کافی زمان بدهیم، در حضور آب و اکسیژن، به طور کامل به زنگ آهن تبدیل میشود. زنگ آهن در سطح خود به صورت پوستهپوسته و شکننده ظاهر میشود و هیچ حفاظتی را در برابر سطوح زیرین خود در برابر زنگ زدگی ایجاد نمیکند که این مورد دقیقا برخلاف تشکیل پتینه بر روی سطوح مس است. زنگ آهن اصطلاحی است که برای خوردگی آهن و آلیاژهای آن همچون فولاد به کار میرود. فلزات دیگری نیز دچار خوردگی میشوند اما اکسیدهای حاصل به طور معمول نام زنگ آهن به خود نمیگیرند.
شکلهای دیگری از زنگ آهن وجود دارند که از آنجمله میتوان به واکنش بین آهن و کلرید در محیط عاری از اکسیژن اشاره کرد. از نمونههای آن میتوان به زنگ آهن ایجاد شده بر روی میلگردهای ستونهای سیمانی در زیر آب اشاره کرد. با وجود اینکه زنگ آهن به طور کلی، ویژگی منفی برای آهن به شمار میآید اما نوع خاصی از زنگ آهن وجود دارد که به آن، زنگ آهن پایدار میگویند و در اثر ایجاد این نوع زنگ آهن در سطح، پوششی محافظ ایجاد میشود که در صورت رطوبت کم، لایههای زیرین را در برابر ادامه خوردگی حفظ میکند.

واکنش های شیمیایی در زنگ آهن
با وجود اینکه زنگ آهن را میتوان ناشی از یک واکنش اکسایش دانست اما باید توجه داشته باشید که تمامی اکسیدهای آهن را نمیتوان زنگ آهن به شمار آورد. همانطور که در ابتدای متن هم به آن اشاره شد، زنگ آهن در اثر واکنش آهن و اکسیژن بوجود میآید اما وجود آهن و اکسیژن در کنار هم به تنهایی کافی نیست. با وجود اینکه 21 درصد از هوا را اکسیژن تشکیل میدهد اما برای ایجاد زنگ آهن، هوای خشک کفایت نمیکند و نیاز به رطوبت داریم.
واکنش آهن، اکسیژن و آب را میتوان نمونهای از یک واکنش الکتروشیمیایی دانست که سبب خوردگی میشود. در چنین واکنشی، دو واکنش الکتروشیمیایی به طور مجزا بوقوع میپیوندند. در واکنش اول، اکسایش آهن را شاهد هستیم:
در واکنش دوم نیز کاهش کاتدی اکسیژن را خواهیم داشت:
یون آهن و هیدروکسید در اثر واکنش با یکدیگر، هیدروکسید آهن را تشکیل میدهند.
در اثر واکنش اکسید آهن با آب نیز، زنگ آهن بوجود میآید. با توجه به طبیعت الکتروشیمیایی واکنش، الکترولیت حل شده در آب، به انجام واکنش کمک میکند. به طور مثال، در آب شور، زنگ آهن با سرعت بیشتری نسبت به آب خالص تشکیل میشود.
به یاد داشته باشید که گاز اکسیژن، تنها منبع اکسیژن در هوا یا آب نیست بلکه دیاکسید کربن را هم میتوان منبعی از اکسیژن در فرآیند زنگ آهن به شمار آورد. در اثر واکنش دیاکسید کربن و آب، اسید ضعیفی به نام کربنیک اسید تشکیل میشود. این اسید، الکترولیت بهتری نسبت به آب است. در اثر واکنش اسید با آهن، مولکولهای آب به هیدروژن و اکسیژن شکسته میشوند. اکسیژن آزاد و آهن حل شده از اکسید آهن، الکترون آزاد میکنند که میتوانند به بخش دیگری از فلز منتقل شوند. زمانی که زنگ آهن تشکیل شود، این فرآیند تا خوردگی کامل آهن ادامه پیدا خواهد کرد.
واکنش های زنگ آهن به طور خلاصه
در ادامه، واکنشهایی که سبب تشکیل زنگ آهن میشوند را قبل از بررسی دقیقتر، به طور خلاصه و به همراه پتانسیل استاندارد سلول، در زیر میآوریم:
واکنش در آند:
واکنش در کاتد:
واکنش کلی:
آنچه که به عنوان زنگ آهن میشناسیم در حقیقت، آهن (III) اکسید آبدار است که به هنگام واکنش یون آهن (II) با اکسیژن اضافی تشکیل میشود:
تعداد مولکولهای آب در ترکیب آبدار، متغیر است و بنابراین، با نشان داده شدهاند. همانطور که گفته شد، بر خلاف پتینه تشکیل شده بر روی مس، زنگ آهن هیچ لایه محافظی را ایجاد نمیکند و با ادامه خوردگی آهن و پوسته پوسته شدن آن، آهن جدیدتر در معرض هوا قرار خواهد گرفت.

توصیف دقیقتر واکنشها در زنگ آهن
میدانیم که زنگ آهن یک فرآیند الکتروشیمیایی است که با انتقال الکترون از آهن به اکسیژن معنی پیدا میکند. در این فرآیند، آهن، عامل اکسنده و اکسیژن، عامل کاهنده به شمار میآید. سرعت این خوردگی متاثر از آب و الکترولیت است. فرآیند کاهش اکسیژن را میتوان به عنوان واکنش کلیدی در نظر گرفت:
با توجه به اینکه در چنین فرآیندی، هیدروکسید تشکیل میشود، واکنش به شدت متاثر از حضور اسید خواهد بود و خوردگی بسیاری از فلزات در pH پایین شدت پیدا میکند. با اکسایش آهن، الکترون لازم برای واکنش بالا فراهم خواهد شد. همچنین، واکنش ردوکس زیر در حضور آب بوقوع میپیوندد که در تشکیل زنگ آهن بسیار مهم است:
علاوه بر این، واکنشهای چندمرحلهای اسید-باز هم در تشکیل زنگ آهن موثر هستند:
در این خصوص باید واکنشهای تعادلی آبگیری زیر را نیز اضافه کنیم:
به کمک واکنشهای بالا یک بار دیگر در مییابیم که وجود آب و اکسیژن، زنگ آهن را سبب میشوند. اگر میزان اکسیژن محلول، محدود باشد، ترکیباتی از آهن (II) همچون مگنتیت با فرمول و خواهیم داشت. همچنین، با داشتن غلظتهای بالا از اکسیژن، ترکیباتی از آهن (III) تولید میشوند.
علاوه بر این، چنین فرآیندهای پیچیدهای از حضور سایر یونها همچون تاثیر میگیرند که به عنوان الکترولیت در افزایش سرعت تشکیل زنگ آهن موثر است. همچنین، این یون در ترکیب با هیدروکسیدها و اکسیدهای آهن، رسوباتی شامل ذرات کلسیم، آهن، اکسیژن و هیدروکسید تشکیل میدهد.
شناسایی شروع زنگ آهن
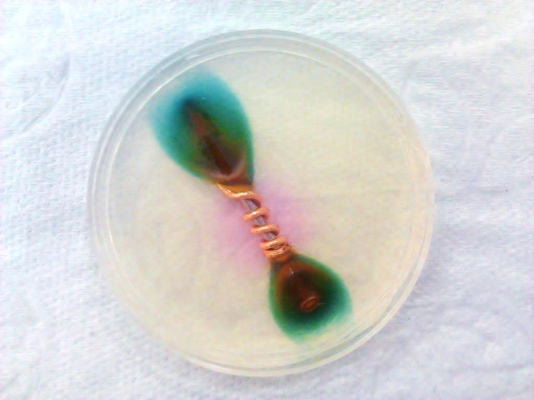
شروع زنگ آهن را میتوان در آزمایشگاه به کمک محلول شناساگر «فروکسیل» (Ferroxyl) انجام داد. این محلول در شناسایی یونهای هیدروکسید و کاربرد دارد. در صورت وجود یونهای و هیدروکسید، به ترتیب لکههایی به رنگ آبی و صورتی در محلول ظاهر میشوند.
روشهای جلوگیری از زنگ آهن
با توجه به گستردگی استفاده از محصولات آهنی و فولادی، جلوگیری از تشکیل زنگ آهن به عنوان یکی از اصلیترین فعالیتهای اقتصادی و فناورانه به شمار میآید. توجه داشته باشید که زنگ آهن، در مقابل هوا و آب نفوذپذیر است و در نتیجه، لایههای زیرین لایه زنگزده نیز در معرض خوردگی قرار دارند. در نتیجه، برای جلوگیری از تشکیل زنگ آهن به پوششهایی نیاز داریم تا این نفوذپذیری را از بین ببرند. در ادامه، مروری اجمالی بر روشهای جلوگیری از تشکیل زنگ آهن خواهیم داشت.
آلیاژهای ضدزنگ
فولاد ضدزنگ، لایهای از کروم (III) اکسید ایجاد میکند تا عمل «غیرفعالسازی» (Passivation) را انجام دهد. چنین رفتاری در منیزیم، تیتانیوم، روی، اکسیدهای روی، آلومینیوم، پلیآنیلین و سایر پلیمرهای دیگر دیده میشود. در طراحی محصولات و موادی که دچار زنگ زدگی میشوند باید بدترین شرایط را در نظر گرفت چراکه این مواد حتی در شرایط ایدهآل، به زنگ زدن خود ادامه میدهند.
گالوانیزه کردن
«گالوانیزه کردن» (Galvanization) شامل استفاده از پوشش محافظی از روی (Zn) برای محافظت از آهن یا فولاد در برابر خوردگی است. دلیل استفاده از روی، ارزان بودن آن ذکر میشود که به خوبی به فولاد میچسبد و در سطح آن، یک حافظت کاتدی ایجاد میکند. در محیطهایی با خورنگی بیشتر همچون آب شور، از آبکاری کادمیم بهره میگیرند. این روش برای شکافها، درزها، لولاها و اتصالات به علت ایجاد شدن فضای خالی در پوشش، مناسب نیست.
در چنین شرایطی، پوشش همچنان به عنوان روش محافظت کاتدی جزئی برای فلز عمل میکند اما نقش آند گالوانی دارد و با خوردگی، از زنگ زدن لایه زیری جلوگیری میکند. بنابراین، لایه محافظ از جنس روی، خود دچار خوردگی میشود و تنها برای مدت محدودی از زنگ آهن جلوگیری میکند.
در روشهای جدیدتر، به این پوشش علاوه بر روی، آلومینیم نیز اضافه میکنند. آلومینیوم با حرکت خود، خراشهای ایجاد شده را پوشش میدهد و موجب انجام محافظت در مدت زمان بیشتری میشود. این روش، به جای فرآیند اکسایش به عنوان «آند فداشونده» (Sacrificial Anode) بر ایجاد خراش بر روی سطح تکیه میکند. در برخی شرایط که خوردگی بالایی داشته باشیم، از روی و پوشش دیگر به منظور افزایش حفاظت در برابر خوردگی استفاده میشود.
پوشش معمولی که برای فولاد در استفاده روزمره آن بکار گرفته میشود شامل پوششی از جنس روی با ضخامت 85 میکرومتر است. تحت شرایط معمول هوازدگی، در هر سال، حدود ۱ میکرومتر از ضخامت این لایه کم میشود و در نتیجه، تا ۸۵ سال حفاظت از خوردگی را برای چنین محصولاتی خواهیم داشت.
حفاظت کاتدی
حفاظت کاتدی به روشی برای ممانعت از خوردگی و تشکیل زنگ آهن در تاسیسات دفن شده در زیر زمین میگویند. در این روش، به کمک بار الکتریکی، واکنش الکتروشیمیایی را محدود میکنند. با بکارگیری درست این روش، عمل خوردگی به طور کامل متوقف خواهد شد. در شکل ساده حفاظت کاتدی، یک آند فداشونده به سیستم متصل میشود که بدینوسیله، آهن یا فولاد، نقش کاتد را در سلول الکتروشیمیایی ایفا میکنند.
پتانسیل الکترود در آند فداشونده نسبت به آهن یا فولاد باید منفیتر باشد. این آند به طور معمول از جنس روی، آلومینیوم یا منیزیم است. در نهایت، این آند فداشونده دچار خوردگی میشود. بنابراین لازم است تا آنها را به طور دورهای تعویض کنند.

رنگ زدن و پوشش
تشکیل زنگ آهن را میتوان به کمک پوششهایی همچون رنگ، لاکالکل، لایههایی از ورنی یا موم کنترل کرد چراکه با این کار، آهن را از محیط (هوا و رطوبت) جدا میکنیم. در کشتیها و خودروها که بخشهایی سربسته دارند، به کمک تزریق موادی بر پایه موم، آنها را در برابر خوردگی محافظت میکنند.
زمانی که برای مدت زمان کوتاهی به محافظت در برابر خوردگی نیاز داشته باشیم میتوان لایه نازکی از روغن، گریس یا مخلوطهای ویژهای را روی سطوح آهنی اعمال کرد. از این روش در حمل و نقل یا نگهداری محصولات استفاده میشود. همچنین، برای جلوگیری از تشکیل زنگ آهن در سطوح ماشینکاری شده و رشتههای فلزی از این روش استفاده میکنند. این ترکیبات به طور معمول شامل مخلوطی از گریس با پودر فلزاتی همچون مس، روی یا آلومینیوم هستند.
ممانعت کنندهها
به کمک برخی از «ممانعت کنندههای خوردگی» (Corrosion Inhibitors) در فاز گاز و ممانعت کنندههای فرار، میتوان در محفظههای عایق، از خوردگی جلوگیری کرد. البته این روش در محیطهای باز و در معرض جریان هوا کاربرد ندارد.
کنترل رطوبت
با کنترل رطوبت هوا، زنگ آهن قابل کنترل خواهد بود. نمونهای از این کار را میتوان در بستههای نمگیر حاوی سیلیکاژل مشاهده کرد که در کالاهای حمل و نقل شده با کشتی از آن بهره میگیرند.
از بین بردن زنگ آهن
مقادیر کم از زنگ آهن را میتوان به سادگی در یک کارگاه خانگی از بین برد. برای این کار به ابزارهای سادهای همچون سطل پلاستیکی پرشده از الکترولیت (محلول آب و سدیم کربنات) به همراه میلگرد نیاز دارید. میلگرد را به طور عمودی در سطل قرار دهید تا نقش آند فداشونده را ایفا کند. یک شارژر باتری نیز به عنوان منبع تغذیه نیاز دارید که قطب مثبت آنرا به آند وصل کنید تا قطب منفی متصل به ماده، نقش کاتد داشته باشد.
همچنین، زنگ آهن را میتوان به کمک مواد مخصوصی شامل فسفریک اسید یا «تانیک اسید» از بین برد. علاوه بر این، از طریق اسیدهای آلی همچون سرکه، سیتریک اسید یا اسیدهای قویتری مانند هیدروکلریک اسید، زنگ آهن از بین میرود. حتی به کمک محلول ملاس نیز میتوان زنگ آهن را از روی اشیا پاک کرد.
بررسی تاثیرات اقتصادی زنگ آهن
تشکیل زنگ آهن در تاسیسات و ابزارها، تجزیه و خوردگی آنها را به همراه دارد. با توجه به اینکه زنگ آهن، حجم بیشتری نسبت به جرم اصلی آهن دارد، تشکیل آن در سازهها به بخشهای مجاور نیرو وارد میکند. چنین پدیدهای سبب تخریب «پل میانوس» (Mianus River Bridge) در سال 1983 شد. علاوه بر این، فروریختن پل «سیلور بریج» (Silver Bridge) یا پل نقرهای در سال 1967 و کشته شدن 46 راننده به دلیل زنگ آهن رخ داده بود.
در سال 2003 نیز پل «کینزوا» (Kinzu) در پنسیلوانیا دچار ریزش شد. این ریزش در اثر گردباد بوجود آمد اما در حقیقت، پیچهای نگهدارنده ستون مرکزی پل زنگ زده بودند و پل، تنها بر اثر نیروی وزن خود بر روی زمین قرار گرفته بود.
سازههای شامل «بتن مسلح» (Reinforced Conceret) نیز در معرض تخریب بر اثر زنگ آهن قرار دارند. فشار داخلی که در اثر انبساط حاصل از خوردگی فولاد و آهن داخل بتن ایجاد میشود، پوسته پوسته شدن بتن و از بین رفتن سازه را به همراه دارد. این حالت از زنگ زدگی به عنوان عامل اصلی خرابی پلهای ساخته شده از بتن مسلح به شمار میآید.

زنگ آهن به عنوان نماد فرهنگی
زنگ آهن را به طور معمول به عنوان استعارهای از غفلت میشناسند چراکه در اثر زنگ زدن آهن، این فلز درخشان به یک شئ پوسته پوسته شده تبدیل میشود. بخشهایی از شمال، مرکز و میانه آمریکا که در آن، کارخانههای فولاد و صنایع خودروسازی قرار دارند، به دلیل مشکلات اقتصادی در دهه 1980، به «کمربند زنگار» (Rust Belt) معروف شدند. همچنین در موسیقی، ادبیات و هنر، زنگزدگی با تصاویری از غفلت، شکوه و جلالِ از بین رفته، فروپاشی و تخریب همراه است.
جمعبندی
در این آموزش به طور کامل به بررسی زنگ آهن و عوامل ایجاد آن پرداختیم. یاد گرفتیم که برای تشکیل زنگ آهن به سه عامل اکسیژن، آهن و رطوبت نیاز داریم. همچنین این پدیده را به دو شکل بررسی کردیم. در مرحله اول، واکنشهای زنگ آهن را به طور خلاصه و با زبانی ساده بیان کردیم و در ادامه، توصیف دقیقتری از این واکنشها ارائه دادیم. دیدیم که برای شناسایی زنگ آهن میتوان از روشهای طیفسنجی و همچنین محلولی موسوم به فروکسیل استفاده کرد.
پس از آشنایی با نحوه ایجاد زنگ آهن و واکنشهای آن، راههای جلوگیری از تشکیل زنگ آهن را بررسی کردیم که از آنجمله میتوان به حفاظت کاتدی اشاره کرد که در تاسیسات مدفون، مانع از ایجاد زنگ آهن میشود. در پایان نیز روشهای مختلف در از بین بردن زنگ آهن را بررسی و مثالهایی از اثرات تشکیل زنگآهن بر اقتصاد را بیان کردیم که شامل ریزش پلهای زنگزده و معرفی منطقهای موسوم به کمربند زنگار بود. البته فراموش نکنیم که این پدیده در ادبیات و هنر نیز به عنوان نمادی از غفلت و فروپاشی شناخته میشود.