جرم مولی عناصر جدول تناوبی — روش محاسبه + لیست — از صفر تا صد

جرم مولی عناصر، جرم یک مول ($$۶٫۰۲۲times۱۰^{۲۳}$$ اتم) از ماده یا عنصر برحسب گرم است. اتمهای عناصر مختلف حاوی تعداد متفاوتی پروتون، نوترون و الکترون هستند، بنابراین جرمهای متفاوتی دارند. جرم مولی از نظر عددی با جرم اتمی میانگین برابر است. در این مطلب از مجله فرادرس با مفاهیم مول و عدد آووگادرو آشنا میشوید و در پایان با انواع مثال میتوانید جرم مولی عناصر جدول تناوبی و ترکیبات گوناگون را محاسبه کنید.
جرم مولی عناصر چیست ؟
«جرم مولی» (Molar Mass) در سادهترین تعریف، جرم یک مول از عنصر است. کمترین مقدار نمونهای از مواد، حاوی مقدار زیادی اتم، یون یا مولکول است. حدود ۵ میلیلیتر آب (به اندازه قاشق چایخوری) $$۲times۱۰^{۲۳}$$ مولکول آب دارد که فراتر از درک و تصور است. به همین علت در شیمی برای شمارش و محاسبات چنین اعدادی از مول استفاده میکنند. با استفاده مول، جرم مولی عناصر را میتوان محاسبه کرد. برای درک بهتر جرم مولی بهتر است با مفهوم مول بیشتر آشنا شوید.
مول
در زندگی روزمره، از انواع واحدهای شمارش استفاده میکنیم. در شیمی برای شمارش اتمها، یونها یا مولکولها در نمونهای از مواد از مول استفاده میکنند. در دستگاه بینالمللی یکاها یا سیستم $$SI$$، مول تعداد اتمهای موجود در ۱۲ گرم از ایزوتوپ کربن-۱۲ تعریف شده است. تعداد واقعی اتم در ایزوتوپ کربن-۱۲ به عدد آووگادرو معروف است.

عدد آووگادرو
مقدار واقعی تعداد اتمها در یک مول، توسط دانشمندان $$۶٫۰۲۲۱۴۰۷۶times۱۱۰^{۲۳}$$ تعیین شد که بهخاطر تلاشهای دانشمند ایتالیایی «آمدئو آووگادرو» (Amedeo Avogadro) در گسترش نظریه مولکولی این عدد به نام آووگادرو نامگذاری شده است. عدد آووگادرو به صورت $$N_A$$ نمایش داده میشود.
$$N_A=۶٫۰۲۲۱۴۰۷۶times۱۱۰^{۲۳}$$
در محاسبات، این عدد به صورت گرد شده استفاده میشود که برابر است با:
$$N_A=۶٫۰۲۲times۱۰^{۲۳}$$
با این تعریف، وقتی بیان میشود که ۱ مول مس یعنی $$۶٫۰۲۲times۱۰^{۲۳}$$ اتم مس داریم که برابر با ۶۳٫۵۴۶ گرم مس است.
۱ مول مس $$=$$ $$۶٫۰۲۲times۱۰^{۲۳}$$ اتم مس $$=$$ ۶۳٫۵۴۶ گرم مس
فرمول جرم مولی
جرم مولی عناصر از رابطه زیر بهدست میآید. در سیستم $$SI$$ واحد جرم مولی کیلوگرم بر مول $$(kg/mol)$$ است ولی معمولا برحسب گرم بر مول $$(g/mol)$$ بیان میشود.
$$M =\frac{m}{n}$$
- $$M$$: جرم مولی
- $$m$$: جرم ماده
- $$n$$: مول ماده
جرم اتمی میانگین چیست ؟
جرم مولی از نظر عددی با جرم اتمی میانگین برابر است. جرم اتمی یا وزن اتمی، جرم یک اتم است که با واحد جرم اتمی $$(amu)$$ تعریف میشود. یکای جرمی اتمی یا $$۱amu$$ برابر با یکدوازدهم جرم اتم کربن-۱۲ تعریف شده است.
$$۱\,a.m.u=\frac{۱}{۱۲}C_{۱۲}$$
یکدوازدهم جرم اتم کربن-۱۲ برابر با $$ ۱٫۶۶۰۵۳۹۰۶۶۶۰×۱۰^{−۲۷}$$ کیلوگرم است. برای مثال، جرم اتمی کلر برابر با $$۳۵٫۵\,amu$$ است، پس ۱ مول کلر ۳۵٫۵ گرم جرم دارد یا وزن ۱ مول کلر برابر با ۳۵٫۵ گرم است. جرم اتمی برخی عناصر به ترتیب زیر است:
- ۱ مول لیتیم $$=$$ ۶٫۹۴۱ گرم
- ۱ مول کبالت $$=$$ ۵۸٫۹۳۳۲ گرم
- ۱ مول قلع $$=$$ ۱۱۸٫۶۹ گرم
- ۱ مول ید $$=$$ ۱۲۶٫۹۰۴۵ گرم
- ۱ مول جیوه $$=$$ ۲۰۰٫۵۹ گرم
- ۱ مول اورانیوم $$=$$ ۲۳۸٫۰۲۹ گرم
جرم مولی عناصر معروف جدول تناوبی
در جدول زیر جرم مولی برخی از معروفترین عنصرهای جدول تناوبی که در محاسبات کاربردهای زیادی دارند فهرست شده است. در محاسبات معمولی، جرم مولی تا دو رقم اعشار گرد میشود.
| جرم مولی عناصر | ||
|---|---|---|
| عنصر | نماد | جرم اتمی (u) |
| آلومینیوم | Al | ۲۶٫۹۸۱۵۳۹ |
| آهن | Fe | ۵۵٫۸۴۵ |
| آرگون | Ar | ۳۹٫۹۴۸ |
| اکسیژن | O | ۱۵٫۹۹۹۰۳ |
| بور | B | ۱۰٫۸۱۱ |
| پتاسیم | K | ۳۹٫۰۹۸۳ |
| روی | Zn | ۶۵٫۳۸ |
| سدیم | Na | ۲۲٫۹۸۹۷۶۹ |
| سیلیسیم | Si | ۲۸٫۰۸۵۵ |
| طلا | Au | ۱۹۶٫۹۶۶۵۷ |
| فسفر | P | ۳۰٫۹۷۳۷۶۲ |
| فلوئور | F | ۱۸٫۹۹۸۴۰۳ |
| کلسیم | Ca | ۴۰٫۰۷۸ |
| گوگرد | S | ۳۲٫۰۶۵ |
| مس | Cu | ۶۳٫۵۴۶ |
| منیزیم | Mg | ۲۴٫۳۰۵ |
| نئون | Ne | ۲۰٫۱۷۹۷ |
| نقره | Ag | ۱۰۷٫۸۶۸۲ |
| نیتروژن | N | ۱۴٫۰۰۶۷ |
| نیکل | Ni | ۵۸٫۶۹۳۴ |
برخی از عناصر در طبیعت بهشکل تکاتمی یافت نمیشوند و دواتمی هستند. به عنصرهای دواتمی عنصر مولکولی گفته میشود. برای محاسبه جرم مولی یک عنصر دواتمی، جرم اتمی آن در دو ضرب میشود. در جدول زیر جرم مولی عناصر دواتمی فهرست شده است.
| جرم مولی عناصر دواتمی | ||
|---|---|---|
| عنصر | فرمول | جرم مولی $$(g/mol)$$ |
| گاز اکسیژن | $$O_2$$ | ۳۱٫۹۹۹ |
| گاز نیتروژن | $$N_2$$ | ۲۸٫۰۱۴ |
| گاز هیدروژن | $$H_2$$ | ۲٫۰۱۶ |
| گاز فلوئور | $$F_2$$ | ۳۷٫۹۹۶۸۰۶ |
| گاز کلر | $$Cl_2$$ | ۷۰٫۹۰۶ |
| برم | $$Br_2$$ | ۳۱۹٫۶۱۶ |
| ید | $$I_2$$ | ۲۵۳٫۸۰۸۹۴ |
همچنین فسفر بهطور معمول بهشکل چهاراتمی و گوگرد و سیلیسیم بهشکل هشتاتمی وجود دارند.
جرم مولی عناصر چگونه محاسبه میشود ؟
برای نمونه، نحوه محاسبه جرم مولی عناصر در زیر توضیح داده شده است.
جرم مولی گوگرد
گوگرد $$(S)$$ عنصر نافلزی است که در زغالسنگ یافت میشود. با سوختن زغالسنگ، گوگرد موجود در آن به گوگرد دیاکسید $$(SO_۲)$$ و در نهایت به سولفوریک اسید تبدیل میشود که پدیده باران اسیدی را بهوجود میآورد. گوگرد خالص طبیعی $$(S_۸)$$ از هشت اتم $$S$$ تشکیل شده که در یک حلقه به هم متصل شدهاند.
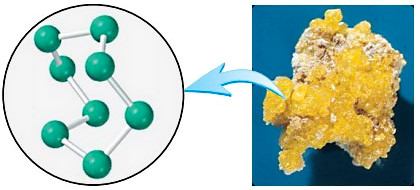
جرم مولی گوگرد خالص طبیعی و همچنین تعداد اتمهای موجود در ۱۶٫۳ گرم از آن را محاسبه کنید؟
- فرمول گوگرد خالص: $$S_۸$$
- جرم اتمی گوگرد: ۳۲٫۰۶۵
$$ = ۸times(S) = ۸times(۳۲٫۰۶۵)$$
$$=۲۵۶٫۵۲$$
برای بهدست آوردن تعداد اتم گوگرد در ۱۶٫۳ گرم، ابتدا باید مقدار گرم به مول تبدیل شود. با بهدست آوردن مقدار مول، آن را به تعداد ذرات یا اتمها تبدیل کرد.
$$۱\,mol\,S = ۳۲٫۰۷\,g\,S$$
بنابراین ۱ مول گوگرد برابر با ۳۲٫۰۷ گرم گوگرد و همچنین $$۶٫۰۲۲times۱۰^{۲۳}$$ اتم گوگرد است. تعداد اتم گوگرد در ۱۶٫۳ گرم از این عنصر از رابطه زیر به دست میآید:
$$۱۶٫۳\,require {cancel} cancel {g\,S}\times \frac{۱\, require {cancel} cancel {mol\,S}}{۳۲٫۰۷\,require {cancel} cancel {g\,S}}timesfrac{N_AS}{۱\,require {cancel} cancel {mol\,S}}$$
$$=۳٫۰۶times۱۰^{۲۳}\,S$$
پس در ۱۶٫۳ گرم گوگرد ، $$۳٫۰۶times۱۰^{۲۳}$$ اتم گوگرد وجود دارد.
جرم مولی گاز نیتروژن
نیتروژن از عناصر گروه ۱۵، نافلز و گازی دواتمی است که رنگ و بویی ندارد. گاز نیتروژن $$(N_۲)$$ نزدیک به ۷۹٪ از جو زمین و هوایی که تنفس میکنیم و بسیاری از ترکیبات زیستی مانند آمینو اسیدها و نوکلئیک اسیدها را تشکیل داده است. بسیاری از ترکیبات مهم صنعتی مانند آمونیاک، نیتریک اسید، نیتراتهای آلی و سیانورها حاوی نیتروژن هستند.

محاسبه کنید که در ۳ مول گاز نیتروژن، چند اتم نیتروژن وجود دارد؟
- جرم اتمی نیتروژن: ۱۴٫۰۰۶۷
هر مول گاز نیتروژن $$(N_۲)$$ از دو اتم N تشکیل شده است. پس ۳ مول گاز نیتروژن در واقع شامل ۶ اتم نیتروژن است.
$$۱\,mol = ۶٫۰۲۲times۱۰^{۲۳}$$
بنابراین:
$$۶\,require {cancel} cancel {mol\,N} \times \frac{۶٫۰۲۲times۱۰^{۲۳}\,N}{۱\,require {cancel} cancel {mol\,N}}$$
$$=۶times۶٫۰۲۲times۱۰^{۲۳}\,N$$
جرم مولکولی عناصر چیست ؟
جرم مولکولی یا جرم مولی یک ترکیب مولکولی که همچنین وزن مولکولی نیز نامیده میشود مجموع جرمهای اتمهای تشکیلدهنده مولکول است یا مجموع حاصلضرب تعداد اتمها در جرم اتمی هر عنصر است. جرم مولکولی آن به صورت زیر محاسبه میشود.
$$n_۱(M_۱)+n_۲(M_۲)+n_۳(M_۳)+...$$
- $$M$$: جرم اتمی عنصر
- $$n$$: تعداد عنصر در مولکول
برای مثال، آمونیاک بر اساس واکنش زیر تهیه میشود. در این واکنش برای تهیه آمونیاک به ۱ مول نیتروژن نیاز است. باید توجه داشت که در اینجا ۱ مول نیتروژن در واقع ۱ مول مولکول نیتروژن $$(N_۲)$$ است نه ۱ مول اتم نیتروژن! زیرا نیتروژن بهطور طبیعی بهشکل $$N_۲$$ وجود دارد. در چنین مواردی بهتر است فرمول شیمیایی عنصر نوشته شود تا ابهامی رخ ندهد.
$$N_{2(g)}+ 3H_{2(g)}\rightleftharpoons 2NH_{3(g)}$$
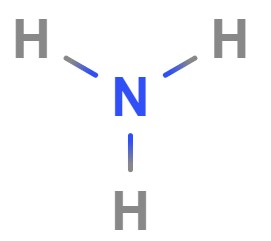
جرم مولی آمونیاک: آمونیاک از ترکیب عنصرهای هیدروژن و نیتروژن ساخته میشود. مجموع جرم مولی عناصر تشکیلدهنده آن بهصورت زیر است.
- فرمول مولکولی آمونیاک: $$NH_۳$$
- جرم اتمی هیدروژن: ۱٫۰۰۷۹۴
- جرم اتمی نیتروژن: ۱۴٫۰۰۶۷
$$ = ۱times(N) + ۳times(H)$$
$$ = ۱times(۱۴٫۰۰۶۷) + ۳times(۱٫۰۰۷۹۴)$$
$$=۱۷٫۰۳۱$$
با توجه به جرم مولی عناصر و تعداد آنها در فرمول مولکولی آمونیاک جرم مولکولی آن برابر با ۱۷٫۰۳۱ گرم بر مول است.
جرم مولی آب: فرمول مولکولی آب، $$H_۲O$$ است. مولکول آب از ۲ اتم هیدروژن و یک اتم اکسیژن تشکیل شده است.
-
- فرمول مولکولی آب: $$H_۲O$$
- جرم اتمی هیدروژن: ۱٫۰۰۷۹۴
- جرم اتمی اکسیژن: ۱۵٫۹۹۹۰۳
$$ = ۲times(H) + ۱times(O)$$
$$ = ۲times(۱٫۰۰۷۹۴) + ۱۵٫۹۹۹۴ = ۱۸٫۰۱۵۳$$

پس جرم مولکولی آب برابر با ۱۸٫۰۱ است.
جرم مولی سدیم کلرید: جرم مولی ترکیبات یونی نیز مانند ترکیبات مولکولی محاسبه میشود. برای مثال جرم مولی نمک خوراکی $$(NaCl)$$ که از دو عنصر سدیم و کلر تشکیل شده است به صورت زیر محاسبه میشود.
- فرمول مولکولی نمک: $$NaCl$$
- جرم اتمی سدیم: ۲۲٫۹۸۹۸
- جرم اتمی کلر: ۳۵٫۴۵۲۷
$$ = ۱times(Na) + ۱times(Cl)$$
$$= (۲۲٫۹۸۹۸) + (۳۵٫۴۵۲۷) = ۵۸٫۴۴۲۵$$
جرم مولی اتانول: اتانول از ترکیب شیمیایی آلی است که به اختصار $$EtOH$$ نوشته میشود. اتانول مایعی فرار، اشتعالپذیر، بیرنگ و با عطری تند است که بهطور طبیعی از تخمیر قندها و «آبدهی» (Hydration) اتیلن تولید میشود. اتانول برای ضدعفونی کردن وسایل در پزشکی، حلال شیمیایی در سنتز ترکیبات آلی در آزمایشگاه و همچنین برای سوخت کاربرد دارد.

جرم مولی اتانول که از ترکیب عنصرهای هیدروژن، اکسیژن و کربن تشکیل شده بهصورت زیر محاسبه میشود.
- فرمول مولکولی اتانول: $$C_۲H_۵OH$$
- جرم اتمی هیدروژن: ۱٫۰۰۷۹۴
- جرم اتمی اکسیژن: ۱۵٫۹۹۹۰۳
- جرم اتمی کربن: ۱۲٫۰۱۱
$$ = ۲times(C) + ۶times(H)+ ۱times(O)$$
$$ = ۲times(۱۲٫۰۱۱) + ۶times(۱٫۰۰۷۹۴)+ ۱times(۱۵٫۹۹۹۰۳)$$
$$ =۴۶٫۰۷$$
جرم مولی استیک اسید: استیک اسید، اسیدی بیرنگ و جزء اصلی سرکه است. این اسید از کربوکسیلیک اسیدهای ساده است که در تولید «سلولز استات» (Cellulose Acetate)، «پلیوینیل استات» (Polyvinyl Acetate) استفاده میشود. استیک اسید از اسیدهای ضعیف در صنایع غذایی برای چاشنی و تنظیمکننده اسیدیته کاربرد دارد.

جرم مولی استیک اسید بهصورت زیر محاسبه میشود.
- فرمول مولکولی استیک اسید: $$CH_۳COOH$$
- جرم اتمی هیدروژن: ۱٫۰۰۷۹۴
- جرم اتمی اکسیژن: ۱۵٫۹۹۹۰۳
- جرم اتمی کربن: ۱۲٫۰۱۱
$$ = ۲times(C) + ۴times(H)+ ۲times(O)$$
$$ = ۲times(۱۲٫۰۱۱) + ۴times(۱٫۰۰۷۹۴)+ ۲times(۱۵٫۹۹۹۰۳)$$
$$ =۶۰٫۰۵۲$$
جرم مولی سدیم سولفات: سدیم سولفات جامدی سفیدرنگ، محلول در آب و از ترکیات معدنی است. سدیم سولفات از ترکیبات پرکاربرد در صنایع شیمیایی است که در مواد و پودرهای شوینده استفاده میشود.
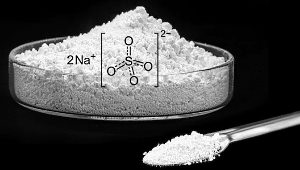
سدیم سولفات از عنصرهای سدیم، اکسیژن و گوگرد تشکیل میشود. محاسبه جرم مولی این ترکیب بهصورت زیر است.
- فرمول مولکولی سدیم سولفات: $$Na_۲SO_۴$$
- جرم اتمی سدیم: ۲۲٫۹۸۹۷۶۹
- جرم اتمی اکسیژن: ۱۵٫۹۹۹۰۳
- جرم اتمی گوگرد: ۳۲٫۰۶۵
$$ = ۲times(Na) + ۱times(S)+ ۴times(O)$$
$$ = ۲times(۲۲٫۹۸۹۷۶۹) + ۱times(۳۲٫۰۶۵)+ ۴times(۱۵٫۹۹۹۰۳)$$
$$ =۱۴۲٫۰۴$$
در جدول زیر جرم مولی برخی از ترکیبات مهم فهرست شده است. جرم مولی ترکیبات به صورت جرم مولکولی بر حسب گرم بر مول بیان میشود.
| جرم مولی ترکیبات مهم | ||
|---|---|---|
| ترکیب | فرمول | جرم مولکولی $$(g/mol)$$ |
| آمونیاک | $$NH_3$$ | ۱۷٫۰۳ |
| آب | $$H_2O$$ | ۱۸٫۰۱ |
| اتانول | $$C_2H_5OH$$ | ۴۶٫۰۷ |
| استیک اسید | $$CH_3COOH$$ | ۶۰٫۰۵ |
| سدیم سولفات | $$Na_2SO_4$$ | ۱۴۲٫۰۴ |
| سدیم کربنات | $$Na_2CO_3$$ | ۱۰۵٫۹۸ |
| سدیم کلرید | $$NaCl$$ | ۵۸٫۴۴ |
| سدیم هیدروکسید | $$NaOH$$ | ۳۹٫۹۹ |
| سولفوریک اسید | $$H_2SO_4$$ | ۹۸٫۰۷ |
| کربن دیاکسید | $$CO_2$$ | ۴۴٫۰۱ |
| گلوکز | $$C_6H_{12}O_6$$ | ۱۸۰٫۱۵ |
| نیتروگلیسیرین | $$C_3H_5N_3O_9$$ | ۲۲۷٫۰۸ |
| نیتریک اسید | $$HNO_3$$ | ۶۳٫۰۱ |
مثال: «ژوگلان» (Juglone) یا (۵-هیدروکسی-۱و۴-نفتاکینون) ترکیبی فنولی است که در پوست، ریشه، شاخه، برگ، گل و گرده گردو وجود دارد و رنگی سیاه ایجاد میکند. این ترکیب همچنین علفکشی طبیعی است که مانع رشد دیگر گیاهان رقیب اطراف درخت گردو میشود.
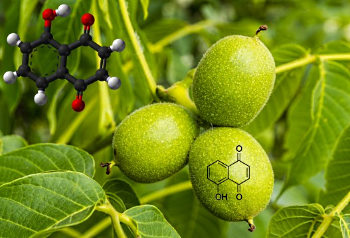
فرمول شیمیایی ژوگلان $$C_{۱۰}H_۶O_۳$$ است.
- الف: جرم مولی ژوگلان را به دست آورید.
- ب: نمونهای $$۱٫۵۶times۱۰^{-۲}$$ گرمی از ژوگلان خالص که از پوسته گردو استخراج شده چند مول است؟
پاسخ:
الف:
- فرمول مولکولی ژوگلان: $$C_{۱۰}H_۶O_۳$$
- جرم اتمی هیدروژن: ۱٫۰۰۷۹۴
- جرم اتمی اکسیژن: ۱۵٫۹۹۹۰۳
- جرم اتمی کربن: ۱۲٫۰۱۱
$$ = ۱۰times(C) + ۶times(H)+ ۳times(O)$$
$$ = ۱۰times(۱۲٫۰۱۱) + ۶times(۱٫۰۰۷۹۴)+ ۳times(۱۵٫۹۹۹۰۳)$$
$$ = ۱۷۴٫۱۵۵$$
پس جرم مولی این ترکیب برابر با $$۱۷۴٫۱۵۵$$ است.
ب: حال با استفاده از مقدار جرم مولی ترکیب میتوان، مقدار مول $$۱٫۵۶times۱۰^{-۲}$$ گرم از ژوگلان خالص را بهصورت زیر محاسبه کرد.
$$۱٫۵۶times۱۰^{-۲}require {cancel} cancel {g}timesfrac{۱\,mol}{۱۷۴٫۱require {cancel} cancel {\,g}}$$
$$=۸٫۹۶times۱۰^{-۵}\,mol$$
پس $$۱٫۵۶times۱۰^{-۲}$$ گرم از ژوگلان خالص برابر $$۸٫۹۶times۱۰^{-۵}\,mol$$ مول از این ترکیب است.
نمونه سوال تستی جرم مولی عناصر
در پایان میتوانید با سنجش خود متوجه شوید که آیا مفهوم جرم مولی عناصر را به خوبی درک کردهاید یا به مطالعه بیشتر نیاز دارید.
سوالات متداول
در این مطلب چگونگی محاسبه جرم مولی عناصر جدول تناوبی را آموختیم. در ادامه، به برخی از پرسشهای رایج در این مورد پاسخ داده شده است.
جرم مولی گرافیت چیست ؟
گرافیت یکی از دگرشکلهای کربن است. جرم مولی کربن و گرافیت یکسان و برابر با ۱۲ گرم بر مول است.
amu چیست ؟
جرم یک ایزوتوپ کربن-۱۲ برابر با عدد ۱۲ است. اگر این عدد را به ۱۲ بخش یکسان تقسیم شود، هر بخش را ۱amu مینامند که به آن یکای جرمی اتمی نیز میگویند. از این مقیاس برای اندازهگیری جرم اتمها استفاده میشود.











سلام تسیار خوب بود. ممنون