ترکیب یونی در شیمی — به زبان ساده

در علم شیمی، ترکیب یونی به ترکیبی شیمیایی میگویند که از یونهایی در کنار هم تشکیل شده باشد و این امر توسط پیوند یونی امکانپذیر خواهد بود. یک ترکیب یونی، به طور کلی خنثی اما شامل بارهایی مثبت و منفی به نام کاتیون و آنیون است. یونها در یک ترکیب یونی به طور معمول، چندین یون در همسایگی خود دارند اما آنها را نمیتوان بخشی از یک مولکول در نظر گرفت بلکه بخشی از شبکه به هم پیوسته سهبعدی در ساختار یک بلور را تشکیل میدهند.
تعریف ترکیب یونی
«ترکیب یونی» (Ionic Compound) به جامد بلوری میگویند که از قرارگیری یونهایی منظم با بار مخالف تشکیل شده باشد. این ترکیبات به طور معمول به هنگام واکنش فلزات با نافلزات شکل میگیرند. به بیان سادهتر، ترکیباتی که پیوندهای یونی در کنار یکدیگر قرار گرفتهاند را می توان در دسته ترکیبات یونی طبقهبندی کرد.
اگر با آرایش الکترونی و قاعده اکتت (هشتتایی) آشنا باشید میدانید که عنصرها با گرفتن یا از دست دادن الکترونها، به آرایش الکترونی گاز نجیب قبل یا بعد از خود میرسند چراکه با این کار، در نهایت پایدار میشوند.
در واکنش بین یک فلز با نافلز، فلزات برای تکمیل آرایش الکترونی و پیروی از قاعده اکتت، الکترون از دست میدهند و به طور مشابه نیز نافلزات، الکترون جذب میکنند. همانطور که گفته شد، واکنش فلزات با نافلزات سبب تشکیل ترکیبات یونی میشود.
ساختار ترکیب یونی
ساختار یک ترکیب یونی به اندازه نسبی کاتیونها و آنیونهای آن وابسته است. ترکیبات یونی شامل نمکها، اکسیدها، هیدروکسیدها، سولفیدها و بسیاری از ترکیبات معدنی هستند. لازم به ذکر است که جامدهای یونی به کمک نیروی جاذبه بین یونهای مثبت و منفی نگه داشته شدهاند.
به طور مثال، یونهای سدیم، یونهای کلر را جذب و یونهای کلر، یونهای سدیم را جذب میکنند. نتیجه این اتفاق، ساختار سهبعدی و متناوب یونهای سدیم و کلر موسوم به ترکیب یونی سدیم کلرید است. این بلور به لحاظ بار الکتریکی، خنثی در نظر گرفته میشود چراکه تعداد یونهای سدیم در این بلور با تعداد یونهای کلر برابر هستند و این نیروهای جاذبه بین یونها، سبب نگهداری آنها در شبکه بلور این ترکیب یونی شده است.
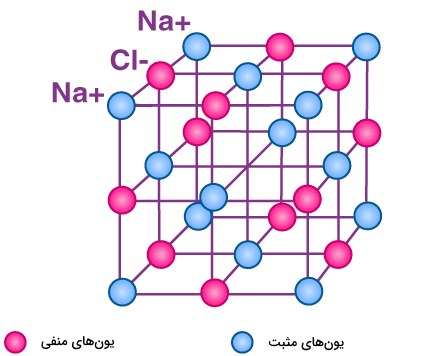
چنین پیوندهای یونی بین ذرات باردار، ساختار عظیمی از یونها را بوجود میآورد. از آنجایی که این یونها با قدرت زیادی در کنار یکدیگر قرار گرفتهاند، انرژی زیادی برای شکستن تمامی پیوندهای آن مورد نیاز است. به همین دلیل، یک ترکیب یونی نقطه ذوب و جوش بالایی دارد.
مثال ترکیب یونی
در ادامه، چند نمونه ترکیب یونی را بررسی خواهیم کرد. به طور مثال، واکنش بین منیزیم و کلر را در نظر بگیرید. با نگاهی به جدول تناوبی میبینیم که اتم منیزیم در خارجیترین لایه خود دو الکترون دارد. با از دست دادن دو الکترون، اتم منیزیم به آرایش گاز نجیب قبل از خود میرسد. در این حالت، هسته اتم منیزیم، همچنان دارای ۱۲ پروتون است اما تعداد الکترونها به تعداد ۱۰ الکترون کاهش پیدا میکنند. بار مثبت ایجاد شده در اثر این اختلاف، سبب میشود تا یون منیزیم را به صورت بنویسیم.
در طرف دیگر، اتم کلر در خارجیترین لایه خود ۷ الکترون دارد و بنابراین تنها به یک الکترون نیاز دارد تا قاعده اکتت را تکمیل کند و به پایداری برسد. این یک الکترون میتواند از طریق اتم منیزیم در بالا تامین شود. از آنجایی که اتم منیزیم دو الکترون از دست میدهد اما اتم کلر تنها به یک الکترون نیاز دارد، در نتیجه دو اتم کلر با یک اتم منیزیم برای تشکیل ترکیب یونی منیزیم کلرید با یکدیگر ترکیب میشوند.
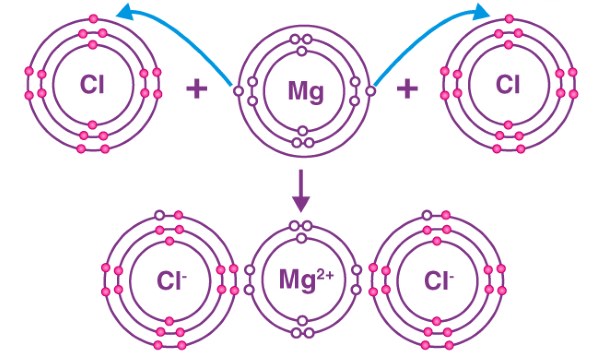
بر اساس مثال بالا، ترکیبات یونی را میتوان به صورت ترکیبات تشکیل شده حاصل از داد و ستد الکترونها بین فلز و نافلز تعریف کرد. پیوند حاصل از این فرآیند را نام پیوند یونی میشناسند. به دلیل حضور یونهایی با بار مخالف، ترکیبات یونی توسط نیروهای جاذبه الکترواستاتیک در کنار یکدیگر قرار گرفتهاند.
خواص ترکیبات یونی
در ادامه به بررسی خواص ترکیب یونی میپردازیم.
خواص فیزیکی ترکیبات یونی
به دلیل وجود نیروهای قوی جاذبه بین بارهای مثبت و منفی، ترکیبات یونی، جامد هستند و به سختی شکسته میشوند. به طور کلی، این ترکیبات، شکننده هستند و در اثر اعمال فشار، به قطعات کوچکتر شکسته و خرد خواهند شد.
نقطه ذوب و جوش ترکیب یونی
همانند قبل، به دلیل نیروهای جاذبه الکترواستاتیک بین یونها، برای شکستن یک ترکیب یونی به انرژی زیادی نیاز داریم و به همین دلیل، ترکیبات یونی، نقطه ذوب و جوش بالایی دارند.
انحلال پذیری ترکیب یونی
ترکیبات یونی به طور کلی در محلولهای قطبی همچون آب، انحلالپذیر هستند و این انحلالپذیری در محلولهای ناقطبی مانند بنزین و گازوییل، کاهش پیدا میکند.
هدایت الکتریکی ترکیبات یونی
ترکیبات یونی در حالت جامد، الکتریسیته را از خود عبور نمیدهند اما در حالت مذاب و بهصورت محلول در آب، هادی خوب جریان الکتریکی هستند. هدایت الکتریکی شامل جریان بار از یک بخش به بخش دیگر است. در حالت جامد، به دلیل اینکه حرکت یونها امکانپذیر نیست، ترکیبات یونی هدایت الکتریکی نخواهند داشت. اما در حالت مذاب و محلول، به دلیل امکان جابجایی یونها، هدایت الکتریکی نیز امکانپذیر خواهد بود.
ترکیب یونی دوتایی
ترکیبات یونی که تنها شامل دو اتم باشند، ترکیبات یونی دوتایی نام دارند که یک اتم، فلز با انرژی یونش پایین و دیگری نافلز با الکترونگاتیوی بالا است. با وجود اینکه فلزات به طور کلی انرژی یونش پایینی دارند اما این میزان انرژی کم در همه آنها به میزان کافی پایین نیست تا با بسیاری از نافلزات، ترکیب یونی دوتایی تشکیل دهند. به عنوان یک قانون کلی، تمامی ترکیبات دوتایی شامل فلزاتی از گروههای ۱،۲،۳، لانتانید ها و اکتینیدها، ترکیب یونی تشکیل میدهند. البته هیدروژن، فلز نیست و نوعی استثنا در این قانون به شمار میآید.
همچنین، برلیم با انرژی یونش ۸۹۹ کیلوژول بر مول، انرژی بالایی برای تشکیل ترکیب یونی دارد و در این قانون قرار نمیگیرد. فلزات واسطه در سمت راست گروه ۳ جدول تناوبی، ترکیبات دوتایی زیادی را تشکیل میدهند که شامل ترکیبات کووالانسی نیز هستند و نمیتوان آنها را در این قانون قرار داد.
نافلزات در ترکیب با یکدیگر، ترکیبات کووالانسی را تشکیل میدهند. به همین دلیل، حضور یک نافلز در ترکیب، تضمین کننده یونی بودن ترکیب نیست.
ترکیب یونی چندتایی
زمانی که در ترکیبات یونی از یونهای چنداتمی استفاده شود، تعداد ترکیبات یونی افزایش پیدا میکند. این نوع از ترکیبات یونی که شامل یونهای چنداتمی هستند را با نام ترکیبات یونی چندتایی میشناسند. بسیاری از ترکیبات یونی، شامل یونهای چنداتمی هستند. از نمونههای شناختهشده این ترکیبات یونی دوتایی میتون به کلسیم کربنات با فرمول و آمونیوم نیترات اشاره کرد. در مطلب «یون چیست؟ — به زبان ساده (+ دانلود فیلم آموزش رایگان)» جدول کاملی از کاتیونها و آنیونهای چنداتمی آورده شده است.
خواص ترکیبات شامل یونهای چنداتمی، بسیار مشابه ترکیبات یونی دوتایی است. یونها در شبکهای بلوری توسط نیروهای جاذبه الکترواستاتیک در کنار یکدیگر قرار گرفتهاند و پس از ذوب، هدایت الکتریکی خواهند داشت.
ترکیب یونی چندتایی در بیشتر موارد در آب انحلالپذیر است. به طور کلی، یونهای چنداتمی بیرنگ هستند البته یا با داشتن فلزات واسطه، ترکیباتی رنگی را تشکیل میدهند. لازم به ذکر است که ترکیبات شامل یونهای چنداتمی باید به لحاظ الکتریکی خنثی باشند. به طور مثال، در بلور کلسیم سولفات، باید تعداد برابر از یونهای کلسیم و سولفات داشته باشیم تا موازنه بار برقرار باشد. در نتیجه، فرمول این ترکیب، است.
اما در مقابل، یون سدیم دارای یک بار مثبت است و ، دو بار مثبت دارد و بنابراین در ترکیب سدیم سولفات، به دو یون سدیم نیاز داریم و فرمول ترکیب به صورت خواهد بود.
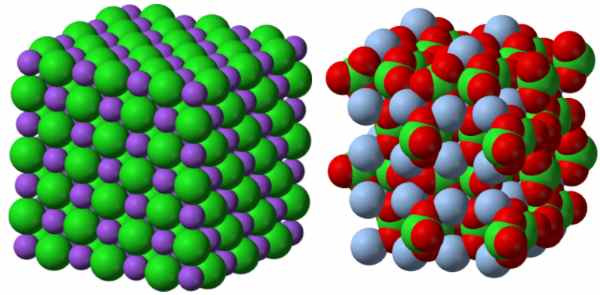
به لحاظ ساختاری یونهای چنداتمی مشابه جامدهای یونی هستند. در طرف چپ تصویر زیر، ساختار نشان داده شده و در طرف راست، ساختار پیچیدهتر نقره کلرات با فرمول نمایش داده شده است. در هر دو ساختار، شبکهای مستحکم با الگویی تکراری مشاهده میشود.
نام گذاری ترکیب یونی
حال که با ترکیبات یونی آشنا شدیم، میخواهیم نحوه نامگذاری ترکیب یونی را بررسی کنیم. به طور خلاصه، یک ترکیب یونی در ابتدا با نام کاتیون و سپس با نام آنیون آن نامگذاری میشود. کاتیون، نامی همانند عنصر خود دارد و به نام آنیون، پسوند «ید» را اضافه میکنیم. به طور مثال، ترکیب یونی به صورت پتاسیم فلوئورید نامگذاری میشود.
درصورتیکه کاتیون یا آنیون، یونی چنداتمی باشد از نام یون چنداتمی برای نامگذاری ترکیب یونی استفاده میکنیم. به طور مثال، ترکیب موسوم به کلسیم نیترات است.
برای کاتیونهایی مثل مس که ظرفیتهای مختلفی دارند، از اعداد رومی بعد از نام کاتیون استفاده میکنیم. به طور مثال، نام ترکیب را به صورت مس (II) نیترات مینویسم. البته در برخی موارد از نام معمول این ترکیبات نیز استفاده میشود که در جدول زیر، نام سیستماتیک و نام متداول ترکیبات یونی مختلف به همراه فرمول شیمیایی آنها آورده شده است.
| فرمول | نام علمی | نام متداول |
| مس (I) کلرید | کوپرو کلرید | |
| مس (II) کلرید | کوپریک کلرید | |
| جیوه (I)کلرید | مرکورو کلرید | |
| جیوه (II) اکسید | مرکوریک کلرید | |
| آهن (II) سولفید | فرو اکسید | |
| آهن (III) سولفید | فریک اکسید |












ترکیبات یونی در حالت محلول هم رسانای جریان الکتریکی هستند این رو هم اضف کنید، چون فقط به حالت مذاب اشاره شده و میتونه توی امتحانات برای ما دردسر ساز باشه
سلام و وقت شما بهخیر؛
ترکیبات یونی هم در حالت مذاب و هم بهصورت محلول در آب به دلیل داشتن توانایی حرکت یونها، هادی بسیار خوبی هستند.
با تشکر از همراهی شما دوست عزیز با مجله فرادرس.
چند نوع ترکیب یونی داریم؟ مثلاً نمکها یه نوع از ترکیبات یونیاند.
سلام و روز شما بهخیر؛
ترکیبهای یونی را میتوان در دو دسته زیر گنجاند:
۱) ترکیبی که از دو اتم به شکل یون تشکیل شده باشد. مثالی از این مورد ترکیب یونی سدیم کلرید با فرمول شیمیایی NaCl است که از دو یون Na+ و Cl− به وجود میآيد.
۲) دسته دوم ترکیبی از یک یون اتمی و یک یون چند اتمی است. مثالی از این مورد ترکیب یونی پتاسیم فسفات با فرمول شیمیایی K3PO4 است که از یون اتمی K+ و یون چند اتمی PO43− به وجود میآيد.
خوشحالیم که با مجله فرادرس همراه هستید.