عوامل موثر بر قدرت اسید و باز — به زبان ساده

در بحثهای قبلی مجله فرادرس در خصوص قدرت اسید صحبت کردیم. در ادامه قصد داریم تا به بررسی عوامل موثر بر قدرت اسید و باز بپردازیم. در حقیقت، قصد داریم تا از دانش خود در خصوص ساختارهای آلی برای درک واکنشپذیری در ترکیبات آلی استفاده کنیم.
اثرات ساختاری بر قدرت اسید و باز
برای بررسی قدرت اسید و باز باید عوامل مختلفی را بررسی کنیم. این عوامل در زیر آورده شدهاند:
- روندهای تناوبی
- اثر رزونانس
- اثر القایی
- اثر هیبریداسیون
این عوامل را در ادامه مورد بررسی قرار خواهیم داد:
روندهای تناوبی
در ابتدا، اتمها را جداگانه بررسی میکنیم و روندهای تناوبی مرتبط با محل آنها در جدول تناوبی را مورد بررسی قرار خواهیم داد. همچنین، از ترکیبات ساده آلی همچون اتان، متیلآمین و اتانول بهره میگیریم. البته این مفهوم را میتوان در خصوص مولکولهای زیستی پیچیدهتر مانند زنجیره جانبی آمینو اسیدها نیز بکار برد. تصویر زیر، تاثیر روندهای تناوبی بر قدرت اسید و باز را نشان میدهد:
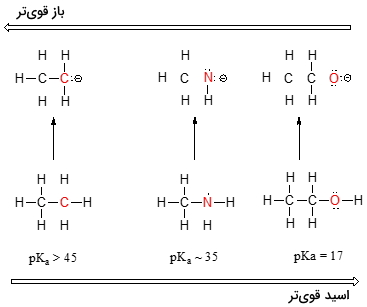
در این تصویر، روند مشخصی را در خصوص قدرت اسیدی پیدا میکنیم به گونهای که با حرکت از چپ به راست در طول تناوب دوم، قدرت اسیدی از کربن به نیتروژن و سپس اکسیژن، افزایش پیدا میکند. برای درک بهتر این روند باید باز مزدوج هر یک از این ترکیبات آلی را بررسی کنیم. هر قدر باز پایدارتر (ضعیفتر) باشد، اسید قویتری خواهیم داشت. به بار منفی در هر باز مزدوج توجه کنید. در باز مزدوج اتان، بار منفی بر روی اتم کربن ایجاد شده است در حالیکه در باز مزدوج متیلآمین و اتانول، بار منفی به ترتیب بر روی نیتروژن و اکسیژن قرار دارد. همانطور که در خصوص روندهای تناوبی میدانیم، با حرکت از سمت چپ به راست در جدول تناوبی، الکترونگاتیوی افزایش پیدا میکند. در نتیجه، اکسیژن، بیشترین الکترونگاتیوی را در بین این عناصر دارد.
بنابراین، آنیون متواکسید، پایدارترین ترکیب بین این سه باز مزدوج خواهد بود و آنیون اتیل کربانیون، کمترین پایداری را دارد. همچنین، اتانول، قویترین و اتان، ضعیفترین اسید است. نکته قابل توجه این است که هرقدر الکترونگاتیوی یک اتم بیشتر باشد، توانایی بیشتری برای پذیرش بار منفی دارد. بازهای ضعیفتر، بار منفی را بر روی اتمهای الکترونگاتیوتر دارند در حالیکه در بازهای قوی، بار منفی بر روی اتم با الکترونگاتیوی کمتر است.
قدرت اسید و باز در جدول تناوبی
با حرکت در بین گروههای جدول تناوبی نیز میتوان قدرت اسید و باز را بررسی کرد. این روند را به خوبی میتوان در خصوص «هالواسیدها» (Haloacids) و یونهای هالید مشاهده کرد.
همچون الکترونگاتیوی، خاصیت بازی نیز با حرکت از بالا به پایین، کاهش پیدا میکند. به عکس، خاصیت اسیدی در هالواسیدها، در هر گروه از بالا به پایین افزایش مییابد.
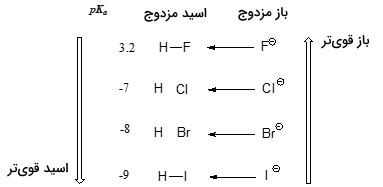
بار دیگر برای اینکه این روند را بهتر درک کنیم، پایداری باز مزدوج را در نظر میگیریم. از آنجایی که اتم فلوئور، الکترونگاتیوترین هالوژن به شمار میآید، انتظار داریم که فلوراید نیز کمترین خاصیت بازی را در بین یونهای هالوژن داشته باشد. اما در حقیقت، این یون، کمترین پایداری و در نتیجه، بیشترین خاصیت بازی را دارد. زمانی که به طور عمودی در جدول تناوبی حرکت کنیم، شعاع اتمی از بالا به پایین افزایش پیدا میکند و بار منفی، به حجم بیشتری اختصاص پیدا میکند. به همین دلیل، در مقایسه بین اتمهای ید و فلوئور، با توجه به اینکه شعاع اتمی ید، تقریبا دو برابر فلوئور است، این اتم، باز ضعیفتری خواهد بود.
این امر یک مفهوم اساسی را در شیمی آلی بیان میکند: بارهای الکتریکی مثبت یا منفی، زمانی که در حجم بیشتری پخش شوند، پایدارتر خواهند بود.
چنین مفهومی به طور متناوب در متون علمی شیمی آلی مورد استفاده قرار میگیرد. در اینجا، این مفهوم را تنها در خصوص تاثیر شعاع اتمی بر قدرت بازی در نظر میگیریم. با توجه به اینکه فلوراید، بیشترین خاصیت بازی را در بین بازهای مزدوج هالیدی دارد، اسید HF نیز، کمترین خاصیت اسیدی را خواهد داشت و اسیدی ضعیف به شمار میآید و تنها قدری از یک کربوکسیلیک اسید قویتر است. این در حالیست که HI با را به عنوان یک اسید قوی همچون سولفوریک اسید در نظر میگیرند.
در بررسی مولکولهای آلی، این روند بیان میکند که تیولها، اسیدیتر از الکلها هستند. به طور مثال، مقدار گروه تیول در زنجیر جانبی «سیستئین» (Cysteine)، در حدود 8/3 است در حالیکه در زنجیر جانبی «سرین» (Serine)، مقداری در حدود 17 دارد.
بررسی قدرت اسید و باز در واکنشهای شیمیایی
واکنش زیر را بین هیدروکلریک اسید و یون فلوراید در نظر بگیرید:
میدانیم که از قویتر است و در نتیجه با توجه به مباحثی که در خصوص قدرت اسید و ثابت تفکیک اسید مطرح شد، به این نتیجه میرسیم که تعادل به سمت تولید فرآورده خواهد بود. میدانیم که یون کلرید، از فلوراید پایدارتر است. همین امر نیز دلیلی بر جهت پیشرفت واکنش به سمت تولید فرآورده به شمار میآید چراکه در این واکنش، از یون با پایداری کم، به یون با پایداری بیشتر حرکت میکنیم. عامل دیگری که علاوه بر پایداری اجزا باید در نظر بگیریم، «انرژی پیوند کل» (Total Bond Energy) است. با مراجعه به جدول انرژیهای پیوند، در مییابیم که انرژی پیوند ، قویتر از انرژی پیوند ذکر میشود. در حقیقت، واکنش به طرفی خواهد بود که از یک پیوند ضعیف، به پیوندی قویتر برسیم.
جمعبندی روندهای تناوبی در قدرت اسید و باز
قدرت یک اسید (HA)، به قدرت پیوند بستگی دارد. در هر گروه جدول تناوبی از بالا به پایین، قدرت پیوند کاهش پیدا میکند. با توجه به اینکه قدرت پیوند به طور معکوس با خاصیت اسیدی ارتباط دارد. قدرت اسیدهای شامل هالوژن روند زیر را دنبال میکنند:
در هر تناوب از چپ به راست، خاصیت اسیدی افزایش پیدا میکند. این روند را میتوان به صورت زیر نشان داد:
این روند بیانگر تغییر پایداری بار منفی با الکترونگاتیوی اتم باز مزدوج است. به همین شکل، افزایش قدرت باز مزدوج را هم میتوان به صورت زیر بیان کرد:
بسیاری از ترکیبات آلی، به لحاظ ساختاری با اسیدها و بازهای معدنی مرتبط هستند. از اینرو، قدرت اسید و باز را میتوان با مقایسه اسید آلی با اسید معدنی مشابه، پیشبینی کرد. میدانیم که سولفوریک اسید، نوعی اسید قوی به شمار میآید. بنابراین، انتظار داریم متان سولفونیک اسید نیز، یک اسید قوی باشد چراکه پیوند دارد و به لحاظ ساختاری، مشابه با پیوند در سولفوریک اسید است.

این مقایسه را میتوان در خصوص بازها نیز انجام داد. به طور مثال، میدانیم که آمونیاک، یک باز ضعیف است. بنابراین، انتظار داریم اتیل آمین با فرمول که ساختاری مشابه با آمونیاک دارد نیز، یک باز ضعیف باشد.

تاثیر رزونانس بر قدرت اسید و باز
در بخش قبل بر روندهای تناوبی و تاثیر آنها بر قدرت اسید و باز تمرکز کردیم یعنی جایی که پروتونها، به عناصر مختلف پیوند داشتند. در این بخش، به ساختارهای گروههای آلی مختلفی خواهیم پرداخت که به بازها و اسیدها و قدرت نسبی اسیدی و بازی در آنها اختصاص دارند.
اولین مدل، اتانول و استیک اسید است اما این مدل را میتوان برای تمامی الکلها و کربوکسیلیک اسیدها تعمیم داد.
با وجود اینکه هردو این ترکیبها از جمله اکسیاسیدها هستند، مقدار اتانول و استیک اسید، تفاوت بسیاری با یکدیگر دارند. اما چه عاملی سبب میشود تا خاصیت اسیدی کربوکسیلیک اسید بیشتر از الکل باشد. این مورد را با بررسی پایداری باز مزدوج میتوان توضیح داد. به یاد داریم که هرقدر باز مزدوج پایدارتر (ضعیفتر) داشته باشیم، اسید آن، قویتر است.
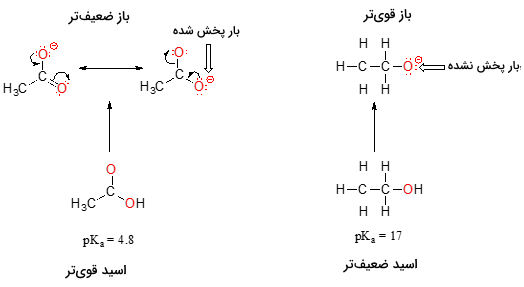
در هر دو ماده، بار منفی باز مزدوج، بر روی اکسیژن قرار دارد و بنابراین نمیتوان بر اساس روندهای تناوبی استدلال کرد. اما در استیک اسید، یک تفاوت اصلی وجود دارد. دو ساختار رزونانس را میتوان برای باز مزدوج درنظر گرفت و بار منفی نیز میتواند بین دو اتم اکسیژن مشترک باشد. در مقابل، در یون اتوکسید، بار منفی تنها به یک اکسیژن اختصاص دارد. این مورد سبب میشود تا یون اتوکسید، پایداری کمتری داشته باشد.
همانطور که در بالا گفته شد، بارهای الکترواستاتیک مثبت یا منفی، زمانی که به یک محل اختصاص داشته باشند، پایداری بیشتری دارند. حال این مفهوم را به شکل دیگری میبینیم. در حقیقت، زمانی که بارها بوسیله رزونانس، پخش شده یا به عبارتی «غیرمتمرکز» (Delocalized) باشند، پایداری بیشتری داریم که مفهوم گستردهتری را جدا از اندازه اتمها بیان میکند.
پخش شدن بار بوسیله رزونانس، تاثیر بسیاری در واکنشپذیری مولکولهای آلی دارد. این تاثیر به گونهای است که اختلاف 12 واحدی بین اتانول و استیک اسید را توصیف میکند و حتما میدانید که ، تعریفی لگاریتمی از ثابت تفکیک اسید را شامل میشود که یعنی این اختلاف برای ، برابر با است.
اثر رزونانس بر قدرت اسید و باز را همچنین میتوان برای اتم نیتروژن بکار برد که در آمین، به صورت بازی است اما زمانی که بخشی از یک آمید باشد، خاصیت بازی ندارد. در یک آمید، با توجه به اینکه جفتالکترون ناپیوندی در آمید، به صورت ساختار رزونانسی و بخشی از یک پیوند پای است، شاخصهای از یک پیوند دوگانه در این دسته از ترکیبات خواهیم داشت.
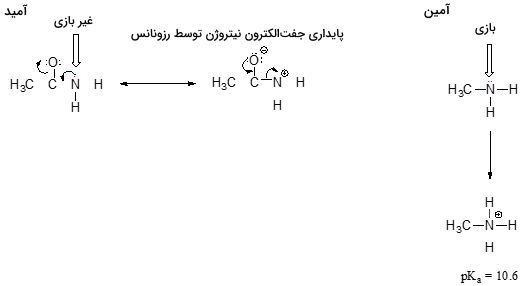
درحالیکه جفتالکترون ناپیوندی نیتروژن در آمین، به یک مکان اختصاص دارد، جفت الکترون ناپیوندی نیتروژن در آمید، به کمک رزونانس، به صورت پخش شده (غیرمتمرکز) است. به عبارت دیگر، جفت الکترون ناپیوندی نیتروژن در آمید نمیتواند در پیوند شرکت کند چراکه این دو الکترون، به یک پیوند پای اختصاص دارند و جایگاهی به اصطلاح «راحت» (Comfortable) را در این نوع پیوند تجربه میکنند. در مقابل، چنین جایگاهی در آمین برای جفت الکترون ناپیوندی فراهم نیست و امکان تشکیل پیوند با هر پروتون اسیدی وجود دارد. لازم به ذکر است که پروتوندهی یک گروه آمید، از طریق اتم اکسیژن آن امکانپذیر خواهد بود نه اتم نیتروژن.
جمعبندی تاثیر رزونانس بر قدرت اسید و باز
ثابت تعادل برای واکنشی که واکنشدهندههایی ناپایدار، به فرآوردههایی با پایداری بیشتر تبدیل میشوند، عدد بزرگی خواهد بود. این نگاه کلی را میتوان به قدرت اسید و باز نیز نسبتا داد. زمانی که یک اسید خنثی، تفکیک (یونیزه) شود، باز مزدوجی با بار منفی به تولید میرسد. پایدار شدن بار منفی در باز مزدوج، موجب افزایش خواهد بود. یکی از راههایی که باز مزدوج به پایداری برسد، پخش شدن بار منفی بین دو اتم یا بیشتر است. به این اثر، «پایداری رزونانسی» (Resonance Stabilization) میگویند.
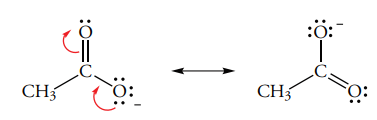
زمانی که باز مزدوج یک اسید، پایداری رزونانسی داشته باشد، قدرت اسید به طور قابل توجهی افزایش پیدا میکند. به طور مثال، متانول و اتانوییک اسید، هردو در اثر تفکیک، باز مزدوج با بار منفی روی اکسیژن بدست میدهند اما اتانوییک اسید 10 میلیارد بار اسیدیتر از متانول است.
بار منفی یون اتانوات، به طور مساوی بین دو اتم اکسیژن، توزیع شده است. در مقابل، بار منفی در باز مزدوج متانول، یعنی یون متوکسید ، بر روی یک اتم اکسیژن متمرکز شده است.
اثر القایی
مقدار در استیک اسید را با مشتقات کلرزنی شده مونو، دی و تریِ آن با یکدیگر مقایسه کنید:
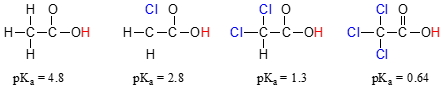
حضور اتم کلر به طور واضح، خاصیت اسیدی گروه کربوکسیلیک اسید را افزایش میدهد. بحثی که در اینجا مطرح میشود این است که برای توصیف این حالت، نمیتوان از رزونانس بهره گرفت چراکه هیج ساختار رزونانسی برای مولکولهای کلرزده رسم نمیشود. برای توضیح این پدیده، از مفهومی به نام «اثر القایی» (Inductive Effects) استفاده میکنیم. اتم کلر، الکترونگاتیوتر از هیدروژن است و بنابراین، قادر است تا چگالی الکترونی را به سمت خود بکشد و از گروه کربوکسلیک اسید دور کند. در عمل، اتم کلر، به بیشتر پخش شدن چگالی الکترونی باز مزدوج کمک میکند. در این مثال، گروههای کلر را میتوان به عنوان گروههای کِشنده الکترون در نظر گرفت.
توجه داشته باشید که کاهش مقدار در هر اتم کلر، اثر کمتری نسبت به اثر رزونانس بین الکل و کربوکسیلیک اسید دارد. به طور کلی، اثر رزونانس، قویتر از اثر القایی است. از آنجایی که اثر القایی به الکترونگاتیوی وابسته است، گروههای شامل فلوئور، تاثیر بیشتری نسبت به کلر در کاهش مقدار دارند.
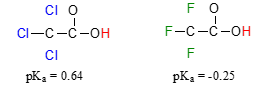
علاوه بر این، اثر القایی از طریق پیوندهای کووالانسی انجام میشوند و تاثیر آنها به طور قابل توجهی با افزایش فاصله، کاهش پیدا میکند. بنابراین، اتم کلری که به میزان دو اتم کربن، دورتر از یک گروه کربوکسیلیک اسید باشد، قدرت اسیدی کمتری نسبت به اتم کلر در فاصله یک اتم از گروه کربوکسیل دارد. این حالت در تصویر زیر قابل بررسی است و در آن، ترکیب سمت چپ، اسید قویتری محسوب میشود.
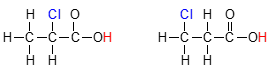
جمعبندی اثر القایی
هر اتم یا گروهی از اتمها در یک مولکول آلی که چگالی الکترونی را از پیوند بین اتم هیدروژن و اتم دیگر همچون کربن، اکسیژن یا نیتروژن، به طرف خود بکشد، خاصیت اسیدی را از طریق اثر القایی، افزایش میدهد. این اثر، با افزایش فاصله، کاهش پیدا میکند. چنین اثری را میتوان در تصویر زیر نشان داد که قدرت اسیدی ۲-کلروبوتانوییک اسید، با توجه به نزدیکی اتم کلر به هیدروژن اسیدی، بیشتر است.

تاثیر هیبریداسیون بر قدرت اسید و باز
در بسیاری از ترکیبات آلی، هیدروژن اسیدی به یک اتم الکترونگاتیو همچون اکسیژن متصل شده است.
البته در برخی از ترکیبات آلی، این هیدروژن اسیدی، با یک اتم کربن پیوند دارد. این «کربن اسیدها» (Carbon Acids)، به طور معمول، اسیدهای ضعیفی هستند. در نتیجه، برای حذف پروتون از آنها، یک باز بسیار قوی مورد نیاز است.
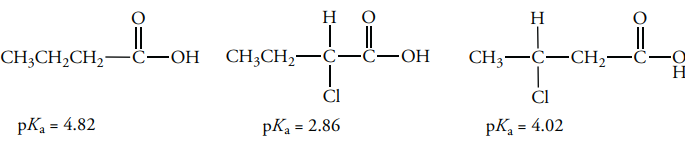
همانطور که در تصویر بالا نیز مشاهده میکنید، ثابت تفکیک اسید در هیدروکربنها، عدد بسیار کوچکی است اما اختلاف بسیار زیادی بین گروههای مختلف هیدروکربنی وجود دارد. در حقیقت، قدرت اسیدی هیدروکربنها به هیبریداسیون اتم کربن در پیوند وابسته است. خاصیت اسیدی در یک اتم کربن را بر اساس اوربیتالهای هیبریدی و به شکل زیر میتوان نشان داد:
فاصله متوسط اوربیتالهای هیبرید از هسته، به درصد دخیل بودن اوربیتالهای s و p در آنها بستگی دارد. برای یک اوربیتال ، اوربیتال به میزان ۲۵ درصد دخیل است یعنی این اوربیتال، ۲۵ درصد خاصیت دارد زیرا یک اوربیتال و سه اوربیتال در مجموع، چهار اوربیتال هیبرید را تشکیل میدهند. این خاصیت اوربیتال ، در اوربیتال و به ترتیب برابر با ۳۳ و ۵۰ درصد است. با توجه به اینکه یک اوربیتال ، نسبت به اوربیتالهای و ، خاصیت بیشتری دارد، الکترونهای آن، به هسته نزدیکتر هستند. همچنین، از آنجایی که قدرت یک اسید به پایداری باز مزدوج آن وابسته است، کربانیونی که بار منفی آن بر روی اوربیتال هیبرید قرار دارد، پایداری بیشتری نسبت به کربانیون با اوربیتالهای هیبرید یا دارد.
اگر این مطلب برای شما مفید بوده است، آموزشها و مطالب زیر نیز به شما پیشنهاد میشوند:
- مجموعه آموزشهای دروس شیمی
- مجموعه آموزشهای نرمافزارهای مهندسی شیمی
- آموزش محلولسازی در آزمایشگاه
- تیتراسیون اسید باز — از صفر تا صد
- واکنش اسید و باز — از صفر تا صد
- جدول تناوبی — از صفر تا صد
^^












سلام، امکانش هست لطفا نحوه عمل یک کاتالیزور رو در یک واکنش بصورت ساده و با جزئیات بیان کنید، مطالبی خوندم در مورد پروتن دهی و پروتون خاهی ولی کامل متوجه نشدم،آیا کاتالیزور اتم های H در یک پیوند رو یونیزه میکنه و باعث شکستن پیوند های کوالانسی میشه یا پروتون میده بهشون ، اگه پروتون بده عنصر کلا تغییر نمیکنه.؟.
با سلام؛
برای آشنایی با عملکرد کاتالیزور در واکنشهای شیمیایی، مطالعه مطلب زیر پیشنهاد میشود.
کاتالیست و واکنش کاتالیستی — به زبان ساده
با تشکر از همراهی شما با مجله فرادرس
سلام ، میشه لطفا بصورت ساده توضیح بدید در پلاسما که یک گاز یونیزه شده است و الکترونهای آزاد داره چطوری و با چه مکانیزمی باعث شکستن پیوند مولکولها میشه؟
سلام ببخشید!
چرا oh که درساختار الکل یا مثلا در بوریک اسید است و یا ترکیبات دیگری اسیدیه ولی در هیدروکسید های فلزی بازیه ؟؟ فرق بین اونohکه توی الکل است یا توی قند با اون oh توی هیدروکسید های فلزی است از لحاظ ساختاری چیه؟ اگه هر دو یکیه کدوم عوامل سبب تفاوت خواص اسیدی و بازی oh توی این ترکیبات میشه؟ ممنون میشم توضیح بدین برا من خیلی مهمه
با سلام؛
برای درک بهتر این موضوع پیشنهاد میکنیم مطلب «اکسید چیست ؟ — بررسی رفتار شیمیایی اکسیدهای فلزی و نافلزی» را مطالعه کنید.
با تشکر از همراهی شما با مجله فرادرس
سلام،میشه توضیح بدین ارجحیت این چهارفاکتور چجوریه؟مثلا اگر بین فاکتور اوربیتال و اثرالقایی با فاکتور رزونانس تضاد وجود داشته باشه کدوم ارجح تره؟واسیدی تره؟
باسلام !
در ابتدای مطالب عنوان شده:
(بازهای ضعیفتر، بار منفی را بر روی اتمهای الکترونگاتیوتر دارند در حالیکه در بازهای قوی، بار منفی بر روی اتم با الکترونگاتیوی کمتر است.)
برای مثال در بحث رد این موضوع ، یون یدید (-I) به عنوان باز ضعیف و یون فلوئورید(-F) به عنوان باز قوی، یون یدید در مقایسه با یون فلوئورید بار منفی را روی اتم ید با الکترونگاتیوی کمتری نگه میدارد،
که آیا در این موضوع مشکلی وجود ندارد؟
سلام و روز شما بهخیر؛
به نکته خوبی اشاره کردید اما توجه داشته باشید که عبارت «بازهای ضعیفتر، بار منفی را بر روی اتمهای الکترونگاتیوتر دارند در حالیکه در بازهای قوی، بار منفی بر روی اتم با الکترونگاتیوی کمتر است.» برای بازهایی مورد بررسی قرار گرفته است که از حداقل دو اتم متفاوت تشکیل شده باشند و مقایسه روی الکترونگاتیوی اتمهای مختلف یک باز است. این مقایسه را نباید بین دو باز مختلف انجام داد و بر اساس آن برای قوی و ضعیف بودن بازها تصمیمگیری کرد.
همچنین این عبارت برای بازهای تک اتمی کاربرد ندارد.
یون یدید نسبت به یون فلوئورید باز ضعیفتری است زیرا شعاع اتمی بسیار بیشتری دارد.
خوشحالیم که با مجله فرادرس همراه هستید.
با سلام؛
در منابع معتبر شیمی آلی مقایسهای بین این فاکتورها به صورت تک به تک انجام نشده است چراکه هریک را میتوان به طور جداگانه بررسی کرد. با این وجود، برای چنین مقایسهای باید از مطالعات آزمایشگاهی بهره گرفت.
با تشکر از همراهی شما با مجله فرادرس
سلام ، میشه لطفا در مورد مقایسه قدرت اسیدی الکل ها هم توضیح بدید، اینکه چرا قدرت اسیدی الکل های پر ازدحام کمتر از الکل های کم ازدحامه؟
با سلام؛
از همراهی شما با مجله فرادرس سپاسگزاریم.
به بیان ساده، استخلافهای الکترونگاتیو سبب افزایش خاصیت اسیدی میشوند و همانطور که انتظار داریم، هرقدر الکترونگاتیوی استخلاف، بیشتر باشید، خاصیت اسیدی نیز بیشتر است. به طور کلی، الکلها در محلولهای آبی، خاصیت اسیدی کمتری نسبت به آب دارند. با این وجود، اختلاف بین ثابت تفکیک اسید در الکلها زیاد نیست و اختلاف در خاصیت اسیدی الکلها به دلیل استخلاف در محل کربن ۱ ذکر میشود. در بسیاری از منابع، قدرت اسیدی الکلها در محلولهای آبی بررسی شده است. توضیح کلی به این صورت است که «استخلافهای» (Substituent) بزرگتر، الکتروندهندههای بهتری هستند که آنیون آلکوکسید حاصل را ناپایدار میکنند. از آنجایی که هیدروژن، کمترین الکتروندهندگی را دارد، در میان آنها، آب قویترین اسید در نظر گرفته میشود اما این تعریف، کامل نیست زیرا نتایج را برای فاز گاز در نظر نمیگیرد. با این وجود، خاصیت اسیدی در فاز گازی، برعکس خاصیت اسیدی در محلولهای آبی است. در نتیجه، در تفسیر خاصیت اسیدی الکلها، فاز گازی نیز باید در نظر گرفته شود.
با تشکر