فلزات سنگین – به زبان ساده
فلزات سنگین به طور کلی به فلزاتی میگویند که چگالی، جرم اتمی یا عدد اتمی بالایی داشته باشند. در متون مختلف، دستهبندیهای مختلفی برای فلزات سنگین وجود دارد. به طور مثال در مهندسی مواد، این فلزات را بر اساس چگالی تعریف میکنند درحالیکه در فیزیک، این تعریف بر اساس عدد اتمی بنا شده است. البته شیمیدانها علاقه دارند که طبقهبندی را بر اساس رفتار شیمیایی انجام دهند.


تعریف فلزات سنگین
تعریفهای مختلف دیگری نیز در مقالات مختلف به چاپ رسیده اما هیچکدام به طور گسترده مورد پذیرش قرار نگرفتهاند و تنها فلزاتی همچون جیوه، سرب و بیسموت در تمامی این تعریفها یکسان هستند. تعریفی که در بیشتر منابع مورد استفاده قرار میگیرد این است که فلزاتی با چگالی بیشتر از را در دسته فلزات سنگین جای میدهند.
فلزاتی که از گذشته شناخته شدهاند مانند آهن، مس، قلع و فلزات گرانبها مانند نقره، طلا و پلاتین به عنوان فلز سنگین شناخته میشوند. از سال ۱۸۰۹ میلادی تا به امروز، فلزات سبکی همچون منیزیم، آلومینیوم و تیتانیوم به همراه برخی دیگر از فلزات سنگین مانند گالیم، تالیم و هافنیم کشف شدهاند.
برخی از این فلزات مانند آهن، کبالت و روی از جمله مواد مغزی ضروری به شمار میآیند و برخی دیگر نیز مانند نقره، ایندیوم و روتنیم فلزاتی بیضرر هستند اما مقادیر زیاد آنها خاصیت سمی دارند.
تعیین مشخصههای فیزیکی و شیمیایی فلزات سنگین باید با دقت بیشتری انجام شود زیرا چگالی بالای این فلزات، واکنشپذیری آنها را کاهش میدهد و سولفیدها و هیدروکسیدهای کمتری نسبت به فلزات سبک دارند. با وجود اینکه تشخیص فلزات سنگینی همچون تنگستن از فلزاتی سبکتری مانند سدیم سادهتر است اما برخی فلزات مانند روی، جیوه و سرب مشخصههایی مشابه فلزات سبک دارند و فلزات سبکتر همچون بریلیوم، اسکاندیم و تیتانیوم مشخصههایی مشابه فلزات سنگین دارند.
فلزات سنگین منابع کمی بر روی پوسته زمین دارند اما در جنبههای مختلفی از زندگی امروز یافت میشوند. به طور مثال از آنها در مواد ضدعفونی کننده، خودروها، پلاستیکها، پنلهای خورشیدی و تلفنهای همراه بهره میگیرند.

منشا و نام گذاری فلزات سنگین
سنگین بودن فلزاتی مانند طلا، مس و آهن از دوران باستان شناخته شده بود و به دلیل خاصیت چکشخواری عاملی برای ساخت ابزارآلات و سلاح در گذشته به شمار میآمد. تمامی فلزاتی که تا سال ۱۸۰۹ میلادی کشف شده بودند چگالی بالایی داشتند و این سنگینی آنها نکته مشهود در میان این فلزات بود اما از سال ۱۸۰۹ به بعد، فلزات سبکی همچون سدیم، پتاسیم و استرانسیوم نیز کشف شدند. چگالی پایین آنها روش کلی شناخت فلزات را دچار مشکل کرد و در آن زمان به این فلزات سبک، «شبهفلز» (Metalloids) میگفتند. البته بعدها این نام به عناصری تعلق گرفت که توصیف آنها برای فلز یا نافلز بودن دشوار بود.
عبارت فلزات سنگین در اوایل سال ۱۸۱۷ شکل گرفت یعنی در زمانی که شیمیدان آلمانی «لئوپولد گملین» (Leopold Gmelin) عناصر را به نافلزات، فلزات سبک و فلزات سنگین تقسیمبندی کرد. فلزات سبک چگالی بین 0/860 - 5 و فلزات سنگین چگالی بین 5/308 - 22 گرم بر سانتیمتر مکعب داشتند. این واژه بعدها معادل با عناصری با جرم اتمی و عدد اتمی بالا شد. به همین دلیل برخی مواقع به جای عبارت فلزات سنگین از عناصر سنگین استفاده میکنند. نکته قابل توجه این است که با توجه به معانی مختلفی که فلزات سنگین را یدک میکشند، این عبارت در متون علمی مورد استفاده قرار میگیرند.
فلزات سنگین در جدول تناوبی
همانطور که گفته شد، معیارهای مختلفی در رابطه با نحوه تشخیص این فلزات ذکر شده است. برای درک بهتر این موضوع، فلزات سنگین در جدول تناوبی بر اساس تعداد معیارهای تشخیصی در تصویر زیر آورده شدهاند. همانطور که مشاهده میکنید، فلزات جیوه، سرب و بیسموت در تمامی این تعریفها یکسان هستند.
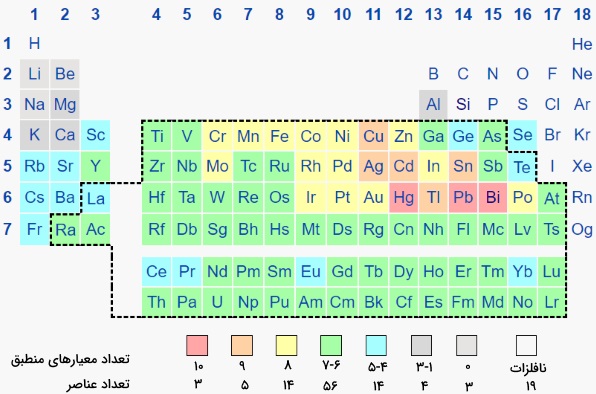
نقش بیولوژیکی فلزات سنگین
مقادیر کم از فلزات سنگین بویژه در دوره چهارم از جدول تناوبی برای انجام برخی از فرآیندهای بیولوژیکی بدن ضروری است. این عناصر در فهرست زیر آورده شدهاند:
- مس: حمل الکترون و اکسیژن
- کبالت: متابولیسم سلولی
- روی: هیدروکسیلاسیون (هیدروکسیلدار کردن)
- کروم: بهرهگیری از گلوکوز
- نیکل: رشد سلولی
- سلنیوم: آنتیاکسیدان و تولید هورمون
دورههای چهارم و پنجم جدول تناوبی شامل مقادیر کمتری از فلزات سنگین ضروری هستند چراکه وزن سنگینتر و مقدار کمتری در طبیعت دارند. در تناوب پنجم، مولیبدن به عنوان کاتالیزور واکنشهای ردوکس مورد استفاده قرار میگیرد. در تناوب ششم کادمیم در فرآیندهای متابولیکی باکتریها نقش دارد.
مشخصه فلزات سنگین
از جمله مشخصه فلزات سنگین سمی بودن آنها است که در ادامه مطلب به آن خواهیم پرداخت. همچنین بیشتر فلزات سنگین دارای چگالی، وزن اتمی و عدد اتمی بالایی هستند. برخی از شبهفلزات، فلزات واسطه، لانتانیدها و اکتینیدها نیز در دسته فلزات سنگین جای میگیرند. بسیاری از منابع، فلزاتی همچون جیوه، سرب، بیسموت و کادمیم را از جمله عناصر سمی فلزات سنگین بیان کردهاند. از جمله نمونههای فلزات سنگین میتوان به عناصر زیر اشاره کرد:
- سرب
- جیوه
- کادمیم
- کروم
- آهن
- مس
- روی
- آلومینیوم
- برلیم
- کبالت
- منگنز
- آرسنیک
خاصیت سمی فلزات سنگین
گمان بر این است که فلزات سنگین بسیار سمی و برای محیط زیست مضر هستند. باید گفت برخی از این فلزات، سمی هستند و برخی دیگر در صورتیکه مقادیر زیادی از آنها وجود داشته باشند خاصیت سمی دارند. به طور مثال، عناصری مثل کروم، آرسنیک، جیوه، کادمیم و سرب از جمله عناصری هستند که مقدار زیاد آنها خاصیت سمی ایجاد میکنند. فرم عنصری یا ترکیبی این عناصر و توزیع آنها در محیط زیست، خاصیت سمی خواهند داشت. به طور مثال، کروم با عدد اکسایش خاصیت سمی به اندازه بخار جیوه یا ترکیبات جیوه دارد. این ۵ عنصر، تمایل زیادی به جذب گوگرد دارند و در بدن انسان از طریق گروههای تیول به آنزیمهای کنترلکننده سرعت واکنشهای متابولیکی متصل میشوند.
پیوند گوگرد-فلز حاصل، از عملکرد بهینه آنزیمها جلوگیری میکند و سبب آسیب به سلامتی انسان و گاهی مرگ نیز میشود. کروم عاملی سرطانزا و کادمیم نیز مشکلات ستون فقرات و مفاصل ایجاد میکند. سرب نیز به سیستم مرکزی اعصاب، آسیب میرساند. در ادامه، آثار این فلزات را به همراه برخی فلزات دیگر به شکلی دقیقتر مورد بررسی قرار میدهیم.

خطرات فلزات سنگین
خطر فلزات سنگین به دلیل «تجمع زیستی» (Bioaccumulation) آنها در بدن انسان و سایر موجودات زنده است. تجمع زیستی به این معناست که غلظت یک ماده شیمیایی در طول زمان درون یک موجود زنده در مقایسه با غلظت آن در محیط زیست افزایش پیدا کند. این افزایش غلظت زمانی اتفاق میافتد که جذب و ذخیرهسازی آنها سریعتر از شکست ترکیبات (متابولیزه شدن) رخ دهد. فلزات سنگین می توانند از طریق فاضلابهای صنعتی به سیستم آبرسانی منازل ورود کنند یا اینکه در اثر بارانهای اسیدی وارد خاک، دریاچهها، آبهای زیرزمینی و رودخانهها شوند. سه مورد از آلودهترین فلزات سنگین، سرب، کادمیوم و جیوه هستند.
تاثیر سرب بر محیط زیست
بسته به مدت زمان و میزان در معرض بودن انسان در برابر سرب، تاثیرات بیولوژیکی مختلفی رخ میدهد که تاثیر آن بر روی جنین و نوزادان بیشتر از فرد بالغ است. مقادیر زیاد این ماده سبب بروز مشکلاتی در تولید هموگلوبین، کلیهها، دستگاه گوارش و آسیب به مفاصل و سیستمهای عصبی میشود.
سرب در محیط زیست ناشی از منابع طبیعی و انسانی است و افراد از طریق غذا، آب و هوا در معرض این ماده قرار میگیرند. همچنین در رنگهای قدیمی نیز از سرب بهره میگرفتند. البته غذا، آب و خاک از جمله منابع اصلی هستند که انسان میتواند از طریق آن در معرض سرب قرار بگیرد.
تاثیر کادمیوم بر محیط زیست
کادمیوم از جمله فلزات سنگین به شمار میآید که در صورت جذب، تا سالها و حتی دههها در بدن موجودات زنده همچون انسان باقی میماند. اگر انسان در مواجهه طولانیمدت با کادمیوم قرار بگیرد دچار مشکلات کلیوی خواهد شد. این ماده در مقادیر زیاد سبب بروز مشکلات در ریه و سرطان و بروز نقصهای استخوان خواهد شد. علاوه بر این، افزایش فشار خون حیوانات و بروز مشکلات قلبی در آنها را نیز میتوان از جمله تاثیرات کادمیوم بر محیط زیست دانست.
کادمیوم به هنگام استخراج و فرآوری روی به تولید میرسد چراکه این فلز به همراه روی در سنگ معدن وجود دارد و از جمله مصارف عمده آن در تولید باتریهای نیکل-کادمیومی و آلیاژها و قطعات الکترونیکی است.
تاثیر جیوه بر محیط زیست
جیوه مادهای سمی است که عملکرد شناخته شدهای در بدن انسان ندارد و به ندرت در موجودات زنده یافت میشود. مسمومیت با جیوه سبب مشکلاتی همچون سقط خودبهخودی جنین و بروز ناهنجاریهای بدو تولد خواهد شد. این ماده از جمله آلایندههایی به شمار میرود که خواص شیمیایی و فیزیکی پیچیدهای دارد. منبع طبیعی اصلی جیوه ناشی از آزاد شدن گازها در زیر پوسته زمین و انتشار آنها از طریق آتشفشانها یا تبخیر آبهای سطحی است. همچنین، حفاریهای گسترده معدنی سبب آزاد شدن جیوه در جو زمین میشود.

ناگفته نماند که استفاده از این ماده در بسیاری از فرآیندهای صنعتی و محصولات مختلفی همچون باتری، دماسنج و لامپها رواج دارد. علاوه بر این از این ماده به عنوان آمالگام در دندانپزشکی بهره میگیرند.
معرفی فیلم آموزش علوم تجربی پایه نهم - بخش شیمی
از مباحث اصلی که در دروس شیمی علوم تجربی آموزش داده میشود، آشنایی با جدول تناوبی عناصر است. به همین دلیل، فرادرس دوره آموزشی ۲ ساعتهای را در قالب ۳ درس تدوین کرده است که در ادامه به توضیح آنها میپردازیم.
در درس یکم به نقش مواد در زندگی پرداخته میشود که تعریف عنصر، آشنایی با جدول تناوبی و همچنین آشنایی با انواع پلیمرها از جمله مباحث مهم این درس به شمار میآیند. درس دوم به بررسی رفتا اتمها اختصاص دارد. در این درس با انواع ترکیبات یونی و کووالانسی و همچنین نقش یونها در بدن انسان آشنا خواهیم شد. ترکیبهای نفت خام و کاربردهای نفت خام و انواع هیدروکربنها نیز از جمله مباحث مهم درس سوم هستند.
کاربرد فلزات سنگین
تقریبا در تمامی جنبههای زندگی امروزه از فلزات سنگین استفاده میشود. در این میان، آهن بیشترین سهم را از این فلزات دارد. همچنین در حدود ۲۰ درصد از کالاهای مصرفی زندگی بشر از جنس پلاتین تشکیل شده است. برخی از کاربردهای معمول این فلزات به مشخصههای کلی آنها همچون هدایت الکتریکی و «خاصیت بازتابندگی» (Reflectance) مرتبط میشود. همچنین مشخصههای اصلی فلزات سنگین مانند چگالی، دوام و استحکام بالا سبب بهرهگیری بیشتر از آنها شده است.
علاوه بر موارد بالا، خواص مثبت و منفی بیولوژیکی این فلزات نیز در استفاده از آنها موثر است. آرایش الکترونی اتمهای این فلزات نیز عامل دیگری در بکارگیری آنها به شمار میآید. به طور مثال اوربیتال نیمهپر «d» یا «f» در بسیاری از فلزات واسطه، لانتانیدها و اکتینیدها تشکیل ترکیباتی رنگی را امکانپذیر میکند.
بسیاری از فلزات سنگین از جمله سریوم، پلاتین و بیسموت، اعداد اکسایش متفاوتی دارند و به همین دلیل به عنوان کاتالیزور نیز از آنها بهره میگیرند. همپوشانی ضعیف اوربیتالهای 3d یا ۴f در عناصری مثل آهن، کبالت، نیکل و برخی از لانتانیدها و اکتینیدها، خاصیت مغناطیسی این عناصر را سبب میشوند. به طور کلی، کاربرد فلزات سنگین را میتوان در ۶ شاخه زیر دستهبندی کرد.
کاربرد بر اساس وزن یا چگالی
در ورزشها، مهندسی مکانیک، صنایع نظامی و دانش هستهای از چگالی بالای فلزات سنگین بهره میگیرند. از نمونه این کاربردها میتوان به ورزش گلف اشاره کرد که از فلزاتی همچون تنگستن، آلیاژ برنج و همچنین مس برای پایین آوردن مرکز جرم چوب گلف استفاده میکنند. در صنایع نظامی نیز از تنگستن برای آبکاری فلزات در تجهیزات بهره میگیرند.
کاربرد بر اساس دوام و استحکام
استحکام و دوام فزاتی همچون کروم، آهن، نیکل، مس، روی، مولیبدن، قلع، تنگستن و سرب و آلیاژهای این فلزات سبب شده است تا از آنها در ساخت مجسمهها، دستگاههای مختلف، لوازم خانگی، ظروف، لولهها، ساختمانها، خودروها و بسیاری از صنایع استفاده شود.
به طور مثال، مس، روی، قلع و سرب به لحاظ مکانیکی فلزات ضعیفی به شمار میآیند اما برای جلوگیری از خوردگی فلزات مورد استفاده قرار میگیرند.

کاربرد بر اساس نقش بیولوژیکی و شیمیایی
خاصیت کشنده برخی از فلزات سنگین مانند مس، پلاتین، اسمیوم، روتنیوم و آرسنیک سبب استفاده از آنها در درمانهای ضد سرطان شده است. فلزات دیگری نیز همچون آنتیموان، بیسموت، طلا و آهن نیز در پرشکی کاربرد دارند. علاوه بر این، مس، روی، نقره و طلا نیز در ساخت مواد ضدعفونی کننده بکار میروند.
مقادیر کمی از فلزات سنگین برای کنترل رشد جلبکها در برجهای خنککننده مورد استفاده قرار میگیرند. همچنین، در کاتالیزور خودروها و در فرآیند پالایش سوخت از نقش شیمیایی فلزات سنگین کمک میگیرند.
کاربرد بر اساس خواص نوری و رنگ
رنگ شیشهها، لعاب سرامیکها و همچنین رنگهای پلاستیکها و ساخت جوهرها همگی به کمک بهرهگیری از فلزات سنگین یا ترکیبات آنها امکانپذیر است. از جمله این فلزات میتوان به کروم، کبالت، مس، روی، سلنیوم، زرگون (زیرکونیوم)، مولیبدن، ایریدیوم، طلا، سرب، تنگستن و اورانیوم اشاره کرد. همچنین از خاصیت بازتابش برخی از فلزات در ساخت آینهها و ابزارهای نجوم بهره میگیرند.

کاربرد بر اساس خواص الکترونیکی و مغناطیسی
فلزات سنگین یا ترکیبات آنها را میتوان در قطعات الکترونیک، الکترودها، سیمپیچیها و پنلهای خورشیدی پیدا کرد. به طور مثال، بسیاری از تجهیزات الکتریکی در منازل به کمک سیمهای مسی سیمپیچی شدهاند. همچنین در پیلهای سوختی، فلزاتی همچون مس و نقره از گذشته مورد استفاده قرار میگرفتند.
کاربرد در خواص هسته ای
برخی از فلزات سنگین با عدد اتمی بالا در تصویربرداری پزشکی، میکروسکوپهای الکترونی و دانش هستهای کاربرد دارند. به طور مثال، فلزاتی همچون تنگستن یا کبالت، بخش آند لولههای پرتو ایکس را تشکیل میدهند یا اینکه فلزاتی مانند سرب، طلا، پالادیوم، پلاتین و اورانیوم برای تشکیل پوشش هادی در میکروسکوپها مورد استفاده قرار میگیرند.













اگر بخوام این مطالب رو استفاده کنم داخل پایان نامم مرجعشو چی بزنم؟
با سلام؛
برای استفاده از مطالب مجله فرادرس میتونید به شرایط استفاده در انتهای صفحه یا این لینک مراجعه کنید.
با تشکر از همراهی شما با مجله فرادرس