بیوشیمی انواع ویتامین – به زبان ساده

ویتامینها ترکیبات آلی هستند که در بدن پستانداران سنتز نمیشوند، اما در رشد و سلامت بدن نقش مهمی دارند. به همین دلیل باید در رژیم غذایی فرد مصرف شوند. بیشتر این ترکیبات با ساختار غیرفعال وارد بدن شده و پس از تغییرات شیمیایی به شکل فعال تبدیل میشوند. ویتامینها بر اساس حلالیت به دو نوع محلول در چربی و محلول در آب تقسیم میشوند. برخی از ویتامینها آنتیاکسیدانهایی هستند که رادیکالهای آزاد بدن را خنثی میکنند و برخی به انجام واکنشهای کاتالیزی آنزیمها کمک میکنند. در این مطلب از مجله فرادرس بیوشیمی انواع ویتامین را توضیح میدهیم.
چند نوع ویتامین وجود دارد؟
پیش از آنکه با بیوشیمی انواع ویتامین آشنا شویم باید انواع ویتامینها را بشناسیم. تمام ویتامینها ترکیبات آلی هستند که ساختار اکثر آنها از حلقههای کربنی تشکیل میشود و زنجیرههای جانبی این حلقه، محلول در آب (هیدروفیل) یا محلول در چربی بودن (هیدروفوب) ویتامین را مشخص میکند. بر این اساس ویتامینها K، E، A و D محلول در چربی و ویتامینهای B و C از انواع محلول در آب هستند. این تفاوت حلالیت سبب تفاوت روش جذب، ذخیره و متابولیسم ویتامینها در بدن میشود.
بیوشیمی انواع ویتامین های محلول در آب
ویتامینهای گروه B و C ترکیبات قطبی یا گروههای عاملی کربوکسیل، هیدروکسیل و آمیدی هستند که انحلالپذیری زیادی درآب دارند. این ترکیبات بهوسیله ناقلهای پروتئینی همراه گلوکز یا سدیم وارد سلولهای دیواره روده میشوند. این ویتامینها در بدن ذخیره نمیشوند.
بیوشیمی انواع ویتامین B
گروه ویتامینهای B از تیامین (B1)، ریبوفلاوین (B2)، نیاسین (B3)، پانتوتنیکاسید (B5)، پیروکسیدین (B6)، بیوتین (B7)، فولات (B9) و کوبالامین (B12) تشکیل شده است. این ویتامینها کوآنزیم واکنشهای زنجیره انتقال الکترون، سنتز هموگلوبین گلبولهای قرمز، مسیرهای تجزیه گلوکز و سنتز مولکولهای ضروری بدن هستند.
ویتامین B1
ساختار تیامین از یک حلقه تیازول و یک حلقه پیریمیدین شده که بهوسیله گروه متیل به هم متصل میشوند. این ویتامین همراه ویتامینهای دیگر در روده کوچک و بهوسیله ناقلهای پروتئینی غشا وارد سلولهای دیواره روده میشود.
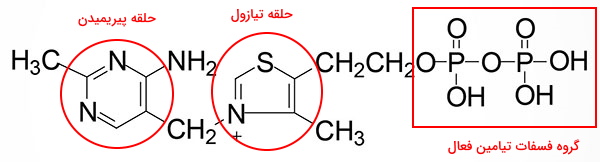
در دیواره سلولهای دیواره روده کوچک آنزیم تیامین فسفوکیناز ۱ (TPK1) آنزیم را به ساختار فعال تیامین فسفات تبدیل میکند. تیامین فسفات کوفاکتور ضروری آنزیمهای پیروات دهیدروژناز، ۲-اوگزوگلوتارات (آلفا گلوتارات) و دهیدروژناز کتوزیدهای شاخهدار است. پیرووات دهیدروژناز واکنش بین پیروات و لیپوآمید برای تولید دیاکسید کربن و لیپوآمید استیله را کاتالیز میکند. آلفا گلوتارات در چرخه کربکس واکنش تبدیل آلفا کتوگلوتارات به سوکسینیل کوآ را کاتالیز میکند و دهیدروژناز کتوزیدهای شاخهدار یکی از آنزیمهای مسیر متابولیسم آمینواسیدهای لوسین، ایزولوسین و والین است. تیامین فسفات علاوه بر آنزیمهای دهیدروژناز کوفاکتور ضروری برای فعالیت آنزیم ترانسکتولاز در مسیر پنتوز فسفات و آنزیم ۲-هیدروکسی فیتانوئیل-کوآ لیاز در کاتابولیسم اسیدهای چرب است. کمبود این ویتامین توانایی سلول در تولید انرژی و سنتز نوکلئوتیدها را کاهش میدهد.
ویتامین B2
ساختار ریبوفلاوین از سه حلقه و با زنجیره جانبی ۵ کربنه و گروه هیدروکسیل تشکیل شده است. این ویتامین محلول در آب پیشساز FMN (فلاوین آدنین دینوکلئوتید) و FAD (فلاوین مونونوکلئوتید)، دو کوفاکتور مهم واکنشهای زنجیره انتقال الکترون، گلیکولیز و چرخه کربس است. تعداد ناقلهای این ویتامین در غشای سلولهای مغزی بسیار زیاد است.
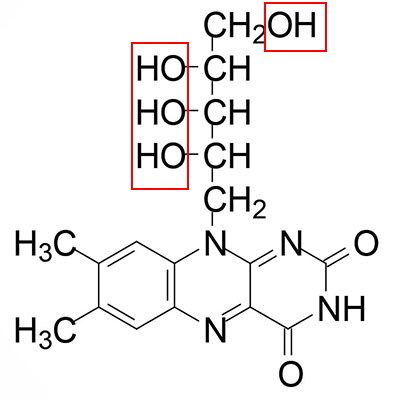
FMN از اضافه شدن یک گروه فسفات به هیدروکسیل انتهایی فلاوین بهوسیله آنزیم ریبوفلاوین کیناز سنتز میشود. در مرحله بعد آنزیم فلاوین آدنین دینوکلئوتید سنتتاز ۱ با اضافه کردن یک AMP به فسفات FMN کوفاکتور FAD را سنتز میکند. فلاووپروتئینها و متالوفلاووپروتئینها دو دسته آنزیمی هستند که برای کاتالیز واکنشهای آنزیمی به FMN یا FAD نیاز دارند. این ویتامین کوفاکتور مشترک دهیدروژنازهای تیامین فسفات است.
به علاوه سوکسینات دهیدروژناز (آنزیم تبدیل سوکسینات به فومارات در چرخه کربس و کمپلکس II زنجیره انتقال الکترون در میتوکندری)، گلسیرول ۳ فسفات دهیدروژناز (آنزیم کاهنده دیهیدروکسی استیل فسفات به گلیسرول ۳-فسفات در شاتل گلیسرول فسفات و سنتز تریگلیسیرید) و زانتین اکسیداز (آنزیم مسیر کاتابولیسم نوکلئوتیدها) برای فعالیت به کوفاکتورهای FAD و FMN نیاز دارند.
ویتامین B3
نیاسین یا ویتامین B3 عضو دیگر خانواده B است که مشتقات نوکلئوتیدی آن نقش مهمی در واکنشها متابولیکی دارند. این ویتامین با به شکل دو ترکیب نیکوتین آمید و نیکوتینیکاسید از رژیم غذایی دریافت میشوند.
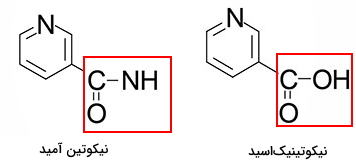
نیکوتین آمید آدنین دینوکلئوتید ($$NAD^+$$) و نیکوتین آمید آدنین دینوکلئوتید فسفات ($$NADP^+$$) دو ترکیب مشتق از ویتامین B3 و کوفاکتور واکنشهای اکسایش-کاهش در مسیرهای مختلف آنابولیمی و کاتابولیسمی هستند.
ویتامین B5
پانتوتنیکاسید یا ویتامین B5 تنها ویتامین گروه B که در ساختار آن حلقه وجود ندارد. در انسان این از آمینواسید آلانین بهوسیله باکتریهای مفید روده کوچک سنتز شده و بهوسیله پروتئین همانتقال با یون سدیم وارد سلولهای روده کوچک میشود. پانتوتنیکاسیددر یک واکنش پنجمرحله به استیل کوآنزیم آ (کوفاکتور مهم چرخه کربس و اکسیداسیون اسیدهای چرب) تبدیل میشود.
- آنزیم پنتوتنات کیناز با اضافه کردن یک گروه فسفات به هیدروکسیل پنتوتنات این ویتامین را به ۴-فسفوپنتوتنات تبدیل میکند.
- آنزیم فسفاپنتوتنیلسیستئین سنتتاز، آمینواسید سیستئن را بهوسیله گروه سولفیدریل فعال به کربوکسیل انتهایی ۴-فسفوپنتوتنات اضافه و ۴-فسفو-N-پانتوتنوئیل سیستئین (PPC) تولید میکند.
- کربوکسیل PCC بهوسیله آنزیم دکربوکسیلاز از مولکول جدا و ۴-فسفوپنتتین تشکیل میشود.
- آنزیم استیل کوآ سنتتاز در دو مرحله با اضافه کردن ATP به ۴-فسفوپنتتین و اضافه کردن فسفات به هیدروکسیل ریبوز این ترکیب، استیل کوآ را سنتز میکند.
ویتامین B6
پریدوکسین، پرودوکسال و پریدوکسامین سه ساختار ویتامین B6 در مواد غذایی هستند که در بدن بهوسیله متالوآنزیم پریدوکسال کیناز به ساختار فعال پریدوکسال فسفات تبدیل میشوند. ساختار این ویتامینها از یک حلقه .. و زنجیره جانبی هیدروکسیل (OH)، آلدهید (CHO) یا آمین (CNH) تشکیل شده است. این مولکولها بدون مصرف انرژی به سیتوپلاسم سلولهای دیواره ژژنوم منتقل و پس از اضافه شدن فسفات وارد خون میشوند.
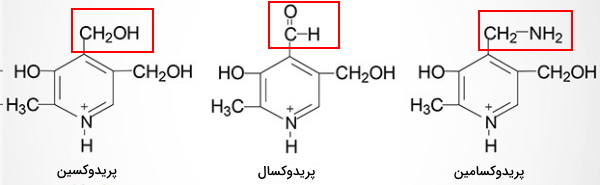
پریدوکسال فسفات کوفاکتور تمام آنزیمهای ترانسآمیناز در مسیر سنتز آمینواسیدها، آنزیم DOPA کربوکسیلاز (آنزیم مسیر سنتز انتقالدهندههای عصبی دوپامین، اپینفرین، نوراپینفرین و سروتونین) و آنزیم گلوتامیکاسید دکربوکسیلاز (آنزیم مسیر سنتز انتقالدهنده عصبی گاباآمینوبوتیریکاسید | GABA)، دلتاآمینولوونینیکاسید سنتتاز (آنزیم مسیر سنتز هم)، سیستاتیون بتا سنتتاز و سیستاتیوناز (آنزیمهای مسیر سنتز آمینواسیدهای متیونین و سیستئین) و گلیکوژن فسفوریلاز است.
ویتامین B7
ساختار بیوتین، ویتامین H یا B7 از دو حلقه و زنجیره جانبی کربوکسیل تشکیل شده و کوفاکتور آنزیمهای کربوکسیلاز، دکربوکسیلاز و ترانس کربوکسیلاز در مسیرهای بیوشیمیایی سلولهای یوکاریوتی و پروکاریوتی است. بیوتین مورد نیاز انسان علاوه بر دریافت از رژیم غذایی بهوسیله باکتریهای مفید روده سنتز میشود. این ویتامین به باقیمانده لوسین پروتئینها متصل شده و بیوسیتین تشکیل میدهد. این ویتامین بهوسیله پروتئين همناقل یون سدیم به سلولهای دیوراه روده منتقل میشود.
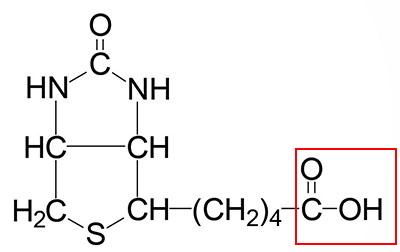
استیل کوآ کربوکسیلاز، پیرووات کربوکسیلاز، پروپیونیل کوآ کربوکسیلاز و ۳-متیل کروتونیل کوآ کربوکسیلاز آنزیمهای مهم متابولیسم بدن هستند که کوآنزیم آنها ویتامین B7 است.
- استیل کوآکربوکسیلاز: استیل کوآکربوکسیلاز یکی از آنزیمهای مسیر سنتز اسیدهای چرب در سیتوپلاسم و وابسته به بیوتین است. این آنزیم در یک واکنش برگشتناپذیر و دومرحلهای استیل کوآ را به مالونیل کوآ تبدیل میکند. در مرحله اول با مصرف یک ATP گروه کربوکسیل بیکربنات به بیوتین اضافه شده و در مرحله بعد این کربوکسیل به استیل کوآ منتقل میشود.
- پیرووات کربوکسیلاز: پیرووات کربوکسیلاز اولین آنزیم مسیر گلیکوژنز برای تبدیل پیرووات به گلوکز است. این آنزیم با مصرف ATP یک گروه کربوکسیل بیکربنات را به بیوتین متصل به باقیمانده لوسین اضافه میکند. در مرحله بعد گروه کربوکسیل به پیرووات منتقل شده و اوگزالواستات (اولین ترکیب چرخه کربس) سنتز میشود.
- پروپیونیل کوآ کربوکسیلاز: این آنزیم چندزیرواحدی ($$\alpha_6\beta_6$$) پروپیونیل کوآ حاصل از اکسایش آمینواسیدهای والین، متیونین، ایزولوسین، تروئونین و اسیدهای چرب زوج کربن را به متیل مانوئیل کوآ تبدیل میکند. مانوئیل کوآ بهوسیله واکنش آنزیمی موتاز به سوکسینیل کوآ تبدیل و وارد چرخه کربس میشود. دومین انتقال بیوتین (بین زیرواحدهای آلفا و بتا) این آنزیم در سایر کربوکسیلازهای وابسته به بیوتین وجود ندارد. این دومین بین دو زیرواحد آنزیم ارتباط برقرار میکند.
- ۳-متیلکروتونیل کوآ کربوکسیلاز: این آنزیم مسیر کاتابولیسم لوسین در میتوکندری قرار دارد و با اضافه کردن یک گروه عاملی کربوکسیل به ۳-متیلکروتونیل کوآ، در سنتز ۳-متیل گولوتاکونیل کوآ شرکت میکند. ۳-متیل گولوتاکونیل پس از دریافت یک مولکول آب (هیدراسیون) به استواستات و استیل کوآ تجزیه میشود.
ویتامین B12
ساختار ویتامین B12 یا کوبالامین از حلقه تتراپیرول (حلقه کورین) با یک کبالت مرکزی تشکیل شده است. عدد اکسایش کبالت با دریافت یا اهدای الکترون تغییر کرده و به کاتالیز واکنشهای بیوشیمیایی کمک میکند. بیشتر ویتامین B12 مورد نیاز انسان بهوسیله باکتریهای مفید دستگاه گوارش سنتز شده و همراه پروتئینهای کبدی به شکل متیل کوبالامین یا ۵-دئوکسیآدنوزین کوبالامین در بدن وجود دارد. آنزیم پپسین معده با تجزیه بخش پروتئینی سبب فعال شدن این ويتامین میشود.
B12 پس از جدا شدن از پروتئینهای کبدی به گلیکوپروتئین هاپتوکورین متصل می شود این پروتئین در پاسخ به غذا از غدد بزاقی دهان ترشح شده و از معده تا دئودئوم، کوبالامین را از اسید معده محافظت میکند هاپتوکورین در دئودئوم در اثر فعالیت تریپسین پانکراس از B12 جدا میشود. در این مرحله گلیکوپروتئین فاکتور داخلی (IF) در pH قلیایی روده کوچک به کوبالامین متصل خواهد شد. فاکتور داخلی از سلولهای حاشیه معده و در پاسخ به هورمونهای هیستامین، استیل کولین و گاسترین ترشح میشود. کمپلکس فاکتورداخلی-کوبالامین در مرحله بعد به گیرندههای کوبیلین در غشای انتروسیتهای دئودئوم متصل میشود.
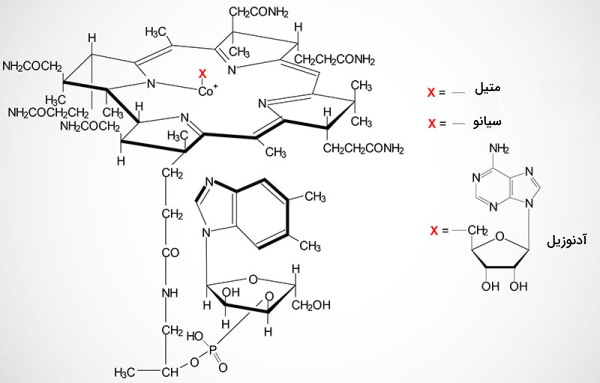
کوبیلین پروتئین محیطی غشا و فاقد دومینهای عرض غشایی یا سیتوزولی است. اتصال فاکتورداخلی-کوبالامین یه این گیرنده با فعال شدن پروتئینهای سیتوپلاسمی و اندوسیتوز همراه است. فاکتور داخلی پس از اندوسیتوز بهوسله آنزیمهای هیدرولازی لیزوزوم تجزیه و B12 آزاد میشود. کوبالامین پس از اتصال به پروتئین ترانس کوبالامین II از غشای لومنی سلولهای روده به غشای پایه منتقل، بهوسیله ناقلهای پروتئینی وارد خون، دوباره به پروتئین ترانس کوبالامین II متصل و همراه جریان خون به اندامهای مختلف منتقل میشود. دو ایزومر متفاوت کوبالایمن در سلول هدف وجود دارد.
- در سیتوپلاسم سلول کوبالامین به آنزیم متیونین سنتتاز برای سنتز هموسیستئین کمک میکند. در این واکنش با انتقال یک گروه گروه متیل از N-متیل تتراهیدروفولات به کوبالامین، تتراهیدروفولات و متیل کوبالامین تشکیل میشود.
- در میتوکندری کوبالامین ابتدا به آدنوکوبالامین تبدیل شده و سپس به آنزیم متیل مالونیل موتاز در تبدیل متیبل مالونیل کوآ به سوکسینیل کوآ کمک میکند.
فولیک اسید
در بخشهای قبلی این مطلب بیوشیمی انواع ویتامین B و نقش آنها در واکنشهای آنزیمی را توضیح دادیم. فولیکاسید آخرین عضو این گروه است که در سنتز آمینواسیدها نقش مهمی دارد. ساختار فولیکاسید یا B9 از اتصال یک حلقه پتریدین به یک پارا آمینوبنزوئیکاسید تشکیل شده است. وجود گروههای عاملی کربوکسیل و هیدروکسیل این ترکیب را به یک ویتامین محلول در آب تبدیل میکند. فولاتها (دیهیدروفولات و تتراهیدروفولات) اشکال فعال این مولکول در بدن هستند. آنزیمهای سنتز این ویتامین در انسان وجود ندارد و ویتامین موجود در غذا معمولا از مخمر، برگ گیاهان و کبد جانوران تامین میشود.
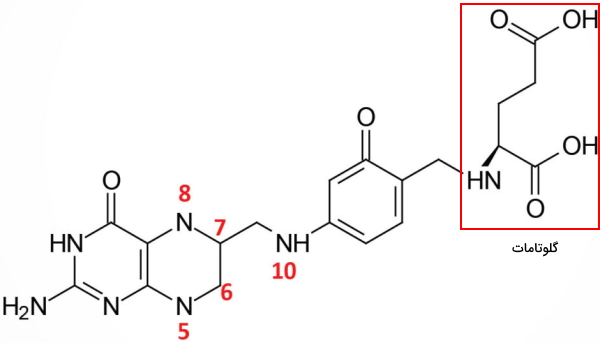
ببیشتر فولات رژیم غذایی به شکل متیل تتراهیدروفولات است. این ترکیب بهوسیله پروتئینهای همانتقال پروتون-فولات از انتروسیت ژژنوم جذب و در این سلولها بهوسیله آنزیم فولات هیدرولاز I یا گلوتامات کربوکسی پپتیداز II به مونوگلوتامات تبدیل میشود. بار منفی این ترکیب کمتر از فولات و انتقال از غشای پایه سلول به خون راحتتر است. فولات موجود در خون پس از اتصال به گیرندههای فولات ۱ وارد سیتوپلاسم سلولهای مغز استخوان، تیموس، طحال، تخمدان و رحم میشود.
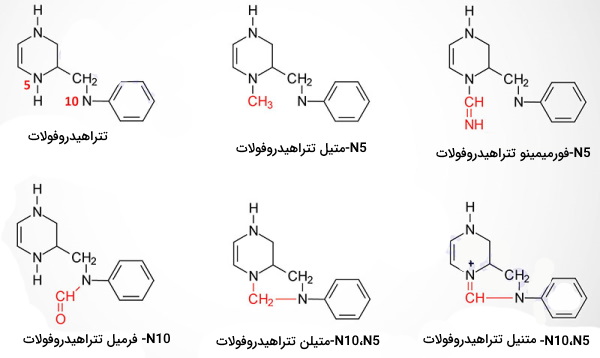
مونوگلوتامات در سلولهای کبدی و کلیه بهوسیله آنزیم فولیل پلیگلوتامات سنتتاز به پلیگلوتانات تبدیل و ذخیره میشود. در صورت نیاز بدن، آنزیم گاما-گلوتاریل هیدرولاز آنزیم لیزوزومی سلولهای کبدی و کلیه پلیگلوتامات را از فولات ذخیره شده در میتوکندری این سلولها جدا میکند. N5-متیل تتراهیدروفولات، N5-فرمیمینو تتراهیدروفولات، N10-فرمیل تتراهیدروفولات، N5، N10-فرمیل تتراهیدروفولات، N5، N10-متیلن تتراهیدروفولات و N5،N10-متنیل تتراهیدروفولات، مشتقات تتراهیدروفولات هستند که یک گروه اهداکننده کربن دارند. این مولکولها در واکنشهای بیوشیمیایی سنتز سرین، متیونین، گلایسن، کولین، نوکلئوتیدهای پورین و دئوکسی تیمیدین مونوفسفات شرکت میکنند.
بیوشیمی ویتامین C
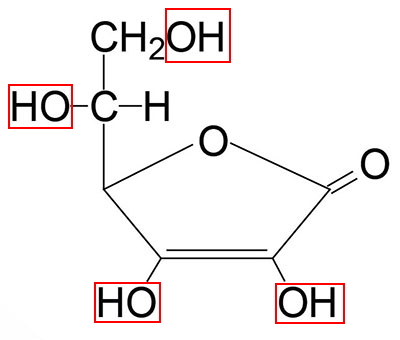
تا اینجا با بیوشیمی انواع ویتامین B آشنا شدیم. آسکوربیکاسید یا ویتامین C ترکیبی است که از اکسایش گلوکز در مسیر اورونیکاسید تشکیل میشود. آنزیم L-گلونو-گاما-لاکتون اکسیداز در این مسیر گلوکولاکتون را به آسکوربیکاسید تبدیل میکند. ژن این آنزیم در انسان فاقد پنج اگزون است. در نتیجه این آنزیم در انسان تشکیل نشده و ویتامین C مورد نیاز باید از رژیم غذایی تامین شود.
ساختار این اسید از یک قند پنج کربنه تشکیل شده و گروههای هیدروکسیل زنجیره جانبی، این اسید را به یک مولکول محلول در آب تبدیل میکند.
این مولکول نیاز به تغییر ساختار در بدن ندارد و آسکوربیکاسید شکل فعال ویتامین است. ویتامین C رژیم غذایی بهوسیله پروتئینهای همانتقال با یون سدیم در غشای لومنی انتروسیتها جذب میشود. این ویتامین فاکتور کاهندهای است که در بسیاری از واکنشهای اکسایش-کاهش متابولیسمی شرکت میکند. آسکوربیکاسید کوفاکتور مونواکسیژنازهای وابسته به مس، لیزیل هیدروکسیلازها، پروپیل هیدروکسیلازها و دوپامین هیدروکسیلاز است.
اضافه شدن گروه عاملی کربوکسیل به باقیماندههای لیزین و پرولین در کلاژن یکی از مهمترین واکنشهای وابسته به آسکوربیکاسید است. به همین دلیل تشکیل بافتهای همبند بدن (تاندون، رباط، بافتهای محافظ و استخوان) و ترمیم زخم بدون حضور ویتامین C مختل میشود. ویتامین C کوفاکتور آنزیمهای مسیر کاتابولیسم آمینواسید تیروزین، سنتز اپینفرین از تیروزین، سنتز کارنیتین (ناقل اسیدهای چرب در غشای میتوکندری)، تشکیل آمید در هورمونهای پپتیدی و سنتز اسیدهای صفرا است.
آسکوربیکاسید پس از اکسایش به سمیدیهیدروآسکوربات و آسکوربات تبدیل میشود. سیمیدهیدروآسکوربات در سیتوپلاسم سلولها بهوسیله سیتوکروم B5 و تیوردوکسین ردوکتاز با مشارکت کوآنزیمهای NADH و NADPH به آسکوربات تبدیل میشود. اما دهیدروآسکوربات در یک واکنش خودبهخودی بهوسیله گلوتاتیون کاهش یافته و به آسکوربات تبدیل میشود.
نقش ویتامین C در هموستازی آهن
پروتئینهای حاوی آهن نقش مهمی در متابولیسم بدن دارند. انتقال اکسیژن از قلب به اندامهای مختلف، تولید ATP در زنجیره انتقال الکترون میتوکندری و فعالیت جایگاه فعال بسیاری از متالوآنزیمها به وجود میزان کافی این عنصر در بدن بستگی دارد. آهن همراه پروتئینها با دریافت یا از دست دادن یک الکترون بین دو حالت فریک ($$Fe^{3+}$$) و فروس ($$Fe^{2+}$$) تغییر میکند. تنظیم اکسایش و کاهش این پروتئینها نقش بسیار مهمی در کاهش تشکیل رادیکالهای آزاد سلول دارد و آسکوربیکاسید در این واکنشهای تنظیمی شرکت میکند.
- آسکوربیکاسید پس از اتصال ترانسفرین-آهن به گیرندههای غشای سلولی، سنتز فریتین (پروتئین ذخیره آهن) را افزایش، اما تجزیه فریتین در لیزوزوم سلول و خروج آهن از سیتوپلاسم را کاهش میدهد.
- ناقل آهن در غشای سلولهای انتروسیت فقط به یونهای دوظرفیتی اجازه عبور از غشا میدهد. به همین دلیل آهن ۳ دریافتی از رژیم غذایی باید قبل از ورود به سلول به آهن ۲ تبدیل شود. آسکوربیکاسید با سه مکانیسم مختلف این واکنش را کاتالیز میکند.
- سیتوکروم b561 در غشای لومنی انتروسیتهای دئودئوم، آنزیم ردوکتازی است که همراه کوفاکتور آسکوربیکاسید آهن ۳ را به آهن ۲ تبدیل میکند. در این واکنش آسکوربیکاسید سیتوپلاسمی ابتدا به رادیکال آسکوربیل و سپس دهیدروآسکوربات اکسید میشود.
- رادیکالهای آسکوربیل موجود در لومن روده با انتقال الکترون به آهن ۳ این ترکیب را برای انتقال بهوسیله پروتئین غشایی آماده میکند.
- آسکوربیکاسید لومن روده میتواند بدون واکنش آنزیمی آهن ۳ را به آهن ۲ تبدیل کند. آهن ۲ از ناقل کاتیون دوظرفیتی و دهیدروآسکوربات تشکیل شده بهوسیله ناقلهای GLUT1 وارد انتروسیتها میشوند.
- فریتین پروتئین ذخیره آهن در سیتوپلاسم سلولها است که از دو زیرواحد سبک و سنگین تشکیل شده است و آهن ۳ را در سلولها ذخیره میکند. این آهن بهوسیله واکنشهای وابسته به آسکوربیکاسید کاهش یافته و در واکنشهای سلولی استفاده میشود.
بیوشیمی انواع ویتامین محلول در چربی
اگر مطلب را تا اینجا دنبال کرده باشید، با بیوشیمی انواع ویتامین های محلول در آب آشنا شدهاید. در ادامه این مطلب از مجله فرادرس، قصد داریم بیوشیمی انواع ویتامین های محلول در چربی را بررسی کنیم. ویتامینهای محلول در چربی برخلاف ویتامینهای محلول در آب کوفاکتورهای آنزیمی نیستند، اما نقش مهمی در فعالیتهای فیزیولوژیکی بدن ازجمله بینایی، لخته شدن خون، تشکیل ساختار استخوانها و عملکرد سیستم ایمنی دارند.
در این بخش از مطلب مجله فرادرس بیوشیمی انواع ویتامینهای محلول در چربی، ساختار و نقش این ویتامینها در فعالیتهای بدن را توضیح میدهیم.
بیوشیمی ویتامین A
ساختار ویتامین A از یک حلقه و یک زنجیره ۸ کربنی تشکیل شده است. این زنجیره کربنی ویتامین A را به یک مولکول غیرقطبی و محلول در چربی تبدیل میکند. این مولکول با سه ساختار آلدهید (رتینال)، الکل (رتینول) و اسید (رتینوئیکاسید) در فعالیتهای سلولی شرکت میکند. این سه مولکول از بتاکاروتن گیاهی مشتق میشوند. رتینول با زنجیره اسید چرب طولانی، منبع جانوری این ویتامین در رژیم غذایی است.
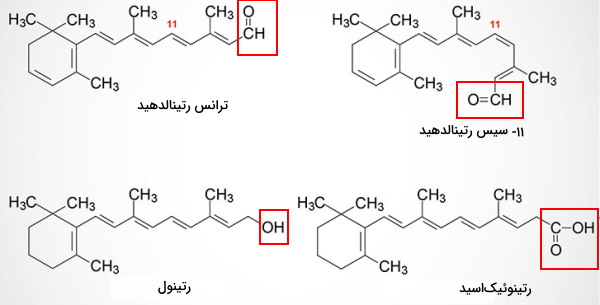
ویتامین A جانوری در ابتدای روده باریک بهوسیله آنزیمهای لیپاز پانکرس از اسیدهای چرب جدا شده و بهوسیله ناقلهای غشایی وارد انتروسیتها میشود. در سیتوپلاسم انتروسیت اسیدهای چرب اشباع بهوسیله آنزیمهای رتینول-لسیتین آسیل ترانسفراز به رتینول اضافه میشود. این ترکیب (رتینیل استر) مثل سایر مولکولهای محلول در چربی یا ساختار کیلومیکرون وارد سیستم لنفاوی و به خون منتقل خواهد شد.
بتاکاروتن دریافتی از مواد غذایی گیاهی بهوسیله یکی از آنزیمهای بتاکاروتن اکسیژناز لومن روده به دو مولکول رتینال تجزیه میشود. رتینال بهوسیله آنزیمهای دهیدروژناز در لومن دئودئوم و با کمک کوآنزیمهای NADPH به رتینول تبدیل میشود. نیمی از بتاکاروتن دریافتی از رژیم غذایی وارد این مسیر میشود. بخش دیگر بتاکاروتن، بهوسیله رسپتورهای غشایی وارد انتروسیت میشود. در سیتوپلاسم انتروسیتها فعالیت آنزیمهای اکسیژناز این ترکیب را به رتینال و فعالیت دهیدروژناز رتینال را به رتینول تبدیل میکند. رتینول پس از اضافه شدن زنجیرههای اسید چرب با ساختارهای کیلومیکرونی از انتروسیت وارد لنف منتقل خواهد شد.
بخشی از رتینول موجود در کیلومیکرونها پس از ورود به سلولهای کبدی در وزیکولهای چربی این اندام ذخیره میشود. بخش دیگر این ویتامین همراه «پروتئینهای اتصالی به رتینول» (Retinol Binding Proteins | RBPs) وارد جریان خون و به اندامهای دیگر منتقل میشود. اتصال RBP به پروتئین ترانستیرتین از دفع کلیوی رتینول جلوگیری میکند. ویتامین A با افزایش مهاجرت لنفوسیتهای T (افزایش بیان اینتگرین $$\alpha4\beta7$$)، ترشح آنتیبادی لنفوسیتهای B، مهار سنتز دیواره سلولی باکتریها و مهار فاکتورها التهابی به فعالیت سیستم ایمنی کمک میکند.
نقش ویتامین A در بینایی
سلولهای استوانهای و مخروطی گیرنده نوری در شبکیه چشم هستند. موج نوری محرک این گیرندهها است و پس از تحریک با آزاد کردن انتقالدهنده عصبی گلوتامات پیام عصبی دیدن را به سلولهای دوقطبی شبکیه چشم منتقل میکنندو. اوپسین بخش اصلی دریافت نور در غشای گیرندههای نوری است. دومین خارجی این پروتئین عرض غشایی با پیوند کووالانسی به رتینال (آلدهید ویتامین A) متصل است. اوپسین سلولهای استوانهای رودوپسین نام دارد و در غشای دیسکهای بخش خارجی این سلول ها قرار دارد. دومین سیتوزولی رودوپپسین به یک G پروتئین ($$G_t$$) و دومین خارج غشایی آن به ۱۱-سیس-رتینال متصل است.
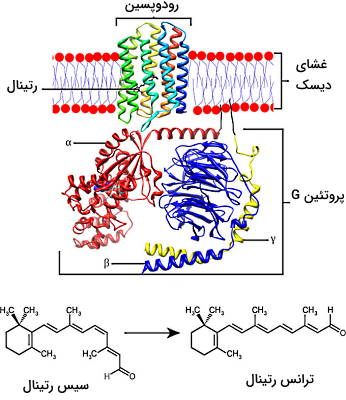
تحریک نوری رودوپسین با تغییر ساختار ۱۱-سیس-رتینال به ترانس رتینال همراه است. این تغییر ساختار سبب تغییر کنفورماسیون رودوپسین به متارودوپسین II میشود. در این شرایط GDP پروتئین G با GTP مبادله، پروتئین فعال و زیرواحد آلفا جدا میشود. اتصال زیرواحد آلفا به بخش تنظیمی آنزیم cGMP فسفودیاستراز با فعال شدن آنزیم، تبدیل cGMP به GMP، کاهش cGMP در فضای داخلی دیسکهای سلول استوانهای و مهار انتقال پتانسل عمل به سلولهای دوقطبی همراه است. مهار انتقال پتانسیل عمل از سلولهای استوانهای به قطبی با مهار آزاد شدن GABA در سیناپس عصب بینایی و انتقال پیام عصبی به مغز همراه است.
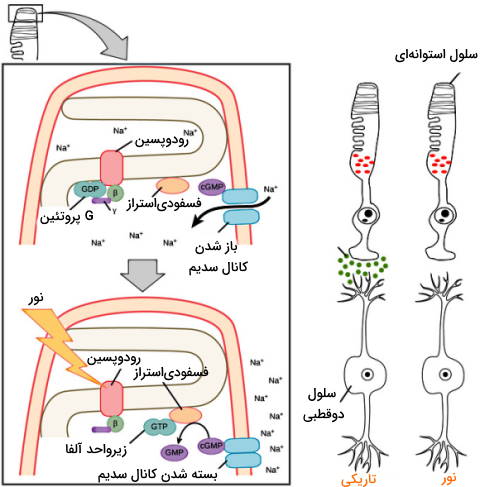
cGMP مولکول تنظیمی کانالهای کاتیونی است. در تاریکی این مولکول با تغییر کنفورماسیون سبب باز شدن کانال، ورود کاتیونهای کلسیم و سدیم به سیتوپلاسم، دپلاریزه شدن غشای سلول استوانهای، آزاد شدن انتقالدهنده عصبی گلوتامات و انتقال پیام بینایی به سلولهای دوقطبی همراه است. دپلاریزه شدن سلولهای دوقطبی سبب آزاد شدن انتقالدهنده عصبی GABA از پایانه آکسون این نورونها در سیناپس با عصب بینایی و مهار انتقال پیام از این عصب به مغز میشود. در نتیجه در تاریکی اجسام را نمیبینیم.
نقش ویتامین A در بیان ژن چیست ؟
رتینال جذب شده در بدن بهوسیله آنزیمهای رتینال دهیدروژناز به رتینوئیکاسید تبدیل میشود.و رتینوئیکاسید یکی از مولکولهای تنظیم بیان ژن در مراحل مختلف تکامل جنین است. این اسید به رسپتورهای داخل سلولی هورمونهای استروئیدی و تیروئیدی متصل میشود. این رسپتورها قبل از اتصال به رتینوئیکاسید به بخشهای ویژه ژنهای پاسخدهنده به رتینوئیکاسید متصل هستند. اتصال رتینوئیکاسید به این گیرندهها بیان ژن های اندامزایی، تکامل صورت و جمجمه و شکلگیری سیستم عصبی را تغییر میدهد. ژنهای پاسخدهنده به رتینوئیکاسید در بزرگسالی تولیدمثل، ایمنی بدن، یادگیری و حافظه را کنترل میکنند.
بیوشیمی ویتامین D
تا اینجا از بیوشیمی انواع ویتامین های محلول در چربی، نقش و ساختار ویتامین A را بررسی کردیم. ویتامینهای D مشتقات کلسترول و دومین ویتامین محلول در چربی است که بیوشیمی آن را توضیح میدهیم. ساختار این ویتامینها از یک هسته شبه استروئید، زنجیره هیدروکربنی و گروه عاملی هیدروکسیل تشکیل شده است.
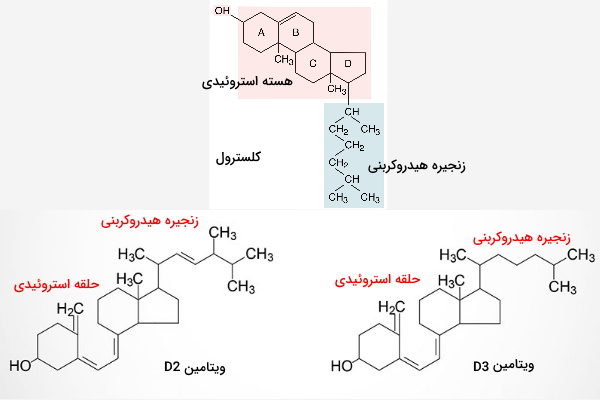
این ویتامین در یک واکنش وابسته به نور و بدون نیاز به آنزیم سنتز میشود. ارگوسترول (استرول گیاهی) و ۷-دهیدروکلسترول (ترکیب حدواسط سنتز کلسترول) پیشسازهای ویتامین D در پوست هستند. برخرود اشعه فرابنفش به پوست با تغییر ساختار ۷-دهیدروکسی کلسترول سبب تولید ویتامین D3 و برخورد این اشعه به ارگوسترول سبب تولید ویتامین D2 میشود. ویتامین D2 (ارگوکلسیفرول) و D3 (کوله کلسیفرول) وارد جریان خون شده و به کبد منتقل می شوند.
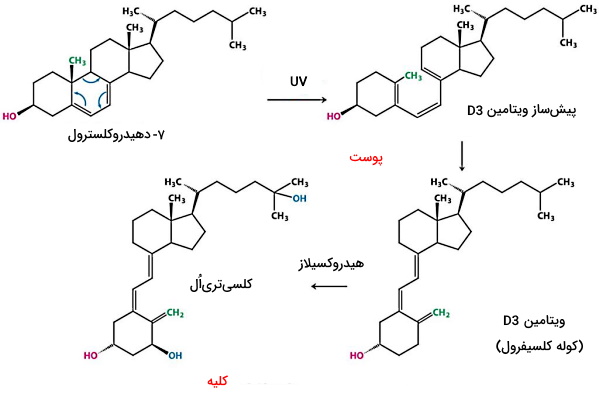
ویتامین D2 و D3 رژیم غذایی پس از جذب در انتروسیتهای روده کوچک همراه گلیکوپروتئین اتصالی به ویتامین D به کبد منتقل میشود. در کبد آنزیمهای هیدروکسیلاز با اضافه کردن گروههای OH به ارگوکلسیفرول این مولکول را به کلسیدیاُل تبدیل میکنند. بیشتر ویتامین D بدن با ساختار کلسی دیاُل در خون جریان دارد و در سلولهای مختلف جذب میشود. کلسیدیاُل در سلولهای توبول نزدیک کلیه با اضافه شدن OH بهوسیله آنزیمهای هیدروکسیلازی غشای داخلی میتوکندری به کلسیتریاُل (ویتامین D فعال) تبدیل میشود. این آنزیم در کراتینوسیتهای پوست، ماکروفاژها و سلو.لهای جفت جنین هم وجود دارد. نقش اصلی کلسیتریاُل در بدن همکاری با هورمون پاراتیروئیدی برای تنظیم کلسیم و فسفر خون است.
هورمون پاراتیروئیدی در پاسخ به کاهش کلسیم خون از غدد چهار غده پاراتیروئید گردن ترشح میشود. اتصال این هورمون به گیرندههای سلولهای کلیه با افزایش بیان ژن سیتوکروم P450 تولید کلسیتریاُل را افزایش میدهد. کلسیتریاُل پس از ورود به سلول به گیرندههای هورمون استروئیدی متصل شده و بیان ژن کالبیندین (پروتئین اتصالی به کلسیم) را افزایش میدهد. این پروتئین بازجذب کلسیم از توبولهای پیچخورده دور و جمعکننده ادرار را افزایش میدهد.
افزایش بیان کالبیندین در انتروسیتها سبب افزایش جذب کلسیم از مواد غذایی و انتقال این یون از غشای لومنی سلولها به غشای پایه (نزدیک رگهای خونی) میشود. به علاوه اتصال کلسیتریاُل به گیرندههای داخل سلولی انتروسیتها بیان ژن کانالهای غشایی کلسیم و پروتئینهای همانتقال کلسیم-سدیم را افزایش میدهد. پروتئین کیناز فعال شده در پاسخ به کلسیتریاُل با فسفوریلاسیون پروتسينهای اتصال محکم انتقال بینسلولی کلسیم و جذب این کاتیون از لومن روده را افزایش میدهد. اتصال این هورمون به گیرندههای استخوان تجزیه ماتریکس این بافت و آزاد شدن کلسیم در خون را به همراه دارد.
برای تنظیم فشار اسمزی و پتانسیل الکتروشیمیایی سلولها، آنیون فسفات معدنی همراه کاتیون کلسیم نیز وارد سلول میشود. افزایش ورود این یونها به انتروسیت به دلیل افزایش بیان پروتئین های همانتقال فسفات-سدیم است. در نتیجه کلسیتریاُل هورمون استروئیدی تنظیم کلسیم و فسفات در بدن انسان است.
بیوشیمی ویتامین E
ویتامین E مخلوطی از مولکولهای توکوفرول و توکوتریانول است. توکوفرولها ترکیبات فنولی و محلول در چربی هستند که از یک حلقه کرومانول و زنجیره ۱۶ کربنه فیتیل تشکیل شدهاند. تفاوت این مولکولها در محل اتصال گروه عاملی متیل به حلقه کرومانول است. در ساختار توکوتریانولها حلقه کرومانول به زنجیره ایزوپرنوئید با سه پیوند دوگانه متصل است.
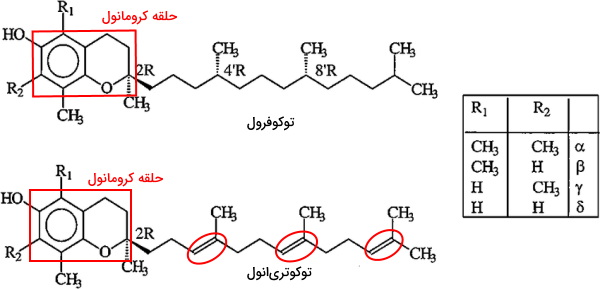
ویتامین E رژیم غذایی پس از ورود به انتروسیتها به شکل کیلومیکرون وارد جریان خون و به کبد منتقل میشود. آنزیمهای کبدی این ویتامین را لیپیدها و پروتئینهای کیلومیکرون جدا میکنند. این ویتامین همراه لیپوپروتئینهای کمچگال (VLDLs) از کبد خارج شده و به اندامهای دیگر منتقل میشود. آلفا توکوفرول بیشتر ویتامین E موجود در VLDLs است. آدیپوسیتهای بافت چربی محل اصلی ذخیره این ویتامین در بدن است.
خنثی کردن اثر رادیکالهای آزاد نقش اصلی ویتامین E در بدن است. این ویتامین از اکسیداسیون اسیدهای چرب غیراشباع در غشای سلولها جلوگیری میکند. برای مثال آلفا توکوفرول پس از انتقال دو الکترون به رادیکالهای آزاد با زنجیره کربنی، با گلوکرونات صفرا ترکیب شده و از بدن خارج میشود. به علاوه گاما توکوفرول و دلتا توکروفرول آنتیاکسیدانهای قوی برای رادیکالهای آزاد نیتروژن هستند.
بیوشیمی ویتامین K
در بخشهای قبلی با بیوشیمی انواع ویتامین های محلول در چربی آشنا شدیم. ویتامین K آخرین عضو این گروه است که ساختار و نقش آن در بدن را توضیح میدهیم. ساختار ویتامین K از یک حلقه کوئینون با زنجیره جانبی هیدروکربنی تشکیل شده است. ویتامین K1 (فیلوکوئینون) در برگ گیاهان و K2 (مناکوئینون) بهوسیله باکتریهای مفید روده انسان سنتز میشود. K3 (منادیون) مکمل صنعتی این ویتامین محلول در چربی است. نقش اصلی این ویتامین تثبیت پروتئینهای شرکتکننده در فرایند انعقاد خون است. این پروتئینها (پروترومبین (فاکتور II)، فاکتور VII، فاکتور IX، فاکتور X، پروتئین C، پروتئین S و پروتئین Z) در کبد سنتز و به شکل غیرفعال وارد خون میشوند. گاما گلوتامیل کربوکسیلاز آنزیمی است که با تغییر باقیمانده گلوتامات این پروتئینها را فعال میکند و ویتامین k کوفاکتور اصلی این آنزیم است. گاما کربوکسی گلوتارات تشکیل شده در پریپروترومبین پس از تشکیل کمپلکیس با یون کلسیم، با فسفولیپیدهای غشایی برهمکنش میدهد. در مرحله بعد در اثر فعالیت آنزیمی فاکتور X به ترومبین فعال تبدیل میشود.
کمبود ویتامینهای محلول در آب
در بخشهای قبلی این مطلب بیوشیمی انواع ویتامین های محلول در آب را توضیح دادیم. اما کمبود این ترکیبات چه مشکلاتی برای بدن ایجاد میکند؟ بیماریهای ایجاد شده به دلیل کمبود این ویتامین بر اثر جهش در کانالهای جذب این ترکیبات در انتروسیتها یا به دلیل کمبود آن در رژیم غذایی ایجاد میشود. کمبود ویتامین B1 در رژیم غذایی در مراحل اولیه منجر به کاهش اشتها، یبوست و احساس تهوع در فرد میشود. کمبود شدید این ویتامین با اختلالهای سیستم عصبی و ضعف همراه است.
کمبود ریبوفلاوین
کمبود ریبوفلاوین رژیم غذایی با خارش و سوزش چشم، التهاب لثه و شکاف لب، التهاب زبان، قرمز شدن چشمها، شوره سر، لرزش بدن، حساسیت زیاد چشم به نور و کندی حرکت بدن همراه است. گوشت مرغ و گاو، تخممرغ، اسفناج، دانه سویا، بادام و گندم منابع غذایی این ویتامین هستند. کمبود نیاسین منجر به التهاب لثه و شکاف لب، کاهش وزن، اسهال، التهاب پوست، افسردگی و اختلال حواس میشود. گوشت مرغ، ماهی تن، بادام زمینی، سیبزمینی، قارچ، هویج، نخودفرنگیو بادام منابع غذایی این ویتامین هستند.
کمبود بیوتین
بیوتین بهوسیله باکتریهای رودهای سنتز و فرد به ندرت به اختلالهای ناشی از کمبود این بیماری مبتلا میشود. مصرف طولانیمدت آنتیبیوتیک یکی از عواملی است که با از بین بردن باکتریهای مفید روده، بیوتین موجود در بدن را کاهش میدهد. ذخیره ویتامین B12 در هپاتوسیتها احتمال ابتلا به اختلالهای ناشی از کمبود این ویتامین را بسیار کاهش میدهد. اما کاهش ترشح فاکتور داخلی از سلولهای حاشیهای کبد به دلیل بیماریهای خودایمنی، با کاهش جذب این ویتامین در روده همراه است.
کمبود فولیک اسید
مهمترین اثر کمبود فولیکاسید در بدن توقف همانندسازی DNA به دلیل اختلال در مسیر سنتز نوکلئوتیدهای تیمین است. در این شرایط سلولهای خونساز در مرحله S چرخه سلولی متوقف میشوند. توقف همانندسازی DNA در مسیر تکامل اریتروسیتها منجر به تشکیل گلبولهای قرمز بزرگ و کمخونی ناشی از آن میشود. جهش ژنی آنزیمهای تتراهیدروفولات ردوکتاز، منجر به اختلال در مسیر سنتز آمینواسید هموسیستئین و تجمع این مولکول در پلاسما میشود. افزایش غلظت هموسیستئین پلاسما با افزایش بیماری رگهای کرونری، اختلال حواس و اختلالات شناختی همراه است. در بخشهای قبلی این مطلب از مجله فرادرس نقش ویتامین C در تغییرات پس از ترجمه کلاژن را توضیح دادیم. کمبود این ویتامین به دلیل ایجاد اختلال از تغییرات پس از ترجمه کلاژن با ضعف عضلانی، سریع کبود شدن پوست، کاهش ترمیم زخم و افزایش خونریزی، پوکی استخوان، خونریزی لثهها و کمخونی همراه است.
کمبود ویتامینهای محلول در چربی
حالا که با بیوشیمی انواع ویتامین های محلول در چربی را توضیح دادیم، راحتتر میتوانیم اختلالهای احتمالی به دلیل کمبود این ویتامینها را متوجه شویم. اختلال در مکانیسمهای جذب چربی بدن و کاهش دریافت ویتامینهای محلول در چربی منجر به اختلال عملکردهای مختلف میشود. برای مثال اختلال در سنتز و ترشح آنزیمهای لیپاز پانکراس با کاهش جذب ویتامینهای محلول در چربی از روده همراه است. در این شرایط حتی اگر ویتامین کافی در رژیم غذایی وجود داشته باشد، بدن توانایی دریافت و استفاده از آن را ندارد.
کمبود ویتامین A
کبد مقدار زیادی از ویتامین A رژیم غذایی را ذخیره و در مواقع لازم در اختیار بافتها قرار میدهد. به همین دلیل کمبود ویتامین A زمانی ایجاد میشود که این ویتامین برای مدت بسیار طولانی از رژیم غذایی حذف شده باشد. کمبود این ویتامین با کاهش بینایی، افزایش احتمال ابتلا به عفونتهای میکروبی، آنمی فقر آهن و خشکی شدی پوست همراه است. به علاوه این ویتامین یکی از آنتیاکسیدانهای قوی بدن است که کمبود آن احتمال آسیب DNA و ابتلا به سرطان را افزایش میدهد.
کمبود ویتامین D
نرمی استخوان مهمترین بیماری ایجاد شده به دلیل کمبود ویتامین D است. کمبود ویتامین D جذب کلسیم از انتروسیتهای روده و انتقال آن به خون را کاهش میدهد. در نتیجه بدن برای جبران کلسیم ماتریکس استخوان را تجزیه میکند. نرمی استخوان بزرگسالان (اوستئومالشیا | Osteomalacia) به دلیل افزایش تجزیه ماتریکس معدنی بافت استخوانی، و نرمی استخوان کودکان (ریکتز | Rickets) به دلیل اختلال در رسوب کلسیم در این ماتریکس ایجاد میشود. افزایش ترشح هورمون پاراتیروئیدی یکی دیگر از مکانیسمهای جبرانی کلسیم است. اما ترشح طولانیمدت این هورمون و افزایش بازجذب کلسیم در توبولهای کلیه منجر به رسوب این کاتیون در بافتهای نرم (Calcification) همراه است.
کمبود آنتیاکسیدان ویتامین E
کمبود آنتیاکسیدان ویتامین E احتمال اکسید شدن لیپیدهای غشایی را افزایش میدهد. اکسیداسیون لیپیدهای غشای نورون و اریتروسیت در این شرایط منجر به اختلال حرکت ماهیچههای اسکلتی، اختلال تکلم، بیماریهای شبکیه چشم، مهار رفلاکس تاندونهای داخلی و شکنندگی غشای گلبول قرمز میشود.
کمبود ویتامین K
ویتامین K مثل بیوتین بهوسیله باکتریهای روده سنتز تولید میشود به همین دلیل مصرف طولانیمدت آنتیبیوتیک با از بین رفتن این باکتریها و اختلالهای ناشی از کمبود ویتامین K به ویژه مهار واکنشهای انعقادی و ترمیم زخم همراه است.
جمعبندی بیوشیمی انواع ویتامین
در این مطلب از مجله فرادرس با بیوشیمی انواع ویتامین آشنا شدیم و ساختار، عملکرد و اختلالهای ایجاد شده به دلیل کمبود انواع ویتامینها را توضیح دادیم. همچنین توضیح دادیم ویتامینها ترکیباتی هستند که در بدن ما سنتز نمیشوند. به همین دلیل مصرف آنها در رژیم غذایی برای سلامت و انجام واکنشهای بیوشیمیایی تولید و تجزیه مواد ضروری است.