بیوشیمی انواع لیپید – به زبان ساده
موجودات زنده از مولکولهای آلی مختلف برای تشکیل ساختارهای خود، تامین انرژی و برقراری ارتباط با موجودات دیگر استفاده میکنند. انواع لیپید ، کربوهیدرات و پروتئین مهمترین درشتمولکولهای آلی در ساختار پروکاریوتها و یوکاریوتها هستند. کربوهیدراتها از اتمهای کربن، هیدروژن و اکسیژن فراوان با فرمول شیمیایی () تشکیل شدهاند این ترکیبات منبع اصلی انرژی در بسیاری از موجودات است. به علاوه انواع آن در تشکیل ساختار دیواره سلولی باکتریها، قارچها، آغازیان و گیاهان شرکت میکنند و در غشای پلاسمایی جانوران به پروتئینها و لیپیدها متصل میشوند. پروتئینها مولکولهای بزرگی هستند که از کنار هم قرار گرفتن آمینواسیدها تشکیل میشوند. الگوی کنار هم قرار گرفتن آمینواسیدها بهوسیله DNA موجود زنده تعیین میشود. انواع پروتئینها در فعالیتهای مختلف سلولی شرکت میکنند. کانالهای غشایی، آنزیمها، هورمونهای پپتیدی، گیرندههای غشایی، فاکتورهای رونویسی و همانندسازی ژنها، اسکلت سلولی و بعضی از انتقالدهندههای عصبی از جنس پروتئین هستند.
- یاد میگیرید ساختار و طبقهبندی انواع لیپید را شناسایی کنید.
- میآموزید لیپیدها چه نقشهایی در ساختار و عملکرد سلول دارند.
- با نقش و تفاوت اسیدهای چرب، فسفولیپیدها، استرولها و موم آشنا میشوید.
- میآموزید مسیرهای متابولیسم، سنتز و تجزیه لیپیدها را توضیح دهید.
- روشهای تحلیلی رایج برای جداسازی و شناسایی انواع لیپید را یاد میگیرید.
- یاد میگیرید هورمونها و متابولیتها چطور متابولیسم لیپید را تنظیم میکنند.


لیپیدها مولکولهای آلی متنوع با تعداد زیاد کربن و آبگریزی زیاد هستند. غشای پلاسمایی ساختار مهمی در تشکیل سلولهای پروکاریوتی و یوکاروتی است که بیش از ۹۰ ٪ آن از انواع لیپیدهای باردار و بدون بار تشکیل میشود. به علاوه بدن مقدار اضافه پروتئین، کربوهیدرات و چربیها را به شکل لیپید تریگلیسرید در بافت چربی ذخیره میکند. استروئیدها گروهی از لیپیدها هستند که مثل هورمونهای پپتیدی وظیفه انتقال پیام بین سلولهای پستانداران را بر عهده دارند. انواع دیگر لیپیدها هورمونهای پاراکرینی هستند که در پاسخ التهابی و تب نقش دارند. بیشتر آنزیمهای سنتز این مولکولهای آلی در بدن پستانداران وجود دارد و دریافت بخش کمی از آنها از رژیم غذایی ضروری است. در این مطلب از مجله فرادرس انواع لیپیدها را به همراه مراحل سنتز، تجزیه و آنالیز آنها را توضیح میدهیم.
انواع لیپید چیست؟
انواع لیپید ها ترکیبات آلی غیرقطبی هستند که آبگریزی ویژگی اصلی آنها است. کربن و هیدروژن دو عنصر اصلی این ترکیبات است. بسیاری از موجودات زنده از این ترکیبات برای ذخیره انرژی استفاده میکنند و بخش اصلی غشای پلاسمایی پروکاریوتها و یوکاریوتها از لیپیدها و پروتئینهای متصل به لیپید تشکیل شده است. این ترکیبات بر اساس عملکرد به انواع ساختاری، ذخیره و مولکولهای انتقال پیام تقسیم میشوند. بر اساس ساختار، لیپیدها را میتوان به انواع اسیدهای چرب، تریگلیسیریدها، فسفولیپیدها، استرولها، موم، گلیکولیپیدها و لیپوپروتئينها تقسیم کرد.
اسیدهای چرب
اسیدهای چرب زنجیرههای هیدروکربنی با گروه عاملی کربوکسیلیکاسید (COOH) هستند که از ۳ تا ۳۶ اتم کربن تشکیل میشوند. در یک انتهای این زنجیره یک گروه کربوکسیل و در انتهای دیگر آن گروه متیل () قرار دارد. کربن آلفا اولین کربن انتهای کربوکسیل، کربن بتا دومین کربن انتهای کربوکسیل و کربن اومگا آخرین کربن انتهای متیل است. این ترکیبات بر اساس تعداد کربن به انواع اسیدهای چرب کوتاه با کمتر از ۶ کربن، اسیدهای چرب متوسط بین ۶ تا ۱۲ کربن و اسیدهای چرب بلند با بیش از ۱۲ کربن تقسیم میشوند. با افزایش تعداد کربنها، نقطه ذوب این ترکیبات افزایش مییابد. به همین دلیل در دمای ۲۵ درجه سانتیگراد، اسیدهای چرب کوتاه مایع و اسیدهای چرب بلند جامد هستند.
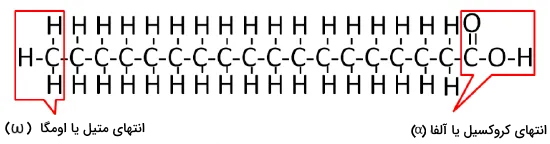
اسیدهای چرب بر اساس نوع پیوندهای به انواع اشباع (بدون پیوند دوگانه) و غیر اشباع (دارای پیوند دوگانه) تقسیم میشوند. اسیدهای چرب غیراشباع دو ساختار سیس (Cis) و ترانس (Trans) دارند. پیوندهای دوگانه حداقل یک کربن با هم فاصله دارند. در ساختار ترانس هیدروژنهای اتمهای کربن درگیر پیوند دو گانه موقعیت فضایی خلاف جهت هم و در ساختار سیس هیدروژنها موقعیت فضایی همجهت دارند. ساختار اکثر اسیدهای چرب طبیعی سیس است. ساختار اسیدهای چرب سیس سبب افزایش بینظمی بین مولکولها و کاهش نقطه ذوب نسبت به اسیدهای چرب اشباع و ترانس میشود.

نام گذاری اسیدهای چرب
برای نامگذاری اسیدهای چرب از روشهای مختلفی استفاده میشود. سادهترین روش نامگذاری استفاده از تعداد کربنها است. در این روش برای نامگذاری اسیدهای چرب اشباع از پسوند آنوئیک (anoic-) و اسیدهای چرب غیراشباع انوئیک (enoic-) استفاده میشود. شمارش کربنها در این روش از انتهای آلفا شروع میشود. برای مثال اوکتانوئیکاسید، اسید چرب اشباع ۱۸ کربنه و اوکتادکنوئیکاسید، اسید چرب غیراشباع ۱۸ کربنه است. در روش دیگر اسیدهای چرب را بر اساس ترکیبات دارای این اسید نامگذاری میکنند. بر این اساس پالمتیکاسید، اسید چرب ۱۶ کربنهای است که نام آن از واژه «پالم» (Palm) به معنی درخت خرما در لاتین گرفته شده است. تنها روش تشخیص اسیدها در این روش به خاطر سپردن نام آنها است. در جدول زیر نام تعدادی از اسیدهای چرب آمده است.
| نام اسید چرب | تعداد کربن |
| لائوریکاسید | ۱۲ کربن - اشباع |
| میریستیکاسید | ۱۴ کربن - اشباع |
| پالمیتیکاسید | ۱۶ کربن - اشباع |
| استئاریکاسید | ۱۸ کربن - اشباع |
| آراشیدیکاسید | ۲۰ کربن - اشباع |
| لیگنوسریکاسید | ۲۴ کربن - اشباع |
| پالمیتولئیکاسید | ۱۶ کربن - یک پیوند دوگانه |
| اولئیکاسید | ۱۸ کربن - یک پیوند دوگانه |
| آراشیدونیکاسید | ۲۰ کربن - چهار پیوند دوگانه |
در روش دیگر میتوان تعداد کربنهای اسیدچرب را با دو نقطه از تعداد پیوندهای دوگانه جدا کرد. در این روش شمارش کربنها از انتهای آلفا شروع میشود. برای مثال 18:0 اسید چرب ۱۸ کربنهای است که پیوند دوگانه ندارد و 18:2 اسید چرب ۱۸ کربنهای است که دو پیوند دوگانه دارد. برای نمایش جایگاه پیوند دوگانه از نماد دلتا () استفاده میشود. شماره کربنهای درگیر در پیوند سمت راست علامت دلتا نوشته میشود. برای مثال اسید چرب ۱۸ کربنهای است که یک پیوند دوگانه بین نهمین و دهمین کربن، و اسیدچرب ۲۰ کربنهای است که یک پیوند دوگانه روی نهمین و یک پیوند دوگانه روی دوازدهمین کربن دارد. نامگذاری اومگا یکی دیگر از روشهای نامگذاری اسیدهای چرب و تنها تفاوت آن با روش قبلی این است که شمارش کربنها از انتهای متیل شروع میشود. بر این اساس ، اسید چرب ۱۸ کربنهای است که یک پیوند دوگانه بین کربن ۹ و ۱۰ دارد.
اسیدهای چرب اومگا
در ساختار اسیدهای چرب اومگا بیش از یک پیوند دوگانه سیس وجود دارد. در اسیدهای چرب اومگا ۳ سومین کربن از انتهای متیل و در اسیدهای چرب اومگا ۶ ششمین کربن از انتهای متیل در تشکیل اولین پیوند دوگانه شرکت میکند.
تری گلیسریدها
تریگلیسیرید، تریگلیسرول، تریآسیلگلیسرول یا چربی سادهترین انواع لیپید ها هستند که از اتصال گلیسرول به سه اسیدچرب تشکیل میشوند. گلیسرول الکلی با سه گروه هیدروکسیل (OH) و سه کربن است. هر یک از اسیدهای چرب با پیوند استری (-C-O-CO-) به گلیسرول متصل میشود. اسیدهای چرب این ترکیب ممکن است یکسان یا متفاوت باشد. بیشتر تریگلیسریدهای طبیعی از اسیدهای چرب یکسان تشکیل شده است. تریگلیسریدها ترکیبات غیرقطبی و نامحلول در آب هستند.
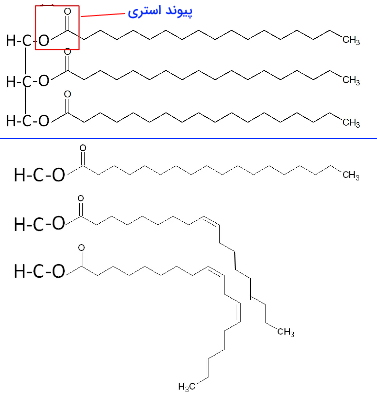
این ترکیبات در بیشتر یوکاریوتها ساختارهایی کروی در سیتوزول تشکیل میدهند و انرژی مورد نیاز متابولیسم سلول را ذخیره میکنند. تریگلیسرید مهرهداران در سلولهای آدیپوسیت (سلولهای چربی) و در گیاهان در دانههای روغنی ذخیره میشود. برای تامین انرژی، اسید چرب این ترکیبات بهوسیله آنزیمهای لیپاز در آدیپوسیتها و سلولهای زاینده گیاهان از گلیسرول جدا و وارد مسیرهای کاتابولیسم میشود. در بعضی از جانوران تریگلیسرید در بافتهای زیر پوست جمع میشود و علاوه بر تامین انرژی، مثل عایقی از تغییر دمای بدن با تغییرات محیطی جلوگیری میکند.
لیپیدهای آرکئاباکتری ها
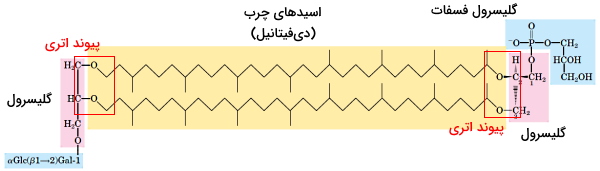
زیستگاه آرکئاباکتریها محیطهای با pH بسیار اسیدی یا قلیایی، دمای بسیار بالا و غلظت یونی بسیار زیاد است. به همین دلیل غشای پلاسمایی آنها از لیپیدهای منحصر به فردی تشکیل شده است. ساختار اصلی این لیپیدها مثل تریگلیسریدها از اسیدهای چرب و گلیسرول تشکیل میشود. با این تفاوت که دو اسید چرب بسیار بلند (۳۲ کربنه) در دو انتها با پیوند اتر به گلیسرول و هر گلیسرول به یک کربوهیدرات یا فسفوگلیسرول متصل میشود. به این لیپیدها، گلیسرول دیآلکیل گلیسرول تترا اتر گفته میشود.
موم
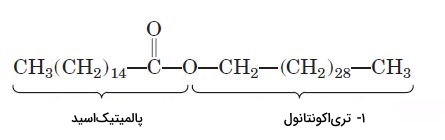
«موم» (Wax) یکی از انواع لیپید است که از اسیدچرب بلندی (۱۴ تا ۳۶ کربنه) تشکیل میشود. ااسیدهای چرب این لیپید با پیوند استری به یک الکل بلند زنجیر (۱۶ تا ۳۰ کربنه) متصل است. ساختار این ترکیبات شبیه تریگلیسریدها است، اما نقطه ذوب بالاتر و آبگریزی بیشتری دارند. موم منبع ذخیره انرژی در پلانکتونهای اعماق دریاها است. موم ترشحشده از غدد عرق گوش میانی انسان، از ورود میکروبها و ذرات گرد و غبار به بخشهای داخلی گوش جلوگیری میکند. لایه مومی سطح برگ گیاهان به کاهش تبخیر آب کمک میکند و لایه مومی سطح پرهای پرندگان از خیس شدن هنگام شنا جلوگیری میکند.
انواع فسفولیپید
فسفولیپیدها ترکیب اصلی غشای پلاسمایی باکتریها، آرکئاباکتریها، آغازیان، جانوران و گیاهان است. ساختار این لیپیدها از الکل، اسیدچرب و فسفات تشکیل شده است. فسفولیپیدها به دو گروه گلیسرولیپیدها و اسفنگولیپیدها تقسیم میشوند.
ساختار گلیسروفسفولیپیدها مثل تریگلسیرید از اتصال اسیدهای چرب به گلیسرول تشکیل میشود. اما در در فسفولیپیدها دو اسید چرب به دو OH متصل شده و OH سوم با فسفات جایگرین شده است. سر الکلی بخش آبدوست و اسیدهای چرب بخش آبگریز این لیپیدها است. این ویژگی فسفولیپیدها نقش مهمی در تشکیل غشای پلاسمای، اندامکهای غشادار و وزیکولها دارد.
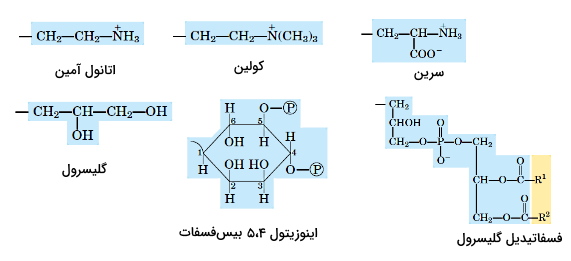
انواع گلیسروفسفولیپیدها مشتقات فسفاتیدیدکاسید هستند که با اضافه شدن گروههای اتانول آمین، کولین، سرین، اینوزیتول ۴،۵-بیسفسفات، گلیسرول و فسفاتیدیل گلیسرول به فسفات تشکیل میشوند. این گروهها با فسفات پیوند فسفودیاستری تشکیل میدهند. گلیسروفسفولیپیدها را میتوان با اضافه کردن فسفاتیدیل به گروه اضافه شده نامگذاری کرد. برای مثال از اتصال اتانول آمین به گروه فسفات، فسفاتیدیل اتانول آمین تشکیل میشود. کاردیولیپین، فسفولیپید غشای داخلی میتوکندری است که از اتصال فسفاتیدیل به فسفات تشکیل شده است. معمولا یک اسید چرب اشباع (۱۶ یا ۱۸ کربنه) و یک اسید چرب غیراشباع (۱۸ یا ۲۰ کربنه) در گلیسروفسفولیپیدها وجود دارد.
در بعضی از گلیسروفسفولیپیدها، گروههای آسیل (اسیدهای چرب) با پیوند اتری (-C-O-C-) به گلیسرول متصل هستند. از اتصال اتری اسیدهای چرب اشباع با گلیسرول، آلکیل اتر لیپیدها و از اتصال اتری اسید چرب غیراشباع با یک پیوند دوگانه بین اولین و دومین کربن، پلاسمالوژنها تشکیل میشود. پلاسمالوژنها لیپیدهای اختصاصی غشای پلاسمایی در ماهیچههای قلبی مهرهداران هستند. لیپیدهای اتری در غشای هالوباکتریها، آغازیان مژکدار و بعضی از بیمهرهها نیز وجود دارد.
انواع گلیکولیپید
گلیکولیپیدها از اتصال مونو، دی و اولیگوساکاریدها به سرآمید یا دیآسیل گلیسرول تشکیل میشوند. اسفنگولیپیدها از اعضای خانواده فسفولیپیدها و گلیکولیپیدها هستند. آمینوالکل اسفنگوزین در این لیپیدها جایگزین گلیسرول شده است. از اتصال یک اسیدچرب به گروه آمینی این الکل، سرآمید و از اتصال گروههای فسفوکولین، گلوکز و اولیگوساکاریدها به گروه OH سرآمید، انواع اسفنگولیپیدها تشکیل میشوند. اسفنگولیپیدها به سه گروه اسفنگومیلینها، گلیکولیپیدهای بدون بار و گانگلیوزیدها تقسیم میشوند.
- اسفنگومیلینها: اسفنگومیلینها، فسفولیپدهایی هستند که در ساختار آنها فسفوکولین یا فسفواتانول آمین به هیدروکسیل سرآمید متصل است. این لیپیدها در غشای پلاسمایی جانوران به ویژه سلولهای شوآن و اولیگودندروسیتها وجود دارد. این سلولها در سیستم عصبی مرکزی و محیطی غلاف میلین آکسون را تشکیل میدهند.
- گلیکواسفنگولیپیدها: فراوانی این لیپیدها در نیمه خارجی غشا بیشتر است. در ساختار گلیکواسفنگولیپیدها یک یا چند کربوهیدرات به OH سرآمید متصل میشود. در سربروزیدها، سرآمید به یک گلوکز یا گالاکتوز متصل است. گلوکوسربروزیدها در غشای بافتهای غیرعصبی و گالاکتوسربروزیدها در غشای بافتهای عصبی وجود دارد. گلوبوزیدها از اتصال حداقل یک گلوکز، گالاکتوز یا N-استیل گالاکتوزآمین تشکیل شده است. این لیپیدها در pH بدن بدون بار هستند.
- گانگلیوزیدها: ساختار گانگلیوزیدها از سایر اسفنگولیپیدها پیچیدهتر است. در این ترکیبات یک گروه اولیگوساکاریدی خطی یا منشعب به سرآمید اضافه میشود. سیالیکاسید (N-استیل نورامیکاسید) یکی از کربوهیدراتهایی است که در تمام گانگلوزیدها وجود دارد. به دلیل وجود این اسید، گانگلوزیدها در pH بدن بار منفی دارند. میزان بار منفی به تعداد سیالیکاسیدها بستگی دارد.
گالاکتولیپیدها و سولفولیپیدها گروه دیگری از گلیکولیپیدها هستند که فراوانی آنها در غشای تیلاکوئیدهای کلروپلاست و غشای پلاسمایی سلولهای گیاهی بیشتر است. در ساختار گالاکتولیپیدها یک یا دو گروه گالاکتوز به دیآسیلگلیسرول و در ساختار سولفولیپیدها گلوکز همراه با سولفونات () به دیآسیلگلیسرول وصل میشود. گالاکتولیپیدها بدون بار هستند و سولفولیپیدها بار منفی دارند.
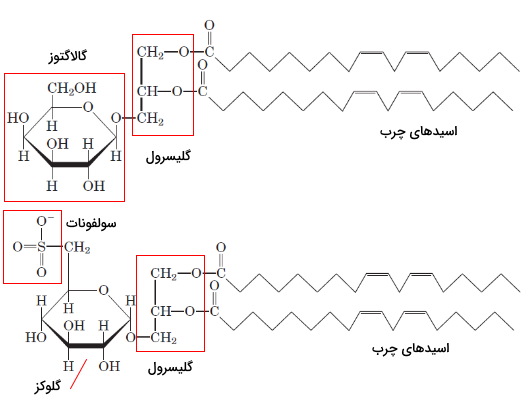
انواع استرول ها
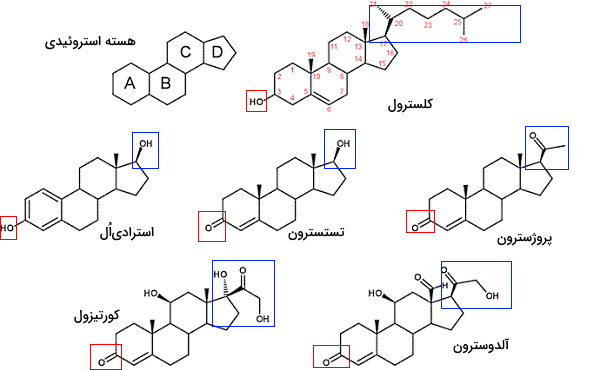
استرولها یکی دیگر از انواع لیپید ها هستند که از ادغام چهار حلقه کربنی تشکیل میشوند و در ساختار غشای بیشتر یوکاریوتها وجود دارد. این لیپیدها در پستانداران در انتقال پیام بین سلولها نیز شرکت میکنند. سه حلقه ساختار اصلی استرولها از ۶ و یک حلقه آن از ۵ کربن تشکیل شده است که ساختار سهبعدی صفحهای دارند. به این ساختار هسته استروئیدی گفته میشود. کلسترول بیشترین استرول غشای پلاسمایی سلولهای جانوری است که از سر قطبی (هیدروکسیل کربن سوم) و انتهای غیرقطبی (حلقهها و زنجیره جانبی کربن ۱۷) تشکیل شده است. این ترکیب پیشساز بعضی از هورمونها و اسیدهای صفرا است.
فیتوسترولها یا استرولهای گیاهی مثل کلسترول جانوران از هسته استروئیدی، گروه OH و زنجیره جانبی آلکیل تشکیل شده است. بتا-سیتوسترول، کامپسترول، استیگماسترول، کامپستانول، براسیکاسترول و سیکلوآرتنول فیتوسترولهایی هستند که در تعداد کربنها و نوع پیوند کربنی (پیوند یگانه یا دوگانه) با هم اختلاف دارند. استانولها، فیتوسترولهای اشباع هستند و در حلقههای استروئیدی آنها پیوند دوگانه وجود ندارد. پروکاریوتها آنزیم سنتز استرولها را ندارند.
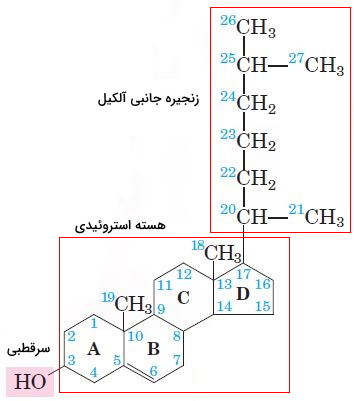
هورمون های استروئیدی
استروئیدها از اکسایش استرولها تشکیل میشوند. در این ترکیبات گروه OH کربن ۳ به کتون اکسید شده است. استروئیدها از استرولها قطبیتر هستند. در بدن انسان غده فوق کلیه و غدد جنسی اندامهایی هستند که وظیفه سنتز هورمونهای استروئیدی را بر عهده دارند. این ترکیبات بهوسیله حاملهای پروتئینی در خون به اندامهای هدف منتقل و با عبور از غشای پلاسمایی به گیرندههای سیتوپلاسمی یا هستهای متصل میشود. گیرنده این هورمونها، فاکتورهای رونویسی هستند که با تغییر بیان ژن عملکرد سلول را تغییر میدهند. کورتیزول و آلدوسترون هورمونهای استروئیدی غدد فوق کلیه و استروژن، پروژسترون و تستسترون هورمونهای استروئیدی غدد جنسی هستند. این هورمونها از تغییرات آنزیمی کلسترول سنتز میشوند.
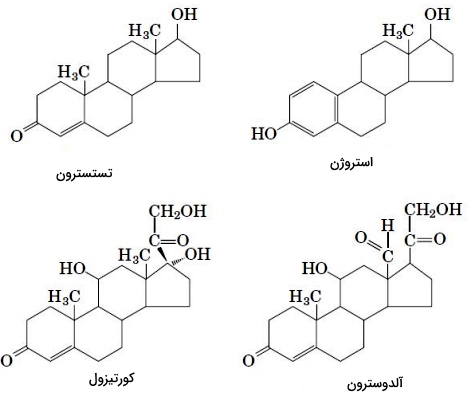
انواع ایکوزانوئیدها
ایکوزانوئیدها هورمونهای پاراکرین مهرهداران هستند. این ترکیبات برخلاف هورمونهای اندوکرین بهوسیله خون، بین اندامهای مختلف منتقل نمیشوند و عملکرد سلولهای نزدیک به هم را تغییر میدهند. این ترکیبات از آراشیدونیک اسید () مشتق میشوند و در تولید مثل، پاسخهای التهابی، ایجاد تب و درد، لخته شدن خون، تنظیم فشار خون، ترشح اسیدهای معده نقش دارند. ایکوزانوئیدها به سه گروه پروستوگلاندینها، ترومبوکسانها و لوکوترینها تقسیم میشوند.
- پروستوگلاندینها: پروستوگلاندینها ترکیبات ۲۰ کربنهای با یک حلقه پنجکربنه هستند که در تمام سلولهای هستهدار بدن تولید میشوند. این ترکیبات اولین بار از بافت پروستات استخراج شد. ساختار این ترکیبات در تعداد گروههای OH تفاوت دارد. پروستوگلاندینها با تنظیم ستز cAMP عملکرد سلول را تغییر میدهند. PGD2 بهوسیله ماستسلها سنتز میشود و به عملکرد سیستم ایمنی کمک میکند. اتصال این لیپید به گیرندههای همراه G پروتئین با تولید ماستسلهای بیشتر، فراخوانی سلولهاس Th2، ائوزینوفیلها و بازوفیلها به محل عفونت و ایجاد واکنشهای آلرژی همراه است. عملکرد PGE2 به نوع پروتئین G همراه گیرنده بستگی دارد. اتصال این لیپید به گیرندههای همراه Gq با انقباض ماهیچههای صاف نایژهها و لوله گوارش، اتصال آن به گیرندههای همراه Gs با استراحت ماهیچههای صاف نایژهها، لوله گوارش و رگها و اتصال آن به گیرندههای همراه Gi با کاهش ترشح اسید معده، افزایش مخاط معده، انقباض رحم در دوارن بارداری، انقباض ماهیچههای صاف لوله گوارش، مهار تجزیه لیپیدها و افزایش سنتز انتقالدهندههای عصبی سیستم خودمختار همراه است.
- ترومبوکسانها: ترومبوکسانها ترکیبات ۲۰ کربنهای هستند که از یک حلقه پنجکربنه با اکسیژن اتری تشکیل شدهاند و از پلاکتها ترشح میشود. این ترکیبات به تشکیل لخته خون کمک میکنند و جریان خون محل تشکیل لخته را کاهش میدهند. داروهای ضدالتهاب غیراستروئیدی با مهار آنزیم تروبوکسان H2 سنتتاز التهاب را کاهش میدهند. این آنزیم مرحله اول تشکیل ترومبوکسان از آراشیدونیکاسید را کاتالیز میکند.
- لوکوترینها: لوکوترینها ترکیبات ۲۰ کربنهای با چهار پیوند دوگانه بین کربنها هستند. آنزیم آراشیدونیک ۵-لیپوکسیژناز تشکیل این ترکیبات از آراشیدونیک اسید را کاتالیز میکند. لوکوترینها فاکتورهای التهابی هستند که از گلبولهای سفید ترشح میشود. این لیپیدها با اتصال به گیرندههای همراه پروتئین G در سلولها تغییر ایجاد میکنند. عملکرد این ترکیبات به نوع پروتئین G همراه گیرنده بستگی دارد.
انواع ویتامین های محلول در چربی
ویتامینها ترکیباتی ضروری برای رشد طبیعی و بقای مهرهداران هستند که آنزیم سنتز آنها در بدن این جانوران وجود ندارد. این ترکیبات به دو گروه محلول در آب و محلول در چربی تقسیم میشوند. ویتامینهای محلول (A، k، E و D) در چربی لیپیدهای ایزوپرنوئید هستند که از کنار هم قرار گرفتن واحدهای ایزوپرن تشکیل میشوند.
ویتامین D3 یا کولهکلسیفرول در سلولهای پوست از واکنش فتوشیمیایی ۷-دیهیدروکلسترول با اشعه فرابنفش تشکیل میشود. این ترکیب با واکنشهای آنزیمی سلولهای کلیه و کبد به ۱،۲۵-دیهیدروکسیکولهکلسیفرول تبدیل میشود. ۱،۲۵-دیهیدروکسیکولهکلسیفرول شکل فعال ویتامین D در خون است که در تنظیم بازجذب کلسیم در رودهها، کلیه و استخوانها شرکت میکند. اشکال مختلف ویتامین A یا رتینول به عنوان هورمون و رنگدانه تشخیص نور در چشم مهرهداران عمل میکند. رتینوئیکاسید یکی از اشکال ویتامین A است که پس از اتصال به گیرندههای درونسلولی بیان ژن در سلولهای مختلف به ویژه پوست را تغییر میدهد. رتینال یکی از مشتقات ویتامین A و رنگدانه همراه پروتئین اوپسین در گیرندههای نوری چشم است.
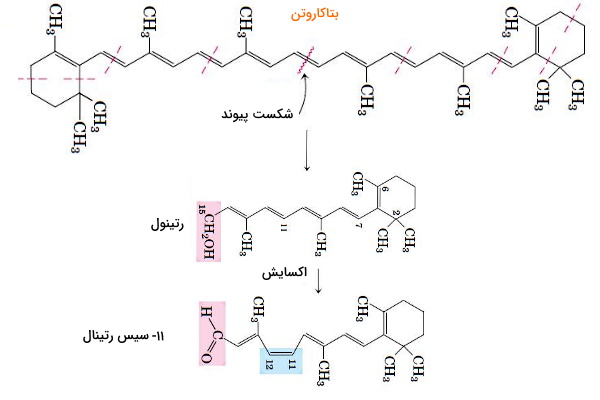
بتاکاروتن رنگدانه زرد گیاهان است که با واکنشهای آنزیمی در بدن مهرهداران به ویتامین A تبدیل میشود. بتاکاروتن ترکیبی ۴۰ کربنه با دو حلقه ششتایی است که از شکستن یکی از پیوندهای دوگانه زنجیره کربنی آن، دو مولکول ویتامین A تولید میشود. اکسایش C15 رتینول (الکل) را به رتینال (آلدهید) تبدیل میکند. از اکسایش C15 رتینال، رتینوئیکاسید تولید میشود.
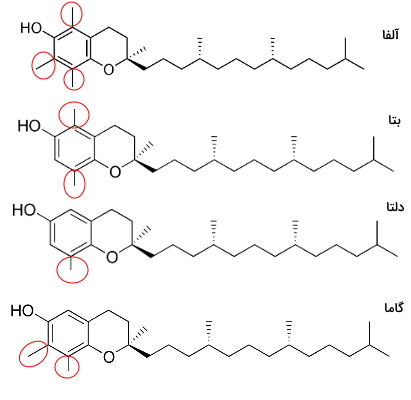
ویتامین E نام کلی گروهی از لیپیدها به نام توپوفرولها است که از حلقه آروماتیک کورومانول و زنجیره هیدروکربنی ۱۶ کربنه تشکیل شدهاند. توپوفرولها بر اساس موقعیت گروههای متیل روی حلقه کرومانول، به انواع تقسیم میشوند. این ترکیبات هیدروفوب در بدن همراه غشای سلولی، لیپوپروتئینهای خون و گرانولهای ذخیره لیپید هستند. حلقه آروماتیک توپوفرولها با رادیکالهای آزاد واکنش داده و اثر آنها را خنثی میکند. مقدار زیادی این ترکیبات در تخممرغ و روغنهای گیاهی وجود دارد.
ویتامین K گروهی از ترکیبات هستند که از حلقه کوئینون و زنجیره ایزوپرنی تشکیل شدهاند. تفاوت ترکیبات این گروه در تعداد اتمهای کربن زنجیره متصل به حلقه است. ویتامین K به تشکیل لخته خون کمک میکند. حلقه این ترکیب در واکنشهای اکسایش-کاهش تشکیل پروتروموبین فعال شرکت میکند. پروترومویبن پروتئازی است که با تجزیه پیوند پپتیدی پروتئین فیبرینوژن خون پروتئین غیرمحلول فیبرین را تولید میکند. فیبرین به سلولهای خونی متصل و لخته خون تشکیل میشود. ویتامین K1 (فیلوکوئینون) در برگ گیاهان سبز وجود دارد و ویتامین K2 (مناکوئینون) بهوسیله فلور میکروبی روده مهرهداران سنتز میشود.
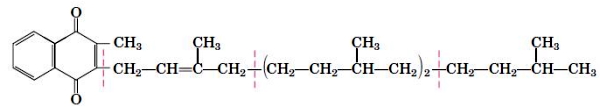
دولیکول چیست؟
دولیکولها ترکیبات آلی تشکیل شده از زیرواحدهای ایزوپرنوئید و الکل هستند که به تشکیل دیواره سلولی باکتریها و اتصال پلیساکاریدها به پروتئینها و لیپیدهای یوکاریوتی کمک میکند. این ترکیبات آبگریزی زیادی دارند و پس از اتصال به غشای پلاسمایی با برهمکنشهای هیدروفوب در اتصال کربوهیدراتهای فعال به مولکولهای زیستی دیگر شرکت میکنند.
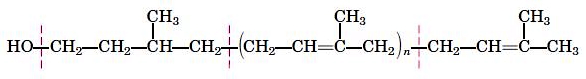
انواع لیپوپروتئين ها
در بخشهای قبلی این مطلب از مجله فراردس توضیح دادیم که انواع لیپیدها ترکیبات آبگریزی هستند که برای انتقال در خون به پروتئینهای حامل نیاز دارند. وظیفه لیپوپروتئینها کمک به جذب این ترکیبات در روده کوچک و انتقال آنها بین اندامها است. لیپوپروتئینهای پلاسما بر اساس اندازه، ترکیب لیپیدها و نوع آپوپروتئین به انواع کیلومیکرونها، باقیماندههای کلیومیکرون، لیپوپروتئین با چگالی بسیار پایین (VLDL)، لیپوپروتئین با چگالی متوسط (IDL)، لیپوپروتئین با چگالی پایین (LDL) و لیپوپروتئين با چگالی بالا (HDL) تقسیم میشوند.
- کلیومیکرون: کیلومیکرونها، لیپوپروتئینهای غنی از تریگلسیرید هستند که در سلولهای روده کوچک برای انتقال این لیپیدها به بافتهای محیطی (ماهیچه قلبی، ماهیچه اسکلتی، آدیپوسیتها و بافت غدد پستان) و کبد سنتز میشوند. در ترکیب این لیپوپروتئین علاوه بر تریگلیسرید، فسفولیپید و کلسترول استری (کلسترول متصل به زنجیره بلند اسید چرب) وجود دارد. کیلومیکرونها از آپوپروتئینهای A-I، AIV، A-V، B48، C-II، C-III و E تشکیل شدهاند و قطر آنها بر اساس مقدار لیپید رژیم غذایی ین ۷۵ تا ۶۰۰ نانومتر است. کیلومیکرونها کمترین مقدار فسفولیپید را نسبت به سایر لیپوپروتئینها دارند.
- باقیماندههای کلیومیکرون: باقیماندههای کلومیکرون با جدا شدن تریگلیسرید از کیلومیکرونها در بافتهای محیطی تشکیل میشود. این لیپوپروتئینها کوچکتر هستند و بیشتر از کلسترول استری تشکیل شدهاند.
- لیپوپروتئین با چگالی بسیار پایین: لیپوپروتئین با چگالی بسیار پایین ترکیبی از آپوپروتئینهای B100، C-I، C-II، C-III و E، تریگلیسریدها، کلسترول استر و کلسترول است که در کبد سنتز میشود. وظیفه این لیپوپروتئین انتقال لیپیدها به بافتهای محیطی است. درصد تریگلیسیریدهای VLDL از کیلومیکرون کمتر و درصد کلسترول، کلسترول استر و فسفولیپید آن بیشتر است. آپوپروتئین اصلی این ترکیبات B-100 است.
- لیپوپروتئین با چگالی متوسط: لیپوپروتئین با چگالی متوسط با جدا شدن تریگلیسرید از VLDL در بافتهای ماهیچهای و آدیپوسیتها تشکیل میشود. کلسترول IDL از VLDL بیشتر و قطر آن کمتر است.
- لیپوپروتئین با چگالی پایین: لیپوپروتئین با چگالی پایین از VLDL و IDL مشتق میشود. این لیپوپروتئینها غنی از کلسترول و کلسترول استرها هستند و وظیفه انتقال بخش اصلی کلسترول به اندامهای محیطی را بر عهده دارند. آپوپروتئین اصلی این ترکیبات مثل لیپوپروتئينهای با چگالی بسیار پایین B100 است. این لیپوپروتئینها اندازه و چگالی متفاوتی دارند. افزایش LDLهای کوچک با افزایش تریگلیسرید در خون، کاهش HDL، افزایش وزن و دیابت نوع II همراه است. تمایل LDLهای کوچک به گیرنده LDL سطح سلولها بسیار کمتر است. در نتیجه این ترکیبات برای مدت طولانیتر در خون میمانند و احتمال رسوب آنها در رگ افزایش مییابد.
- لیپوپروتئين با چگالی بالا: لیپوپروتئینهای با چگالی بالا کوچکترین (حدود ۱۱ نانومتر) لیپوپروتئینهای خون با بیشترین نسبت پروتئین به لیپید هستند. این ترکیبات بیشترین مقدار کلسترول و کمترین مقدار تریگلیسرید را دارند. وظیفه HDL انتقال کلسترول از بافتهای محیطی به کبد است. افزایش این ترکیبات در خون، احتمال ابتلا به تصلب شریان را کاهش میدهد. HDL از آپوپروتئینهای A-I، A-II، A-IV، C-I، C-II، C-III و E تشکیل شده است. این لیپوپروتئینها را میتوان بر اساس چگالی، اندازه، بار الکتریکی و ترکیب آپوپروتئینها به انواع مختلف تقسیم کرد. در همه این ترکیبات A-I آپوپروتئین اصلی است.
آپوپروتئینها علاوه بر تشکیل ساختار لیپوپروتئین در اتصال به گیرندههای سلولی و فعال یا مهار کردن آنزیمها نقش دارند. ویژگی و عملکرد آپوپروتئینها در جدول زیر آمده است.
| آپوپروتئین | محل سنتز | عملکرد |
| APO A-I | کبد و روده | پروتئین اصلی HDL، اتصال به گیرندههای SRB1، فعال کردن آنزیم لسیتین-کلسترول ترانسفراز (تبدیل کلسترول به کلسترول استر) |
| APO A-II | کبد | پروتئین HDL، فعال کردن لیپاز کبد |
| APO A-IV | روده | پروتئین کلیومیکرون و HDL |
| APO A-V | کبد | پروتئین کیلومیکرون، فعال کننده تریگلیسرید لیپاز |
| APO B48 | روده | پروتئین کیلومیکرون |
| APO B-100 | کبد | پروتئین VLD، IDL و VLDL، اتصال به گیرنده LDL |
| APO C-I | کبد | پروتئین LDL و HDL، فعالکننده لسیتین کلسترول آسیلترانسفراز |
| APO C-II | کبد | کوفاکتور تریگلیسرید لیپاز |
| APO C-III | کبد | مهار اتصال لیپوپروتئین لیپاز و ورود لیپید به سلول |
| APO E | کبد | پروتئین تمام لیپوپروتئینها، اتصال به گیرنده LDL |
لیپوپروتئین لیپاز چیست؟
لیپوپروتئین لیپاز آنزیمی است که در ماهیچه اسکلتی، ماهیچه قلبی و بافت چربی تولید و به پس از ترشح به سلولهای اندوتلیوم مویرگها متصل میشود. این آنزیم اسیدهای چرب را از تریگلیسرید کیلومیکرونها و VLDL جدا میکند. اسید چرب با عبور از غشا بهوسیله انتشار ساده یا ناقلهای پروتئینی وارد سیتوپلاسم سلولها میشود. Apo CII و Apo A-V کوفاکتورهای این آنزیم هستند. ترشح انسولین سنتز این آنزیم را افزایش میدهد.
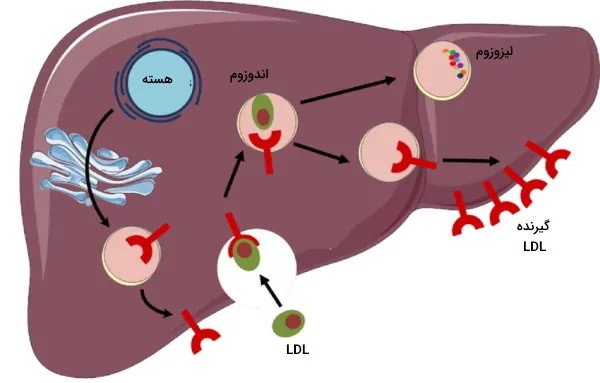
وورد کلسترول به سلول
گیرندههای LDL در غشای تمام سلولهای هستهدار بدن انسان وجود دارد. اما فراوانی آن در هپاتوسیتها بیشتر است. اتصال آپوپروتئین B100 به این گیرندهها با تشکیل پوشش کلاترین در بخش داخلی غشا و اندوسیتوز LDL همراه است. پس از ادغام اندوزوم با لیزوزوم، کلسترول استرهای LDL به اسیدهای چرب و کلسترول، و آپوپروتئین B100 به اسیدهای آمینه تجزیه میشود. کلسترول آزاد در غشای پلاسمایی قرار مییگرد یا به شکل کلسترول استر در گرانولهای چربی ذخیره میشود.
متابولیسم انواع لیپید
اگر بخشهای قبلی این مطلب از مجله فرادرس را دنبال کرده باشید، با ساختار انواع لیپید آشنا شدهاید. در این بخش با متابولیسم این ترکیبات آشنا میشوید. متابولیسم مولکولهای زیستی در دو مجموعه واکنشهای آنابولیسم و کاتابولیسم تشکیل شده است. این مولکولها در واکنشهای آنابولیسمی سنتز و در واکنشهای کاتابولیسمی به انرژی تبدیل میشوند. در بدن انسان واکنشهای آنابولیسم چربیها در سیتوپلاسم و شبکه اندوپلاسمی سلولها (به ویژه سلولهای کبدی و چربی) و واکنشهای کاتابولیسم این درشتمولکولها در میتوکندری، پراکسیزوم و شبکه اندوپلاسمی سلولها (به ویژه سلولهای ماهیچه اسکلتی، آدیپوسیتها و ماهیچه قلبی) انجام میشود. اسیدهای چرب در سیتوپلاسم پروکاریوتها و کلروپلاست گیاهان سنتز میشود.
آنابولیسم انواع لیپید
انواع لیپید وظایف متنوعی در بدن انسان و سایر موجودات زنده انجام میدهند. به همین دلیل علاوه بر دریافت این ترکیبات از رژیم غذایی، سنتز آنها بهوسیله مکانیسمهای تنظیم شده در بدن اهمیت زیادی دارد. اسید چرب در ساختار بیشتر لیپیدها وجود دارد. به همین دلیل در این بخش از مطلب مجله فرادرس ابتدا سنتز اسیدهای چرب را توضیح میدهیم و در ادامه سنتز تریگلیسریدها، فسفولیپیدها و استرولها را بررسی میکنیم.
سنتر اسیدهای چرب
مانوئیل-کوآ ترکیب سهکربنه پایه برای سنتز تمام اسیدهای چرب است. این ترکیب در یک واکنش برگشتناپذیر بهوسیله آنزیم استیل کوآ کربوکسیلاز از استیل کوآ تشکیل میشود. این آنزیم در باکتریها از سه و در جانوران از یک زنجیره پلیپپتیدی تشکیل شده است. هر دو نوع آنزیم تکزیرواحدی و چندزیرواحدی در گیاهان وجود دارد. در هر دو نوع استیل کوآ کربوکسیلاز، بیوتین با پیوند آمیدی به گروه آمین زنجیره اصلی آمینواسیدهای لیزین زنجیره پلیپپتیدی متصل است. در مرحله اول سنتز مانوئیل کوآ، گروه کربوکسیل بیکربنات با مصرف یک مولکول ATP به بیوتین متصل میشود. در مرحله بعد، کربوکسیل از بیوتین به استیل کوآ انتقال مییابد و مانوئیل کوآ تشکیل میشود.
سنتز اسیدهای چرب از مانوئیل کوآ یک واکنش تراکمی است که بهوسیله آنزیم سنتتاز انجام میشود. ساختار این آنزیم در پروکاریوتها و یوکاریوتها کمی متفاوت است، اما اسیدهای چرب در چهار مرحله مشابه سنتز میشوند. آنزیم سنتتاز پروکاریوتها از ۷ زنجیره پلیپپتیدی به نام پروتئین ناقل آسیل (ACP)، استیل کوآ-ACP-ترانساستیلاز (AT)، بتا کتوزیل-ACP-سنتتاز (KS)، مانوئیل کوآ-ACP- ترانسفراز (MT)، بتا کتوزیل-ACP-ردوکتاز (KR)، بتا هیدروکسی آسیل-ACP دهیدراتاز (HD) و انوئیل-ACP ردوکتاز (ER) تشکیل شده است.
گروه استیل، استیل کوآ به گروه تیول (SH-) باقیمانده سیستئین یکی از زنجیرههای کمپلس آنزیمی (بتا کتوآسیل ACP سنتتاز) و مانوئیلِ مانوئیل کوآ به گروه تیول پروتئین ناقل آسیل متصل میشود. آنزیم ترانساستیلاز این واکنشها را کاتالیز میکند. پروتئین ناقل آسیل در پروکاریوتها مولکول کوچکی با یک گروه پروستتیک - فسفوپانتُتئین است. هیدرولیز پیوند فسفودیاستری بین این گروه و استیل کوآ انرژی لازم برای انجام مراحل بعدی سنتز اسید چرب را فراهم میکند. چهار مرحله بعدی در سنتز اسیدهای چرب تکرار میشود.
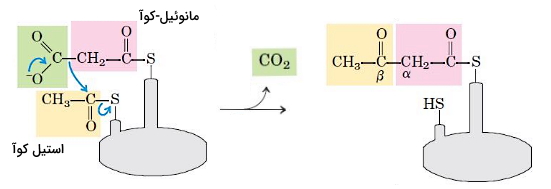
- تراکم: اولین مرحله تشکیل اسیدهای چرب واکنش تراکمی استیل و مانوئیل برای تشکیل استواستیل-ACP است. آنزیم بتاکتوزیل-ACP سنتتاز این واکنش را کاتالیز میکند و یک مولکول در این واکنش آزاد میشود.
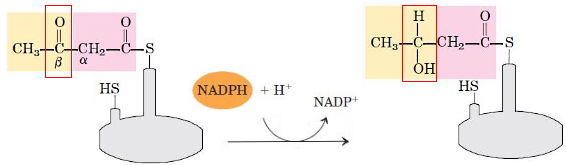
- کاهش گروه کربونیل: در این مرحله آنزیم بتا کتوزیل-ACP ردوکتاز گروه کربونیل C3 را به هیدروکسیل کاهش میدهد. NADPH اهداکننده الکترون در این واکنش است. در پایان این مرحله D-بتا-هیدروکسی بوتیریل-ACP تشکیل میشود.
- دهیدراتاسیون: در این مرحله گروه هیدروکسیل C3 و هیدروژن C2 بهوسیله آنزیم بتا هیدروکسی آسیل-ACP دهیدراتاز، به شکل مولکول آب از D-بتا-هیدروکسی بوتیریل-ACP جدا و پیوند دوگانه تشکیل میشود. در پایان این مرحله ترانس--بوتنوئیل-ACP تشکیل میشود.
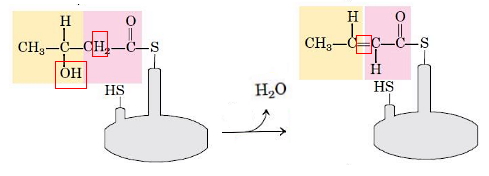
- کاهش پیوندی دوگانه: در مرحله آخر، آنزیم انوئیل-ACP ردوکتاز با اضافه کردن گروههای هیدروژنی ترانس--بوتنوئیل-ACP را به بوتیریل-ACP تبدیل میکند. NADPH اهداکننده الکترون در این واکنش است.
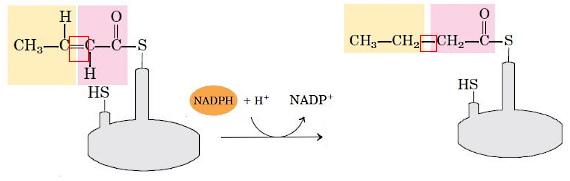
برای افزایش طول زنجیره هیدروکربنی اسید چرب، بوتیریل از ACP به سیستئین کمپلکس آنزیمی منتقل و گروه مانوئیل جدید به ACP متصل میشود. مراحل چهارگانه تا تشکیل زنجیره ۱۶ کربنه اشباع ادامه مییابد. در این مرحله پالمیتوئیل از آنزیم جدا میشود. به این ترتیب معادله زیر واکنش کلی سنتز اسیدچرب را نشان میدهد.
تقریبا در تمام سلولهای یوکاریوتی غیرفتوسنتزکننده، استیل کوآ لازم برای سنتز اسیدهای چرب از اکسیداسیون پیرووات و کاتابولیسم اسکلت کربنی آمینواسیدها در میتوکندری تولید میشود. در غشا داخلی میتوکندری ناقل استیل کوآنزیم A وجود ندارد. به همین دلیل این ترکیب به شکل سیترات به سیتوپلاسم منتقل میشود. در مرحله اول استیل کوآ در چرخه سیتریکاسید بهوسیله آنزیم سیترات سنتتاز با اوگزالواستات ترکیب شده و سیترات تشکیل میشود و سیترات بهوسیله ناقلهای غشایی وارد سیتوزول شده و بهوسیله آنزیم لیاز با مصرف ATP به استیل کوآ و اوگزالواستات تبدیل میشود.
در غشای میتوکندری ناقل اوگزالواستات نیز وجود ندارد. به همین دلیل این ترکیب بهوسیله آنزیم مالات دهیدروژناز سیتوزولی به مالات تبدیل و بهوسیله ناقل مالات-آلفا کتوگلوتارات به میتوکندری منتقل میشود. از اکسایش مالات در ماتریکس میتوکندری اوگزالواستات تشکیل میشود.
در سلولهای جانوری پالمیتیکاسید پیشساز اسیدهای چرب اشباع بلندتر در شبکه اندوپلاسمی و میتوکندری است. آنزیمهای سنتتاز این مسیر با آنزیم سیتوپلاسم تفاوت دارد و کوآنزیم A جای ACP را در این واکنشها میگیرد. اما گروههای کربنی در چهار مرحله مشابه به پالمیتوئیل کوآ اضافه میشود. پالمیتات و استئارات پیشساز پالمیتولئات () و اولئات () هستند. آنزیم کاتالیزکننده این واکنش (دسچوراز | desaturase) از یک بخش اکسیداز، یک بخش اکسیژناز و سیتوکروم P-450 تشکیل شده است.
آنزیم دسچوراز پستانداران فقط تشکیل پیوند دوگانه بین C9 و C10 را کاتالیز میکند. اما دسچوارز کلروپلاست و شبکه اندوپلاسمی گیاهان تشکیل پیوند دوگانه C9، C12 و C15 را کاتالیز میکند. در نتیجه لینولئات () در پستانداران اسید چرب ضروری است و بهوسیله رژیم غذایی تامین میشود. آراشیدونیک پیشساز ایکوزانوئیدها است که از اضافه شدن استیل و پیوندهای دوگانه به لینولئات سنتز میشود. اسیدهای چرب موادغذایی و سنتزی بر اساس نیاز موجود برای تشکیل غشای پلاسمایی به فسفولیپید با برای ذخیره انرژی به تریگلیسرید تبدیل میشود.
سنتز تریگلیسرید
علاوه بر تریگلیسرید سنتز شده در بدن و دریافتی از رژیم غذایی، بخشی از کربوهیدرات جانوران به شکل گلیسرول در تریگلیسرید ذخیره میشود. سلولهای جانوری برای تشکیل تریگلیسرید و گلیسروفسفولیپیدها به گلیسرول ۳-فسفات و آسیل-کوآ نیاز دارند. بخش اصلی گلیسرول ۳-فسفات از دیهیدروکسی استن فسفات تشکیل شده در گلیکولیز و بخش کمی از آن با اضافه شدن فسفات به گلیسرول بهوسیله آنزیم گلیسرول کیناز تولید میشود. آسیل کوآ از واکنش اسیدهای چرب با کوآنزیم A بهوسیله آنزیم آسیل-کوآ سنتتاز تشکیل میشود.
در مرحله اول سنتز تریگلیسرید دو گروه آسیل بهوسیله آنزیم آسیل ترانسفراز به هیدروکسیلهای گلیسرول ۳-فسفات اضافه و دیآسیل گلیسرول ۳-فسفات یا فسفاتیدیکاسید تشکیل میشود. در مرحله بعد، فسفاتیدیکاسید فسفاتاز گروه فسفات را هیدرولیز و ۱،۲-دیآسیل گلیسرول تولید میکند. با اضافه شدن گروه آسیل سوم، تریگلیسرید تشکیل میشود.
سنتز فسفولیپیدها
در سلولهای یوکاریوتی فسفولیپیدها در بخش خارجی غشای شبکه اندوپلاسمی صاف یا غشای داخلی میتوکندری سنتز میشود. فسفاتیدیکاسید مورد نیاز برای سنتز فسفولیپیدها با روش مشابه سنتز تریگلیسریدها یا بهوسیله آنزیم دیآسیل گلیسرول کیناز تشکیل میشود. در روش دوم گروه هیدروکسیل C3 ابتدا به یک نوکلئوتید CDP متصل میشود. در مرحله بعد، CMP با حمله نوکلئوفیلی سر قطبی (برای مثال گروه OH سرین) جدا شده و یک گروه فسفات سر قطبی را به دیآسیل گلیسرول متصل میکند.
در سلولهای یوکاریوتی فسفاتیدیل گلیسرول، کاردیولیپین و فسفاتیدیل اینوزیتول از دیآسیل گلیسرول-CDP تشکیل میشود. در پستانداران فسفاتیدیل سرین از جایگزینی سرین باسر قطبی فسفاتیدیل اتانول آمین بهوسیله آنزیم فسفاتیدیل اتانول آمین سرین ترانسفراز یا فسفاتیدیل سرین دکربوکسیلاز سنتز میشود. فسفاتیدیل کولین در این جانوران از اضافه گروه کولین-GDP به OH فسفاتیدیکاسید تشکیل میشود. فسفاتیدیل کولین در سلولهای کبدی از اضافه شدن گروههای متیل به فسفاتیدیل اتانول آمین بهوسیله آنزیمهای متیلاز نیز سنتز میشود.
سنتر استرول ها
کلسترول یکی از انواع لیپید های ضروری بسیاری از پستانداران است که بهوسیله تمام سلولهای بدن این جانوران سنتر میشود. کلسترول مثل اسیدهای چرب از در چهار مرحله واکنشهای آنزیمی از استیل کوآنزیم A تشکیل میشود.
- سنتر موالونات از استات: در این مرحله ابتدا دو مولکول استیل کوآ بهوسیله آنزیم تیولاز با هم ترکیب شده و استواستیل کوآ تشکیل میشود. از ترکیب استواستیل کوآ با سومین استیل کوآ بهوسیله آنزیم سنتتاز، بتا هیدروکسی-بتا-متیل گلوتاریل-کوآ (HMG-CoA) تشکیل میشود. در مرحله بعد بتا هیدروکسی-بتا-متیل گلوتاریل-کوآ بهوسیله آنزیم HMG-CoA ردوکتاز در غشای شبکه اندپلاسمی صاف به موالونات تبدیل میشود. NADPH اهداکننده الکترون در این واکنش است.
- تبدیل موالونات به ایزوپرن: در این مرحله موالونات در دو مرحله با دریافت دو گروه فسفات از دو مولکول ATP و بهوسیله آنزیم کیناز به ۵-پیروفسفات موالونات تبدیل میشود. ۵-پیروفسفات موالونات بهوسیله آنزیم دکربوکسیلاز با مصرف ATP به ۳-فسفو-۵-پیروفسفات موالونات تبدیل میشود. در مرحله بعد، آنزیم پیرو فسفات دکربوکسیلاز گروه کربوکسیل و فسفات C3 را جدا میکند و -ایزوپنتیل پیروفسفات تشکیل میشود. -ایزوپنتیل پیروفسفات در یک واکنش برگشتپذیر بهوسیله فسفاتاز به دیمتیل آلیل پیروفسفات تبدیل میشود.
- تشکیل اسکوئالن: در این مرحله از اتصال -ایزوپنتیل پیروفسفات و دیمتیل آلیل پیروفسفات بهوسیله آنزیم پرنیل ترانسفراز و جدا شدن یک گروه پیروفسفات، ترکیب دهکربنه جرانیل پیروفسفات تشکیل میشود. از اتصال جرانیل پیروفسفات به یک دیمتیل آلیل پیروفسفات ترکیب ۱۵ کربنه فرنسیل پیروفسفات سنتز میشود. از ترکیب دو مولکول فرنسیل پیروفسفات بهوسیله آنزیم اسکوئالن سنتتاز و جدا شدن پیروفسفاتها، اسکوئالن تشکیل میشود.
- تشکیل حلقه از اسکوئالن: در این مرحله از اکسید شدن C3 اسکوئالن بهوسیله آنزیم مونواکسیژناز، اسکوئالن ۲،۳-اپوکسید تشکیل میشود. با تشکیل چهار حلقه در ساختار حلقوی این مولکول، لانوسترول در جانوران، استیگماسترول در گیاهان و ارگوسترول در قارچها تشکیل میشود. لانوسترول پس از ۲۰ مرحله واکنش آنزیمی به کلسترول تبدیل میشود.
بیشتر کلسترول مهرهداران در کبد سنتز میشود. بخش بسیار کمی از کلسترول در ساختار غشای سلولهای کبدی قرار گرفته و باقیمانده آن به شکل کلسترول صفرا، اسیدهای صفرا و کلسترول استر به اندامهای دیگر منتقل میشود. هورمونهای استروئیدی انسان از تغییر کلسترول در واکنشهای آنزیمی سنتز میشوند. در مرحله اول سنتز این ترکیبات، کلسترول بهوسیله آنزیم دسمولاز با جدا شدن ۶ کربن زنجیره جانبی و اضافه شدن اکسیژن، به ترکیب ۲۱ کربنه «پرگننولون» (Pregnenolone) تبدیل میشود. پرگننولون بهوسیله آنزیم ۳-بتا هیدروکسی استروئید دهیدروژناز به پروژسترون تبدیل میشود. آنزیم ۱۷-آلفا هیدروکسیلاز در زونا فاسیکلاتای قشر فوق کلیه پروژسترون را به ۱۷-آلفا هیدروکسی پروژسترون تبدیل میکند. ۱۷-آلفا هیدروکسی پروژسترون بهوسیله آنزیم ۲۱-آلفا هیدروکسیلاز به ۱۱-دئوکسی کورتیزول و ۱۱-دئوکسی کورتیزول بهوسیله آنزیم ۱۱-بتا هیدروکسیلاز به هورمون کورتیزول تبدیل میشود. این هورمون بدن را برای سازگاری با استرس آماده میکند.
در زونا گلومروسای قشر فوق کلیه، آنزیم ۲۱-آلفا دهیدروکسیلاز پروژسترون را به ۱۱-دئوکسی کورتیکواسترون تبدیل میکند. این ترکیب بهوسیله آنزیم ۱۱-بتا هیدروکسیلاز به کورتیکواسترون و کورتیکواسترون بهوسیله آنزیم آلدوسترون سنتتاز به آلدوسترون تبدیل میشود. اتصال این هورمون به گیرنده بازجذب آب و سدیم در نفرونهای کلیه را افزایش میدهد. در زونا رتیکولای قشر فوق کلیه، پروژسترون بهوسیله آنزیم ۱۷-آلفا هیدروکسیلاز به ۱۷-آلفا هیدروکسی پروژسترون تبدیل میشود. ۱۷-آلفا هیدروکسی پروژسترون بهوسیله آنزیم ۱۷،۲۰-لیاز به دیهیدرواپی اندروسترون و دیهیدرواپی اندروسترون بهوسیله آنزیم ایزومراز به «آندروستندیون» (Androstenedione) تبدیل میشود. آندروستندیون به بافتهای دیگر منتقل و به تستسترون تبدیل میشود. در سلولها لیدینگ بیضه مردان، تستسترون با مکانیسم مشابه غده فوق کلیه سنتز میشود. به علاوه در این سلولها آنزیم آروماتاز، آندروستندیون را به استرون و ۱۷-کتوردوکتاز استرون را به استرادیاُل (استروژن) تبدیل میکند.
کاتابولیسم انواع لیپید
در بخشهای قبلی این مطلب از مجله فرادرس ساختار و مسیرهای سنتز انواع لیپید را توضیح دادیم. در این بخش تجزیه این ترکیبات را بررسی میکنیم. در بعضی از پروکاریوتها و یوکاریوتها انواع لیپید تنها منبع تامین انرژی است یا بخشی از انرژی مورد نیاز فعالیتهای سلولی را فراهم میکند. بیشتر انواع لیپید از زنجیره هیدروکربنی اسیدهای چرب و سر قطبی تشکیل شده است. در این ترکیبات اسید چرب و سر قطبی وارد مسیرهای مختلف کاتابولیسمی میشوند.

فسفولیپازهای A1، 2، C و D وظیفه جدا کردن اسیدهای چرب از فسفولیپیدها را بر عهده دارند. فسفولیپاز A1 پیوند استری اسید چرب با C1 الکل، فسفولیپاز A2 پیوند استری بین اسید چرب با C2 الکل، فسفولیپاز C پیوند فسفودیاستری بین C3 و گروه فسفات، و فسفولیپاز D پیوند بین سر قطبی (برای مثال اینوزیتول) و گروه فسفات را هیدرولیز میکند. این لیپازها به انتقال پیام بین سلولها و جدا کردن اسیدهای چرب برای تامین انرژی کمک میکنند.
تریگلیسریدها در فرایندی به نام لیپولیز به گلیسرول و اسیدهای چرب هیدرولیز میشود. چربیهای رژیم غذایی پس از جذب در سلولهای دیواره روده کوچک به شکل لیپوپروتئینها به ویژه کیلومیکرونها به اندامهای دیگر منتقل میشود. در غشای اندوتلیال مویرگهای نزدیک اندامها آنزیم لیپوپروتئین لیپاز اسیدهای چرب را از گلیسرول جدا میکند.
اسیدهای چرب کوتاه زنجیر با انتشار ساده و اسیدهای چرب بلند با کمک ناقلهای پروتئینی وارد سلول میشود. گلیسرول بهوسیله آنزیم کیناز به گلیسرول ۳-فسفات تبدیل و کلیسرول ۳-فسفات به دیهیدروکسی استن فسفات تبدیل میشود. سپس آنزیم تریوز ایزومراز دیهیدروکسی استن فسفات را به گلیسرآلدهید ۳-فسفات تبدیل و این ترکیب در مسیر گلیکولیز به پیرووات اکسید میشود. اسیدهای چرب پس از انتقال به میتوکندری به مولکولهای استیل کوآ اکسید میشود.
در گرانولهای لیپیدی سلولهای چربی، غدد فوق کلیه، تخمدانها و بیضهها، استرول استرها و تریگلیسریدها در مرکز، و فسفولیپیدها اطراف آن قرار دارد. پرپیلین پروتئینی است که سطح این گرانولها را میپوشاند و لیپیدها را دور از دسترس لیپاز و محیط آبی سیتوپلاسم قرار میدهد. در مواقع نیاز بدن به انرژی اتصال هورمونهای گلوکاگون و اپینفرین به گیرنده غشایی آدیپوسیتها با فعال شدن آدنیلات سیکلاز و افزایش cAMP در سلول همراه است. cAMP پروتئين کیناز A را فعال میکند.
کیناز A با اضافه کردن گروههای فسفات به پرپیلین ساختار این پروتئین اطراف گرانولهای چربی را به هم میریزد. در نتیجه لیپیدها در دسترس لیپاز حساس به هورمون قرار میگیرند. این آنزیم تریگلیسریدها را به اسیدهای چرب و گلیسرول هیدرولیز میکند. اسیدهای چرب بهوسیله پروتئین آلبومین خون به ماهیچه قلبی، ماهیچه اسکلتی و قشر کلیه منتقل و در این سلولها اکسید میشود.
اکسیداسیون اسیدهای چرب
اکسیداسیون اسیدهای چرب در میتوکندری، پراکسیزوم (به ویژه گیاهان) و شبکه اندوپلاسی انجام میشود. در میتوکندری و پراکسیزوم اکسیداسیون از انتهای آلفای اسیدهای چرب شروع شده و به آن بتا اکسیداسیون گفته میشود. در شبکه اندوپلاسمی اکسیداسیون از انتهای اومگا شروع شده و به آن اومگا اکسیداسیون گفته میشود. در این بخش از مجله فرادرس ابتدا انتقال اسیدهای چرب به میتوکندری، سپس بتا اکسیداسیون در میتوکندری و در آخر آلفا و اومگا اکسیداسیون را توضیح میدهیم.
اسیدچربهای کوتاه (۱۲ کربنه و کمتر) با انتشار ساده از غشای میتوکندری عبور و وارد ماتریکس میشوند. اما اسیدچربهای بلند (۱۴ کربنه و بیشتر) با سه مرحله واکنش آنزیمی از غشا عبور میکنند. در مرحله اول این واکنشها اسیدهای چرب آزاد بهوسیله آنزیم آسیل کوآ سنتتاز به کوآنزیم A متصل میشود. آسیل کوآ در واکنشهای سنتز لیپیدهای غشایی در سیتوپلاسم شرکت میکند یا بهوسیله کارنیتین به فضای بین دو غشای میتوکندری منتقل میشود. کارنیتین (۳-هیدروکسی-۴-N-تریمتیل آمینوبوتیرات) آمین نوع چهارم در غشای میتوکندری است. کارنیتین استیل ترانسفراز I در غشای خارجی میتوکندری قرار دارد و اسیدهای چرب را از کوآنزیم A به هیدروکسیل کارنیتین منتقل میکند. سپس آسیل کارنیتین استر از کانالهای غشای خارجی وارد فضای بین غشایی میشود.
آسیل کارنیتین استر با عبور از ناقلهای پروتئینی غشای داخلی وارد ماتریکس میتوکندری میشود. در این مرحله آنزیم کارنیتین آسیل ترانسفراز غشای داخلی اسیدچرب را از کارنیتین جدا و به کوآنزیم متصل میکند و کارنیتین با عبور از ناقلها به سیتوپلاسم بر میگردد.
بتا اکسیداسیون اسیدهای چرب اشباع مثل سنتز این اسیدها، از چهار مرحله واکنش آنزیمی تکرار شونده تشکیل شده است. در مرحله اول این واکنشها آنزیم آسیل کوآ دهیدروژناز بین کربن آلفا و بتای اسید چرب پیوند دوگانه ایجاد و ترانس--انول-کوآ تشکیل میشود. دهیدروژناز این مرحله بخشی از زنجیره انتقال الکترون غشای داخلی میتوکندری است که الکترونهای آسیل کوآ را به مولکول FAD منتقل میکند. در مرحله دوم با اضافه شدن مولکول آب به پیوند دوگانه ترانس--انول-کوآ بهوسیله آنزیم انول کوآ هیدراتاز به L-بتا هیدروکسیآسیل-کوآ تبدیل میشود.
در مرحله سوم این واکنشها آنزیم بتا-هیدروسیل-کوآ دهیدروژناز الکترونهای C2 را به منتقل میکند و بتا کتوزیل کوآ سنتز میشود. در مرحله آخر این واکنش آنزیم تیولاز انتهای کربوکسیل اسیدهای چرب را به یک کوآنزیم A منتقل میکند. در پایان این واکنش یک مولکول استیل کوآ و یک آسیل کوآ با دو کربن کمتر تشکیل میشود.
الکترون مولکولهای FADH2 و NADH تشکیل شده از بتااکسیداسیون اسید چرب وارد زنجیره انتقال الکترون غشای داخلی میتوکندری میشود. در این مسیر از مجموع الکترونهای هر مولکول FADH2 و NADH چهار ATP تولید میشود. در نتیجه از بتااکسیداسیون پالمیتوئیکاسید (۱۶ کربنه) ۸ استیل کوآ و ۲۸ ATP تولید میشود. استیل کوآ تشکیل شده در این واکنشها وارد چرخه کربس (در ماتریکس) یا مسیر سنتز اجسام کتونی میشود.
استیل کوآ در چرخه سیتریکاسید با اوگزالواستات ترکیب شده و سیترات (شش کربنه) تولید و سیترات پس از شش مرحله واکنش آنزیم به اوگزالواستات تبدیل میشود. در این واکنشها کربنهای استیل کوآ به اکسید و سه مولکول NADH، یک مولکول FADH2 و یک مولکول ATP تولید میشود. الکترونهای NADH و FADH2 به تشکیل ADT بیشتر در زنجیره انتقال الکترون غشای داخلی کمک میکند.

بتااکسیداسیون اسیدهای چرب غیراشباع با یک پیوند دوگانه شبیه بتااکسیداسیون اسیدهای چرب اشباع است، اما یک مرحله آنزیمی بیشتر دارد. کربنهای این درشتمولکولها پس از ورود به ماتریکس میتوکندری به مولکولهای استیل کوآ اکسید میشوند. اکسیداسیون تا زمانی ادامه دارد که پیوند دوگانه روی C3 آسیل کوآ قرار گیرد. در این شرایط آنزیم انول کوآ دهیدراتاز پیوند دوگانه سیس را به ترانس تبدیل میکند و واکنشها مثل بتااکسیداسیون اسیدهای چرب اشباع ادامه مییابد. برای اکسیداسیون اسیدهای چرب با بیش از یک پیوند دوگانه آنزیم دیانول ردوکتاز جایگاه پیوند دوگانه و ایزومراز موقعیت فضایی پیوند دوگانه (تبدیل سیس به ترانس) را تغییر میدهد.
بتااکسیداسیون اسیدهای چرب فرد کربن نیز مثل سایر اسیدهای چرب انجام میشود. با این تفاوت که پس از جدا شدن آخرین استیل کوآ، پروپیونیل کوآ (زنجیره سه کربنه) باقی میماند. این ترکیب پس از سه مرحله واکنش آنزیمی به سوکسینیل کوآ تبدیل و وارد چرخه سیتریکاسید میشود. در مرحله اول آنزیم پروپیونیل کوآ کربوکسیلاز، پروپیونیل کوآ را با بیکربنات ترکیب میکند و D-متیل مانوئیل کوآ (زنجیره چهار کربنه) تولید میشود. در مرحله بعد آنزیم اپیمراز این ترکیب را به ایزومر L تبدیل میکند. در مرحله آخر L-متیل مانوئیل کوآ بهوسیله آنزیم موتاز به سوکسینیل کوآ تبدیل میشود.
بتااکسیداسیون اسیدهای چرب در پراکسیزوم سلولهای جانوری و گیاهی مثل بتااکسیداسیون میتوکندری انجام میشود و تنها تفاوت این دو مسیر پذیرنده الکترون در مرحله اول واکنشها است. در پراکسیزوم مولکول پذیرنده الکترون است و با دریافت الکترونها به تبدیل میشود. آنزیم کاتالیز این ترکیب را به و تجزیه میکند.
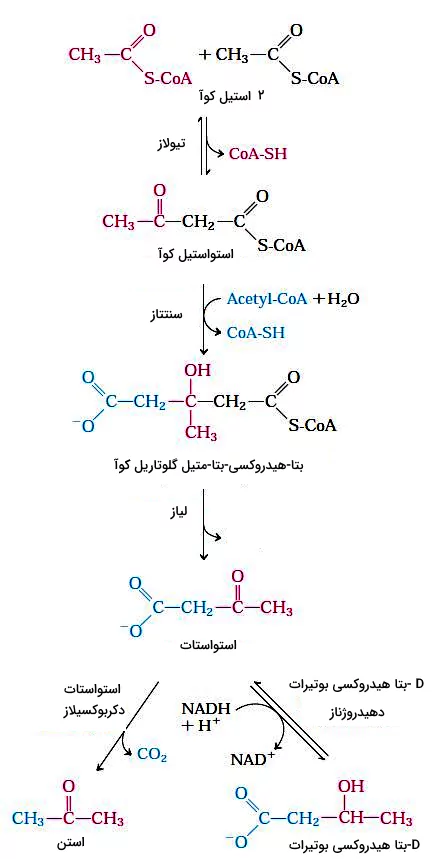
اجسام کتونی
در کبد انسان و بسیاری از پستانداران استیل کوآ حاصل از اکسیداسیون اسیدهای چرب ممکن است به استن، استواستات یا D-بتا هیدروکسی بوتیرات تبدیل شود. مقدار استن نسبت به دو ترکیب دیگر کمتر است و معمولا با تنفس از بدن خارج میشود. استواستات و D-بتا هیدروکسی بوتیرات بهوسیله خون به بافتهای دیگر به ویژه ماهیچههای اسکلتی، قلب و قشر کلیه منتقل و پس از تبدیل شدن به استیل کوآ، وارد چرخه سیتریکاسید میشود. اجسام کتونی در زمانی که گلوکز کافی در دسترس سلولها نیست، کمک فراوانی به تامین ATP میکند.
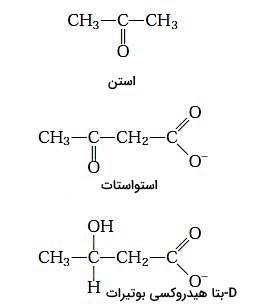
در مرحله اول تشکیل استات، دو مولکول استیل کوآ بهوسیله آنزیم تیولاز با هم ترکیب میشوند. استواستات با استیل کوآنزیم سوم ترکیب و D-بتا هیدروکسی-بتا-متیل گلوتاریل کوآ تشکیل میشود. در پایان بتا هیدروکسی-بتا-متیل گلوتاریل کوآ به استواستات و استیل کوآنزیم A تجزیه میشود. آنزیم دهیدروژناز، استواستات را به D-هیدروکسی بوتیرات کاهش میدهد و آنزیم دکربوکسیلاز با جدا کردن یک مولکول این ترکیب را به استن تبدیل میکند.
اومگا اکسیداسیون اسیدهای چرب
اومگا اکسیداسیون مکانیسم کاتابولیسم اسیدهای چرب در بعضی از مهرهداران است. در پستانداران این مسیر زمانی که مسیر بتااکسیداسیون کارایی لازم را ندارد به اکسیداسیون اسیدهای چرب و تامین انرژی کمک میکند. در مرحله اول این مسیر کمپلکس آنزیمی حاوی سیتوکروم ۴۵۰ به کربن اومگا زنجیره یک گروه OH اضافه میکند. هیدروکسیل بهوسیله آنزیمهای دهیدروژناز به آلدهید و سپس کربوکسیل اکسید میشود. در پایان این مرحله، در هر انتهای زنجیره هیدروکربنی یک گروه کربوکسیل قرار دارد. این درشتمولکول وارد میتوکندری و مسیر بتا اکسیداسیون میشود. در انتهای بتااکسیداسیون این ترکیبات سوکسینات (چهار کربن و ۲ انتهای کربوکسیل) یا آدیپاتاسید (۲ کربن و ۲ انتهای کربوکسیل) تولید میشود.
آلفا اکسیداسیون اسیدهای چرب
وجود گروه متیل روی کربن بتای اسیدهای چرب از بتااکسیداسیون این ترکیبات آلی جلوگیری میکند. آلفا اکسیداسیون، اسیدهای چرب شاخهدار را در پراکسیزوم جانوران اکسید میکند. در مرحله اول این واکنشها آنزیم آسیل-کوآ سنتتاز، کوآنزیم A را به انتهای آلفای زنجیره کربنی متصل میکند. در مرحله بعد آنزیم هیدروکسیلاز با استفاده از مولکول اکسیژن، یک گروه هیدروکسیل اضافه میکند. سپس آنزیم لیاز کربن آلفا را به شکل از ترکیب خارج و کوآنزیم A را به فرمیکاسید منتقل میکند. آلدهید تشکیل شده در پایان این مرحله بهوسیله دهیدروژنازها به کربوکسیل تبدیل و کربوکسیلیکاسید وارد مسیر بتا اکسیداسیون میشود.
تنظیم متابولیسم انواع لیپید
متابولیسم انواع لیپید بهوسیله سیستم اندوکرین بدن و متابولیتهای حدواسط مسیر سنتز یا تجزیه این ترکیبات تنظیم میشود. آنزیم استیل کوآ کربوکسیلاز اولین مرحله سنتز اسیدهای چرب (تبدیل استیل کوآ به مانوئیل کوآ) را کاتالیز میکند. این آنزیم بهوسیله پالمیتوئیل کوآنزیم A (آخرین ترکیب مسیر سنتز) کنترل میشود. افزایش این متابولیت فعالیت آنزیم را کاهش و کاهش آن فعالیت آنزیم را افزایش میدهد. به علاوه در جانوران اتصال سیترات به جایگاه تنظیمی، این آنزیم را فعال میکند.

افزایش استیل کوآ و ATP در میتوکندری با خروج سیترات از این اندامک و افزایش سنتز اسیدهای چرب همراه است. سیترات با مهار آنزیم فسفوفروکتوکیناز-۱ گلیکولیز و تولید ATP بیشتر را مهار میکند. گلوکاگون و اپینفرین در زمان کاهش گلوکز خون از سلولهای آلفای پانکراس و غدد فوق کلیه ترشح میشود. اتصال این هورمونها به گیرندههای سلولی با فسفوریلاسیون و غیرفعال شدن آنزیم استیل کربوکسیلاز همراه است. در این حالت آنزیمهای مسیر تجزیه اسیدهای چرب فعال میشوند. در گیاهان افزایش pH و منیزیم استروما آنزیم استیل کوآ کربوکسیلاز را فعال میکند.
مانوئیل کوآ اولین متابولیت سنتز اسیدهای چرب و تنظیمکننده اکسیداسیون این ترکیبات است. مانوئيل کوآ در زمانی که غلظت گلوکز خون بیش از نیاز بدن است به جایگاه تنظیمی آنزیم کارنیتین آسیل ترانسفراز I متصل شده و این آنزیم را مهار میکند. در نتیجه انتقال اسیدهای چرب به میتوکندری و بتااکسیداسیون کاهش مییابد. به علاوه افزایش نسبت NADH به آنزیم بتا-هیدروکسی آسیل کوآ دهیدروژناز و افزایش غلظت استیل کوآ آنزیم تیولاز را مهار میکند.
سنتز کلسترول در پستانداران بهوسیله غلظت کلسترول سلولی، گلوکاگون و انسولین تنظیم میشود. غلظت کلسترول سلولی بیان ژن آنزیم HMG ردوکتاز را تغییر میدهد. این ژن بهوسیله پروتئینهای اتصالی به عناصر تنظیم استرول کنترل میشود. این پروتئین در غشای شبکه اندوپلاسمی قرار دارد. کاهش غلظت کلسترول در سلول با جدا شدن انتهای آمینی این پروتئین، انتقال آن به هسته و افزایش رونویسی ژن HMG ردوکتاز همراه است.
اتصال گلوکاگون به گیرندههای سلولی با فسفوریلاسیون و غیر فعال کردن آنزیم HMG ردوکتاز، سنتز کلسترول را کاهش میدهد. اما اتصال انسولین به گیرندهها با دفسفوریلاسیون این آنزیم و افزایش سنتز کلسترول همراه است. به علا.ه افزایش غلظت کلسترول سلولی با فعال شدن آنزیم آسیل-کوآ-آسیل ترانسفراز، افزایش کلسترول استر و ذخیره کلسترول همراه است. در این شرایط رونویسی ژن گیرنده LDL و ورود کلسترول از خون به سیتوپلاسم کاهش پیدا میکند.
آنالیز انواع لیپید
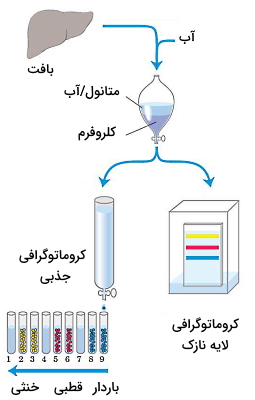
انواع لیپید ها برخلاف پروتئینها و کربوهیدراتها ترکیبات نامحلول در آب هستند. به همین دلیل برای استخراج از بافت و آنالیز آنها از حلالهای آلی غیرقطبی استفاده میکنیم. بر اساس ساختار لیپیدها محلولهای قلیایی یا اسیدی استخراج و آمادهسازی این ترکیبات به کار برده میشود. برای استخراج بعضی از انواع لیپید لازم است از فسفولیپازها یا گلوکوسیدازها استفاده شود. ساختار و درصد این ترکیبات در بافت را میتوان با کروماتوگرافی جذبی، کروماتوگرافی لایه نازک (TLC)، کروماتوگرافی مایع با کارایی بالا (HPLC)، کروماتوگرافی گاز-مایع (GLC) و طیفسنجی جرمی بررسی کرد. قبل از انجام این روشها، مولکولهای لیپید باید از سایر مولکولهای بافت جدا شود.
انواع لیپید های خنثی ازجمله تریگلیسریدها، موم و رنگدانهها بهوسیله اتیل اتر، کلروفروم با بنزن از بافت استخراج میشود. این ترکیبات از «تودهای شدن» (Aggregation) انواع لیپید ها به دلیل برهمکنشهای هیدروفوب جلوگیری میکنند. برای جدا کردن فسفولیپدهای باردار غشا از محلولهای آلی قطبیتر ازجمله اتانول و متانول استفاده میشود. این ترکیبات علاوه بر کاهش برهمکنشهای هیدروفوب، برهمکنشهای الکترواستاتیک و پیوند هیدروژنی بین لیپیدها و پروتئینهای غشا را به هم میریزد.
مخلوط کلروفروم، متانول و آب با نسبتهای ۱:۲:۰٫۸ ترکیب متداولی است که برای استخراج لیپیدها از بافت استفاده میشود. پس از هموژن شدن بافت و جدا شدن تمام لیپیدها، با اضافه کردن آب بیشتر محلول به دو فاز تقسیم میشود. متانول و آب فاز بالایی و کلروفورم فاز پایینی است. کربوهیدراتها و پروتئینها در فاز بالایی و انواع لیپید ها در فاز پایینی قرار دارند.
کروماتوگرافی جذبی
در کروماتوگرافی جذبی، انواع لیپید را بر اساس قطبیت از هم جدا میکنیم. در این روش محلول کلروفرم همراه لیپید به ستونی شیشهای که از مادهای نامحلول و قطبی (مثل سیلیکا ژل) پر شده، اضافه میشود. لیپیدهای قطبی به سیلیسیکاسید متصل میشود. لیپیدهای خنثی بدون برهمکنش با ترکیبات ستون حرکت کرده و اولین لیپیدهایی هستند که از ستون خارج میشود. برای جدا کردن لیپیدهای قطبی ستون با حلالهای قطبی (از قطبیت کم به قطبیت زیاد) شسته میشود. لیپیدهای بدونبار قطبی (ازجمله سربروزیدها) بهوسیله استن، و لیپیدهای باردار و با قطبیت بالا (ازجمله گلیسروفسفولیپیدها) بهوسیله متانول از ستون خارج میشود.
گروماتوگرافی لایه نازک
در کروماتوگرافی لایه نازک، انواع لیپید ها مثل روش کروماتوگرافی جذبی بر اساس قطبیت جدا میشوند. در این روش لایه نازکی از سیلیکا ژل به پلیت شیشهای چسبیده است. پلیت شیشهای در ظرفی که از محلول آلی پر شده قرار میگیرد و مقدار کمی لیپید همراه کلروفروم روی یکی از لبههای کناری ژل ریخته میشود. این ظرف در محفظهای قرار دارد که از بخار حلال پر شده است.
لیپیدهای خنثی برهمکنش کمتری با ژل دارند. به همین دلیل در فاصله بیشتری از لبه ژل و لیپیدهای باردار و قطبی در بخشهای بالاتر ژل قرار میگیرند. جایگاه انواع لیپید را میتوان با استفاده از رنگ فلورسانس یا با استفاده از بخار ید مشخص کرد. ید با پیوند دوگانه اسیدهای چرب واکنش برگشتپذیر میدهد. با استفاده از این روش لیپیدهای غیراشباع زرد یا قهوهای دیده میشوند.
کروماتوگرافی گاز مایع
در کروماتوگرافی گاز-مایع، گازها بر اساس تمایل به حل شدن در ترکیبات بیاثر ستون کروماتوگرافی و تبخیر جدا میشود. در این روش ستون کروماتوگرافی از گازهای بیاثر ازجمله هلیوم پر میشود. برای بررسی اسیدهای چرب در نمونه فسفولیپید، محلول لیپیدی ابتدا با محلول متانول/HCl یا متانول/NaOH حرارات داده میشود.
اسیدهای چربی که با پیوندی استری به گلیسرول متصل هستند به آسیل متیل استر تبدیل میشود. این محلول به ستون کروماتوگرافی گاز-مایع اضافه و با افزایش دمای ستون به بخار تبدیل میشود. اسیدهای چربی که انحلالپذیری کمتری در ترکیبات ستون دارند، سریعتر از اسیدهای چرب دیگر همراه گاز از ستون خارج میشوند. بهوسیله این روش میتواند اسیدهای چرب با تعداد کربنهای متفاوت و اشباع یا غیراشباع را از هم جدا کرد.
طیف سنجی جرمی انواع لیپید
طیفسنجی جرمی روش متداولی برای تعیین ساختار و نوع پیوندهای بسیاری از مواد شیمیایی است. با این روش میتوان نوع لیپیدها و تعداد پیوندهای دوگانه آنها را بررسی کرد. ساختار اسیدهای چربی که با تعداد کربنهای یکسان که پیوند دوگانه آنها روی کربن متفاوتی قرار دارد، بسیار شبیه هم است. به همین دلیل در روشهای کروماتوگرافی همراه هم جدا میشوند. اما به کمک طیفسنجی جرمی میتوان ساختار این دو ترکیب را از هم تشخیص داد. در این روش برای جلوگیری از تغییر موقعیت پیوند دوگانه در قطعات ایجاد شده پس از بمباران الکترونی، اسیدهای چرب ابتدا به مشتقاتی با الکلهای متفاوت تبدیل میشود.
جمعبندی انواع لیپید
در این مطلب از مجله فرادرس توضیح دادیم که اسیدهای چرب ساختار پایه بسیاری از انواع لیپید ها است. لیپیدها را بر اساس ساختار میتوان به انواع تریگلیسریدها، فسفولیپیدها، موم، استرولها، لیپوپروتئینها و گلیکولیپیدها تقسیم کرد. تریگلیسریدها سادهترین انواع لیپید هستند که از اتصال استری گلیسرول به سه اسیدچرب تشکیل میشوند. ساختار فسفولیپیدها شباهت زیادی به تریگلیسریدها دارد. این ترکیبات به دو گروه اسفنگولیپیدها و گلیسروفسفولیپیدها تقسیم میشوند. اسفنگولیپیدها از اتصال اسفنگوزین به یک اسید چرب و گروه فسفات تشکیل میشوند. اما گلیسروفسفولیپیدها از اتصال دو اسید چرب و یک گروه فسفات به گلیسرول تشکیل میشوند.
موم لیپیدی به شدت آبگریز است که از اتصال یک اسید چرب و الکل بلند تشکیل شده است. این ترکیب در گیاهان از تبخیر زیاد آب جلوگیری میکند. استرولها از چهار حلقه کربنی تشیل میشوند و تفاوت انها در نوع زنجیره جانبی متصل به حلقه است. لیپوپروتئینها ترکیبی از آپوپروتئین، کلسترول استر و تریگلیسرید است که انواع آن به انتقال لیپیدها در خون کمک میکند. کیلومیکرون، لیپوپروتئینی است که در سلولهای دیواره روده تشکیل میشود و لیپیدهای رژیم غذایی را به کبد منتقل میکند. VLDL، LDL، IDL و HDL سایر لیپوپروتئینها هستند که بیشتر در انتقال کلسترول نقش دارند. گلیکولیپیدها انواعی از لیپیدهای غشایی است و از اتصال زنجیره جانبی کربوهیدرات به لیپید تشکیل میشود.
در ادامه مطلب انواع لیپید توضیح دادیم که در کاتابولیسم چربیها، ابتدا گلیسرول بهوسیله آنزیمهای لیپازی از اسیدهای چرب جدا میشود. همچنین توضیح دادیم سه مکانیسم برای اکسیداسیون اسیدهای چرب در سلولها وجود دارد. بتااکسیداسیون مکانیسم اصلی پستانداران است که در ماتریکس میتوکندری انجام میشود. در این مکانیسم اسیدهای چرب پس از چند مرحله واکنش به استیل کوآنزیم A تبدیل میشود. استیل کوآنزیم وارد چرخه سیتریکاسید شده و با تشکیل مولکولهای ناقل الکترون (NADH و FADH2) به سنتز ATP در تنفس سلولی کمک میکند. سنتز اسیدهای چرب در سیتوپلاسم و با تشکیل مانوئیل-کوآ از اضافه شدن گروه کربوکسیل بیکربنات به استیل کوآ شروع میشود. استرولها از دیگر انواع لیپید ها هستند که سنتز آنها از اتصال دو استیل کوآنزیم A در سیتوپلاسم سلولهای جانوری شروع میشود.