یون هالید چیست؟ — به زبان ساده
گروه ۱۷ جدول تناوبی مربوط به هالوژنها است که برای تبدیل شدن به یون هالید یک الکترون دریافت میکنند. معمولا برای تشخیص یونهای هالید از ترکیبات آنها استفاده میشود زیرا برخی از ترکیبات یونهای هالید در آب حل میشوند و برخی رسوب تشکیل میدهند. به این صورت به کمک روشهایی که در ادامه به توضیح آنها میپردازیم میتوان یونهای هالید را در محلول یا حالت جامد تشخیص داد. بر اساس حالت فیزیکی و نوع یون هالید، روشهای مختلفی را برای تشخیص یونهای هالیدی به کار میبرند. در این مطلب با بررسی یونهای هالید و ویژگی های آنها یاد میگیریم یون هالید چیست و نحوه تشخیص آن در ترکیبات چگونه امکانپذیر خواهد بود.
یون هالید چیست ؟
اتمهای هالوژن زمانی که در یک ترکیب یونی حضور پیدا میکنند برای ایجاد پیوند شیمیایی و تکمیل الکترونهای لایه ظرفیت خود طبق قانون اکتت برای رسیدن به آرایش الکترونی هشتتایی، یک الکترون دریافت میکنند. در این صورت به آنیون یک بار منفی تبدیل میشوند که این آنیون همان یون هالید است. همانطور که گفتیم بار الکتریکی یونهای هالید است. این گروه از یونها شامل هستند البته به این دلیل که عنصر استاتید (At) خاصیت رادیواکتیوی دارد اغلب این عنصر در خانواده هالوژنها شناخته نمیشود.
این یونهای هالید در برخی خواص مشابه هم هستند و در برخی موارد با هم تفاوت دارند. به عنوان مثال عدد اکسایش هالیدها برابر با است و میتوانند در دو حالت جامد و محلول وجود داشته باشند. اما برخی از یونهای هالید در محلول حل میشوند و برخی تشکیل رسوب میدهند. در قسمت بعدی برخی از خواص مهم یونهای هالید به صورت کلی آورده شده است.
ویژگی های هالید ها
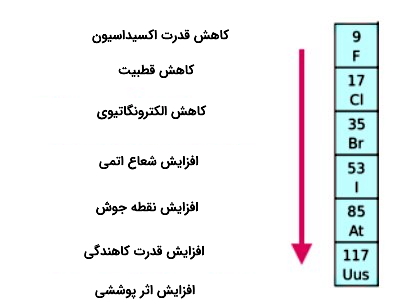
در گروه ۱۷ از بالا به پایین قدرت کاهندگی افزایش پیدا میکند. اگر در گروه ۱۷ از بالا به پایین حرکت کنیم قدرت کاهندگی هالیدها افزایش پیدا میکند. یون هالید به عنوان عامل کاهنده خارجیترین الکترون را از دست میدهد و و توانایی از دست دادن این الکترون به شعاع یونی و اثر پوششی الکترونهای درونی بستگی دارد. هر چه قدرت کاهندگی افزایش پیدا کند هالیدها به راحتی میتوانند الکترون از دست بدهند.
در گروه هالیدها از بالا به پایین جاذبه میان هسته و الکترونهای خارجی کاهش پیدا میکند. جاذبه میان الکترونهای خارجی و هسته با افزایش شعاع یونی ضعیف میشود به این معنا که فاصله میان الکترونهای خارجی و هسته افزایش پیدا میکند. درواقع به این عبارت که با افزایش تعداد لایهها و افزایش شعاع یونی اثر پوششی الکترونهای دورنی بیشتر میشود. بنابراین جاذبه هسته (بار موثر هسته) بر الکترونهای لایه ظرفیت کاهش پیدا میکند.
به طور کلی در تصویر زیر روند تغییرات شعاع اتمی، قطبی، الکترونگاتیوی، قدرت اکسیداسیون، نقطه جوش، قدرت کاهندگی و اثر پوششی آورده شده است. همانطور که در تصویر مشخص است قدرت اکسیداسیون، قطبی بودن، الکترونگاتیوی از بالا به پایین کاهش و شعاع اتمی، نقطه جوش، قدرت کاهندگی، اثر پوششی افزایش پیدا می کند.
ترکیبات یون هالید
هالیدها با فلزات قلیایی، قلیایی خاکی، سیلیکون، هیدروژن و غیره ترکیب تشکیل میدهند. همانطور که قسمتهای قبلی توضیح داده شد برخی از این ترکیبات در آب حل و برخی باعث بهوجود آمدن رسوب میشوند.
یون هالید فلزات قلیایی
همه هالیدهای فلزات قلیایی ترکیباتی به شکل جامدهای بلوری هستند که دمای ذوب بالایی دارند. همه این ترکیبات به جز لیتیم فلوئورید در آب حل میشوند. لیتیم فلوئورید به دلیل انرژی شبکه بالا و کاتیون و آنیون کوچک در آب انحلالناپذیر است. سایر یونهای هالید لیتیوم در اتانول، استون و اتیل استات انحلالپذیر هستند. لیتیوم کلرید در پیریدین (Pyridine) حل میشود. سزیم یدید به دلیل انرژی هیدارته پایین یونهای تشکیل دهنده خود انحلالپذیری کمی دارد.
یون هالید فلزات قلیایی خاکی
بریلیم کلرید منزیم کلرید و منیزیم برمید در حلالهای آلی انحلال پذیر هستند. نقطه ذوب بریلیم کلرید پایین بوده اما درحالیکه نقطه ذوب باریم کلرید بالا است. فلوئوریدهای فلزات قلیایی خاکی در آب انحلالپذیری پایینی دارند که این انحلالپذیری با افزایش شعاع یونی به آرامی افزایش پیدا میکند. و رسوبی را تشکیل نمیدهند. به صورت کلی همه یونهای هالید فلزات قلیایی خاکی به جز بریلیم کلرید پیوند یونی دارند و در آب حل میشوند. بریلیم کلرید پیوند کووالانسی دارد.
رنگ ترکیبات هالیدها
برخی از ترکیبات هالیدی البته در صورتی که رسوب تشکیل دهند رنگهای خاصی دارند. در جدول زیر رنگ رسوبات حاصل از ترکیبات فهرست شده است.
| انحلالپذیری رسوب | یون هالید |
| فلوئورید | بدون تشکیل رسوب |
| کلرید | رسوب سفیدرنگ |
| برمید | رسوب کرمرنگ یا زرد روشن |
| یدید | رسوب زرد |
هیدروژن هالید چیست ؟
هیدروژنهای هالیدی پرکاربردترین هالیدها هستند. اسیدهای قوی بوده اما اسید Hf اسید ضعیفی است. همه هیدروژنهای هالیدی در آب انحلالپذیری بالایی دارند. تقریبا به طور کامل در محلولهای رقیق دچار جدایش میشوند.
آماده سازی هیدروژن های هالیدی
حرارت دادن نمکهای حاوی یون هالید با اسیدهای فرار معمولا روشی است که به کمک آن را در آزمایشگاههای تحقیقاتی میسازند. واکنشهای زیر ترکیب اسیدهای فرار را با نمکهای حاوی یون هالید نشان میدهند.
لازم به ذکر است که روش بالا برای ساخت HI نمیتواند مورد استفاده قرار بگیرد زیرا HI در مقایسه با سایر یونهای هالیدی پایدار نیست. برای ساخت این نوع هیدروژن هالیدی فسفر با ید ترکیب میشود و در اثر این واکنش ترکیب فسفر یدید بهوجود میآید. سپس در اثر هیدرولیز شدن این ترکیب هیدروژن یدید تشکیل میشود. واکنش دو مرحلهای تشکیل هیدروژن یدید در قسمت زیر آورده شده است.
تشخیص یون هالید
یون هالید به دو شکل محلول و جامد میتواند وجود داشته باشد. منظور از تشخیص یون هالید این است که گاهی شما در آزمایشگاه با دو یا چند محلول و ترکیب جامدی روبرو هستید که نمیدانید کدام یک آنها مربوط به محلول یا ترکیبی است که در آن یون هالید وجود دارد. یا اینکه دو محلول یا دو ترکیب دارای یونهای هالید هستند اما به عنوان مثال نمیدانید کدام یک از آنها مربوط به یون برمید و کدام یکی مربوط به یون کلرید است. بنابراین برای تشخیص یون هالید در هر دو حالت محلول و ترکیب جامدی روشهایی وجود دارد که در ادامه به آنها میپردازیم. به کمک این روشها میتوانید یون هالید را در ترکیبات نمکهای هالیدی مانند NaCl(aq), KI (aq) شناسایی کنید.

در تصویر فوق رنگ رسوبات حاصل از یونهای هالید کلر، برم و ید در ۳ محلول فوق آورده شده است.
تشخیص یون کلرید در حالت محلول
برای تشخیص یون کلرید در محلول میتوانید یکی از این ۳ راه را امتحان کنید:
- سرب (II) استات یا سرب (II) نیترات را به محلول نمکهای هالیدی اضافه کنید. در اثر افزودن یکی از دو ماده شیمیایی به محلول، رسوب سفیدرنگ سرب (II) کلرید تشکیل میشود. همچینن این رسوب در آب گرم ذوب میشود و بعد از خنک شدن دوباره رسوب تشکیل میدهد.
- ابتدا نیتریک اسید رقیق را به محلول نمک و بعد از آن محلول نقره نیترات را اضافه کنید. در اثر اضافه کردن اسید و ترکیب نقره نیترات به محلول در صورت حضور یون هالید کلر، رسوب سفیدرنگ نقره کلرید() تشکیل میشود که این رسوب در آمونیا () رقیق حل میشود.
- کلروفرم یا کربن تتراکلرید را به محلول اضافه کنید و سپس محلول جدید را تکان دهید. در این صورت یک لایه بیرنگ تشکیل میشود.
تشخیص یون برمید در حالت محلول
برای تشخیص یون برمید در محلول میتوانید یکی از این ۳ راه را امتحان کنید:
- سرب (II) استات یا سرب (II) نیترات را به محلول نمکهای هالیدی اضافه کنید. بعد از این کار در صورتی که یون هالید برم در محلول وجود داشته باشد باید رسوبی با رنگ کرم متمایل به سفیدرنگ تشکیل شود که متعلق به تشکیل رسوب سرب (II) برمید است. همچینن این رسوب در آب گرم ذوب میشود و بعد از خنک شدن دوباره رسوب تشکیل میدهد.
- ابتدا نیتریک اسید رقیق را به محلول نمک و بعد از آن محلول نقره نیترات را اضافه کنید. در اثر اضافه کردن اسید و ترکیب نقره نیترات به محلول در صورت حضور یون هالید برمید، رسوبی با رنگ کرم متمایل به سفید تشکیل میشود که در آمونیای رقیق شده میتواند حل شود.
- کلروفرم یا کربن تتراکلرید را به محلول اضافه کنید و سپس محلول جدید را تکان دهید. در نهایت گلولههای قهوهای/نارنجی تشکیل میشود.
تشخیص یون یدید در حالت محلول
برای تشخیص یون یدید در محلول مانند تشخیص یون برمید و کلرید نیز همان یکی از سه راه قبلی را طی کنید:
- سرب (II) استات یا سرب (II) نیترات را به محلول نمکهای هالیدی اضافه کنید. با اضافه کردن سرب (II) استات یا سرب (II) نیترات به محلول، رسوب زردرنگ سرب (II) یدید زمانی که این رسوب در حال جوشیدن باشد رسوب ذوب میشود و با سرد کردن مجدد آن، همانند پودر زردرنگ طلا تهنشین میشود.
- اول نیتریک اسید رقیق را به محلول اضافه کنید و بعد از آن محلول نقره نیترات را اضافه کنید. رسوب زردرنگ نقره یدید بهوجود میآید که در آمونیا حل نمیشود.
- کلروفرم یا کربن تتراکلرید را به محلول اضافه کنید. اگر یون برمید در محلول وجود داشته باشد گلولههای ارغوانیرنگ تشکیل میشود.
در قسمت زیر تمامی مطالب ذکر شده در فوق برای تشخیص یونهای کلر، برم و ید در حالت محلول به صورت خلاصه فهرست شده است.
در صورتی که عامل واکنشگر، سرب (II) استات یا سرب (II) نیترات باشد با اضافه کردن هر یک ار آنها به محلول مورد نظر با مشاهدات زیر روبرو هستیم:
- یون هالید کلر : رسوب سفیدرنگ سرب (II) کلرید تشکیل می شود که این رسوب در آب گرم انحلالپذیر است. در صورت حل شدن رسوب سرب (II) کلرید در آب گرم و سرد شدن محلول مجددا رسوب تشکیل میشود.
- یون هالید برم : رسوب کرمرنگ سرب (II) برمید تشکیل می شود که این رسوب در آب گرم انحلالپذیر است. در صورت حل شدن رسوب سرب (II) برمید در آب گرم و سرد شدن محلول مجددا رسوب تشکیل میشود.
- یون هالید ید : محلول رسوب زردرنگ سرب (II) یدید تشکیل میشود. اگر محلول مورد نظر به نقطه جوش خود برسد رسوب تشکیل شده در آن قابل حل است. بعد از سرد شدن محلول، رسوب سرب (II) یدید همانند پودر زردرنگ طلا تهنشین میشود.
در صورتی که عامل واکنشگر، در ابتدا اسید نیتریک و سپس نقره نیترات باشد. با اضافه کردن آنها به محلول به ترتیبی که گفته شد با مشاهدات زیر روبرو هستیم:
- یون هالید کلر : رسوب نقره کلرید سفیدرنگی تشکیل میشود که در آمونیای رقیق انحلالپذیر است.
- یون هالید برم : رسوب نقره برمید با رنگ کرمی متمایل به سفید تشکیل می شود که در آمونیای غلیظ حل میشود.
- یون هالید ید : رسوب زردرنگ نقره یدید که در آب انحلالناپذیر است تشکیل میشود.
حال در صورتی که عامل واکنشگر، سرب (II) استات یا سرب (II) نیترات باشد با اضافه کردن هر یک ار آنها به محلول مورد نظر با مشاهدات زیر روبرو هستیم:
- یون هالید کلر : لایهای بیرنگ تشکیل میشود.
- یون هالید برم : گلولههای قهوهای/نارنجی تشکیل میشود.
- یون هالید ید : گلولههای ارغوانی رنگ تشکیل میشود.
تشخیص یون هالید در حالت جامد
در این قسمت برای تشخیص یونهای هالید در حالت جامد مانند دو روش مجزا توضیح داده شده است.
تشخیص یون کلرید در ترکیبات جامد
برای تشخیص یون کلرید در ترکیبات جامد میتوانید مانند یک از دو راه زیر عمل کنید:
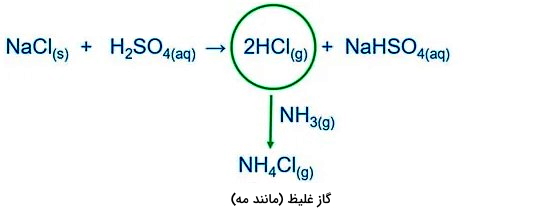
- ترکیب اسید سولفوریک غلیظ و ترکیب جامد کلریدی و در نهایت حرارت دادن آنها این کار سبب میشود تا گاز هیدروکلریک اسید و سدیم هیدروژن کربنات تولید میشود . گاز هیدروکلریک اسید میتواند توسط گاز آمونیا تشخحیص داده شود. هیدروکلریک اسید و گاز آمونیا با هم واکنش میدهند و گاز غلیظ - مانند مه - آمونیوم کلرید را بهوجود میآورند. در تصویر زیر این واکنشها نشان داده شده است.
 2. ترکیب اسید سولفوریک غلیظ، اکسید منگنز و ترکیب جامد کلریدی و در نهایت حرارت دادن آنها
2. ترکیب اسید سولفوریک غلیظ، اکسید منگنز و ترکیب جامد کلریدی و در نهایت حرارت دادن آنهااکسید منگنز عامل اکسیدکنندهای است که یونهای کلریدی را به گاز کلر تبدیل میکند. گاز کلر سبزرنگ متمایل به زرد روشن در اثر انجام واکنش آزاد میشود. توجه داشته باشید که گاز کلر سمی است. واکنش زیر مربوط به تشکیل گاز سمی کلر است.
تشخیص یون برمید در حالت جامد
برای تشخیص یون برمید در ترکیبات جامد یکی از دو روش زیر را می توانید عمل کنید:
- ترکیب اسید سولفوریک غلیظ و ترکیب جامد برمیدی و در نهایت حرارت دادن آنها
اگر ترکیب جامد مورد نظر سدیم برمید باشد در اثر این کار گاز برم قهوهایرنگ و همچینن گاز هیدروژن بهوجود میآید. واکنش زیر مربوط به ترکیب سدیم برمید با اسید سولفوریک غلیظ است.
- ترکیب اسید سولفوریک غلیظ، اکسید منگنز و ترکیب جامد برمیدی و در نهایت حرارت دادن آنها
در اثر این ترکیب گاز برم با رنگ قهوهای تشکیل میشود. اکسید منگنز به یونهای کاهش داده میشود.
تشخیص یون یدید در حالت جامد
برای تشخیص یون یدید در ترکیبات جامد یکی از دو روش زیر را می توانید عمل کنید:
- ترکیب اسید سولفوریک غلیظ و ترکیب جامد یدی و در نهایت حرارت دادن آنها: یون هالید ید اکسیده کمیشود و بدین ترتیب گاز ارغوانی رنگی را بهوجود میآورد. همچنین گاز هیدروژن هم نیز تشکیل میشود.
- ترکیب اسید سولفوریک غلیظ، اکسید منگنز و ترکیب جامد یدی و در نهایت حرارت دادن آنها: زمانی یک ترکیب جامد یددار با سولفوریک اسید و اکسید منگنز ترکیب و در نهایت حرارت داده میشود گاز ارغوانی رنگ ید را بهوجود میآورد.

در قسمت زیر تمامی مطالب ذکر شده در فوق برای تشخیص یون هالید در حالت جامد به صورت خلاصه فهرست شده است.
در صورتی که عامل واکنشگر اسید سولفوریک باشد در صورت اضافه کردن آن به ترکیب هالیدی و حرارت دادن مخلوط مورد نظر با مشاهدات روبرو خواهیم بود:
- یون هالید کلر :گاز هیدروکلریک اسید که توسط آمونیا تشخیص داده میشود. در اثر ترکیب هیدروکلریک اسید با آمونیا گاز غلیظ آمونیوم کلرید تشکیل میشود.
- یون هالید برم : گاز برم قهوهایرنگی تشکیل میشود.
- یون هالید ید : گاز ید ارغوانیرنگ تشکیل میشود.
در صورتی که عامل واکنشگر اسید سولفوریک باشد و اکسید منگنز باشد در صورت اضافه کردن آنها به ترکیب هالیدی و حرارت دادن مخلوط مورد نظر با مشاهدات زیر روبرو خواهیم بود:
- یون هالید کلر : آزاد شدن گاز کلر با رنگ سبز روشن
- یون هالید برم : تشکیل گاز برم قهوهایرنگ
- یون هالید ید : تشکیل گاز ید ارغوان
کاربرد یون هالید
هالیدهای فلزی معمولا به عنوان لامپهای تخلیه فشار بالا به کار میروند که با نام لامپ متال هالید یا لامپ هالید فلزی شناخته میشوند. این لامپها مانند همان لامپهایی هستند که در سطح شهر و خایابانها از آن استفاده میکنند. لامپهای متال هالید در مقایسه با لامپهای بخار جیوه مقرون به صرفه هستند و نسبت به لامپهای سدیم فشار بالا با درخشش نارنجی، قدرت تفکیک رنگ بهتری دارند. از لامپهای هالید فلزی در گلخانهها یا در شرایط بارانی به عنوان جایگزین نور طبیعی استفاده میشود.

در زمانهای قدیم هالیدهای نقره به عنوان فیلمهای عکاسی مورد استفاده قرار میگرفتند. همچنین هالیدها در روغن لحیم اغلب به شکل کلر یا برم کاربرد دارند. هالیدها گاهی اوقات در ترکیبات ارگانو هالید- یعنی هالید کردن پلیمرها- به کار می روند.
سوالات متداول مرتبط با یون هالید
در این قسمت سوالات متداول در مورد یون هالید مطرح و به آنها پاسخ داده شده است تا بتوانید یاد بگیرید یون هالید چیست و چگونه میتوان یونهای هالید را در دو حالت محلول و جامد تشخیص داد.
یون هالید را تعریف کنید؟
در جدول تناوبی، گروه ۱۷ به اتمهای هالوژن اختصاص داده شده است که عبارتند از : . این اتمها برای در لایه ظرفیت خود برای رسیدن به آرایش هشتتایی طبق قانون اکتت نیاز به یک الکترون اضافی دارند. بنابراین هالیدها با دریافت یک الکترون به آنیونهای تبدیل میشوند. به این آنیونها یون هالید میگویند.
نحوه تشخیص سدیم کلرید و سدیم برمید در محلول چگونه است ؟
فرض کنید دو محلول بیرنگ داریم و به ما گفته شده است که یکی از آنها محلول سدیم کلرید و دیگری مربوط به سدیم برمید است. توجه داشته باشید که در هر دو محلول یون سدیم مشترک است. بنابراین آنچه که برای تشخیص این دو محلول مهم است تشخیص یون برمید و کلرید است. برای این کار به هر دو محلول ابتدا اسید نیتریک رقیق و سپس محلول سرب نیترات را اضافه میکنیم.
در این صورت در یکی از محلولها رسوب زردرنگ و در دیگری رسوب سفیدرنگی تشکیل میشود. رسوب سفیدرنگ مربوط به سرب کلرید و رسوب زردرنگ مربوط به سرب برمید است. بنابراین میتوان نتیجه گرفت که در محلولی که رسوب سرب کلرید تشکیل میشود مربوط به سدیم کلرید بوده است و محلول دیگری مربط به محلول سدیم برمید است.
در اثر اضافه کردن سولفوریک اسید غلیظ به یک ترکیب کلریدی و حرارت دادن چه اتفاقی رخ میدهد؟
اگر به یک ترکیب کلریدی مانند سدیم کلرید اسید سولفوریک غلیظ را اضافه کنیم و آن را حرارت بدهیم گاز هیدروکلریک اسید تشکیل میشود. این گاز توسط محلول آمونیا قابل تشخیص است. به این صورت که با واکش آمونیا و گاز هیدروکلریک اسید گاز آمونیوم کلرید به صورت مه غلیظ تشکیل میشود.
چگونه سدیم نیترات را از سدیم برمید تشخیص دهیم ؟
سدیم نیترات و سدیم برمید هر دو در دمای اتاق به صورت جامد سفید رنگی هستند که نمیتوان آنها را به راحتی تشخیص داد. برای تشخیص این که کدام یک از این دو ترکیب سفیدرنگ مربوط به سدیم نیترات و دیگری مربوط به سدیم برمید است در مرحله اول باید به هر کدام مقدار آب اضافه کرد تا محلول تشکیل دهند. هر دو محلول شفاف بی رنگی را تشکیل میدهند یعنی در این مرحله هم نمیتوان آنها را ازهم تشخیص داد.
بنابراین به هریک از آنها، محلول نقره نیترات را اضافه میکنیم با این کار در یکی از محلولها باید رسوب کرمرنگ متمایل به سفید بهوجود آید. رسوب کرمرنگ مربوط به تشکیل نقره برمید است. بنابراین می توان نتیجه گرفت در محلولی که این رسوب تشکیل شده است که مربوط به سدیم برمید بوده است. در ترکیبی از محلولهای سدیم برمید و محلول نقره نیترات آنیون و کاتیونهای وجود دارند. همچینین در ترکیبی از محلولهای سدیم نیترات و محلول نقره نیترات آنیون و کاتیونهای وجود دارند.
در اثر تشکیل رسوب رنگ حاصل از هر یک از هالیدها چه رنگی خواهد بود؟
اگر در محلولی هر یک از یونهای هالید ، و حضور داشته باشد رنگ رسوب حاصل به ترتیب برابر سفید، کرم متمایل به سفید و زرد خواهد بود. یون فلوئورید رسوبی را تشکیل نمیدهد به همین دلیل نام آن در این قسمت ذکر نشده است.
کدام یون هالید به راحتی اکسید میشود ؟
در گروه جدول تناوبی مربوط به قانون دوره ای عنصرها از بالا به پایین قدرت اکسیداسیون عنصرها کاهش پیدا میکند. از آنجا که عنصر ید پایینتر از سایرعناصر هالیدی قرار دارد بنابراین «یدید» نسبت به سایر یونهای هالیدی سریعتر و راحتتر اکسیده میشود.