زنجیره جانبی چیست؟ – به زبان ساده در زیست و شیمی
میلیونها مولکول با ساختارهای مختلف در طبیعت وجود دارند و با پیشرفتهای روز به روز علم، مولکولهای بسیاری در آزمایشگاههای شیمی، زیستشناسی، مهندسی مواد و داروسازی تولید میشود. اساس تمام این مولکولهای کوچک و درشت یکسان است و بر پایه ارتباط بین الکترونهای لایه ظرفیت اتمهای درگیر پیوند است. ساختار بعضی مولکولها را میتوان به بخش زنجیره یا اسکلت اصلی و استخلاف، زنجیره جانبی یا گروه جانشین تقسیم کرد. در این مطلب انواع زنجیره جانبی را به همراه واکنشهای ایجاد آنها و برهمکنش زنجیره جانبی اسیدآمینه برای تشکیل پروتئین را توضیح میدهیم.
- میآموزید زنجیره جانبی چیست و چطور باعث تنوع مولکولها میشود.
- انواع واکنشهای اصلی برای تشکیل یا تغییر زنجیره جانبی را یاد خواهید گرفت.
- خواهید آموخت که زنجیره جانبی آمینواسیدها چه نقشی در ساختار و عملکرد پروتئینها ایفا میکند.
- نقش زنجیره جانبی در پلیساکاریدها، گلیکوپروتئینها و شناسایی سلولی را خواهید شناخت.
- میآموزید تأثیر برهمکنشهای زنجیره جانبی بر پایداری و تاخوردگی پروتئین را ارزیابی کنید.
- با کارکرد زنجیره جانبی ویژه آمینواسیدها و اهمیت آن آشنا میشوید.

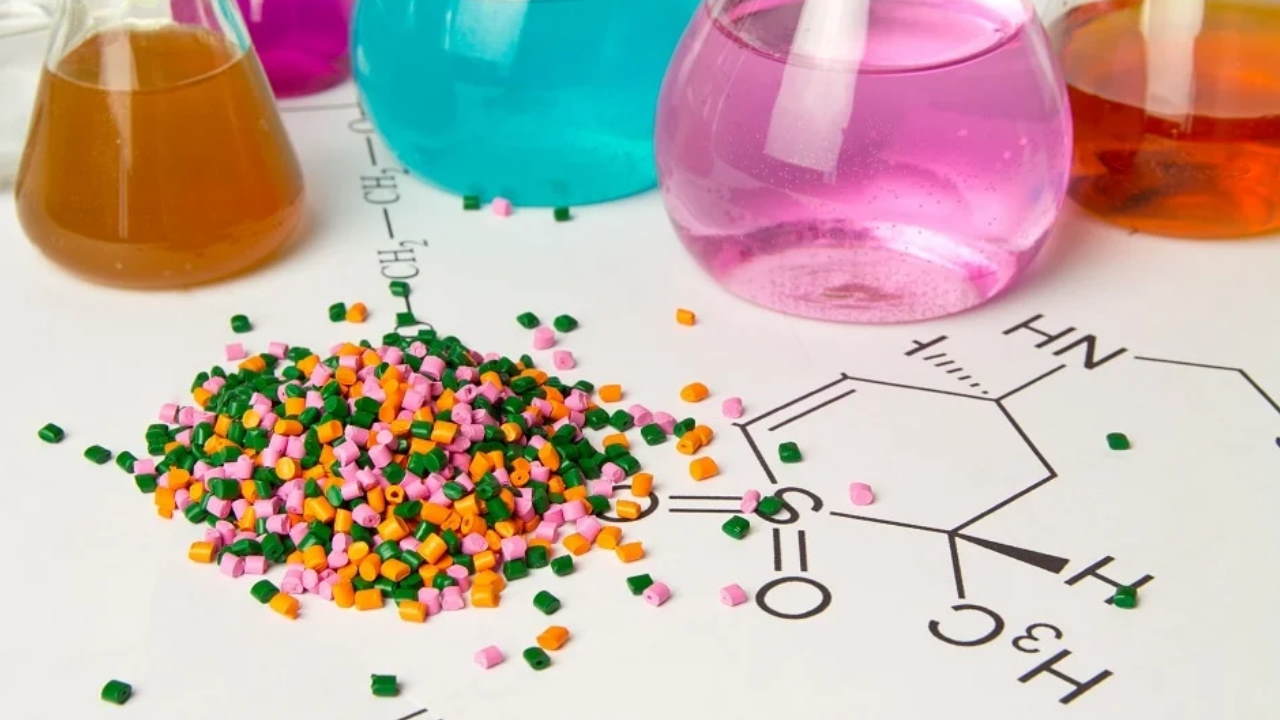
زنجیره جانبی چیست ؟
در زیستشناسی، بیوشیمی و شیمی آلی، «زنجیره جانبی» (Side Chain) گروههای شیمیایی هستند که به زنجیره یا «ساختار اصلی» (Back Bone) مولکولها و پلیمرها متصل میشوند. این زنجیره ممکن است تنها از یک واحد آلکیلی ساده یا از تعداد زیادی مولکول تشکیل شده باشد. ساختار شیمیایی و بار الکتریکی مولکولهای این زنجیره میتواند بار، قطبیت و انحلالپذیری کل مولکول را تغییر دهد. زنجیره جانبی آلکیل و آریل دو نوع متداول این گروهها در مولکولهای آلی هستند.
استخلاف آلکیل
آلکیلها () گروهی از ترکیبات هیدروکربنی هستند که با از دست دادن یک اتم هیدروژن در آلکانها () ایجاد میشوند. متیل () سادهترین آلکیل است که از جایگزین شدن یکی از اتمهای هیدروژن مولکول متان () با زنجیره هیدروکربنی ایجاد میشود. این جایگزینی در سایر آلکانها (اتان، پروپان، بوتان، پنتان و هگزان) آلکیلهای مختلف (اتیل، پروپیل، پوتیل، پنتیل و هگزیل) ایجاد میکند. افزایش تعداد کربن در زنجیره جانبی آلکیلی سبب کاهش انحلالپذیری مولکول اصلی و افزایش نقطه جوش و ذوب ماده میشود. این هیدروکربنها به انواع پلیمرهای زیستی و شیمیایی متصل میشوند. زنجیره جانبی آلکیل بر اساس ساختار و شیوه اتصال به زنجیره جانبی انواع مختلفی دارد.
- آلکیل ساده: این زنجیره جانبی همان ساختار ساده و اصلی آلکیلها است.
- ایزوآلکیل: ایزوآلکیلها از آلکیلهای سهکربنه شروع میشوند. در این مولکول کربنهای انتهایی به زنجیره اصلی متصل نمیشوند. پیشوند ایزو (iso) به معنی وجود گروه در انتهای شاخه است.
- آلکیل نوع دوم: آلکیلهای نوع دوم (sec) از ترکیبات چهارکربنه شروع میشوند و در آنها دومین کربن ار انتهای زنجیره جانبی به زنجیره اصلی متصل میشود. از آنجایی که بیش از یک کربن دوم در پنتیل و هگزیل وجود دارد که ایزومرهای متفاوتی تشکیل میدهند، پیشوند sec را برای این آلکیلها استفاده نمیکنیم.
- آلکیل سوم: آلکیلهای سوم (tert- | t) از ترکیبات چهارکربنه شروع میشوند. ساختار این هیدروکربنها شبیه به حرف t انگلیسی است که از سه اتم کربن اصلی تشکیل شده است. دومین اتم کربن از یک طرف با کربنهای آلکیلی و از طرف دیگر با زنجیره اصلی پیوند میدهد.
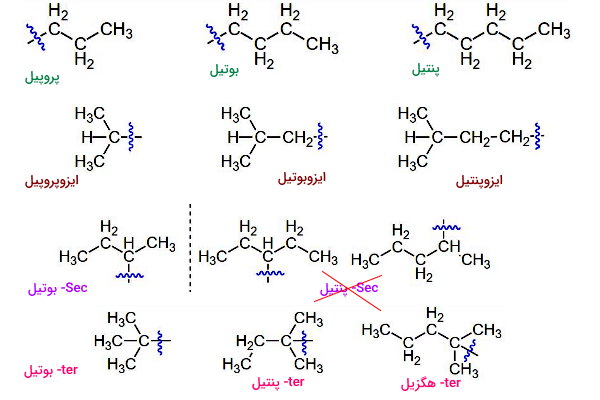
استخلاف آریل
زنجیره جانبی «آریل» (Aryl) حلقههای آروماتیک هیدروکربنهای آروماتیک هستند که در آنها زنجیره هیدروکربنی (R) جایگزینی یکی از هیدروژنهای متصل به حلقه میشود. فنیل () سادهترین آریل و مشتق از بنزن، تولیل () آریل مشتق از تولوئن، زایلیل () آریل مشتق از زایلن و نفتیل () آریل مشتق از نفتالن است.
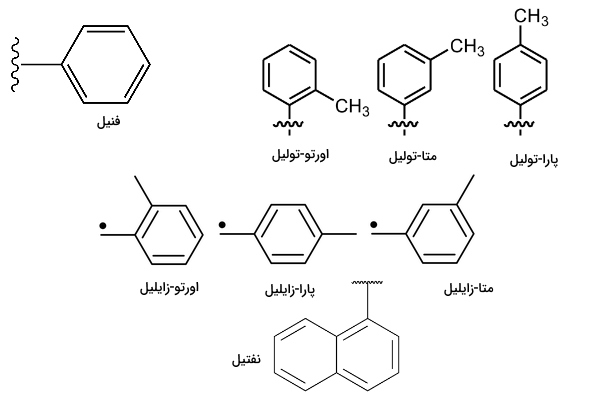
واکنش های تشکیل زنجیره جانبی
واکنشهای تشکیل زنجیره جانبی، مجموعهای از واکنشهای جانشینی هستند که چهار ویژگی اصلی در تمام آنها وجود دارد. اول اینکه در تمام واکنشهای جانشینی، یک پیوند کربن شکسته و پیوند دیگری تشکیل میشود. دوم، در این واکنشها یک منبع غنی از الکترون (نوکلئوفیل) و یک منبع کمالکترون (الکتروفیل) وجود دارد. شباهت این واکنشها به واکنشهای اسیدی و باز سومین ویژگی مشترک آنها است. با این تفاوت که هیدرولیز و تشکیل پیوند به جای اتم هیدروژن، در اتم کربن انجام میشود. چهارمین ویژگی اساسی در این واکنشها وجود گروه الکتروفیل، نوکلئوفیل، ترککننده و محصول است. واکنشهای جانشینی بر اساس این چهار ویژگی، به سه گروه جانشینی الکتروفیل، جانشینی نوکلوفیل و جانشینی رادیکال آزاد تقسیم میشوند.
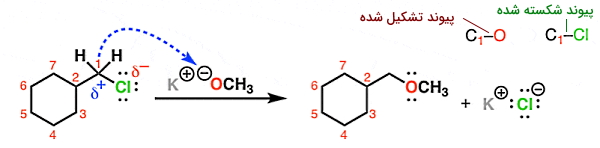
برای مثال واکنش ۱-کلرومتیل سیکلوهگزان با ترکیب پتاسیم متوکسید () را در نظر بگیرید. در این واکنش ترکیب یونی از یک بخش بار مثبت () و یک بخش بار منفی () تشکیل شده است. در ترکیب ۱-کلرومتیل سیکلوهگزان، کلر متصل به کربن الکترونگاتیوی بیشتر و بار جزئي مثبت دارد. در نتیجه اتم اکسیژن (متوکسی) تمایل به اشتراک گذاشتن و اتم کربن تمایل به دریافت الکترون دارد. از اشتراکگذاری الکترونهای اکسیژن با اوربیتال خالی لایه ظرفیت اتم کربن، پیوندی کلر با کربن شکسته شده و پیوند اکسیژن-کربن تشکیل میشود.
واکنشهای تشکیل زنجیره جانبی در سلولها بر اساس همین واکنشهای جانشینی انجام میشود. با این تفاوت که آنزیمهای موجود در سلول در فعال کردن گروههای شرکتکننده در واکنش و کاهش انرژی فعالسازی نقش دارند. به علاوه کنفورماسیون، ساختار و توالی آمینواسیدهای موجود در جایگاه فعال آنزیم، موقعیت فضایی حمله الکتروفیلی یا نوکلئوفیلی را مشخص میکند.
جانشینی نوکلئوفیل
برای توضیح بهتر واکنشهای جانشینی از واژه حمله الکتروفیلی یا نوکلئوفیلی استفاده میشود. در حمله نوکلئوفیلی، یک اتم یا مولکول نوکلئوفیل (دارای بار منفی یا الکترون جفت نشده) به یک مولکول یا اتم درگیر پیوند، با جزئی مثبت یا اوربیتال خالی حمله میکند. در نتیجه پیوند جدید بین اتم نوکلئوفیل و الکتروفیل ایجاد میشود. در این واکنشها، الکترونگاتیوی (نوکلئوفیل ضعیفتر) گروه ترککننده از مولکول حملهکننده کمتر است. در نتیجه پیوند بین گروه حملهکننده و الکتروفیل ایجاد میشود. این واکنشها در کربن ترکیبات آلیفاتیک، کربن گروههای آروماتیک (فراوانی کمتر) و کربن ترکیبات غیراشباع (پیوند دوگانه و سهگانه) و با دو مکانیسم SN1 و SN2 انجام میشود.
مکانیسم واکنش SN1
این واکنش در دو مرحله انجام میشود. در مرحله اول گروه ترککننده از مولکول خارج میشود و یک کاربوکاتیون () در مولکول اصلی باقیمیماند. در مرحله دوم، مولکول نوکلئوفیل با پیوند کووالانسی سیگما به مولکول اصلی یا سوبسترا متصل میشود. اگر کربن سوبسترا کایرال باشد، این مکانیسم کونفیگوراسیون آن را تغییر خواهد شد.
مکانیسم واکنش SN2
در این نوع واکنش، حمله نوکلئوفیل و خارج شدن بخش ترککننده از سوبسترا همزمان انجام میشود. در این مکانیسم کنفیگوراسیون محصول نهایی، همیشه تغییر میکند. اگر کربن الکتروفیل سوبسترا کایرال باشد، «وارونهسازی والدن» (Walden Inversion) در مولکول ایجاد میشود. جانشینی نوکلئوفیل در مواردی از این مکانیسم پیش میرود که ممانعت فضایی گروههای اطراف کربن الکتروفیل کم باشد.
جانشینی الکتروفیل
در این نوع واکنشها یک مولکول الکتروفیل (با بار مثبت، اوربیتال خالی لایه ظرفیت یا الکترونگاتیوی کمتر) به یک مرکز کربن نوکلئوفیل (جزئی بار منفی یا الکترون جفت نشده لایه ظرفیت) حمله میکند. سوبسترای این واکنشها اغلب اما نه همیشه، یک ترکیب آروماتیک است. به علاوه زنجیره جانبی و استخلافهای بسیاری از ترکیبات آلیفاتیک بهوسیله واکنش جانشینی الکتروفیل به مولکول اصلی اضافه میشود. در بسیاری از این واکنشها گروههای هالوژن (هالوژناسیون)، نیتروژن (نیتروژناسیون)، گوگرد (سولفوناسیون)، گروه آسیل (آسیلاسیون) و آلکیل (آلکیلاسیون) جایگزین هیدروژن متصل به حلقه میشود.
جانشینی رادیکال آزاد
در این واکنشهای جانشینی یک رادیکال آزاد، مولکول حدواسط در واکنش است. این واکنش در چند مرحله انجام میشود. در مرحله شروع (Initiation) رادیکال آزاد بهوسیله پرتو فرابنفش (UV)، گرما یا ترکیبات آلی (ترکیبات آزو یا پروکسیداز) ایجاد میشود. در مرحله بعد (پایان | Termination) رادیکال آزاد ایجاد شده با رادیکال آزاد دیگری وارد واکنش و مولکول جدید تشکیل میشود. اگر رادیکال آزاد ایجاد شده به جای تشکیل پیوند و مولکول جدید، رادیکالهای آزاد دیگری تشکیل دهد، واکنش وارد مرحله «تجمعی» (Propagation) خواهد شد. فراوانی این واکنشها در آلکانها، آریلها و هالوژنها بیشتر است.
زنجیره جانبی مولکول های زیستی
آمینواسیدها، پلیساکاریدهای منشعب، گلیکولیپیدها و گلیکوپروتئینها، مولکولهای زیستی هستند که زنجیره جانبی دارند. زنجیره جانبی آمینواسیدها انواع مختلفی از مولکولهای شیمیایی هستند که ویژگیهای این اسیدهای آمیدی را تغییر میدهند و برهمکنش آنها در شکلگیری ساختار سهبعدی پروتئین و برهمکنشهای این مولکول با سایر مولکولهای پروتئینی، DNA و RNA نقش دارد. به علاوه زنجیره جانبی آمینواسیدهای جایگاه فعال آنزیم، در کاتالیز واکنش بهوسیله این پروتئینها شرکت میکند. زنجیره جانبی در پلیساکاریدهای منشعب، گلیکولیپیدها و گلیکوپروتئینها، از اولیگوساکاریدهایی تشکیل میشود که میتواند در نقش عملکردی یا ساختاری مولکول تغییر ایجاد کند.
زنجیره جانبی آمینو اسیدها
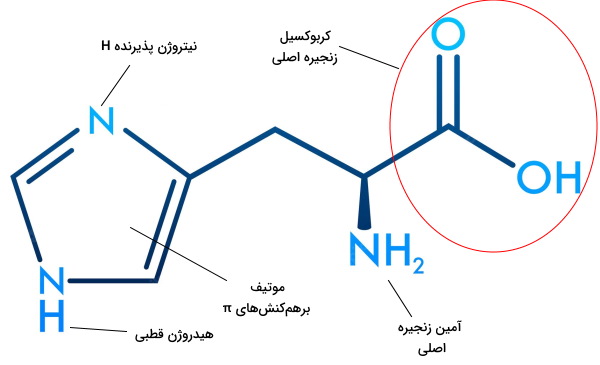
آمینواسیدها گروهی از مولکولهای آلی هستند که از کنار هم قرار گرفتن آنها مهمترین مولکول زیستی (پروتئین) ایجاد میشود. ساختار این مولکول از اتم کربنی تشکیل میشود که چهار موقعیت اتصال به گروههای مختلف دارد. گروههای عاملی آمین () و کربوکسیل () و یک اتم هیدروژن، سه گروه مشترکی هستند که در تمام آمینواسیدها، به کربن اصلی متصل میشوند. چهارمین الکترون لایه ظرفیت اتم کربن در این ساختار با گروههای مختلفی پیوند برقرار میکند که ویژگی شیمیایی این مولکول را تغییر میدهند. این گروه زنجیره جانبی آمینواسید نام دارد و با حرف R نمایش داده میشود. گلایسین سادهترین آمینواسید است که زنجیره جانبی آن از یک مولکول H تشکیل میشود. این مولکولها را بر اساس ویژگیهای شیمیایی زنجیره جانبی به انواع قطبی یا ناقطبی، اسیدی یا بازی و باردار (بار منفی یا مثبت) یا خنثی تقسیمبندی میکنند.
زنجیره جانبی قطبی و ناقطبی
قطبیت یک ترکیب بر اساس اختلاف الکترونگاتیوی بین دو اتم درگیر پیوند تعریف میشود. هر چه این اختلاف بیشتر باشد، یکی از اتمها تمایل بیشتر برای جذب الکترونها به هسته خود دارد. در نتیجه قطبیت پیوند و مولکول ایجاد شده افزایش مییابد. وجود گروههای عاملی اسید (C OOH)، آمید ()، الکل (OH) و آمین () در زنجیره جانبی، قطبیت مولکول را افزایش میدهد. قطبیت آمینواسید در نهایت به میزان قطبیت زنجیره جانبی و تعداد کربنهای موجود در آن بستگی دارد. آسپارژین (آمین)، گلوتامین (آمین)، سرین (الکل)، سیستئین (تیول)، تیروزین (فنول)، تروئونین (الکل) آمینواسیدهایی هستند که زنجیره جانبی قطبی دارند.
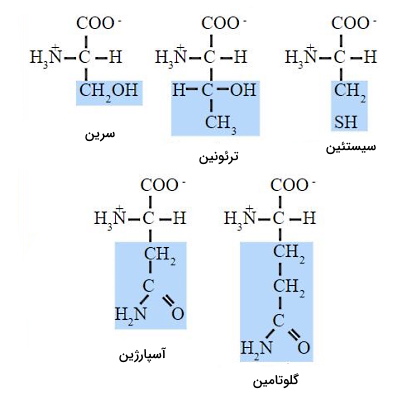
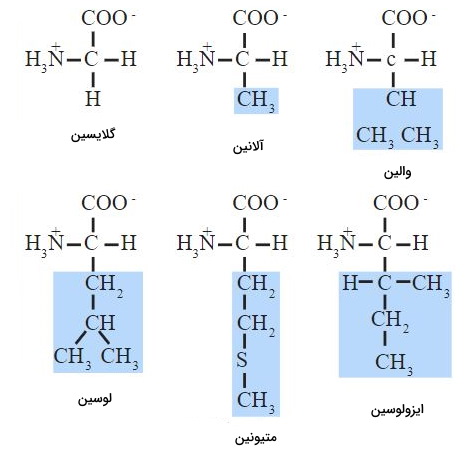
زنجیره جانبی تشکیل شده از گروههای آلکیل یا آروماتیک ساده، آمینواسید را به یک مولکول ناقطبی تبدیل میکند. آلانین (متیل)، گلایسن (اتم هیدروژن)، ایزولوسین (sec-بوتیل)، لوسین (ایزوبوتیل)، متیونین (هیدروکربن گوگردی)، تریپتوفان (حلقه آروماتیک)، فنیل آلانین (حلقه آروماتیک)، پرولین (حلقه پیرولیدون) و والین (ایزوپروپیل) آمینواسیدهایی هستند که زنجیره جانبی آنها ناقطبی است.
زنجیره جانبی آلیفاتیک و آمفی پاتیک
مولکول آمفیپاتیک یا دوگانهدوست به مولکولی گفته میشود که بخشی از آن آبگریز و بخشی از آن آبدوست است. اما ویژگی آلیفاتیک به مولکولهایی گفته میشود که آبگریز و ناقطبی است. از آنجایی که بخش اصلی بدن انسان و سلولها را آب تشکیل میدهد، آلفیاتیک یا آمفیپاتیک بودن زنجیره جانبی در توالی آمینواسیدها نقش مهمی در ساختار سهبعدی پروتئین دارد. این ساختار به شکلی تشکیل میشود که بخشهای آبگریز حداقل تماس با مولکولهای آب را داشته باشند.
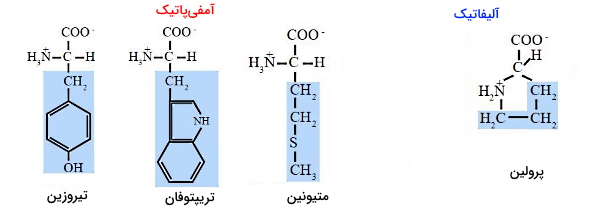
گلایسین، آلانین، والین، لوسین، ایزولوسین و پرولین، زنجیره جانبی آلیفاتیک دارند و میزان آبگریزی با تعداد گروههای کربن رابطه مستقیم دارد. تریپتوفان (ایندول) و تیروزین (بخش قطبی هیدروکسل و بخش ناقطبی حلقه بنزنی متصل به متیل) دو آمینواسید آروماتیک آمفیپاتیک و میتونین یکی از آمینواسیدهای با زنجیره ناقطبی است که در بعضی تقسیمبندیها در گروه آمینواسیدهای آمفیپاتیک قرار میگیرند.
زنجیره جانبی اسیدی و بازی
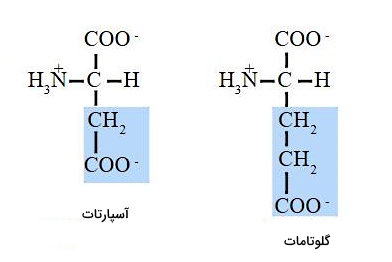
زنجیره جانبی دو آمینواسید طبیعی آسپارتیکاسید () و گلوتامیکاسید () از گروه عاملی کربوکسیل تشکیل میشود. به علاوه وجود پیوند دوگانه اکسیژن و گروه عاملی هیدروکسیل، قطبیت این دو آمینواسید را افزایش میدهد.
وجود گروه عاملی آمین در زنجیره جانبی سبب مثبت شدن بار کلی مولکول و ویژگیهای بازی میشود. آمین زنجیره جانبی مثل آمین متصل به کربن آلفا در pH بدن پروتونه است. لیزین، هیستیدین و آرژینین سه آمینواسید طبیعی هستند که در بدن ویژگیهای بازی دارند. توجه به تفاوت آمین و آمید در این بخش مهم است. آمین گروه عاملی است که از نیتروژن متصل به سه کربن تشکیل میشود. اما در آمید نیتروژن به یک به سه گروه کربنی (که یکی از آنها با اکسیژن پیوند دوگانه دارد) متصل میشود.
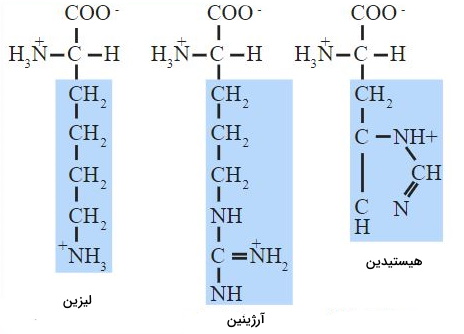
زنجیره جانبی خنثی و باردار
در pH فیزیولوژیک بدن (۷٫۴)، گروه کربوکسیل در ساختار اصلی آمینواسید دپروتونه () و گروه آمین پروتونه () است. به همین دلیل مجموع بار کلی مولکول خنثی است و اضافه شدن زنجیره جانبی بار مولکول را تغییر میدهد. لیزین (آمین | )، آرژینین (گوانیدینو) و هیستیدین (حلقه ایمیدازول) سه آمینواسیدی هستند که بار کلی آنها در pH بدن مثبت است. به علاوه کربوکسیل موجود در زنجیره جانبی آسپارتیکاسید و گلوتامیکاسید در pH بدن دپروتونه است و سبب منفی شدن بار کلی مولکول میشود. تمام الکترونهای ظرفیت در کربن آمید به مولکولهای کربن متصل است و با تغییر pH پروتونه یا دپروتونه نمیشود. به همین دلیل زنجیره جانبی آسپارژین و گلوتامین خصوصیات بازی ندارد.
زنجیره جانبی پلی ساکارید ها
پلیساکاریدها گروه دیگری از پلیمرهای زیستی هستند که از کنار هم قرار گرفتن زیرواحدهای کربوهیدراتی تشکیل میشوند. این مولکولها ساختارهای متفاوتی دارند. بعضی از آنها ازجمله سلولز از یک پلیمر خطی ساده تشکیل میشوند. اما بعضی از آنها انشعابات فراوانی دارند (گلیکوژن و نشاسته) که به آنها زنجیره جانبی یا شاخه فرعی گفته میشود. به علاوه این پلیمرها را میتوان بر اساس عملکرد به دو نوع ساختارری و ذخیره تقسیم کرد. سلولز و کیتین پلیساکاریدهای ساختاری در دیواره سلولی گیاهان و اسکلت خارجی حشرات، گلیکوژن و نشاسته پلیساکارید ذخیرهای در سلولهای جانوری و گیاهی هستند.
گلیکوژن پلیمری است که از کنار هم قرار گرفتن زیرواحدهای D-گلوکزی تشکیل شده است که با پیوند آلفا-۱-۴ گلیکوزیدی (اتصال OH کربن ۱ با H کربن ۴) به هم متصل میشوند. تقریبا پس از هر ۱۰ واحد گلوکزی زنجیره جانبی از اولیگوساکاریدهای گلوکزی با پیوند آلفا ۱-۶ گلیکوزیدی به ساختار اصلی متصل میشود.
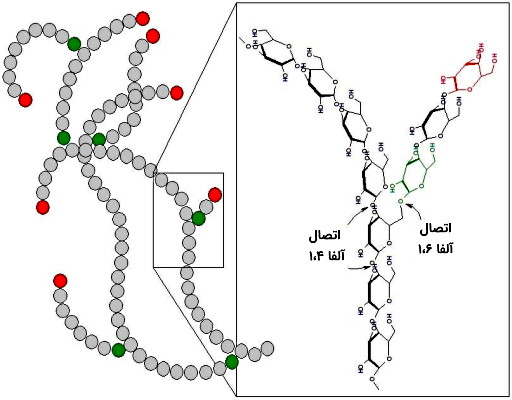
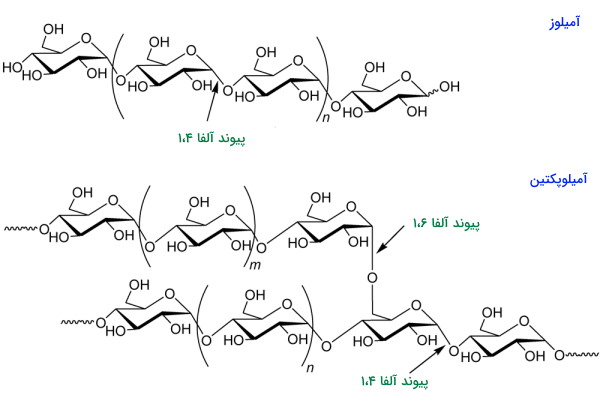
نشاسته پلیساکارید ذخیرهای دیگری است که دو ساختار خطی (آمیلوز) و منشعب (آمیلوپکتین) دارد و بر اساس نوع گیاه درصد این ساختار در ترکیب ذخیرهای تغییر میکند. ساختار اصلی این پلیمر مثل گلیکوژن از کنار هم قرار گرفتن زیرواحدهای D-گلوکز بهوسیله پیوند آلفا ۱،۴-گلیوکوزیدی تشکیل شده است و تعداد این زیرواحدها معمولا بین ۳۰۰ تا ۳۰۰۰ مولکول تغییر میکند. زنجیره جانبی اولیگوساکاریدی گلوکز پس از هر تکرار ۲۴ تا ۳۰ زیرواحدی، بهوسیله پیوند آلفا ۱،۶-گلیکوزیدی به زنجیره اصلی متصل خواهد شد. اتصال گلوکزها در زنجیره جانبی مثل ساختار اصلی با پیوند آلفا-۱،۴ انجام میشود.
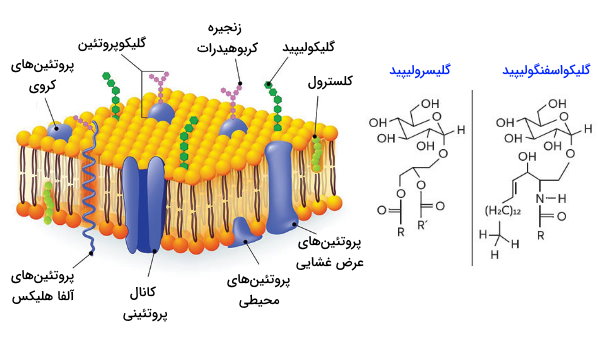
زنجیره جانبی گلیکوپروتئین ها
گلیکوپروتئینها، پلیمرهای زیستی هستند که حداقل یک زنجیره اولیگوساکاریدی یا پیوند کووالانسی به زنجیره جانبی زیرواحدهای آمینواسیدی آنها متصل میشود. این شاخههای جانبی همزمان با ترجمه mRNA یا پس از آن (در دستگاه گلژی) به ساختار اصلی پروتئین اضافه میشوند و بیشتر پروتئینهای ترشحی (هورمون تحریک تیروئید، هورمون اریتروپویتین، هورمون تحریک فولیکول و هورمون لوتئال) از این نوع هستند. زنجیره اولیگوساکاریدی در گلیکوپروتئینهای عرض غشایی در بخش خارجی غشا قرار دارد و به اتصال دو سلول مجاور کمک میکند. اضافه شدن زنجیره جانبی کربوهیدراتی به پروتئین، گلیکوزیلاسیون نام دارد و با دو مکانیسم برگشتپذیر و برگشتناپذیر انجام می شود. گلیکوزیلاسیون برگشتپذیر یکی از مسیرهای سلولی برای انتقال پیامها است. اما در گلیکوزیلاسیون برگشتپذیر، ساختار پروتئين بدون گروههای قندی کامل نیست و عملرکرد لازم را ندارد.
کلاژن (پروتئین بافت پیوندی و ماتریکس خارج سلولی)، موسین (پروتئین مخاط)، ترانسفرین (پروتئین حامل آهن)، ایمونوگلوبولینها (آنتیبادیهای سیستم ایمنی)، لکتین (پروتئین اتصال سلولی) و سکلتین (پروتئین پیامرسانی سلول) از جمله گلیکوپروتئینهای بدن انسان هستند. زنجیره جانبی اولیگوساکاریدی به اتمهای مختلفی در زنجیره جانبی آمینواسید متصل میشود که اتصال به اتم اکسیژن و نیتروژن از همه متداولتر است.
- گلیکوزیلاسیون N: در این اتصال گروه کربوهیدرات معمولا به نیتروژن آمیدی زنجیره جانبی آسپارژین متصل میشود.
- گلیکوزیلاسیون O: در این اتصال گروه کربوهیدرات معمولا به اکسیژن هیدروکسیلی زنجیره جانبی سرین و تروئونین متصل میشود.
- گلیکوزیلاسیون P: به اتصال گروه کربوهیدرات به فسفر یا فسفوسرین گلیکوزیلاسیون P گفته میشود.
- گلیکوزیلاسیون C: در این اتصال گروه قندی مستقیم به کربن زنجیره جانبی متصل میشود. برای مثال مانوز میتواند مستقیم به کربن تریپتوفان متصل شود.
- گلیکوزیلاسیون S: در این نوع اتصال، یک مولکول بتا-N-استیل گالاکتوز آمین به اتم گوگرد موجود در زنجیره جانبی سیستئین متصل میشود.
گلوکر، فروکتوز، زایلوز، مانوز، گالاکتوز، N-استیل گلوکز آمین، گلوکورونیکاسید، ایدورونیکاسید، N-استیل گالاکتوز آمین، سیالیکاسید و ۵-N-استیل نورامیکاسید، ۱۰ مونوساکاریدی هستند که زنجیره جانبی گلیکوپروتئينهای پستاندران را میسازند.
زنجیره جانبی گلیکولیپید ها
گلیکولیپیدها از اتصال زنجیره جانبی اولیگوساکاریدی بهوسیله پیوند کووالانسی (گلیکوزیدی) به مولکولهای لیپیدی تشکیل میشود. وظیفه اصلی آنها حفظ ساختار غشای پلاسمایی، کمک به شناسایی سلول بهوسیله مولکولهای ایمنی و اتصال دو سلول کنار هم برای تشکیل بافت است. برای تشکیل این مولکولها، کربن آنومریک مونوساکاریدها یا اولیگوساکاریدها به گروه هیدروکسیل آزاد در گلیسرول یا اسفنگوزین انتهای قطبی لیپیدهای غشایی متصل میشود.
آنزیم گلیکوزیل ترانسفراز یکی از ترانسفرازهای دستگاه گلژی پستانداران است که گروههای اولیگوساکاریدی را به لیپیدها متصل میکند. سپس گلیکولیپیدها به شکل وزیکول از دستگاه گلژی خارج و به غشای سیتوپلاسمی منتقل میشوند. ادغام وزیکول با غشا، گلیکولیپیدها آنها را به ترکیب آن اضافه میکند. به علاوه آنزیم گلیکوزیل هیدرولاز با هیدرولیز همه یا بخشی از اولیگوساکاریدهای متصل به لیپید غشا، ساختار این لیپیدها را تغییر میدهدو بازگشت کربوهیدراتها به سیتوپلاسم سلول را تسهیل میکند. گلیکولیپیدها بر اساس نوع لیپید ساختار اصلی و نوع کربوهیدراتهای زنجیره جانبی به دو گروه گلیسرولیپیدها و گلیکواسپینگولیپیدها تقسیم میشوند.
- گلیسرولیپیدها: در این مولکولها زنجیره کربوهیدرات به مولکول گلیسرول در ساختار لیپید متصل میشود. این مولکولها درصد زیادی از ترکیب غشای فتوسنتزی تیلاکوئیدها را به خود اختصاص میدهند و بر اساس کربوهیدرات زنجیره جانبی به دو گروه تقسیم میشوند.
- گالاکتولیپید: در این مولکولها مونوساکارید گالاکتوز به مولکول گلیسرول لیپید متصل میشود. این مولکولها در غشای کلروپلاست سلولهای گیاهی قرار دارند.
- سولفولیپید: مونوساکارید اتصالی به دی آسیل گلیسرول در این مولکولها حداقل یک گروه عاملی گوگردی دارد. سولفوکوئینووسیل دی آسیل گلیسرول یکی از شناخته شدهترین انواع این مولکول است که در زنجیره انتقال الکترون غشای فتوسنتزی قرار دارد.
- گلیکواسفنگولیپیدها: زنجیره کربوهیدراتی در این مولکولها به اسفنگوزین بخش لیپیدی متصل میشود. گلیکواسفنگولیپدها، گلیکولیپدهای تخصصی سیستم عصبی در پستانداران هستند که در پیامرسانی سلولها نقش دارند. این مولکولها بر اساس نوع و تعداد مونوساکاریدهای زنجیره جانبی به انواع مختلفی تقسیم میشوند.
- سربروزید: گالاکتوز، مونوساکارید موجود در گالاکتوسربروزیدها است و این مولکولها بیشتر در بافت عصبی قرار دارند. اما گلوکوسربروزیدها، از اضافه شدن گلوکز به بخش اسفنگوزین ایجاد میشوند و بیشتر در بافتهای غیر عصبی وجود دارند. سولفاتیدها، گروه دیگری از سربروزیدها هستند که در کربوهیدرات زنجیره جانبی آنها، گروه عاملی سولفیدی وجود دارد. این مولکولها در بسیاری از فرایندهای زیستی از پاسخهای ایمنی تا انتقال پیامهای سلولی مشارکت میکنند.
- گانگلیوزید: گانگلیوزیدها پیچیدهترین گلیکولیپیدهای موجود در سلول جانوری هستند که در زنجیره جانبی آنها حداقل یک مولکول اسید سیالیک وجود دارد. فراوانی این مولکولها در بافتهای عصبی بیشتر از بافتهای دیگر است.
- گلوبوزید: زنجیره جانبی این گلیکولیپیدها بیش از یک واحد کربوهیدراتی دارد.
بر هم کنش های زنجیره جانبی آمینو اسید
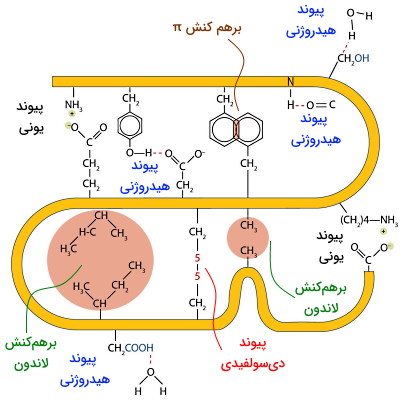
ساختار اول (ساختار خطی) پروتئينها از کنار هم قرار گرفتن آمنیواسیدها بهوسیله پیوند پپتیدی شکل میگیرد. ساختار دوم این مولکول بهوسیله پیوند هیدروزنی بین گروههای کربوکسیل و آمید زنجیره اصلی آمنیواسیدها در فواصل منظم تشکیل میشود (آلفا هلیکس در فاصله ۳٫۶ آمینواسید و صفحات بتا بین آمینواسیدهای روبهروی هم). اما سوم (سهبعدی) این مولکول زیستی بر اساس توالی آمینواسیدها، نوع زنجیره جانبی آنها و برهمکنشهای غیرکووالان زنجیره جانبی آمینواسید تعیین میشود. به علاوه برهمکنش این مولکولها با مولکولهای دیگر ازجمله RNA و DNA به نوع زنجیرههای جانبی بستگی دارد. برهمکنشهای قطبی-قطبی، نیروهای لاندن (دوقطبی لحظهای)، نیروهای الکترواستاتیک، پیوندهای دیسولفیدی و انواع برهمکنش از مهمترین برهمکنشهای زنجیره جانبی در تشکیل ساختار پروتئین هستند.
- برهمکنش الکترواستاتیک: نیروهای الکترواستایک بین مولکولها یا اتمها با دو بار مخالف ایجاد میشود. این نیروها بین زنجیرههای جانبی بار منفی (آسپارتیکاسید و گلوتامیکاسید) و بار مثبت (لیزین، آرژینین و هیستیدین) آمینواسید بیشتر در پروتئینهای تنظیمی و جایگاه فعال آنزیمها دیده میشود. به علاوه این نیرو یکی از عوامل اتصال سوبسترا به جایگاه فعال آنزیم است.
- پیوندهای هیدروژنی: به طور کلی پیوند هیدروژنی نیرویی است که بین اتم هیدروژن متصل به اتمهای الکترونگاتیو (اکسیژن، نیتروژن و فلوئور) و یک اتم الکترونگاتیو دیگر ایجاد میشود. زنجیره جانبی قطبی آمینواسیدهای سرین، گلوتامین و آسپارژین در تشکیل این پیوند شرکت میکنند.
- پیوندهای دیسولفیدی: پیوندهای دیسولفید بین سولفیدریل یا تیول (SH) زنجیره جانبی سیستئین ایجاد و سبب تاخوردگی پروتئین میشود. ایجاد این پیوند پایداری پروتئین را افزایش میدهد. از آنجایی که این پیوند از اکسایش گروه تیول ایجاد میشوند (با کمک آنزیم سولفیدریل اکسیداز) و محیط سیتوزول سلول شرایط احیاکننده دارد، تعداد پروتئینهای دارای این برهمکنش در سیتوپلاسم بسیار کم است. هورمون انسولین یکی از پروتئینهایی است که ساختار آن از سیستئین و پیوندهای دیسولفیدی فراوان تشکیل شده است.
- نیروهای لاندن: این برهمکنشهای ضعیف زمانی ایجاد میشوند که توزیع الکترون در یک پیوند برای لحظهای تغییر میکند و یک اتم ناقطبی برای لحظهای قطبی میشود. این برهمکنشها در پروتئینهایی ایجاد میشوند که بیشتر توالی آمینواسیدی از زنجیرههای ناقطبی تشکیل شده است. فیبروئین (پروتئین نامحلول در آب ابریشم) یکی از پروتئینهای ساختاری است که نیروهای لاندن در تشکیل ساختار آن نقش مهمی دارند. این نیروها را نباید با نیروهای هیدروفوب اشتباه گرفت. نیروهای هیدروفوب به دلیل پیوند هیدروژنی بین مولکولهای آب و مولکول آب با بخشهای قطبی پروتئین ایجاد میشود. در این حالت پروتئینی به شکلی تا می خورد که گروههای ناقطبی در دورترین فاصله از مولکولهای آب قرار بگیرند. برهمکنشهای ازجمله این برهمکنشهای لاندن هستند.
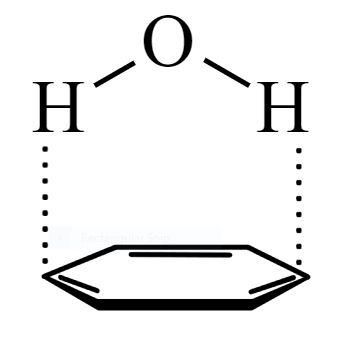
برهم کنش های
این برهم کنش از انواع برهمکنشهای بین مولکولی و ضعیف لاندن هستند که به دلیل تغییر لحظهای در توزیع الکترون پیوندی ایجاد میشوند. برهمکنشهای پای مثل نیروهای الکترواستاتیک بین اتم دارای بار جزئی مثبت، بار جزئی منفی، اتم یا کاتیون فلزی، آنیون و سیستم پای دیگر (زنجیره جانبی آروماتیک) ایجاد میشود. برهمکنشهای نقش مهمی در اتصال لیگاند-رسپتور و آنتیژن-آنتیبادی دارند. به دلیل همپوشانی اوربیتالها P بین اتمهای کربن با پیوند دوگانه ایجاد میشود. برهمکنش گروه پای و اتم یا کاتیون فلزی و مولکولهای قطبی با آرایش در آرایش روبهرو ایجاد میشود. در برهمکنش پای و مولکول قطبی، گروه پای در حالت چهارقطبی لحظهای قرار دارد.
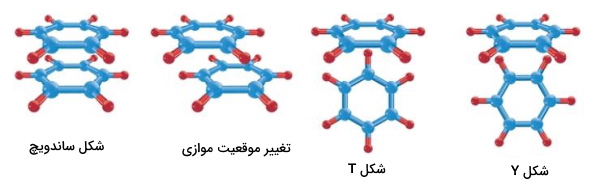
برهمکنش برای ایجاد برهمکنش - بین زنجیره جانبی مولکولهای پروتئینی با لیگاندهای پروتئینی و شیمیایی، پروتئینهای تنظیمی DNAو RNA (بازهای آلی وارد برهمکنشهای پای میشوند)، در چهار موقعیت روبرو یا ساندویچ (Sandwich | S) موازی (Parallel Displaced)، شکل T و شکل Y قرار میگیرند. به این برهمکنشها پای استاکینگ () گفته میشود.
نقش بر هم کنش پای در سیستم های زیستی
ساختار استیل کولین استراز از ۱۴ زنجیره آروماتیک محافظت شده تشکیل میشود. گروه تریمتیل آمونیوم استیل کولین به این حلقههای آروماتیک زنجیره جانبی تریپتوفان در این آنزیم متصل میشود. ایندول موجود در زنجیره جانبی تریپتوفان از دو حلقه آروماتیک تشکیل شده است. در نتیجه تجمع الکترون و بار جزئی منفی در این زنجیره بیشتر از زنجیرههای تیروزین و فنیل آلانین است.
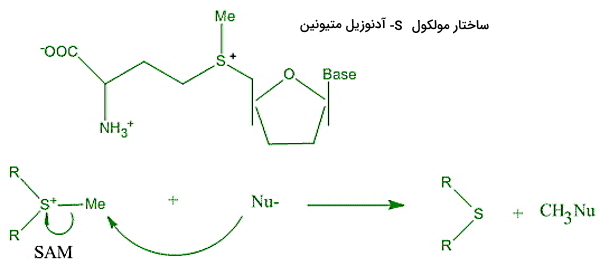
S-آدنوزیل متیونین (S-Adenosyl Methionine | SAM) یکی از مولکولهای اهداکننده متیل در واکنشهای زیستی است. این مولکول در واکشنهای جانشینی الکتروفیل شرکت میکند. نوکلئوفیل واکنشهای SAM اسیدهای نوکلئوئیک، پروتئینها، قندها و پیوند دوگانه بین اتمهای کربن () در لیپیدهای غیراشباع و استروئیدها است. اتصال بخش () SAM با زنجیره جانبی تریپتوفان در آنزیم متیل ترانسفراز از نوع پای-کاتیون است.
زنجیره جانبی تیروزین
تیروزین یکی از آمینواسیدهای مهم در گیرندههای انتقال پیام سلولی است. تیروزین کینازها یکی از مهم ترین مسیرهای انتقال پیام را با فسفوریله کردن گروه هیدروکسیل زنجیره جانبی این آمینواسید در بخش سیتوپلاسمی رسپتورهای عرض غشایی شروع میکنند. به علاوه زیرواحدهای تیروزینی فتوسیستم II، مولکولهای اهداکننده الکترون در زنجیره انتقال الکترون کلروپلاست هستند. باقیمانده تیروزین این پروتئین در یک واکنش اکسایش-کاهش هیدروژن متصل به OH فنول را از دست میدهد و مولکول کلروفیل را اکسید میکند. رادیکال ایجاد شده در این واکنش بهوسیله دسته چهار مرکزی منگنز احیا میشود.
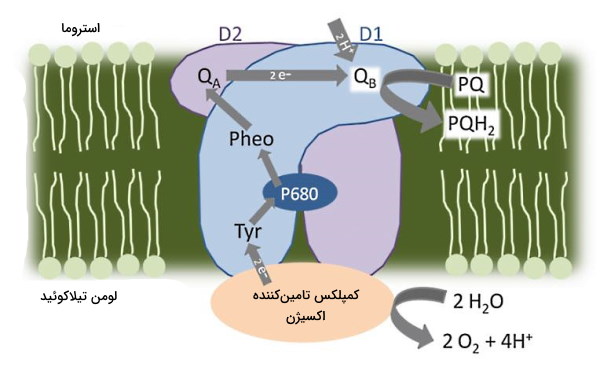
سولفانسیون یا اضافه شدن گروههای گوگردی به زنجیره جانبی تیروزینها یکی دیگر از واکنشهای مهم این آمینواسید در ساختار پروتئین است. سولفانیسون تیورزین به افزایش پایداری و برهمکنشهای بین پروتئینی کمک میکند. این واکنش یکی از تغییرات پس از ترجمه پروتئینها در دستگاه گلژی برای پروتئینهای اتصال سلولی، رسپتورهای جفت شده با پروتئینهای G، فاکتورهای انعقادی، مهارکنندههای سرین پروتئاز، پروتئینهای ماتریکس خارج سلولی و هورمونها است که بهوسیله آنزیم تیروزیل پروتئین سولفوترانسفرازهای (Tyrosylprotein Sulfotransferase) کاتالیز و در دستگاه گلژی انجام میشود. اهداکننده گروه گوگردی در این واکنش مولکول فسفو آدنوزین-فسفوسولفات () است. تیروزین هدف این واکنش بین توالی از آمینواسیدهای اسیدی قرار دارد.
زنجیره جانبی تریپتوفان
در بخشهای قبلی توضیح دادیم که زنجیره جانبی تریپتوفان یکی از گروههای مهم در انواع برهمکنشهای پای و در نتیجه برهمکنشهای مختلف پروتئینها است. یکی دیگر از ویژیگیهای مهم این زنجیره که در شناسایی توالی آمینواسید کمک میکند، ویژگی فلوئورسنت حلقه ایندول در زنجیره جانبی است. اکثر تابش ذاتی فلوئورسنت پروتئینهای تاخورده، به دلیل وجود این باقیمانده آمینواسید در ساختار مولکول است.
زنجیره جانبی پرولین چیست ؟
پرولین تنها آمینواسیدی است که آمین زنجیره اصلی آن یا زنجیره جانبی واکنش داده و حلقه تشکیل میدهد. این آمینواسید در ساختار پیوند پپتیدی، همیشه پذیرنده هیدروژن است. به علاوه تشکیل پیوند پپتیدی بین tRNA پرولین با آمینواسیدهای پلیپپتید کمتر از سایر tRNA-آمینواسیدها است. انعطاف کم زنجیره جانبی پرولین، بر کنفورماسیون ساختار دوم پروتئین اثر دارد. وجود این آمینواسید در میانه توالی آمینواسید تشکیل ساختارهای آلفا هلیکس و بتا شیت در پروتئین را متوقف میکند. به همین دلیل اکثر پرولین موجود د این ساختارها در ابتدای موتیف قرار میگیرد. برخلاف ساختارهای آلفا هلیکس و بتا شیت، ساختار زنجیره جانبی پرولین به تشکیل موتیفهای پیچ کمک میکند. توای پرولینها در ساختار کلاژن، موتیفی به نام هلیکس پرولین ایجاد میکند که اضافه شدن گروههای هیدروکسیل بهوسیله هیدروکسیلاز پایداری و نقطه ذوب کلاژن را افزایش میدهد.
زنجیره جانبی هیستیدین چیست ؟
حلقه ایمیدازول موجود در زنجیره جانبی هیستیدین این آمینواسید را به یک مولکول استراتژیک در پروتئينهای عملکردی تبدیل میکند. ثابت تفکیک اسید این حلقه آروماتیک ۶٫۵ است و کوئوردیناسیون الکترونی آن این مولکول را به لیگاند مناسب (ازجمله و ) برای فلزات، پذیرنده و اهداکننده هیدروژن در پیوند هیدروژنی تبدیل میکند. به همین دلیل این آمینواسید در جایگاه فعال بسیاری از آنزیمها وجود دارد. برهمکنش هیستیدین با آمینواسیدهای دیگر و یونهای فلزی به پنچ گروه تقسیم میشود.
- برهمکنش کاتیون-: برهم کنش حلقه ایمیدازول زنجیره جانبی با کاتیونهای فلزی و آمینواسیدهای مثبت (لیزین و آرژینین) از این نوع است. به علاوه برهمکنش هیستیدین پروتونه با سایر آمینواسیدهای آروماتیک (فنیل آلانین، تیروزین و تیرپتوفان) از نوع کاتیون- است.
- برهمکنش -: برهمکنش حلقه ایمدازول با زنجیره جانبی آمینواسیدهای آروماتیک از نوع - است.
- برهمکنش هیدروژن-: هیدروژن قطبی هیستیدین میتواند با زنجیره جانبی آمینواسیدهای آروماتیک با آرایش T برهمکنش هیدروژن- داشته باشد.
- برهمکنش کوئوردیناسیونی: برهمکنش نیتروژن بازی در حلقه ایمیدازول زنجیره جانبی این آمینواسید با یونهای فلزی از نوع کوئوردینانسی است.
- پیوند هیدروژنی: هیدروژن قطبی حلقه ایمدازول، دهنده هیدروژن و نیتروژن بازی این حلقه پذیرنده هیدروژن برای برقراری پیوند هیدروژنی است.
نقش زنجیره جانبی آمینو اسید در جایگاه فعال آنزیم
بسیاری از آنزیمها ازجمله سرین پروتئازها، سیستئن پروتئازها، پروتئن کینازها و فسفاتازها برای کاهش انرژی فعالسازی واکنش پیوند کوالانسی موقتی با سوبسترا برقرار میکنند. این واکنشها (مثل بسیاری از واکنشهای شیمیایی خارج بدن) در دو مرحله تشکیل (محدودکننده) و شکستن پیوند (بازایابی آنزیم) انجام میشود. مکانیسمهای کاتالیز الکتروفیل و نوکلئوفیل ازجمله مکانیسمهای هستند که از تشکیل پیوند کووالانسی بهره میبردند. در جایگاه فعال آنزیمهایی که از مکانیسمهای نوکلئوفیلی استفاده میکنند، یکی از آمینواسیدهای سرین، سیستئین، آسپارتات و گلوتامین (آمینواسیدهای با زنجیره جانبی مثبت یا قطبی) قرار دارد. جایگاه فعال آنزیمهایی که از مکانیسم الکتروفیل برای کاتالیز واکنشهای زیستی استفاده میکنند، از توالی آمینواسیدهای الکتروفیل (با زنجیره جانبی مثبت) تشکیل میشود. اما به دلیل اینکه خاصیت الکتروفیلی زنجیره جانبی آمینواسیدها قوی نیست، این کاتالیزورها معمولا به کوفاکتور برای انجام واکنش نیاز دارند.
یکی دیگر از مکانیسمهای کاتالیزی در آنزیمها، اهدا و دریافت پروتئین در اسید و باز است. در بعضی از گروه هیدروکسیل و پروتون بین اسید و باز منتقل میشود. اما در بسیاری از واکنشهای آنزیمی، گروههای موجود در ساختار سوبسترا و آنزیم اسید و باز لوئیس هستند. آسپارتات، گلوتامات، هیستیدین و سیستئین ازجمله آمینواسیدهایی هستند که در جایگاه فعال این آنزیمها قرار دارند. زنجیره جانبی این مولکولها در واکنش آنزیمی تشکیل الکتروفیل یا نوکلئوفیل میدهند و بار منفی و مثبت مورد نیاز برای پیشبرد واکنش را تامین میکنند.
واکنش گلیکوزیلاسیون
واکنش گلیکوزیلاسیون در سلولهای یوکاریوتی با فعال شدن کربوهیدرات شروع میشود و آنزیمهای ترانسفرازی، کربوهیدرات فعال (در بیشتر موارد قند متصل به نوکلئوتیدها) را از مولکول اهداکننده به زیرواحد پذیرنده (پروتئین، لیپید یا پلیساکاریدها) اضافه میکنند. شکل فعال گالاکتوز، گلوکز، N-استیل-گالاکتوز آمین، N-استیل-گلوکز آمین، گالاکتوز آمین و زایلوز متصل به UDP، شکل فعال مانوز و فروکتوز متصل به GDP و شکل فعال سیالیکاسید متصل به CMP است. آنزیمهای نوکلئوتید ترانسفراز، پیوند کوالانسی بین گروههای قندی را کاتالیز و یک مولکول دو فسفاته (پیروفسفات) آزاد میکنند. مکانیسم کاتالیتیکی آنزیم گلیکوزیل ترانسفراز بر اساس یک حمله الکتروفیلی، به اتم نوکلئوفیل اکسیژن یا نیتروژن در پروتئین، لیپید یا زنجیره کربوهیدراتی است.
این آنزیمها بر اساس نوع و تعداد قندی که به زنجیره اصلی اضافه میکنند انواع مختلفی دارند. اما بر اساس کنفورماسیونهای ساختار دو نوع گلیکوزیل ترانسفرازهای A و B تقسیم میشوند. با اضافه شدن گروههای قندی ممکن است همراه با تغییر (Inversion) یا عدم تغییر (Retention) کنفورماسیون کربن آنومریک باشد. اغلب گلیکوزیل ترانسفرازهای سلول یوکاریوتی، پروتئینهای عرض غشایی نوع II هستند که انتهای C کروی در آنها سمت لومن گلژی قرار دارد. مکانیسم کاتالیز و ساختار جایگاه فعال آنزیمهای تغییردهنده کنفورماسیون جایگاه فعال کربن آنومریک، متفاوت است.
- آلفا-۳-فروکتوز ترانسفراز از مکانیسم SN2 برای اضافه کردن زیرواحدهای قندی به مولکولهای زیستی استفاده میکنند.
- در جایگاه فعال گلیکوزیل ترانسفرازهای A تغییردهنده کنفورماسیون کربن آنومریک، یون منیزیومی وجود دارد که نقش کاتالیوزر اسیدی را بازی میکند.
- جایگاه فعال آنزیمهای گلیکوزیل ترانسفراز B کاملا متفاوت و بدون یون فلزی است.
جمع بندی
در این مطلب توضیح دادیم که زنجیره جانبی گروههای شیمیایی هستند که با اضافه شدن به ساختار اصلی سایر مولکولها ویژگی جدید ساختاری یا عملکرید در آنها ایجاد میکنند. یکی از مهمترین زنجیرههای جانبی در زیستشناسی، زنجیره جانبی مولکولهای آمینواسید است که در تشکیل ساختار و برهمکنش این مولکول با سایر مولکولها نقش بسیار مهمی دارد. واکنشهای تشکیل زنجیره جانبی در شیمی و زیستشناسی یکسان است و تفاوت اصلی آنها محیط واکنش (محیط پایدار بدن) و حضور آنزیمها برای کاتالیز این فرایندها است.












