ساختار پروتئین در چهار سطح | به زبان ساده

پروتئینها مولکولهای بزرگ و پیچیدهای هستند که نقشهای حیاتی بسیاری در بدن دارند. این مولکولها از واحدهایی به نام اسیدهای آمینه تشکیل شدهاند که با اتصال به یکدیگر، زنجیرههای بلندی را تشکیل میدهند. 20 نوع مختلف اسید آمینه در طبیعت، وجود دارد که به صورتهای مختلفی با هم ترکیب میشوند و انواع بسیار گوناگونی از پروتئینها را ایجاد میکنند. توالی اسیدهای آمینه، سرانجام، ساختار سهبعدی منحصر به فرد هر پروتئین و عملکرد خاص آن را تعیین میکند. به دلیل اهمیت قابل توجه ساختار پروتئین در عملکرد و اختصاصیت آن، در این نوشتار، به معرفی چهار سطح ساختار پروتئین میپردازیم.
ارتباط ساختار پروتئین با عملکرد آن
پروتئینها عناصر سازنده ساختارهای سلولی و موتور فعالیتهای سلولی هستند. آنها بیشتر کارها را در سلول انجام میدهند و برای ساختار، عملکرد و تنظیم بافتها و اندامهای بدن، مورد نیاز هستند. ماهیت آنها «مدولار» (Modular) است؛ به این معنی که هرگونه میانکنش آنها با دیگر مولکولهای سلول، به وجود حوزههای عملکردی خاص متکی است.
این حوزههای عملکردی را دامنه یا «دمین» (Domain) مینامیم. شکل دقیق دامنه، که خود، ناشی از وجود پیوندهای غیر کووالانسی بین ریشههای یک زنجیره پلی پپتیدی است، عملکرد نهایی پروتئین را تعیین میکند. بهترین مثال شناخته شده از رابطه شکل و عملکرد، تئوری «کلید و قفل» است که عملکرد آنزیمی را توصیف میکند.
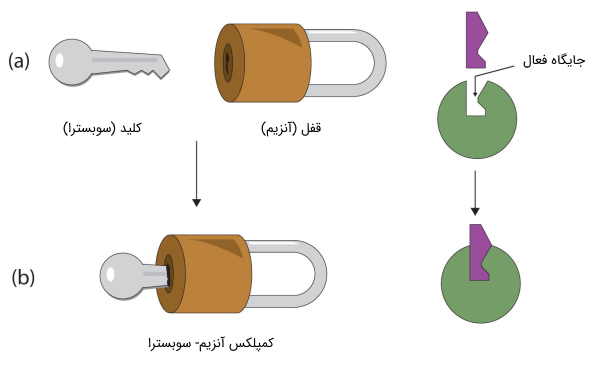
تغییر جایگاه فعال آنزیم، به دلیل جهش یا تغییر در یک اسید آمینه، بسیاری از ویژگیهای آنزیم را تغییر میدهد. یکی از این ویژگیها، تمایل آنزیم برای اتصال به سوبسترا است که به اختصار، «تمایل آنزیمی» (Affinity) خوانده میشود.
به طور خلاصه، میتوان نتیجه گرفت که هرچقدر ساختار سهبعدی دو پروتئین، بیشتر با هم سازگار باشد، اتصال کارامدتری بین آن دو برقرار خواهد شد. این اتصال کارامد، کمک میکند تا پیوندهای بیشتری بین دو پروتئين، شکل بگیرد، پیامها سریعتر مخابره شوند یا مولکول حاوی پروتئین، محکمتر به سطح مورد نظر خود، متصل شود.
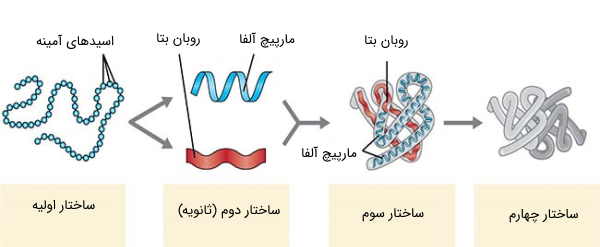
ساختار سهبعدی پروتئین به میانکنش بین اسیدهای آمینه در زنجیره پلیپپتیدی بستگی دارد. از آنجا که توالی اسیدهای آمینه به کد ژنتیکی وابسته است، میتوان نتیجه گرفت که شکل پروتئین در DNA رمزگذاری میشود. پروتئینها دارای چهار سطح ساختاری هستند.
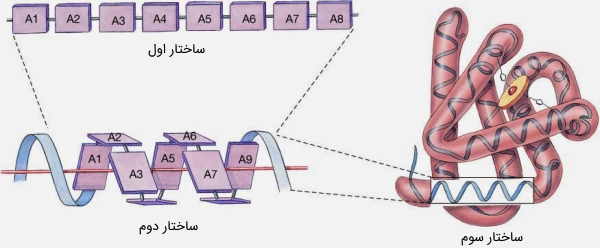
- ساختار اولیه به توالی خطی اسیدهای آمینه اشاره دارد. این اسیدهای آمینه، با پیوندهای پپتیدی به یکدیگر متصل میشوند.
- ساختار دوم (ثانویه) به آرایش منظم و مکرر فضایی اسید آمینههای مجاور، در یک زنجیره پلیپپتیدی اشاره دارد. این ساختار پروتئین بر اثر پیوندهای هیدروژنی بین هیدروژنهای گروه آمید و اکسیژنهای گروه عاملی کربونیل ایجاد میشود، که در واقع، بدنه پروتئین را تشکیل دادهاند. دو گروه بزرگ از ساختارهای ثانویه، شامل «مارپیچهای آلفا» (α-helices) و ساختارهای بتا (β-structures) هستند.
- ساختار سوم (سهبعدی) شکلی است که در نتیجه تاخوردن ساختارهای ثانویه ایجاد میشود و به چگونگی برقراری پیوند بین زنجیرههای جانبی اسیدهای آمینه وابسته است. با تشکیل این ساختار پروتئين ، اسیدآمینههایی که روی رشته پلیپپتیدی، در فاصله دوری از هم قرار داشتند، به یکدیگر نزدیک میشوند.
- ساختار چهارم آرایش زنجیرههای پلی پپتیدی در یک ترکیب چند زیرواحدی را توصیف میکند.
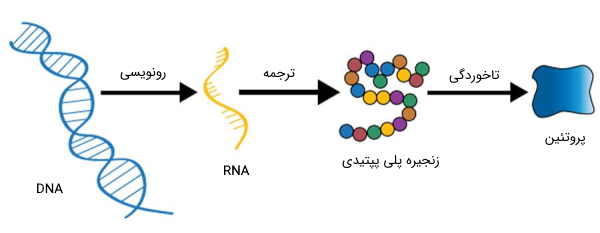
تمام آنچه برای ایجاد شکل منحصر به فرد به پروتئین و عملکرد منحصر به فرد آن، لازم است، در قطعهای از DNA نوشته شده است، که به عنوان ژن شناخته میشود. در طول عمر سلول، هر ژن، ممکن است بارها رونویسی شود. اگر جهش رخ ندهد، هر بار، پروتئین یکسانی از روی آن، ساخته میشود و عملکرد از پیش برنامهریزی شده خود را بر عهده خواهد گرفت.
این امر در مورد سلولهای مختلف منشا گرفته از یک سلول مادری، که از تقسیم میتوز، حاصل شدهاند، نیز صدق میکند. حتی اگر ژن، به صورت یک قطعه بیگانه، وارد ژنوم موجود دیگری شود، بازهم بالقوه، میتواند موجب رمز کردن همان پروتئین، با همان الگوی ساختار سهبعدی شود. هرچند در این حالت، موجود میزبان نیز، ممکن است بر روی این الگوها تاثیرگذار باشد.
پروتئین ها مهمترین محصولات نهایی مسیرهای اطلاعاتی و یکی از ابزارهای مولکولی هستند که از طریق آنها اطلاعات ژنتیکی بیان میشوند. شناخت ویژگیهای بیوشیمیایی پروتئینها و اسیدهای آمینه، یک گام مهم در بسیاری از پژوهشهای حوزه زیستشناسی، به شمار میرود.
ساختار اولیه پروتئین ها
پروتئینها مهمترین و متنوع ترین گروه از درشت مولکولهای سلول هستند و نقشهای گوناگونی را در سلول، بازی میکنند، از جمله این نقشها میتوان به موارد زیر اشاره کرد:
- انتقال مواد مغذی
- کاتالیز انواع واکنشهای بیوشیمیایی
- حضور به عنوان اجزای ساختاری سلولها
- موتورهای مولکولی
پروتئینها پلیمرهای خطی از اسیدهای آمینه هستند که توسط پیوندهای پپتیدی به هم متصل میشوند. آنها از رشته الگوی DNA سنتز میشوند و هریک، حاوی توالیهای منحصر به فردی از آمینو اسیدها هستند که به شکل خطی، در کنار یکدیگر، قرار گرفتهاند. این فرم خطی، به عنوان «ساختار اولیه» (Primary Structure) شناخته میشود.
فقط بیست اسید آمینه برای تولید هزاران پروتئین در سلول، لازم و کافی است. این بدان معنا نیست که فقط بیست اسید آمینه وجود دارد. این یک تصور غلط رایج است. آمینو اسیدهای بیشماری در جهان وجود دارند، اما در سایر واکنشهای متابولیکی شرکت میکنند و در سنتز پروتئین نقش ندارند.
اینکه یک پروتئین واحد، چگونه هویت پیدا میکند و به ساختار سهبعدی منحصر به فرد خود در میآید، کاملا وابسته به چیدمان اسیدهای آمینه، در کنار یکدیگر است و این ویژگی، تمام خصوصیات دیگر پروتئین را تعیین میکند.
اسیدهای آمینه را که با پیوند پپتیدی به هم متصل میشوند، «زنجیره پلی پپتیدی» (Polypeptide Chain) مینامند. همانطور که گفتیم، این زنجیره، از توالی اسیدهای آمینه تشکیل شده است. این توالی اسیدهای آمینه، تنوع حیاتی را برای تأمین نیازهای زندگی فراهم میکند.
حفاظت از توالی منحصر به فرد هر پروتئین، به قدری مهم است که سلول، ساز و کارهای تنظیم کنندهای را طراحی میکند تا اطمینان حاصل شود که تنها، پروتئینهای کامل و صحیح، تولید میشوند و در فعالیتهای سلولی شرکت میکنند.
هر توالی، از چیدمان متفاوتی از اسیدهای آمینه تشکیل شده است که عملکرد بسیار منحصر به فردی را برای پروتئين، ایجاد میکند. هر گونه تغییر در چینش، منجر به تغییرات جدی و قابل ملاحظهای در عملکرد نهایی آن زنجیره خواهد شد. حتی ممکن است عملکرد کل پروتئین، تحت تاثیر قرار بگیرد یا کاملاً از بین برود.
اما همه جهشها یا تغییرات پروتئینی، منجر به عواقب فاجعه بار نمیشود. برخی از آنها سلول و ارگانیسم را با فشارهای محیطی، سازگارتر میکنند، فرایندی که زیست شناسان، آن را «تکامل» (Evolution) مینامند.
خواص اسیدهای آمینه و تفاوتهای زنجیره جانبی آنها
اسیدهای آمینه ساختار پایه یکسانی دارند که برای تشکیل پیوند شیمیایی مناسب بین مولکولهای مجاور، مهم است. هر اسید آمینه، دارای یک کربن مرکزی است که با نام کربن آلفا شناخته میشود. کربن α همیشه چهار گروه زیر را به خود متصل میکند:
- –NH2: یک گروه آمینه بازی است
- –COOH: یک گروه اسیدی (معروف به گروه کربوکسیل)
- –H: یک اتم هیدروژن است
- –R: یک زنجیره جانبی
–R نماد زنجیره جانبی است. این زنجیره، تنها گروه شیمیایی است که در بین بیست اسید آمینه متفاوت است. اساساً زنجیره جانبی، اسید آمینه را منحصر به فرد میکند و میتوان آن را به عنوان اثر انگشت آن تصور کرد.

مهمترین ویژگی اسیدهای آمینه که بر روی الگوهای تاخوردگی و در پی آن، بر عملکرد کل مولکول پروتئین تأثیر میگذارد، میانکنش شناخته شده و قابل پیش بینی آنها با آب است. بر این اساس، اسیدهای آمینه را میتوان به دو گروه بزرگ تقسیم کرد:
- اسید آمینههای آبگریز
- اسید آمینههای آبدوست
اسید آمینه های آبگریز
«اسید آمینههای آبگریز» (Hydrophobic)، غیر قطبی هستند و هیدروکربنهای اشباع شدهای را به عنوان زنجیره جانبی خود حمل میکنند. اسیدهای آمینه آلانین، والین، متیونین، لوسین و ایزولوسین و دو اسید آمینه با حلقههای آروماتیک، به نامهای تریپتوفان و فنیل آلانین در این گروه، جای میگیرند.
اسید آمینههای هیدروفوبیک، نقش اساسی در تاخوردگی پروتئین، بر عهده دارند. چراکه این ریشهها به دلیل غیرقطبی بودن، تمایل دارند در بخشهای داخلی پروتئين، مجتمع شوند و دور از آب قرار بگیرند. این اسیدهای آمینه، معمولاً به صورت مارپیچهای بلند در «دمینهای ترا غشایی» (Transmembrane Domains) پروتئین، حضور دارند یا در اعماق داخلی فضای آبگریز پروتئینهای کروی دیده میشوند.
اسید آمینه های آب دوست
اسیدهای آمینه آب دوست، به راحتی با آب ارتباط برقرار میکنند. این گروه، شامل دو زیرمجموعه است:
- آمینو اسیدهایی که یونیزه و دارای بار الکتریکی مثبت یا منفی میشوند.
- آمینو اسیدهایی که قطبی اما بدون بار هستند.
تعدادی از اسیدهای آمینه، علاوه بر گروه کربوکسیل متصل به کربن آلفا، که در تشکیل پیوند پپتیدی دخالت دارد، دارای زنجیرههای جانبی با یک گروه کربوکسیل هستند. این گروه، بار الکتریکی منفی دارند و شامل اسید گلوتامیک و اسید آسپارتیک هستند - توجه داشته باشید که نام آنها به دلیل وجود دو گروه کربوکسیل، حاوی اصطلاح «اسید» است.
زنجیرههای جانبی لیزین، آرژنین و هیستیدین، دارای گروههای بازی قوی و در نتیجه، بار مثبت هستند. اسیدهای آمینه آبدوستی که قطبی اما بدون بار هستند، عبارتند از آسپاراژین، گلوتامین، سرین، ترئونین و تیروزین. زنجیرههای جانبی آبدوست و باردار اسیدهای آمینه، در سطح پروتئین قرار میگیرند و به ویژه در جایگاههای فعال آنزیم یا مولکولهای انتقالی، به طور گستردهای دیده میشوند. قرارگیری بارهای الکتریکی، در معرض محیط، موجب میشود تا پروتئین، مانند یک آهنربا عمل کند و مولکولهای متناسب را به سوی خود، بکشاند.
چندین آمینو اسید، به دلیل ویژگیهای منحصر به فرد موجود در زنجیرههای جانبیشان، به شکلگیری ساختار پروتئین کمک میکنند. یکی از این اسیدهای آمینه، پرولین است که ساختار آن با دیگر اسیدهای آمینه یک تفاوت اساسی دارد. چرا که زنجیره جانبی پرولین، به طور همزمان، به نیتروژن و کربن مرکزی، متصل شده است.
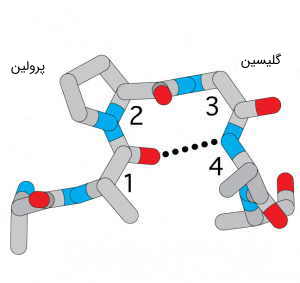
این اسید آمینه، از نظر شیمیایی غیر واکنشی (آبگریز) است، اما به دلیل داشتن یک حلقه پنج عضوی، شکل فضایی پروتئین را تحت تاثیر جدی قرار میدهد. این اسید آمینه، باعث ایجاد تغییرات ناگهانی در وضعیت سهبعدی ساختار پروتئين میشود و با ایجاد انواع شکستها و خمشدگیها، زنجیره پلی پپتیدی را از حالت صاف و یکدست، به ساختار نامنظم سهبعدی، تبدیل میکند.
اسید آمینه متمایز دیگر، گلیسین است که اصلاً یک زنجیره جانبی ندارد. بلکه به جای گروه R، فقط یک اتم هیدروژن دیگر، به کربن آلفا متصل است. گلیسین، ویژگیهای قطبی یا اکترونگاتیوی قابل توجهی ندارد و بنابراین، به طور معمول در جایگاههایی دیده میشود که میبایست، قسمتهایی از زنجیره پلی پپتیدی خم و به یکدیگر نزدیک شوند.
سیستئین، اسید آمینهای است که به دلیل تأثیر زیاد بر ساختار پروتئین ، بسیار شناخته شده است. گروه سولفیدریل موجود در شاخه جانبی این اسید آمینه، مسئول ایجاد پیوندهای دی سولفیدی است که ساختار سوم پروتئینها را تثبیت و به عملکردهای مولکولی آنها، کمک زیادی میکند. در ادامه این متن، به طور مفصل به این موارد میپردازیم.
ساختار دوم و همه حلقهها
از کجا بفهمیم پروتئینها، پس از تاخوردگی، واقعاً به چه شکلی درمیآیند؟ دو روش وجود دارد که به ما اجازه میدهد تا به ساختار پروتئین نگاه کنیم.
- پراش اشعه X
- طیفسنجی رزونانس مغناطیسی هستهای (NMR)
روش پراش اشعه X، یک نقشه خطی سهبعدی از الکترونها را در یک کریستال پروتئین تولید میکند. این نقشه بر اساس نحوه تغییر مسیر اشعه ایکس، هنگام عبور از داخل نمونه است.
NMR فاصله بین پروتئینها را در یک محلول اشباع، اندازه گیری و از اطلاعات مربوط به محدودیتهای فضایی برای تعیین ساختار پروتئین استفاده میکند. این دو آزمایش، در کنار هم، به پژوهشگران کمک میکنند تا شکل تاخورده پروتئین را درک کنند.
ساختار پروتئین ، تنها توسط توالی اسیدهای آمینه در زنجیره پلی پپتیدی تعیین میشود و هیچ فاکتور دیگری در آن دخالت ندارد. این توالی، دقیقاً از الگوی DNA پیروی میکند. به این ترتیب، یک کد منحصر به فرد، طراحی منحصر به فردی را ایجاد میکند.
تاخوردگی پروتئین، نتیجه خواص فیزیکی زنجیرههای جانبی آمینو اسیدها و برهمکنشهای آنها با ریشههای اطراف است. پروتئینها در چندین مرحله یا سطح از ساختار پروتئین ، سرانجام به شکلی با کمترین سطح انرژی، درمیآیند. این وضعیت، «حالت طبیعی» (Native State) نامیده میشود.
تاخوردگیها و معماری پروتئین
زنجیرههای پلی پپتیدی، با ورود به سیتوزول یا لومن شبکه اندوپلاسمی، حالتگیریهای موضعی به نام ساختارهای ثانویه را ایجاد میکنند که میانکنش بین زنجیرههای جانبی اسیدهای آمینه با یکدیگر و آب را بهینه میکند. اسکلت پلی پپتیدی، به ساختارهای فنری و روبانهایی تا میشود که به ترتیب، «مارپیچ آلفا» (α- helix) و «صفحههای بتا» (β-sheet) نام دارند.
مارپیچهای آلفا و صفحههای بتا، ساختار پروتئین را به بخشهایی تقسیم میکنند که دارای یک شکل هندسی منظم هستند. این بخشها با پیچهای نسبتا ملایمی به هم متصل میشوند و توسط حلقههایی با سازمانیافتگی کمتر، از یکدیگر جدا میشوند.
مارپیچ آلفا، کربنهای آلفا را طوری بستهبندی میکند که با چرخش آن، زاویههای مطلوبی برای تشکیل پیوند هیدروژن قدرتمند و بستهبندی محکم زنجیرهای جانبی، فراهم شود. ورقههای بتا ساختارهای مسطحی هستند که از چندین رشته بتا تشکیل شدهاند. این رشتهها (یا روبانها) از طریق پیوندهای هیدروژنی، به رشتههای بتای همسایه متصل میشوند.
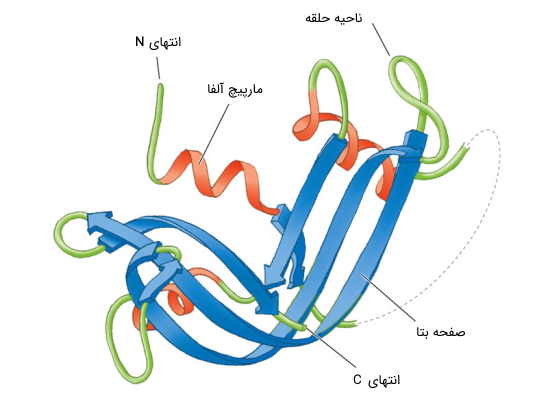
در مورد ورقهای β، زنجیرههای پلی پپتیدی ممکن است به صورت همجهت یا در خلاف جهت یکدیگر قرار بگیرند. در حالت اول، به آنها «موازی» (Parallel) و در حالت دوم، «ضد موازی» (Anti-parallel) گفته میشود. در ساختارهای ضد موازی، پیوندهای هیدروژنی پایدارتری شکل می گیرند.
صفحههای متشکل از نوارهای موازی، تمایل دارند در داخل ساختار پروتئین ، مجتمع شوند. همانطور که گفتیم، ساختارهای ثانویه، توسط بخشهایی از پروتئین، که هیچ شکل نظاممندی ندارند و همچنین، انواع ساختارهای حلقهای شکل، به یکدیگر متصل میشوند.
ساختار سوم پروتئین
روشهای زیادی وجود دارد که طی آنها، ساختارهای ثانویه میتوانند به صورت یک شبکه سهبعدی بزرگ، بهم پیوند بخورند. ساختار سوم پروتئین، ترکیبی سهبعدی از مارپیچهای آلفا و صفحههای بتا است که در نتیجه پیوندهای غیرکووالانسی بین گروههای جانبی اسیدهای آمینه و ریشههای دیگر پلی پپتید، در کنار یکدیگر جمع میشوند. در این مرحله، علاوه بر پیوندهای هیدروژنی، پیوندهای دیگری نیز در تشکیل این ساختار پروتئین نقش دارند. مهمترین آنها پیوند دی سولفیدی است که بین دو ریشه سیستئین ایجاد میشود.
مهمترین ویژگی ساختارهای سوم، وجود مناطق محافظت شده با عملکردهای مشابه است که به عنوان «حوزههای عملکردی» (Functional Domains) شناخته میشوند. ساختارهای سوم، از ثبات کمتری برخوردار هستند و در واقع، بیشتر آنها، چندین بار در طول عمر پروتئین، تغییر شکل میدهند. تغییرات ساختاری در این حوزههای عملکردی، اساس کار پروتئین است.
این تغییرات، ممکن است یک مرحله از روند تاخوردگی و بلوغ پروتئین باشند، که در این حالت، به صورت دائمی و برگشت ناپذیر، رخ خواهند داد. یا مکن است به عنوان روشی برای تنظیم فعالیت پروتئین، در هر واکنش، عمل کنند، که در این صورت، برگشتپذیر هستند و با پایان یافتن واکنش، دوباره به حالت اولیه خود، برمیگردند.
دامنههای عملکردی یکسان، در پروتئینهای مختلف، فعالیتهای مشابهی را انجام میدهند. هرچند، لزوماً توالی محافظت شدهای ندارند. به عنوان مثال، همه دامنههای «کیناز» (Kinase)، مسئول متصل کردن گروه فسفات به سوبسترا هستند. اما این دامنهها بر اساس سوبسترا و مولکول تامینکننده گروه فسفات، شکلهای متفاوتی دارند که به نوبه خود، متاثر از توالی اسیدآمینهای آنهاست.
همانطور که گفتیم، ساختارهای ثانویهای که حوزههای عملکردی را تشکیل میدهند، لزوما، به طور متوالی در یک زنجیره پلی پپتیدی قرار نگرفتهاند. در واقع، در بسیاری از موراد، این ساختارها به طور قابل توجهی از هم دور هستند و حتی ممکن است در پروتئینهای چند زیرواحدی، بخشهایی از چندین پلی پپتید مختلف باشند.
«موتیفها» (Motifs) زیر گروهی از حوزههای عملکردی هستند که توالی آنها، در طی تکامل، حفظ شده است. روشن است که این توالی حفاظت شده، یک ساختار سهبعدی حفاظت شده را در پی دارد.
به عنوان مثال، موتیفهای «ابرمارپیچ» (Coiled-coil) ساختارهای بسیار منظمی از دو مارپیچ آلفا هستند که با هم ترکیب شده و یک ساختار رشتهای را تشکیل میدهند که اساس دیمرهای پایدار است. این ساختار، معمولاً از دو مارپیچ آلفا تشکیل شده است که در یک کونفورماسیون چپ گرد، به دور یکدیگر پیچیده شده و با واکنشهای آبگریز، تثبیت میشوند.
ساختار چهارم
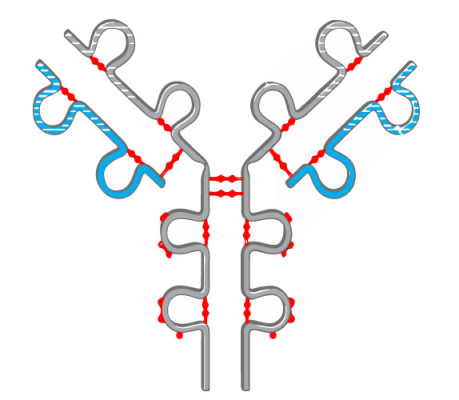
ساختار چهارم، در نتیجه سرهمبندی دو یا چند پلی پپتید و تشکیل یک پروتئین عملکردی چند زیر واحدی، ایجاد میشود. عمده پیوندهای دخیل در ایجاد این ساختار پروتئین عبارتند از:
- پیوندهای آبگریز
- پیوندهای دیسولفیدی
به واسطه این دو نوع پیوند، بخشهای گوناگونی از پلیپپتیدهای مختلف، به یکدیگر متصل میشوند و یک ساختار بزرگ و پیچیده را پدید میآورند که شامل انواع جایگاههای اتصال برای سوبسترا و عوامل تنظیمی است.
اگر زیر واحدها یکسان باشند، پروتئین با پیشوند «هومو» (Homo) و اگر متفاوت باشند با پیشوند «هترو» (Hetero) توصیف میشود. به عنوان مثال، آنزیم فسفریلاز گلیکوژن در ماهیچهها، یک هومودیمر است و پروتئینهای G هتروتریمری هستند.
فرایندهای درون سلولی، مانند سیگنالینگ (انتقال پیام) به تعامل بین مولکولها بستگی دارد. هر چه تناسب ساختاری بین دو مولکول بهتر باشد، پیوندهای بیشتری ایجاد میشود یا تأثیر متقابل (میل بین آنها) بیشتر است. توالی اسیدهای آمینه رمز شده توسط یک ژن و خواص زنجیرههای جانبی اسیدهای آمینه، وضعیت نهایی ساختار پروتئين و میانکنشهای آن را تعیین میکنند.











سلام یه سوال داشتم.آنزیم ها رو کدوم ساختمان پروتییین اثر میگذارند و چرا؟
با سلام
یه سوال دارم که خیلی وقته ذهنم رو درگیر کرده کریستال های آلفا و بتا و گاما چه نوع کریستال هایی هستن و چگونه روی صفحه قرار میگیرن ؟؟
سلام. یه سوال واسم پیش اومده. دلیل دسته بندی ساختارهای پروتئین به اول تا چهارم صرفا به خاطر معرفی جزئیات بوده یا میخواستن نشون بدن که ساختارهای اول تا چهارم متفاوت نشان دهنده نقش متفاوت هر پروتئین هست؟
مسلما نقش متفاوت اونها