پیوند واندروالسی چیست؟ – توضیح به زبان ساده
«پیوند واندروالسی» (Van Der Waals Force) که عبارت صحیح آن «نیروی واندروالسی» است، شامل دو نوع «نیروی پراکندگی لاندن» (London Dispersion Force) و «نیروی دوقطبی-دوقطبی» (Dipole-Dipole Force) است. این نیرو ضعیفترین نیروی است که در ساختار اتمها و مولکولها بهصورت بینمولکولی حضور دارد. در این مطلب میخواهیم ابتدا ماهیت پیوند واندروالسی را مطالعه کنیم و سپس در مورد انواع آن صحبت خواهیم کرد.
- یاد میگیرید که ساختار و علت شکلگیری نیروی واندروالسی را توضیح دهید.
- میآموزید که انواع نیروهای واندروالسی و تفاوت آنها را تشخیص دهید.
- نقش نیروی واندروالسی را در ویژگیهای مواد و کاربردهای عملی بررسی میکنید.
- یاد خواهید گرفت چگونه تأثیر عوامل فیزیکی و شیمیایی بر قدرت این نیرو را تحلیل کنید.
- خواهید توانست نمونه مسائل مفهومی و عددی درباره نیروهای بینمولکولی را حل کنید.

پیوند واندروالسی چیست ؟
پیوند واندروالسی عبارتی کلی برای بیان نیروی بینمولکولی است و دو نوع دارد:
- نیروی پراکندگی لاندن: این نیرو ضعیف است.
- نیروی دوقطبی-دوقطبی: این نیرو نسبت به نیروی پراکندگی لاندن قویتر است.
نیروی واندروالسی صحیح است یا پیوند واندروالسی ؟
در این بخش میخواهیم بدانیم که عبارت نیروی واندروالسی صحیح است یا پیوند واندروالسی. بهتر است نگاهی به این واژه در زبان انگلیسی بیاندازیم. معادل این مفهوم را با Van Der Waals Force بیان میکنند که در آن واندروالس به عنوان یک نیرو و نه پیوند بیان شده است. برای کسب اطمینان سراغ تعریف این عبارت میرویم.
واندروالس به نیروی برهمکنش بین مولکولی بین دو ذره اشاره دارد و هیچ پیوندی در برقراری این برهمکنش ایجاد نمیشود بنابراین میتوانیم با اطمینان بگوییم که واندروالس پیوند نیست. در واقع عبارت پیوند واندروالسی غلط مصطلحی است که در زبان فارسی بهکار میرود. در این متن دو عبارت «پیوند واندروالسی» و «نیروی واندروالسی» یک مفهوم را بیان میکنند و هر جا از پیوند واندروالسی استفاده شد، منظور همان نیروی برهمکنش ضعیف بینمولکولی واندروالسی است.
نیروی واندروالسی چگونه به وجود می آید ؟
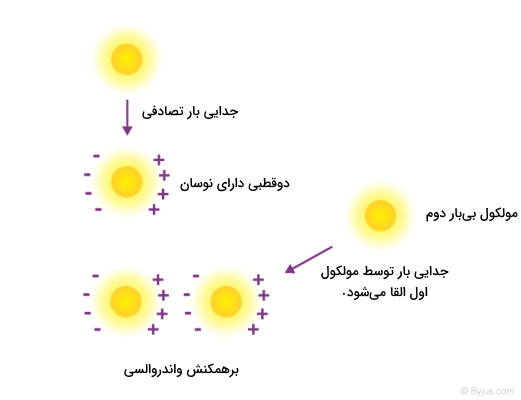
نیروی واندروالسی به هر نیروی گفته میشود که بهدلیل اختلاف در بار الکتریکی دو اتم یا مولکول نزدیک به یکدیگر بهوجود بیاید. در حالت کلی این نیرو در سه حالت ممکن خواهد بود.
- برهمکنش دو دوقطبی دائمی: مولکول هیدروکلریک اسید مثالی از این مورد است.
- برهمکنش دوقطبی دائمی با ذره بیبار: این مورد باعث بهوجود آمدن دوقطبی القایی میشود.
- برهمکنش دوقطبی ذاتی با ذره بیبار: دوقطبی ذاتی باعث دوقطبی شدن ذره بدون بار میشود.
قدرت پیوند واندروالسی
نیروی واندروالسی در بین نیروهای بینمولکولی ضعیف از همه ضعیفتر است و با افزایش فاصله بین دو ذره برهمکنش کننده به سرعت از بین میرود. قدرت این نوع نیرو معمولا در بازه ۰٫۴ کیلوژول بر مول تا ۴ کیلوژول بر مول است. با توجه به فاصله دو ذره درگیر در برهمکنش سه حالت میتواند وجود داشته باشد.
- زمانی که فاصله بین اتمها بیشتر از ۰٫۶ نانومتر باشد، نیروی واندروالسی بسیار ضعیف است و مشاهده نمیشود.
- زمانی که فاصله بین دو اتم درگیر بین ۰٫۴ نانومتر و ۰٫۶ نانومتر باشد، نیروی واندروالسی از نوع جاذبه است.
- زمانی که این فاصله کمتر از ۰٫۴ نانومتر باشد، نیروی واندروالسی از نوع دافعه خواهد بود.
این نیرو عاملی برای کنار هم نگهداشتن اتمها و مولکولها بهصورت مایع و جامد است. در حالت جامد، به دلیل ضعیف بودن این نیرو، نقطه ذوب پایین است. همچنین این جامدات از جامدهای یونی نرمتر هستند.
انواع پیوند واندروالسی
نیروی ضعیف بینمولکولی واندروالسی انواع مختلفی دارد اما میتوان در حالت کلی آن را به دو دسته تقسیم کرد. بقیه انواع این نیرو همه زیرشاخههای این دو هستند. در ادامه به معرفی هر کدام از آنها بهصورت جداگانه و بهتفضیل خواهیم پرداخت.
نیروی پراکندگی لاندن
احتمال حضور الکترون اتم در منطقه مشخص، در ابر الکترونی، و در زمان مشخص را «چگالی بار الکترون» (Electron Charge Density) مینامیم. از آنجا که هیچ راهی برای دانستن موقعیت دقیق الکترون وجود ندارد و از طرفی الکترونها در یک بازه زمانی طولانی سر جای خود ثابت باقی نمیمانند و حرکت میکنند، با تجمع آنها در یک نقطه «گشتاور دوقطبی» (Dipole Moment) ایجاد میشود.
این اتفاق حتی برای مولکولهای غیرقطبی نیز رخ میدهد. آنها به دلیل تجمع الکترون در یک نقطه بهصورت لحظهای قطبی میشوند.
از آنجا که این تجمع باعث قطبی شدن مولکول میشود و غلظت آن را در یک طرف مولکول افزایش میدهد، آن سمت بهصورت جزئی دارای بار منفی میشود. این باعث میشود که طرف دیگر مولکول که عاری از الکترون شده است نیز بهصورت لحظهای و جزئی دارای بار مثبت شود و دوقطبی به وجود بیاورد. به این فرایند که باعث به وجود آمدن دوقطبی در مولکول میشود، پراکندگی لاندن میگوییم.

نیروی پراکندگی لاندن در مولکولهایی که ساختاری فشرده ندارند و بهصورت خطی هستند، قویتر است. دلیل این امر این است که جاذبه بین الکترونها و پروتونهای موجود در هسته اتم کمتر خواهد بود. هرچه جابهجایی و قدرت تحرک الکترونها در مولکولی بیشتر باشد، مولکول پتانسیل بیشتری برای قطبیده شدن دارد.
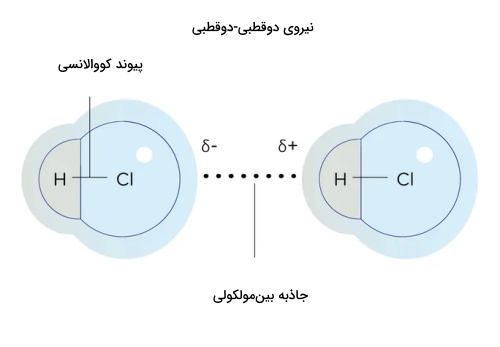
نیروی دوقطبی-دوقطبی
اساس نیروی دوقطبی-دوقطبی مانند نیروی پراکندگی لاندن است با این تفاوت که به جای دوقطبی لحظهای، با دوقطبی دائمی سروکار داریم. در این برهمکنش بین مولکولی، مولکولی قطبی مانند آب با قطب منفی خود سر مولکول قطبی دیگری را از جهت مثبت جذب میکند. به این نیروی جاذبه نیروی دوقطبی-دوقطبی میگوییم.
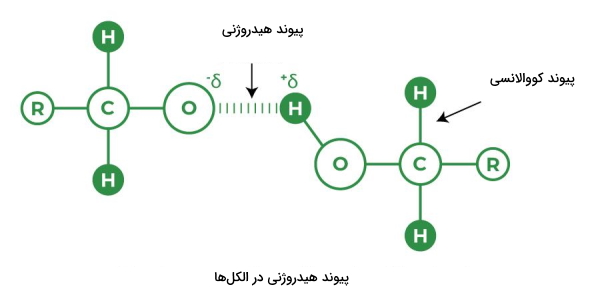
پیوند هیدروژنی
پیوند هیدروژنی نوع خاصی از برهمکنش دوقطبی-دوقطبی القایی بین اتمهای هیدروژن است. با اینحال اگر بخواهیم در مورد قدرت آن صحبت کنیم، پیوند هیدروژنی بسیار قویتر از نیروی دوقطبی-دوقطبی و نیروی پراکندگی لاندن است.
پیوند هیدروژنی زمانی به وجود میآید که اتم هیدروژن با دو اتم بسیار الکترونگاتیو مانند نیتروژن و اکسیژن پیوند کووالانسی تشکیل بدهد. قدرت این پیوند بین ۴ تا ۵۰ کیلوژول بر مول است.
قطبش پذیری
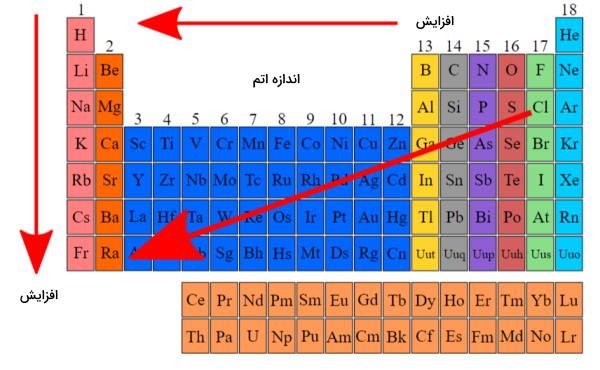
به توانایی مولکول برای قطبی شدن و جابهجایی الکترونهای درون خود «قطبشپذیری» (Polarizability) میگویند. هرچه تعداد الکترونهای یک مولکول بیشتر باشد، توانایی قطبیده شدن آن نیز بیشتر است. در جدول تناوبی عناصر در یک ستون از بالا به پایین قطبشپذیری افزایش مییابد. همچنین در یک دوره با حرکت از سمت چپ به راست نیز شاهد افزایش قطبشپذیری هستیم.
این روند به این دلیل است که با افزایش جرم مولکولی، تعداد الکترونهای موجود در ساختار نیز بیشتر میشود. با داشتن تعداد بیشتری الکترون، آنهایی که در لایه بیرونی قرار دارند کمتر تحت تاثیر نیروی هسته با بار مثبت هستند و میتوانند راحتتر جدا شوند. نیروی هسته با بار مثبت برای الکترونها جاذبه ایجاد میکند و جدایی آنها در این صورت سختتر خواهد بود.
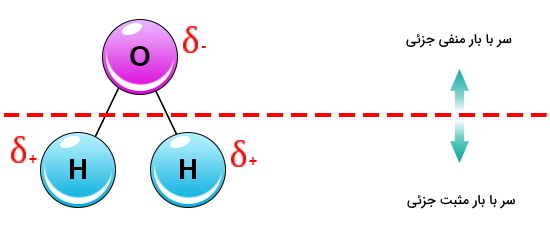
زمانی که مولکول قطبی میشود، نقطه ذوب و نقطه جوش آن افزایش مییابد زیرا برای از بین بردن نیروهای ایجاد شده در آن به گرما و نیروی بیشتری نیاز است. بنابراین هرچه جرم بیشتر باشد و هرچه تعداد الکترون بیشتری حضور داشته باشد، نقطه ذوب و نقطه جوش بالاتر خواهد بود.
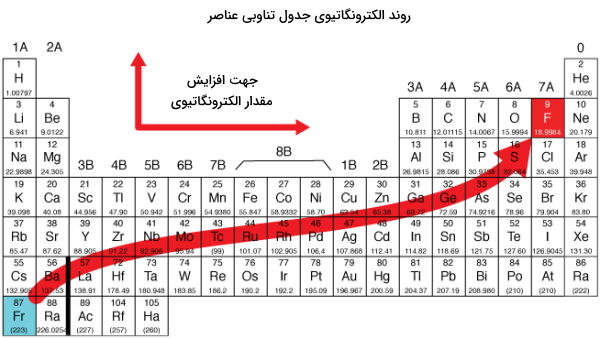
الکترونگاتیوی عکس قطبشپذیری است و بهصورت تمایل اتمها به کشیدن الکترون و بار الکترونی به سمت خود تعریف میشود. الکترونگاتیوی در جدول تناوبی عناصر در بالای سمت راست بیشترین مقدار خود را دارد، یعنی بیشترین الکترونگاتیوی مربوط به عنصر فلوئور و کمترین مربوط به عنصر فرانسیم است. این شاخصه باعث به وجود آمدن قطبیت درون یک مولکول میشود بهصورتی که اگر اختلاف الکترونگاتیوی دو اتم درگیر از ۰٫۵ بیشتر باشد آن مولکول قطبی خواهد بود. با اینحال اگر چنین شرایطی در مولکولی متقارن وجود داشته باشد، ناقطبی خواهد بود. در این مورد مثالی را مورد بررسی قرار میدهیم.
مولکول را در نظر بگیرید. الکترونگاتیوی فلوئور از هیدروژن بیشتر است. (۳٫۹۸ در مقابل ۲٫۲) به همین دلیل اتم فلوئور چگالی بار را به سمت خود میکشد و آن سمت مولکول دارای بار جزئی مثبت میشود. به همین طریق سمت هیدروژنی مولکول به دلیل کمبود الکترون دارای جزئی بار منفی خواهد بود. مولکول به دلیل ماهیت قطبی خود در برهمکنش دوقطبی-دوقطبی شرکت میکند.
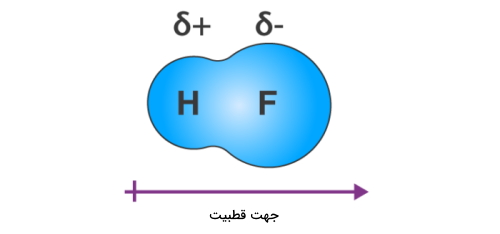
این مولکول وقتی در کنار مولکول دیگری قرار میگیرد سر مثبت آن را به سمت فلوئور جذب میکند. همانطور که میدانیم سرهای همنام یکدیگر را دفع و سرهای ناهمنام یکدیگر را جذب میکنند.
علت وجود پیوند واندروالسی
مکانیک کوانتوم با «معادله شرودینگر» (Schrodinger Equation) و «اصل عدم قطعیت هایزنبرگ» (Heisenberg's Uncertainty Principle) روی حرکت دائمی الکترونها در اتم تاکید میکند. بر طبق اصل عدم قطعیت هایزنبرگ انرژی الکترونها هیچ وقت صفر نمیشود بنابراین بهطور دائمی دور اوربیتال خود میچرخد. همچنین طبق معادله شرودینگر اگر اتم را مانند جعبهای در نظر بگیریم، امکان حضور الکترون در همه جای آن وجود دارد.
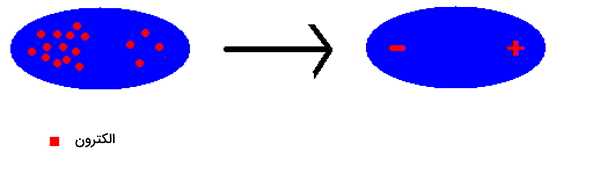
این دو اصل مهم مکانیک کوانتومی جابهجایی دائم الکترونها را در اتم پیشنهاد میدهند بنابراین دوقطبی شدن آن امری بسیار محتمل است. بنابر تعریف دوقطبی مولکول یا اتمی است گه در دو طرف خود بار الکتریکی برابر و خلاف جهت دارد. بهصورت ساده میتوان یک دو قطبی را مانند تصویر زیر نمایش داد.
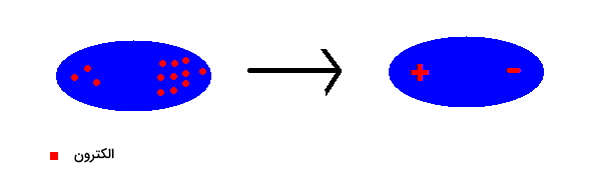
نحوه تشکیل دوقطبی را در تصویر بالا مشاهده میکنید. زمانی که گروهی از الکترونها به یک سمت از مولکول میروند، نتیجه بهوجود آمدن دوقطبی است. باید توجه داشته باشید که این الکترونها بعد از تشکیل دو قطبی در جای خود ثابت باقی نمیمانند و مدام در دو طرف مولکول جابهجا میشوند. بنابراین دوقطبی دیگری با تعویض سر مثبت و منفی بهوجود میآید. این دوقطبی را میتوان بهصورت زیر نشان داد.
انواع برهمکنش دوقطبی دوقطبی
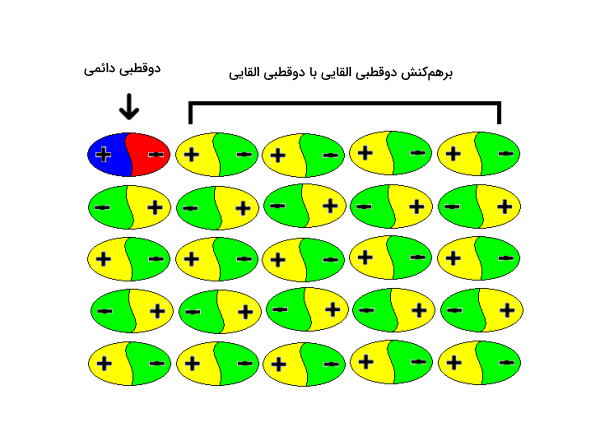
این برهمکنش بین مولکولهایی که دارای دوقطبی دائمی هستند، اتفاق میافتد. به این مولکولها بهاصطلاح مولکول «قطبی» (Polar) نیز میگویند. برهمکنش بین دو مولکول قطبی را میتوان بهصورت تصویرهای زیر نمایش داد.
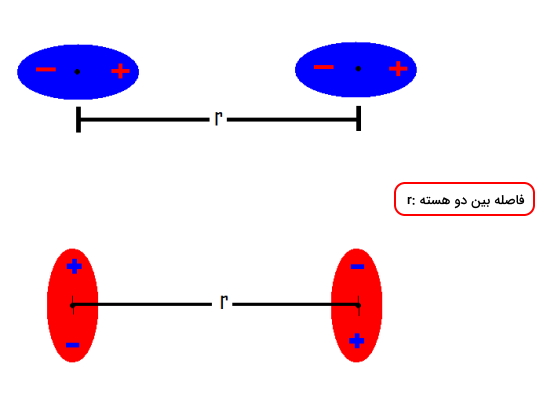
برای محاسبه انرژی این دو برهمکنش میتوان از دو معادله زیر استفاده کرد. برای درک ابتدا بهتر هر کدام از پارامترهای معادله را معرفی میکنیم.
- : انرژی پتانسیلی
- : ممان دوقطبی
- : گذردهی خلاء
- : عدد پی
- : فاصله بین دو هسته
معادله محاسبه انرژی پتانسیلی برای تصویر اول:
معادله محاسبه انرژی پتانسلی برای تصویر دوم:
علامت منفی معادلات نشاندهنده این است که سیستم انرژی آزاد میکند اما این انرژی با تشکیل پیوند است که آزاد میشود. همچنین علامت منفی یعنی که برهمکنش به کمک نیروی جاذبه پیش میرود. (علامت مثبت نشاندهنده وجود نیروی دافعه است.) اگر تمامی شرایط برای دو تصویر بالا یکسان باشد، دومی انرژی پتانسیلی بیشتری خواهد داشت زیرا در آن هر دو سر مثبت و منفی درگیر هستند.
دو قطبی القایی
دوقطبی القایی وضعیتی موقت است که طی آن یک اتم غیرقطبی خنثی مثلا هلیوم، به دلیل حضور در محیطی خاص دستخوش جدایی بار میشود. زمانی که یک اتم دو قطبی ذاتی به اتمی دیگر برخورد میکند باعث قطبیده شده آن میشود. در این حالت میگوییم گه اتم دوم دوقطبی القایی است. تصویر زیر انجام این فرایند را بهخوبی نشان میدهد. اتم دوم دارای دوقطبی القایی در آن با مشخص شده است.
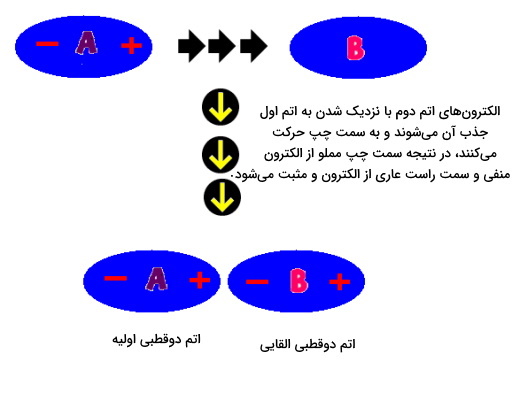
با وجود اینکه این دو اتم با یکدیگر برهمکنش دارند اما دوقطبی بودنشان ثابت نیست. همانطور که پیشتر گفتیم الکترونها در حرکت هستند و این امکان تغییر دو سر مثبت و منفی را بهوجود میآورد. حرکت الکترونها در این وضعیت به گونهای خواهد بود که هر دو اتم دوقطبی بودن خود را حفظ کنند. در تصویر زیر این تغییر را مشاهده میکنید. سر مثبت و منفی هر اتم با یکدیگر جابهجا شده است.
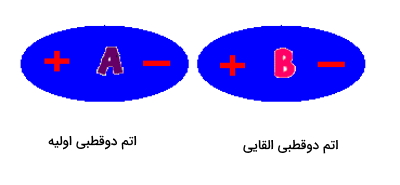
انرژی برهمکنش دوقطبی القایی با دو قطبی ذاتی را میتوان با معادله زیر به دست آورد. تمام پارامترهای این معادله مانند معادلههای قبلی است. تنها یک پارامتر جدید آورده شده است که در پایین مفهوم آن را روشن میکنیم.
- : قطبشپذیری مولکول غیرقطبی
آلفا نشاندهنده این است میزان سختی تغییر چگالی الکترونی یک اتم توسط میدان الکتریکی خارجی است.
برهمکنش دوقطبی القایی با دوقطبی ذاتی
به برهمکنش دوقطبی القایی با دوقطبی ذاتی نیز پراکندگی میگویند. شبکه بزرگی از نیروهای بینمولکولی بین مولکولها و اتمهای غیرقطبی و قطبی وجود دارد. خود اتمهایی که به روش القایی دوقطبی شدهاند، یعنی دوقطبی القایی هستند میتوانند باعث دوقطبی شدن اتمهای دیگری شوند. به این صورت شبکه بزرگی از اتمهای دوقطبی نزدیک به هم خواهیم داشت. در تصویر زیر میتوانید این گفته را مشاهده کنید. یک اتم دوقطبی ذاتی در ابتدای شبکه باعث ایجاد دوقطبی القایی در تمام اتمهای بعدی شده است. در واقع هر اتم ابتدا خود دوقطبی میشود و سپس اتم غیرقطبی کناری خود را قطبی میکند.
انرژی برهمکنش دوقطبی القایی با دوقطبی القایی را میتوان بهصورت زیر نشان داد. توجه داشته باشید که پارامترهایی که مشخص نشدهاند در معادلات قبلی حضور داشتند و در این معادله نیز به همان مفاهیم بهکار گرفته شدهاند.
از آنجا که شعاع در این معادله به توان ۶ میآید و در مخرج معادله قرار دارد، با کوچکترین افزایش در آن، انرژی پتانسیلی کاهش چشمگیری خواهد داشت.
معادله واندروالس
معادله واندروالس برای مطالعه روی انحراف گازها از رفتار گازهای ایدهال استفاده میشود. توجه داشته باشید که ارتباطی بین معادله واندروالس و نیروی واندروالسی وجود ندارد. از این معادله برای شرایط خاص، مثلا برای گازهای غیرایدهآل، استفاده میشود زیرا میتواند مقداری واقعی به دست دهد. این معادله بهصورت زیر نوشته میشود. ابتدا معنای هر کدام از پارامترها را مشخص میکنیم.
- : حجم گاز مورد نظر
- : بزرگی جاذبه بین مولکولها و اتمها
- : فشار اعمال شده
- : ثابت گازها که برابر با ۰٫۰۸۲۰۶ لیتر بر مول بر کلوین است.
- : تعداد مولهای گاز
- : دما
- : حجم حذف شده توسط یک مول از ذرات
برخلاف بسیاری از معادلاتی که برای اندازهگیری گازهای واقعی و ایدهآل به کار میروند، معادله واندروالسی حجم دخیل گاز را مورد محاسبه قرار میدهد.
این معادله را میتوان بهصورت زیر نیز نمایش داد.
این معادله را میتوان به کمک بسط دوجملهای نیوتون نوشت.
معادله واندروالسی بهصورت زیر درمیآید.
$$\begin{split}P&\;=\frac{RT}{\bar{V}}\left[1+frac{b}{\bar{V}}+frac{b^2}{\bar{V}^2}+cdotsright]-frac{a}{\bar{V}^2}&\;= \frac{RT}{\bar{V}}+(RTb-a)\frac{1}{\bar{V}^2}+frac{RTb^2}{\bar{V}^3}+cdotend{split} \nonumber$$
عوامل موثر بر پیوند واندروالسی
دو عامل بسیار مهم هستند که روی شدت و نوع نیروی واندرولسی ایجاد شده بین ذرهها تاثیر میگذارند. در این بخش میخواهیم بهتفضیل در مورد این دو عامل صحبت کنیم.
تعداد الکترونهای اتم یا مولکول
با حرکت در جدول تناوبی عناصر در یک گروه از بالا به پایین شعاع اتمی عنصرها افزایش پیدا میکند. همچنین با بالا رفتن عدد جرمی تعداد الکترونهای جذب شده به هسته نیز بیشتر میشود. با بالا رفتن تعداد الکترون و شعاع اتمی، این الکترونها فضای بیشتری برای حرکت آزادانه در اختیار دارند و این باعث میشود که بهوجود آمدن دوقطبی بسیار آسانتر باشد و هرچه تعداد دوقطبیهای لحظهای بیشتر باشد، نیروی واندروالسی با شدت بیشتری حضور خواهد داشت.
شکل مولکول
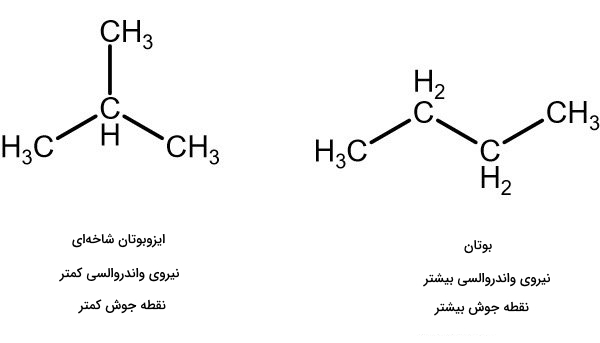
مولکولهای طویل و خطی نسبت به مولکولهای شاخهای و کوتاه نیروی پراکندگی بیشتری دارند. برای درک بهتر، این مورد را با مثالی مورد بررسی قرار میدهیم.
ایزومرهای ساختاری بوتان و ایزوبوتان (۲-متیل پروپان) با وجود داشتن فرمول شیمیایی یکسان، نقطه جوش متفاوتی دارند. به جدول زیر توجه کنید.
| نام مولکول | فرمول شیمیایی | نقطه جوش (سانتیگراد) |
| بوتان | ۰٫۵- | |
| ایزوبوتان | ۱۱٫۷- |
این اختلاف در نقطه جوش را میتوان به حساب متفاوت بودن نیروی واندروالسی در این دو ایزومر گذاشت. نیروی واندروالسی در مولکول بوتان خطی قویتر از نیروی واندروالسی در مولکول شاخهای ایزوبوتان است.
عواملی دیگری نیز بر نیروی واندروالسی موثر هستند که در زیر آنها را مرور خواهیم کرد.
- فاصله: هرچه فاصله بین اتمها یا مولکولها بیشتر باشد، نیروی واندروالسی حاصل از برهمکنش آنها ضعیفتر خواهد بود.
- ماهیت عنصر: ماهیت عنصرها بر قدرت نیروی واندروالسی تاثیر میگذارد. بیشتر نافلزها چه در حالت مایع چه گاز، این نیرو را دارند.
- دما: این مولفه تنها روی برهمکنش دوقطبی-دوقطبی تاثیر خواهد گذاشت.
ویژگی های پیوند واندروالس
در این بخش میخواهیم بهصورت خلاصه به برخی از مهمترین ویژگیهای این نیروی شعیف بینمولکولی بپردازیم.
- پیوند کووالانسی و پیوند یونی بهمراتب نیروی بیشتری نسبت به نیروی واندروالسی دارند.
- نیروی واندروالسی نیرویی بهذات فزاینده است یعنی برهمکنشهای متعددی آن را تولید کند.
- نیروی واندروالسی اشباع نمیشود.
- نیروی واندروالسی به دما بستگی ندارد. (به جزء برهمکنش دوقطبی-دوقطبی)
- این نیروها کوتاهبرد هستند. با نزدیک شدن مولکولها و اتمهای درگیر مقدار آن افزایش پیدا میکند.
- نیروی واندروالسی در بسیاری از ترکیبها وجود دارد اما به دلیل حضور پیوندهایی با نیروهای بیشتر به آن پرداخته نمیشود.
کاربرد پیوند واندروالس
- بسیاری بر این باورند که توانایی ایستادن مارمولکها روی سطوح تنها با استفاده از انگشت پا وجود نیروی واندروالسی است.
- این نیرو به مارمولکها کمک میکند تا بتوانند روی سطوح عمودی راه بروند. برخی جانوران دیگر مانند عنکبوت نیز از همین روش بهره میبرند.
- جذب سطحی مولکولهای گازی روی سطح جاذب به دلیل ایجاد نیروی واندروالسی است.
- نیروی واندروالسی باعث چسبندگی فازهای متراکم میشود.
- این نیرو عامل پایداری ساختار پروتئینها است.
- نیروی واندروالس دلیل مایع و جامد بودن مولکولها و اتمهای غیرقطبی است.
- از این نیرو در علم پلیمر و زیستشناسی استفاده میشود.
- نیروی واندروالسی روی ویژگیهای جامدات مولکولی و ترکیبهای آلی تاثیر میگذارد.

مقایسه نیروی واندروالس با نیروی های بین مولکولی دیگر
نیروی واندروالس از تمامی نیروهای بین مولکولی دیگر قدرت کمتری دارد اما اگر بین دو مولکول تعداد زیادی از این نیرو برقرار باشد میتواند قدرت بیشتری داشته باشد. در جدول زیر این نیرو را با دیگر نیروهای بین مولکولی مورد مقایسه قرار میدهیم.
| نام نیرو | قدرت (کیلو ژول بر مول) | فاصله (نانومتر) |
| واندروالس | ۴٫۰ تا ۰٫۴ | ۰٫۶ تا ۰٫۳ |
| پیوند هیدروژنی | ۳۰ تا ۱۲ | ۰٫۳ |
| برهمکنش یونی | ۲۰ | ۰٫۲۵ |
| برهمکنش آبگریز | کمتر از ۴۰ | متفاوت است. |
کاشف پیوند واندروالسی
«یوهان دیدریک وان در والس» (Johannes Diderik van der Waals) در سال ۱۸۷۳ در هلند به دنیا آمد. او استاد دانشگاه آمستردام بود و برای مطالعه روی معادله حالت گازها و مایعات برنده جایزه نوبل فیزیک سال ۱۹۱۰ میلادی شد. او همچنین مطالعات بسیاری در مورد نیروی بین مولکولها به انجام رسانده است که به افتخارش به نام نیروی واندروالسی شناخته میشوند.

مثال و حل تمرین
تا اینجا دانستیم که نیروی واندروالسی چیست و در مورد انواع آن صحبت کردیم. در این بخش تصمیم داریم با مثالهای بیشتری عمق درک مطلب را بالا ببریم.
مثال اول
چرا سطح تماس مولکولها و اتمها روی نیروی واندروالسی تاثیر میگذارد؟
پاسخ: هرچه سطح تماس بینمولکولی بیشتر باشد، دوقطبیهای القایی بیشتری میتواند بهوجود بیاید و در نتیجه روی مقدار و شدت نیروی واندروالسی موثر است.
مثال دوم
چرا در دمای اتاق مایع اما گاز است؟
پاسخ: شعاع اتم برم از کلر بیشتر است بنابراین نیروی پراکندگی بیشتری نیز دارد. این نیروی پراکندگی بیشتر میتواند اتمهای آن را محکمتر کنار هم نگه دارد بنابراین برم به فرم مایع وجود دارد.
مثال سوم
چرا فاصله در نیروی پراکندگی عامل مهمی بهشمار میآید؟
پاسخ: از آنجا که این نیرو به ایجاد دوقطبی القایی بستگی دارد، نیاز است که مولکول بهحدی به یکدیگر نزدیک باشند که توانایی ایجاد دوقطبی القایی وجود داشته باشد. اگر این فاصله زیاد باشد حتی با وجود ایجاد دوقطبی لحظهای نیروی پراکندگی مشاهده نمیشود.
مثال چهارم
قطبشپذیری چیست؟
پاسخ: قطبشپذیری معیاری است برای سختی یا آسانی پراکنده شدن الکترونهای یک اتم.
مثال پنجم
چرا گازهای نجیب و مولکولهای غیرقطبی میتوانند در حالت مایع حضور داشته باشند؟
پاسخ: نیروی پراکندگی باعث میشود اتمها کنار یکدیگر قرار بگیرند و بهحالت مایع در بیایند. گازهای نجیب نیز به دلیل داشتن نیروی پراکندگی میتوانند بهحالت مایع وجود داشته باشند.
مثال ششم
چرا نقطه جوش مقیاس خوبی برای سنجش نیروی پراکندگی است؟
پاسخ: مولکولهایی که نیروی قویتر دارند، اتمهای خود را با شدت بیشتری نگه میدارند یعنی تمایل بیشتری برای حضور در حالت فیزیکی مایع یا جامد دارند. در فاز گازی اتمها به سستی کنار یکدیگر قرار گرفتهاند بنابراین نیروی بین آنها ضعیف است. هرچه نقطه جوش بالاتر باشد نیروی بینمولکولی نیز بیشتر است زیرا برای جداکردن اتمها به انرژی بیشتری نیاز خواهد بود.
مثال هفتم
تفاوت دوقطبی القایی و دوقطبی لحظهای چیست؟
پاسخ: دوقطبی لحظهای بهدلیل حرکات نامتوازن الکترون به وجود میآید. دوقطبی القایی در اثر نزدیکی یک مولکول خنثی به مولکولی دوقطبی ایجاد میشود.
مثال هشتم
جای خالی را با عبارت مناسب پر کنید.
دوقطبی لحظه ای بر اثر ... به وجود میآید.
پاسخ: دوقطبی لحظهای بهدلیل انتقال ناگهانی الکترون که منجر به عدم تقارن بار میشود به وجود میآید.
مثال نهم
برهمکنش دوقطبی-دوقطبی چیست؟
پاسخ: این نیرو بین دو مولکول قطبی (دوقطبی دائمی) به دو صورت دافعه و جاذبه حضور دارد.
مثال دهم
برهمکنش دوقطبی-دوقطبی القایی چیست؟
پاسخ: به نیروی جاذبه و دافعه بین یک مولکول قطبی و مولکولی که به روش القایی دوقطبی شده است، برهمگنش دوقطبی-دوقطبی القایی میگویند.
مثال یازدهم
نیروی پراکندگی لاندن بین چه نوع اتمها و مولکولهایی به وجود میآید؟
پاسخ: این نیروی واندروالسی بین دو اتم یا مولکول بیبار یا غیرقطبی مشاهده میشود.
مثال دوازدهم
چرا مارمولک و عنکبوت میتوانند از سطح صاف بالا بروند؟
پاسخ: نیروی واندروالسی بین پاهای این حیوانات با سطوحی که از آن بالا میروند وجود دارد که از نوع جاذبه است و باعث میشود بتوانند از سطوح صاف بالا روند.
مثال سیزدهم
اگر نمونهای تنها حاوی گاز نئون باشد، چه نیروی واندروالسی را در آن مشاهده میکنیم.
پاسخ: در این نمونه شاهد نیروی واندروالسی از نوع نیروی پراکندگی لاندن خواهیم بود.
مثال چهاردهم
پاسخ: اگر نمونهای حاوی گاز نئون و بخار آب باشد چه نیروی واندروالسی در آن مشاهده میشود.
پاسخ: مانند مورد قبلی در این نمونه نیز نیروی واندروالسی از نوع نیروی پراکندگی لاندن خواهد بود.
مثال پانزدهم
تمرین و آزمون
مثال شانزدهم
تمرین و آزمون
مثال هفدهم
تمرین و آزمون
مثال هجدهم
تمرین و آزمون
مثال نوزدهم
تمرین و آزمون
مثال بیستم
تمرین و آزمون
مثال بیست و یکم
تمرین و آزمون
مثال بیست و دوم
تمرین و آزمون
مثال بیست و سوم
تمرین و آزمون
مثال بیست و چهارم
تمرین و آزمون
مثال بیست و پنجم
تمرین و آزمون
مثال بیست و ششم
تمرین و آزمون
مثال بیست و هفتم
تمرین و آزمون
مثال بیست و هشتم
تمرین و آزمون
مثال بیست و نهم
تمرین و آزمون
مثال سیام
تمرین و آزمون
مثال سی و یکم
تمرین و آزمون
مثال سی و دوم
تمرین و آزمون
مثال سی و سوم
تمرین و آزمون
مثال سی و چهارم
تمرین و آزمون
مثال سی و پنجم
تمرین و آزمون
مثال سی و ششم
تمرین و آزمون
مثال سی و هفتم
تمرین و آزمون
مثال سی و هشتم
تمرین و آزمون
مثال سی و نهم
تمرین و آزمون
مثال چهلم
تمرین و آزمون
مثال چهل و یکم
تمرین و آزمون
مثال چهل و دوم
تمرین و آزمون
مثال چهل و سوم
تمرین و آزمون
مثال چهل و چهارم
تمرین و آزمون
مثال چهل و پنجم
تمرین و آزمون
سوالات متداول
حال که دانستیم نیروی واندروالسی چیست و چه انواعی دارد، در این بخش میخواهیم به برخی از مهمترین و پرتکرارترین سوالها در مورد نیروی واندروالسی پاسخ دهیم.
آیا پیوند هیدروژنی نوعی از نیروی واندروالسی است ؟
عبارت نیروی واندروالسی به تمامی برهمکنشهای بین دو اتم یا مولکول دوقطبی اشاره دارد. از آنجا که پیوند هیدروژنی برهمکنش بین دوقطبیهای دائمی است، میتوان آن را نوعی از نیروی واندروالسی در نظر گرفت. با اینحال توجه داشته باشید که پیوند هیدروژنی از باقی برهمکنشهایی زیرمجموعه نیروی واندروالسی، قویتر است.
دوقطبی چیست؟
دوقطبی سیستمی است که دارای دو سر باردار با مقدار برابر و علامت متفاوت در فاصله بسیار کم از یکدیگر است.
دوقطبی لحظه ای و القایی چگونه به وجود می آیند ؟
این دوقطبیها بهدلیل حرکت الکترونها و پراکندگی نامتقارن آنها به وجود میآیند.
نیروی پراکندگی لاندن چیست ؟
نیروی پراکندگی لاندن نیروی بینمولکولی بین دو ذره بدون بار است.
اتم ها در مواجه با جاذبه الکتروستاتیکی چه واکنشی دارند ؟
در این شرایط اتمها تبدیل به دوقطبی لحظهای دارای نوسان میشوند.
تعریف نیروی واندروالسی چیست ؟
نیروی واندروالسی نیرویی بسیار ضعیف و کوتاهبرد است و شدت آن با افزایش فاصله کاهش مییابد.
چه عواملی بر نیروی واندروالس تاثیر می گذارند ؟
سه عامل در شدت نیروی واندروالسی اثرگذار هستند:
- تعداد الکترونهای اتم
- اندازه و شکل اتم
- ماهیت اتم
تفاوت نیروی بین مولکولی و درون مولکولی چیست ؟
نیروی بین مولکولی بین دو مولکول متفاوت وجود دارد، اما نیروی درون مولکولی داخل یک مولکول واحد دیده میشود.
چه چیزی باعث به وجود آمدن نیروی واندروالسی می شود ؟
برهمکنشهایی که از تفاوت بار الکتریکی در دو یا تعداد بیشتری اتم و مولکول نزدیک به هم ناشی بشوند، باعث بهوجود آمدن نیروی واندروالسی خواهند شد.
آیا واندروالس نیرویی قوی است ؟
خیر، نیروی واندروالسی ضعیفترین نیروی بینمولکولی است که میتواند دو اتم یا مولکول را به خود درگیر کند.
جمع بندی
هدف از این مطلب این بود که بدانیم نیروی ضعیف بینمولکولی واندروالسی چیست و چه انواعی دارد. سپس بهطور کامل در مورد دو نوع آن، نیروی پراکندگی لاندن و نیروی دوقطبی-دوقطبی صحبت کردیم و برای درک بهتر مثالهای متعددی از آن را مورد بررسی قرار دادیم.













درود بر شما عالی بود
فقط تست 27 مشکل دارد
با سلام؛
پاسخ سوال بیست و هفت، بازبینی و اصلاح شد.
با تشکر از همراهی شما با مجله فرادرس
بسیار عالی توضیحدادهبودید،متشکرم.