سرعت واکنش — به زبان ساده
سرعت واکنش یا نرخ واکنش به سرعت تبدیل واکنشدهندهها به فرآوردهها میگویند. به طور مثال، فرآیند اکسایشی زنگ آهن در شرایط اتمسفر بسیار آهسته انجام میشود و ممکن است سالها به طول بیانجامد در حالیکه سوختن یک کاغذ در کسری از ثانیه به وقوع میپیوندد. برای بیشتر واکنشها، سرعت واکنش با پیشروی آن کاهش مییابد. سینتیک شیمیایی بخشی از شیمی فیزیک است که به مطالعه سرعت واکنش میپردازد. مفهوم سینتیک شیمیایی در بسیاری از زمینهها همچون مهندسی شیمی، آنزیمشناسی و مهندسی محیط زیست کاربرد دارد.
عوامل موثر بر سرعت واکنش
از جمله عوامل موثر بر سرعت واکنش شیمیایی این موارد هستند: غلظت واکنشدهندهها، دما، حالت فیزیکی واکنشدهندهها، پراکندگی واکنشدهندهها، نوع حلال و همچنین حضور یا عدم حضور یک کاتالیزور.
با وجود اینکه یک معادله شیمیایی موازنه شده روابط کمی میان مقادیر واکنشدهنده و فرآورده را بیان میکند اما هیچ اطلاعاتی در خصوص سرعت وقوع آن بدست نمیدهد. این اطلاعات از طریق مطالعه سینتیک شیمیایی قابل دسترس هستند. با مطالعه سرعت واکنش، شیمیدانها اطلاعات دقیقی در خصوص نحوه کنترل واکنشهای شیمیایی و دستیابی به فرآوردههای مورد نظر بدست میآورند.

غلظت
دو ماده تنها در صورتی با یکدیگر وارد واکنش میشوند که اجزای تشکیل دهنده آنها مانند اتمها، مولکولها و یونها با یکدیگر در تماس باشند. اگر تماسی وجود نداشته باشد، سرعت واکنش صفر خواهد بود. به عکس، هر قدر اجزای واکنشدهندهها در واحد زمان، بیشتر با هم در تماس باشند، احتمال وقوع واکنش نیز بیشتر خواهد بود. در نتیجه به طور معمول، سرعت واکنش با افزایش غلظت واکنشدهندهها افزایش مییابد.
دما
افزایش دمای یک سیستم موجب افزایش انرژی جنبشی اجزای تشکیلدهنده آن خواهد بود. هر اندازه که میانگین انرژی جنبشی افزایش یابد، حرکت ذرات سریعتر و برخورد آنها با یکدیگر در واحد زمان سریعتر خواهد شد که افزایش بیشتر انرژی ذرات را به همراه دارد. افزایش دما و به تبع آن افزایش انرژی، موجب افزایش سرعت واکنش شیمیایی میشود. در نتیجه عملا سرعت واکنش تمامی واکنشها با افزایش دما افزایش پیدا میکند.
به عکس، با کاهش دما، سرعت انجام واکنشها نیز کاهش مییابند. به طور مثال، منجمد کردن مواد غذایی موجب کاهش سرعت رشد باکتریها در غذا میشود. این امر به دلیل کاهش سرعت واکنشهای بیوشیمیایی باکتریها در تولید یکدیگر است.
در سیستمهایی که ممکن است شامل بیش از یک واکنش باشند، واکنشدهندهها تحت شرایط مختلف، فرآوردههای متفاوتی بدست میدهند. به طور مثال، در حضور سولفوریک اسید رقیق و دمای حدودا 100 درجه سانتیگراد، اتانول به دی اتیل اتر تبدیل خواهد شد:
$$\mathrm{2 C H _3 C H_2 O H}\xrightarrow{\mathrm{H _ 2 S O _ 4}}\mathrm{C H _ 3 C H _ 2 O C H _ 2 C H _ 3}+\mathrm{H _ 2 O}$$
با افزایش دما به 180 درجه سانتیگراد، واکنشی کاملا متفاوت خواهیم داشت که موجب تولید اتیلن است:
$$\mathrm{C H _3 C H_2 O H}\xrightarrow{\mathrm{H _2 S O_ 4}}\mathrm{C _ 2 H _ 4}+\mathrm{H _ 2 O} $$
اثرات مساحت و فاز
زمانی که دو واکنشدهنده در یک فاز مایع قرار داشته باشند، اجزای تشکیلدهنده آنها بیشتر از زمانی که جامد باشند با یکدیگر برخورد دارند. این حالت برای زمانی که دو مایع امتزاجناپذیر باشند نیز مانند حالت جامد توصیف میشود. اگر واکنشدهندهها به طور یکنواخت در یک محلول همگن پراکنده شده باشند، همانطور که پیشتر نیز اشاره شد، تعداد برخورد اجزا در واحد زمان، به غلظت و دما وابسته است. اگر محلول ناهمگن باشد، واکنشدهندهها در دو فاز مختلف قرار دارند و برخوردها تنها در لایه مرزی بین دو واکنشدهنده انجام میشوند. در نتیجه این اتفاق، برخوردها نسبت به حالت همگن به شدت کاهش مییابند که کاهش سرعت واکنش را نیز به همراه دارند. بنابراین، سرعت در یک واکنش همگن، به سطح فاز متراکمتر وابسته است.
موتور اتومبیلها از اثر مساحت برای افزایش سرعت واکنش بهره میگیرند. بنزین به داخل سیلندر تزریق و فرآیند احتراق به کمک جرقه شمع انجام میشود. تزریق بنزین به شکل قطرات میکروسکوپی صورت میگیرد زیرا با این کار مساحت سطح قطرات بیشتر خواهد بود و در نتیجه عمل احتراق سریعتر صورت میگیرد.

حلال
طبیعت حلال بر سرعت واکنش اجزای حلشونده موثر است. به طور مثال، محلول سدیم استات با متیل یدید در یک واکنش جانشینی (تبادلی) به متیل استات و سدیم یدید تبدیل میشود:
$$C H _ 3 C O _ 2 N a _ {(soln)} + C H _ 3 I _ {(l)} \rightarrow C H _ 3 C O _ 2 C H _ {3\; (soln)} + N a I _{(soln)}$$
این واکنش در حلال آلی دی متیل فرمآمید (DMF)، ده میلیون بار سریعتر از حلال متانول انجام میشود. با وجود اینکه هر دو حلال آلی با ثابت دیالکتریک تقریبا یکسان هستند، متانول توانایی تشکیل پیوند هیدروژنی را با یونهای استات دارد. این امکان در DMF وجود ندارد. پیوند هیدروژنی، موجب کاهش واکنشپذیری اتمهای اکسیژن در یون استات میشود.
ویسکوزیته حلال نیز در تعیین سرعت واکنش موثر است. در حلالهای ویسکوز، اجزای حلشونده با سرعت کمتری در حلال پراکنده میشوند. در نتیجه این امر، برخورد ذرات در واحد زمان کاهش مییابد. بنابراین سرعت واکنش در بیشتر موارد با افزایش ویسکوزیته حلال، کاهش مییابد.
کاتالیزور
یک کاتالیزور با حضور در یک واکنش شیمیایی موجب افزایش سرعت واکنش میشود اما تغییری در خواص شیمیایی واکنشدهندهها صورت نمیدهد. به طور مثال، تجزیه هیدروژن پراکسید را با کاتالیزورهای متفاوت در نظر بگیرید. به علت اینکه کاتالیزورها بسته به نوع واکنش انتخاب میشوند، نوع محصول را با افزایش سرعت یکی از واکنشهای ممکن از میان واکنشهای موجود تعیین میکنند. به طور مثال واکنش تجزیه هیدروژن پراکسید را در نظر بگیرید. متوجه خواهید شد که نوع کاتالیزور استفاده شده در حجم تولیدی گاز اکسیژن موثر است:
$$2 \mathrm { H } _ { 2 } \mathrm { O } _ { 2 ( \mathrm { aq } ) } \quad \rightarrow \quad \mathrm { O } _ { 2 ( \mathrm { g } ) } + 2 \mathrm { H } _ { 2 } \mathrm { O } _ { ( \mathrm {l } ) }$$
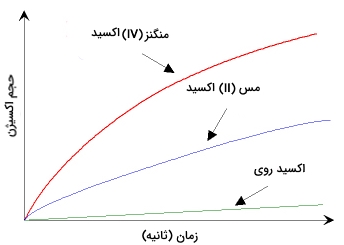
در تولید صنعتی بیشتر مواد شیمیایی از کاتالیزورها استفاده میشود. آمارها حاکی از آن است که در حدود 30 درصد تولید ناخالص ملی در ایالات متحده و دیگر کشورهای صنعتی به طور مستقیم یا غیر مستقیم به استفاده از کاتالیزورها وابسته است.
تعریف سرعت واکنش
سرعت واکنش معیاری برای اندازهگیری تغییر غلظت واکنشدهندهها یا فرآوردهها در واحد زمان است. سرعت یک واکنش را میتوان به صورت تغییر غلظت مشاهده شده تقسیم بر بازه زمانی این تغییر بیان کرد:
بازه زمانی تغییرات/تغییرات غلظت = سرعت واکنش
اگر در یک واکنش داشته باشیم $$A + B \rightarrow C$$، سرعت واکنش میتواند بر اساس تغییرات غلظت اجزا و به صورت زیر تعریف شود:
$$\text{r}=-\dfrac{\Delta [A]}{\Delta t}$$
$$\text{r}=-\dfrac{\Delta [B]}{\Delta t}$$
$$\text{r}=\dfrac{\Delta [C]}{\Delta t}$$
در رابطه بالا، $$Δ[A]$$ تغییرات غلظت $$A$$ در بازه زمانی $$t_1$$ تا $$t_2$$ است.
سرعت لحظهای
سرعت بیشتر واکنشها با مصرف واکنشدهندهها کاهش مییابند. با توجه به این مطلب، رابطه گفته شده در بالا زمانی که بازه زمانی مورد نظر بسیار بزرگ باشد، معنی خود را از دست میدهد. بنابراین، برای واکنشهایی که نمودار آن در زیر آورده شده است، سرعت واقعی به طور مداوم تغییر میکند. این سرعت در زمان صفر، بیشترین مقدار را به خود اختصاص میدهد. سرعت لحظهای یک واکنش به معنای شیب نمودار غلظت زمان است.
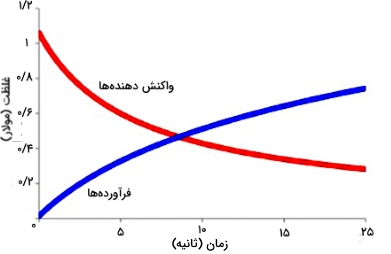
هنگامی که محسابه سرعت در ابتدای واکنش (در زمان $$t = 0$$) صورت بگیرد، به آن «سرعت اولیه» (Initial Rate) میگویند که نقش بسیار مهمی در سینتیک شیمیایی دارد. اگر با محاسبات دیفرانسیلی آشنا باشید، میدانید که این شیب در حقیقت مشتق مقادیری است که در هر نقطه از نمودار تغییر میکند. به عبارت دیگر این سرعتهای لحظهای را میتوان به صورت حدی بیان کرد:
$$\text{r} = \lim_{\Delta t \rightarrow 0} \dfrac{-[A]}{\Delta t}$$
از این تعریف میتوان اینطور برداشت کرد که هر اندازه $$\Delta t$$ بزرگتر باشد، دقت سرعت لحظهای کاهش مییابد.
فرمول سرعت واکنش
واکنش زیر را در نظر بگیرید:
$$a A + b B \rightarrow p P + q Q $$
در معادله بالا، حروف بزرگ نمایانگر واکنشدهندهها و فرآوردهها و همچنین حروف کوچک ضرایب استوکیومتری واکنش هستند. سرعت واکنش بالا از رابطه زیر بدست میآید:
$$r = - \frac { 1 } { a } \frac { d [ \mathrm { A } ] } { d t } = - \frac { 1 } { b } \frac { d [ \mathrm { B } ] } { d t } = \frac { 1 } { p } \frac { d [ \mathrm { P } ] } { d t } = \frac { 1 } { q } \frac { d [ \mathrm { Q } ] } { d t }$$
شرایط واکنش طبق تعریف آیوپاک:
- سیستم بسته
- فرآیند همحجم (حجم ثابت)
- بدون تولید واکنشدهندههای واسطه
در رابطه بالا، عبارت داخل کروشه، برابر با غلظت مواد است. در نتیجه، واحد سرعت واکنش به صورت $$mol / L / s$$ بیان میشود.
سرعت واکنش همواره عددی مثبت است. علامت منفی به عنوان نمادی برای نمایش کاهش غلظت فرآوردهها در نظر گرفته میشود. برای اینکه سرعت یک واکنش شیمیایی مستقل از نوع واکنشدهندهها یا فرآوردهها باشد، از یک ضریب در فرمول استفاده میشود. این ضریب با ضرایب استوکیومتری واکنش برابر است.

از فواید دیگر این معادله این است که برای «واکنشهای ابتدایی» (Elementary Reactions) و «واکنشهای برگشتناپذیر» (Irreversible Reactions)، سرعت واکنش برای یک فرآورده برابر با احتمال غلبه بر انرژی فعالسازی حالت گذار و تعداد دفعاتی است که مولکولهای واکنشدهنده به حالت گذار میرسند. با این تعریف، برای یک واکنش ابتدایی و برگشت ناپذیر، $$r$$ سرعت انجام یک واکنش شیمیایی است که به تولید فرآورده منتج میشود.
تعریف بالا تنها برای یک واکنش در سیستم بسته و شرایط حجم ثابت صدق میکند. اگر آب به ظرفی که شامل آب شور است اضافه شود، غلظت نمک کاهش پیدا میکند در حالیکه هیچ واکنش شیمیایی رخ نداده است.
برای یک سیستم باز، موازنه جرمی را باید در نظر بگیریم:
مصرف - تولید + خروجیها - ورودیها = تجمع
$$F _ { \mathrm { A } 0 } - F _ { \mathrm { A } } + \int _ { 0 } ^ { V } v d V = \frac { d N _ { \mathrm { A } } } { d t }$$
در رابطه بالا:
- $$F _ { A 0}$$: نرخ ورودی A بر حسب مول بر ثانیه
- $$F _ { A }$$: نرخ خروجی
- $$v$$: سرعت لحظهای A در حجم مشخص و دیفرانسیلی V که برای کل سیستم انتگرالگیری میشود.
زمانی که رابطه بالا را برای یک سیستم بسته و حجم ثابت در نظر گرفته شود خواهیم داشت:
$$r = \frac{d[A]}{dt}$$
در این رابطه غلظت $$[A]$$ به تعداد مولکولها $$(N _ A)$$ از طریق رابطه زیر مرتبط میشود که در این رابطه $$N _ 0 $$ برابر با عدد آووگادرو است:
$$[ A ] = \frac{N _ A}{N _ 0 V}$$
برای یک واکنش در یک سیستم بسته با حجم متغیر، سرعت واکنش که به «نرخ تبدیل» (Rate of Conversion) موسوم است، به صورت مشتق «مقدار واکنش» (Extent of Reaction) بر حسب زمان بیان میشود:
$$r = \frac { d \xi } { d t } = \frac { 1 } { \nu _ { i } } \frac { d n _ { i } } { d t } = \frac { 1 } { \nu _ { i } } \frac { d \left( C _ { i } V \right) } { d t } = \frac { 1 } { \nu _ { i } } \left( V \frac { d C _ { i } } { d t } + C _ { i } \frac { d V } { d t } \right)$$
در رابطه بالا:
- $$v _ i$$: ضرایب استوکیومتری ماده $$i$$، یعنی همان c، b، a و d است.
- $$V$$: حجم واکنش
- $$C _ i$$: غلظت ماده $$i$$
زمانی که فرآوردههای جانبی یا واکنشدهندههای واسطه در طول واکنش ایجاد شوند، آیوپاک توصیه میکند از عبارات «نرخ ظهور» (Rate of Appearance) یا «نرخ حذف» (Rate of Disapperance) برای فرآوردهها و واکنشدهندهها استفاده شود.

معادله سرعت
واکنش زیر را در نظر بگیرید:
$$a A + b B \rightarrow p P + q Q $$
معادله سرعت یک رابطه ریاضی در سینتیک شیمیایی است که سرعت واکنش را به غلظت واکنشدهندهها مرتبط میکند و از رابطه زیر بدست میآید. لازم به ذکر است که برای واکنشهای گازی، سرعت معمولا بوسیله فشارهای جزئی بیان میشود:
$$r = k ( T ) [ A ] ^ { n } [ B ] ^ { m }$$
در عبارت بالا $$k ( T )$$ «ضریب سرعت واکنش» (Reaction Rate Coefficient) یا «ثابت سرعت» (Rate Constant) نام دارد. البته به معنای حقیقی، این عبارت یک ثابت نیست چراکه تمامی پارامترهای موثر بر سرعت واکنش را به غیر از غلظت، شامل میشود. توانهای $$m$$ و $$n$$ در رابطه موسوم به مرتبه واکنش و به نوع و مکانیسم واکنش وابسته هستند. برای واکنشهای ابتدایی، این عدد برابر با ضرایب استوکیومتری واکنش است. برای واکنشهای کمپلکس (چند مرحلهای)، معادله سرعت باید به طور دقیق توسط مکانیسم واکنش تعیین شود.
برای واکنشهای ابتدایی، مرتبه و ضرایب استوکیومتری یکسان هستند و به تعداد مولکولهای شرکت کننده وابستهاند. برای واکنشهای «تک مولکولی» (Unimolecular)، سرعت با غلظت مولکولهای واکنشدهنده تناسب دارد و بنابراین معادله سرعت از مرتبه اول شناخته میشود. برای واکنشهای «دو مولکولی» (Bimolecular)، تعداد برخوردها با غلظت دو واکنشدهنده و فرآورده تولیدی آنها تناسب دارد. بنابراین معادله از مرتبه دوم است. یک واکنش مرتبه سوم بسیار آهسته است و برخورد همزمان سه مولکول معمولا کمتر اتفاق میافتد.
مثال
واکنش زیر را در نظر بگیرید:
$$2 H _{ 2 (g)} + 2 N O _ {(g)} \rightarrow N _ {2 (g)} + 2 H _ 2 O _ {(g)} $$
در این واکنش با دو برابر کردن غلظت $$NO$$ سرعت واکنش ۴ برابر و با دو برابر کردن غلظت $$H _ 2 $$ سرعت واکنش دو برابر میشود، بنابراین معادله سرعت به صورت زیر خواهد بود:
$$r = k [ H _ 2 ] [ N O ] ^ 2$$
همانطور که میبینید برای بسیاری از واکنشهای شیمیایی، معادلات سرعت که به صورت تجربی بدست آمدهاند با ضرایب استوکیومتری واکنش یکسان نیستند. واکنش بالا از نوع مرتبه سوم است یعنی مجموع اعداد ۱ برای $$H _ 2$$ و ۲ برای $$N O$$.
در سینتیک شیمیایی، سرعت واکنش کلی از طریق مکانیسم کلی واکنش بیان میشود. به طور مثال، واکنش بالا حاصل سه واکنش است که در زیر میبینید. به طور معمول، کندترین مرحله، سرعت واکنش را کنترل میکند:
مرحله اول: (تعادل سریع) $$2 N O _ {(g)} \leftrightharpoons N _ 2 O _{2 (g)}$$
مرحله دوم: (آهسته) $$N _ 2 O _{2} + H _ 2 \rightarrow N _ 2 O + H_ 2 O $$
مرحله سوم: (سریع) $$N _ 2 O + H _ 2 \rightarrow N _ 2 + H _ 2 O$$
واکنش اول و سوم در مقایسه با واکنش دوم بسیار سریع هستند. بنابراین واکنش مرحله دوم، تعیین کننده سرعت واکنش است. این واکنش از نوع دو موکلولی است که سرعت آن از رابطه زیر بدست میآید:
$$r = k _ 2 [ H _ 2 ] [N _ 2 O _ 2]$$
در این رابطه $$k _ 2 $$ ثابت سرعت برای مرحله دوم است. علاوه بر این، $$N _ 2 O _ 2 $$ یک فرآورده ناپایدار است که غلظت آن با توجه به این که در حال تعادل است از رابطه زیر بدست میآید:
$$[ N _ 2 O _ 2 ] = K _ 1 [ N O ] ^ 2 $$
در رابطه بالا، $$K _ 1$$ ثابت تعادل برای مرحله اول است. جایگزینی این معادله در معادله قبل سبب ایجاد رابطه سرعت بر اساس واکنشدهندهها میشود:
$$r = k_ 2 K _ 1 [ H _ 2 ] [N O] ^ 2$$
اگر در فرمول بالا، مقدار حاصلضرب $$k_ 2 K _ 1$$ برابر با $$k$$ در نظر بگیریم، معادله به فرم معادله اصلی که در ابتدای مثال دیدیم تبدیل میشود.
وابستگی دما
ضریب $$k$$ در معادله سرعت، به دما وابسته است که به طور معمول با «معادله آرنیوس» (Arrenius Equation) توصیف میشود:
$$k = A e ^ {- \frac{ E _ a }{ R T }}$$
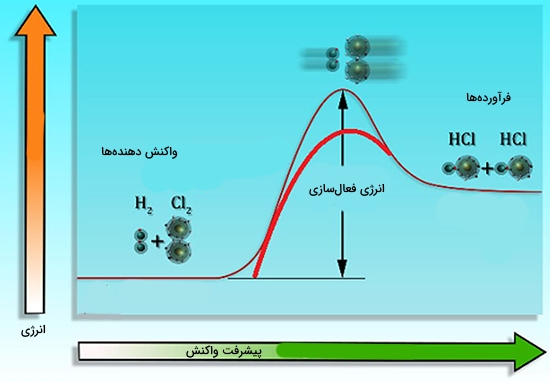
در این رابطه، $$E _ a$$ انرژی فعالسازی است و $$R$$ ثابت گازها است. مقادیر $$A$$ و $$E _ a$$ به نوع واکنش وابسته هستند. لازم به ذکر است که یک واکنش شیمیایی تنها زمانی اتقاق میافتد که ذرات واکنشدهندهها با یکدیگر برخورد داشته باشند. البته همه برخوردها به انجام واکنش منجر نمیشوند. فرآوردهها زمانی تشکیل میشوند که ذرات برخورد کننده به حداقلی از انرژی موسوم به «آستانه انرژی» (Threshold Energy) دست پیدا کنند. به عنوان یک قانون سر انگشتی، با افزایش ده درجهای دما، سرعت در بیشتر واکنشها دو برابر خواهد شد. در یک واکنش مشخص، نسبت ثابت سرعت در دمای بالاتر به دمای پایینتر را «ضریب دما» (Temperature Coefficient) مینامند که آن را با $$Q$$ نمایش میدهند. این عبارت معمولا برای توصیف نسبتهای سرعت در اختلاف دمای ده درجه سانتیگراد کاربرد دارد.
وابستگی فشار
وابستگی فشار به ثابتِ سرعت برای واکنشهای تراکمی، یعنی زمانی که واکنشدهندهها و فرآوردهها جامد یا مایع باشند، بسیار ضعیف است و در صنعت معمولا از آن صرف نظر میشود.
اگر این مطلب برای شما مفید بوده است، آموزشهای زیر نیز به شما پیشنهاد میشوند:
- مجموعه آموزشهای دروس شیمی
- مجموعه آموزشهای نرمافزارهای مهندسی شیمی
- آموزش Aspen Plus (اسپن پلاس) – برای شبیه سازی فرآیندهای شیمیایی
- ترمودینامیک — از صفر تا صد
- اسید چرب — به زبان ساده
^^











سلام
سوال داشتم
چطور میشه میزان A و E رو در برای ریت واکنش در معادله ارنیوس تخمین و محاسبه کرد.
ممنون میشم راهنمایی کنید.
تشکر
با سلام به همگی مخصوصا نگارنده این مطلب می خواستم بدونم مقدار حلال هم می تونه در میزان راندمان محصول موثر باشه یا خیر با تشکر
سلام.
چطور میشود یک فاکتور را برای افزایش سرعت واکنش شیمیایی مناسب دانست یا بهتر از فاکتور های دیگه دانست
بفرض مثال در واکنش br2 + cl2 = brcl افزایش دما بهتر از افزایش فشار است(به همگن بودن گازی واکنش) که این سادست درواقع چون کل واکنش گازی است نمیتوان افزایش فشار را پیشنهاد داد ، افزایش حجم هم که عمل عکسش هست.
سوال من این است که اگر شما یک واکنش همگن مایه(aq) داشته باشد بهترین فاکتور برای افزایش سرعت
افزایش دما است
یا افزایش غلظت
و ایا این ربط به ماهیت واکنش داره؟، چون اکثر واکنش های aq با افزایش غلظت افزایش سرعت بهتری خواهند داشت نسبت به بالا بردن دما
اما برای بعضی از واکنشها مانند مواد الی، بالا بردن دما نتها باعث افزایش دما نمیشه بلکه فقط به تجزیه شدن ماده سرعت بخشیده.
اما در بعضی از واکنش ها مانند Cu(s) + 2AgNo3(aq) = Cu(No3)2(aq) +2Ag(s) برای افزایش سرعت واکنش
شما اول میاین غلظت no2 رو افزایش میدید یا جرم سیستم و یا مساحت سطح؟ و یا شاید چون یک واکنش همگن هست دست به افزایش چیزی نمیزنید و فقط سرعت واکنش رو نظارت میکنید با توجه به رنگ آنها؟
با سلام؛
خوشحالیم از اینکه مطالعه مطلب برای شما مفید بوده است. در این رابطه باید گفت سرعت واکنش ارتباط مستقیمی با بازده ندارد. برای همین پیشنهاد میکنیم مطلب «بازده درصدی واکنش در شیمی — به زبان ساده» را مطالعه کنید.
با تشکر از همراهی شما با مجله فرادرس
سلام خسته نباشید
ببخشید میخواستم بدونم در واکنش های تعادلی که واکنش دهنده، ماده جامد یا مایع خالص باشد، سرعت واکنش رفت همواره عدد ثابتی ست؟
با سلام؛
در واکنشهای تعادلی، سرعت واکنش رفت و برگشت به هنگام رسیدن به تعادل، با یکدیگر برابر است. برای آشنایی بیشتر پیشنهاد میکنیم مطلب «تعادل شیمیایی — از صفر تا صد» را مطالعه کنید.
با تشکر از همراهی شما با مجله فرادرس
توضیح دهید چرااا افزایش مقدار مواد جامد و مایع خالص سرعت واکنش تغییر نمیکند
لطفا ج بدید زوددددد♥️?
سلام، چون سرعت واکنش به غلظت بستگی دارد و افزایش مقدار ماده جامد با مابع، باعث افزایش غلظت نمیشود، چون به همان میزان که جرم زیاد میشود، حجم هم زیاد میشود و چگالی ثابت است.
عالی بود