سری الکتروشیمیایی چیست؟ — کاربرد + جدول — به زبان ساده
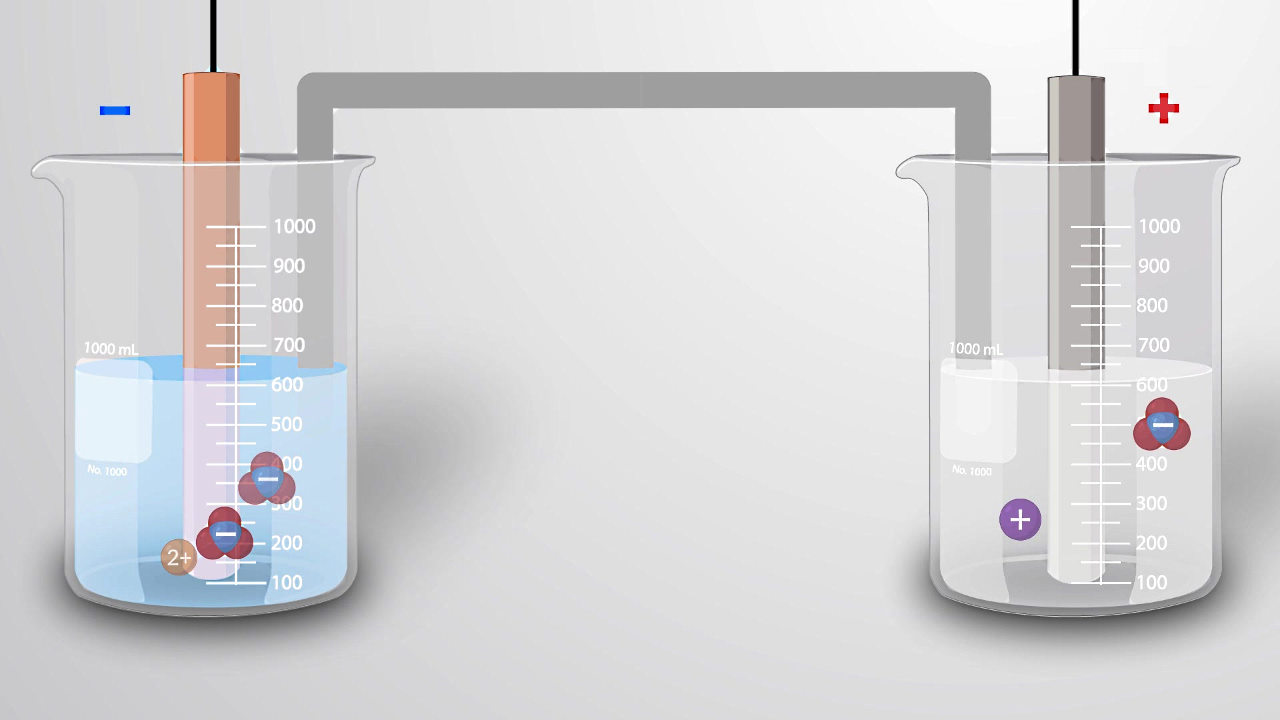
سری الکتروشیمیایی یا سری فعالیت، «پتانسیل استاندارد الکترود» ($$E°$$ | Standard Electrode Potential) بر حسب ولت، نسبت به الکترود استاندارد هیدروژن است. مقادیر سری الکتروشیمیایی در دمای ۲۹۸٫۱۵ کلوین (۲۵ درجه سلسیوس)، فشار یک اتمسفر و غلظت یک مولار الکترولیت اندازهگیری میشوند. $$E°$$ قدرت کاهندگی عنصر را نشان میدهد. این مطلب شامل جدول کامل سری الکتروشیمیایی و کاربردهای آن همراه با چند مثال است.
سری الکتروشیمیایی چیست؟
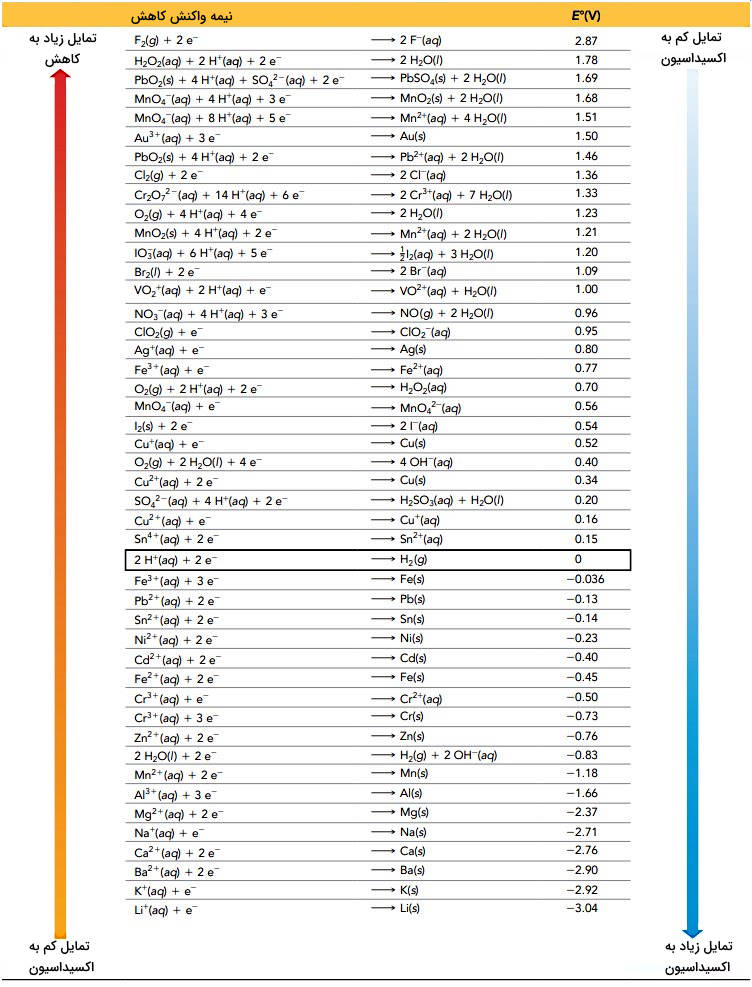
سری الکتروشیمیایی جدولی است که در آن عناصر بر اساس پتانسیل استاندارد الکترود به صورت افزایشی یا کاهشی فهرست شدهاند. همچنین به سری الکتروشیمیایی، سری فعالیت عناصر نیز گفته میشود.
هرچه مقدار پتانسیل استاندارد کاهش بزرگتر باشد، کاهش یافتن عنصر آسانتر و اکسیدکننده بهتری است. برای مثال پتانسیل استاندارد کاهش $$F_۲$$ برابر با ۲٫۸۷+ ولت و $$Li^+$$ برابر با $$-۳٫۰۵$$ ولت است.
$$F_2(g) + 2 e^−⇌ 2 F^− = +2.87 V$$
$$Li^+ + e^−⇌ Li(s) = −3.05 V$$
مقدار پتانسیل استاندارد کاهش $$F_2$$ نشان دهنده این است که این عنصر به راحتی کاهش مییابد و بنابراین یک عامل اکسیدکننده خوب است. در مقابل، پتانسیل استاندارد کاهش منفی برای $$Li^+$$ نشان دهنده این است که به سختی کاهش مییابد. در واقع سخت کاهش یافتن $$Li^+$$ یعنی راحتتر اکسید میشود پس یک عامل کاهنده بسیار خوب است.
$$Zn^{۲+}$$ دارای پتانسیل استاندارد کاهش $$Zn^{۲+}$$ برابر با ۰٫۷۶- ولت است به عبارتی $$Zn^{۲+}$$ توسط هر عنصری که پتانسیل استاندارد کاهشی بیش از $$-۰٫۷۶$$ ولت داشته باشد اکسید شود و توسط هر الکترود با پتانسیل استاندارد کاهشی کمتر از $$-۰٫۷۶$$ ولت کاهش مییابد.
نکات مهم سری الکتروشیمیایی
مهمترین نکات سری الکتروشیمیایی در زیر آورده شده است.
- در سری الکتروشیمیایی پتانسیل کاهش عنصر نسبت به الکترود استاندارد هیدروژن اندازهگیری شده است و به عنوان معیاری از تمایل آن عنصر به کاهش توصیف میشود.
- پتانسیل کاهش بیشتر نشاندهنده این است که آن عنصر راحتتر کاهش مییابد و در مقابل عنصری که پتانسیل کاهش کمتری دارد، سریعتر اکسید میشود.
- عنصری که الکتروندهنده بهتری است، پتانسیل کاهش منفی دارد یعنی در جدول سری الکتروشیمیایی پایینتر قرار دارد و عنصری که الکتروفیلتر است، پتانسیل کاهش آنها مثبت است و در بالای جدول قرار میگیرند.
- عناصر کاهنده قویتر، پتانسیل کاهش استاندارد منفی دارند و معمولا در جدول سری الکتروشیمیایی پایینتر از هیدروژن قرار دارند.
- عوامل کاهنده ضعیفتر با پتانسیل کاهش استاندارد مثبت در بالای هیدروژن فهرست شدهاند.
- در جدول سری الکتروشیمیایی با حرکت به سمت پایین قدرت عامل کاهنده افزایش و قدرت عامل اکسیدکننده کاهش پیدا میکند
کاربردهای سری الکتروشیمیایی
پتانسیلهای الکترود استاندارد در محاسبات سیستمهای ردوکس در زیستشناسی و بیوشیمی اهمیت بالایی دارند. بیشتر این سیستمها وابسته به pH هستند.
پتانسیلهای الکترود این سیستمها در $$pH=۷٫۰$$ که آنرا به صورت $$E^°_7$$ نیز نمایش میدهند به عنوان روشی استاندارد به منظور مقایسه قدرت اکسید یا کاهندگی فهرست می شوند. سیستمهای ردوکس مهم در بیوشیمی عبارتند از:
- NADH/NAD
- فلاوینها
- پیروات/لاکتات
- اگزالاستات/مالات
- کینون/هیدروکینون
سیتوکرومها نمونههای بسیار خوبی از چنین سیستمهایی هستند. عملکرد فیزیولوژیکی سیتوکرومها آسان کردن انتقال الکترون است.
شناسایی اکسنده و کاهنده قوی
با استفاده از سری الکتروشیمیایی امکان شناسایی اکسیدکننده و کاهش دهنده خوب ممکن میشود. سریهای الکتروشیمیایی کمک میکند تا یک اکسیدکننده یا عامل کاهنده خوب را شناسایی کنیم. مواردی که در سری الکتروشیمیایی در بالای جدول قرار میگیرند یعنی پتانسیل کاهش استاندارد مثبت دارند عاملهای اکسیدکننده خوبی هستند و در مقابل، مواردی که در پایین جدول قرار گرفتهاند و پتانسیل کاهش استاندارد منفی دارند، عامل کاهنده خوبی هستند. برای مثال، الکترود $$F_2$$ که پتانسیل کاهش استاندارد آن ۲٫۸۷ ولت است عامل اکسیدکننده خوب و $$Li^+$$ با پتانسیل کاهش استاندارد $$-۳٫۰۵$$ ولت عامل کاهنده قوی است.
محاسبه emf استاندارد پیل الکتروشیمیایی
نیروی الکتروموتوری یا $$emf$$ استاندارد از مجموع پتانسیل کاهش استاندارد دو نیمسلول محاسبه می شود.
$$E°_{cell} = E°_{red}+E°_{ox}$$
بر اساس استاندارد پتانسیل اکسیداسیون استاندارد بر حسب پتانسیل کاهش نوشته می شود. بنابراین:
پتانسیل کاهش استاندارد - = پتانسیل اکسیداسیون استاندارد
یا
$$E°_{cell}= E°_{cathode}– E°_{anode}$$
مثال: برای واکنش زیر
$$2Ag^+ (aq) + Cd → 2Ag + Cd^{+2}(aq)$$
پتانسیل کاهش استاندارد داده شده به صورت زیر است:
$$Ag^+/ Ag =0.80\,volt$$
$$Cd^{+2}/ Cd = -0.40\,volt$$
با توجه به واکنش $$Cd$$ الکترون از دست میدهد و $$Ag^+$$ الکترون گرفتهاست؛ بنابراین نیم سلول اکسیداسیون یا آند سیستم $$Cd$$ است. با استفاده از فرمول $$E°_{cell}= E°_{cathode}– E°_{anode}$$ مقدار $$E°$$ به محاسبه میشود:
$$E°_{cell}= (0.80)–(-0.40)$$
$$=1.20\, volt$$
پیش بینی امکان سنجی واکنش ردوکس
اگر مقدار تغییر انرژی آزاد گیبس $$(ΔG)$$ منفی باشد، واکنش به صورت خودبهخودی انجام میشود. انرژی آزاد به صورت زیر با $$emf$$ پیل رابطه دارد.
$$ΔG°=nFE°$$
- $$n$$: تعداد الکترون مبادله شده
- $$F$$: ثابت فارادی
- $$E°$$: مقدار $$emf$$ پیل
با توجه به رابطه بالا شرایط زیر بین $$ΔG$$ و $$E°$$ وجود دارد.
- اگر $$E°$$ مثبت باشد $$ΔG$$ می تواند منفی باشد.
- وقتی که $$E°$$ مثبت است، واکنش خودبهخودی بوده و منبع انرژی الکتریکی است یا الکتریسیته تولید میکند.
اگر $$E°$$ منفی باشد واکنش غیر خودبهخودی است و برای رخ دادن واکنش نیاز به انرژی است.
مثال: پیشبینی مقدار $$E°$$ برای واکنش، هنگام نگهداری محلول نمک فلزی در ظرف فلزی دیگر مهم است. با توجه به این موضوع آیا امکان نگهداری محلول سولفات مس در ظرفی از جنس نیکل وجود دارد؟
برای واکنش $$Ni + CuSO_4 → NiSO_4 + Cu$$ پتانسیل کاهش استاندارد داده شده به صورت زیر است:
$$Ni^{2+}/ Ni =-0.25\,volt$$
$$Cu^{+2}/Cu = 0.34\,volt$$
باید بررسی کنیم آیا فلز نیکل با اکسیداسیون، $$NiSO_4$$ تولید میکند یا نه؟
$$Ni(s) + Cu^{+2}(aq) → Ni^{+2}(aq) + Cu(s)$$
نیم سلول اکسیداسیون یا آند سیستم $$Ni$$ است. با استفاده از فرمول
$$E°_{cell}= E°_{cathode}– E°_{anode}$$
مقدار $$E°$$ به صورت زیر محاسبه میشود:
$$E°_{cell}= (0.34)–(-0.25)$$
$$=0.59\, volt$$
مقدار به دست آمده برای $$E°$$ مثبت است که نشان دهنده این است که وقتی سولفات مس در ظرفی از جنس نیکل نگهداری شود $$NiSO_4$$ تولید میکند و محلول به مرور زمان از بین میرود و باعث خوردگی ظرف میشود بنابراین برای نگهداری محلول مناسب نیست.
پیش بینی محصول الکترولیز
هنگام الکترولیز وقتی دو یا چند نوع یون مثبت و منفی در محلولی وجود دارند، یونی که عامل اکسیدکننده قویتر است؛ یعنی پتانسیل کاهش استاندارد بالاتری دارد، زودتر در کاتد رسوب میشود.
برای مثال هنگام الکترولیز محلول آبی نمک سدیم کلرید که در آن یونهایی چون $$Na^+، Cl^-، H^+$$ و $$OH^-$$ موجود است یون $$H^+$$ به جای کاهش $$Na^+$$ به دلیل اینکه پتانسیل کاهش استاندارد بالاتری از سدیم دارد در کاتد رسوب میکند. پتانسیل کاهش استاندارد $$H^+=۰٫۰$$ و برای $$Na^+= -۲٫۷۱$$ است.
همچنین در آند، که اکسیداسیون صورت میگیرد، آنیونی که پتانسیل کاهش کمتری دارد زودتر اکسید میشود؛ بنابراین در آندی که اکسیداسیون انجام میشود، آنیونی که پتانسیل کاهش کمتری دارد اکسید میشود؛ بنابراین، $$OH^-$$ که پتانسیل کاهش استاندارد آن ۰٫۴۰ ولت است نسبت به $$Cl^-$$ با پتانسیل کاهش استاندارد ۱٫۳۶ ولت زودتر اکسید میشود.
اندازه گیری پتانسیل ردوکس
پتانسیل استاندارد الکترود، اندازهگیری قدرت کاهندگی عنصر یا ترکیب است که آیوپاک آن را بهصورت تعریف میکند:
مقدار نیروی محرکه الکتریکی استاندارد پیلی که هیدروژن مولکولی در فشار استاندارد به پروتونهای حل شده اکسید میشود.
در اندازهگیری پتانسیل نیمپیل عناصر از نیمپیل «الکترود استاندارد هیدروژن» (Standard Hydrogen Electrode | SHE) که مقدار آن برابر صفر فرض شده، استفاده میشود. با تشکیل پیل گالوانی که براساس قدرت کاهندگی گونهها، انرژی الکتریکی تولید میکند با نیمپیل استاندارد هیدروژن و دیگر گونهها اندازه پتاسیل نیمپیل ممکن میشود.
$$\triangle V_{cell}= E_{{red,\,cathode}}-E_{{red,\,anode}}$$
یا به صورت
$$\triangle V_{cell}= E_{{red,\,cathode}}+E_{{ox,\,anode}}$$
محاسبات بالا با توجه به تعریف «آیوپاک» (IUPAC) صورت گرفته است که در آن تفاوت پتانسیلهای الکترودهای سمت راست و چپ سلول گالوانیکی، اختلاف پتانسیل الکتریکی پیل است و جریان بار الکتریکی مثبت از آند به کاتد وقتی رخ میدهد که $$\triangle V_{cell}$$ مثبت است.
در واکنش اکسایش-کاهش پتانسیل اکسیداسیون با منفی پتانسیل کاهش نیمواکنش برابر است، بنابراین پس از محاسبه هر یک با تغییر علامت مقدار به دست آمده اندازه دیگری محاسبه میشود. پتانسیل استاندارد الکترود معمولاً به شکل پتانسیل استاندارد کاهش نوشته میشود.
برای هماهنگی و رعایت استاندارد در نوشتهها، نیم واکنشها به صورت کاهشی نوشته میشوند.
- گونه اکسنده در سمت چپ
- گونه کاهنده در سمت راست
اندازهگیریها در دمای ۲۵ درجه سلسیوس، فشار ۱ اتمسفر و غلظت ۱ مولار الکترولیت انجام میشود. پتانسیلی که در چنین شرایطی اندازهگیری شده باشد را پتانسیل استاندارد نیمپیل یا E صفر $$E°$$ مینامند.
چون پتانسیلهای الکترود به عنوان پتانسیل کاهش تعریف میشوند، علامت پتانسیل برای الکترود فلزی که اکسید میشود هنگام محاسبه پتانسیل کلی پیل باید علامت مخالف بگیرد یعنی اگر پتانسیل کاهش مثبت است، منفی و اگر منفی است، مثبت شود. پتانسیلهای الکترود از تعداد الکترونهای منتقل شده مستقل هستند در واقع، مقدار انرژی به ازای هر الکترون منتقلشده بر حسب ولت اندازهگیری میشود.
هنگام اندازهگیری پتانسیل عنصر یا ترکیب به صورت عملی الکترود عنصر به پایه مثبت و الکترود استاندارد هیدروژن به پایه منفی الکترومتر متصل و از سیستم سه الکترودی شامل الکترود کار، کمکی و مرجع برای اندازهگیری استفاده میشود.
پتانسیل استاندارد رابطه زیر محاسبه میشود.
$$E=\frac{\sum\triangle G_L - \sum\triangle G_R }{F}$$
- $$\triangle G$$: انرژی آزاد گیبس استاندارد تشکیل
- $$F$$: ثابت فارادی
علامت قراردادی سری الکتروشیمیایی
علامت مقدار پتانسیل به طور قراردادی به دو شیوه صورت میگیرد. که به روش آمریکایی و اروپایی شناخته میشوند.
- روش آمریکایی: قرارداد نرنست–لوئیس–لاتیمر
- روش اروپایی: گیبس-استوالد-استکهلم
آیوپاک هر دو شیوه را صحیح میداند با اینحال روش دوم با اتفاق آرا برای جلوگیری از ابهامات انتخاب شده است. در هر دو روش الکترود استاندارد هیدروژن برابر صفر در نظر گرفته شده و واکنش نیمپیل به صورت کاهشی نوشته میشود. تفاوت اصلی بین دو روش، تغییر علامت $$E$$ هنگام معکوس نوشتن واکنش است. در روش اول با معکوس شدن واکنش علامت $$E$$ نیز تغییر میکند، در حالی که در روش اروپایی چنین نیست.
نمونه سوال سری الکتروشیمیایی
مثال اول: خودبه خودی بودن واکنش زیر را بررسی کنید.
$$Fe^{3+} + 2Cl^– → Fe^{2+} + Cl_2$$
پتانسیل کاهش استاندارد داده شده به صورت زیر است:
$$Fe^{2+}/ Fe =-0.44\,volt$$
$$Cl/Cl^- = 1.36\,volt$$
پاسخ: با توجه به پتانسیل کاهش استانداردها، مشخص است که کلر پتانسیل کاهش بیشتری نسبت به آهن دارد بنابراین کلر، کاتد و آهن، آند است.
با استفاده از فرمول
$$E°_{cell}= E°_{cathode}– E°_{anode}$$
مقدار $$E°$$ به صورت زیر محاسبه میشود:
$$E°_{cell}= (1.36)–(-0.44)$$
$$=1.80\, volt$$
وقتی مقدار $$E°$$ مثبت باشد به این معنی است که واکنش به صورت خودبهخودی انجام می شود.
مثال دوم: با توجه به پتانسیل کاهش استاندارد نیم واکنشهایی که در زیر آمده است کدام یک از گونههای زیر عامل کاهنده قویتری است؟
- $$Zn$$
- $$Cr$$
- $$Cu$$
- $$Fe^{+3}$$
$$Zn^{+2}(aq) + 2e^– \rightarrow Zn(s);\,\,\,-0.76\,volt$$
$$Cr^{+3}(aq) + 3e^–\rightarrow Cr(s);\,\,\,-0.74\,volt$$
$$Cu^{+2}(aq) + 2e^– \rightarrow Cu(s);\,\,\,0.34\,volt$$
$$Fe^{+3}+ e^– \rightarrow Fe^{+2};\,\,\,0.77\,volt$$
پاسخ: عامل کاهنده در واکنش اکسایش کاهش، دهنده الکترون به گونه شیمیایی دیگر است. از دست دادن الکترون یعنی عامل کاهنده اکسید میشود.
همچنین
(پتانسیل کاهش)$$-$$ = پتانسیل اکسیداسیون
از میان نیمواکنشهای داده شده $$Zn^{+۲}$$ کمترین پتانسیل کاهش را دارد و با توجه به رابطه بالا یعنی $$Zn^{+۲}$$ بالاترین پتانسیل اکسیداسیون استاندارد را دارد؛ بنابراین فلز روی با پتانسیل اکسیداسیون ۰٫۷۶۲ ولت قویترین عامل کاهنده بین موارد داده شده است.
مثال سوم: پتانسیل اکسیداسیون استاندارد $$(E°)$$ برای نیم واکنشهای زیر به صورت زیر است.
$$Cu \rightarrow Cu^{+2} + 2e^–;\,\,\,E° = -0.34\,volts$$
$$Fe \rightarrow Fe^{+2} + 2e^–;\,\,\,E° = 0.41\,volts$$
$$emf$$ پیل مورد نظر را طبق واکنش زیر محاسبه کنید.
$$Cu^{+2} + Fe \rightarrow Cu + Fe^{+2}s$$
پاسخ: مقدار $$E°_{cell}$$ را می توان از دو رابطه زیر محاسبه کرد.
[A $$-$$ B] = $$E°_{cell}$$
A: پتانسیل کاهش استاندارد نیم سلول کاهشی
B: پتانسیل کاهش استاندارد نیم سلول اکسیداسیون
یا
[(D$$-$$) $$-$$ (C) $$-$$] = $$E°_{cell}$$
C: پتانسیل اکسیداسیون استاندارد نیم سلول کاهشی
D:پتانسیل اکسیداسیون استاندارد نیم سلول اکسایش
$$E°_{cell}= (-0.34)–(-0.41)$$
$$=0.07\, volt$$
الکتروشیمی چیست؟
جهت یادآوری مفهوم الکتروشیمی و برخی از اصطلاحات آن و اینکه چه کاربردهایی دارد به صورت کوتاه و خلاصه مطلب زیر آورده شده است.
الکتروشیمی از مهمترین دانشهای کاربردی شیمی است که نقش زیادی در زندگی روزمره دارد. استفاده از باتریهای قابل حمل در ابزارهایی چون تلفن همراه، دوربینهای دیجیتال، لپتاپ، تبلت و ساعتهای هوشمند به دلیل بهکارگیری دانش الکتروشیمی در زندگی است. الکتروشیمی همچنین در پدیدههایی چون خوردگی که در صنعت از اهمیت زیادی برخوردار است تا تولید آلومینیوم، کلر و سدیم هیدروکسید نقش دارد.
همچنین از تکنیکهای الکتروشیمیایی در ساخت الکترودهایی استفاده میشود که در شیمی تجزیه برای آنالیز و ردیابی آلایندهها در آبهای طبیعی یا مقادیر ناچیزی از مواد شیمیایی در خون انسان که ممکن است نشانهای از ایجاد بیماری خاص باشد، استفاده میشوند.
در تعریفی سادهتر، الکتروشیمی دانش مطالعه تبادل انرژی شیمیایی و الکتریکی است که شامل واکنشهای اکسایش-کاهش میشود. بهطور کلی واکنشهای اکسایش-کاهش به دو دسته خودبهخودی و غیر خودبهخودی تقسیم میشوند.
- خودبهخودی: در واکنش خودبهخودی، از واکنش شیمیایی جریان الکتریکی تولید میشود.
- غیرخودبهخودی: در واکنش غیر خودبهخودی، برای انجام واکنش شیمیایی از جریان الکتریکی استفاده میشود.
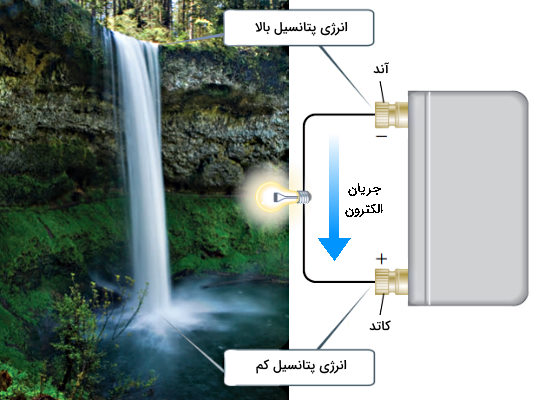
همانطور که آب بهطور خودبهخودی در سراشیبی جریان مییابد، الکترونها نیز بهطور خودبهخود در سلول ولتایی از آند به کاتد جریان مییابند.
واکنش اکسایش کاهش
در واکنشهای اکسایش-کاهش یا «ردوکس» (Redox)، بین گونههای حاضر در واکنش، الکترون رد و بدل میشود. گونهای که الکترون از دست میدهد اکسایش و گونهای که الکترون میگیرد کاهش مییابد. به فرایندهای گرفتن یا دادن الکترون نیمواکنش میگویند که هر نیمواکنش باید از لحاظ جرم و بار موازنه باشد. برخی اصطلاحات در واکنشهای اکسایش-کاهش به صورت زیر تعریف میشوند.
- اکسنده: مادهای که الکترون میگیرد و سبب اکسایش گونه دیگر میشود.
- کاهنده: مادهای که الکترون میدهد و موجب کاهش گونه دیگر میشود.
- آند: الکترودی که نیمواکنشِ اکسایش در آن رخ میدهد.
- کاتد: الکترودی که نیمواکنشِ کاهش در آن رخ میدهد.
- نیروی الکتروموتوری (emf): اختلاف پتانسیلِ میان دو نیمسلول است.
برای درک واکنش ردوکس و تولید جریان الکتریکی به واکنش بین $$MnO_4^-$$ و $$Fe^{2+}$$ توجه کنید.
$$8H^+(aq)+MnO_4^-(aq)+5Fe^{2+}(aq)\rightarrow$$
$$Mn^{2+}(aq)+5Fe^{3+}(aq)+4H_2O(l)$$
در این واکنش $$Fe^{2+}$$ اکسید شده و $$MnO_4^-$$ کاهش مییابد یعنی الکترونهای از عامل کاهنده ($$Fe^{2+}$$) به سمت عامل اکسیدکننده ($$MnO_4^-$$) جریان پیدا میکنند.
واکنش ردوکس بالا به دو نیم واکنش زیر تجزیه میشود.
- کاهش:
$$8H^+MnO_4^-+5e^-\rightarrow Mn^{2+}+4H_2O$$
- اکسایش:
$$5(Fe^{2+}\rightarrow Fe^{3+}+e^-)$$
برخورد اکسیدکننده با احیاکننده در واکنش شیمیایی موجب انتقال سریع الکترون میشود که با آزاد شدن گرما همراه است. برای مهار این انرژی، عامل اکسیدکننده از عامل احیاکننده جدا میشود و انتقال الکترون بین آنها از طریق سیم صورت میگیرد. جریانی که از انتقال الکترونها ایجاد میشود میتواند توسط دستگاهی مانند موتور الکتریکی هدایت شود.
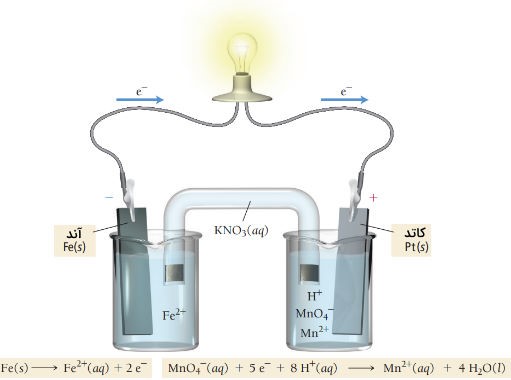
وقتی گونههای موجود در نیمواکنش همه در فاز آبی هستند، به یک رابط رسانا برای انتقال الکترون نیاز است. در این سلول الکتروشیمیایی، نواری از جنس آهن به عنوان آند و نوار پلاتینی به عنوان کاتد عمل میکند. آهن در آند اکسید میشود و یون پرمنگنات در کاتد کاهش مییابد.
سوالات متداول سری الکتروشیمیایی
پاسخ برخی از پرسشهای رایج درباره سری الکتروشیمیایی و پتانسیل الکترود استاندارد در زیر آمده است.
علامت منفی یا مثبت پتانسیل کاهشی استاندارد چه معنایی دارد؟
در جدول سری الکتروشیمیایی علامت $$E°$$ قدرت کاهندگی عنصر را نشان میدهد.
- اگر قدرت کاهندگی بیشتر از $$H_2$$ باشد، $$E°$$ علامت منفی میگیرد.
- اگر قدرت کاهندگی کمتر از $$H_2$$ باشد، $$E°$$ علامت مثبت میگیرد.
منظور از پتانسیل الکترود استاندارد چیست؟
به مقدار اختلاف پتانسیل بین الکترود و الکترولیت پتانسیل الکترود استاندارد گفته میشود.
مقدار پتانسیل الکترود استاندارد هیدروژن چقدر است؟
مقدار الکترود استاندارد هیدروژن بهطور قراردادی برابر صفر $$(0.0\,V)$$ در نظر گرفته شده است.
پتانسیل کاهش کمتر نشان دهنده چیست؟
در جدول سری الکتروشیمیایی عنصری که پتانسیل کاهش کمتری دارد، آسانتر اکسید میشود.
جمعبندی سری الکتروشیمیایی
از پتانسیلهای الکترود استاندارد و معادله نرنست برای محاسبه پتانسیل پیل گالوانیکی یا پتانسیل لازم برای عملکرد پیل الکترولیتی استفاده میشود. پتانسیل ترمودینامیکی پیل الکتروشیمیایی تفاوت بین پتانسیل الکترود سمت راست و پتانسیل الکترود الکترود سمت چپ است.
در پایان باید توجه داشته باشید که هیچکدام از این پتانسیلها، از جمله پتانسیل الکترود هیدروژن استاندارد، نمیتوانند مستقیماً در آزمایشگاه اندازهگیری شوند. شرایط الکترود $$SHE$$ فرضی است و چنین سیستمهای الکترودی را نمیتوان در آزمایشگاه تهیه کرد زیرا هیچ راهی برای تهیه محلولهای حاوی یونهایی وجود ندارد که فعالیت آنها دقیقاً ۱ باشد.










