لنفوسیت B چیست؟ – به زبان ساده + وظیفه و مراحل تکامل
بدن انسان روزانه با میلیونها پاتوژن متفاوت در ارتباط است. برای حفظ بقا و محافظت از عملکرد بخشهای مختلف، مجموعهای از سلولها و مولکولهای شیمیایی سیستم ایمنی تشکیل میدهند که وظیفه محافظت از بدن را بر عهده دارد. گلبولهای سفید سلولهای ایمنی بدن هستند که گیرندهها و پروتئینهای سطحی آنها آنتیژنهای پروتئینی، لیپوساکاریدی و گلیکولیپدی غشای باکتریها، ویروسها، انگلها و قارچها را شناسایی و مکانیسمهای ایمنی را فعال میکنند. این سلولها به طور اختصاصی به یک نوع آنتیژن مشخص یا به طور غیراختصاصی به گروهی از آنتیژنها پاسخ میدهند. لنفوسیت B یکی از گلبولهای سفید سیستم ایمنی بدن است که پاتوژنهای خارج سلولی را به طور اختصاصی شناسایی میکند.
لنفوسیتهای B پس از اتصال گیرنده به آنتیژن، فعال میشود و با ترشح آنتیبادی از بدن دفاع میکند. آنتیبادیها پروتئینهایی با توالی مکمل آنتیژن هستند. اتصال آنتیبادی به آنتیژن از ورود پاتوژنها به سلول جلوگیری میکند. به علاوه این سلولها با فعال کردن سیستم کمپلمان و افزایش فاگوسیتوز در از بین بردن پاتوژن نقش دارد. در این مطلب از مجله فرادرس ابتدا ویژگیهای ساختاری لنفوسیت B و در ادامه مراحل تکامل و مکانیسم دفاعی این سلولها را توضیح میدهیم. در انتهای این مطلب تفاوت این سلولها با لنفوسیتهای T (گلبولهای سفید دیگر در دفاع اختصاصی) را بررسی میکنیم.
لنفوسیت B چیست؟
لنفوسیت B گروهی از گلبولهای سفید سیستم ایمنی جانوران است که در دفاع اختصاصی شرکت میکند. این سلولها اولین بار از بورسا فابروسیس (اندام لنفاوی) مرغ جدا شد. به همین دلیل به آنها سلولهای B (بورسا | Bursa) گفته میشود. لنفوسیتهای B انسان مثل سایر گلبولهای سفید از تمایز سلولهای بنیادی خونساز در مغز قرمز استخوان تولید میشود. این سلولها در خون، لنف و اندامهای لنفاوی (گرههای لنفاوی، طحال و لوزهها) وجود دارد. سلولهای B با ترشح پروتئینهایی به نام آنتیبادی در از بین بردن پاتوژنها به سیستم ایمنی کمک میکنند. به همین دلیل هسته بزرگ و شبکه اندوپلاسمی گستردهای در سیتوپلاسم این سلولها وجود دارد. غشای لنفوسیت B از گلیکولیپیدها و گلیکوپروتئینهایی تشکیل شده که این سلولها را از سایر گلبولهای سفید به ویژه لنفوسیتهای T متمایز میکند. به علاوه گیرندههای پروتئینی غشا آنتیژنهای مختلف را شناسایی میکند.
گیرنده لنفوسیت B
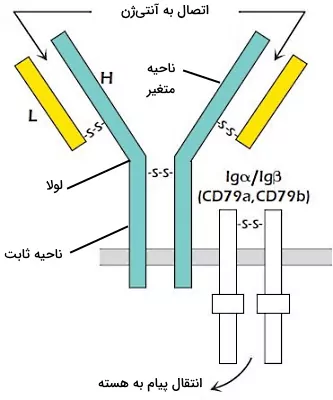
در غشای لنفوسیتهای B بالغ گیرنده اتصالی به آنتیژن (BCR)، ایمونوگلبولینهای انتقال پیام، CDهای نشانه هر رده سلولی و CDهای کمککننده به گیرنده وجود دارد. گیرنده آنتیژنی سلولهای B، آنتیبادی غشایی است که با آنتیبادیهای آلفا و بتا جفت شده است. آنتیبادی آلفا و بتا با پیوند دیسولفیدی به هم متصل شده و دیمر تشکیل میدهند. این پروتئینها به قرار گرفتن گیرنده آنتیژنی در غشا و انتقال پیام کمک میکنند.
هر آنتیبادی یا ایمونوگلوبولین از چهار زنجیره پلیپپتیدی (دو زنجیره سبک و دو زنجیره سنگین) با دومینهای متغیر و ثابت تشکیل شده است. ناحیه متغیر به آنتیژن متصل میشود و بخش کوچکی از دومین ثابت زنجیره سنگین BCR در غشای پلاسمایی قرار دارد. هر زنجیره سبک (L) با پیوند دیسولفیدی به زنجیرههای سنگین (H) متصل میشود. در زنجیرههای سنگین علاوه بر ناحیه ثابت و متغیر، بخشی به نام لولا وجود دارد که این دو ناحیه را به هم متصل میکند. لولا از تعداد زیادی آمینو اسید سیستئین و پرولین تشکیل شده است. سیستئینها در تشکیل پیوند دیسولفیدی بین زنجیرهها شرکت میکنند. پرولین سبب خمیدگی زنجیره و تشکیل ساختار Y آنتیبادیها میشود.
دومین ژنی متغیر ($$V_L$$) و اتصالی ($$J_L$$)، ناحیه متغیر زنجیره سبک و دومین ژنی ثابت ($$C_L$$)، ناحیه ثابت این زنجیره را کد میکند. قطعات بین این دومینها در تغییرات پس از ترجمه mRNA بهوسیله آنزیم ریکامبیناز حذف شده و این دومینها کنار هم قرار میگیرند. $$\lambda$$ و $$\kappa$$ دو نوع زنجیره سبک آنتیبادیهای پستانداران هستند. ناحیه متغیر زنجیرههای سنگین بهوسیله سه دومین متغیر ($$V_H$$)، اتصالی ($$J_H$$) و متنوع ($$D_H$$) و ناحیه ثابت آن بهوسیله دومین ثابت ($$C_H$$) کد میشود. ایمونوگلوبولینها بر اساس نوع زنجیره ثابت به پنج کلاس IgM، IgD، IgG، IgA و IgE تقسیم میشوند که زنجیره ثابت آنها $$\mu$$، $$\delta$$، $$\gamma$$، $$\alpha$$ یا $$\epsilon$$ است.
CD21، CD19، CD82 و CD225 پروتئینهای غشایی لنفوسیت B هستند که مستقیم به آنتیژن متصل نمیشوند اما پیام ایجاد شده از اتصال آنتیژن به BCR را افزایش میدهند. پروتئینهای سازگاری بافتی ویژه (MHCII) گروه دیگر پروتئینهای غشای لنفوسیت B هستند. این پروتئینها با ارائه آنتیژن به فعال شدن لنفوسیتهای T کمککننده نقش دارند. به علاوه بعضی از پروتئینهای غشای لنفوسیت B فعال ازجمله پروتئینهای B7 و CD40 به تحریک سلول و ترشح آنتیبادی کمک میکنند. این پروتئینها به لیگاند غشای سلولهای T فعال متصل میشود. گیرندههای سیتوکین، گروه دیگری از پروتئینهای غشای لنفوسیت B است. این گیرندهها در پاسخ اینترلوکین و اینترفرونِ لنفوسیتهای T، کلاس آنتیبادیها را تغییر میدهند.
لنفوسیتهای B در مراحل مختلف بلوغ در اندامهای متفاوتی قرار دارند. برای مثال سلولهای بالغ اولیه در گرههای لنفاوی و سلولهای خاطره در بافت پوست یا ریه قرار دارند. مسیر و محل استقرار این سلولها بهوسیله گیرندههای کموکین، اینتگرینها و سلکتینها تعیین میشود. کموکینها مولکولهای کوچکی شبیه به سیتوکینها هستند که به حرکت تمام لوکوسیتها ازجمله سلولهای B و T کمک میکنند. اینتگرینها پروتئینهایی با دو زنجیره پلیپپتیدی هستند که به اتصال بسیاری از سلولها به هم کمک میکنند. سلکتینها گلیکوپروتئینهای تکزنجیرهای هستند که به کربوهیدرات سلولهای دیگر متصل میشوند. همکاری این پروتئینها مسیر حرکت و محل استقرار لنفوسیتهای B را تعیین میکند.
مراحل تکامل لنفوسیت B
لنفوسیتهای B پستانداران از تمایز سلولهای رده لنفوئیدی مغز استخوان تولید میشود و مراحل اولیه تکامل را طی میکند. به همین دلیل مغز استخوان اندام لنفاوی اصلی در این جانوران و محلی است که گیرندههای اختصاصی آنتیژن اولین بار بیان میشود. سلولهای استرومای مغز استخوان ماتریکسی برای رشد سلولهای پیشساز B ایجاد و با ترشح سیتوکینها ازجمله اینترلوکین ۱۷ (IL17) به تمایز این سلولها کمک میکنند. سلولهای خونساز مغز استخوان ابتدا به سلولهای اجدادی چندتوان و سپس به سلولهای اجدادی مشترک لنفوئیدی تمایز مییابد. مراحل بعدی تکامل این سلولها به بازآرایی ژنهای زنجیره سبک و سنگین آنتیبادی بستگی دارد.
اولین رده سلولهای B با نوترکیبی دومینهای ژنی $$D_H$$ و $$J_H$$ تولید میشود. گلیکوپروتئینهای CD19 از پروتئينهای اختصاصی غشای این سلولها است که در تمام ردههای سلول B به جز پلاسموسیتها وجود دارد. CD10 گلیکوپروتئینهای دیگر غشای سلولهای B این رده و رده بعدی است. سلولهای B رده بعدی از بازآرایی ژنهای $$V_H$$، $$J_H$$ و $$D_H$$ تولید میشود. در غشای این سلولها CD19 و CD10 وجود دارد. بیان گیرندههای سلول B یکی از ویژگیهای اختصاصی سلولهای این رده است. اگر بازآرایی دومینهای ژنی به شکلی انجام شود که گیرنده سلول B عملکردی تولید نشود، سلول با آپوپتوز از بین میرود. گیرنده این سلولها از یک زنجیره $$\mu$$، پروتئینهای جایگزین زنجیره سبک (CD179a و CD179B)، ایمونوگلوبولین آلفا و ایمونوگلوبولین بتا تشکیل شده است. در مرحله بعدی تکامل لنفوسیتهای B نوترکیبی زنجیره سنگین ایمونوگلوبولین و بیان پروتئینهای جایگزین زنجیره سبک متوقف، و نوترکیبی ژنهای زنجیره سبک شروع میشود.
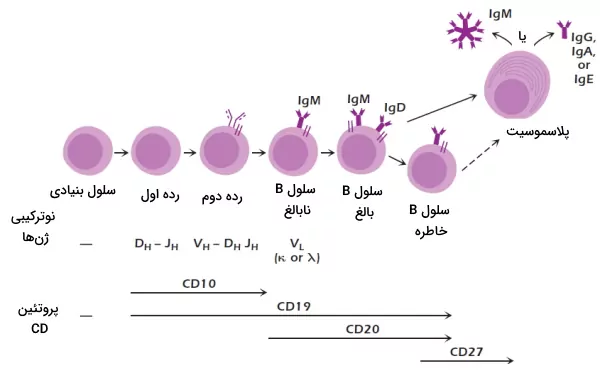
در مرحله بعدی بلوغ لنفوسیتهای B، زنجیره سبک کنار زنجیره سنگین قرار میگیرد و ایمونوگلوبولین M مونومری را تشکیل میدهد. ایمونوگلوبولین M در غشا کنار دیمر ایمونوگلوبین آلفا/بتا قرار میگیرد و گیرنده اصلی سلول B تشکیل میشود. به سلولهای این رده لنفوسیتهای B نابالغ گفته میشود و گلیکوپروتئین CD20 غشا این سلولها را از سایر سلولهای B متمایز میکند. در مرحله بعدی لنفوسیتهای B نابالغ وارد فرایند انتخاب منفی میشوند.
سلولهایی که پس از انتخاب منفی زنده میمانند، لنفوسیتهای انتقالی نام دارند. بیان ژن ایمونوگلوبولین D در این سلولها شروع میشود. سلولهای انتقالی، اولین رده سلولهای B هستند که به فاکتور BAFF پاسخ میدهند. BAFF فاکتور لنفوسیت B و از خانواده فاکتورهای نکروز تومور است که از مونوسیتها، سلولهای دندریتی و سلولهای استرومای مغز استخوان ترشح میشود و سیگنال بقای سلولهای B است.
سلولهای B بالغ یا اولیه رده بعدی سلولهای B هستند. در غشای این سلولها ایمونوگلوبولین D بیشتری نسبت به سلولهای B انتقالی وجود دارد. بخشی از این سلولها در فولیکولهای اولیه و ثانویه گرههای لنفاوی و بخشی از آنها در ناحیه حاشیهای طحال مستقر میشوند. این سلولها پس از برهمکنش با آنتیژن به سلولهای B خاطره و پلاسموسیتها تمایز مییابد.
انتخاب منفی سلول های B چیست؟
نوترکیبی ژنتیکی ممکن است منجر به تشکیل گیرندههایی شود که آنتیژنهای سطح سلولهای خودی را شناسایی و پاسخ ایمنی ایجاد میکنند. به همین دلیل گیرنده سلولهای B نابالغ پیش از خروج از مغز استخوان، بهوسیله انتخاب منفی بررسی میشود. در این فرایند سلولهای B با آنتیژنهای سطحی سلولهای استرومای مغز استخوان برهمکنش میدهند. لنفوسیتهای B نابالغی که به آنتیژن غشای این سلولهای متصل شود بهوسیله آپوپتوز از بین میرود و لننفوسیتهایی که نسبت به این آنتیژنها خنثی هستند، مغز استخوان را پس از ۲۴ ساعت به مقصد اندامهای لنفاوی ثانویه ترک میکنند.
انواع لنفوسیت B
لنفوسیتهای B را بر اساس طول عمر، عملکرد و محل استقرار به انواع پلاسمابلاست، پلاسموسیت، سلولهای B خاطره، سلولهای B1، سلول B2 و سلولهای B تنظیمی تقسیم میکنند.
- پلاسمابلاست: پلاسمابلاستها سلولهای B تمایزیافته با طول عمر کوتاه هستند که تکثیر میشوند و آنتیبادی ترشح میکنند. اما تمایل آنتیبادی آنها به آنتیژن کمتر از پلاسموسیتها است. این سلولها با فعال شدن مستقل از لنفوسیتهای T و معمولا در مراحل اولیه آلوده شدن بدن تولید میشوند.
- پلاسموسیت: پلاسموسیتها سلولهایی با طول عمر زیاد هستند که آنتیبادی ترشح میکنند اما تکثیر نمیشوند. این سلولها دیرتر از پلاسموسیتها و با کمک لنفوسیتهای T تولید میشود. تمایل آنتیبادیهای این سلولها به آنتیژن بیشتر است. گیرندههای شناسایی آنتیژن در غشای این سلولها وجود ندارد. CD27 غشا این سلولها را سایر سلولهای B متمایز میکند.
- سلولهای B1: این سلولها بیشتر در حفره شکمی و حفره قفسه سینه قرار دارند. CD5 پروتئین اختصاصی غشای این سلولها است که در سایر سلولهای B وجود ندارد. این سلولها مستقل از لنفوسیتهای T فعال میشوند و به دفاع اولیه در برابر باکتریهای خون کمک میکنند.
- سلول B2: این سلولها در فولیکولهای گره لنفاوی و ناحیه حاشیهای طحال قرار دارند. بیشتر سلولهای فولیکولار در تولید پلاسموسیتها نقش دارند. ناحیه حاشیه طحال مقدار زیادی خون دریافت میکند. سلولهای B2 این ناحیه از اولین گلبولهای سفیدی هستند که با پاتوژنهای خون برخورد میکنند. این سلولها با دو روش مستقل و وابسته به لنفوسیتهای T فعال میشوند. اما فعال شدن بیشتر آنها مستقل از لنفوسیتهای T است.
- سلولهای B تنظیمی: سلولهای B تنظیمی با ترشح IL-10، IL-35 و $$TGF\beta$$ فعال شدن لنفوسیتهای B را مهار و لنفوسیتهای T تنظیمی را فعال میکنند.
لنفوسیت B خاطره چیست؟
لنفوسیتهای B بالغ پس از اتصال به آنتیژن با میتوز تقسیم میشوند و کلونی از سلولهای B با آنتیبادی غشایی اختصاصی آنتیژن تولید میکنند. از تمایز این سلولها پلاسموسیتها و سلولهای B خاطره ایجاد میشود. لنفوسیتهای B خاطره برخلاف پلاسموسیتها گیرنده اتصالی به آنتیژن دارند و سالها در بدن باقیمیماند. BCR این سلولها شبیه کلونی است که از آن تمایز یافتهاند و در برخورد بعدی با همان آنتیژن پاسخ سریعتری ایجاد میکند.
فعال شدن لنفوسیت B
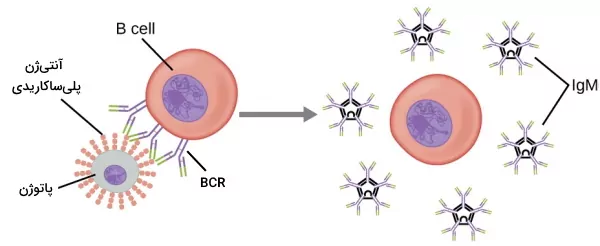
در بخشهای قبلی این مطلب از مجله فرادرس اشاره کردیم که لنفوسیتهای B با کمک لنفوسیتهای T و مستقل از این گلبولهای سفید فعال میشوند. سلولهای B بالغ در پاسخ به آنتیژنهای غیر پروتئینی (پلیساکاریدها یا لیپوپلیساکاریدها) متصل به غشای پاتوژن، مستقل از لنفوسیتهای T فعال میشوند. اتصال چند BCR به توالیهای تکراری آنتیژنها اولین پیام فعال شدن لنفوسیت B است. پیام دوم فعال شدن سلولها از اتصال کمکگیرندهها به پروتئینهای سیستم کمپلمان یا گیرندههای تول لایک ایجاد میشود.
در ناحیه سیتوپلاسمی ایمونوگلوبولینهای آلفا و بتا توالی آمینواسیدی به نام موتیف فعال شدن گیرنده ایمنی تیروزینی (Immunoreceptor Tyrosine-based Activation Motif| ITAMs) قرار دارد. در این مسیر اتصال آنتیژن به گیرنده با فسفوریله شدن موتیف ITAM بهوسیله کینازهای Fyn و Lyn همراه است. فسفوریله شدن این موتیف کینازهای بیشتر و این کینازها پروتئینهای اتصالی به سلول بی (BLNK) را فعال میکنند. این پروتئینها فعالیت آنزیمی ندارند اما جایگاه اتصال به تعداد زیادی از پروتئینهای انتقال پیام در ساختار آنها وجود دارد. فسفولیپاز C یکی از پروتئینهای مهمی است که به BLNK متصل میشود. این آنزیم لیپیدهای فسفاتیدیل اینوزیتول بیس فسفات غشای لنفوسیت را به اینوزیتول تریفسفات (IP3) و دیآسیل گلیسرول (DAG) تجزیه میکند.
IP3 با اتصال به کانالهای شبکه اندوپلاسمی به خروج کلسیم از این اندامک و افزایش کلسیم سیتوپلاسم کمک میکند. DAG پروتئین کیناز C را فعال میکند. این آنزیم با آبشاری از واکنشهای فسفوریلاسیون فاکتور رونویسی $$NF-\kappa B$$ را فعال میکند. به علاوه DAG با Ras (آنزیم GTPase) برهمکنش میدهد و مسیر کینازهای پروتئین فعال میتوزی (MAP) را فعال میشود. در نهایت فاکتورهای رونویسی AP-1 و NFAT فعال شده و بیان ژنهای میتوز، گیرندههای سیتوکینها و آنتیبادی افزایش مییابد. در نتیجه کلونی از سلولهای B تشکیل میشود که به پلاسموسیتها تمایز مییابد. سلولهای B خاطره در مسیر فعال شدن مستقل از لنفوسیتهای T تولید نمیشود. پاسخ سریع پلاسموسیتها با ترشح ایمونوگوبینهای M ایجاد میشود.
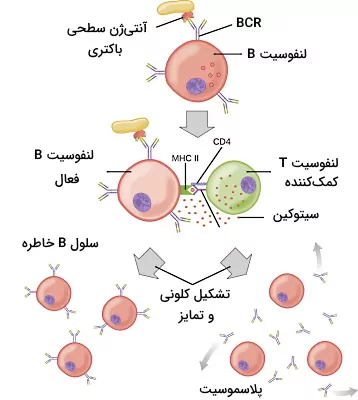
لنفوسیتهای B بالغ برای پاسخ به آنتیژنهای پروتئینی محلول در خون و لنف یا پروتئینهای غشای پاتوژنها به لنفوسیتهای T کمککننده نیاز دارند. در این مسیر اتصال آنتیژن محلول به BCR با اندوسیتوز آنتیژن همراه است. آنتیژنهای سطحی قبل از ورود به سلول از غشای پاتوژن جدا میشوند. آنتیژن پس از پردازش و اتصال به مولکولهای MHCII به سطح سلولهای B بر میگردد.
گیرنده T مخصوص این آنتیژن در غشای سلولهای T کمککننده، آنتیژن را شناسایی میکند و CD4 غشای Th2 به مولکول MHCII متصل میشود. این برهمکنش سنتز و ترشح سیتوکینها در Th2 را تحریک میکند. سیتوکینها به گیرندههای کمکی لنفوسیت B متصل میشود و واکنشهای فسفوریلاسیونهای سیتوپلاسم، بیان ژن پروتئینهای میتوز و سنتز آنتیبادیها را افزایش میدهد. در نتیجه کلونی از سلولهای B فعال تشکیل میشود که بخش زیادی از آنها به پلاستوسیتها و بخش کمی از آنها به سلولهای B خاطره تمایز مییابد. پس از ترشح ایمونوگلوبولینهای M اتصال سیتوکینها به گیرنده غشای لنفوسیت B، تغییر کلاس ژنهای آنتیبادی را فعال میکند. در تغییر کلاس بخش شناساییکننده آنتیژن ثابت است و ناحیه اتصالی به مولکولهای زیستی (دومین ثابت) آنتیبادی تغییر میکند. برای مثال در این حالت آنتیبادیهای G و A تولید شده به یک نوع آنتیژن متصل میشود.
نقش آنتی بادی
در بخش اول این مطلب توضیح دادیم که آنتیبادیها بر اساس ناحیه ثابت زنجیره سنگین به انواع IgG، IgM، IgA، IgE و IgD تقسیم میشوند. ساختار اصلی این آنتیبادیها یکسان است اما بعضی از آنها در حالت مونومری و بعضی از آنها در حالت اولیگومری فعال هستند. آنتیبادیهای G، D و E ساختار مونومری، آنتیبادیهای A ساختار دیمری و آنتیبادیهای M ساختار پنتامری دارند. زیرواحدهای آنتیبادی A و M بهوسیله پیوندهای دیسولفیدی و زنجیره پلیپپتیدی J به هم متصل میشوند.

به علاوه هر یک از این آنتیبادیها عملکرد متفاوتی دارد. این پروتئینها با آگلوتیناسیون، اوپسونیزاسیون، خنثی کردن توکسین، فعال کردن سیستم کمپلمان و خنثی کردن ویروس به سیستم ایمنی کمک میکنند. به علاوه آنتیبادی G با عبور از جفت و آنتیبادی A همراه شیر مادر به بدن نوزاد انتقال پیدا میکند. این دو آنتیبادی نقش مهمی در شکلگیری سیستم ایمنی اولیه جنین و نوزاد دارند.
- در آگلوتیناسیون، آنتیبادیها به آنتیژن آزاد یا آنتیژن سطحی میکروبها متصل میشود. این اتصال با تشکیل تودههای باکتری یا رسوب آنتیژنهای آزاد همراه است. ایمونوگلوبولینهای G و M در آگلوتیناسیون شرکت میکنند.
- اوپسونیزاسیون فرایندی است که با برهمکنش مکانیسمهای دفاع اختصاصی و ذاتی ایجاد میشود. در این فرایند فاگوسیتها (ماکروفاژ، نوتروفیل و سلولهای دندریتی) ناحیه ثابت آنتیبادیهای متصل به آنتیژن سطحی را شناسایی و فاگوسیتوز میکنند.
- گیرنده ناحیه ثابت آنتیبادیها علاوه بر فاگوسیتها در غشای سلولهای کشنده طبیعی وجود دارد. این سلولها آنتیبادی متصل به میکروب یا سلولهای توموری را شناسایی و با آزاد کردن وزیکولهای سیتوپلاسمی سلول را از بین میبرند. آنتیبادی G به آنتیژنهای توموری متصل میشود.
- سیستم کمپلمان به مجموعهای از پروتئینهای پلاسما گفته میشود که با افزایش فاگوسیتوز یا لیز کردن میکروبها به سیستم ایمنی کمک میکنند. در مسیر کلاسیک این سیستم، اولین پروتئین مکمل به آنتیبادی-آنتیژن سطحی متصل میشود. اتصال پروتئینهای بعدی با تشکیل کانالهای پروتئینی در غشای میکروب و لیز شدن سلول همراه است. ایمونوگلوبولین M و G به پروتئینهای این سیستم متصل میشوند.
- اتصال ایمونوگلوبولین G به توکسین باکتریها، اثر توکسین بر بافتها را مهار میکند.
- اتصال آنتیبادی به پروتئینهای اتصال به میزبان پوشش ویروس یا پروتئینهای لازم برای رهایش DNA یا RNA، ویروسها را خنثی میکند. آنتیبادیهای G و A با اتصال به ویروسها به سیستم ایمنی کمک میکنند.
تفاوت لنفوسیت B و لنفوسیت T چیست؟
لنفوسیتهای T گلبولهای سفید دیگر دفاع اختصاصی بدن هستند. این سلولها با کمک لنفوسیتهای B، نوتروفیلها، بازوفیلها، ماستسلها و ائوزینوفیلها از بدن در برابر پاتوژنهای مختلف محافظت میکنند. لنفوسیتهای B آنتیژنهای ویروسی، باکتریایی و انگلی موجود در مایعات بدن را شناسایی میکنند. اما وظیفه اصلی لنفوسیتهای T از بین بردن سلولهای آلوده به ویروس و توموری است. در این بخش از مطلب مجله فرادرس تفاوت گیرندهها، مراحل تکامل و مکانیسم عمل لنفوسیتهای B و T را توضیح میدهیم.
تفاوت گیرنده سلول B و لنفوسیت T
یکی از تفاوتهای لنفوسیت B و T در این است که لنفوسیتهای T فقط آنتیژنهای متصل به گیرنده سلولهای ارائهدهنده آنتیژن (ماکروفاژ، سلولهای دندریتی و سلولهای B) را شناسایی میکنند. گیرنده آنتیژنی لنفوسیت تی (TCR) شباهت زیادی به گیرنده آنتیژنی لنفوسیت B دارد. به علاوه پروتئینهای CD غشای این سلولها نشانههای تمایزی انواع سلولهای T است و در اتصال به سلولهای ارائهدهنده آنتیژن نقش دارد.
گیرنده بیشتر سلولهای T برخلاف گیرنده لنفوسیت B از دو زنجیره پپلیپپتیدی آلفا و بتا، و در تعداد کمی از این سلولها از زنجیره گاما و دلتا تشکیل شده است که با پیوند دیسولفیدی به هم متصل میشود. این گلیکوپروتئینها از دومینهای ثابت و متغیر، و بخش کوچک درونغشایی تشکیل شده است. این گیرندهها برخلاف گیرندههای لنفوسیت B آنتیژنهای پپتیدی کوچک را شناسایی میکنند و تنها یک جایگاه اتصال به آنتیژن دارند. به علاوه ناحیه لولا در ساختار زنجیره سنگین گیرندههای لنفوسیت B انعطافپذیری این پروتئینها نسبت به گیرندههای لنفوسیت T را افزایش میدهد. گیرندههای لنفوسیت B در غشا و پس از ترشح به آنتیژنها متصل میشوند. اما شکل ترشحی گیرندههای لنفوسیت T وجود ندارد.
جهشهای ژنتیکی دومینهای ثابت و متغیر گیرندههای لنفوسیت B تمایل این پروتئینها به آنتیژن و کلاس آنتیبادیها را در طول پاسخ ایمنی تغییر میدهد. اما دومینهای ثابت و متغیر گیرندههای لنفوسیت T پس از اتصال به آنتیژن تغییر نمیکند. در ژن زنجیره آلفا و بتای گیرندههای لنفوسیت T مثل زنجیره سبک گیرنده لنفوسیت B دو جایگاه J و V وجود دارد. اما ژن زنجیرههای گاما و دلتا از سه جایگاه J، V و D تشکیل شده است.
هر گیرنده آنتیژنی لنفوسیت T بهوسیله برهمکنشهای غیرکووالانسی به یک مولکول CD3 و دو زنجیره پلیپپتیدی کاملا مشابه زتا متصل است. این پروتئینها مثل دیمر آنتیبادی آلفا/بتا در غشای لنفوسیتهای B به انتقال پیام در سیتوپلاسم کمک میکنند. CD3 از سه زنجیره گاما، دلتا و اپسیلون تشکیل شده است که به شکل دیمرهای گاما اپسیلون و دلتا اپسیلون در غشا قرار میگیرند. در ناحیه سیتوپلاسمی هر دیمر CD3 دو و در هر زنجیره زتا سه موتیف فعال شدن بر اساس تیروزین (ITAM) وجود دارد.
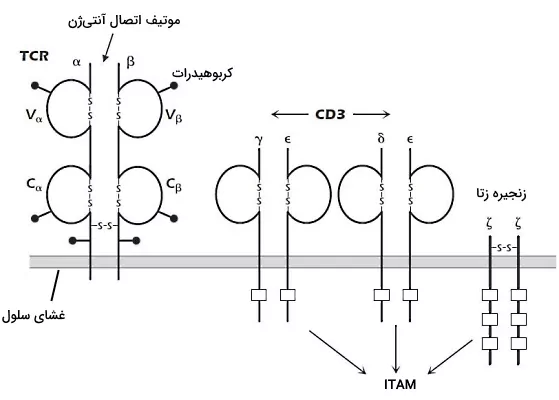
در غشای لنفوسیت T مثل لنفوسیت B پروتئینهای کمکگیرنده وجود دارد که تحریک آنها پاسخ ایمنی را افزایش میدهد. CD4 و CD8 کمکگیرنده انواع لنفوسیت T است. CD4 از یک و CD8 از دو زنجیره گلیکوپروتئینی تشکیل شده است. CD4 به MHCI و CD8 به MHCII متصل میشود. لنفوسیتهای T بالغ مثل لنفوسیتهای B بالغ برای فعال شدن به دو سیگنال نیاز دارند. سیگنال اول از برهمکنش آنتیژن-MHC با TCR و سیگنال دوم از برهمکنش پروتئینهای کمک محرک با پروتئینهای غشای سلولهای ارائهدهنده آنتیژن ایجاد میشود. CD28 یک از پروتئینهای کمک محرک لنفوسیت T است که با پروتئینهای خانواده B7 در غشای سلولهای ارائهدهنده آنتیژن برهمکنش میدهد. این برهم کنش ترشح IL-2 (فاکتور رشد لنفوسیت T) را تحریک میکند. CD40 کمک محرک دیگر غشای لنفوسیت T است که با پروتئینهای CD40 غشای ماکروفاژها، سلولهای دندریتی و سلولهای B برهمکنش میدهد.
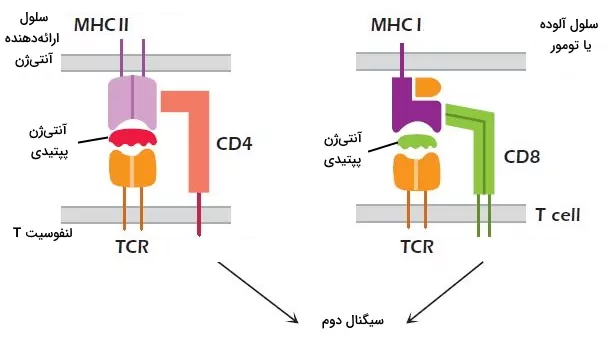
مولکولهای چسبنده غشای لنفوسیت T حرکت این سلولها اطراف سلولهای ارائهدهنده آنتیژن را کاهش و زمان در دسترس برای بررسی مولکول MHC را افزایش میدهد. پروتئینهای اتصالی و گیرندههای کموکین غشای لنفوسیتهای T مثل لنفوسیتهای B در مسیر حرکت و محل استقرار این سلولها نقش دارند. پروتئین L-سلکتین سلولهای T بالغ را به گرههای لنفاوی و اینتگرین $$\alpha_4\beta_7$$ این سلولها را به بافت مخاطی هدایت میکند.
تفاوت تکامل سلول B و لنفوسیت T
لنفوسیتهای T مثل لنفوسیتهای B از تمایز سلولهای رده لنفوئیدی در مغز قرمز استخوان تولید میشوند. اما مراحل بلوغ آنها در تیموس کامل میشود. تیموس یکی از اندامهای لنفاوی ثانویه است که در قفسه سینه بالای قلب قرار دارد. یکی دیگر از تفاوتهای لنفوسیتهای B و T این است که تمایز سلولهای T پس از بلوغ به دلیل کاهش اندازه تیموس، کاهش مییابد. کمکگیرندههای CD4 و CD8 در سلولهای اجدادی لنفوئیدی مشترک وجود ندارد. این سلولها در تیموس بین شبکهای از سلولهای اپیتلیال قشر و مدولای تیموس، و سلولهای دندریتی قرار دارند. سلولهای دندریتی تیموس از تمایز سلولهای بنیادی مغز استخوان تشکیل میشود. در غشای سلولهای دندریتی و اپیتلیال تیموس مولکولهای MHCI و MHCII وجود دارد که به تکامل لنفوسیتهای T کمک میکند. به علاوه این سلولها مثل سلولهای استرومای مغز استخوان اینترلوکین ۱۷ (IL17) ترشح میکنند. این سیتوکین به تکثیر و بقای لنفوسیتها کمک میکند.
در مرحله اول تکامل تیموسی با بیان آنزیمهای ریکامبیناز و دئوکسی ریبونوکلئوتیدیل ترانسفراز بازآرایی ژنتیکی زنجیرههای گاما، دلتا و بتای TCR شروع میشود. ژن زنجیره بتا در سلولهای با بازآرایی بهتر ژن دلتا و گاما، خاموش میشود. این لنفوسیتها از تیموس خارج شده و در بافت اپیتلیال محیطی بدن مستقر میشوند. در سلولهایی که بازآرایی ژن بتا بهتر است، پروتئینهای CD3، زتا و پیشزنجیره آلفا بیان میشود. در مرحله دوم تکامل بیان ژنهای پیشزنجیره آلفا کاهش یافته و با افزایش بیان آنزیم ریکامبیناز، بازآرایی ژن زنجیره آلفا شروع میشود. به علاوه کمکگیرندههای CD8 و CD4 در این مرحله بیان میشوند.
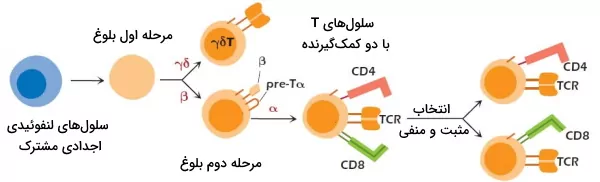
پس از جدا شدن لنفوسیتهای CD4 و CD8 در انتخاب مثبت و منفی بازآرایی زنجیرههای پلیپپتدی آلفا پایان مییابد و لنفوسیتهای T بالغ از تیموس خارج میشود. این سلولها بر اساس گیرندههای کموکین و پروتئینهای اتصالی به سلولهای دیگر در بخشهای مختلف سیستم لنفاوی بدن مستقر میشوند. این سلولها پس از اتصال به آنتیژن کلونی تشکیل میدهند که به سلولهای عملکننده و خاطره تمایز مییابد. سلولهای T خاطره مثل سلولهای B خاطره در برخورد مجدد با آنتیژن سریعتر پاسخ ایمنی ایجاد میکنند.
سلولهای کشنده طبیعی، گلبولهای سفید دیگری هستند که از تمایز سلولهای لنفوئیدی اجدادی مشترک در تیموس تولید میشوند. در غشای این سلولها علاوه بر TCR، پروتئینهای N1K1 بیان میشود که بین این سلولها و سایر لنفوسیتها تمایز ایجاد میکند. این سلولها زمانی ایجاد میشوند که نوترکیبی ژنی سبب سنتز گیرنده آنتیژنی حساس به گلیکولیپیدهای CD1d در غشای سلولهای اپیتلیال تیموس میشود.این سلولها در ایمنی ذاتی و اختصاصی بدن شرکت میکنند.
انتخاب مثبت و منفی لنفوسیت های T
انتخاب مثبت و منفی دو فرایند مجزا است که سلولهای T را براساس کمکگیرندهها جدا میکند. در پایان این فرایند در بعضی از سلولهای T پروتئین CD4 و در بعضی از این سلولها CD8 بیان میشود. در مرحله اول (انتخاب مثبت) سلولهایی که دو پروتئین CD4 و CD8 را دارند با مولکولهای MHCI و MHCII سلولهای اپیتلیال قشر تیموس برهمکنش میدهند. به MHC این سلولها آنتیژنهای پپتیدی سلولهای خودی بدن متصل است. سلولهای T که با یکی از مولکولهای MHC با تمایل بیشتری برهمکنش میدهد، زنده باقی میماند. بیان CD4 در سلولهایی که MHCI پاسخ میدهند، کاهش و بیان CD8 در این سلولها افزایش میدهد. به طور متقابل، بیان CD8 در سلولهایی که به MHCII پاسخ میدهند، کاهش و بیان CD4 در این سلولها افزایش مییابد.
در مرحله دوم (انتخاب منفی) لنفوسیتهای T که با MHC سلولهای خودی اتصال محکم برقرار میکنند برای جلوگیری از ایجاد بیماریهای خودایمنی با آپوپتوز حذف میشوند. در این مرحله لنفوسیتهای T با آنتیژن-MHC غشای سلولهای دندریتی قشر یا مدولای تیموس، یا سلولهای اپیتلیال مدولا برهمکنش میدهد. در غشای لنفوسیتهای T کشنده CD8 و در غشای سلولهای T کمککننده CD4 وجود دارد.
تفاوت عملکرد لنفوسیت T و سلول B
اگر در بخشهای قبلی این مطلب با ما همراهی کرده باشید، متوجه شدید که لنفوسیتهای T مثل لنفوسیتهای B به دو سیگنال برای فعال شدن نیاز دارند. در نبود سیگنال دوم، سیگنال اول منجر به غیرفعال شدن لنفوسیت T میشود. به علاوه متوجه شدیم که لنفوسیتهای T به آنتیژن متصل به MHC سلولهای ارائدهدهنده آنتیژن واکنش میدهند. سلول های دندریتی انواعی از گلبولهای سفید است که از تمایز سلولهای بنیادی میلوئیدی در مغز استخوان تولید میشود و سلولهای ارائهدهنده آنتیژن اصلی در فعال شدن لنفوسیتهای است. سلولهای دندریتی به دو گروه اصلی پلاسماسیتوئید و میلوئید تقسیم میشوند. سلول دندریتی پلاسماسیتوئید با ترشح اینترفرون آلفا و بتا به مراحل اولیه پاسخ ذاتی بدن و سلول دندریتی میلوئید با فعال کردن لنفوسیتهای T به دفاع اکتسابی کمک میکنند.
در غشای سلولهای دندریتی نابالغ گیرندههای شناساییکننده الگو، گیرنده فاگوسیتوز و تعداد کمی مولکول MHC وجود دارد. بعد از اتصال آنتیژن به گیرندههای فاگوسیتوز، پاتوزن وارد سیتوپلاسم سلول شده و در فاگولیزوزوم آنتیژن آن جدا میشود. آنتیژن پس از پردازش به مولکولهای MHC II متصل و به غشای پلاسمایی منتقل میشود. این سلولها پس از فعال شدن از بافت آلوده به گرههای لنفاوی منتقل میشود و آنتیژن را در اختیار لنفوسیتهای T کمککننده (Th) قرار میدهد. برهمکنش آنتیژن با TCR، کمکگیرنده CD4 با MHC و پروتئینهای کمک محرک در غشای لنفوسیت T با سلولهای دندریتی، تیروزین کینازهای Fyn و Lck را فعال میکند. این کینازها مسیر انتقال پیام سلولی مشابه لنفوسیتهای B را فعال میکنند. در این مسیر فسفولیپاز C فعال شده و اینوزیتول بیش فسفات غشا را به IP3 و DAG تجزیه میکند. این مولکولها با افزایش غلظت کلسیم سیتوپلاسم و فعال کردن فاکتورهای رونویسی بیان ژنها را تغییر میدهند.
بخش اصلی ژنهای فعال شده مربوط به سیتوکینها است. این سیتوکینها فعالیت سلولهای Tدیگر، سلولهای B، سلولهای مغز استخوان و گلبولهای سفید ایمنی ذاتی را تغییر میدهد. IL2 یکی از ژنهایی است که در لنفوسیتهای T فعال بیان میشود. این سیتوکین فاکتور رشد لنفوسیتهای T است و به گیرندههای سلولی که از آن ترشح شده و سلولهای کلون تازه تشکیل شده متصل میشود. در پایان این مرحله سلولهای T به سلولهای عملکننده و خاطره تمایز مییابد. بیان پروتئینهای اتصالی در سلولهای T عملکننده تغییر میکند. در نتیجه این سلولها از گرههای لنفاوی خارج شده و به بافت آلوده مهاجرت میکنند. Th خروجی از گرههای لنفاوی یکی از سلولهای Th1، Th2 یا Th17 است.
- سلولهای Th1: از اتصال IL-12 به گیرندههای سیتوکین لنفوسیت T بالغ سلولهای Th1 تشکیل میشود. IL-12 در مراحل اولیه آلودگی داخلی سلولی با باکتری و ویروس از سلولهای دندریتی و سلولهای کشنده طبیعی ترشح میشود. سلولهای Th1 با ترشح اینترفرون گاما و IL2 ماکروفاژها، لنفوسیتهای T کشنده و سلولهای کشنده طبیعی را فعال میکنند. اینترفرون گاما با اتصال به گیرندههای سلول B کلاس آنتیبادیها را تغییر میدهد.
- سلولهای Th2: این سلولها از تمایز لنفوسیتهای T بالغ، پس از اتصال IL-4 به گیرنده در پاسخ به آلودگی انگلی تولید میشود. این سیتوکین از ماستسلها، سلولهای T کمککننده فعال و سلولهای کشنده طبیعی ترشح میشود. فعال شدن این سلولها با ترشح IL-4، IL-5 و IL-13 همراه است. اتصال IL-4 و IL-13 به گیرندههای سیتوکین سلولهای B سبب تغییر کلاس آنتیبادیها از E به G میشود و IL-5 ائوزینوفیلها را فعال میکند.
- سلولهای Th17: سلولهای Th17 از اثر همزمان IL21، IL6 و «فاکتور رونویسی دگرگونی بتا» ($$Transforming Growth Factor \beta | TGF-β$$) بر لنفوسیت T بالغ تولید میشود. این سلولها با ترشح IL-17، IL-21 و IL-22 به سیستم ایمنی کمک میکنند. IL-17 و IL-22 فاکتورهای پیشالتهابی هستند. به علاوه IL-17 بسیاری از گلبولهای سفید ایمنی ذاتی بدن را فعال میکند. این سلولها به ایجاد پاسخ ایمنی در برابر باکتریهای خارج سلولی و قارچها کمک میکنند.

فعال شدن و انتقال پیام سلولی در لنفوسیتهای T کشنده (CD8) مثل لنفوسیتهای T کمککننده است. با این تفاوت که این سلولها آنتیژن ویروسی یا توموری متصل به MHC I را شناسایی میکنند. مولکولهای MHCI در تمام سلولهای هستهدار بدن و MHCII فقط در سلولهای ایمنی بیان میشود. سلولهای CD8 با دو مکانیسم، آپوپتوز سلولهای هدف را فعال میکند. در مکانیسم اول گرانولهای سیتوپلاسمی حاوی پرفورین و گرانزیم پس از فعال شدن لنفوسیت آزاد میشود. پرفورینها پروتئینهایی هستند که با تشکیل کانال نفوذپذیری غشای سلولهای هدف را تغییر میدهند. گرانزیم سرین پروتئاز گرانولهای لنفوسیت T است. این آنزیم از کانالهای پرفورین وارد سیتوپلاسم شده و مسیر آپوپتوز را فعال میکند. مکانیسم دوم، برهمکنش پروتئینهای FasL در غشای لنفوسیت CD8 و Fas در غشای سلول هدف است. اتصال این دو پروتئین، آنزیمهای کاسپاز مسیر آپوپتوز را فعال میکند و منجر به مرگ سلول میشود.
جمعبندی
در این مطلب از مجله فرادرس توضیح دادیم که لنفوسیت B یکی از گلبولهای سفید سیستم ایمنی است که مثل سایر سلولهای خونی از تمایز سلولهای بنیادی مغز استخوان تولید میشود. این سلولها و لنفوسیتهای T تنها گلبولهای سفیدی هستند که آنتیژنها را به طور اختصاصی شناسایی میکنند. لنفوسیتهای B بیشتر آنتیژنهای غیرپروتئینی موجود در مایعات بدن و لنفوسیتهای T آنتیژنهای پروتئینی سلولهای آلوده به ویروس و تومورها را شناسایی میکنند. گیرنده آنتیژنی سلولهای B آنتیبادی M است که از چهار زنجیره پلیپپتیدی تشکیل شده و دو مکانیسم وابسته و مستقل از لنفوسیتهای T فعال میشود. اتصال این گیرنده به آنتیژنها با فعال شدن سلول و ترشح آنتیبادیهای M پنتامر، E، A، D و G همراه است. آنتیبادیها به آنتیژن غشایی پاتوژنها، آنتیژن محلول در خون یا لنف و توکسین باکتریها متصل میشود. اتصال آنتیبادی به آنتیژنهای سطحی از ورود پاتوژن به سلولهای سالم جلوگیری میکند و احتمال فاگوسیتوز شدن پاتوژن را افزایش میدهد. بعضی پروتئینهای سیستم کمپلمان آنتیبادی متصل به آنتیزن را شناسایی میکنند و پاتوژن را از بین میبرند. در نتیجه تکثیر و رشد پاتوژن در بدن متوقف میشود.