بیماری خود ایمنی چیست؟ | علل، علائم و درمان بیماری خود ایمنی

خود ایمنی به پاسخ و حمله سیستم ایمنی بدن به سلولها و بافتهای خودی گفته میشود. در ادامه این مطلب مثالهایی از انواع بیماری خود ایمنی و علائم و درمانهای موجود برای آنها توضیح داده شده است.
نقص ایمنی و خود ایمنی
انواع زیادی سندرم نقص ایمنی وجود دارند که خصوصیات بالینی و آزمایشگاهی خود ایمنی را نشان میدهند. کاهش توانایی سیستم ایمنی در رفع عفونت در این بیماران ممکن است مسئول ایجاد خود ایمنی از طریق فعالسازی مضاعف سیستم ایمنی باشد.
خود ایمنی خفیف
خود ایمنی شدید باعث بروز بیماری و از بین رفتن بافتهای خودی میشود اما بیماری خود ایمنی خفیف ممکن است مفید باشد. بر اساس تئوریها و برخی شواهد علمی، خود ایمنی نوعی مکانیسم دفاعی برای حفظ حیات پستانداران است. سیستم ایمنی به طور تصادفی توانایی تشخیص بین خودی و غیر خودی را از دست نمیدهد.
حمله به سلولهای خودی ممکن است ناشی از فرآیندهای متابولیکی باشد که برای حفظ هومئوستازی خون ضرورت دارند. به طور مثال، در شروع ایجاد عفونت در بدن، واکنش سریع و قوی سیستم ایمنی برای مبارزه با پاتوژنهای بیماریزا ضروری است.
مکانیسم خود ایمنی چیست؟
سیستم ایمنی بدن انسان مسئول شناسایی آنتیژنها و پیشگیری از آسیبهای بدن است. اما چه مکانیسمی باعث میشود این سیستم مولکولهای خودی را از پاتوژنها تشخیص دهد؟ تحمل ایمنی مکانیسمی است که در فرایند بلوغ لنفوسیتها این سلولهای ایمنی را نسبت به سلولهای بدن غیرفعال میکند. اختلال در هر یک از مراحل تکامل لنفوسیتها یا جهش ژنتیکی گیرندههای سلولی ایجاد شود، سیستم ایمنی بدن فعال شده و بیماری خودایمنی ایجاد میشود.
تحمل ایمنی
ایجاد پاسخ ایمنی، تحمل و عدم واکنش سه مکانیسمی است که پس از اتصال آنتیژن به رسپتور فعال میشود. برای ایجاد پاسخ ایمنی، پس از اتصال آنتیژن به گیرندههای غشای لنفوسیت این سلول فعال شده و پاتوژن را از بین میبرد. آنتیژنهایی که این پاسخ را فعال میکنند (میکروبها)، ایمونولوژیک نام دارند. تحمل زمانی ایجاد میشود که اتصال آنتیژن به گیرندههای لنفوسیتی با فعال شدن مسیرهای مرگ سلولی (آپوپتوز) یا غیرفعال شدن سلول ایمنی همراه است. به این آنتیژن تولروژنیک گفته میشود و آنتیژنهای خودی در این گروه قرار دارند. اما در حالت سوم لنفوسیت آنتیژن را شناسایی نمیکند. به این آنتیژنها غیرایمونولوزیک گفته میشود. تحمل مرکزی و محیطی دو مکانیسم بدن برای پیشگیری از پاتوژن شناختن آنتیژنهای خودی و بیماری خودایمنی است.
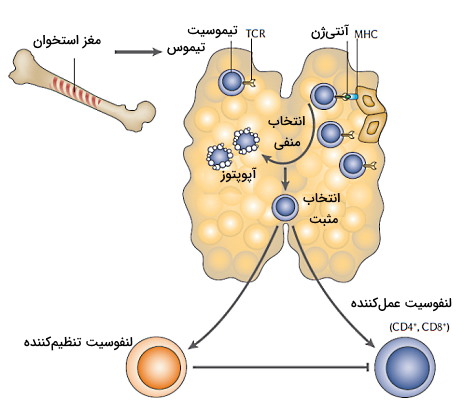
تحمل مرکزی لنفوسیت T
لنفوسیتهای T در مغز قرمز استخوان و از تمایز سلولهای بنیادی لنفوئیدی تشکیل میشوند. اما در تیموس تکامل یافته و اماده ایجاد پاسخ ایمنی میشوند. اتصال گیرندههای سطحی لنفوسیت و آنتیژنها در تیموس مسیر تکامل لنفوسیت را مشخص میکند. این گیرندهها میتوانند میلیونها آنتیژن خودی و ایمونولوژیک را شناسایی کنند.
کمپلکس سازگاری بافتی ویژه ( Major Histocompatibility Complex| MHC) پروتئینی است که در غشای تمام سلولهای هستهدار بدن (MHC I) و سلولهای ایمنی (MHC II) آنتیژنها را در غشای سلول قرار میدهد. اگر اتصال این پروتئینها با گیرنده لنفوسیت T نابالغ (TCR) کاملا مکمل و قوی باشد، مسیر آپوپتوزی فعال شده و لنفوسیت T از بین میرود. به این مکانیسم انتخاب منفی نیز گفته میشود. آنتیژن متصل به MHC پروتئینهای پلاسما و پروتئینهای عرض غشایی مشترک بین تیموس و سلولهای محیطی هستند. فاکتور رونویسی AIRE (تنظیمکننده خودایمنی) بیان ژنهای خودی در تیموس را کنترل میکند. جهش ژن این پروتئین منجر به ایجاد بیماری خودایمنی نادر به نام APECED همراه است. اگر اتصال آنتیژن خودی با لنفوسیت نابالغ کاملا و محکم نباشد، سلول ایمنی به لنفوسیت T تنظیمی تمایز یافته و به بافتهای محیطی منتقل میشود.
تحمل محیطی لنفوسیت T
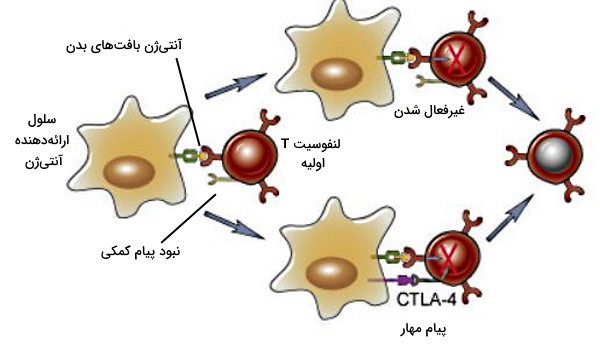
آنرژی، مرگ سلولی و فعالیت لنفوسیتهای T تنظیمکننده سه مکانیسمی است که لنفوسیت خودایمن را در بافتهای مرکزی حذف میکند. فعال شدن لنفوسیت T به تحریک همزمان دو پیام نیاز دارد. اتصال آنتیژن به گیرنده پیام اول و پروتئینهای (B7) غشای سلولهای ارائهدهنده آنتیژن (APCs) که در پاسخ به آنتیژن بیان میشوند، پیام دوم است. سلولهای ارائهدهنده آنتیژن که آنتیژنهای خودی را در دسترس لنفوسیت T قرار میدهند به دلیل فعال نشدن ایمنی ذاتی، غیرفعال هستند.
نبود پیام دوم، فعال شدن لنفوسیت را بهوسیله آنرژی مهار میکند. در این شرایط لنفوسیت T آنتیژن بافت بدن را شناسایی میکند اما مسیرهای دفاعی آن فعال نمیشود. در نتیجه پاسخ ایمنی علیه سلولهای بدن فعال نمیشود. این مکانیسم به تدریج منجر به غیرفعال شدن کامل لنفوسیت T خواهد شد. بهعلاوه CD152 پروتئین غشایی است که در پاسخ به آنتیژنهای بافت خودی بیان میشود. این پروتئین تمایل زیادی به پروتئینهای B7 در غشای سلولهای ارائهدهنده آنتیژن دارد و برهمکنش این دو پروتئین با هم مسیرهای مهاری لنفوسیت T را فعال میکند.
مرگ سلولی
تکرار اتصال گیرنده لنفوسیتی به آنتیژنهای خودی با فعال شدن مسیرهای آپوپتوزی و حذف لنفوسیت خودایمن همراه است. به این مکانیسم مرگ سلولی القاشده بهوسیله فعال شدن میگویند که از دو مسیر انجام میشود.
- اتصال گیرنده-آنتیژن خودی در لنفوسیتهای CD4 بیان گیرنده مرگ Fas و لیگاند آن (FasL) را تحریک میکند. اتصال FasL به خود لنفوسیت T یا لنفوسیت T کناری با فعال شدن کاسپازها و مسیر آپوپتوزی همراه است.
- اتصال گیرنده-آنتیژن خودی بیان پروتئینهای پیشآپوپتوزی را فعال میکند. این مسیر بهوسیله آنتیژنهای ایمونولوژیک نیز فعال میشود، اما پروتئینهای آنتیآپوپتوزی و پیام دوم فعال شدن مرگ سلولی لنفوسیت را مهار میکند.
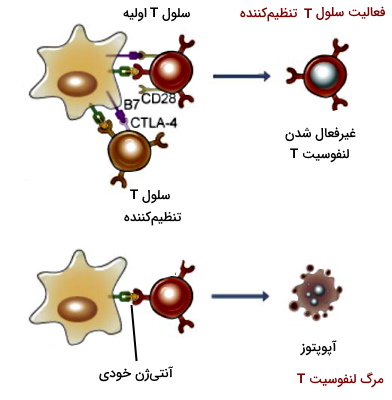
لنفوسیت T تنظیمکننده
لنفوسیتهای تنظیمکننده سلولهای ایمنی هستند که آنتیژنهای خودی را شناسایی میکنند. این لنفوسیتها در تیموس یا بافتهای لنفاوی محیطی (گرههای لنفاوی، طحال، لوزه و غشای مخاطی) تمایز مییابند. پروتئینهای CD4 و CD25 (گیرنده زنجیره آلفا IL2) در غشای پلاسمایی بیشتر این سلولها وجود دارد. این سلولها با ترشح سیتوکین ( و IL10) یا برهمکنش مستقیم، لنفوسیتهای خودایمن را مهار میکند.
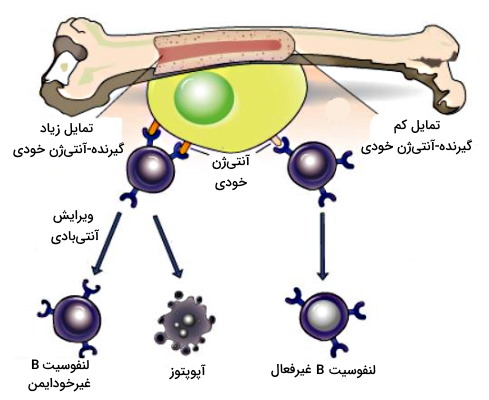
تحمل مرکزی لنفوسیت B
پلیساکاریدها، نوکلئیکاسیدها و لیپیدهای سلولهای خودی آنتیژنهای اصلی هستند که لنفوسیتهای B در مکانیسم تحمل نسبت به آنها غیرفعال میشوند. مکانیسمهای تحمل لنفوسیتهای B بسیار شبیه لنفوسیتهای T است. با این تفاوت که سلولهای B پس از تمایز از سلولهای بنیادی لنفوئیدی در مغز استخوان تکامل مییابد. اتصال گیرنده این سلولها (BCR) به آنتیژنهای غشای پلاسمایی سلولهای خودی یا آنتیژنهای محلول با دو مکانیسم لنفوسیت B خودایمن را غیرفعال میکند.
- مرگ سلولی: اتصال محکم گیرنده-آنتیژن خودی با فعال شدن مسیر آپوپتوزی و انتخاب منفی سلول همراه است.
- تغییر گیرندههای سطح سلولی: اتصال آنتیژن-گیرنده با فعال شدن نوترکیبی ژنهای ایمونوگلوبولین و تغییر ساختار جایگاه اتصال به آنتیژن (زنجیره سبک آنتیبادی) همراه است. در نتیجه لنفوسیت B توانایی شناسایی آنتیژن خودی را از دست میدهد.
تحمل محیطی لنفوسیت B
آنرژی مکانیسمی است که لنفوسیتهای B خودایمن را در بافتهای محیطی غیرفعال میکند. در این شرایط به دلیل اینکه پاتوژن وجود ندارد، سلولهای T کمککننده (Th) غیرفعال هستند. در نتیجه لنفوسیتهای B فقط پیام آنتیژن خودی را دریافت میکند. این پیام برای فعال شدن لنفوسیت B کافی نیست و منجر به غیرفعال شدن سلول میشود. به علاوه تحریک آنتیژنهای از Th برای فعال کردن لنفوسیت B کافی نیست. در نتیجه پاسخ خودایمنی ایجاد نمیشود. این لنفوسیتها از فولیکولهای گره لنفاوی خارج میشود.
علل بیماری خود ایمنی چه هستند؟
خود ایمنی توسط عوامل مختلفی از جمله گرایش ژنتیکی، عفونت، استرس، التهاب و استفاده از دارو ایجاد میشود. برخی تحقیقات نشان می دهند که در افراد مستعد، آسیب به سد رودهای میتواند منجر به افزایش نفوذپذیری روده به نام «بیماری نشت روده» یا «سندرم روده چکه کن» شود که ممکن است در ایجاد برخی از بیماریهای خود ایمنی نقش داشته باشد. برخی افراد از نظر ژنتیکی مستعد ابتلا به بیماریهای خود ایمنی هستند. جهش در سه مجموعه اصلی از ژنها در بسیاری از بیماریهای خود ایمنی دیده میشوند:
- ایمونوگلوبولینها
- گیرندههای سلول T
- مجموعه سازگاری بافتی اصلی (Major histocompatibility complex) (MHC): آنتیژنهای گلبول سفید خون
دو مورد اول که در شناسایی آنتیژنها نقش دارند، ذاتاً متغیر و مستعد نوترکیبی هستند. این تغییرات سیستم ایمنی را قادر میسازند تا به طیف بسیار گستردهای از عوامل بیماریزا پاسخ دهد اما از طرفی ممکن است لنفوسیتهایی را ایجاد کند که قادر به حمله به سلولهای خودی هستند.
نقش عوامل محیطی در بیماری خود ایمنی
به غیر از عوامل مستعد کننده ژنتیکی، برخی دلایل اکتسابی نیز در حمله سیستم ایمنی به سلولهای خودی نقش دارند که در ادامه توضیح دادهایم.
- بیماریهای عفونی و انگلی: یک رابطه معکوس بین بیماریهای عفونی و بیماریهای خود ایمنی وجود دارد. در مناطقی که عفونتهای بومی شایع هستند، بیماریهای خود ایمنی به ندرت دیده میشوند و برعکس این مورد هم صدق میکند. فرضیه بهداشت، این همبستگی را به تغییرات سیستم ایمنیِ ناشی از عوامل بیماریزا نسبت میدهد. طبق برخی مطالعات، عفونت انگلی با کاهش شدت بیماری خود ایمنی همراه است.
انگل به منظور محافظت از خود، پاسخ ایمنی میزبان را کاهش میدهد که برای فردی که همزمان به بیماری خودایمنی مبتلا است، مزیت محسوب میشود. احتمالا ترشح عوامل ضد التهابی یا تداخل در سیگنالینگ ایمنی میزبان از دلایل این فرآیند هستند. از طرفی، برخی میکروبهای خاص با بروز یا تشدید خود ایمنی مرتبط هستند.
به عنوان مثال، باکتری کلبسیلا پنومونیه و کوکساکی ویروس B، به ترتیب با اسپوندیلیت آنکیلوزان و دیابت نوع 1 ارتباط زیادی دارند. این امر با تمایل ارگانیسم آلوده به تولید آنتیژنهای فعالکننده لنفوسیتهای B پلیکلونال و مقادیر زیادی آنتیبادی مربوط است که برخی از آنها باعث بروز پاسخ ایمنی میشوند. - عوامل شیمیایی و داروها: داروهای شیمیایی خاصی با ایجاد خود ایمنی یا شرایط مشابه خودایمنی، همراه هستند. مهمترین نمونه، بیماری لوپوس اریتماتوز ناشی از دارو است. به طور معمول ترک داروی عامل خود ایمنی، باعث رفع بیماری و بهبود علائم خواهد شد. سیگار کشیدن اکنون به عنوان یک عامل خطر عمده برای بروز و شدید شدن بیماری آرتریت روماتوئید شناخته میشود که ممکن است مربوط به سیترولیناسیون غیر طبیعی پروتئینها باشد، زیرا اثرات سیگار کشیدن با تولید آنتیبادی به پپتیدهای سیترولین شده ارتباط دارد.
نقش جنسیت در بیماری خود ایمنی چیست؟

برخی شواهد نشان میدهند که جنسیت ممکن است در ایجاد بیماری خود ایمنی نقش داشته باشد چون اغلب بیماریهای خود ایمنی از نظر وراثت وابسته به جنس هستند. بیماریهای خود ایمنی که شانس ابتلای زنان و مردان در آنها یکسان است عبارتند از:
- اسپوندیلیت آنکیلوزان
- دیابت نوع 1
- گرانولوماتوز همراه با پلی آنژیت
- بیماری کرون
- کلانژیت اسکلروزانکننده اولیه
- پسوریازیس
دلایل نقش جنسیت در خود ایمنی متفاوت است. به نظر میرسد تحریک سیستم ایمنی در زنان، پاسخ التهابی شدیدتری نسبت به مردان ایجاد میکند و با افزایش خطر خود ایمنی همراه است. عامل مؤثر دیگر در ایجاد این بیماریها، مقدار هورمونهای استروئیدی هستند. به عنوان مثال در دوران بارداری، در چرخه قاعدگی یا هنگام استفاده از قرص پیشگیری از بارداری احتمال آغاز یا حمله بیماری خودایمنی بیشتر است. همچنین به نظر میرسد سابقه بارداری احتمال بروز بیماری خود ایمنی را افزایش میدهد. تبادل اندک و مستقيم سلولها بين مادر و جنین طی بارداری، میتواند در این زمینه نقش داشته باشد.
طبق یک نظریه دیگر تمایل زیاد زنان به خود ایمنی به دلیل غیرفعالسازی غیر متعادل کروموزوم X است. نقش غیرفعالسازی کروموزوم X، که توسط جف استوارت از دانشگاه پرینستون ارائه شد، اخیراً به طور آزمایشی در اسکلرودرمی و تیروئیدیت خودایمنی تأیید شده است. در جدول زیر نسبت ابتلا به بیماریهای خود ایمنی در زنان و مردان با یکدیگر مقایسه شدهاند.
| بیماریهای خود ایمنی | نسبت بروز در زن / مرد |
| تیروئید هاشیموتو | ۱۰:۱ |
| بیماری گریوز | ۷:۱ |
| مولتیپل اسکلروزیس (ام اس) | ۲:۱ |
| میاستنی گراویس | ۲:۱ |
| لوپوس اریتماتوی سیستمیک (SLE) | ۹:۱ |
| روماتیسم مفصلی | ۵:۲ |
| کلانژیت اسکلروزان اولیه | ۱:۲ |
انواع بیماری های خود ایمنی
بیماریهای خودایمنی را میتوان به طور گستردهای به اختلالات خودایمنی سیستمیک و ارگان خاص یا موضعی تقسیم کرد که بستگی به ویژگیهای اصلی کلینیکال و آسیبشناسی بیماری دارد.
- بیماریهای خود ایمنی سیستمیک: شامل بیماری سلیاک، لوپوس اریتماتوز، سندرم شوگرن، سارکوئیدوز، اسکلرودرمی، آرتریت روماتوئید، واسکولیت کریوگلوبولینمیک و درماتومیوزیت است. این نوع خود ایمنی، با آنتیبادی علیه آنتی ژنهایی که خاص بافت نیستند، مرتبط است. بنابراین اگرچه پلیمیوزیت در بافت کمابیش مختص بافت است اما به دلیل وجود آنتیژنهای خودی علیه اغلب آنزیمهای t-RNA سنتتاز، میتواند در این گروه قرار بگیرد.
- سندرمهای محلی: اندام یا بافت خاصی را تحت تأثیر قرار میدهند و عبارتند از:
- غدد درونریز: دیابت نوع 1، تیروئیدیت هاشیموتو، بیماری آدیسون
- دستگاه گوارش: بیماری کرون، کم خونی مخرب
- بیماری پوستی: پمفیگوس ولگاریس، ویتیلیگو
- خونی: کم خونی همولیتیک خودایمن، پورپورای ترومبوسیتوپنی ایدیوپاتیک
- عصبی: مولتیپل اسکلروزیس، میاستنی گراویس، انسفالیت خودایمن، آتاکسی گلوتن
بر اساس طبقهبندی سنتی اختصاصی و غیر اختصاصی اندام، بسیاری از بیماریها در یک گروه قرار میگیرند. با این حال، بسیاری از اختلالات التهابی مزمن انسانی فاقد تجمع سلول ایمنی ناشی از سلول B و T هستند. التهاب علیه خود در بافت لزوماً به پاسخهای غیرطبیعی سلولهای T و B متکی نیست.
بیماری خود ایمنی کبد
در هپاتیت خود ایمنی یا AIH، بدن به سلولهای کبد حمله میکند و میتواند منجر به سیروز کبد و در نهایت نارسایی کبدی شود. اگرچه علت اصلی این بیماری هنوز مشخص نیست اما ریسکفاکتورهای متعددی برای ابتلا به آن وجود دارند:
- سابقه فامیلی هپاتیت خود ایمنی
- سابقه عفونت ویروسی یا باکتریایی
- جنسیت زن
- استفاده از داروهای خاصی مانند ماینوسایکلین
هپاتیت خود ایمنی دو نوع دارد:
- تیپ ۱: شایعتر است و بیشتر در زنان جوان ایجاد میشود و با دیگر بیماریهای خود ایمنی مرتبط است.
- تیپ ۲: اساسا دختران ۲ تا ۱۴ سال را مبتلا میکند.
علائم هپاتیت خود ایمنی عبارتند از:
- بزرگ شدن کبد
- بزرگ شدن عروق خونی زیرپوستی
- تیره شدن ادرار
- روشن شدن رنگ مدفوع
- خستگی
- کاهش اشتها
- تهوع و استفراغ
چون علائم بالینی بسیار شبیه به هپاتیت ویروسی هستند برای افتراق هپاتیت خود ایمنی باید آزمایشاتی جهت رد کردن هپاتیت ویروسی و تستهای آنتیبادی مرتبط با AIH انجام شوند. این آزمایشات شامل موارد زیر هستند:
- آنتیبادی علیه ماهیچه صاف
- آنتی بادی علیه میکروزوم کلیوی - کبدی نوع ۱
- آنتی بادی ضد هسته
- آنتیبادی ایمونوگلوبولین G یا IgG
درمان با مصرف داروهای خوراکی یا در موارد حاد پیوند کبد آغاز میشود. داروها آسیب کبدی را کند، متوقف و گاهی درمان میکنند. تقریباً 65 تا 80 درصد مبتلایان به AIH بهبود مییابند. با این حال، بهبودی ممکن است تا سه سال طول بکشد.

بیماری خود ایمنی غدد
اگر سیستم ایمنی به غدد حمله کند، در اثر کاهش تعداد سلولهای غده، میزان ترشح هورمون کاهش پیدا میکند یا برعکس غده به ترشح مقدار بیشتری هورمون تحریک میشود. در مورد از این بیماریها شامل موارد زیر هستند:
- «بیماری آدیسون» (Addison’s Disease): در این بیماری غده آدرنال که هورمونهای کورتیزول، هورمونهای استروئیدی و آلدوسترون را تولید میکند مورد حمله سیستم ایمنی قرار میگیرد. مقدار بسیار کم کورتیزول بر متابولیسم کربوهیدرات و قند اثر میگذارد. کاهش میزان آلدوسترون منجر به از دست دادن سدیم و افزایش پتاسیم خون میشود. فرد مبتلا به آدیسون علائمی مانند ضعف و خستگی، کاهش وزن و کاهش قند خون دارد.
- «بیماری گریوز» (Graves’ Disease): با هجوم سلولهای ایمنی، غده تیروئید تحریک به ترشح مقادیر زیادی هورمون تیروئید میشود. از آنجایی که این هورمون مسئول تنظیم سوخت و ساز بدن است، مقدار متابولیسم افزایش پیدا میکند که منجر به بروز نشانههایی همچون تپش قلب، ضعف اعصاب، عدم تحمل گرما و کاهش وزن شدید میشود. یکی از نشانههای اصلی و ظاهری این نوع از پرکاری تیروئید، بزرگ شدن چشمها است.
بیماری خود ایمنی تیروئید
تیروئید یک غده کوچک در جلوی گلو است که هورمون تولید میکند. اگر تیروئید به اندازه کافی هورمون تولید نکند اندامهای مختلف بدن نمیتوانند عملکرد خود را انجام دهند و در نهایت سطح انرژی، سلامت قلب و عروق، خلق و خو و وزن دچار تغییر میشوند. گاهی این عدم تولید کافی هورمون به دلیل حمله سیستم ایمنی بدن به غده تیروئید و از بین رفتن سلولهای تولید کننده هورمون است که بیماری «تیروئیدیت هاشیموتو» (Hashimoto's Thyroiditis) نام دارد و پیشرونده است. ترکیبی از عوامل ویروسی ژنتیکی ممکن است در ایجاد هاشیموتو دخیل باشند. ریسک ابتلا در شرایط زیر بالاتر است:
- در زنان
- دوران میانسالی
- ابتلا به یک بیماری خود ایمنی دیگر مانند لوپوس، دیابت نوع ۱، آرتریت روماتوئید
- سابقه خانوادگی ابتلا به خود ایمنی
- قرارگیری در معرض اشعه
در ابتدای ابتلا فرد هیچ علامتی ندارد اما با پیشرفت آن ممکن است تیروئید برای جبران کمبود هورمون، بزرگ شود که به این اختلال گواتر گفته میشود. زمانی که هاشیموتو منجر به کاهش شدید هورمون تیروئید شده باشد، نشانهها بروز پیدا میکنند:
- خستگی مفرط
- حساسیت به سرما
- ورم صورت
- یبوست
- بزرگ شدن زبان
- ناخن و پوست روشن و شکننده
- ریزش مو
- افزایش وزن
- درد مفاصل و عضلات
- افسردگی
- کاهش حافظه
- خونریزی شدید در قاعدگی
بیماری خود ایمنی چشم
۵ بیماری که چشم و بینایی را تحت تأثیر قرار میدهند عبارتند از موارد زیر:
- مولتیپل اسکلروزیس یا ام اس: بیماران ام اس مبتلا به دوبینی یا حرکات کنترل نشده چشم هستند. اولین علامت ام اس معمولا به صورت ضعف دید گزارش میشود.
- آرتریت روماتوئید: اختلال التهابی که میتواند باعث خشکی چشم شود. برخلاف MS، مشکلات بینایی ناشی از آرتریت روماتوئید به طور معمول هر دو چشم را درگیر میکنند. سندرم خشکی چشم شاید شایعترین بیماری چشمی باشد که همراه با آرتریت روماتوئید است اما امکان ایجاد اسکلریت دردناک (التهاب در سفیدی چشم) و یووئیت (التهاب بافت دیواره چشم) نیز وجود دارد.
- لوپوس: این بیماری خود ایمنی میتواند هر قسمتی از بدن مانند چشم را تحت تأثیر قرار دهد و اسکلریت، ضایعات عروقی شبکیه و نوروپاتی بینایی ایجاد کند. لوپوس غالباً با سندرم شوگرن در ارتباط است که اغلب به دلیل تولید ناکافی اشک از بدن که به غدد اشکی چشم حمله میکند و مشابه سندرم خشکی چشم است.
- دیابت: تقریباً همه بیماران دیابتی نوع 1 و بیش از نیمی از بیماران دیابتی نوع 2 رتینوپاتی را تجربه میکنند که شایعترین علت نابینایی در بزرگسالان ۲۰ تا ۷۴ ساله مبتلا به دیابت است. در رتینوپاتی دیابتی حمله سیستم ایمنی به رگهای خونیِ پشت چشم آسیب میرساند.
- پسوریازیس: پسوریازیس روی پوست از جمله پوست پلکها تأثیر میگذارد. ممکن است چشمها موقع پلک زدن دچار قرمزی و پوسته پوسته شدن و درد شوند. از آنجا که پوست اطراف چشم بسیار ظریف است، باید فوراً به دنبال درمان بود که به طور معمول با مصرف داروهای کورتیکواستروئید یا داروهای اگزما انجام میشود.
- «سندرم شوگرن» (Sjögren’s Syndrome): سیستم ایمنی به غدد اشکی حمله میکند. علائم بارز سندرم شوگرن خشکی چشم و خشکی دهان است اما احتمال دارد که بر روی مفاصل یا پوست نیز تأثیر بگذارد.
بیماری خود ایمنی و کرونا
افراد مبتلا به بیماریهای خود ایمنی در برابر ابتلا به انواع بیماریهای عفونی ریسک بالاتری دارند. بر اساس مطالعاتی که از زمان آغاز ایجاد کرونا منتشر شدهاند، حدود ۱٪ از افراد مبتلا به کرونا دچار بیماری خود ایمنی بودهاند. هنوز نیاز به شواهد بیشتری برای نظر قطعی در مورد ارتباط کرونا با بیماری خود ایمنی وجود دارد اما بر اساس دانش تئوری ممکن است بیماران خود ایمنی به نوع شدیدتری از کرونا مبتلا شوند چون در این بیماران سیستم التهابی و ایمنی فعالتر است و واکنش شدیدتری نشان میدهد.
از طرفی برخی از داروهایی که برای درمان کرونا استفاده می شوند مانند هیدروکسی کلروکین، کورتیکواستروئیدها یا توسیلیزوماب داروهای درمان برخی اختلالات خود ایمنی نیز هستند که ممکن است این مسئله باعث کاهش شدت کرونا در این بیماران شود. برای نتیجهگیری بین ارتباط این دو بیماری نیاز به شواهد بیشتری وجود دارد. اگر علاقهمند به پیگیری اطلاعات مربوط به تحقیقات در زمینه واکسن کرونا هستید، میتوانید مقاله واکسن کرونا — هر آنچه باید بدانید را بخوانید.
بیماری خود ایمنی خون
برخی از بیماریهای خودایمنی، خون و سیستم گردش خون را تحت تأثیر قرار میدهند که در اینجا به چند مورد از آنها اشاره کردهایم:
- «واسکولیت خود ایمنی» (Autoimmune Vasculitis): سیستم ایمنی بدن به رگهای خونی حمله میکند و التهاب سبب تنگی رگها می شود و کاهش جریان خون میشود.
- «کم خونی پرخطر» (Pernicious Anemia): کمبود پروتئینی به نام فاکتور ذاتی که توسط سلولهای پوششی معده ساخته میشود و برای جذب ویتامین B۱2 در روده کوچک ضروری است. بدون داشتن مقدار کافی این ویتامین، فرد دچار کمخونی میشود و توانایی بدن برای سنتز DNA تغییر میکند. کم خونی پرخطر در سالمندان شایعتر است.
- کم خونی همولیتیک (Hemolytic Anemia): در این بیماری سیستم ایمنی بدن به گلبولهای قرمز خون حمله میکند و آنها را از بین میبرد. بعضی از افراد هیچ علامتی ندارند و افراد دیگر دچار خستگی، تنگی نفس و رنگ پریدگی هستند. کم خونی همولیتیک مزمن، ممکن است به دلیل وجود اسپلنومگالی (بزرگ شدن طحال) با نشانههای زردی و ناراحتی شکمی همراه باشد. آزمایش خون برای تشخیص کم خونی و تعیین علت واکنش خود ایمنی استفاده می شود. درمان این بیماری مصرف کورتیکواستروئیدها یا سایر داروهای سرکوبکننده سیستم ایمنی و گاهی جراحی و خارج کردن طحال است.
دو نوع اصلی کم خونی همولیتیک خود ایمنی وجود دارد:- کم خونی همولیتیک با آنتیبادی گرم: آنتیبادیها در دمای طبیعی بدن به سلولهای قرمز خون متصل میشوند و آنها را از بین میبرند.
- کم خونی همولیتیک با آنتیبادی سرد (بیماری آگلوتینین سرماخوردگی): آنتیبادیها فعال میشوند و فقط در زیر دمای طبیعی بدن به گلبولهای قرمز حمله می کنند.
بیماری خود ایمنی سیستم عصبی
انواع مختلفی از بیماریهای خود ایمنی باعث آسیب سیستم عصبی محیطی یا سیستم عصبی مرکزی میشوند.
- انسفالیت خودایمنی (AE): به گروهی از بیماریهای غیر عفونی اشاره دارد که به دلیل ایجاد آنتیبادیهای ضد سلولهای عصبی یا پروتئینهای سیناپسی به وجود میآیند. برخلاف سایر اشکال انسفالیت عفونی، انسفالیت خود ایمنی در مرحله اولیه یا طی بیماری، با علائم خلقی روان پریشی و غیر روان پریشی بروز میکند. در بین طیف گستردهای از علائم روانپزشکی، سندرمهای افسردگی اغلب در AE دیده میشوند. این علائم به طور معمول در پاسخ به داروهای ضد افسردگی اثرات محدود و گذرا نشان میدهند. نشانهها در انواع مختلف AE متفاوت هستند.
- ميليت عرضی (TM) و نوروميليت اپتيكا (NMO): انواع مختلفی از اختلالات التهابی ناشی از تخریب میلین نورونها در سیستم عصبی مرکزی و نخاع هستند. این بیماریها اغلب منجر به ضايعات مغزی و گاهی تنها با آسیب به عصب بينايی مشاهده میشوند.
- مولتیپل اسکلروزیس (MS): در این بیماری پوشش میلین اطراف نورونهای مغز و نخاع دچار آسیب میشوند که باعث اختلال در انتقال سیگنالهای عصبی خواهد شد. طیف وسیعی از علائم از جمله مشکلات جسمی مانند دوبینی، نابینایی در یک چشم، ضعف عضلانی و عدم تعادل ایجاد میشوند. ام اس به اشکال مختلفی بروز میکند و نشانههای آن به صورت حملات عود کننده یا پیشرونده هستند.
- اسکلروز جانبی آمیوتروفیک (ALS): شایعترین نوع بیماری در نورونهای حرکتی است. علائم اولیه ALS شامل سفتی عضلات، گرفتگی عضلات و افزایش تدریجی ضعف و تحلیل رفتن عضلات هستند. این بیماری ممکن است با ضعف در بازوها یا پاها یا با مشکل در صحبت کردن یا بلعیدن، شروع شود. تقریباً نیمی از افراد مبتلا حداقل از نظر تفكر و رفتار دچار مشكلات بسیار خفیف میشوند و احساس درد و لامسه و دیگر حواس آنها به خوبی کار میکنند. عضلات آسیب دیده وظیفه جویدن غذا ، گفتار و راه رفتن را بر عهده دارند. از دست دادن نورونهای حرکتی تا زمانی که توانایی غذا خوردن، صحبت کردن، حرکت و در نهایت نفس کشیدن از بین نرود، ادامه مییابد. ALS در نهایت باعث فلج و مرگ زودرس میشود که معمولاً به دلیل نارسایی تنفسی است.
- پارکینسون (PD): یک اختلال دژنراتیو طولانی مدت در سیستم عصبی مرکزی است که به طور عمده بر سیستم حرکتی تأثیر میگذارد. علائم معمولاً به آهستگی ظاهر میشوند و با بدتر شدن بیماری، علائم غیرحرکتی شایعتر خواهند بود. بارزترین نشانههای اولیه پارکینسون شامل لرزش، سفتی، کندی حرکت و مشکل در راه رفتن هستند اما اختلالات شناختی و رفتاری نیز ممکن است رخ دهند. علل و مکانیسمهای بسیاری برای این بیماری ارائه شدهاند اما هیچ یک به طور قطعی به اثبات نرسیدهاند. مهمترین علل شناخته شده برای پارکینسون، قرارگیری در معرض آفتکشها و عفونت با هلیکوباکتر پیلوری (H.pylori) هستند که می تواند از جذب برخی داروها از جمله لوودوپا جلوگیری کند.
- آلزایمر (Alzheimer's Disease): یک بیماری مزمن است که به دلیل تخریب سیستم عصبی به آرامی آغاز و به تدریج پیشرفت میکند. ۶۰ تا ۷۰ درصد موارد زوال عقل مربوط به آلزایمر هستند. شایعترین علائم اولیه مشکل در حافظه کوتاهمدت، نوسانات خلقی، از دست دادن انگیزه، گیجی و اختلالات شناختی و رفتاری را شامل میشوند. به تدریج عملکردهای بدن از بین میروند و در نهایت این بیماری منجر به مرگ میشود.
- هانتینگتون (Huntington's Disease): یک بیماری ارثی که به دلیل تجمع پروتئین هانتینگتون جهش یافته در سیستم عصبی ایجاد میشود اگرچه مکانیسم دقیق ایجاد پاتوفیزیولوژی بیماری هانتینگتون ناشناخته است. علائم هانتینگتون با مشکلات خلق و خو یا اختلال در تواناییهای ذهنی آغاز میشود و عدم هماهنگی عضلات بدن و عدم تعادل از نشانههای بعدی آن هستند. با پیشرفت بیماری، حرکات غیر هماهنگ و غیر ارادی بدن معروف به «کوریا» آشکارتر میشوند.
- نوروپاتی محیطی (Peripheral Neuropathy): تخریب نورونهای حسی، حرکتی یا خودمختار که منجر به نقص در حس، حرکت، عملکرد غدد و بسیاری از مشکلات دیگر میشود. نوروپاتی محیطی ممکن است شروع ناگهانی و پیشرفت سریع داشته باشد (نوروپاتی حاد) یا علائم خفیف باشند و به آرامی پیشرفت کنند (نوروپاتی مزمن) که میتواند برگشتپذیر یا دائمی باشد.
- سندرم گیلن - باره (GBS) و پلی رادیکولونوروپاتی التهاب دمیلینه مزمن (CIDP): هر دو نوع نوروپاتی محیطی به واسطه اختلال خودایمنی هستند اما در دورههای مختلف بالینی ایجاد میشوند. تحقیقات قبلی نشان داده است که پاسخ خود ایمنی در GBS با تقلید مولکولی بین آنتیژنهای میکروبی و عصبی ایجاد و منجر به تخلیه میلین و آسیب آکسونها میشود. مبتلایان، اختلالات حسی و دورههای افسردگی را نشان میدهند.
- میاستنی گراویس: میاستنی گراویس (MG) نوعی اختلال خود ایمنی است که در بدن آنتیبادی علیه گیرنده استیل کولین در غشای پس سیناپسی محل اتصالات عصبی - عضلانی تولید میشود. این بیماری با یک روند مزمن و نوسان در ضعف و خستگی عضلات و علائم متعددی مانند پتوزیس پلک، مشکلات بلع و ضعف اندام همراه است.
بیماری خود ایمنی پوست
یکی از بافتهایی که به طور معمول تحت تأثیر اختلالات خود ایمنی قرار میگیرد، پوست است. انواع مختلفی از اختلالات خود ایمنی مرتبط با پوست از جمله موارد زیر:
- اسکلرودرمی (Scleroderma): اسکلرودرمی در واقع یک بیماری گسترده است که تمام بافت پیوندی بدن را تحت تأثیر قرار میدهد. از آنجا که این اختلال خود ایمنی در سراسر بدن گسترش مییابد، بیماران تغییرات پوستی، علائمی در رگهای خونی، عضلات و تمام اندامها تجربه میکنند. یک فرم موضعی اسکلرودرمی منجر به ایجاد فلسهای پوستی ضخیم میشود.
- درماتومیوزیت (Dermatomyositis): این اختلال خودایمنی در درجه اول ماهیت عضلانی دارد اما از آنجا که درماتومیوزیت پوست را نیز تحت تأثیر قرار میدهد، گاهی اوقات جزء بیماریهای خود ایمنی مرتبط با پوست دستهبندی میشود. درماتومیوزیت همراه با پلی میوزیت، یک بیماری خود ایمنی است که باعث ضعف عضلات، درد و سفتی آنها میشود.
بیماران با این شرایط ممکن است در بلع و تنفس دچار مشکل شوند. درماتومیوزیت با بثورات پوستی در قسمت بالای بدن و همچنین ضخیم شدن و سفت شدن پوست در بسیاری از نواحی بدن از درماتومیوزیت همراه با میوزیت افتراق مییابد. درماتومیوزیت علائمی از جمله تب، خستگی، بثورات و ضعف دارد. بیماران ممکن است پلکهایی با رنگ بنفش نیز داشته باشند. درماتومیوزیت در کودکان با فرم بزرگسالان متفاوت است. در کودکان، این اختلال به طور معمول در سنین 5 تا 15 سالگی بروز میکند اما در بزرگسالان، افراد 40 تا 60 ساله بیشتر در معرض خطر هستند. این بیماری در زنان شیوع بیشتری دارد. - اپیدرمولیز بولوزا (Epidermolysis Bullosa): این اختلال خود ایمنی مزمن، شامل تاولهای پوستی است که از نظر شدت متفاوت هستند. در برخی موارد، بیمار ممکن است فقط قرمزی یا تحریک پوستی خفیف را تجربه کند، در حالی که موارد دیگر شدیدتر پوست دچار چندین تاول است که میتوانند باز شوند و زخم ایجاد کنند.
- پمفیگوئید (Bullous Pemphigoid): پمفیگویید بولوس به طور معمول در بازوها، پاها یا تنه تاول ایجاد میکند و تقریباً در یک سوم موارد تاول در دهان ایجاد میشود. برخی اما نه همه افرادی که به این بیماری مبتلا هستند نیز دچار خارش و خونریزی لثه میشوند. موارد پمفیگوئید بولوس در همه گروههای سنی گزارش شده است اما این اختلال بیشتر در سالمندان رخ میدهد. زنان و مردان به طور مساوی در معرض خطر پمفیگوئید تورمی قرار دارند. تشخیص این بیماری دشوار است زیرا علائم عود کننده هستند و در بسیاری از بیماران پس از شش سال كاملاً از بین میرود.
بیماری خود ایمنی و ریزش مو
یکی از شایعترین عاملان ریزش مو، به ویژه قبل از 50 سالگی، بیماری خود ایمنی است که طبق گزارش Autoimmune Registry تا به امروز در حدود 14/7 تا 23/5 میلیون آمریکایی به آن مبتلا شدهاند. با این نوع شرایط، سیستم ایمنی بدن شخص به اشتباه به بدن حمله میکند و یکی از رایجترین عوارض جانبی همراه با تعداد زیادی دیگر، ریزش مو است. علاوه بر لوپوس، بیماری کرون و پسوریازیس که پیش از این توضیح داده شدند میتوان به بیماریهای خود ایمنی زیر نیز اشاره کرد که منجر به ریزش مو میشوند:
- «آلوپسیا آره اتا» (Alopecia Areata): شایعترین بیماری خود ایمنی است که منجر به ریزش مو میشود و حدود 6/6 میلیون نفر در ایالات متحده و 147 میلیون نفر در سراسر جهان به آن مبتلا هستند. مشخصه آلوپسیا ریزش موی تکهای است که میتواند منجر به ریزش کامل مو (آلوپسی توتالیس) یا در موارد شدید ریزش موی کل بدن شود. هرکسی میواند به آلوپسی آره آتا مبتلا شود اما برخی از افراد بیشتر در معرض خطر ابتلا به آن قرار دارند.
حدود 10 تا 20 درصد افراد مبتلا به آلوپسی آره آتا دارای سابقه خانوادگی هستند. افراد مبتلا به آسم، تب یونجه، درماتیت آتوپیک، بیماری تیروئید، ویتیلیگو یا سندرم داون نیز بیشتر در معرض آلوپسی آره آتا هستند.
هیچ درمانی که مورد تأیید FDA باشد برای آلوپسی آره آتا وجود ندارد اما برخی پزشکان برای ریزش موی تکه ای همراه با آلوپسی، یک دوره تزریق کورتیکواستروئید به پوست سر یا پوست و تزریق PRP را گزینههای درمانی میدانند که در برخی موارد موفقیت آمیز است. گاهی اوقات این درمانها همزمان با استفاده موضعی از ماینوکسیدیل بدون نسخه پیشنهاد میشوند. - «بیماری گریوز» (Graves' Disease): نوعی اختلال تیروئیدی است که در آن آنتیبادیها به سطح سلولهای تیروئید متصل میشوند و آنها را به تولید بیش از حد هورمونهای تیروئیدی تحریک میکنند که بر تولید موهای جدید در پوست سر و گاهی اوقات در سایر نقاط بدن تأثیر میگذارد. از داروهای ضد تیروئید مانند پروپیل تیوراسیل و متیمازول که در تولید هورمون تیروئید تداخل ایجاد میکنند، میتوان برای درمان بیماری گریوز استفاده کرد.
آزمایش تشخیص بیماری خود ایمنی
تشخیص اختلالات خود ایمنی به پیشزمینه پزشکی، سلامت عمومی فرد و معاینه فیزیکی بیمار بستگی دارد اما آزمایشات تخصصی نتایج دقیقی به دست میدهند. در برخی اختلالات سیستمیک، آزمایشات سرولوژی که میتوانند آنتیبادی را تشخیص دهند مورد استفاده قرار میگیرند که بهترین روش تشخیص آن بیوپسی ایمونوفلورسانس است. با بررسی مقدار آنتیبادیها بسیاری از بیماریهای خود ایمنی و میزان پیشرفت بیماری قابل تشخیص هستند. بیوپسی و تصویربرداری با اشعه X هم دو روش دیگر برای تشخیص برخی انواع این بیماری هستند.

درمان بیماری خود ایمنی در طب سنتی
علاوه بر دارو و درمانهای پزشکی، طب جایگزین یا طب سنتی در آسیا، به صورت تجربی مؤثر شناخته شدهاند و با وجود مطالعات علمی، امتحان کردن بعضی از این روشها میتواند مفید باشد یا دست کم آسیبی به فرد وارد نمیکند. در ادامه برخی از آنها شرح داده شدهاند.
- طب سوزنی: که از سوزن های نازک برای تحریک عصب و عضلات استفاده میکند، ممکن است در درمان اختلالات خود ایمنی مفید باشد. به عنوان مثال، در برخی مطالعات، التهاب و درد در بیماران آرتریت روماتوئید (RA) از طریق طب سوزنی تسکین پیدا کردهاند. نظریه های بی شماری در مورد نحوه عملکرد طب سوزنی وجود دارد اما یک توضیح این است که ورود سوزن، بدن را به تولید هورمونهای مهار کننده التهاب و درد تحریک میکنند.
- واحدهای TENS: تحریک الکتریکی عصب از طریق پوست، به روشی مشابه طب سوزنی، با ارسال تکانههای الکتریکی به مناطق دردناک عمل میکند. تصور میشود که در این روش سطح اندورفین، که کشنده طبیعی سلولهای ایمنی است، افزایش مییابد.
- ماساژ درمانی: برای اختلالات خود ایمنی که باعث درد میشوند، ماساژ درمانی میتواند مفید باشد. ماساژ دهنده باید سابقه کار یا آموزش ماساژ برای نقص ایمنی را داشته باشد چون ماساژ در برخی نقاط ملتهب ممنوعیت دارد.
- مکملهای خوراکی: مکملهایی که در کاهش التهاب تأثیر دارند، ممکن است برای بیماران مبتلا به اختلالات خود ایمنی مفید باشند. از جمله میتوان به ویتامین E، ویتامین A، روغن ماهی، روغن گل پامچال و روغن بذر کتان اشاره کرد.
راه مقابله با بیماری خود ایمنی
درمان سنتی بیماری خود ایمنی استفاده از داروهای سرکوبکننده سیستم ایمنی، ضد التهاب یا تسکین دهنده است. مدیریت التهاب در بیماریهای خود ایمنی اهمیت بسیاری دارد. درمانهای غیر ایمونولوژیک مانند جایگزینی هورمون در تیروئیدیت هاشیموتو یا دیابت نوع 1، نتایج واکنش خود ایمنی را درمان میکند، بنابراین این درمانهای صرفا تسکیندهنده هستند. تغییر رژیم غذایی شدت بیماری سلیاک را کاهش میدهد.
درمان استروئیدی یا NSAID علائم التهابی بسیاری از بیماریها را محدود میکند. IVIG برای CIDP و GBS استفاده میشود. درمانهای خاص برای تعدیل سیستم ایمنی مانند آنتاگونیستهای TNFα (به عنوان مثال Etanercept)، عامل تخلیه سلول B، داروهای ریتوکسیماب و توسیلیزوماب (گیرنده ضد IL-6) برای درمان بیماریهای خود ایمنی همچون آرتریت روماتوئید مؤثر هستند. برخی از روشهای ایمنی درمانی ممکن است با افزایش خطر عوارض جانبی مانند حساسیت به عفونت همراه باشند.
«درمان هلمینتیک» یا کرم درمانی، یک رویکرد تجربی بر اساس تلقیح بیمار با نماتدهای انگلی روده است. در حال حاضر تلقیح با «نکاتور آمریکانوس» (Necator americanus)، معروف به کرم قلاب یا تلقیح با «تخمهاى كرم شلاقى خوک» (Trichuris Suis Ova)، دو نوع کرم درمانی هستند که برای بیماریهای خود ایمنی استفاده میشوند. واکسیناسیون با سلولهای T سیستم ایمنی نیز نیز به عنوان یک درمان احتمالی در آینده برای اختلالات خود ایمنی در حال بررسی است.
رژیم درمانی خود ایمنی
پروتکل خود ایمنی (AIP) یک رژیم غذایی با هدف کاهش التهاب، درد و سایر علائم ناشی از بیماریهای خودایمنی مانند لوپوس، بیماری التهابی روده (IBD)، سلیاک و آرتریت روماتوئید است. بسیاری از افرادی که رژیم AIP را دنبال کردهاند، کاهش علائم شایع اختلالات خود ایمنی مانند خستگی و درد روده یا مفاصل را گزارش میکنند. با این حال، اگرچه تحقیقات در مورد این رژیم امیدوار کننده اما محدود هستند. برخی از مواد غذایی نفوذپذیری روده و احتمال نشت روده را افزایش میدهند. رژیم AIP بر از بین بردن این غذاها و جایگزینی آنها با غذاهای غنی از مواد مغذی متمرکز است که در نهایت، التهاب و علائم خودایمنی را کاهش میدهند. این رژیم غذایی دو فاز اصلی دارد:
- مرحله حذف: در این مرحله غذاها و داروهایی که احتمالاً باعث التهاب روده، عدم تعادل بین سطح باکتریهای خوب و بد یا حمله سیستم ایمنی شدهاند، حذف میشوند. طی این فاز غذاهایی همچون گلوتن، حبوبات، دانهها، مغزها، صیفیجات، تخم مرغ و لبنیات، غذاهای فرآوری شده، غذاهای آماده، توتون و تنباکو، الکل، داروهای ضد التهاب غیر استروئیدی همچون ناپروکسن، ایبوپروفن، دیکلوفناک و دوزهای بالای آسپرین و افزودنیهای شیمیایی غذا به طور کامل حذف میشوند. تا زمانی که بیمار تغییرات مثبت و کاهش علائم را مشاهده کند باید این فاز را ادامه بدهد که معمولا بین ۳۰ تا ۹۰ روز طول میکشد.
- مرحله جایگزینی: پس از بهبود علائم و اولین اثرات مثبت مرحله حذف، این فاز آغاز میشود و غذاهایی که حذف شده بودند به آرامی به رژیم غذایی اضافه میشوند. هدف از این مرحله تشخیص غذاهایی که علائم را تشدید میکنند و حذف آنها است. در طول این مرحله، غذاها باید به مدت ۵ تا ۷ روز و به نوبت به رژیم روزانه اضافه شوند، در صورتی که علائم تشدید نشدند، میتوان آن را وارد رژیم روزانه کرد. علاوه بر غذاهایی که در مرحله حذف ذکر شدند، این کار را برای دستههای مختلف مواد غذایی انجام میشود.
در این پروتوکل توصیه میشود که غذاها با ترتیب خاصی دوباره وارد رژیم شوند. به عنوان مثال، هنگام مصرف مجدد لبنیات، با محصولات لبنی با کمترین میزان لاکتوز آغاز کنید. در برخی از پروتکلهای AIP باید از تمام میوههای تازه یا خشک در مرحله حذف، پرهیز کرد. در برخی نیز مصرف 10 تا 40 گرم فروکتوز، مساوی ۱ تا ۲ میوه در روز، مجاز است. استفاده از جلبکهایی مانند اسپیرولینا یا کلرلا در مرحله حذف در این رژیم غذایی منع شده است، چون به دلیل تحریک سیستم ایمنی و التهابی، احتمال دارد علائم را تشدید کنند. برخی توصیه می کنند که میزان نمک، چربیهای اشباع شده و امگا 6، قندهای طبیعی مانند عسل یا شربت افرا و غذاهایی با پایه نارگیل باید تعدیل شوند.
توصیه: به دلیل حساسیت بالای سیستم ایمنی، قبل از هرگونه تغییر اساسی در رژیم غذایی یا داروهای مصرفی حتما با پزشک متخصص خود مشورت کنید.

ویتامین D و خود ایمنی
از آنجا که اکثر سلولها و بافتهای انسانی از جمله سلولهای T و B گیرنده ویتامین D دارند، سطح کافی ویتامین D میتواند به تنظیم سیستم ایمنی بدن کمک کند. ویتامین D با تأثیر بر سلولهای T و سلولهای کشنده طبیعی در عملکرد ایمنی نقش دارد. تحقیقات نشان دادهاند که ارتباطی بین ویتامین D پایین در سرم خون و بیماریهای خود ایمنی از جمله مولتیپل اسکلروزیس، دیابت نوع 1 و لوپوس اریتماتوز سیستمیک وجود دارد.
چون در لوپوس یا برخی دیگر از بیماریهای خود ایمنی حساسیت به نور رخ میدهد، به این بیماران توصیه میشود از قرارگیری در معرض نور خورشید خودداری کنند. چندشکلی در ژن گیرنده ویتامین D به طور معمول در افراد مبتلا به بیماریهای خود ایمنی یافت میشود و یک مکانیسم بالقوه برای نقش ویتامین D در خود ایمنی ایجاد میکند. شواهد مختلفی در مورد تأثیر مکمل ویتامین D در دیابت نوع 1، لوپوس و مولتیپل اسکلروزیس وجود دارد.
آیا بیماری خود ایمنی کشنده است؟
بیماری خود ایمنی از جمله 10 علت اصلی مرگ و میر در زنان و دومین بیماری مزمن در آمریکا و همچنین عامل مستعد کننده برای ابتلا به بیماریهای قلبی عروقی و سرطان است اما نه به آن معنی که بیماریهای خود ایمنی کشنده باشند، بلکه اغلب به دلیل مزمن و مادامالعمر بودن فرد با چالشهای بیشتری در زمینه سلامت روبرو خواهد بود.
آیا بیماری خود ایمنی واگیر دار است؟
تصور بر این است که علاوه بر عوامل ژنتیکی، عوامل خارجی مانند ویروسها، باکتریها و سایر عوامل بیماریزای عفونی از جمله ویروس Epstein-Barr (عامل بیماری مونونوکلئوز)، هرپس نوع 1 و 2 و باکتری اشرشیا کولی، نقش مهمی در پیشرفت بیماریهای خود ایمنی دارند. بنابراین انتقال این عوامل به افراد دیگری که زمینه ژنتیکی بروز بیماری خود ایمنی را دارند، میتواند عامل محرکی برای آغاز بیماری باشد اما خود بیماریهای خود ایمنی واگیردار نیستند.
طول عمر بیماران خود ایمنی
تقریباً همه بیماریهای خود ایمنی باعث کاهش امید به زندگی میشوند و البته موارد استثنایی مانند کم کاری تیروئید وجود دارند که به دارو پاسخ بهتری نشان میدهند.
آیا بیماری خود ایمنی درمان دارد؟
به طور کلی اختلالات خود ایمنی قابل درمان نیستند اما در بسیاری از موارد میتوان بیماری را کنترل کرد. برخی از روشهای مدیریت علائم خود ایمنی عبارتند از:
- داروهای ضد التهاب: برای کاهش التهاب و درد
- کورتیکواستروئیدها: برای کاهش التهاب یا رفع علائم هنگام حمله سیستم ایمنی
- مسکن: مانند پاراستامول و کدئین
- داروهای سرکوب کننده سیستم ایمنی: برای جلوگیری از فعالیت بیش از اندازه سیستم ایمنی
- فیزیوتراپی: برای افزایش تحرک بدون ایجاد آسیب به مفاصل
- درمان یا کنترل بیماری زمینهای: به عنوان مثال تزریق انسولین برای کنترل دیابت
- جراحی: مثلا برای درمان انسداد روده در بیماری کرون یا خارج کردن طحال در کم خونی همولیتیک













سلام ببخشید یه سوال دارم ایا رابطه جنسی با کسی که بیماری خودایمنی دارد خطرناک است و آیا واگیر دارد
یا مثلآ رابطه دهان به دهان امکانش هست که ویروس انتقال پیدا کند به فرد دیگر
در این متن نوشته که کسانی که خود ایمنی دارند بیشتر کرونا میگیرند ، درحالیکه این کاملاً اشتباه و برعکس است. یعنی در این افراد سیستم ایمنی بیش از حد طبیعی قویست که هر میکروبی رو زود از بین میبره و حتی مقداری هم به سلولهای خود بدن تاثیر کرده و بیماریهای خود ایمنی بوجود میاره . من که خود ایمنی دارم به عوض اینکه هر ساله چند بار سرماخوردگی داشته باشم ، از سه چهارسال یکبار میشه که خیلی خفیف و در یکی دو روز ازبین میره حتی تب هم نمیکنم. اصلاً ماسک و دستکش و فاصله اجتماعی و استریل دستها و وسایل رو تا حالا هیچ رعایت نکردم و کرونا رو هم نگرفتم .
خواهر زاده منم خود ایمنی داره امکانش هست خوب بشه میشه یکم راهنمایی کنید