کنفورماسیون چیست؟ – آشنایی با انواع صورت بندی به زبان ساده

در این مطلب از مجله فرادرس میآموزیم که کنفورماسیون چیست و به چه روشی در مولکولهای مختلف قابل تشخیص است. کنفورماسیون نوعی ایزومر فضایی است که در آن چرخشی حول یک پیوند شیمیایی یگانه در مولکولهای آلی رخ میدهد. این چرخش میتواند باعث ایجاد تغییرات قابل ملاحظهای در ویژگیهای آنها بهخصوص پایداری ساختار شود. از همین رو مطالعه این مفهوم از اهمیت بالایی برخوردار است. دانشجویان رشته شیمی و شاغلان در این حوزه با تسلط بر شیمی فضایی مولکولهای آلی میتوانند مهارت بالایی در سنتزهای شیمیایی پیدا کنند. در غیر این صورت درک بسیاری از مکانیسمهای واکنشهای شیمیایی و نحوه انجام آن برای افراد دشوار خواهد بود.
در ادامه مطلب، این مفهوم را روی تعدادی مولکول، از جمله اتان، بوتان و سیکلوهگزان بررسی میکنیم و انواع کنفورماسیونهای موجود از هر کدام را به همراه مقدار انرژی و پایداری آنها مرور میکنیم. در ادامه نحوه رسم کنفورماسیونهای مختلف یک سیکلوهگزان را مرحلهبهمرحله مورد بررسی قرار میدهیم. در انتها نیز به بررسی تعداد مثال و تمرین میپردازیم و آموختههای خود را محک میزنیم.
کنفورماسیون چیست؟
در شیمی «ایزومری کنفورماسیونی» (Conformational Isomerism) نوعی از ایزومر فضایی است که در آن ایزومرها میتوانند با چرخش حول پیوندهای یگانه خود به یکدیگر تبدیل شوند. در این صورت به هر دو مولکولی که در آن آرایش اتمها با چرخش حول پیوند یگانه با یکدیگر تفاوت داشته باشد، یک «کنفورماسیون» یا «صورت بندی» (Conformation) گفته میشود و به کنفورماسیونهایی که مربوطه به کمینه مقدار انرژی پتانسیلی هستند، یک ایزومر کنفورماسیونی یا «کنفورمر» (Conformer) میگویند.
همچنین به کنفورماسیونهایی که دارای بیشینه مقدار انرژی پتانسیلی هستند، «حالت گذار» (Transition State) گفته میشود. نحوه نمایش انواع صورت بندی مختلف در خانوادههای ترکیبات آلی با یکدیگر متفاوت است. بنابراین در ادامه میخواهیم این مفهوم را در برخی از مهمترین آنها مورد بررسی قرار دهیم.
کنفورماسیون در آلکان
همانطور که میدانید در ایزومر کنفورماسیونی، نحوه اتصال اتمها به یکدیگر هیچ تغییری نمیکند و تنها چرخش پیوند سیگما در آن رخ میدهد. در این بخش برای بررسی کنفورماسیون در آلکانها، سادهترین آلکان یعنی اتان را مورد بحث قرار میدهیم.
گرچه در این مولکول ۷ پیوند سیگما وجود دارد اما چرخش حول محور ۶ پیوند، هیچ تغییری در شکل مولکول به وجود نمیآورد زیرا اتمهای هیدروژن کروی هستند. با این حال چرخش حول پیوند کربن-کربن به کنفورماسیونهای احتمالی بسیاری میانجامد. در این مورد به تصویر زیر توجه کنید که در آن چرخش حول پیوند کربن مشخص شده است.
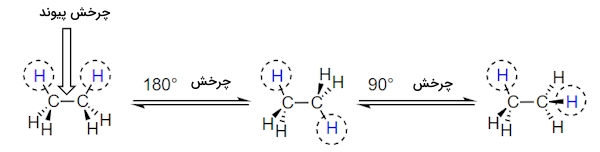
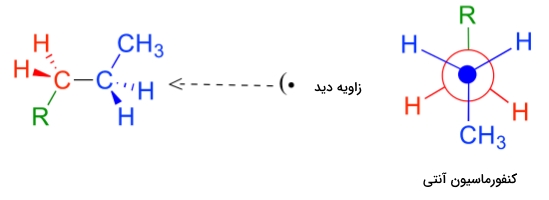
برای درک بهتر تفاوتهای کنفورماسیونها از روش ترسیمی استفاده میکنیم که «طرح نیومن» (Newman Drawing) نامیده میشود. در این طرح از روبرو به پیوند مورد نظر نگاه خواهیم کرد که در این مورد پیوند کربن-کربن در مولکول اتان است. در طرح نیومن اتم جلویی را با یک نقطه و اتم پشت آن را با دایره نشان میدهیم. به این مورد در تصویر زیر توجه کنید.

همانطور که مشاهده میکنید در طرح نیومن ۶ پیوند کربن و هیدروژن با خطوطی مشخص شده است که نسبت به دو اتم کربن در زاویه ۱۲۰ درجه قرار دارد و نشاندهنده چهاروجهی بودن آن است. در طرح نیومن بالا، کنفورماسیونی از اتان را مشاهده میکنید که کمترین انرژی را دارد و «کنفورماسیون ناپوشیده» (Staggered Conformation) نامیده میشود. در این صورت بندی تمامی پیوندهای کربن-هیدروژن جلویی نسبت به پیوندهای کربن-هیدروژن پشتی در زاویه ۶۰ درجه قرار دارند. این زاویه بین پیوند سیگمای کربن جلویی با پیوند سیگمای کربن پشتی «زاویه دو وجهی» (Diherdral Angle) خوانده میشود. در این کنفورماسیون فاصله بین پیوندها و در نتیجه الکترونهای آنها در بیشترین مقدار خود قرار دارد.
افزایش فاصله بین الکترونها باعث کاهش دافعه الکتروستاتیکی بین آنها میشود و ساختار حاصل از پایداری بیشتری برخوردار خواهد بود. حال اگر گروه متیل روی کربن جلویی را به میزان ۶۰ درجه بهصورت ساعتگرد بچرخانیم، مولکول دارای «کنفورماسیون پوشیده» (Eclipsed Conformation) خواهد بود که بیشترین مقدار انرژی را دارد. در این کنفورماسیون، اتمهای هیدروژن روی کربن جلویی در نزدیکترین فاصله از هیدروژنهای روی کربن پشتی قرار دارند. این کنفورماسیون را در تصویر زیر با طرح نیومن مشاهده میکنید.

همانطور که گفتیم در این وضعیت ساختار بیشترین انرژی را دارد زیرا دافعه الکتروستاتیک در آن، بین الکترونهای پیوند هیدروژن و کربن در جلو با الکترونهای پیوند هیدروژن و کربن در پشت، نامطلوب است. انرژی این کنفورماسیون حدود ۳ کیلوکالری بر مول یا ۱۲ کیلوژول بر مول از کنفورماسیون ناپوشیده بیشتر است. از این اختلاف انرژی بین دو کنفورماسیون با نام «کرنش پیچشی» (Torsional Strain) یاد میشود که از افزایش دافعه الکتروستاتیک در پیوندهای پوشیده به وجود میآید.
در صورتی که این مولکول را بهصورت ساعتگرد ۶۰ درجه دیگر بچرخانیم، نتیجه کنفورماسیون دیگری خواهد بود. این فرآیند را میتوان تا تکمیل ۳۶۰ درجه ادامه داد که در نهایت ۳ کنفورماسیون پوشیده و ۳ کنفورماسیون ناپوشیده به دست میآيد. همچنین احتمالهای بسیاری نیز در این میان وجود دارد اما از آنجا که این دو نوع کنفورماسیون داری کمینه و بیشینه انرژی هستند، برای مطالعه اتان روی آنها تمرکز خواهیم کرد.
چرخش پیوند در اتان
توجه داشته باشید که پیوند کربن-کربن در اتان بهطور کامل آزاد نیست و به راحتی بر ۳ کیلوکالری بر مول انرژی فائق نمیآید. کرنش پیچشی در اتان مانعی سر راه تبدیل کنفورماسیون پوشیده به ناپوشیده و برعکس است. با این حال مقدار این انرژی آنقدر زیاد نیست که مانع از تبدیل کنفورماسیونها به یکدیگر شود، البته این حالت در دمای بسیار سرد اتفاق خواهد افتاد. بنابراین در دمای معمولی پیوند کربن-کربن بهصورت پیوسته در حال چرخش است. اتان در تمامی لحظات تمایل بیشتری برای حضور در کنفورماسیون ناپوشیده دارد که در دره انرژی است.
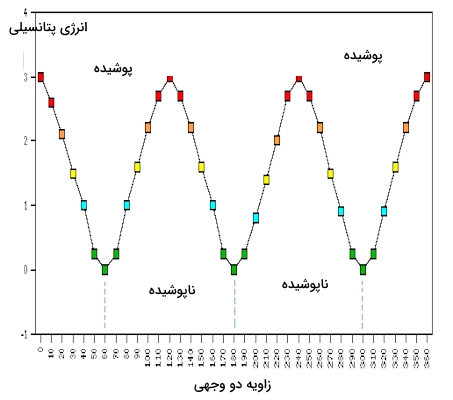
نحوه تغییر انرژی کنفورماسیونهای مختلف و جایگاه هر کدام از کنفورماسیونها را در تصویر بالا مشاهده میکنید. گرچه کنفورمرهای اتان در تعادلی سریع با یکدیگر قرار دارند اما وجود اختلاف انرژی ۳ کیلوکالری بر مولی باعث میشود که در هر لحظه مقدار کنفورماسیون ناپوشیده بیش از ۹۹٪ را تشکیل دهد.
کنفورماسیون در مولکولهای آلی راستزنجیر
با بررسی اتان به عنوان یکی از سادهترین مولکولهای آلی «راستزنجیر» (Open Chain) میتوانیم مفاهیم را گستردهتر کنیم و به ترکیبات دیگر بپردازیم. توجه داشته باشید که اساس مفاهیم همان است اما با توجه به پیچیدگی بیشتر مولکولهای بزرگتر نیاز به بررسی عمیقتری خواهیم داشت.
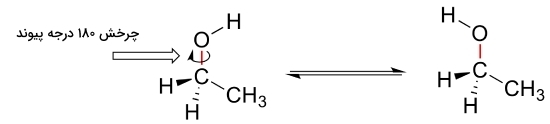
در ابتدا میخواهیم ساختار مولکولی با گروه عاملی الکل، یعنی اتانول را بررسی کنیم. در صورتی که چرخشی ۱۸۰ درجهای حول پیوند کربن و اکسیژن در اتانول صورت بگیرد، ظاهر مولکول به کلی تغییر خواهد کرد که این در تصویر زیر نشان داده شده است.
حال میخواهیم مولکول آلی دیگری را مورد بررسی قرار دهیم و کنفورماسیونهای آن را با طرح نیومن نشان دهیم. بوتان دارای زنجیرهای کربنی متشکل از ۴ اتم کربن است. در این حالت ۳ پیوند کربن-کربن وجود دارد که میتواند بچرخد اما در اینجا تمرکز ما روی پیوند بین کربن شماره ۲ با کربن شماره ۳ است. در تصویر زیر طرح نیومن این مولکول را در صورت بندی پوشیده آن مشاهده میکنید. در این مورد دافعه بین دو گروه متیل روی کربن جلو و کربن پشتی، کنفورماسیون پوشیده را به وجود میآورد که در این حالت پیوندهای کربن-کربن آنها نسبت به یکدیگر دارای زاویه صفر درجه هستند.

در صورتی که کربن جلویی را که به رنگ آبی مشخص شده است به میزان ۶۰ درجه در جهت ساعتگرد بچرخانیم، بوتان کنفورماسیون ناپوشیدهای پیدا میکند. این را میتوانید در تصویر زیر مشاهده کنید.
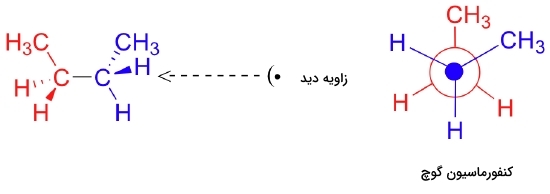
به این کنفورماسیون ناپوشیده نام ویژه «کنفورماسیون گوچ» (Gauche Conformation) داده میشود. توجه داشته باشید که با وجود ناپوشیده بودن این کنفورماسیون، گروه متیلی در کربن جلو فاصله چندانی با گروه متیل در کربن پشتی ندارد و به همین دلیل برای آن نامی اختصاصی در نظر گرفته میشود تا از کنفورماسیون ناپوشیده قابل تشخیص باشد.
در مرحله بعد اگر پیوند بین کربن شماره ۲ و کربن شماره ۳ را ۶۰ درجه دیگر بچرخانیم، کنفورماسیون پوشیده دیگری به دست میآید. توجه داشته باشید که این کنفورماسیون پوشیده با کنفورماسیون پوشیدهای که پیش از این از ساختار بوتان بررسی کردیم، متفاوت است. در کنفورماسیون پوشیده قبلی دلیل پوشیده بودن، فاصله بسیار کم بین گروه متیل کربن جلو با گروه متیل کربن پشتی بود اما در این کنفورماسیون پوشیده، هر گروه متیل در فاصله کمی از یک اتم هیدروژن قرار دارد که این را میتوانید در تصویر زیر مشاهده کنید.
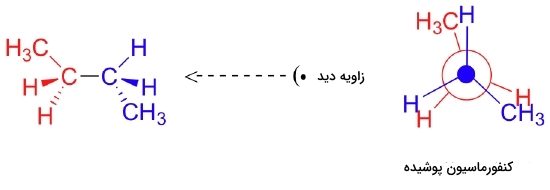
در مرحله بعد و با چرخاندن بوتان در جهت ساعتگرد به میزان ۶۰ درجه، شاهد به وجود آمدن کنفورماسیون ناپوشیده ویژهای هستیم که با نام «کنفورماسیون آنتی» (Anti Conformation) خوانده میشود. ویژگی منحصربهفرد این کنفورمر این است که در آن دو گروه متیل در نقطه مقابل یکدیگر روی کربن جلو و پشت قرار دارند، به عبارتی زاویه بین آنها برابر با ۱۸۰ درجه است که میتوانید در تصویر زیر آن را مشاهده کنید.
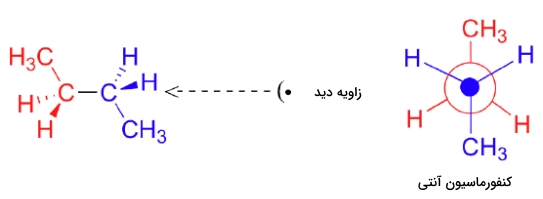
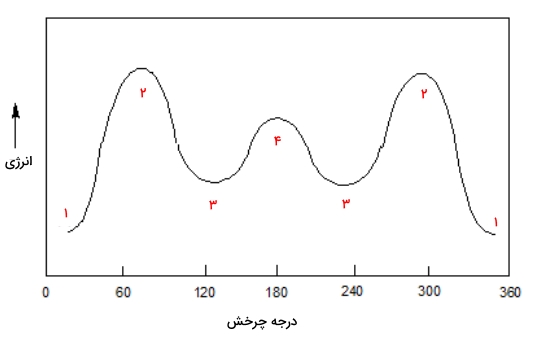
درست مانند مولکول اتان که پیش از این بررسی کردیم، کنفورماسیونهای ناپوشیده بوتان در دره انرژی و کنفورماسیونهای پوشیده بوتان در قله انرژی قرار دارند اما در مورد بوتان درهها و قلهها نیز با یکدیگر تفاوت انرژی دارند که در نمودار زیر آنها را مشاهده میکنید. هر سطح انرژی در این نمودار مربوطه به یکی از کنفورماسیونهای پوشیده، ناپوشیده، گوچ و آنتی است.
در این نمودار صورت بندی گوچ نسبت به صورت بندی آنتی انرژی بیشتری دارد که به دلیل وجود «کرنش فضایی» (Steric Strain) در آن است. کرنش فضایی در واقع دافعه بین دو گروه حجیم متیل است که در کنفورماسیون گوچ در فاصله کمتری از یکدیگر قرار دارند.
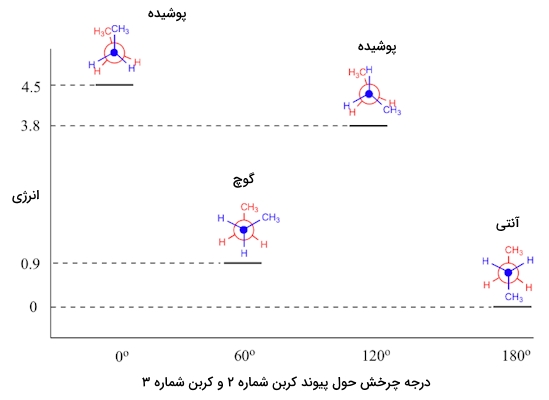
هچنین در دو کنفورماسیون پوشیده نیز شاهد اختلافی در مقدار انرژی هستیم. در کنفورماسیون پوشیده در صورتی که نزدیک بودن دو گروه متیل باعث پوشیدگی شود، مقدار انرژی بسیار بیشتر از حالتی است که یک گروه متیل در نزدیکی اتم هیدروژن قرار داشته باشد.
از آنجا که در کنفورماسیون آنتی، مقدار انرژی از کنفورماسیونهای دیگر کمتر است، آلکانها را بهصورت راستزنجیر در فرم زیگزاگی با این کنفورماسیون رسم میکنند. برای مثال به تصویر زیر توجه کنید که مربوط به آلکانی ۸ کربنه به نام اکتان است. در این مورد زاویه دید ما از کربن شماره ۲ به کربن شماره ۳ است و چرخش حول این پیوند را مورد بررسی قرار میدهیم.
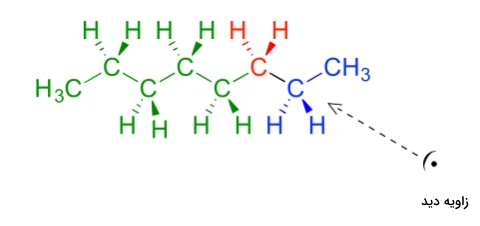
همانطور که در تصویر زیر مشاهده میکنید، کنفورماسیون آنتی در مورد اکتان بهصورتی رسم میشود که گروه متیل (آبی رنگ) و گروه آلکیل (سبز رنگ) در دورترین فاصله از یکدیگر قرار داشته باشند و زاویه بین آنها برابر با ۱۸۰ درجه باشد. در این صورت این مولکول در دره انرژی قرار دارد و کمترین انرژی ممکن را خواهد داشت.
کنفورماسیون در حلقه
حال که دانستیم کنفورماسیون چیست و در ساختارهای خطی به چه شکل است، میخواهیم با نحوه رسم آن در ساختارهای حلقوی نیز آشنا شویم. حلقههای سیکلو آلکانی که از سیکلوپنتان بزرگتر باشند در صورتی که تخت باشند، دارای کشش زاویهای خواهند بود. به همین دلیل سیکلوهگزان نمیتواند تخت باشد و به اصطلاح چروک میخورد. حلقههای بزرگتر مانند سیکلوهپتان و سیکلواکتان دارای کشش بیشتری نسبت به سیکلوهگزان هستند و ممکن است با ممانعت فضایی نیز روبرو باشند. در این بخش میخواهیم به مطالعه کنفورماسیونهایی بپردازیم که یک سیکلوهگزان میتواند داشته باشد.
کنفورماسیون سیکلوهگزان
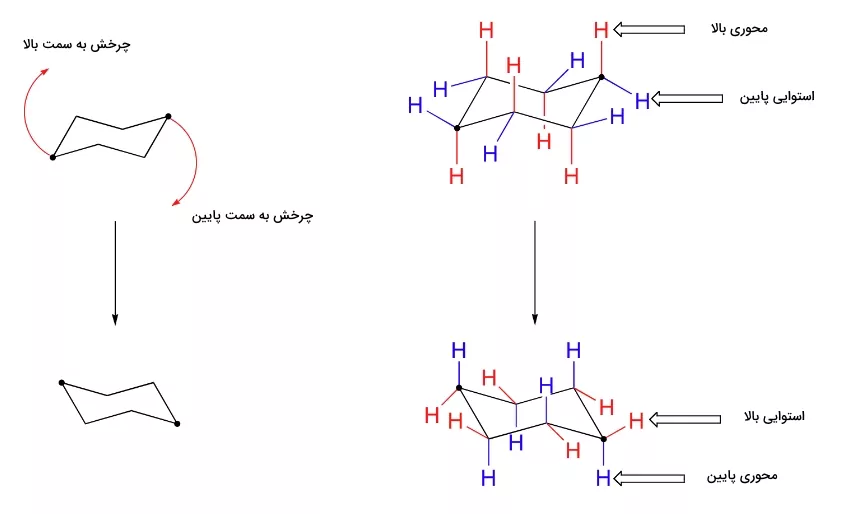
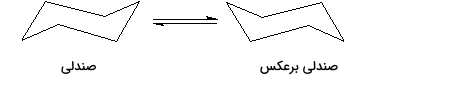
سیکلوهگزان دو صورت بندی پایدار دارد که آنها را با نام «صندلی» (Chair) میشناسیم و توسط فرآیند چرخش صندلی به یکدیگر تبدیل میشوند. در تصویر زیر این دو کنفورماسیون را مشاهده میکنید. توجه داشته باشید که هیچ کدام از این دو ساختار تخت نیستند.
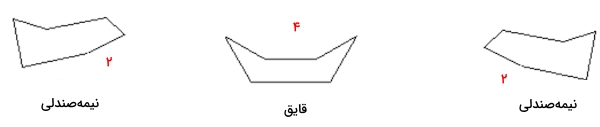
در تبدیل این دو کنفورمر به یکدیگر، چندین کنفورماسیون دیگر نیز به وجود میآید که از معروفترین آنها میتوان به «کنفورماسیون قایق» (Boat Conformation)، «کنفورماسیون پیج خورده» (Twist Conformation) و «کنفورماسیون نیمهصندلی» (Half Chair Conformation) اشاره کرد. در تصویر زیر این سه کنفورماسیون را مشاهده میکنید.
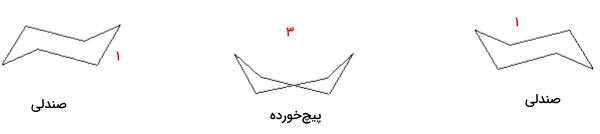
انرژی نسبی هر کنفورماسیون نشاندهنده مقدار پایداری آن است، بهصورتی که هرچه مقدار انرژی آن بیشتر باشد به این معناست که پایداری کمتری دارد. در تصویر زیر جایگاه هر کدام از کنفورماسیونهای سیکلوهگزان را به توجه به سطح انرژی آن مشاهده میکنید.
کنفورماسیون صندلی
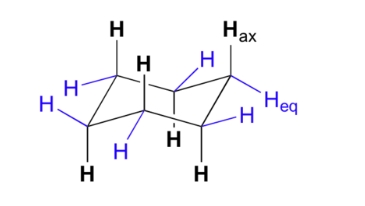
کنفورماسیون صندلی سیکلوهگزان از دیگر کنفورماسیونها انرژی کمتری دارد و میخواهیم در این بخش بهطور اختصاصی به آن بپردازیم. در هنگام مطالعه این کنفورماسیون متوجه میشویم که ۱۲ هیدروژنی که روی این مولکول قرار دارند از نظر ساختاری با یکدیگر برابر نیستند. ۶ اتم هیدروژن در مجاورت حلقه کربنی قرار دارند و «هیدروژن استوایی» (Equatorial Hydrogen) نامیده میشوند. ۶ هیدروژن دیگر به سمت بالا و پایین حلقه جهتگیری کردهاند و «هیدوژن محوری» (Axial Hydrogen) نام دارند.
برای سادگی، هیدروژنهای استوایی را بهصورت $$H_{eq}$$ و هیدروژنهای محوری را بهصورت $$H_{ax}$$ نشان میدهند. در کنفورماسیون صندلی زیر ۱۲ هیدروژن سیکلوهگزان نمایش داده شدهاند. مشاهده میکنید که هیدروژنهای محوری با رنگ آبی و هیدروژنهای استوایی با رنگ مشکی مشخص شدهاند.
از آنجا که دو کنفورماسیون صندلی بهصورت پیوسته و سریع در تعادل با یکدیگر هستند، هر ۱۲ هیدروژن بهصورت همزمان دارای نیمی از ویژگی هیدروژن استوایی و نیمی از ویژگی هیدروژن محوری است. در تصویر زیر میتوانید نحوه تبدیل این دو کنفورماسیون صندلی به یکدیگر را مشاهده کنید.
همانطور که در تصویر بالا مشاهده میکنید، هیدروژن استوایی در کنفورماسیون صندلی با برعکس شدن کنفورماسیون، تبدیل به هیدروژن محوری میشود. همچنین در این فرآيند هیدروژن محوری نیز به هیدروژن استوایی تبدیل خواهد داشت. در هر مورد رنگ آنها مشخصکننده است.
رسم کنفورماسیون سیکلوهگزان
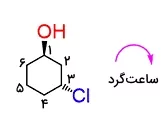
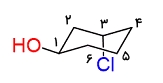
از جمله موارد حائز اهمیت در مورد کنفوماسیونها توانایی رسم و تبدیل آنها به یکدیگر است. در این بخش میخواهیم با بررسی یک مثال این مورد را بررسی کنیم. مولکولی که در اینجا مورد مطالعه است، سیکلوهگزانی است که روی خود دارای یک استخلاف هیدروکسیلی و یک استخلاف کلر است. میتوانید آن را در تصویر زیر مشاهده کنید.
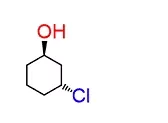
اولین کاری که باید انجام دهیم، شمارهگذاری اتمهای موجود در زنجیره است. در این مورد جهت عددگذاری، مانند آنچه در نامگذاری الکلها انجام میشود، تفاوتی ایجاد نمیکند. در اینجا عدد ۱ به کربن دارای گروه هیدروکسیل تعلق گرفته است و بهصورت ساعتگرد ادامه پیدا کرده است.
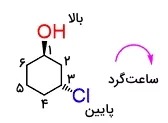
در مرحله بعد در کنار استخلافهایی که با گوه مشخص شدهاند، عبارت «بالا» و در کنار استخلافهایی که با خطچین مشخص شدهاند، عبارت «پایین» را یادداشت میکنیم. همانطور که میدانید بالا و پایین بودن بستگی به زاویه دید ما نسبت به مولکول دارد اما انجام این مرحله کار را سادهتر میکند و میتوان در مورد هیدروژنهای استوایی و محوری تصمیمگیری کرد.
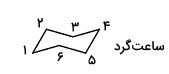
سپس یکی از دو کنفورماسیون صندلی را بدون استخلافهای مولکول اصلی رسم میکنیم. در این مورد هر کدام از آنها را که بخواهیم میتوانیم رسم کنیم و تفاوتی ایجاد نمیشود.
روی این کنفورماسیون صندلی اتمهای کربن را شمارهگذاری میکنیم. توجه داشته باشید که نقطه شروع شمارهگذاری مهم نیست اما جهتگیری آن باید حتما مطابق با مرحله اول باشد، بنابراین عددگذاری را ساعتگرد انجام میدهیم.
این مرحله باید با دقت بالایی انجام شود زیرا باید استخلافهای موجود روی مولکول اصلی را روی این کنفورماسیون صندلی وارد کنیم. بنابراین استخلاف هیدروکسیل را روی کربن شماره ۱ و استخلاف کلر را روی کربن شماره ۳ قرار میدهیم. به بالا و پایین بودن هر استخلاف در مرحله دوم توجه داشته باشید.
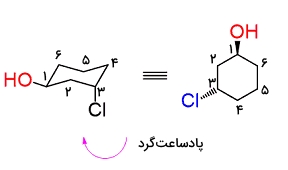
در صورتی که در مرحله اول شمارهگذاری بهصورت ساعتگرد و در مرحله دوم شمارهگذاری بهصورت پادساعتگرد باشد، مولکولی که به دست میآوریم، انانتیومر مولکول مورد نظر ما است. این نکته را برای این مثال در تصویر زیر مشاهده میکنید.
ملاحظه میکنید که این دو مولکول با یکدیگر متفاوت هستند، بنابراین باید به جهت عددگذاری توجه ویژه داشته باشیم.
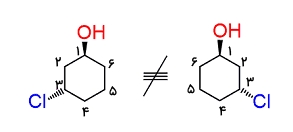
دو مولکول تصویر بالا تصاویر آینهای یکدیگر هستند که بر هم منطبق نمیشوند و هرچه آنها را در جهتهای مختلف بچرخانیم با یکدیگر یکسان نخواهند بود.
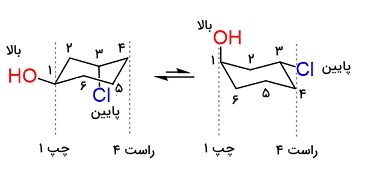
در مرحله بعد کنفورماسیون دیگر صندلی را نیز رسم میکنیم. در این مورد باید به سه نکته توجه داشته باشید.
- استخلاف یا اتمی که به سمت بالا یا پایین است، به همان صورت باقی میماند.
- استخلاف یا اتم استوایی تبدیل به محوری میشود.
- استخلاف یا اتم محوری تبدیل به استوایی میشود.
با در نظر گرفتن این نکات به تصویر زیر خواهیم رسید.
ایزومر سیس و ترانس در سیکلوهگزان
در این بخش میخواهیم بدانیم نحوه رسم ایزومر سیس و ترانس مولکول سیکلوهگزان در کنفورماسیون پایدار صندلی به چه صورت است. برای این کار باید به جهت قرارگیری استخلافها روی حلقه بهصورت استوایی یا محوری توجه داشته باشیم. برای این کار از ساختارهای ساده شروع میکنیم و سپس مثالهای پیچیدهتری را مورد بررسی قرار میدهیم.
مولکول کلرو سیکلوهگزان
کلروسیکلوهگزان مولکولی است که روی حلقه ۶ کربنی خود یک استخلاف کلر دارد. ساختار این مولکول را در تصویر زیر به همراه کنفورماسیون صندلی آن مشاهده میکنید.
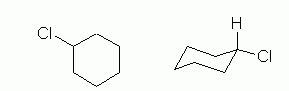
از آنجا که در این ساختار تنها یک استخلاف وجود دارد، میتوان آن را روی هر اتم کربنی در کنفورماسیون صندلی نشان داد. تنها باید به این نکته توجه داشته باشید که کلر از هیدروژن حجیمتر است و به همین دلیل در موقعیت استوایی قرار دارد. گذاشتن استخلافها و اتمهای حجیمتر در موقعیت محوری از پایداری کنفورماسیون میکاهد.
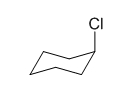
در تصویر بالا کنفورماسیون صندلی این مولکول را بهصورتی رسم کردهایم که در آن اتم کلر در موقعیت محوری باشد. این کنفورماسیون سطح انرژی بالاتر و پایداری کمتری دارد. در مثالهای پیش رو دلیل این امر را در سیکلوهگزانهایی با بیش از یک استخلاف مشاهده خواهید کرد.
مولکول دیکلرو سیکلوهگزان
در این بخش مولکول دیکلرو سیکلوهگزان را مورد بررسی قرار میدهیم که در ساختار خود دارای دو استخلاف است. مورد اولی که باید بدانیم این است که این دو استخلاف روی کدام یک از کربنها قرار دارند. ابتدا ساختاری را در نظر بگیرید که ۱و۳-دیکلرو سیکلوهگزان نامیده میشود. میتوانید تصویر آن را در زیر مشاهده کنید.
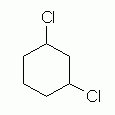
همانطور که میدانید جهتگیری این دو اتم کلر میتواند به تولید دو ایزومر متفاوت سیس و ترانس بیانجامد. به عبارتی زمانی که بیش از یک استخلاف داشته باشیم، قرارگیری اتم کلر در موقعیت محوری و استوایی از اهمیت ویژهای برخوردار است.
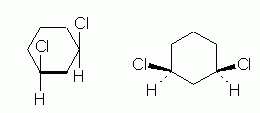
ساختار سیس ۱و۳-دیکلرو سیکلوهگزان
ایزومر سیس ایزومری است که دو استخلاف در آن نسبت به یکدیگر در یک سمت مولکول قرار داشته باشند. این مورد را میتوان بهصورت مولکول سمت چپ نشان داد که در آن حلقه، تخت است و دو اتم کلر به سمت بالا جهتگیری کردهاند. همچنین در مولکول سمت راست، دو کلر هر دو به کمک گوه به کربن مربوطه به خود متصل هستند.
در تصویر زیر کنفورماسیون صندلی ساختار سیس ۱و۳-دیکلرو سیکلوهگزان را مشاهده میکنید. همانطور که میدانید روی هر اتم کربن سیکلوهگزان یک موقعیت استوایی و یک موقعیت محوری وجود دارد. نکته مهمی که میخواهیم به آن بپردازیم این است که برای داشتن ساختار سیس، اتمهای کلر باید چه جایگاهی را اشغال کنند. به ساختار موجود در تصویر زیر دقت کنید.
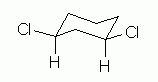
همانطور که مشاهده میکنید روی کربن شماره ۱ و ۳ دو استخلاف وجود دارد که یکی بهصورت استوایی و دیگری محوری است. در موقعیت استوایی فضای بیشتری برای اتم یا استخلاف وجود دارد.
ساختار ترانس ۱و۳-دیکلرو سیکلوهگزان
در ساختارهایی با استخلاف ۱ و ۳ روی سیکلوهگزان، در صورتی که هر دو محوی یا هر دو استوایی باشند، ساختار بهصورت سیس و در صورتی که یک استخلاف در موقعیت محوری و دیگری در موقعیت استوایی باشد، ساختار ترانس است. این را میتوانید در تصویر زیر مشاهده کنید.
ساختار سیس ۱و۲-دیکلرو سیکلوهگزان
در این ساختار دو استخلاف کلر به جای کربن شماره ۱ و ۳ روی کربن شماره ۱ و ۲ قرار دارند. در تصویر زیر میتوانید ساختار این مولکول را مشاهده کنید که در آن جهتگیری استخلافها نامشخص است.
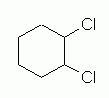
مانند مولکول قبلی، در این مولکول نیز دو ایزومر سیس و ترانس میتواند وجود داشته باشد بهصورتی که در ایزومر سیس هر دو استخلاف در یک سمت و در ایزومر ترانس، استخلافها در دو سمت متفاوت مولکول قرار دارند. در تصویر زیر دو نحوه نمایش ایزومر سیس این مولکول را مشاهده میکنید.
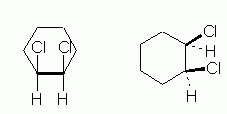
در ادامه تعدادی ساختار را از این مولکول مورد بررسی قرار میدهیم تا به ساختار صحیح سیس آن دست پیدا کنیم. توجه داشته باشید که بهطور کلی ترجیح بر قرار دادن استخلافهای حجیم در موقعیت استوایی است که فضای بیشتری دارد.
مولکول بالا صحیح نیست زیرا مربوط به ترانس ۱و۲-دیکلرو سیکلوهگزان است. همانطور که مشاهده میکنید در یکی از آنها هیدروژن در بالای کلر قرار دارد و در دیگری برعکس، یعنی کلر بالای هیدروژن قرار دارد. بنابراین دو استخلاف کلر در دو طرف ساختار هستند و ترانس نامیده میشوند.
توجه داشته باشید که برای رسم این ساختار نمیتوان هر دو استخلاف حجیم را در موقعیت استوایی قرار داد و نکتهای که پیش از این گفتیم در تمامی موارد صدق نمیکند.
همانطور که مشاهده میکنید در این مولکول، استخلاف کلر در هر دو مورد به سمت بالا جهتگیری کرده است، بنابراین هر دو در یک سمت واحد از حلقه قرار دارند.
مثال از رسم کنفورماسیون پایدار
حال که میدانیم کنفورماسیون چیست و چگونه میتوان به پایداترین ساختار آن رسید، میخواهیم در این بخش تعدادی مثال را مورد بررسی قرار دهیم و پایداترین کنفورماسیون آنها را با کمترین مقدار انرژی، رسم کنیم.
مثال اول کنفورماسیون
در مولکول سیس ۱-اتیل ۳-متیل سیکلوهگزان پایدارترین کنفورماسیون چیست؟
پاسخ
در این کنفورماسیون استخلاف اتیل روی کربن شماره ۱ و در موقعیت استوایی و استخلاف متیل روی کربن شماره ۳ و در موقعیت استوایی قرار دارد. در این صورت هر دو آنها جهتگیری به سمت پایین دارند و از همینجا میتوانیم به درستی ساختار خود پی ببریم زیرا در ایزومر سیس، دو استخلاف باید هر دو در یک جهت مولکول باشند.
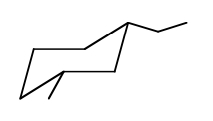
مثال دوم کنفورماسیون
در مولکول سیس ۱-اتیل ۴-ایزوپروپیل سیکلوهگزان پایدارترین کنفورماسیون چیست؟
پاسخ
در این کنفورماسیون پایدار، استخلاف اتیل بر کربن شماره ۱ و در موقعیت محوری و استخلاف ایزوپروپیل روی کربن شماره ۴ و در موقعیت استوایی قرار دارد. همانطور که مشاهده میکنید هر دو دارای جهتگیری برابر (به سمت پایین) هستند، بنابراین ایزومر سیس به درستی رسم شده است.
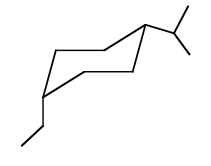
مثال و حل تمرین
تا اینجا دانستیم کنفورماسیون چیست و در هر مولکول چگونه قابل تشخیص است. حال میخواهیم ابتدا تعدادی مثال را به همراه پاسخ تشریحی آنها مورد بررسی قرار دهیم. سپس درک خود را با مرور تعدادی تمرین چند گزینهای عمق میبخشیم.
مثال
در این بخش به بررسی تعدادی مثال خواهیم پرداخت. توجه به پاسخ تشریحی آنها میتواند در پاسخگویی به سوالهای مشابه بسیار کمککننده باشد.
مثال اول
پایدارترین کنفورماسیون اتان چه نامیده میشود؟ دلیل برتری این کنفورماسیون چیست؟
پاسخ
پایدارترین کنفورماسیون مولکول اتان، کنفورماسیون ناپوشیده آن است که به میزان ۳ کیلوکالری بر مول نسبت به کنفورماسیون پوشیده انرژی کمتری دارد. دلیل این برتری و انرژی کمتر، وجود دافعه بین اتمهای هیدروژن در دو کربن این ساختار است. کنفورماسیون ناپوشیده بهصورتی است که این دافعه به کمترین مقدار ممکن خود میرسد.
مثال دوم
در مولکول با ساختار ۲-متیل پروپان پایدارترین کنفورماسیون چیست؟ آن را به کمک طرح نیومن نشان دهید.
پاسخ
در این ساختار ۳ کربن وجود دارد، بنابراین طرح نیومن را طوری رسم میکنیم که زاویه دید ما به پیوند کربن ۱ و کربن ۲ باشد. توجه داشته باشید که در این مورد رسم پیوند بین کربن ۲ و کربن ۳ نیز صحیح است. در این صورت روی کربن جلو دو گروه متیلی وجود دارد. در حالتی که این دو گروه با هیدروژنهای کربن پشتی در بیشترین فاصله باشند، در واقع کنفورماسیون ناپوشیده باشد، بیشترین مقدار پایداری و کمترین سطح انرژی وجود خواهد داشت. این کنفورماسیون ناپوشیده را بهصورت زیر رسم میکنیم.
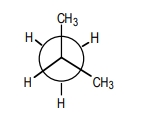
مثال سوم
پایدارترین طرح نیومن مولکول بوتان را بهصورتی رسم کنید که زاویه دید بیننده از کربن شماره ۲ به کربن شماره ۳ باشد.
پاسخ
در این مولکول در صورتی که زاویه دید از کربن شماره ۲ به کربن شماره ۳ باشد، روی هر کدام از آنها یک گروه متیلی و دو اتم هیدروژن وجود دارد. در این صورت پایدارترین کنفورماسیون به فرم آنتی است که در آن دو گروه حجیم متیل نسبت به یکدیگر در زاویه ۱۸۰ درجه قرار داشته باشند. ساختار این کنفورماسیون بهصورت نشان داده شده در تصویر زیر است.
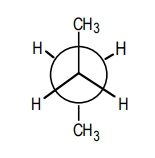
مثال چهارم
در مولکول ترانس ۱و۲-دیمتیل سیکلوهگزان و سیس ۱و۲-دیمتیل سیکلوهگزان پایدارترین کنفورماسیون چیست؟
پاسخ
برای رسم کنفورماسیون صندلی یک سیکلوهگزان بهصورت ترانس، باید استخلافها در دو جهت مختلف باشند. همانطور که مشاهده میکنید در مولکول زیر یکی از متیلها به سمت بالا و دیگری به سمت پایین است. در صورتی که هیدروژنهای این دو کربن را رسم کنیم، این جهتگیری بیشتر مشخص خواهد شد. در این مولکول هر دو استخلاف در موقعیت استوایی قرار دارند.
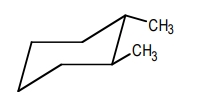
برای رسم کنفورماسیون صندلی یک سیکلوهگزان بهصورت سیس، باید استخلافها در یک جهت یکسان باشند. همانطور که مشاهده میکنید در مولکول زیر یکی از متیلهای در موقعیت محوری و به سمت بالا و دیگری در موقعیت استوایی و به سمت بالا است.
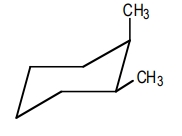
مثال پنجم
در مولکول ترانس ۱-ترشیوبوتیل ۳-اتیل سیکلوهگزان پایدارترین کنفورماسیون چیست؟
پاسخ
دو کنفورماسیون زیر پایدارترین نوع نمایش این مولکول هستند. همانطور که مشاهده میکنید استخلاف ترشیو بوتیل روی کربن شماره ۱ در موقعیت محوری و استخلاف اتیل روی کربن شماره ۳ و در موقعیت استوایی قرار گرفته است. این دو استخلاف در هر دو حالت در دو جهت مخالف یکدیگر قرار دارند و ساختار ترانس را تشکیل میدهند.
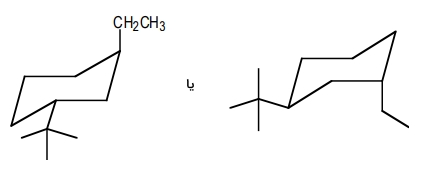
مثال ششم
پایدارترین طرح نیومن کنفورماسیون ۲و۳-دیمتیل بوتان را با زاویه دید از کربن شماره ۲ به کربن شماره ۳ رسم کنید.
پاسخ
ابتدا برای راحتی کار ساختار این مولکول را بهصورت خطی رسم میکنیم که از زنجیرهای با ۴ اتم کربن و دو استخلاف متیلی روی کربن شماره ۲ و ۳ تشکیل میشود. این را میتوانید در تصویر زیر مشاهده کنید.
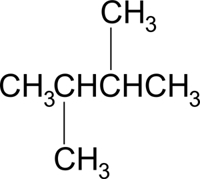
در صورتی که بخواهیم از کربن شماره ۲ به کربن شماره ۳ نگاه کنیم، روی هر کدام از کربنهای جلویی و پشتی، دو گروه متیل وجود دارد. این گروهها حجیم هستند و در صورتی که در فاصله نزدیکی از یکدیگر قرار بگیرند در ساختار ایجاد ناپایداری میکنند. بنابراین پایداترین کنفورماسیون این مولکول را بهصورت زیر نشان میدهیم که ناپوشیده است و متیلهای در بیشترین فاصله ممکن از یکدیگر قرار دارند.
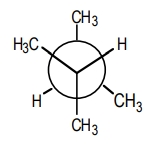
مثال هفتم
در کنفورماسیون پایدار مولکول زیر، چند استخلاف آلکیلی در موقعیت محوری قرار دارند؟
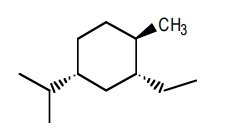
پاسخ
برای پاسخ به این مثال، ابتدا پایداترین کنفورماسیون این مولکول را بهصورت زیر رسم میکنیم. باید توجه داشته باشید که گروه اتیل نسبت به ایزوپروپیل سیس است. همچنین گروه متیل نسبت به گروه اتیل در موقعیت ترانس قرار دارد.
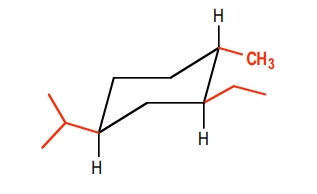
همانطور که مشاهده میکنید این مورد در کنفورماسیون زیر رعایت شده است، بهصورتی که ایزوپروپیل و اتیل هر دو در یک سمت قرار دارند اما متیل و اتیل در دو سمت متفاوت قرار داده شدهاند. اتیل به سمت بالا و متیل به سمت پایین است. بنابراین میتوان گفت که در پایدارترین کنفورماسیون این مولکول هر ۳ گروه آلکیلی در موقعیت استوایی هستند و هیچ کدام از آنها در موقعیت محوری قرار ندارند و پاسخ این سوال، صفر است.
مثال هشتم
کنفورماسیون صندلی مولکول زیر به چه صورت خواهد بود؟
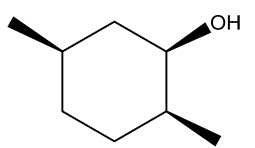
پاسخ
در این سیکلوهگزان دو استخلاف متیل و یک استخلاف هیدروکسیل وجود دارد که همگی با گُوه نشان داده شدهاند و به این معناست که در یک سمت مولکول قرار دارند، بنابراین کنفورماسیون صندلی آن را نیز باید بهصورتی رسم کنیم که همگی دارای جهتگیری بالا یا پایین باشند. این نکته در ساختار زیر رعایت شده است. همانطور که مشاهده میکنید یکی از متیلها در موقعیت استوایی و دیگری در موقعیت محوری است. همچنین استخلاف هیدروکسیل در موقعیت استوایی قرار داده شده است.
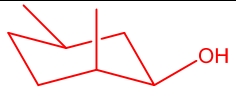
این کنفورماسیون صندلی را میتوان برعکس کرد و نتیجه بهصورت زیر خواهد بود.
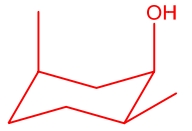
مثال نهم
کنفورماسیون صندلی مولکول زیر را رسم کنید.
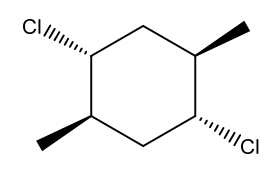
پاسخ
این سیکلوهگزان دارای ۴ استخلاف مختلف است که در آن دو استخلاف کلر نسبت به یکدیگر به حالت سیس و دو استخلاف متیل نیز نسبت به یکدیگر در حالت سیس و این دو گروه نسبت به یکدیگر ترانس هستند. بنابراین برای رسم کنفورماسیون صندلی آن در صورتی که دو استخلاف کلر به سمت بالا باشند، دو استخلاف متیل باید به سمت پایین باشد و برعکس. این را میتوانید در تصویر زیر مشاهده کنید.
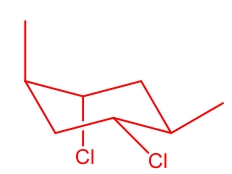
در این کنفورماسیون دو کلر به سمت پایین و دو متیل به سمت بالا جهتگیری کردهاند. برای رسم راحتتر میتوان از روش شمارهگذاری استفاده کرد و جایگاه هر استخلاف را به دست آورد، سپس به موقعیت آنها نسبت به یکدیگر پرداخت.
حل تمرین
حال که میدانیم کنفورماسیون چیست و در هر مولکولی خود را چگونه نشان میدهد، میخواهیم به تعدادی تمرین چند گزینهای در این رابطه بپردازیم.
تمرین اول
کدام یک از کنفورماسیونهای مولکول سیکلوهگزان پایداری بیشتری دارد؟
کنفورماسیون قایق
کنفورماسیون صندلی
کنفورماسیون پیچخورده
کنفورماسیون نیمصندلی
تمرین دوم
چرخش حول پیوند کربن شماره ۲ و کربن شماره ۳ در ساختار بوتان نیازمند چه مقداری از انرژی است؟
۱۰۰ کیلوژول بر مول
۱۰ کیلوژول بر مول
۵۰ کیلوژول بر مول
۳ کیلوژول بر مول
تمرین سوم
در کنفورماسیون گوچ بوتان، زاویه دو ساختار متیلی چه مقداری است؟
۶۰ درجه
۹۰ درجه
۱۸۰ درجه
۳۶۰ درجه
تمرین چهارم
کدام یک از کنفورماسیونهای زیر کمترین پایداری و بیشترین سطح انرژی را دارد؟
کنفورماسیون آنتی
کنفورماسیون گوچ
کنفورماسیون پوشیده
کنفورماسیون ناپوشیده
تمرین پنجم
به دو کنفورماسیون زیر توجه کنید و بگویید رابطه بین آنها در کدام یک از گزینههای زیر بهصورت صحیح آورده شده است؟
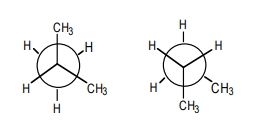
این دو کنفورماسیون ایزومر یکدیگر نیستند.
ایزومر کنفورماسیونی یکدیگر هستند.
ایزومر ساختاری هستند.
ایزومر سیس و ترانس یکدیگر هستند.
این دو ساختار، ایزومر کنفورماسیونی نیستند زیرا در یکی از آنها دو گروه متیل روی کربن جلویی قرار دارد و در دیگری روی کربن جلو ۱ گروه متیل و روی کربن پشتی نیز ۱ گروه متیل وجود دارد، بنابراین مولکولهای متفاوتی هستند. یکی از آنها «بوتان» و دیگری «۲-متیل پروپان» است که ایزومر ساختاری یکدیگر به شمار میروند.
تمرین ششم
کدام یک از گزینههای زیر در مورد پایدارترین کنفورماسیون ساختار ۱و۱و۳-تریمتیل سیکلوهگزان صحیح است؟
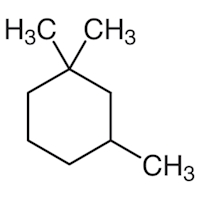
گروه متیل روی کربن شماره ۳ بهصورت استوایی است.
کربن شماره ۱ کربن نوع سوم و کربن شماره ۳ کربن نوع اول است.
هر دو متیل روی کربن شماره ۱ بهصورت استوایی هستند.
هر دو متیل روی کربن شماره ۱ بهصورت محوری هستند.
تمرین هفتم
کدام یک از عبارتهای زیر توصیف بهتری از کنفورماسیون صندلی مولکول ترانس ۱و۴-دیمتیل سیکلوهگزان است؟
هر دو کنفورماسیون صندلی دارای انرژی برابری هستند.
کنفورماسیون صندلی با انرژی بالاتر دارای یک گروه متیل در موقعیت محوری و یک گروه متیل در موقعیت استوایی است.
کنفورماسیون صندلی با انرژی پایینتر دارای یک گروه متیل در موقعیت محوری و یک گروه متیل در موقعیت استوایی است.
کنفورماسیون صندلی با انرژی پایینتر دارای دو گروه متیل در موقعیت محوری است.
تمرین هشتم
کدام یک از گزینههای زیر ترتیب انرژی کنفورماسیونهای سیکلوهگزان را بهصورت صحیح نمایش میدهد؟
صندلی < پیچ خورده < قایق < نیمصندلی
صندلی < قایق < نیمصندلی < پیچ خورده
نیمصندلی < قایق < پیچ خورده < صندلی
قایق < صندلی < نیمصندلی < پیچ خورده
تمرین نهم
کدام یک از عبارتهای زیر توصیف بهتری از کنفورماسیون صندلی مولکول ترانس ۱و۳-دیاتیل سیکلوهگزان است؟
هر دو کنفورماسیون صندلی دارای انرژی برابری هستند.
کنفورماسیون صندلی با انرژی بالاتر دارای دو گروه اتیل در موقعیت محوری است.
کنفورماسیون صندلی با انرژی بالاتر دارای دو گروه اتیل در موقعیت استوایی است.
کنفورماسیون صندلی با انرژی پایینتر دارای یک گروه متیل در موقعیت محوری است.
تمرین دهم
در پایدارترین کنفورماسیون مولکول سیس ۱و۳-دیمتیل سیکلوهگزان، چند هیدروژن در موقعیا محوری قرار دارند؟
۲
۳
۶
۵
در تصویر زیر پایدارترین کنفورماسیون صندلی این ساختار را مشاهده میکنید که در آن گروههای متیل، موقعیت استوایی را اشغال کردهاند و دو هیدروژن در موقعیت محوری هستند. بنابراین تا اینجا ۲ هیدروژن محوری داریم.
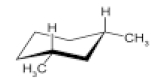
دقت داشته باشید که در این ساختار ۴ اتم کربن دیگر وجود دارند که دو ظرفیت آنها در پیوند با کربن اشغال شده است و ۲ ظرفیت دیگر نیز با اتمهای هیدروژن پر میشود. بنابراین روی هر ۴ اتم کربن دیگر، ۲ هیدروژن وجود دارد که یکی در موقعیت محوری و دیگری در موقعیت استوایی است و در مجموع ۶ هیدروژن با موقعیت محوری داریم.
سوالات متدوال
حال که میدانیم مفهوم کنفورماسیون چیست و چه انواعی دارد، میخواهیم در این بخش به تعدادی از مهمترین و پرتکرارترین سوالهای پیرامون آن پاسخ دهیم.
تعریف کنفورماسیون چیست؟
کنفورماسیونها آرایشهای متفاوتی از یک مولکول واحد هستند که بر اثر چرخش حول پیوند یگانه به وجود میآیند.
یک کنفورماسیون چگونه به وجود میآید؟
کنفورماسیونها از چرخش حول پیوند یگانه در ساختار مولکول به وجود میآيند.
کنفورماسیون آنتی چیست؟
ویژگی منحصربهفرد کنفورماسیون آنتی این است که در آن دو گروه حجیم در نقطه مقابل یکدیگر روی کربن جلو و پشت قرار دارند، به عبارتی زاویه بین آنها برابر با ۱۸۰ درجه است.
تعدادی کنفورماسیون متداول را نام ببرید؟
از جمله کنفورماسیونها میتوان به کنفورماسیون پوشیده، کنفورماسیون ناپوشیده، کنفورماسیون آنتی و کنفورماسیون گوچ اشاره کرد.
هیدروژن استوایی و هیدروژن محوری در کنفورماسیون چیست؟
در کنفورماسیون صندلی ۶ اتم هیدروژن در مجاورت حلقه کربنی قرار دارند و هیدروژن استوایی نامیده میشود. ۶ هیدروژن دیگر به سمت بالا و پایین حلقه جهتگیری کردهاند و هیدوژن محوری نام دارند.
کنفورماسیون پوشیده چیست؟
کنفورماسیون پوشیده، کنفورماسیونی است که اتم یا استخلاف روی کربن جلویی در نزدیکترین فاصله از هیدروژن یا استخلاف روی کربن پشتی قرار داشته باشد.
جمعبندی
هدف از این مطلب مجله فرادرس این بود که بدانیم کنفورماسیون چیست و در هر ترکیب خود را به چه اشکالی نشان میدهد. از مهمترین ساختارهایی که در آنها به بررسی مفهوم کنفورماسیون پرداختیم، آلکانها و هیدروکربنهای حلقوی مانند سیکلوهگزان هستند.
مقایسه بین کنفورماسیونهای یک ساختار از اهمیت بهسزایی برخوردار است زیرا اختلاف انرژی آنها را نشان میدهد. هرچه مقدار انرژی کنفورماسیون کمتری باشد، از پایداری بیشتری برخوردار است و زمان بیشتری را به شکل آن کنفورماسیون سپری خواهد کرد. در نهایت نیز با بررسی تعدادی مثال و تمرین به مرور آموختههای خود از این مبحث پرداختیم.