ایزوتوپ پایدار چیست؟ – به زبان ساده
ایزوتوپهای پایدار، عنصرهایی هستند که هسته اتم آنها دچار واپاشی پرتوزا نمیشود و از این نظر مخالف ایزوتوپ ناپایدار یا رادیو ایزوتوپ هستند. در این مطلب میخواهیم بدانیم ایزوتوپ پایدار چیست و چه کاربردی دارد و از کجا میتوان به وجود پایداری در ایزوتوپی پی برد.
ایزوتوپ چیست ؟
برای درک بهتر مفهوم ایزوتوپ پایدار، بهتر است ابتدا تعریف دقیقی از ایزوتوپ را بررسی کنیم. ایزوتوپهای یک عنصر تعداد پروتونهای برابر اما تعداد نوترونهای نابرابر دارند. به عبارتی ایزوتوپهای یک عنصر عدد اتمی مشابه اما عدد جرمی متفاوتی دارند و به همین دلیل یک موقعیت را در جدول تناوبی عناصر اشغال میکنند. تعداد الکترونهای هسته یک عنصر مگر در حالتی که تشکیل یون بدهد، برابر با تعداد پروتونهای آن است. ایزوتوپهای یک عنصر با فراوانی متفاوتی در کره زمین حضور دارند. به فرایندی که طی آن یک ایزوتوپ جداسازی میشود، غنیسازی ایزوتوپی میگوییم.
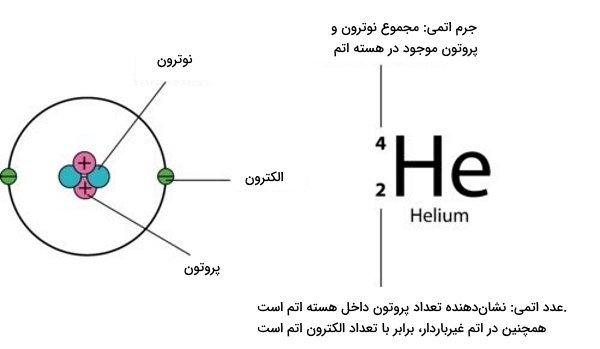
برای یافتن تعداد نوترونهای هسته یک اتم کافیست عدد اتمی را از عدد جرمی آن کم کنیم. در زیر این معادله را مشاهده میکنید.
$$A=N + Z $$
در رابطه بالا:
- $$A$$: عدد جرمی
- $$N$$: تعداد نوترون
- $$Z$$: عدد اتمی
ایزوتوپ پایدار چیست ؟
به عنصرهایی که هسته غیررادیواکتیو دارند، ایزوتوپ پایدار (Stable Isotope) میگویند. این هستهها برخلاف ایزوتوپهای ناپایدار از خود تابشی ساطع نمیکنند و به همین دلیل پایدار هستند.
در واقع ایزوتوپهایی به عنوان ایزوتوپ پایدار در نظر گرفته میشوند که تابهحال از آنها هیچ تابشی مشاهده نشده است. ۸۰ عنصر وجود دارند که هر کدام ۱ یا تعداد بیشتر ایزوتوپ پایدار دارند و روی هم ۲۵۱ عدد ایزوپ پایدار را به وجود میآورند.
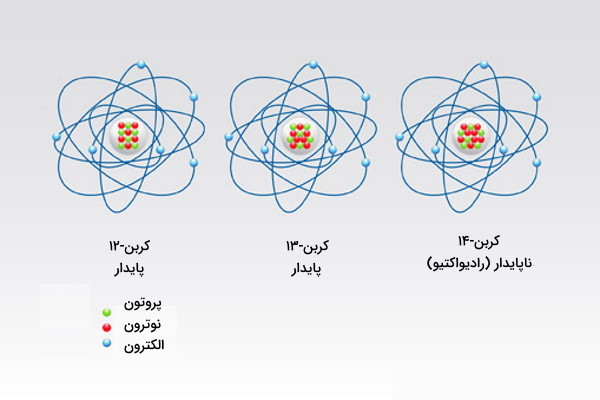
از بین این ۸۰ عنصر، ۲۶ عدد تنها یک ایزوتوپ پایدار دارند و به همین دلیل به آنها عنصرهای تک ایزوتوپی گفته میشود. باقی ۵۴ عنصر بیشتر از ۱ ایزوتوپ پایدار دارند. قلع عنصری با بیشترین تعداد ایزوتوپ پایدار شناخته شده است. این عنصر تنها ۱۰ ایزوتوپ بهصورت پایدار دارد. در جدول زیر تعدادی از ایزوتوپهای پایدار عنصرها را مشاهده میکنید. بیشتر عنصرهایی که بهصورت طبیعی وجود دارند، پایدار هستند.
| نام عنصر | نماد عنصر | عدد جرمی ایزوتوپ(های) پایدار |
| هیدروژن | $$H$$ | 1، ۲ |
| هلیوم | $$He$$ | 3، ۴ |
| لیتیوم | $$Li$$ | ۶، ۷ |
| بریلیوم | $$Be$$ | ۹ |
| بور | $$B$$ | ۱۰، ۱۱ |
| کربن | $$C$$ | ۱۲، ۱۳ |
| نیتروژن | $$N$$ | ۱۴، ۱۵ |
| اکسیژن | $$O$$ | ۱۶، ۱۷، ۱۸ |
| فلوئور | $$F$$ | ۱۷ |
پایداری هسته اتم
هسته اتمها به دو صورت «پایدار» و «ناپایدار و رادیواکتیو» وجود دارند. هستههای ناپایدار از خود تابشهای معروفی مانند آلفا، بتا و گاما ساطع میکنند. همانطور که میدانید هسته هر اتم از تعدادی نوترون و تعدادی پروتون تشکیل شده است که به کمک نیروی هستهای قوی کنار هم نگه داشته شدهاند. جمع تعداد نوترونها و پروتونهای داخل هسته هر اتم عدد جرمی آن را به وجود میآورد.
با افزایش تعداد پروتونها نیاز است که برای حفظ پایداری تعداد نوترون نیز افزایش پیدا کند. بنابراین برای سنجش پایداری هسته اتم باید هر دوی این ذرات را در نظر بگیریم. در این مورد مثالی را بررسی خواهیم کرد.
هیدروژن دارای ۳ ایزوتوپ است که به ترتیب هیدروژن، دوتریم و تریتیوم نامیده میشوند. از بین این ۳ ایزوتوپ،تریتیوم به دلیل داشتن ۱ پروتون و ۲ نوترون ناپایدار و رادیواکتیو است.
هستههایی با عدد اتمی بالای ۸۳ همگی رادیواکتیو هستند. برای توجیه این ادعا چند مورد زیر را بیان میکنند.
- دافعه بین نوترونها
- دافعه بین الکترونها
- تمایل پروتون به نوترون
- تمایل الکترون به هستههای باردار مثبت
- دافعه بین پروتونها
پایداری هسته اتم معیاری برای سنجش پایداری ایزوتوپ است و برای مطالعه آن دو عامل بسیار مهم را باید مد نظر قرار داد.
- نسبت نوترون به پروتون در هسته اتم
- تعداد کل نوکلئونهای موجود در هسته اتم
عامل اصلی برای سنجش پایداری یا عدم پایداری هسته اتم مورد اول یعنی نسبت نوترون به پروتون است. عنصرهایی که عدد جرمی کوچکتر از ۲۰ دارند سبک هستند و ترجیح میدهند تعداد نوترون و پروتون برابری داشته باشند.
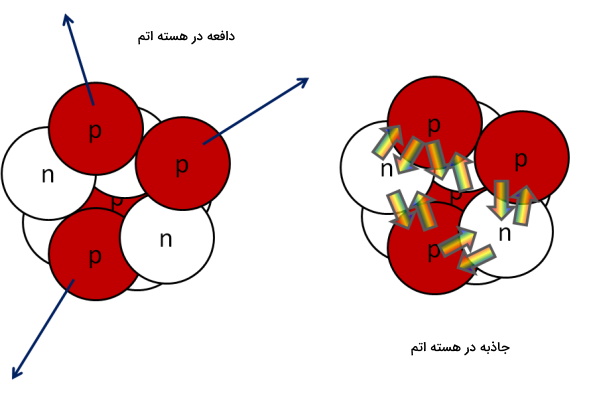
عنصرهایی که عدد اتمی آنها بین۲۰ تا ۸۲ است، عنصرهای سنگین هستند و نسبت نوترون به پروتون هسته آنها متفاوت و بهصورت 1٫5:1 است. دلیل این اختلاف نیروی دافعه بین پروتونهای هسته است و هرچه این دافعه بیشتر باشد، به تعداد نوترون بیشتری برای پایدار کردن هسته نیاز است. در واقع نوترونها بین پروتونها قرار گرفته و میزان دافعه حس شده برای هر پروتون از سمت همتای خود را کاهش میدهند.
ایزوتوپ عنصر ها
از بین تمام عنصرهای شناختهشده ۸۰ عنصر، حداقل یک ایزوتوپ پایدار دارند. این عنصرها از موقعیت هیدروژن-۱ تا سرب-۸۲ را شامل میشوند. در این بین دو عنصر تکنسیم-۴۳ $$(Tc)$$ و پرومتیوم-۶۱ $$(Pm)$$ استثنا هستند و ایزوتوپ پایداری ندارند. به واقع از این عنصرها هیچ تابشی ساطع نشده است و آنچنان نیمهعمر طولانی دارند که قابل اندازهگیری نیست.
در فهرست زیر تعدادی ایزوتوپهای پایدار عنصرهای متفاوت را مشاهده میکنید.
- ۱ عنصر (قلع)، ۱۰ ایزوتوپ پایدار دارد.
- ۵ عنصر با ۷ ایزوتوپ پایدار
- ۷ عنصر با ۶ ایزوتوپ پایدار
- ۱۱ عنصر با ۵ ایزوتوپ پایدار
- ۹ عنصر با ۴ ایزوتوپ پایدار
- ۵ عنصر با ۳ ایزوتوپ پایدار
- ۱۶ عنصر با ۲ ایزوتوپ پایدار
- ۲۶ عنصر تکایزوتوپی، یعنی ۲۶ عنصر تنها ۱ ایزوتوپ پایدار دارند.
برای نمایش ایزوتوپهای متفاوت یک عنصر از روشهای متفاوتی استفاده میشود. قبل از مطالعه متن بهتر است مروری بر آنها داشته باشیم. در این جدول منظور از $$X$$ نماد عنصر، $$Z$$ عدد اتمی و $$A$$ عدد جرمی است.
| $$^A_Z \textrm X$$ | $$^A \textrm X$$ | عنصر-عدد جرمی |
| $${^{16}_8 O}$$ | $${^{16} O}$$ | اکسیژن-۱۶ |
| $${^{17}_8 O}$$ | $${^{17} O}$$ | اکسیژن-۱۷ |
| $${^{18}_8 O}$$ | $${^{18} O}$$ | اکسیژن-۱۸ |
ایزوتوپها با مقادیر متفاوتی در طبیعت وجود دارند که به آن فراوانی ایزوتوپ گفته میشود. مثلا در مورد اکسیژن که در جدول بالا آورده شده است، اکسیژن-۱۸ به مقدار ۹۹٫۷۶٪، اکسیژن-۱۸ به مقدار ۰٫۲٪ و اکسیژن-۱۷ به مقدار ۰٫۰۴٪ در طبیعت وجود دارد.
ایزوتوپ هسته ای پایدار
تمامی ایزوتوپهایی که از آنها به عنوان پایدار یاد میکنیم، هستهای در حالت پایه دارند. از این بین تنها تانتالم-۱۸۰ام است که به حالت برانگیخته خود حضور دارد اما پایدار است. به این حالت ایزوتوپ، ایزوتوپ هستهای میگویند. جالب است بدانید که همین عنصر در حالت پایه و غیربرانگیخته خود رادیواکتیو است و نیمهعمری برابر با ۸ ساعت دارد. گزارشها حاکی از این است که نیمهعمر تانتالم-۱۸۰ام بیشتر از $$10^{15}$$ سال است. این ایزوتوپ بهطور عمده دچار واپاشی گاما میشود اما واپاشی آلفا و بتا نیز از آن مشاهده شده است.

پایداری شهودی (observationally stable)
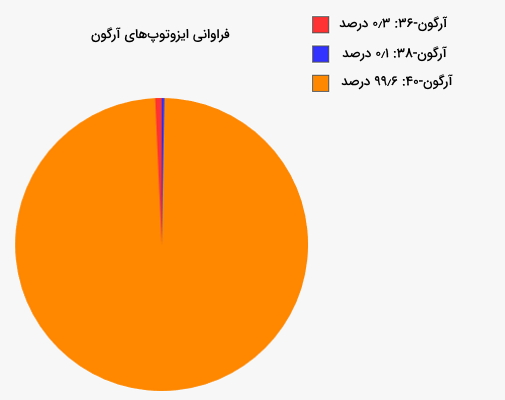
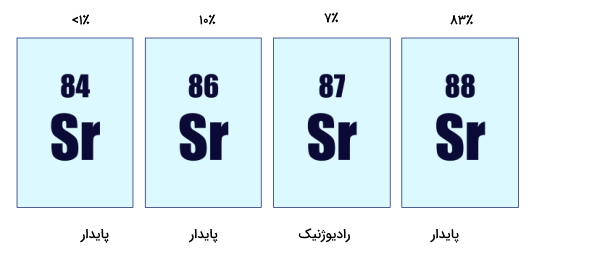
به نظر میرسد با پیشرفت تجهیزات و تکنولوژی و انجام مشاهدات و آزمایشهای بیشتر، از برخی ایزوتوپهایی که امروزه به عنوان ایزوتوپ پایدار در نظر گرفته میشوند، تابشهایی مشاهده شود. تاییدی بر این ادعا کشف رادیواکتیو بودن بیسموت-۲۰۹ در سال ۲۰۰۳ است. هرچند مقدار تابش آن بسیار کم است اما باید لحاظ شود. این ایزوتوپ از خود تابش آلفایی را با سرعت بسیار کم ساطع میکند. به ایزوتوپهایی که بهصورت نظری آنها را ناپایدار در نظر میگیریم اما از آنها تابشی دیده نشده است، ایزوتوپهای پایدار شهودی میگویند. ۱۶۱ عنصر وجود دارند که آنها را ناپایدار در نظر میگیریم اما از ۴۵ تای آنها هیچ تابشی مشاهده نشده است. مثالی از این مورد آرگون-۳۶ $$(^{36}Ar)$$ است.
پایداری ایزوتوپ
برای نشان دادن ایزوتوپهای پایدار از نمودار زیر استفاده میکنند. در این نمودار محور عمودی نشاندهنده تعداد نوترونها و محور افقی نشاندهنده تعداد پروتونهای هسته یک ایزوتوپ است. حالا که میدانیم ایزوتوپ پایدار چیست بهتر میتوانیم در مورد هستههایی که به رنگ سیاه نشان داده شدهاند صحبت کنیم.
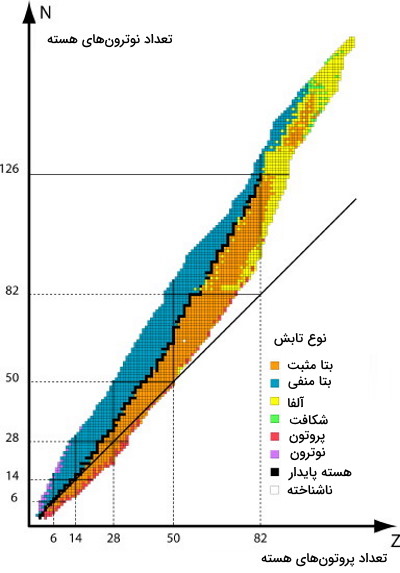
در این نمودار خط موربی نیز وجود دارد که نسبت برابر از پروتون و نوترون را نشان میدهد. هر ایزوتوپی که عدد اتمی بیشتر از ۲۰ داشته باشد و روی این خط قرار بگیرد، در واقع نسبت نوترون به پروتون در آن ۱:۱ باشد، ایزوتوپ پایدار است. این پایداری تا نسبت ۱٫۵:۱ نیز برای نوترون به پروتون ایزوتوپهای پایدار دیده میشود.
در بالای سمت راست این نمودار ایزوتوپهای ناپایدار قرار دارند. اینها ایزوتوپهای رادیواکتیوی هستند که از خود تابش ساطع میکنند. همانطور که میبینم ایزوتوپ با تابشهای متفاوت با رنگهای متنوع نشان داده شدهاند. برای مثال ایزوتوپهای دارای تابش آلفا به رنگ زرد نمایش داده میشوند. تمام ایزوتوپهای با عدد اتمی بالای ۸۳ ناپایدار و در نتیجه رادیواکتیو هستند. برای روشن شدن این مورد در ادامه مثالهایی را بررسی خواهیم کرد.
انحراف از خط پایداری به این معنا است که برای پایدار کردن تعداد پروتون خاص به تعداد بیشتر نوترون برای غلبه به نیروی دافعه نیاز است. در این مورد $$N>\;Z$$ صدق خواهد کرد.
اعداد جادویی پایداری
مفهوم عدد اکتت (Octet Number) از این مشاهده به دست آمده است که اتمها با ۸ الکترون در لایه ظرفیت پایدار هستند و این آرایش رواج دارد. شرایطی مشابه برای ایزوتوپهای پایدار و غیر رادیواکتیو از نظر تعداد پروتون و نوترون هسته اتم آنها وجود دارد. به اینها اعداد جادویی میگویند و در ایزوتوپهایی که بهطور طبیعی پایدار هستند، دیده میشوند. در زیر این اعداد را مشاهده میکنید.

ایزوتوپها چه تعداد پروتون، چه تعداد نوترونی مانند این اعداد داشته باشند، به احتمال بسیار زیاد پایدار هستند. اگر هر دوی آنها را نیز داشته باشند پایدار هستند. این اتفاق تنها برای ایزوتوپهای سنگینتر به دلیل دافعه بین پروتونها، میافتد.
- اعداد جادویی پایداری پروتون: ۲، ۸، ۲۸، ۵۰، ۸۲ و ۱۱۴
- اعداد جادویی پایداری نوترون: ۲، ۸، ۲۰، ۲۸، ۵۰، ۸۲، ۱۲۶ و ۱۸۴
روشهای دیگری نیز برای حدس زدن در مورد پایداری و ناپایداری ایزوتوپها وجود دارد که در بخشهای بعد به آنها خواهیم پرداخت.
پایداری ایزوتوپ بر اساس زوج و فرد بودن تعداد نوترون و پروتون
درست مانند الکترونها در آرایش الکترونی، که در آن زوج بودن تعداد الکترون باعث پایداری میشود، زوج بودن تعداد نوکلئونها نیز نقش مهمی در پایداری ایزوتوپها دارد. زیرا با زوج بودن تعداد نوترون و پروتون، انرژی هسته پایین میآید و این سبب پایداری میشود.
این پایداری از ایجاد واپاشی بتا و تولید هستهای با دو پروتون بیشتر و دو نوترون کمتر جلوگیری میکند زیرا در مسیر به وجود آمدن هسته جدید موقعیتی وجود دارد که تعداد نوترون و پروتون فرد میشود و به تبع آن انرژی هسته بالا میرود و باعث ناپایداری آن میشود. برای جلوگیری از به وجود آمدن چنین حالتی، این هستهها دچار واپاشی دوگانه بتا با نیمهعمری چند برابر قدمت جهان، میشوند. از ۲۵۱ هسته پایدار، ۱۵۰ عدد در همین دستهبندی میگنجند. در جدول زیر تعداد ایزوتوپهای موجود از ترکیبهای ممکن را مشاهده میکنید.
| تعداد پروتون $$(Z)$$ | تعداد نوترون | تعداد ایزوتوپهای پایدار |
| زوج | زوج | 163 |
| زوج | فرد | 53 |
| فرد | زوج | 50 |
| فرد | فرد | 4 |
توجه داشته باشید که 5 ایزوتوپ استثنا وجود دارند که با وجود پایداری، تعداد نوترون و پروتون فرد دارند.
- هیدروژن-۲ (دوتریم): $${^2_1H} $$
- لیتیم-۶: $${^{6}_3Li} $$
- بور-۱۰: $${^{10}_5B} $$
- نیتروژن-۱۴: $${^{14}_7N} $$
- تانتالم-۱۸۰ام: $${^{180}_{73}Ta} $$
همچنین ۴ ایزوتوپ طبیعی رادیواکتیو وجود دارند که تعداد نوترون و پروتون آنها بهصورت فرد-فرد است و نیمهعمری بیش از یک میلیارد سال دارند. این ایزوتوپها بسیار نادر هستند زیرا ترکیب نوترون و پروتون فرد-فرد ناپایدار است و تمایل به داشتن پایداری با ایجاد واپاشی بتا دارند.
- پتاسیم-۴۰: $${^{40}_{19}K} $$
- وانادیم-۵۰: $${^{50}_{23}V} $$
- لانتانوم-۱۳۸: $${^{138}_{57}La} $$
- لوتتیوم-۱۷۶: $${^{176}_{71}Lu} $$
عنصرهایی که در جدول تناوبی عناصر بعد از سرب قرار دارند به دلیل داشتن هستهای با ۱۲۸ نوترون (۲ عدد بیشتر از عدد جادویی پایداری ۱۲۶) بسیار ناپایدار هستند و به سرعت دچار واپاشی آلفا میشوند. این نکته دلیلی بر نیمهعمر بسیار کوتاه عنصرهایی مانند استاتین $$(At) $$، رادون $$(Rn) $$ و فرانسیم $$(Fr) $$ است. همین واپاشی با شدت کمتری برای عنصرهایی با تعداد نوترون ۸۴ (۲ عدد بیشتر از عدد پایداری ۸۲) نیز اتفاق میافتد. این عنصرها همان لانتانیدها (Lantanides) در جدول تناوبی عناصر هستند.
ذکر نکته دیگری در مورد هستههایی با تعداد نوترون یا پروتون فرد خالی از لطف نیست. این هستهها تعداد ایزوتوپ پایدار کمتری نیز دارند. از ۲۶ عنصر تکایزوتوپی (آنهایی که تنها به یک فرم ایزوتوپی حضور دارند) همه به جز ۱ عدد، عدد اتمی فرد دارند. از این تعداد همه به جز ۱ عدد، تعداد نوترون فرد دارند و عنصر بریلیوم $$(Be) $$ در این ۲۶ عدد استثنا است.
قوانینی برای حدس پایداری
در این بخش ۳ حالت را بررسی میکنیم که میتواند تا حد زیادی کمک کند تا در مورد پایداری و ناپایداری ایزوتوپها اظهار نظر کنیم.
- جمع تعداد نوترونها و پروتونها (نوکلئونها) را برای هسته ایزوتوپ مد نظر محاسبه کنید. اگر تعداد نوکلئون زوج بود، به احتمال زیاد ایزوتوپ پایدار است.
- اعداد جادویی پایداری را فراموش نکنید. ۲، ۸، ۲۰، ۲۸، ۵۰، ۸۲ و ۱۱۴ برای پروتون، ۱۲۶ و ۱۸۴ برای نوترون، نشاندهنده پایداری هسته اتم است.
- نسبت نوترون به پروتون را محاسبه کنید و با مراجعه به نمودار پایداری ایزوتوپ موقعیت آن را پیدا کنید.
ایزوتوپ ناپایدار چیست ؟
تعدادی از عنصرها هستههای ناپایداری دارند. به ایزوتوپهای این عنصرها، ایزوتوپ ناپایدار یا رادیوایزوتوپ گفته میشود. این هستهها با تابش پرتو دچار فروپاشی و تغییر میشوند. در مطالعه ایزوتوپهای ناپایدار مفهومی به نام نیمهعمر برای سنجش زمان مورد نیاز برای فروپاشی آنها استفاده میشود که در ادامه آن را با هم بررسی خواهیم کرد.
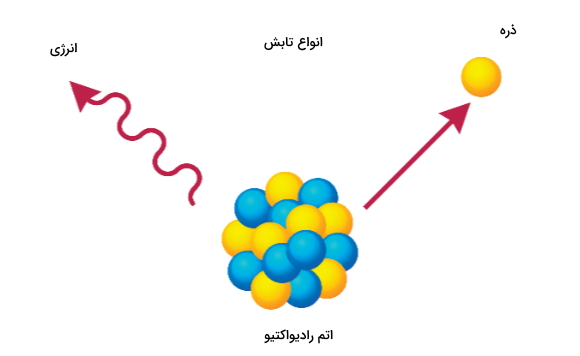
بیشتر ایزوتوپهایی که به صورت طبیعی وجود دارند، پایدار هستند که چیزی در حدود ۲۵۱ ایزوتوپ است. و از مجموع ۲۸۶ ایزوتوپ طبیعی ۳۴ عدد، هسته ناپایدار دارند و به همین دلیل رادیواکتیو هستند. این ۳۴ ایزوتوپ با داشتن نیمهعمر بسیار طولانی، همانطور که پیشتر اشاره کردیم، بهاصطلاح ایزوتوپهای ازلی خوانده میشوند.
نیمه عمر چیست ؟
به زمان مورد نیاز برای اینکه مقدار ایزوتوپ ناپایدار به نصف مقدار اولیه خود برسد، نیمهعمر میگوییم. اگر نیمهعمر هسته یک عنصر بیشتر از عمر سیاره زمین (۴٫۵ میلیارد سال) باشد، مقادیر زیادی از آن از زمان تشکیل منظومه شمسی باقی مانده است و بهاصطلاح به آن «ازلی» (Piromodial) گفته میشود. مثالی از این ایزوتوپها ازلی اورانیوم-۲۳۵ است. در حال حاضر میتوان هستههایی با نیمهعمر ۷۰۰ میلیون سال را شناسایی کرد. نیمهعمرهای بلندتر از این تا بهحال شناسایی نشدهاند، مگر در مورد ایزوتوپهایی که به تازگی تشکیل شده باشند.

پیشبینی میشود برخی ایزوتوپهایی که در طبقه پایدار قرار گرفتهاند، یعنی تا بهحال تابش رادیواکتیوی از آنها مشاهده نشده است، نیمهعمر بسیار طولانی در حد $$10^{18}$$ سال یا بیشتر داشته باشند. اگر روشی برای سنجش دقیق این نیمهعمر وجود میداشت، ممکن بود این ایزوتوپها از طبقه پایدار به ناپایدار انتقال پیدا کنند.
در طول زمان نیز این اتفاق رخ داده است، یعنی برخی ایزوتوپها که پایدار در نظر گرفته میشدند به لیست ایزوتوپهای ناپایدار منتقل شدند. در این مورد مثالی را بررسی خواهیم کرد. دو عنصر بیسموت-۲۰۹ $$(^{209}Bi)$$ و تنگستن-۱۸۰ $$(^{180}W)$$ قبلا در طبقه ایزوتوپهای پایدار قرار داشتند اما در سال ۲۰۰۳ از آنها تابش آلفا دیده شد.
ایزوتوپهای پرتوزاد
برخی دانشمندان بر این باور هستند که بیشتر ایزوتوپهای پایدار در فرایند هستهزایی (Nucleosynthesis) مانند انفجار بزرگ (Big Bang) یا بهوجود آمدن ستارهها در تشکیل منظومه شمسی به وجود آمدهاند. با اینحال برخی ایزوتوپهای پایدار نیز در اثر واپاشی هستههای رادیواکتیو تشکیل شدهاند. به این ایزوتوپها پرتوزاد (Radiogenic) گفته میشود. با اینحال اکثر ایزوتوپهای پایدار موجود از نوع غیرپرتوزاد هستند.
تابش ایزوتوپ ناپایدار
وجود توازن بین تعداد نوترون و پروتون در داخل هسته اتم باعث به وجود آمدن پایداری میشود. در واقع نوترون در کنار پروتون عامل ایجاد پایداری در هسته است و اگر از تعدادی که برای پایداری مورد نیاز است کمتر یا بیشتر باشد هسته ناپایدار و بهاصطلاح میگوییم که ایزوتوپ رادیواکتیو است. در بیشتر موارد ناپایداری به دو روش به وجود میآید.
- تعداد بسیار زیاد پروتون در هسته اتم
- تعداد کم یا زیاد نوترون: بهطوری که نتواند در کنار پروتون پایداری مورد نیاز را به وجود بیاورد.
ایزوتوپهایی با هسته ناپایدار تابشهای متفاوتی از خود ساطع میکنند. با توجه به موقعیت ایزوتوپها در نمودار پایداری میتوان در مورد ماهیت این تابشها نظر داد. این تابشها به صورت متوالی تا زمانی پیش میرود که هسته دختر (Daughter Nucleus) تولید شده از والد (Parent Nucleus)، در نمودار پایداری ایزوتوپ روی خط پایداری قرار بگیرد.
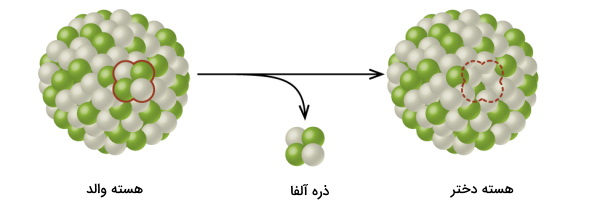
برخلاف واکنشهای شیمیایی که در آنها آرایش لایههای الکترونی عنصرها دستخوش تغییر میشود، در واپاشی هستهای، هسته اتم است که تغییر میکند.
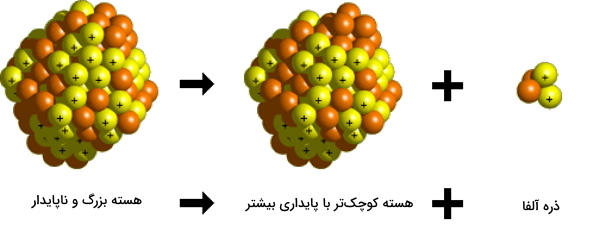
واپاشی آلفا
این واپاشی در بالای خط مورب نمودار پایداری ایزوتوپ صورت میگیرد و با کاهش جرم اتمی عنصر، باعث پایداری آن میشود. واپاشی آلفا این کار را با ساطع کردن یک ذره آلفا که در واقع هسته هلیوم است به انجام میرساند. با وقوع این تابش تعداد پروتونهای ایزوتوپ ۲ واحد و تعداد نوترونهای آن نیز ۲ واحد کاهش مییابد. بنابراین با توجه به رابطه بین پروتون، نوترون و عدد جرمی که در بالا ذکر کردیم، عدد جرمی آن ۴ واحد کاهش پیدا میکند.
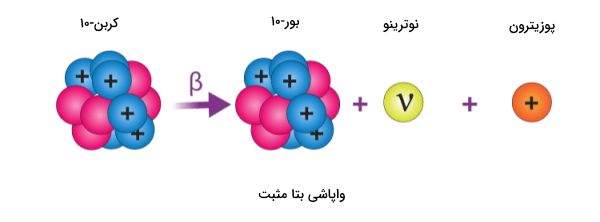
واپاشی بتا مثبت پوزیترون
تابش بتای مثبت پوزیترون و به دام انداختن الکترون زمانی اتفاق میافتد که ایزوتوپ، نوترون بیشتر به دست میآورد. ایزوتوپهایی که دچار این تابش میشوند زیر خط پایداری قرار دارند زیرا تعداد پروتون آنها بیشتر از نوترون است. گویا برای این تعداد پروتون تعداد کمی نوترون وجود دارد. (این ایزوتوپها در نمودار پایداری با رنگ نارنجی نمایش داده شدهاند.)
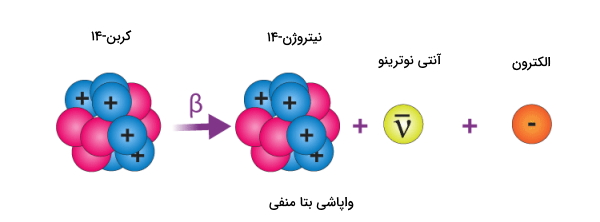
واپاشی بتا منفی
واپاشی بتا منفی پذیرنده پروتون است بنابراین هم تعداد نوترون و هم پروتون را تغییر میدهد. بهطوری که تعداد پروتون ۱ واحد افزایش و تعداد نوترون ۱ واحد کاهش مییابد. این مسیر برای هستههای ناپایداری که تعداد نوترون بالایی دارند اتفاق میافتد. (این ایزوتوپها در نمودار پایداری ایزوتوپ با رنگ آبی مشخص شدهاند.)
آنالیز ایزوتوپی چیست ؟
تا اینجا متوجه شدیم که ایزوتوپ پایدار چیست و از اینجا به بعد در مورد کاربرد آن صحیت خواهیم کرد. آنالیز ایزوتوپی (Isotope Analysis) به مجموعه فعالیتهایی گفته میشود که به اندازهگیری مقدار ایزوتوپ پایدار و ناپایدار هر عنصر در ترکیبهای آلی و معدنی میپردازد. از این آنالیز میتوان برای پیبردن به جریان انرژی در چرخه غذایی برای مطالعه شرایط جوی و محیطی استفاده کرد. همچنین از آنالیز ایزوتوپی برای بررسی رژیم غذایی انسان و حیوان، بسیاری فرایندهای فیزیکی، شیمیایی و زمینشناسی بهره میبرند.

یکی از روشهایی که در آنالیز ایزوتوپی از آن استفاده میشود، به کارگیری طیفسنجی جرمی (Mass Spectrometry) است. بهصورتی که مقدار هر ایزوتوپ را به کمک اندازهگیری نسبت جرم به بار محاسبه میکند.
کاربرد آنالیز ایزوتوپی
دانستن نوع و مقدار هر ایزوتوپ در شرایط مختلف میتواند در مطالعه آن موضوع به ما کمک بسیاری کند. مثلا میتوان از این روش برای سنجش میزان کلسیم استخوان استفاده کرد. در ادامه برخی از مهمترین کاربردهای این روش را بررسی خواهیم کرد.
آنالیز ایزوتوپی در بدن انسان
ایزوتوپ اکسیژن بهطور عمده از طریق تنفس وارد بدن انسان میشود و میتوان برای مطالعه قدمت استخوان و دندان از آن استفاده کرد. اکسیژن در این مورد در تولید هیدروکسی کربونیک آپاتیت سازندهی استخوان و دندان شرکت میکند. استخوان فرد در طول حیات مدام در حال تغییر است اما این در مورد بافت دندان صدق نمیکند. بنابراین با بررسی نسبتهای ایزوتوپی دندان فرد میتوان در مورد اکسیژن موجود در هوای محل تولد و رشد او نظر داد.
همچنین با مطالعه دندان میتوان در مورد سنی که نوزاد نوشیدن شیر مادر را کنار گذاشته است (Weaning) اظهار نظر کرد. زیرا در تولید شیر مادر از آب بدن وی استفاده میشود و این آب غنی از اکسیژن-۱۸ است. میزان اکسیژن-۱۶ بدن مادر به دلیل تعریق و ادرار کمتر از اکسیژن-۱۸ خواهد بود.
آنالیز ایزوتوپی در باستان شناسی (Archaeology)
مواد مورد مطالعه در علم باستانشناسی مانند مو، استخوان و صدف دریایی را میتوان به عنوان نمونه در آنالیز ایزوتوپی به کار برد. برای پی بردن به رژیم غذایی گذشتگان از آنالیز ایزوتوپی کربن، نیتروژن و روی استفاده میشود. از آنالیز کربن میتوان به منبع غذایی مورد استفاده آنها پی برد. منابع کربن در کلاژن (Collagen) و هیدروکسی آپاتیت (Hydroxy Apatite) استخوان باقی میماند. از آنجا که استخوان انسان از دو قسمت آلی (کلاژن) و معدنی (هیدروکسی آپاتیت) تشکیل شده است در آنالیزها نیز منابع پروتئینی در فاز آلی و منابع معدنی مانند کربوهیدارت در فاز معدنی مشاهده میشود.
از آنالیز نیتروژن و تشخیص مقدار نسبت نیتروژن-۱۵ به نیتروژن-۱۴ به وضعیت خاکی که مواد غذایی مورد استفاده فرد از آن به دست میآمده، بهره میبرند. همچنین میتوان اطلاعاتی در مورد وضعیت جوی منطقه نیز به دست آورد. باید بدانیم که حتی اگر دو فرد در یک بازه زمانی در منطقه واحدی زندگی کرده باشند، ممکن است در آنالیز ایزوتوپی نتایجی متفاوتی از خود نشان بدهند. یعنی نحوه رفتار ایزوتوپها درون بدن، از فرد به فرد متغیر خواهد بود.

آنالیز ایزوتوپی در بوم شناسی (Ecology)
تمام عنصرهای فعال بیولوژیکی ، دارای تعدادی ایزوتوپ متفاوت هستند. مثلا کربن به دو فرم وجود دارد: ایزوتوپ کربن-۱۲ که بخش عمده این عنصر را تشکیل میدهد و باقی بهصورت کربن-۱۳ وجود دارد. نسبت ایزوتوپها ممکن است در فرایندهای زیستی و ژئوفیزیکی متفاوت باشد و میتوان از این نکته در مطالعات بومشناسی بهره برد. در آنالیز ایزوتوپی برای مطالعه در بومشناسی از تعدادی عنصر بیشتر استفاده میشود که شامل موارد زیر هستند.
- کربن
- نیتروژن
- اکسیژن
- هیدروژن
- گوگرد
در جایگاهی بعد از این فهرست، ۳ ایزوتوپ سیلیسیم، استرانسیم و آهن نیز در بومشناسی به کار گرفته میشوند.

آنالیز ایزوتوپی در اکوسیستم آبی
مطالعه روی ایزوتوپهای پایدار، به دانشمندان در درک بهتر «اکوسیستم آبی» (Aquatic Ecosystem) از طریق بررسی چرخه غذای دریایی کمک رسانده است. یکی از روشهایی که مورد استفاده قرار میگیرد بررسی میزان حضور ایزوتوپهای مختلف یک عنصر در ماهیچه جانوران دریایی و ماهیها است زیرا نشاندهنده درصد حضور ایزوتوپها در محل زندگیشان خواهد بود. در آنالیز ایزوتوپی اکوسیستمها ایزوتوپهای ۳ عنصر بیشتر از باقی موارد حضور دارند.
- کربن-۱۳
- نیتروژن-۱۵
- گوگرد-۳۴
عموما برای بررسی وضعیت چرخه غذای دریایی از ۳ ایزوتوپ ذکر شده، ۲ مورد را انتخاب میکنند و مطالعات لازم را روی آنها انجام میدهند.

آنالیز ایزوتوپی در پزشکی قانونی
در سالهای اخیر پیشرفتهای بسیاری در آنالیز ایزوتوپی مو در پزشکی قانونی صورت گرفته است. موی انسان در هر ماه ۱۱-۹ میلیمتر و در هر سال حدود ۱۵ سانتیمتر رشد میکند و این میزان رشد به رژیم غذایی فرد بهخصوص آبی که مینوشد بستگی دارد. درصد ایزوتوپهای موجود در آب به منبع آن و بسترهای آن ربط دارد. مهمترین ایزوتوپهای مورد مطالعه در آب شامل استرانسیوم-۸۷، استرانسیوم-۸۸ و اکسیژن هستند و مقادیر آنها در موی انسان قابل ردیابی است.

بنابراین با بررسی موی انسان میتوان حدس زد که در چند وقت اخیر در چه موقعیت جغرافیایی حضور داشته است. مثلا میتوان با کمک این روش حدس زد که فردی که به اتهام ترور دستگیر شده است در گذشته در کشوری خاص زندگی کرده است یا خیر. این روش غیرتهاجمی (Non-Invasiev) در مواردی که مطالعات دیگر مانند بررسی دیانای (DNA) به نتیجهای نمیرسد بسیار مفید و پرکاربرد است.
نکات تکمیلی
در این قسمت میخواهیم بهصورت خلاصه چند نکته مهم در مورد ایزوتوپهای پایدار را مرور کنیم.
- سنگینترین عنصر پایدار جدول تناوبی عناصر بیسموت-۸۳ $$^{209}_{83}Bi$$ است.
- بهطور کلی پایداری ایزوتوپهایی که تعداد پروتون و نوترون زوج-زوج دارند نسبت به آنهایی که فرد-فرد هستند، بیشتر است.
- تمام ایزوتوپهایی که عدد اتمی بیشتر از ۸۳ دارند، ناپایدار و رادیواکتیو هستند.
- تمام ایزوتوپهایی با عدد اتمی کمتر از ۸۳ حداقل ۱ ایزوتوپ پایدار دارند. در این بین تکنسیم-۴۳ $$(Tc)$$ و پرومتیوم-۶۱ $$(Pm)$$ استثنا هستند.
- در بین عنصرها، قلع بیشترین تعداد ایزوتوپهای پایدار (۱۰ عدد) را دارد.
- به ایزوتوپهایی که بهصورت نظری ناپایدار در نظر گرفته میشوند اما تاکنون تابشی از آنها مشاهده و ثبت نشده است، ایزوتوپ پایدار شهودی میگویند.
- به ایزوتوپهایی که به دلیل داشتن نیمهعمر بسیار طولانی و غیرقابل اندازهگیری پایدار در نظر گرفته میشوند، ایزوتوپهای ازلی گفته میشود.
ایزوتوپ ها کجا حضور دارند ؟
ایزوتوپها در همهجای کره زمین حضور دارند، در غذایی که میخوریم، آبی که مینوشیم و هوایی که تنفس میکنیم. مقدار و نوع آنها با توجه به منبع و جغرافیایی که در آن حضور داریم متفاوت خواهد بود. این ایزوتوپها در روند رشد بدن انسان تاثیر دارند و از غذا و آب به بافت بدن منتقل میشوند و اسکلت استخوانی آن را میسازند.
مثالهایی از محاسبه پایداری و ناپایداری ایزوتوپ ها
تا اینجا متوجه شدیم که ایزوتوپ پایدار چیست و از چه طریقی میتوان به پایداری آن پی برد. در این بخش با مثالهایی این موضوع را روشنتر میکنیم.
مثال اول
کربن ۳ ایزوتوپ دارد که همیشه مورد استفاده دانشمندان است:
- $$^{12}C$$
- $$^{13}C$$
- $$^{14}C$$
برای ایزوتوپ کربن-۱۲ ، تعداد نوترون،پروتون، تعداد کل نوکلئون و نسبت نوترون به پروتون را محاسبه کنید.
جواب:
تعداد کل نوکلئونهای کربن-۱۲ برابر ۱۲ است، یعنی همان عدد جرمی هسته اتم. با نگاه به جدول تناوبی عناصر متوجه میشویم که عدد اتمی یا تعداد پروتونهای کربن فارغ از اینکه چه ایزوتوپی از آن باشد، برابر با ۶ است. با کمک گرفتن از معادلهای که پیشتر آوردیم و جایگذاری اعداد، تعداد نوترون آن به دست میآید.
$$A=N + Z $$
$$12=N + 6 $$
$$12-6=N$$
$$N=6$$
حال میتوانیم نسبت نوترون به پروتون هسته اتم کربن را محاسبه کنیم:
$$N\:Zrightarrow1\:1 $$
در واقع ۹۹٪ کربن موجود در کره زمین از همین ایزوتوپ است.
مثال دوم
برای ایزوتوپ $$^{18}_8O$$، تعداد نوترون، پروتون و نسبت نوترون به پروتون را به دست آورید.
جواب:
تعداد پروتونهای هسته که برابر با عدد اتمی است، همانطور که در پایین اکسیژن نوشته شده، ۸ است. با کم کردن تعداد پروتون از عدد جرمی، تعداد نوترونها به دست میآید.
$$A=N + Z $$
$$12=N + 8 $$
$$18-8=N$$
$$N=10$$
حال میتوانیم نسبت نوترون به پروتون هسته اتم کربن را محاسبه کنیم:
$$N\:Zrightarrow10\:8 $$
$$N\:Zrightarrow1.25\:1 $$
مثال سوم
چند ایزوتوپ نام ببرید که ترکیب هسته آنها فرد-فرد است.
پاسخ:
- هیدروژن-۲
- لیتیم-۶
- بور-۱۰
- نیتروژن-۱۴
مثال چهارم
با توجه به نمودار پایداری ایزوتوپ، اگر ایزوتوپی بالای خط مورب و در سمت راست باشد، چه نوع رادیواکتیوی است؟
پاسخ:
با توجه به نموداری پایداری ایزوتوپ، ایزوتوپهای دارای تابش آلفا که با رنگ زرد نمایش داده میشوند، در بالای خط مورب و سمت راست قرار دارند.
مثال پنجم
با توجه به نموداری پایداری ایزوتوپ، بگویید هر ایزوتوپ چه حالتی دارد؟ آیا پایدار است؟ در صورت ناپایداری چه تابشی از خود ساطع میکند؟
- $${^{40}_{20}Ca} $$
- $${^{54}_{25}Mn} $$
- $${^{210}_{84}Po} $$
پاسخ:
- کلسیم پایدار است زیرا در هسته خود ۲۰ نوترون دارد که یکی از اعداد جادویی ذکر شده در این مطلب است.
- منگنز ناپایدار است زیرا تعداد پروتون و نوترون آن هر دو فرد است.
- پلوتونیوم دارای تابش آلفا است زیرا عدد جرمی آن ۸۴ و از اولین قانون جدول بالا پیروی میکند.
مثال ششم
با توجه به اطلاعات بیان شده در این مطلب، در مورد پایدار یا ناپایدار بودن ایزوتوپهای زیر بهطور کامل نظر دهید.
- $${_{15}^{30} P}$$
- $${_{43}^{98} Tc}$$
- $$Tin-118$$
- $${_{94}^{239} Pu}$$
- $${_{90}^{232} Th}$$
- $${_{20}^{40} Ca}$$
- $${_8^{15} O}$$
- $${_{57}^{139} La}$$
پاسخ:
این ایزوتوپ فسفر دارای ۱۵ نوترون و ۱۵ پرتون است. بنابراین نسبت نوترون به پروتون در آن بهصورت ۱:۱ خواهد بود. گرچه عدد اتمی ۱۵ بسیار کمتر از ۸۳ است که عنصرهای سنگینتر از آن همگی ناپایدار هستند، اما نسبت نوترون به پروتون در این مورد از مقدار قابل انتظار برای عنصری با این جرم کمتر است. بهعلاوه در این ایزوتوپ هم تعداد نوترون و هم پروتون عددی فرد است که احتمال ناپایدار بودن ایزوتوپ را بالا میبرد. پس میتوان حدس زد که $${_{15}^{30} P}$$ ناپایدار و در نتیجه رادیواکتیو است.

این ایزوتوپ عنصر تکنسیم دارای ۵۵ نوترون و ۴۳ پروتون است. با محاسبه نسبت نوترون به پروتون عدد ۱٫۲۸ به دست میآید که باعث میشود ایزوتوپ در لبه خط پایداری قرار بگیرد. عدد اتمی این ایزوتوپ ۴۳ و از ۸۳ بسیار کمتر است. با در نظر گرفتن این موارد ممکن است تصور کنیم ایزوتوپ پایدار است با اینحال توجه داشته باشید که هم تعداد نوترون و هم تعداد پروتون فرد است و این ترکیب بهندرت ایزوتوپ پایداری را به وجود میآورد. در نتیجه $${_{43}^{98} Tc}$$ ناپایدار و رادیواکتیو است.

این ایزوتوپ قلع ۶۸ نوترون و ۴۳ پروتون دارد و نسب تعداد نوترون به پروتون در آن برابر با ۱.۳۶ است. مانند مورد قبل این موارد ما را تشویق میکنید که نظر به پایداری آن بدهیم. بهعلاوه هم تعداد نوترون و هم تعداد پروتون در این ایزوتوپ زوج است که خود احتمال پایداری را افزایش میدهد. نکته آخری که به ما اطمینان میدهد این است که تعداد پروتونهای آن ۵۰ است که جزو اعداد جادویی پایداری است. بنابراین میتوان اینطور نتیجهگیری کرد که ایزوتوپ قلع-۱۱۸ پایدار است.

عدد اتمی این ایزوتوپ ۹۴ و بیشتر از ۸۳ است. همگی ایزوتوپهایی که تعداد پروتون آنها بیشتر از این عدد باشد ناپایدار هستند. بنابراین میتوان اینطور نتیجهگیری کرد که این ایزوتوپ پلوتونیوم ناپایدار و رادیواکتیو است.

مانند مثال قبل عدد اتمی این ایزوتوپ بیشتر از ۸۳ است و میدانیم تمامی ایزوتوپهایی که بیشتر از ۸۳ پروتون داشته باشند ناپایدار هستند. بنابراین این ایزوتوپ توریم نیز ناپایدار است و از خود تابش ساطع میکند.

این ایزوتوپ کلسیم دارای ۲۰ نوترون و ۲۰ پروتون است بنابراین نسبت این دو بهصورت ۱:۱ خواهد بود. باید توجه داشته باشیم که هر دوی این اعداد زوج هستند و این احتمال پایداری آن را بالا میبرد. بهعلاوه تعداد نوترون برابر با ۲۰ جزو اعداد جادویی پایداری است. در نتیجه میتوان اینطور جمعبندی کرد که این ایزوتوپ پایدار است و از خود تابشی ساطع نمیکند.

ابتدا تعداد نوترون و پروتون ایزوتوپ را مینویسیم. این ایزوتوپ ۸ پروتون و ۷ نوترون دارد. ممکن است با کمی عجله اینطور برداشت کنیم که چون ۸ جزو اعداد جادویی پایداری است، این ایزوتوپ نیز پایدار است اما باید توجه داشته باشیم که نسبت نوترون به پروتون برای آن کوچکتر از ۱ است. بهعلاوه تعداد نوترون آن فرد است. در نتیجه این ایزوتوپ اکسیژن ناپایدار و رادیواکتیو است.

تعداد پروتون و نوترون این ایزوتوپ به ترتیب برابر با ۵۷ و ۸۲ است، بنابراین نسبت نوترون به پروتون مساوی ۱٫۴۳ و بزرگتر از ۱ است. عدد اتمی آن پایینتر از ۸۳ بوده و میتواند پایدار باشد. نوترون در این ایزوتوپ جزو اعداد جادویی پایداری و تعداد پروتون نیز فرد است. بنابراین ایزوتوپ لانتیانیوم پایدار است و از خود تابشی ساطع نمیکند.

سوالات متدوال
حال که میدانیم ایزوتوپ پایدار چیست و چه نقشی در زندگی انسان دارد، میخواهیم به چند سوال مهم و پرتکرار در مورد آنها پاسخ دهیم.
آیا کربن ایزوتوپی پایدار است ؟
بله کربن دارای ۲ ایزوتوپ پایدار بهصورت کربن-۱۲ و کربن-۱۳ است.
ایزوتوپ پرتوزاد چیست ؟
ایزوتوپ پرتوزاد ایزوتوپی است که در اثر واپاشی هستههای رادیواکتیو تشکیل شده باشد.
چند ایزوتوپ پایدار وجود دارد ؟
تعداد ایزوتوپهای پایدار شناخته شده ۲۵۱ عدد است.
ایزوتوپ ناپایدار چیست ؟
به هستههایی که به دلیل داشتن انرژی بالا دچار واپاشی هستهای میشوند و از خود تابشی ساطع میکنند، ایزوتوپ ناپایدار گفته میشود.
کدام عنصرها هستند که تنها یک ایزوتوپ پایدار دارند ؟
۲۶ عنصر وجود دارند که تنها یک فرم ایزوتوپی پایدارند دارند، از آنها میتوان به فلوئور $$(F)$$، کبالت $$(Co)$$، ید $$(I)$$ و سزیم $$(Cs)$$ اشاره کرد.
کاربرد ایزوتوپ های پایدار چیست ؟
از ایزوتوپهای پایدار در آنالیز ایزوتوپی در زمینههای متنوعی مانند بومشناسی، پزشکی قانونی و باستانشناسی استفاده میشود.
کدام عنصرها با وجود تعداد نوترون و پروتون فرد، پایدار هستند ؟
۵ عنصر وجود دارند که با وجود داشتن تعداد نوترون و پروتون فرد هسته پایداری دارند.
- هیدروژن-۲ (دوتریم): $${^2_1H} $$
- لیتیم-۶: $${^{6}_3Li} $$
- بور-۱۰: $${^{10}_5B} $$
- نیتروژن-۱۴: $${^{14}_7N} $$
- تانتالم-۱۸۰ام: $${^{180}_{73}Ta} $$
اعداد جادویی پایداری چیستند ؟
هر ایزوتوپی که تعداد نوترون یا پروتونی (یا هر دو) مشابه لیست زیر داشته باشد، پایدار است. به اینها اعداد جادویی پایداری میگویند.
- اعداد جادویی پایداری پروتون: ۲، ۸، ۲۸، ۵۰، ۸۲ و ۱۱۴
- اعداد جادویی پایداری نوترون: ۲، ۸، ۲۰، ۲۸، ۵۰، ۸۲، ۱۲۶ و ۱۸۴
کدام عنصر است که بیشترین تعداد ایزوتوپ های پایدار را دارد ؟ به چه تعدادی ؟
عنصر قلع که با نماد $$Ti$$ نشان داده میشود بیشترین تعداد ایزوتوپ پایدار (۱۰ عدد) را دارد.
جمع بندی
هدف از خواندن این مطلب این بود که بدانیم ایزوتوپ پایدار چیست و چه کاربردهایی دارد. ایزوتوپهای پایدار در مقابل ایزوتوپهای ناپایدار و رادیواکتیو قرار دارند و از خود تابشی ساطع نمیکنند. از آنالیز این ایزوتوپها برای ردیابی در علومی مانند باستانشناسی، بومشناسی و پزشکی قانونی استفاده میشود. برای تشخیص پایداری یا عدم پایداری یک هسته میتوان از تعدادی قوانین که در این مطلب بهطور مفصل بررسی شده است، کمک گرفت.
جدول تمام ایزوتوپ های پایدار
حالا که این مطلب را خواندیم و دانستیم ایزوتوپ پایدار چیست بهتر است لیستی از عنصرهایی که ایزوتوپ پایدار دارند را بهطور کامل ارائه کنیم. در این جدول لیست کاملی از تمام ایزوتوپهای پایداری که وجود دارند را آوردهایم.
| نام عنصر | نماد عنصر | عدد جرمی ایزوتوپ(های) پایدار |
| هیدروژن | $$H$$ | ۱ و ۲ |
| هلیوم | $$He$$ | ۳ و ۴ |
| لیتیوم | $$Li$$ | ۶ و ۷ |
| بریلیوم | $$Be$$ | ۹ |
| بور | $$B$$ | ۱۰ و ۱۱ |
| کربن | $$C$$ | ۱۲ و ۱۳ |
| نیتروژن | $$N$$ | ۱۴ و ۱۵ |
| اکسیژن | $$O$$ | ۱۷ و ۱۸ |
| فلوئور | $$F$$ | ۱۹ |
| نئون | $$Ne$$ | ۲۰ و ۲۱ و ۲۲ |
| سدیم | $$Na$$ | ۲۳ |
| منیزیم | $$Mg$$ | ۲۴ و ۲۵ و ۲۶ |
| آلومینیوم | $$Al$$ | ۲۷ |
| سیلیسیم | $$Si$$ | ۲۸ و ۲۹ و ۳۰ |
| فسفر | $$P$$ | ۳۱ |
| گوگرد | $$S$$ | ۳۲ و ۳۳ و ۳۴ و ۳۶ |
| کلر | $$Cl$$ | ۳۵ و ۳۷ |
| آرگون | $$Ar$$ | ۳۶ و ۳۸ و ۴۰ |
| پتاسیم | $$K$$ | ۳۹ و ۴۱ |
| کلسیم | $$Ca$$ | ۴۰ و ۴۲ و ۴۳ و ۴۴ و ۴۶ |
| اسکاندیوم | $$Sc$$ | ۴۵ |
| تیتانیوم | $$Ti$$ | ۴۶ و ۴۷ و ۴۸ و ۴۹ و ۵۰ |
| وانادیوم | $$V$$ | ۵۱ |
| کروم | $$Cr$$ | ۵۰ و ۵۲ و ۵۳ و ۵۴ |
| منگنز | $$Mn$$ | ۵۵ |
| آهن | $$Fe$$ | ۵۴ و ۵۶ و ۵۷ و ۵۸ |
| کبالت | $$Co$$ | ۵۹ |
| نیکل | $$Ni$$ | ۶۰ و ۶۱ و ۶۲ و ۶۴ |
| مس | $$Cu$$ | ۶۳ و ۶۵ |
| روی | $$Zn$$ | ۶۴ و ۶۶ و ۶۷ و ۶۸ و ۷۰ |
| گالیوم | $$Ga$$ | ۶۹ و ۷۱ |
| ژرمانیوم | $$Ge$$ | ۷۰ و ۷۲ و ۷۳ و ۷۴ |
| آرسنیک | $$As$$ | ۷۵ |
| سلنیوم | $$Se$$ | ۷۴ و ۷۶ و ۷۷ و ۷۸ و ۸۰ |
| برم | $$Br$$ | ۷۹ و ۸۱ |
| کریپتون | $$Kr$$ | ۸۰ و ۸۲ و ۸۳ و ۸۴ و ۸۶ |
| روبیدیوم | $$Rb$$ | ۸۵ |
| استرانسیوم | $$Sr$$ | ۸۴ و ۸۶ و ۸۷ و ۸۸ |
| ایتیریوم | $$Y$$ | ۸۹ |
| زیرکونیوم | $$Zr$$ | ۹۰ و ۹۱ و ۹۲ و ۹۴ |
| نیوبیوم | $$Nb$$ | ۹۳ |
| مولیبدن | $$Mo$$ | ۹۲ و ۹۴ و ۹۵ و ۹۶ و ۹۷ و ۹۸ |
| روتنیوم | $$Ru$$ | ۹۶ و ۹۸ و ۹۹ و ۱۰۰ و ۱۰۱ و ۱۰۲ و ۱۰۴ |
| رودیوم | $$Rh$$ | ۱۰۳ |
| پالادیوم | $$Pd$$ | ۱۰۲ و ۱۰۴ و ۱۰۵ و ۱۰۶ و ۱۰۸ و ۱۱۰ |
| نقره | $$Ag$$ | ۱۰۷ و ۱۰۹ |
| کادمیوم | $$Cd$$ | ۱۰۶ و ۱۰۸ و ۱۱۰ و ۱۱۱ و ۱۱۲ و ۱۱۴ |
| ایندیوم | $$In$$ | ۱۱۳ |
| قلع | $$Sn$$ | ۱۱۲ و ۱۱۴ و ۱۱۵ و ۱۱۶ و ۱۱۷ و ۱۱۸ و ۱۱۹ و ۱۲۰ و ۱۲۲ و ۱۲۴ |
| آنتیموان | $$Sb$$ | ۱۲۱ و ۱۲۳ |
| تلوریوم | $$Te$$ | ۱۲۰ و ۱۲۲ و ۱۲۳ و ۱۲۴ و ۱۲۵ و ۱۲۶ |
| ید | $$I$$ | ۱۲۷ |
| زنون | $$Xe$$ | ۱۲۶ و ۱۲۸ و ۱۲۹ و ۱۳۰ و ۱۳۱ و ۱۳۲ و ۱۳۴ |
| سزیم | $$Cs$$ | ۱۳۳ |
| باریم | $$Ba$$ | ۱۳۲ و ۱۳۴ و ۱۳۵ و ۱۳۶ و ۱۳۷ و ۱۳۸ |
| لانتیانیوم | $$La$$ | ۱۳۹ |
| سریوم | $$Ce$$ | ۱۳۶ و ۱۳۸ و ۱۴۰ و ۱۴۲ |
| پرازئودمیم | $$\Pr$$ | ۱۴۱ |
| نئودمیوم | $$Nd$$ | ۱۴۲ و ۱۴۳ و ۱۴۵ و ۱۴۶ و ۱۴۸ |
| ساماریوم | $$Sm$$ | ۱۴۴ و ۱۴۹ و ۱۵۰ و ۱۵۲ و ۱۵۴ |
| اوروپیوم | $$Eu$$ | ۱۵۳ |
| گادولینیوم | $$Gd$$ | ۱۵۴ و ۱۵۵ و ۱۵۶ و ۱۵۷ و ۱۵۸ و ۱۶۰ |
| تبریوم | $$Tb$$ | ۱۵۹ |
| دیسپروسیوم | $$Dy$$ | ۱۵۶ و ۱۵۸ و ۱۶۰ و ۱۶۱ و ۱۶۲ و ۱۶۳ و ۱۶۴ |
| هولمیوم | $$Ho$$ | ۱۶۵ |
| اربیوم | $$Er$$ | ۱۶۲ و ۱۶۴ و ۱۶۶ و ۱۶۷ و ۱۶۸ و ۱۷۰ |
| تولیم | $$Tm$$ | ۱۶۹ |
| ایتربیوم | $$Yb$$ | ۱۶۸ و ۱۷۰ و ۱۷۱ و ۱۷۲ و ۱۷۳ و ۱۷۴ و ۱۷۶ |
| لوتتیوم | $$Lu$$ | ۱۷۵ |
| هافنیوم | $$Hf$$ | ۱۷۶ و ۱۷۷ و ۱۷۸ و ۱۷۹ و ۱۸۰ |
| تانتالم | $$Ta$$ | ۱۸۰ |
| تنگستن | $$W$$ | ۱۸۲ و ۱۸۳ و ۱۸۴ و ۱۸۶ |
| رنیوم | $$Re$$ | ۱۸۵ |
| اوسمیوم | $$Os$$ | ۱۸۷ و ۱۸۸ و ۱۸۹ و ۱۹۰ و ۱۹۲ |
| ایریدیوم | $$Ir$$ | ۱۹۱ و ۱۹۳ |
| پلاتینیوم | $$Pt$$ | ۱۹۲ و ۱۹۴ و ۱۹۵ و ۱۹۶ و ۱۹۸ |
| طلا | $$Au$$ | ۱۹۷ |
| جیوه | $$Hg$$ | ۱۹۶ و ۱۹۸ و ۱۹۹ و ۲۰۰ و ۲۰۱ و ۲۰۲ و ۲۰۴ |
| تالیم | $$Ti$$ | ۲۰۳ و ۲۰۵ |
| سرب | $$Pb$$ | ۲۰۴ و ۲۰۶ و ۲۰۷ و ۲۰۸ |











تا دیدار دیگر اگر خدا خواست شما را به خداوند متعال میسپارم هزار افرین بر شما
بسیار خوب وساده بنده دررشته علوم انسانی درس خواندم اما با مطالعه این مطالب بخوبی فهمیدم تشکر از جوانان و اساتید ایران عزیز دست مریزاد
مرسی چقدرخوب و روان توضیح دادید.
بسیار عالی بود. مخصوصا جدول آخر که قرار داده بودید. توی سایتهای دیگه اینقدر قشنگ توضیح نداده بودند. ممنون