عنصر سدیم چیست؟ – به زبان ساده
سدیم (Sodium | Na) با عدد اتمی ۱۱ از عنصرهای فلزات قلیایی گروه ۱ جدول تناوبی است. این فلز، رنگی نقرهای مایل به سفید و واکنشپذیری بسیاری بالایی دارد. این عنصر ششمین عنصر فراوان در پوسته زمین و بههمراه کلر از فراوانترین عناصر محلول در آب اقیانوس هستند. نمک خوراکی یکی از ترکیبهای بسیار پرکاربرد آن در صنعت بهشمار میآید. در این مطلب با ویژگیهای این فلز و ترکیبات مختلف آن آشنا خواهید شد.


سدیم چیست ؟
سدیم با عدد اتمی ۱۱ و نماد شیمیایی Na که از واژه آلمانی «Natrium» گرفته شده است یکی از فلزات قلیایی است. این عنصر فلزی نرم، بسیار واکنشپذیر و رنگی نقرهای مایل به سفید دارد. تنها ایزوتوپ پایدار آن است که بهطور آزاد در طبیعت یافت نمیشود و از کانیهایی مانند «فلدسپات» (Feldspar)، «سودالیت» (Sodalite) و «سنگ نمک یا هالیت» (Halite) استخراج میشود. نمکهای Na انحلالپذیری بالایی در آب دارند و این فلز به همراه کلر از فراوانترین عناصر محلول در آب اقیانوس هستند.

این عنصر مانند منیزیم (Mg)، استرانسیم (Sr) و باریم (Ba) نخستین بار توسط شیمیدان بزرگ «همفری دیوی» (Humphry Davy) از برقکافت یا الکترولیز سدیم هیدروکسید به دست آمد.
فلزات قلیایی
این فلز به همراه لیتیم (Li)، پتاسیم (K)، روبیدیم (Rb)، سزیم (Cs) و فرانسیم (Fr) عناصر تشکیلدهنده فلزات قلیایی هستند. فلزات قلیایی و هیدروژن در گروه ۱ جدول تناوبی قرار دارند. بهدلیل تشکیل قلیا هنگام واکنش با آب به این فلزات، قلیایی گفته میشود. ترکیبات هیدروکسید این فلزات مانند پتاسیم هیدروکسید بازهای قوی هستند.

این فلزات نرم، ظاهری براق و نقطه ذوب پایین و واکنشپذیری بالایی در هوای آزاد دارند، به همین دلیل معمولاً در نفت نگهداری میشوند. فلزات قلیایی با از دست دادن بیرونیترین الکترون لایه ظرفیت خود به کاتیونهای تبدیل میشوند.
سزیم، پنجمین فلز این گروه با عدد اتمی ۵۵، واکنش پذیرترین فلز در بین تمام فلزات جدول تناوبی است. با افزایش عدد اتمی و حرکت از بالاترین عنصر گروه به سمت پایینترین عنصر به ترتیب ویژگیهای زیر تغییر میکند.
- افزایش واکنشپذیری
- افزایش شعاع اتمی
- کاهش الکترونگاتیوی
- کاهش نقطه ذوب و جوش
در این گروه، بهطور کلی چگالی از بالا به پایین افزایش پیدا میکند. تنها پتاسیم از این قاعده پیروی نمیکند و چگالی کمتری نسبت به Na دارد.
ویژگیهای فیزیکی
در دما و فشار استاندارد Na فلزی نقرهای و نرم است و برای اینکه خواص خود را حفظ کند باید بهطور کامل در روغن یا گاز نجیب قرار بگیرد در غیر این صورت به سرعت با اکسیژن هوا ترکیب میشود و سدیم اکسید سفید متمایل به خاکستری تولید میشود.

فلز Na به راحتی با چاقو برش داده میشود. از آنجا که این فلز تنها یک الکترون در لایه ظرفیتی خود دارد، رسانای خوبی برای الکتریسیته و گرما به حساب میآید. این موضوع موجب ایجاد پیوند فلزی ضعیف و الکترونهای آزاد حامل انرژی، میشود. این عنصر از نظر چگالی در بین فلزات عنصری بهدلیل جرم اتمی کم و شعاع اتمی زیاد سومین عنصر با چگالی بسیار کم است و بههمراه لیتیم و پتاسیم یکی از سه فلزی است که میتواند روی آب شناور بماند.
برخی از ویژگیهای این عنصر با افزایش فشار بهطور چشمگیری تغییر میکند. برای مثال:
- در ۱/۵ مگابار، رنگ فلز از نقرهای به سیاه در میآید.
- در ۱/۹ مگابار به رنگ قرمز شفاف تبدیل میشود.
- در ۳ مگابار، این فلز جامدی شفاف و بیرنگ میشود.
همه این دگرشکلها که در فشارهای بالا بهوجود میآیند، «الکترید» (Electride) و عایق هستند.
نقطه ذوب
نقطه ذوب این عنصر ۹۸ درجه سانتیگراد و نقطه جوش آن ۸۸۳ درجه سانتیگراد است که کمتر از لیتیم است اما در مقایسه با فلزات قلیایی سنگینتر موجود در قسمت پایین گروه مانند پتاسیم، روبیدیم و سزیم و به دلیل تغییرات تناوبی، نقطه ذوب و جوش بالاتری دارد.
رنگ شعله
در آزمون شعله، Na و ترکیبات آن به رنگ زرد پدیدار میشوند، زمانی که الکترونهای برانگیخته ۳s سدیم از اوربیتال ۳p به ۳s منتقل میشوند، فوتون آزاد میکنند که طول موج این فوتون با خط D، خطوط فراونهوفر در حدود ۵۹۸/۳ نانومتر مطابقت دارد.
رنگ زرد نور خورشید و دیگر ستارگان اغلب توسط اتمهای Na ایجاد میشود.

برهمکنشهای اسپین-مدار که الکترون در مدار ۳p را شامل میشوند، خط D را به دو قسمت در طول موجهای ۵۸۹/۶ و ۵۸۹/۰ نانومتر تفکیک میکنند. «ساختار هایپرفاین» (Hyperfine Structure) که هر دو اوربیتال را درگیر میکنند منجر به تشکیل خطوط بسیار بیشتری میشوند.
ایزوتوپ ها
از میان بیست ایزوتوپ شناخته شده این عنصر، تنها پایدار است. در فرایند کربنسوزی در ستارگان از ترکیب دو اتم کربن به یکدیگر تشکیل میشود که برای تولید آن به دمای بالاتر از ۶۰۰ مگاکلوین و یک ستاره با جرمی حداقل سهبرابر خورشید نیاز است. دو ایزوتوپ کیهانی و پرتوزای این فلز محصول جانبی پرتوهای کیهانی میباشند.
- ایزوتوپ : نیمهعمر آن ۲/۶ سال است.
- ایزوتوپ : نیمهعمری نزدیک به ۱۵ ساعت دارد.
همهٔ ایزوتوپهای دیگر این عنصر، نیمه عمری کمتر از یک دقیقه دارند.
ویژگیهای شیمیایی
اتمهای سدیم یک الکترون بیشتر از پیکربندی پایدار نئون گاز نجیب پیش از خود دارند در واقع سدیم ۱۱ الکترون دارد. معمولاً ترکیبات یونی سدیمدار کاتیون را بهوجود میآورند. انرژی یونش اول و دوم سدیم به ترتیب ۴۹۵/۸ و ۴۵۶۲ کیلوژول بر مول است. بهطور کلی فلز سدیم نسبت به پتاسیم واکنشپذیری کمتری و نسبت به لیتیم واکنشپذیرتر است. اگرچه پتاسیم و لیتیم پتانسیل منفی بیشتری نسبت به سدیم دارند اما فلز سدیم با پتانسیل کاهش استاندارد برابر با ۲/۷۱- ولت به شدت احیاکننده است.
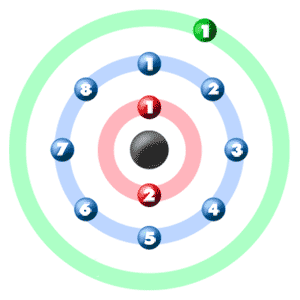
مدل اتمی سدیم
عدد اتمی که همان تعداد پروتونهای عنصر است برای سدیم برابر با ۱۱ و تعداد الکترونهای آن نیز با تعداد پروتونها برابر است. در مدل اتمی این عنصر، در هسته ۱۲ نوترون و ۱۱ پروتون وجود دارد که الکترونها در سه لایه الکترونی پیرامون هسته قرار گرفتهاند. به الکترونهای بیرونیترین لایه الکترونی، الکترون ظرفیت گفته میشود.
| مدل اتمی سدیم | |
| نوترون | ۱۲ |
| پروتون | ۱۱ |
| الکترون | ۱۱ |
| لایه الکترونی | ۳ |
| تعداد الکترونهای لایه اول | ۲ |
| تعداد الکترونهای لایه دوم | ۸ |
| تعداد الکترونهای لایه سوم | ۱ |
| الکترون ظرفیت | ۱ |
در مدل اتمی بور، الکترونهای پیرامون هسته نمایش داده میشود. هر لایه تعداد مشخصی الکترون را در خود جای میدهند. الکترونهای موجود در نزدیکترین لایه به هسته کمترین انرژی و در دورترین لایه، بیشترین انرژی را دارند.
مراحل رسم مدل بور اتم سدیم:
برای رسم مدل اتمی Na ابتدا باید تعداد پروتونها، الکترونها و نوترونهای اتم Na را پیدا کرد. پروتونها ذراتی با بار مثبت و نوترونها ذراتی بدون بار هستند که در هسته قرار میگیرند. الکترونها بار منفی دارند و پیرامون هسته در گردش هستند. تعداد پروتونها با عدد اتمی عنصر برابر است.
تعداد نوترونها از رابطه زیر بهدست میآید. عدد جرمی Na برابر با ۲۳ و تعداد نوترونهای آن برابر با ۱۲ است.
عدد اتمی - عدد جرمی عنصر = تعداد نوترونها
بنابراین در اتم خنثی Na تعداد پروتونها، الکترونها و نوترونها به صورت زیر است.
- تعداد الکترونها: ۱۱
- تعداد پروتونها: ۱۱
- تعداد نوترونها: ۱۲

حال با توجه به تعداد الکترونی که هر لایه میتواند داشته باشد، ۱۱ الکترون Na را باید در هر لایه قرار داد. اولین لایه تنها ۲ الکترون و لایه دوم ۸ الکترون ظرفیت دارند. بنابراین دو الکترون در لایه نخست و ۸ الکترون در دومین لایه قرار میگیرند. لایه سوم ظرفیت ۱۸ الکترون دارد و تنها یک الکترون باقیمانده است که در این لایه قرار میگیرد.
محلول های آبی
سدیم همانند سایر فلزات قلیایی، به صورت گرماده با آب واکنش میدهد. واکنش این فلز با آب موجب تولید ترکیب سود سوزآور یا سدیم هیدروکسید و گاز هیدروژن قابل اشتعال میگردد. واکنش سوختن آن در مجاورت اکسیژن هوا موجب تشکیل سدیم پراکسید با مقداری سدیم اکسید میشود. ایجاد لایهای از سدیم اکسید روی سطح سدیم موجب تغییر رنگ آن از نقرهای به کدر و خاکستری مات میشود.

این عنصر تمایل زیادی به تشکیل ترکیبات محلول در آب همانند سولفاتها، نیتراتها، هالیدها، کربوکسیلاتها و کربناتها دارد. در ترکیبات محلول آب بهشکل کمپلکسهای آبی وجود دارد که در آن n = ۴–۸ است. مقادیر n = 6 از دادههای «بلورنگاری پرتوی ایکس» (X-ray Crystallography) و شبیهسازیهای کامپیوتری بهدست آمدهاند.
بهدلیل انحلالپذیری و تمایل زیاد نمکهای سدیم با آب معمولاً این ترکیبات بهطور مستقیم بهشکل رسوب دیده نمیشوند. سدیم بیسموتات از جملههای نمکهای این فلز است که از این قاعده پیروی نمیکند. ترکیبات نمک آن معمولاً از راه تبخیر یا استفاده از ضدحلالی مانند اتانول بهشکل جامد جدا میشوند. انحلالپذیری سدیم کلرید در اتانول تنها ۰٫۳۵ گرم در لیتر است.
از «اترهای تاجی» (Crown Ethers)، همچون ۱۵-کرون-۵ ، میتوان برای «فروکافت تغییر فاز» (Phase-transfer Catalyst) استفاده کرد. میزان سدیم در نمونهها را میتوان بوسیلهٔ طیفسنجی جذب اتمی یا با استفاده از الکترودهای انتخاب یونی در پتانسیومتری تعیین کرد.
الکتریدها و سدیدها
این فلز مانند سایر فلزات قلیایی در در آمونیاک و برخی آمینها حل میشود و محلولهای رنگی بسیار پررنگی ایجاد میکند. تبخیر این محلول ورقههای براقی از سدیم فلزی به جا میگذارد. محلولها این فلز، حاوی کمپلکس شیمیایی هستند. کریپتاندها (Cryptand) شرایط جداسازی این کمپلکسها را به صورت جامد کریستالی فراهم میسازند. این عنصر همچنین با کریپتاندها، اترهای تاجی و دیگر لیگاندها کمپلکس تشکیل میدهد.

ترکیبات ارگانوسدیم
تاکنون ترکیبات ارگانوسدیم بسیاری ساخته شدهاند. پیوندهای سدیم-کربن قطبیت بالایی دارند و مانند منابع کربانیون رفتار میکنند و نمکهای آلی را تولید میکنند. برخی از این ترکیبات عبارتند از:
- سدیم سیکلوپنتادیانید
- سدیم تریتیل با فرمول
- سدیم نفتالین با فرمول ، که از مخلوط کردن سدیم و نفتالین در محلولهای اتری ایجاد میشود.
ترکیبات میانفلزی
این عنصر با فلزهای مانند پتاسیم (K)، کلسیم (Cl)، سرب (Pb) و عناصر گروه ۱۱ و ۱۲ تشکیل آلیاژ میدهد.
- ترکیب سدیم و پتاسیم: از ترکیب این دو عنصر آلیاژهای و تولید میشود. آلیاژ با نسب ۴۰ تا ۹۰ پتاسیم که در دمای اتاق در فاز مایع است رسانای بسیار خوب گرما و الکتریسیته است.
- ترکیب سدیم و کلسیم: از ترکیب این دو فلز نمکهای دوتایی و سهتایی تولید میشود.
- ترکیب سدیم و سرب: سدیم در حالت مایع با فلز سرب مخلوط میشود. آلیاژ این دو فلز را میتوان به روشهای گوناگونی تولید کرد. یکی از این روشها ذوب هر دوی آنها با یکدیگر و روش دیگر، رسوب سدیم به صورت الکترولیتی روی کاتدهای مذاب سرب میباشد. برخی از آلیاژهای شناختهشده این دو فلز عبارتند از:
همچنین آلیاژهایی با طلا ، نقره ، روی ، کادمیم و جیوه تشکیل میدهد.
ترکیبات سدیم
ترکیبات این فلز اهمیت تجاری بسیار زیادی بهویژه در صنایع تولید شیشه، پارچه، کاغذ و صابون دارند. در ترکیبات آن، عنصر سدیم معمولاً به صورت یون، به آب و آنیونها متصل میشود و به عنوان یک اسید لوئیس سخت به حساب میآید. از مهمترین ترکیبات این فلز عبارتند از:
- نمک خوراکی
- سدیم کربنات
- سدیم هیدروژنکربنات یا جوش شیرین
- سدیم هیدروکسید
- سدیم نیترات
- سدیم فسفات
- سدیم تیوسولفات
- بوراکس
بسیاری از صابونها نمک سدیم «اسیدهای چرب» (Fatty Acids) میباشند. صابونهای سدیم در مقایسه با صابونهای پتاسیم دمای ذوب بالاتری دارند و در اصطلاح «سختتر» به حساب میآیند. اکسیدهای مخلوط سدیم فوتوکاتالیست و کاتالیزورهای نویدبخشی هستند. یون سدیم با فعالیت فتوشیمیایی خود فوتوالکتروکاتالیستی تنگستن تریاکسید را افزایش میدهد.
در زیر برخی از مهمترین ترکیبات این عنصر فهرست شدهاند:
- سدیم کلرید: این ترکیب معدنی با نقطه ذوب ۸۰۱ درجه سلسیوس به شکل بلورهای سفید رنگ است. این ترکیب گاهی بهدلیل وجود برخی عناصر مانند منیزیم رنگهای صورتی و خاکستری نیز دارد. نمک خوراکی تعادل مایعات بدن را حفظ می کند و برای بقای موجودات زنده لازم است. استفاده از نمک برای طعم دادن به غذا از کاربردهای رایج آن است و از مهمترین و قدیمیترین طعمدهندههای مورد استفاده توسط انسان است. به دلیل خواص کلر و سدیم و همچنین ترکیبات آنها، نمک به یکی از مواد پرکاربرد در صنعت تبدیل شده است. فرمول شیمیایی و نقطه ذوب این ترکیب در زیر آورده شده است.

- سدیم اکسید: این ترکیب با فرمول شیمیایی و نقطه ذوب ۱٬۹۵۰ درجه سلسیوس جامدی سفید رنگ است در تولید سرامیک و شیشه استفاده میشود.
- سدیم هیدروکسید: این ترکیب معدنی با فرمول شیمیایی نقطه ذوبی نزدیک به ۱٬۳۸۸ درجه سلسیوس دارد. این ترکیبی بازی قوی است که میتواند موجب سوختگی پوست شود. انحلالپذیری بالایی در آب دارد و به راحتی رطوبت و کربن دیاکسید را از هوا جذب میکند.

- سدیم بیکربنات: جوش شیرین با فرمول شیمیایی یکی از ترکیبات شناخته شده این فلز است. از جوش شیرین در پخت و پز در نقش تخمیرکننده استفاده میشود.

- سدیم نیترات: این ترکیب شیمیایی با فرمول جامدی سفید رنگ با انحلالپذیری بالا در آب است. از در مقیاس صنعتی برای تولید انواع کود کشاورزی، مواد آتشزا، بمبهای دودزا و مواد منفجره، لعابهای شیشه و سفال و نگهدارندههای مواد غذایی استفاده میشود.
- سدیم استات: این ترکیب با فرمول شیمیایی که بهطور کوتاهنوشت بهشکل NaOAc نیز نوشته میشود از جمله نمکهای خوراکی است. همچنین در صنعت نساجی، فرایند ساخت بتن کاربرد دارد.
کاربرد سدیم چیست ؟
فلز Na در تولید استرها و ترکیبات آلی نقش بسیار مهمی دارد. از آن برای بهبود ساختار برخی از آلیاژها نیز استفاده میشود. ترکیب یا سود سوزآور از شناخته شدهترین ترکیبات Na است که در تولید صابون کاربرد دارد. نمک از دیگر ترکیبات پرکاربرد این عنصر عامل یخزدایی و مادهای مغذی برای حیوانات از جمله انسان است. از این فلز همچنین برای رسوبزدایی و خالصسازی فلزات و ساخت شیشه نیز استفاده میشود.
برخی از کاربردهای این عنصر در زیر فهرست شدهاند.
- در نقش براقکننده در فلزات استفاده میشود.
- فاز مایع این فلز در نقش خنککننده در راکتورهای هستهای استفاده میشود.
- از نمک آن برای اسیدهای چرب در صابون استفاده میشود.
- ترکیب ، عاملی مهم انتقال حرارت است.
- از ترکیبات این عنصر در صنایع کاغذ، نساجی، نفت و صنایع شیمیایی استفاده میشود.
- ترکیب برای درمان درماتوفیتوز یا قارچ پوستی (Dermatophytosis) بهطور گسترده استفاده میشود.
- این فلز برای تولید نور و روشنایی در چراغهای خیابانی بهکار میرود، زیرا میتواند درخشش زرد با درخشندگی روشن ایجاد کند.
- از هیدروکسید آن در پاککنندهها استفاده میشود.
لامپ بخار سدیم
«لامپ بخار سدیم» (Sodium-vapor Lamp) از نوع لامپهای تخلیه در گاز است که از سدیم در حالت برانگیخته برای تولید نور با طول موج ۵۸۹ نانومتر استفاده میشود.

کارکرد زیستی سدیم چیست ؟
این فلز همچنین از عنصرهای ضروری برای موجودات زنده بهشمار میرود و یونهای آن از اجزای اصلی «مایعات برونسلولی» (Extracellular Fluid | ECF) هستند و نقش عمدهای در فشار اسمزی و حجم محفظه ECF دارند. از دست دادن آب محفظه ECF منجر به افزایش غلظت سدیم میگردد، وضعیتی که به آن «هایپرناترمی» (Hypernatremia) گفته میشود.
سلولهای انسان بوسیلهٔ پمپ سدیم-پتاسیم، سه یون Na را به ازای دو یون پتاسیم پمپ شده، از سلول خارج میسازند. با مقایسه غلظت یون از داخل به خارج در سراسر غشای سلولی، به این نتیجه میرسیم که Na، حدود ۱ به ۱۰ و پتاسیم حدود ۴۰ به ۱ میباشد. در سلولهای عصبی، بار الکتریکی موجود در سرتاسر غشای سلول هنگام انتقال جریانهای عصبی یا «پتانسیل عمل» (Action Potential) از بین میرود که Na در افزایش بار الکتریکی آن، نقش بسزایی دارد.
سوالات متدوال
در این بخش به برخی از پرسشهای رایج در مورد این عنصر فلزی (Na) پاسخ داده شده است.
سدیم چند الکترون دارد ؟
این عنصر ۱۱ الکترون دارد.
سدیم چه رنگی است ؟
فلز Na رنگی نقرهای مایل به سفید دارد و هنگام سوختن روی شعله نوری زرد رنگ از خود تابش میکند.

سدیم چند نوترون دارد ؟
این عنصر ۱۲ نوترون دارد.
سدیم جامد است یا مایع ؟
فلز Na بهطور طبیعی جامد است ولی در شرایطی میتواند به مایع نیز تبدیل شود.
سدیم فلز است؟
عنصر Na از فلزات قلیایی است.













بسیار معلومات دلچسپ بود و برایم مفید تمام شد