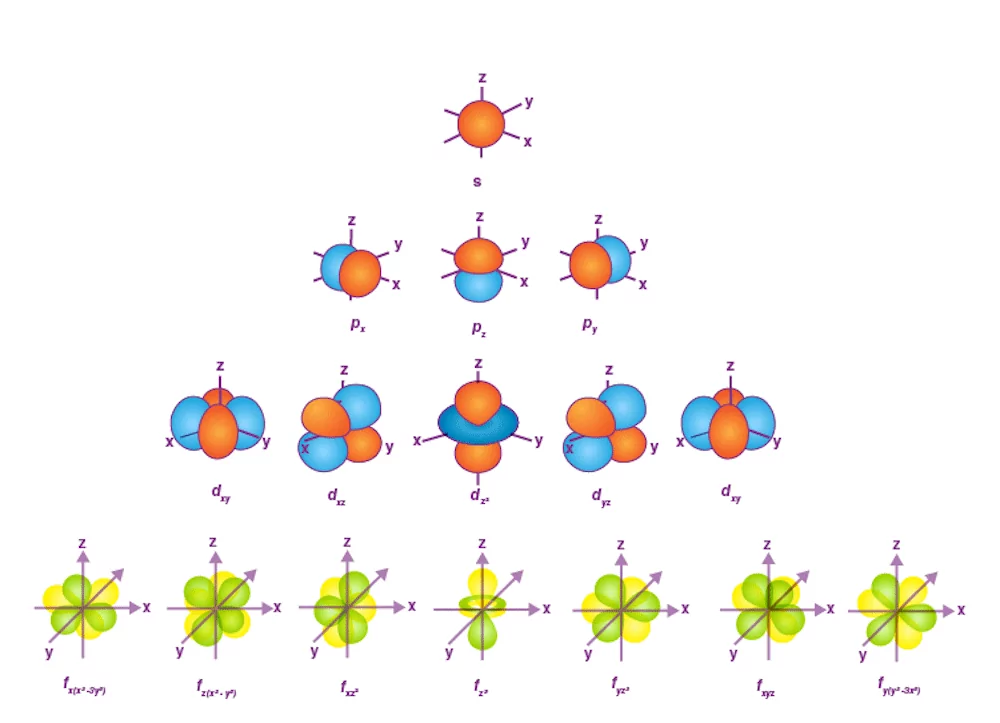
ساختار اتم و اجزای آن چگونه است؟ – به زبان ساده + نمونه سوال با جواب

ساختار اتم، ساختاری است که از پروتون، نوترون و الکترون تشکیل شده است که هر کدام دارای ویژگیهایی منحصربهفرد هستند. در این مطلب از مجله فرادرس میخواهیم به مفهوم ساختار اتم بپردازیم و روند تکمیل دانش پیرامون آن را مرور کنیم. همچنین در مورد انواع ذرههای زیراتمی نیز صحبت خواهیم کرد.
ساختار اتم چیست؟
«ساختار اتم» (Atomic Structure) به ساختاری اشاره دارد که در آن یک اتم از یک «هسته» (Nucleus) در مرکز خود ساخته شده است که ذرههایی با بار منفی به نام «الکترون» (Electron) حول محور آن میچرخند. همچنین در هسته دو ذره وجود دارد که یکی دارای بار مثبت به نام «پروتون» (Proton) و دیگری ذرهای خنثی به نام «نوترون» (Neutron) نامیده میشود.
مطالعه ساختار اتم باعث میشود دید بهتری نسبت به مفاهیمی مانند واکنشهای شیمیایی، پیوندهای شیمیایی و ویژگیهای فیزیکی آنها به دست آوریم.
تعریف اتم و عنصر
در این بخش میخواهیم بدانیم دو مفهوم اتم و عنصر چه تفاوتهایی با یکدیگر دارند زیرا در مواردی این دو با هم اشتباه گرفته میشوند. عنصر ماده شیمیایی خالص یا خامی است که از تعدادی اتم ساخته شده باشد. اتمها در جدول تناوبی عناصر با توجه به عدد اتمی خود دستهبندی میشوند. میتوان اینطور بیان کرد که اتم کوچکترین عضو سازنده یک عنصر است. در فهرست زیر به برخی از تفاوتهای این دو مفهوم اشاره کردهایم.
- اتم سادهترین بخش یک عنصر است اما عنصر سادهترین بخش یک ماده است و معمولا نمیتوان آن را به بخشهای کوچکتری تقسیم کرد.
- اتمها از ذرههای زیراتمی به نام الکترون، پروتون و نوترون تشکیل شدهاند اما عنصر تنها از یک نوع اتم به وجود میآيد.
- از اتصال اتمها به یکدیگر مولکولها به وجود میآیند. در صورتی که این اتمها همه از یک نوع باشند، عنصر به وجود میآید. عنصرها نیز در ترکیب با یکدیگر مولکول را به وجود میآورند.
مدلهای اتمی
در طول قرن ۱۸ و ۱۹ میلادی تعداد زیادی از دانشمندان تلاش کردند تا به کمک مدلهای اتمی تعریف دقیقی از ساختار اتم به دست دهند. هر کدام از این مدلها مزایا و معایبی داشتند و هر کدام به نوبه خوب نقش موثری در پیشرفت مدل اتمی مدرن بازی کردند. در زیر به معرفی و بررسی تعدادی از مهمترین و تاثیرگذارترین مدلهای اتمی خواهیم پرداخت.
نظریه اتمی دالتون
شیمیدان انگلیسی «جان دالتون» (John Dalton) در نظریه اتمی خود پیشنهاد داد که تمامی مواد از اتمها ساخته شدهاند که به نظر او شکسته نمیشدند و از بین نیز نمیرفتند. دالتون همچنین بیان کرد که تمامی اتمهای یک عنصر دقیقا مشابه یکدیگر هستند اما با اتمهای عنصرهای دیگر جدول تناوبی تفاوت دارند.
با توجه به نظریه اتمی دالتون، واکنشی شیمیایی در واقع بازآرایی از اتمها است که طی آن محصولات به وجود میآيد. با توجه به این نظریه، ساختار اتمی از اتمهایی تشکیل میشود که کوچکترین ذرات مسئول انجام واکنشهای شیمیایی هستند. در فهرست زیر فرضهایی که دالتون برای نظریه اتمی خود در نظر گرفته است را آوردهایم.
- تمامی مواد از اتمها تشکیل شدهاند.
- اتمها غیرقابل شکستن هستند.
- برخی از عنصرهای ویژه در ساختار خود تنها ۱ نوع اتم دارند.
- هر اتمی جرم ثابت خود را دارد و این جرم از عنصری به عنصر دیگر تغییر میکند.
- اتمها طی یک واکنش شیمیایی دستخوش بازآرایی میشوند.
- اتمها نه به وجود میآیند و نه از بین میروند اما میتوانند از نوعی به نوع دیگر تبدیل شوند.
نظریه اتمی دالتون توانست قوانین مسلط بر واکنشهای شیمیایی را بهخوبی توجیه کند. این قوانین شامل «قانون بقای جرم» (Law Of Conservation Of Mass)، «قانون نسبتهای معین» (Law Of Definite Proportions)، «قانون نسبتهای چندگانه» (Law Of Multiple Proportions) و «قانون نسبتهای متقابل» (Law Of Reciprocal Proportions) میشوند.
معایب نظریه اتمی دالتون
نظریه اتمی دالتون معایبی نیز دارد که در فهرست زیر آنها را مشاهده میکنید.
- این نظریه نمیتواند وجود ایزوتوپها را توجیه کند.
- هیچ اطلاعاتی در مورد ساختار اتمها به دست نمیدهد.
- با گذر زمان دانشمندان به وجود ذرههایی در اتم پی بردند و این فرضیه غیرقابل شکست بودن اتم را رد میکند.
کشف ذرههای سازنده اتم که آنها را با نام ذرههای زیر اتمی میشناسیم، باعث شد درک بهتری از گونههای شیمیایی به دست بیاید. روند کشف این ذرهها در گذر زمان را میتوانید در مدلهای اتمی پیش رو مشاهده کنید.
مدل اتمی تامسون
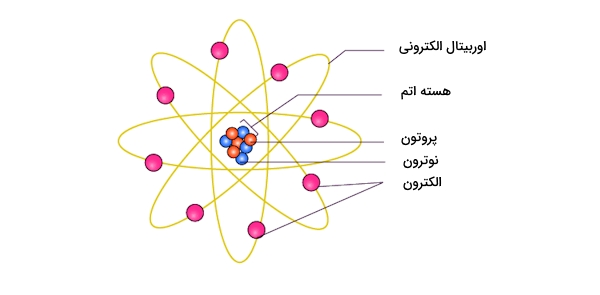
شیمیدان انگلیسی «سر جوزف جان تامسون» (Sir Joseph John Thomson) مدل اتمی خود در اوایل قرن ۱۹ ارائه داد. او در سالهای بعد برای کشف «الکترون» (Eelectron) بزنده جایز نوبل شد. اساس و پایه این نظریه «آزمایش اشعه کاتدی» (Cathode Ray Expriment) است که در ادامه به بررسی آن خواهیم پرداخت.
آزمایش اشعه کاتدی
در این آزمایش لولهای شیشهای وجود دارد که دو دهانه دارد. در یکی از آنها پمپ خلاء وجود دارد و از دیگری گازی نجیب به داخل آن وارد میشود. تصویر این لوله را میتوانید در زیر مشاهده کنید که همراه با اجزای آن آورده شده است.
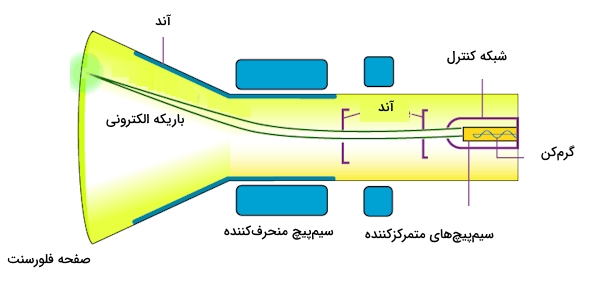
نقش پمپ خلاء این است که خلائی جزئی در داخل شیشه ایجاد کند. به این لوله منبع تغذیهای ولتاژ قوی با استفاده از الکترودها (کاتد و آند) که درون لوله نصب شدهاند، وصل میشود. مشاهدات تامسون را در ادامه آوردهایم.
- زمانی که منبغ تعذیهای ولتاژ قوی روشن میشود، شاهد تابش پرتوهایی از کاتد به سمت آند هستیم. این مورد به کمک لکههای فلورسنت روی صفحه $$ZnS$$ مورد استفاده، تایید میشود. از این پرتوها با عنوان پرتو کاتدی یاد میشود.
- زمانی که به آن میدان الکتریکی اعمال میشود، پرتوهای کاندی منحرف میشوند و به سمت الکترود مثبت جهتگیری میکنند. در صورتی که در غیاب این میدان الکتریکی مسیری مستقیم را میپیمایند. چرخش اشعههای کاتدی را در حضور میدان الکتریکی در تصویر زیر مشاهده میکنید.
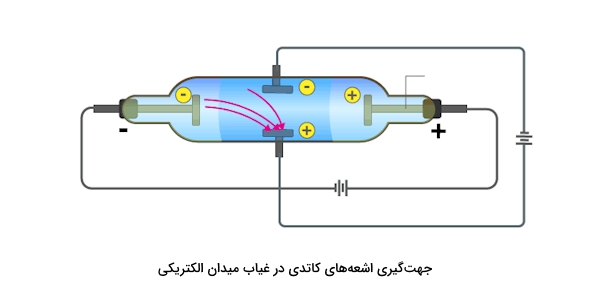
- زمانی که پرههایی چرخان در مسیر اشعههای کاتدی قرار میگیرند، به چرخش در میآیند. این چرخش ثابت میکند که اشعههای کاتدی از ذرههایی با جرم مشخص ساخته شدهاند و دارای انرژی هستند.
- با توجه به تمام مشاهداتی که تا اینجا به آن پرداختیم، تامسون اینطور نتیجهگیری کرد که اشعه کاتدی از ذرههایی با بار منفی تشکیل شدهاند و آنها را الکترون نامگذاری کرد.
- با اعمال میدان الکتریکی و مغناطیسی از طریق اشعههای کاتدی (الکترونها) تامسون توانست به نسبت بار به جرم الکترونها دست پیدا کند. او این مقدار را بهصورت زیر به دست آورد.
$$ (e/m)_{ electron}: 17588 \times 10^{11}\; e/kg $$
با در دست داشتن این نسبت، مقدار بار الکترون توسط آزمایش قطره روغن رادرفورد به دست آمد و مقادیر را میتوان بهصورت زیر نمایش داد.
$$ Charge_{ e^–} = 1.6 × 10^{-16} \;C $$
$$ Mass_{ e^–} = 9.1093 × 10^{-31}\; kg $$
نتیجهگیری مدل اتمی تامسون
با توجه به مشاهدات در آزمایش اشعه کاتدی، تامسون به این نتیجهگیری رسید که میتوان ساختار اتمی را بهصورت فضایی با بار مثبت توصیف کرد که الکترونهایی با بار منفی در آن پراکنده شدهاند.
از این مدل با عنوان مدل کیک کشمشی نیز یاد میشود. دلیل این نامگذاری این است که میتوان کل فضای اتم را مانند کیکی در نظر گرفت که بار مثبت دارد. در این کیک کشمشهایی پراکنده شدهاند که همان الکترونها با بار منفی هستند. این تشابه را میتوانید در تصویر زیر مشاهده کنید.
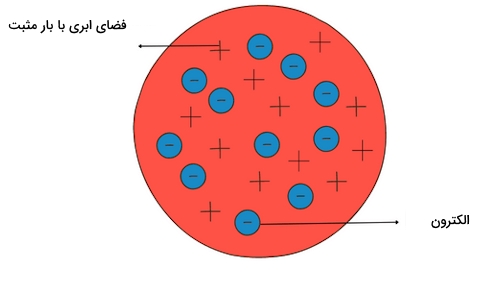
در نظریه اتمی تامسون، اتمها بهصورت ساختارهایی بدون بار الکتریکی یا خنثی توصیف شدند. در واقع مقدار و تعداد ذرههایی با بار مثبت را با ذرههایی با بار منفی درون این ساختار برابر با یکدیگر در نظر گرفت.
محدودیتهای نظریه اتمی تامسون
در نظریه اتمی تامسون پایداری ساختارهای اتمی بهخوبی توضیح داده نشده است. همچنین ذرههای زیراتمی که بعد از آن کشف شدهاند را نیز نمیتوان در این مدل جا داد. به عبارتی وجود آنها توسط این مدل اتمی غیرقابل توجیه است.
نظریه اتمی رادرفور
رادرفورد شاگرد تامسون بود و با کشف هسته اتم، نظریه اتمی جدیدی را پیشنهاد داد. رادرفورد این نظریه را با توجه به آزمایش پراکندگی اشعه آلفا پیشنهاد داد. در ادامه میخواهیم کمی بیشتر در مورد جزئیات مدل اتمی رادرفورد بدانیم.
آزمایش پراکندگی اشعه آلفا
در این آزمایش یک ورقه طلای بسیار نازک با ضخامت ۱۰۰۰ اتم به کار گرفته میشود. سپس آن را تحت بمباران با ذرههای آلفا قرار میدهیم. همانطور که میدانید ذرههای آلفا از هلیوم با دو بار مثبت بهصورت $$He^{2+}$$ تشکیل شده است. همچنین پشت ورقههای طلا از «گوگرد روی» ($$ZnS$$) استفاده میشود.
مشاهدات آزمایش پراکندگی اشعه آلفا
پس از بمباران ورقه طلا توسط اشعه آلفا، رادرفورد مشاهدات خود را بهصورت زیر یادداشت کرد.
- بیشتر اشعههای آلفا از ورقه طلا عبور کردند و روی صفحه گوگرد روی واقع در پشت آن، لکههای روشن به جا گذاشتند.
- تعدادی از اشعهها بعد از برخورد با ورقه طلا منعکس شدند.
- از هر ۱۰۰۰ اشعه آلفا، ۱ عدد پس از برخورد با ورقه طلا با زاویهای ۱۸۰ درجه (در جهت مخالف) منعکس میشود.
نتیجهگیری آزمایش پراکندگی اشعه آلفا
با توجه به مشاهداتی که در بخش قبلی به آنها اشاره کردیم رادرفورد توانست به نتایج جالبی در مورد ساختار اتم دست پیدا کند که آنها را در ادامه آوردهایم.
- از آنجا که بیشتر اشعهها از ورقه طلا عبور میکند، رادرفورد به این نتیجه رسید که بخش اعظم فضای اتم باید خالی باشد.
- تعدادی از اشعهها منعکس شدند که این نشاندهنده دفع آنها توسط بار مثبت موجود در اتم است.
- از هر ۱۰۰۰ اشعه ۱ عدد در جهت مخالف بازتابانده شد، رادرفور این را به وجود باری بسیار مثبت در مرکز اتم ربط داد و از آن با عنوان هسته یاد کرد.
- به نظر رادرفور مقدار عمده بار و جرم ساختار اتم به هسته موجود در مرکز آن برمیگردد.
ساختار اتم در نظریه رادرفور
با توجه به آزمایش ورقه طلا و مشاهدات حاصل از آن، رادرفور برای توضیح چگونگی ساختار هسته اتم پیشنهادهای خود را بهصورت زیر ارائه داد.
- هسته اتم در مرکز آن قرار دارد که شامل عمده جرم و باری است که در ساختار هر اتم مشاهده میشود.
- ساختار اتمی کروی است.
- الکترونها در مداری دایرهای به دور هسته اتم میچرخند. این چرخش مانند مسیری است که سیاره زمین در اطراف خورشید طی میکند.
محدودیتهای مدل اتمی رادرفورد
مدل اتمی رادرفورد اطلاعات بسیاری در اختیار افراد قرار میدهد اما همچنان کامل نیست و با محدودیتهایی همراه است. در فهرست زیر به تعدادی از این محدودیتها اشاره کردهایم.
- اگر الکترونها در مداری به دور هسته بچرخند، نیاز به صرف انرژی برای این کار دارند. بهعلاوه در مسیر این گردش باید به جاذبه موجود از سمت هسته نیز غلبه کنند. بنابراین الکترونها نیاز به انرژی بسیار بالایی دارند و در صورتی که این میزان انرژی تمام شود، به هسته سقوط میکنند. مشاهده میکنید که از این مدل اتمی نمیتوان برای توضیح پایداری اتمها بهره برد.
- در صورتی که در واقعیت الکترونها بهطور پیوسته دور هسته در چرخش باشند، طیف مورد انتظار آن نیز پیوسته خواهد بود در صورتی که طیف اتمها خطی است.
مدل اتمی بور
«نیلز بور» (Neils Bohr) اولین مدل اتمی خود را در سال ۱۹۱۵ ارائه کرد. این مدل پرکاربردترین مدلی است که برای توصیف ساختار اتم به کار گرفته میشود. مبنای این نظریه اتمی، «نظریه کوانتیزاسیون پلانک» (Planck's Theory Of Quantization) است. در ادامه به معرفی مدل اتمی بور خواهیم پرداخت.
- الکترونها در اتم در مداری گسسته حضور دارند که به نام «مدار ثابت» (Stationary Orbits) نامیده میشوند.
- سطوح انرژی این لایهها را میتوان به کمک اعداد کوانتومی نشان داد.
- الکترونها با دریافت انرژی میتوانند به لایههای بالاتری بروند. همچنین قادر هستند انرژی خود را از دست بدهند و منتشر کنند تا به لایههایی با انرژی پایینتر بروند.
- تا زمانی که یک الکترون در لایه خود باقی بماند، نه انرژی جذب میکند و نه از خود انرژی منتشر خواهد کرد.
- الکترونها در اطراف هسته اتم تنها در مدارهای ثابتی میچرخند.
- انرژی مدارهای ثابت «کوانتیزه» (Quantised) است.
محدودیت مدل اتمی بور
این نظریه نیز با وجود پیشرفت فراوانی نسبت به نظریههای پیشین، با محدودیتهایی روبرو است که آن را در ادامه آوردهایم.
- نظریه اتمی بور تنها برای گونههایی با یک الکترون کارکرد دارد. برای مثال میتوان به گونههای $$H$$، $$He^+$$، $$Li^{2+}$$ و $$Be^{3+}$$ اشاره کرد.
- زمانی که طیف نشری هیدروژن در طیفسنجی با دقت بالاتری مشاهده شد، هر طیف ترکیبی از تعدادی خطوط گسسته کوچکتری بود.
- از این نظریه نمیتوان برای توجیه «اثر اشتارک» (Stark Effect) و «اثر زیمان» (Zeeman Effect) استفاده کرد. اثر اشتارک به انحراف الکترونها در حضور میدان الکتریکی اشاره دارد. همچنین اثر زیمان پدیدهای است که به انحراف الکترونها در حضور میدان مغناطیسی میپردازد.
ذرههای زیراتمی
امروزه و با پیشرفت علم میدانیم که اتمها از سه ذره زیراتمی پروتون، نوترون و الکترون تشکیل شدهاند و هر کدام جایگاه ویژه خود را دارند. در این بخش به معرفی این ذرههای زیر اتمی میپردازیم.
پروتون
از ویژگی «پروتونها» (Protons) میتوان به موارد زیر اشاره کرد.
- پروتونها ذرههایی زیراتمی با بار مثبت هستند. بار پروتون برابر با بار ۱ الکترون، بهصورت $$ 1.602 \times 10^{-19 }$$ کولن است.
- جرم یک پروتون تقریبا برابر با $$ 1.672 \times 10^{-24 }$$ کیلوگرم است.
- پروتون از الکترون حدود ۱۸۰۰ برابر سنگینتر است.
- تعداد کل پروتونهای موجود در یک اتم همیشه برابر با عدد اتمی آن عنصر است.
نوترون
«نوترونها» (Neutrons) ذرههای زیراتمی بیباری هستند که در هسته قرار دارند. از ویژگیهای این ذره میتوان به موارد زیر اشاره کرد.
- جرم نوترون تقریبا برابر با جرم پروتون و مساوی با $$ 1.674 \times 10^{-24 }$$ کیلوگرم است.
- نوترونها از نظر الکتریکی خنثی هستند و باری را با خود حمل نمیکنند.
- ایزوتوپهای مختلف یک عنصر دارای تعداد برابری از پروتون هستند اما تعداد نوترونهای موجود در هسته آنها با یکدیگر متفاوت است.
الکترون
الکترونها که ذرههای زیر اتمی خارج از هسته اتم هستند، ویژگیهای زیر را دارند.
- الکترونها داری یک بار منفی هستند و بار الکتریکی آنها برابر با $$ 1.602 \times 10^{-19 }$$ کولن است.
- جرم الکترون برابر با $$ 9.1 \times 10^{-31 }$$ کیلوگرم است.
- با توجه به وزن بسیار پایین و قابل اغماضی که الکترونها دارند، آنها را در اندازهگیری جرم اتم لحاظ نمیکنیم.
ساختار اتمی ایزوتوپها
«نوکلئونها» (Neucleons) ذرههای تشکیلدهنده هسته اتم هستند و میتوانند بهصورت پروتون یا نوترون حضور داشته باشند. ممکن است از یک عنصر، اتمهایی به تعداد نوکلئون متفاوت وجود داشته باشید که در ادامه به بررسی آن خواهیم پرداخت. پیش از آن باید مفهوم چند اصطلاح را بدانیم.
عدد اتمی چیست؟
هر هسته دارای تعداد منحصربهفردی پروتون است که آن را به عنوان «عدد اتمی» (Atomic Number) نیز میشناسیم. بنابراین عدد اتمی هر اتم یکی از ویژگیهای آن به شمار میآید و میتوان از آن برای شناسایی اتم نیز استفاده کرد.
عدد جرمی چیست؟
به مجموع تعداد نوکلئونهای هر اتم (پروتون و نوترون) نیز «عدد جرمی» (Mass Number) گفته میشود.
نماد شیمیایی عنصر چیست؟
«نماد شیمیایی» (Chemical Symbol) اسامی مخففی هستن که برای نشان دادن عنصرهای شیمیایی موجود در جدول تناوبی از آنها استفاده میشود. در تصویر زیر نماد شیمیایی منیزیم را مشاهده میکنید.
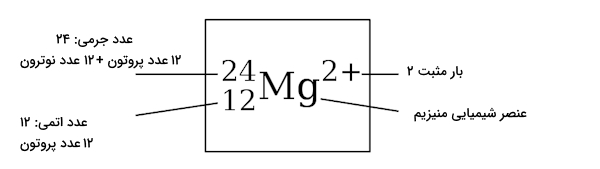
عدد جرمی در سمت چپ بالا، عدد اتمی در سمت چپ پایین و بار الکتریکی در بالا سمت راست نوشته میشود. بنابراین میتوان از نماد شیمیایی یک عنصر به اطلاعات بسیار مفیدی در مورد آن دست پیدا کرد.
ایزوتوپ چیست؟
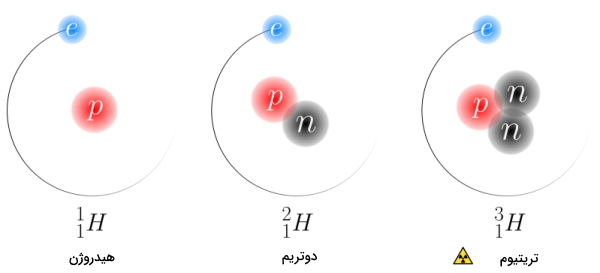
«ایزوتوپها» (Isotops) اتمهای متفاوتی از یک عنصر با تعداد پروتون برابر هستند اما در تعداد نوترون با یکدیگر تفاوت دارند. برای نمایش ساختار اتمی ایزوتوپها میتوان از نماد شیمیایی آنها استفاده کرد که در آن عدد اتمی و عدد جرمی به چشم میآید. برای مثال در زیر ۳ ایزوتوپ متفاوت عنصر هیدروژن را مشاهده میکنید. همانطور که در نماد آن نیز پیداست، این اتمها دارای عدد اتمی برابر و عدد جرمی متفاوت هستند.
ایزوتوپهای یک عنصر در پایداری نیز با یکدیگر تفاوتهایی دارند و در نتیجه دارای نیمهعمرهای متفاوتی هستند. با این حال معمولا در رفتار شیمیایی مشابه هستند زیرا ساختار الکترونی آنها کاملا یکسان است.
بررسی ساختار اتمی تعدادی عنصر
ساختار اتمی هر عنصر را میتوان با تعداد پروتون، نوترون و الکترون موجود در آن معرفی کرد. در این بخش به بررسی ساختار اتمی تعدادی از عنصرهای بسیار متداول میپردازیم.
ساختار اتمی هیدروژن
هیدروژن دارای سه ایزوتوپ است که در طبیعت یافت میشوند. این ایزوتوپها را در زیر مشاهده میکنید.
- $$^1H$$: این ایزوتوپ به نام «پروتویم» (Protium) شناخته میشود و درصد فراوانی ایزوتوپی برابر با ۹۹٫۹۸ درصد دارد. در هسته این اتم تنها ۱ عدد پروتون وجود دارد و از این نظر بسیار ویژه است زیرا در ساختار هسته خود فاقد نوترون است.
- $$^2H$$: این ایزوتوپ با نام «دوتریم» (Deuterium) شناخته میشود و در هسته خود دارای ۱ نوترون و ۱ پروتون است.
- $$^3H$$: این ایزوتوپ «تریتیوم» (Tritium) نامیده میشود و در هسته خود داری ۲ نوترون و ۱ پروتون است. این ایزوتوپ هیدروژن رادیواکتیو است.
در بخش بالا تصویر این ایزوتوپهای هیدروژن را مشاهده کردید. همانطور که میبینید با توجه به متغیر بودن تعداد نوترونها، عدد جرمی آنها نیز با یکدیگر متفاوت است.
ساختار اتمی کربن
کربن دارای دو ایزوتوپ پایدار کربن-۱۲ و کربن-۱۳ و یک ایزوتوپ ناپایدار کربن-۱۴ است. فراوانی کربن-۱۲ برابر با ۹۸٫۹ درصد است که در آن ۶ الکترون، ۶ نوترون و ۶ پروتون وجود دارد. ایزوتوپهای متفاوت این عنصر را در تصویر زیر مشاهده میکنید.
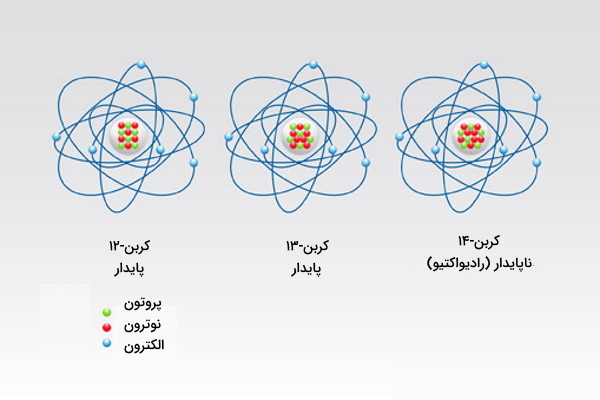
در کربن ۱۲ دو لایه وجود دارد که لایه خارجی دارای ۴ الکترون است. کربن به دلیل ۴ ظرفیتی بودن میتواند پیوندهای شیمیایی متنوعی را با عنصرهای دیگر جدول تناوبی برقرار کند.
ساختار اتمی اکسیژن
از اکسیژن سه ایزوتوپ پایدار وجود دارد که به نام اکسیژن-۱۶، اکسیژن-۱۷ و اکسیژن-۱۸ شناخته میشوند. از این سه، اکسیژن-۱۶ بیشترین پایداری را دارد. در این اتم، ۸ پروتون، ۸ نوترون و ۸ الکترون وجود دارد. از این تعداد، ۲ الکترون در لایه ظرفیت حضور دارند.
اعداد کوانتومی الکترون
از مجموعه «اعداد کوانتومی» (Quantum Numbers) میتوان برای پی بردن به موقعیت و انرژی الکترونها در یک اتم استفاده کرد. بهطور کلی از ۴ عدد کوانتومی مختلف برای این کار استفاده میشود که بهصورت زیر هستند.
- «عدد کوانتومی اصلی» (Principal Quantum Number)
- «عدد کوانتومی اوربیتالی» (Azimuthal Quantum Number)
- «عدد کوانتومی مغناطیسی» (Magnetic Quantum Number)
- «عدد کوانتومی اسپین» (Spin Quantum Number)
در واقع این اعداد راهحلی را به دست میدهند که توسط «معادله موج شرودینگر» (Schrodinger Wave Equation) برای اتم هیدروژن مورد قبول است. در ادامه میخواهیم مفهوم و نحوه استفاده از هر کدام از این اعداد کوانتومی را مورد بررسی قرار دهیم.
عدد کوانتومی اصلی چیست؟
عدد کوانتومی اصلی را با نماد $$n$$ نمایش میدهند و نشاندنده لایه اصلی الکترونی یک اتم است. در فهرست زیر شاهد برخی از ویژگیهای آن هستید.
- این عدد نشاندهنده بیشترین فاصله ممکن بین هسته اتم و الکترونها است، بنابراین هرچه مقدار آن بزرگتر باشد، فاصله بین هسته و الکترونها نیز بیشتر خواهد بود. در واقع اندازه اتم نیز در این صورت بیشتر است.
- مقدار عدد کوانتومی اصلی میتواند هر عدد صحیح و مثبتی برابر با ۱ یا بزرگتر از آن باشد. زمانی که مقدار $$n$$ برابر با ۱ باشد، نشاندهنده درونیترین لایه اتم است. الکترونی که در این لایه قرار دارد دارای انرژی حالت پایه است.
- قابل درک است که مقدار $$n$$ نمیتواند برابر با عددی منفی یا صفر باشد، زیرا الکترون نمیتواند در لایه صفر یا لایهای منفی حضور داشته باشد.
- زمانی که انرژی مازادی به الکترونی داده شود، شاهد این هستیم که الکترون از یک لایه اصلی به لایه بالاتری پرش میکند و باعث افزایش مقدار $$n$$ میشود. به همین صورت اگر الکترونی انرژی خود را از دست بدهد، به لایه پایینتری منتقل میشود و مقدار $$n$$ آن نیز کاهش پیدا میکند.
- افزایش مقدار $$n$$ یک الکترون را به نام «جذب» (Absorption) میشناسیم زیرا در آن «فوتون» (Photon) یا انرژی توسط الکترون جذب میشود. به همین صورت به فرآیندی که توسط آن انرژی الکترون از دست میرود، «انتشار» (Emission) گفته میشود.
عدد کوانتومی اوربیتالی چیست؟
«عدد کوانتومی اوربیتالی» (Azimuthal Quantum Number) با نام «عدد کوانتومی زاویهای تکانهای» (Angular Momentum Quantum Number) نیز شناخته میشود که در ادامه به معرفی ویژگیهای آن میپردازیم.
- این عدد کوانتومی نشاندهنده شکل اوربیتال داده شده است. این عدد را با نماد $$l$$ نشان میدهند و مقدار آن برابر با جمع گرههای زاویهای در یک اوربیتال است.
- مقدار این عدد کواتومی نشاندهنده زیرلایههای $$s$$، $$p$$، $$d$$ و $$f$$ است که در شکل خود با یکدیگر متفاوت هستند. این عدد به عدد کوانتومی اصلی بستگی دارد، بهصورتی که مقدار عددی آن بین ۰ تا $$n-1$$ است.
- در صورتی که مقدار عدد کوانتومی اصلی برابر با ۳ باشد، مقدار عدد کوانتومی اوربیتالی سه مقدار ۰، ۱ و ۲ را خواهد داشت. زمانی که عدد کوانتومی اوربیتالی برابر با ۰ باشد، اوربیتال از نوع $$s$$، در صورتی که برابر با ۱ باشد، اوربیتال از نوع $$p$$ و در نهایت اگر برابر با ۲ باشد، اوربیتال از نوع $$d$$ است. بنابراین در صورتی که مقدار عدد کوانتومی اصلی برابر با ۳ باشد، اوربیتالهای $$3s$$ و $$3p$$ و $$3d$$ حضور خواهند داشت. در صورتی که مقدار عدد کوانتومی اوربیتالی برابر با ۳ باشد، در اتم سه گره زاویهای وجود دارد.
- در مثالی دیگر اگر عدد کوانتومی اصلی برابر با ۵ باشد، عدد کوانتومی اوربیتالی بین ۰ تا ۴ خواهد بود.
- در تصویر زیر رابطه بین عدد کوانتومی اصلی و عدد کوانتومی اوربیتالی را مشاهده میکنید.
در تصویر بالا ترکیبهای عدد کوانتومی اصلی و عدد کوانتومی اوربیتالی مجاز را مشاهده میکنید. همانطور که دیدید امکان وجود اوربیتال $$2d$$ وجود ندارد زیرا مقدار $$l$$ همیشه از مقدار $$n$$ کمتر است.
عدد کوانتومی مغناطیسی چیست؟
تعداد کل اوربیتالهای موجود در یک زیرلایه و جهتگیری آنها را توسط عدد کوانتومی مغناطیسی به دست میآورند که با نماد $$m_l$$ نمایش داده میشود. در تصویر زیر انواع اوربیتالها و جهتگیری آنها را مشاهده میکنید.
مقدار عدد کوانتومی مغناطیسی به عدد کوانتومی اوربیتالی بستگی دارد بهصورتی که برای مقدار خاصی از $$l$$، بازه عدد کوانتومی مغناطیسی بین $$-l$$ تا $$+l$$ خواهد بود. بنابراین مستقیما به مقدار عدد کوانتومی اصلی نیز بستگی دارد. به مثال زیر توجه کنید.
در اتمی مقدار عدد کوانتومی اصلی و عدد کوانتومی اوربیتالی را بهصورت زیر داریم.
$$ n=4 $$
$$ l=3 $$
در این حالت مقدار عدد کوانتومی مغناطیسی بین ۳- تا ۳+ خواهد بود.
$$ m_l= -3, -2, -1, 0, +1, +2, +3 $$
تعداد کل اوربیتالهای موجود در یک زیرلایه، تابعی از $$l$$ است و میتوان آن را از رابطه زیر به دست آورد.
$$ 2 l + 1 $$
برای مثال زیرلایه $$3d$$ را در نظر بگیرید. در این زیرلایه مقدار عدد کوانتومی اصلی برابر با ۳ و مقدار عدد کوانتومی اوربیتالی برابر با ۲ است. با جاگذاری مقدار $$l$$ در رابطه بالا، تعداد اوربیتالها به دست میآيد.
$$ 2 \times 2 + 1 =5 $$
از آنجا که در هر اوربیتال ۲ الکترون جای میگیرد، در زیرلایه $$3d$$ میتوان ۱۰ الکترون گنجاند. برای بررسی بیشتر به جدول زیر مراجعه کنید.
| عدد کوانتومی اوربیتالی | تعداد اوربیتالهای مربوطه | مقادیر ممکن برای $$m_l$$ |
| ۰ (زیرلایه $$s$$) | $$2\times0 +1=1$$ | 0 |
| ۱ (زیرلایه $$p$$) | $$2\times1 +1=3$$ | $$-1,0, 1$$ |
| ۲ (زیرلایه $$d$$) | $$2\times2 +1=5$$ | $$-2,-1,0, 1,2$$ |
| ۳ (زیرلایه $$f$$) | $$2\times3 +1=7$$ | $$-3,-2,-1,0, 1,2,3$$ |
عدد کوانتومی اسپین چیست؟
آخرین عدد کوانتومی که نیاز داریم بدانیم اسپین نام دارد و در ادامه به بررسی آن خواهیم پرداخت.
- عدد کوانتومی اسپین الکترون به مقدار عددهای کوانتومی دیگر بستگی ندارد و تنها اطلاعاتی در مورد جهت قرارگیری الکترون در داخل اوربیتال در اختیار ما میگذارد. این عدد کوانتومی را با نماد $$m_s$$ نمایش میدهیم.
- همانطور که پیشتر گفتیم از مقدار این عدد میتوان به اطلاعاتی در مورد جهتگیری الکترون دست پیدا کرد. اعداد ممکن برای این عدد کوانتومی $$ \frac{۱} {۲} $$ و $$ -\frac{۱} {۲} $$ هستند.
- در صورتی که اسپین الکترون رو به بالا باشد، آن را با فلشی به سمت بالا نمایش میدهند و مقدار عدد کوانتومی اسپین آن برابر با $$ \frac{۱} {۲} $$ است.
- همچنین در صورتی که اسپین الکترون رو به پایین باشد، آن را با فلشی به سمت پایین نمایش میدهند و مقدار عدد کوانتومی اسپین آن برابر با $$ -\frac{۱} {۲} $$ است.
- مقدار عدد کوانتومی اسپین تعیین میکند که آیا اتم مورد نظر توانایی تولید میدان مغناطیسی را دارد یا خیر.
آرایش الکترونی اتم
حال که با لایههای الکترونی اتم آشنا شدیم، میخواهیم بدانیم ترتیب جایگذاری الکترونها در این لایههای به چه صورت است. «آرایش الکترون» (Electron Configuration) نشاندهنده مدل توزیع الکترونها در اوربیتالهای اتمی است.
لایههای الکترونی
بیشترین تعداد الکترونی که میتوان در یک لایه گنجاند به عدد کوانتومی اصلی آن ربط دارد. در صورتی که شماره لایه برابر با $$n$$ باشد، تعداد الکترونها از رابطه زیر به دست میآید.
$$ 2n^2 $$
ظرفیت الکترونی لایههای مختلف محاسبه شده است که میتوانید آن را در جدول زیر مشاهده کنید.
| شماره لایه | تعداد الکترونها |
| ۱ | ۲ |
| ۲ | ۸ |
| ۳ | ۱۸ |
| ۴ | ۳۲ |
زیرلایههای الکترونی
نکاتی که برای پر کردن زیرلایهها در آرایش الکترونی مورد نیاز است را در فهرست زیر مشاهده میکنید.
- زیرلایههایی که الکترونها در آنها توزیع میشوند بر اساس عدد کوانتومی اوربیتالی هستند که آن را با $$l$$ نمایش میدهیم.
- این عدد کوانتومی به عدد کوانتومی اصلی بستگی دارد، برای مثال در صورتی که مقدار $$n$$ برابر با ۴ باشد، ۴ زیرلایه متفاوت در آن وجود خواهد داشت.
- در این حالت مقادیر $$l$$ از ۰ تا ۳ خواهد بود و زیرلایههای $$s$$ و $$p$$ و $$d$$ و $$f$$ در آن حضور دارند.
- مقدار کل الکترونهایی که میتوان در یک زیرلایه گنجاند از رابطه زیر قابل شمارش است.
$$ 2\times(2l+1) $$
- بنابراین در زیرلایه $$s$$ تعداد ۲ الکترون، در زیرلایه $$p$$ تعداد ۶ الکترون، در زیرلایه $$d$$ تعداد ۱۰ الکترون و در زیرلایه $$f$$ تعداد ۱۴ الکترون جا میگیرد.
جدول زیر اطلاعات جامعی در مورد زیرلایهها به دست میدهد.
| عدد کوانتومی اصلی | عدد کوانتومی | زیرلایه در آرایش الکترونی |
| $$n=1$$ | $$l=0$$ | $$1s$$ |
| $$n=2$$ | $$l=0$$ | $$2s$$ |
| $$l=1$$ | $$2p$$ | |
| $$n=3$$ | $$l=0$$ | $$3s$$ |
| $$l=1$$ | $$3p$$ | |
| $$l=2$$ | $$3d$$ | |
| $$n=4$$ | $$l=0$$ | $$4s$$ |
| $$l=1$$ | $$4p$$ | |
| $$l=2$$ | $$4d$$ | |
| $$l=3$$ | $$4f$$ |
همانطور که مشاهده میکنید، زیرلایهای بهصورت $$1p$$ و $$2d$$ و $$3f$$ وجود خارجی ندارند زیرا همیشه باید مقدار عدد کوانتومی اوربیتالی از عدد کوانتومی اصلی کمتر باشد.
نحوه پر کردن زیرلایه
آرایش الکترونی یک اتم را به کمک زیرلایههای آن مینویسیم. به نکات زیر در این مورد توجه کنید.
- هر زیرلایه باید دارای یک شماره لایه باشد که برابر با عدد کوانتومی اصلی آن است. سپس نام زیرلایه در کنار آن قرار میگیرد که از عدد کوانتومی اوربیتالی گرفته میشود. در نهایت نیز تعداد کل الکترونهای موجود در آن را بهصورت بالانویس میآوریم.
- برای مثال اگر دو الکترون در زیرلایه $$s$$ لایه اول حضور داشته باشند، نتیجه بهصورت $$1s^2$$ خواهد بود.
در ادامه آرایش الکترونی را برای چند اتم مختلف مورد بررسی قرار میدهیم اما پیش از آن باید به بررسی قوانینی بپردازیم که در آرایش الکترونی باید رعایت شوند.
اصل آفبا
طبق «اصل آفبا» (Aufbau Principle) الکترونها ابتدا اوربیتالهایی با انرژی کمتر را اشغال میکنند و سپس سراغ اوربیتالهایی با انرژی بالاتر میروند. ترتیب پر شدن زیرلایههای الکترونی بهصورت زیر است.
$$ 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p $$
توجه داشته باشید که با توجه به اصل آفبا، زیرلایه $$4s$$ انرژی کمتری دارد و پیش از زیرلایه $$3d$$ پر میشود. ترتیب پر شدن زیرلایهها را میتوانید در تصویر زیر بهخوبی مشاهده کنید.
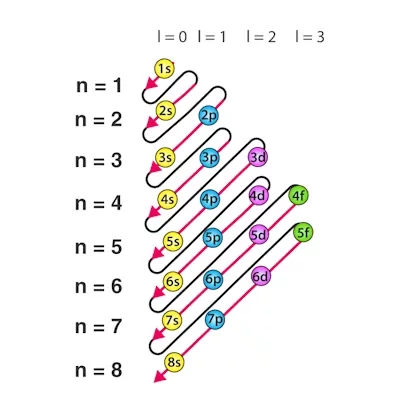
تعدادی از اتمها آرایش الکترونی دارند که با اصل آفبا همخوانی ندارد. در ادامه به بررسی آنها نیز خواهیم پرداخت.
اصل طرد پائولی
طبق «اصل طرد پائولی» (Pauli Exclusion Principle) بیشترین تعداد الکترونی که میتواند در یک اوربیتال قرار بگیرد، ۲ عدد است که نسبت به یکدیگر جهتگیری اسپینی متفاوتی دارند.
با توجه به این اصل هیچ دو الکترونی در یک اتم دارای ۴ عدد کوانتومی برابر با یکدیگر نیستند. به عبارتی در صورتی که عدد کوانتومی اصلی، عدد کوانتومی اوربیتالی و عدد کوانتومی مغناطیسی آنها با یکدیگر برابر باشد، با داشتن جهتگیری متفاوت در اوربیتال، عدد کوانتومی اسپینی آنها متفاوت خواهد بود.
قاعده هوند
«قاعده هوند» (Hund's Rule) نشاندهنده ترتیب پر شدن الکترونها در اوربیتالهای یک زیرلایه است.طبق این قاعده ابتدا در هر اوربیتال ۱ الکترون قرار میگیرد، به عبارتی پیش از اینکه به تمامی اوربیتالها الکترون داده شود، هیچ اوربیتالی پر نمیشود. زمانی که تمامی اوربیتالها دارای یک الکترون باشند، اسپین آن ها نیز همانند یکدیگر خواهد بود. این قاعده را میتوانید در تصویر زیر مشاهده کنید.
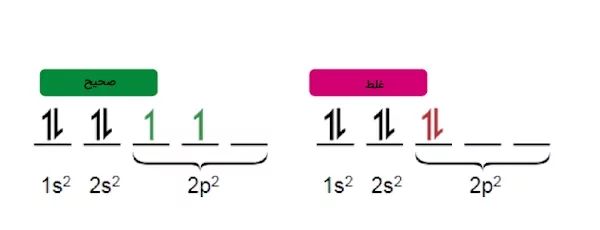
مثال آرایش الکترونی
آرایش الکترونی هیدروژن به چهصورت است؟
پاسخ
هیدروژن اتمی کوچک با تنها یک الکترون است، بنابراین به سادگی میتوان آرایش الکترونی آن را نوشت. این الکترون در زیرلایه $$s$$ اولین لایه الکترونی قرار میگیرد. بنابراین آرایش الکترونی آن بهصورت زیر خواهد بود.
$$^1 H =1s^1 $$
آرایش الکترونی گازهای بیاثر
گاهی برای سادگی آرایشهای الکترونی را ساده میکنند و آنها را به کمک آرایش الکترونی گازهای بیاثر نشان میدهند. این آرایشها را میتوانید در جدول زیر مشاهده کنید.
| اتم و نماد شیمیایی | تعداد الکترون | آرایش الکترونی |
| هلیوم / $$He$$ | ۲ | $$1s^2$$ |
| نئون / $$Ne$$ | ۱۰ | $$ [He]\;2s^2\;2p^6 $$ |
| آرگون / $$Ar$$ | ۱۸ | $$ [Ne]\;3s^2\;3p^6 $$ |
| کریپتون / $$Kr$$ | ۳۶ | $$ [Ar]\;3d^{10}\;4s^2\;4p^6 $$ |
| زنون / $$Xe$$ | ۵۴ | $$ [Kr]\;4d^{10}\;5s^2\;5p^6 $$ |
| رادون / $$Rn$$ | ۸۶ | $$ [Xe]\;4f^{14}\;5d^{10}\;6s^2\;6p^6 $$ |
تاریخچه ساختار اتم
تاریخچه ساختار اتم و مکانیک کوانتوم به زمان «دموکریت» (Democritus) بر میگردد. او اولین فردی بود که این مسئله را عنوان کرد که ماده از اتمها تشکیل شده است. با این حال اولین نظریه علمی حول محور ساختار اتم در ۱۸۰۰ میلادی، توسط «جان دالتون» (John Dalton) ارائه شد. پیشرفت در دانش بشر در مورد ساختار اتم و مکانیک کوانتوم باعث شد که به وجود ذرههای بنیادی در اتم پی ببرد که این کشف پیشزمینه کشفهای بعدی بسیاری بود.

مثال و حل تمرین از ساختار اتم
تا اینجا به اطلاعات بسیاری در مورد ساختار اتم دست پیدا کردیم. در این بخش برای گسترش درک خود از این مفهوم ابتدا تعدادی مثال را به همراه پاسخ تشریحی بررسی میکنیم و سپس چند تمرین چندگزینهای خواهیم داشت.
مثال از ساختار اتم
در این بخش تعدادی مثال را پیرامون ساختار اتم مورد بررسی قرار میدهیم. در هر مورد پاسخ تشریحی متناسب نیز ارائه شده است.
مثال اول
آرایش الکترونی اتم اکسیژن را بنویسید.
پاسخ
عدد اتمی اکسیژن ۸ است، بنابراین در ساختار آن ۸ الکترون نیز حضور دارد. بنابراین ۲ الکترون در لایه اول و ۶ الکترون در لایه دوم قرار میگیرند. آرایش الکترونی اتم اکسیژن را میتوان بهصورت زیر نوشت.
$$ ^8 O =1s^2 \;2s^2\;2p^4 $$
مثال دوم
آرایش الکترونی اتم کلر را رسم کنید.
پاسخ
عدد اتمی کلر برابر با ۱۷ است، بنابراین ۱۷ الکترون نیز در زیرلایههای آن توزیع شده است که میتوان آنها را بهصورت زیر نمایش داد. توجه داشته باشید که در لایه اول تعداد ۲ الکترون، در لایه دوم تعداد ۸ الکترون و در لایه سوم تعداد ۷ الکترون حضور دارد.
$$ ^{17} Cl =1s^2 \;2s^2\;2p^6\;3s^2\;3p^5 $$
همچنین میتوان این آرایش الکترونی را بهصورت خلاصه و بسته نوشت زیرا در اتم نئون ۱۰ الکترون حضور دارد.
$$ ^{17} Cl =[Ne]\;3s^2\;3p^5 $$
مثال سوم
آرایش الکترونی مس را بنویسید.
پاسخ
در اتم مس ۲۹ عدد الکترون وجود دارد و با توجه به قوانین گفته شده، آرایش الکترونی آن بهصورت زیر خواهد بود.
$$ ^{29}Cu=1s^2\;2s^2\;2p^6\;3s^2\;3p^6\;4s^2\;3d^9 $$
این آرایش الکترونی پذیرفته شده نیست زیرا پایداری زیادی ندارد. توجه داشته باشید که اوربیتالها در صورتی که کامل یا نصفه پر شده باشند، از پایداری بیشتری برخوردارند. بنابراین ۱ الکترون از لایه $$4s$$ به $$3d$$ منتقل میشود تا پایداری آرایش الکترونی افزایش پیدا کند.
$$ ^{29}Cu=1s^2\;2s^2\;2p^6\;3s^2\;3p^6\;4s^1\;3d^{10} $$
مثال چهارم
آرایش الکترونی اتم کروم را بنویسید.
پاسخ
این اتم دارای عدد اتمی برابر با ۲۴ است، بنابراین همین تعداد الکترون نیز دارد و میتوان آرایش الکترونی آن را بهصورت زیر نوشت.
$$ 1s^2\;2s^2\;2p^6\;3s^2\;3p^6\;4s^2\;3d^4 $$
با این حال این آرایش از پایداری زیادی برخوردار نیست زیرا در آن اوربیتال $$3d$$ دارای تنها ۴ الکترون است. میتوانیم از اوربیتال $$4s$$، یک الکترون به اوربیتال $$3d$$ منتقل کنیم. در این صورت ۲ اوربیتال بهصورت نصفه پر هستند و پایداری بیشتری دارند. آرایش الکترونی جدید را در زیر مشاهده میکنید.
$$ 1s^2\;2s^2\;2p^6\;3s^2\;3p^6\;4s^1\;3d^5 $$
مثال پنجم
آرایش الکترونی اتم اسکاندیم را بنویسید. این اتم در حالت برانگیخته چه آرایش الکترونی خواهد داشت؟
پاسخ
آرایش الکترونی اتم اسکاندیم را میتوان بهصورت زیر نوشت.
$$ 1s^2\;2s^2\;2p^6\;3s^2\;3p^6\;4s^2\;3d^1 $$
در حالت برانگیخته، زوج الکترون در زیرلایه $$4s$$ از یکدیگر جدا میشوند و یکی از آنها به اوربیتال $$3d$$ منتقل میشود. در واقع در حالت برانگیخته اتمها در اوربیتالی با پایینترین سطح انرژی قرار ندارند. در نتیجه آرایش الکترونی اتم ساکاندیم در حالت برانگیخته را میتوان اینطور نوشت.
$$ 1s^2\;2s^2\;2p^6\;3s^2\;3p^6\;4s^1\;3d^2 $$
مثال ششم
آرایش الکترونی یون $$Ti^{2+}$$ را بنویسید.
پاسخ
برای نوشتن آرایش الکترونی یک یون میتوانیم ابتدا آرایش الکترونی آن را در حالت پایه بنویسیم و سپس با حذف الکترون از بیرونیترین لایه به آرایش الکترونی یون برسیم. آرایش الکترونی این اتم با ۲۲ الکترون بهصورت زیر است.
$$ 1s^2\;2s^2\;2p^6\;3s^2\;3p^6\;4s^2\;3d^2 $$
یون آن دارای دو بار مثبت است، یعنی دو الکترون از بیرونیترین لایه از دست میدهد، بنابراین با حذف ۲ الکترون از زیرلایه $$4s$$ نتیجه بهصورت زیر خواهد بود.
$$ 1s^2\;2s^2\;2p^6\;3s^2\;3p^6\;3d^2 $$
حل تمرین از ساختار اتم
در این بخش به تعدادی تمرین چندگزینهای مرتبط با ساختار اتم خواهیم پرداخت.
تمرین اول
اولین فردی که نظریه اتمی را پیشنهاد داد، چه نام داشت؟
جان دالتون
جوزف تامسون
نیلز بور
رابرت میلیکان
تمرین دوم
بیشینه تعداد الکترون موجود در یک زیرلایه در کدام گزینه بهصورت صحیح آورده شده است؟
$$4l+2$$
$$4l-2$$
$$2n^2$$
$$2l+1$$
تمرین سوم
پروتون بهطور تقریبی جرمی برابر با جرم ... دارد.
نوترون
الکترون
یک ذره آلفا
یک ذره بتا
تمرین چهارم
کدام یک از اوربیتالهای زیر وجود خارجی ندارند؟
$$2p$$
$$3f$$
$$4d$$
$$2s$$
تمرین پنجم
الکترون توسط ... کشف شد.
جوزف تامسون
جان دالتون
رادرفورد
رابرت میلیکان
تمرین ششم
منبع ذره آلفا در آزمایش پراکندگی رادرفورد در کدام یک از گزینههای زیر بهصورت صحیح آورده شده است؟
هسته هلیوم
هسته هیدروژن
هسته آرگون
هیچ کدام
تمرین هفتم
جهتگیری اوربیتال اتمی به کدام یک از گزینههای زیر بستگی دارد؟
عدد کوانتومی اسپین
عدد کوانتومی اوربیتالی
عدد کوانتومی مغناطیسی
عدد کوانتومی اصلی
تمرین هشتم
در اتم روبیدیم چند الکترون p حضور دارد؟
۱۱
۲۵
۱۸
۹
تمرین نهم
یک ذره آلفا شامل کدام یک از گزینههای زیر است؟
۴ بار مثبت و ۲ واحد جرمی
۴ بار مثبت و ۴ واحد جرمی
۲ بار مثبت و ۲ واحد جرمی
۲ بار مثبت و ۴ واحد جرمی
تمرین دهم
آرایش الکترونی آهن در کدام یک از گزینههای زیر بهصورت صحیح آورده شده است؟
$$ 1s^2\;2s^2\;2p^6\;3s^2\;3p^6\;4s^2\;3d^6 $$
$$ 1s^2\;2s^2\;2p^6\;3s^2\;3p^6\;4s^1\;3d^7 $$
$$ 1s^2\;2s^2\;2p^6\;3s^2\;3p^6\;3d^8 $$
$$ 1s^2\;2s^2\;2p^6\;3s^2\;3p^6\;4s^3\;3d^5$$
تمرین یازدهم
آرایش الکترونی یک اتم بهصورت ۲، ۸، ۱۸ و ۷ است. عدد اتمی آن کدام یک از گزینههای زیر است؟
۷
۳۵
۷۰
۱۷
تمرین دوازدهم
آرایش الکترونی اتمی بهصورت زیر است.
$$ 1s^2\;2s^2\;2p^6\;3s^2\;3p^6\;4s^3\;3d^{10}\;4s^2\;4p^2 $$
با توجه به اینکه جرم اتمی آن برابر با ۸۰ است، عدد اتمی و تعداد نوترونهای موجود در هسته آن در کدام یک از گزینههای زیر بهصورت صحیح آورده شده است؟
۳۵ و ۴۵
۴۵ و ۳۵
۴۰ و ۴۰
۳۰ و ۵۰
تمرین سیزدهم
اتمی در ساختار خود دارای ۲۶ الکترون است. همچنین جرم اتمی آن برابر با ۵۶ است. تعداد نوترونهای موجود در هسته آن کدام است؟
۲۶
۳۰
۳۶
۵۶
تمرین چهاردهم
آرایش الکترونی یون $$Fe^{3+}$$ مطابق با کدام یک از گزینههای زیر است؟
$$ 1s^2\;2s^2\;2p^6\;3s^2\;3p^6\;4s^3\;3d^5 $$
$$ 1s^2\;2s^2\;2p^6\;3s^2\;3p^6\;4s^1\;3d^4 $$
$$ 1s^2\;2s^2\;2p^6\;3s^2\;3p^6\;3d^5$$
$$ 1s^2\;2s^2\;2p^6\;3s^2\;3p^6\;4s^2\;3d^3 $$
برای رسیدن به پاسخ صحیح میتوانیم ابتدا آرایش الکترونی اتم آهن را رسم کنیم. این آرایش بهصورت زیر است.
$$ 1s^2\;2s^2\;2p^6\;3s^2\;3p^6\;4s^2\;3d^6 $$
در زمان پر کردن الکترونها باید ابتدا اوربیتالهای با انرژی کمتر را پر کنیم، ب همین دلیل زیرلایه $$4s$$ پیش از $$3d$$ پر میشود. با این حال توجه داشته باشید که وقتی اتمی به یون تبدیل میشود، الکترونهای خود را از بیرونیترین لایه که در این مورد $$4s$$ است از دست میدهد. بنابراین ۲ الکترون از $$4s$$ و ۱ الکترون از $$3d$$ برداشته میشود.
سوالات متدوال ساختار اتم
حال که با ساختار اتم و مفاهیم مرتبط با آن آشنا شدیم، میخواهیم به برخی از مهمترین و پرتکرارترین سوالهای پیرامون آن پاسخ دهیم.
اصل طرد پائولی چیست؟
طبق اصل طرد پائولی بیشترین تعداد الکترونی که میتواند در یک اوربیتال قرار بگیرد، ۲ عدد است که نسبت به یکدیگر جهتگیری اسپینی متفاوتی دارند.
نظریه اتمی دالتون چیست؟
شیمیدان انگلیسی جان دالتون در نظریه اتمی خود پیشنهاد داد که تمامی مواد از اتمها ساخته شدهاند که به نظر او شکسته نمیشدند و از بین نیز نمیرفتند.
عدد کوانتومی مغناطیسی چیست؟
تعداد کل اوربیتالهای موجود در یک زیرلایه و جهتگیری آنها را توسط عدد کوانتومی مغناطیسی به دست میآورند.
اتم از چه ذرههای زیراتمی ساخته شده است؟
ذرههای زیراتمی موجود در اتم شامل الکترون، نوترون و پروتون میشوند.
عدد اتمی چیست؟
هر هسته دارای تعداد منحصربهفردی پروتون است که آن را به عنوان عدد اتمی نیز میشناسیم.
جمعبندی
هدف از این مطلب مجله فرادرس بررسی ساختار اتم و روندی بود که برای پیشرفت آن طی شده است. همچنین به معرفی ذرههای مختلف سازنده اتم پرداختیم و مفاهیم مرتبط با آن را نیز مورد بررسی قرار دادیم. در نهایت نیز تعدادی مثال و تمرین را حل کردیم.