حلال در شیمی چیست؟ – به زبان ساده + انواع و فرق قطبی و ناقطبی
حلال مادهای است که حجم یا وزنی بیشتر از ماده دیگر موجود در محلول دارد. در این مطلب مجله فرادرس میخواهیم بدانیم حلال چیست و چه انواعی دارد. همچنین به بررسی تعدادی از مهمترین انواع حلالهایی که در سنتزهای شیمیایی از آنها استفاده میشود نیز خواهیم پرداخت.
- مفهوم حلال، حلشونده و اجزای محلول را یاد خواهید گرفت.
- تفاوتها و کاربردهای انواع حلال را خواهید آموخت.
- یاد میگیرید تفاوت حلال قطبی و ناقطبی را تشخیص دهید.
- میآموزید چطور با آزمون رنگدانه قطبیت حلال را بررسی کنید.
- نحوه انتخاب و مصرف ایمن حلال مناسب را فرا خواهید گرفت.
- روش تعیین انحلالپذیری و عوامل مؤثر بر آن را یاد میگیرید.


حلال چیست ؟
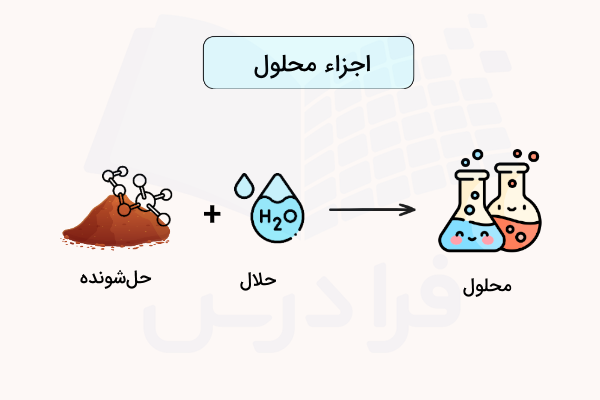
«حلال» (Solvent) در شیمی مادهای است که همیشه مقداری بیشتر از ماده دیگر موجود در محلول، چه از نظر حجم، چه وزن دارد. در بسیاری از فرآيندهای صنعتی از یک یا چندین نوع حلال در مراحل مختلف استفاده میشود. فرآيند انحلال یک ماده در حلال، فرآيندی «برگشتپذیر» (Reversible) است.
حلشونده چیست؟
حال که میدانیم حلال چیست ، میخواهیم به معرفی جزء دیگری بپردازیم که در کنار حلال در محلول قرار دارد. به مادهای که در حلال حل میشود، «حلشونده» (Solute) گفته میشود. ترکیبی از حلال و حلشونده، مخلوط همگنی را تشکیل میدهند که به نام «محلول» (Solution) شناخته میشود. توجه داشته باشید که حلال و حلشونده میتوانند تغییر جایگاه دهند زیرا نکتهای که تعیینکننده نقش آنهاست، نسبت مولی این دو ماده است.
حلشونده بهصورت یکنواختی در حلال حل میشود تا محلول را به وجود بیاورد با این حال برخلاف یک واکنش شیمیایی، حلال و حلشونده لزوما ماده جدیدی به وجود نمیآورند. ممکن است در محلول یونهایی تشکیل شود اما این فرآيند کاملا برگشتپذیر است. در محلول، آرایش و چیدمان جدیدی از پیوند اتمها در مواد به وجود نمیآيد.
جداسازی حلال و حلشونده
حال که میدانیم حلشونده و حلال چیست ، میخواهیم با نحوه جداسازی آنها در محلول نیز آشنا شویم. زمانی که حلال، حلشونده را در خود حل میکند، تمایز بین آنها ممکن نیست زیرا محلولی همگن به وجود میآورند. حلشونده را نمیتوان به راحتی از حلال جدا کرد، حتی در برخی موارد تشکیل رسوب مجدد از حلشونده نیز برای جداسازی کافی نیست. برای جداسازی حلال و حلشونده به فرآیندهای ویژهای نیاز است که انرژی بیشتری مصرف میکنند. برای مثال اگر حلشونده، جامدی مانند نمک و حلال، مایعی مانند آب باشد، حلال باید بهصورت کامل تبخیر شود تا بتوان حلشونده را مجدد به دست آورد.
ترکیباتی که در یک محلول وجود دارند، یعنی حلال و حلشونده، با یکدیگر برهمکنشی نیز خواهند داشت. وقتی مادهای حل میشود، مولکولهای حلال، در اطراف مولکولهای آن آرایشی را به خود میگیرند. در این فرآيند، پدیده انتقال گرما نیز حضور دارد و مقدار آنتروپی افزایش پیدا میکند تا محلول از نظر ترمودینامیکی پایداری بیشتری نسبت به حلال و حلشونده بهصورت مجزا داشته باشد.
حالت فیزیکی حلال چیست ؟
تا اینجا دانستیم حلال چیست و در این بخش میخواهیم بدانیم به چه حالتهای فیزیکی حضور دارد. معمولا وقتی از حلال صحبت میشود، اولین چیزی که افراد متصور میشوند، یک مایع است. با این حال حلال میتواند به حالتهای فیزیکی متفاوتی مانند گاز، مایع، جامد و حتی «سیال فوق بحرانی» (Super Critical Fluid) حضور داشته باشد. برای درک بهتر رابطه بین حلال و حلشونده و حالت محلول به جدول زیر توجه کنید.
| حالت فیزیکی حلال | حالت فیزیکی حلشونده | حالت فیزیکی محلول |
| گاز | گاز | گاز |
| مایع | گاز | مایع |
| مایع | مایع | مایع |
| مایع | جامد | مایع |
| جامد | گاز | جامد |
| مایع | جامد | جامد |
همانطور که در جدول بالا مشاهده میکنید، محلول بهطور معمول حالت فیزیکی مشابه حلال خود دارد. با این حال استثنائاتی نیز وجود دارد. برای مثال در محلول آمالگام جیوه در نقره یا طلا، حلال مایع است اما محلول آن بهصورت جامد طلا است.
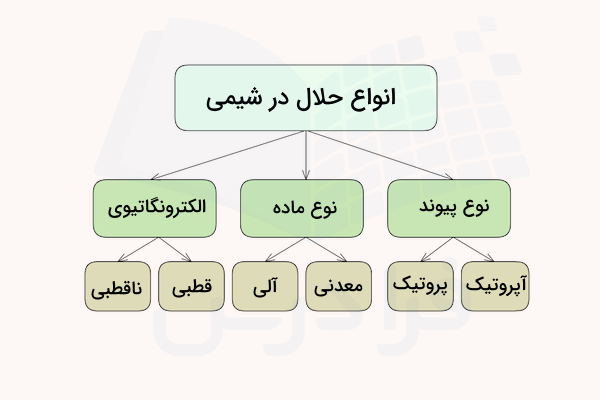
انواع حلال چیست ؟
حال که میدانیم حلال چیست به بررسی طبقهبندیهایی میپردازیم که از این مفهوم وجود دارد. آب حلالی عمومی است زیرا طیف وسیعی از مواد، شامل مایع، گاز و جامد را در خود حل میکند. با این حال موادی نیز وجود دارند که آب قادر به حل کردن آنها نیست. از این نمونه میتوان به هیدروکربنها اشاره کرد. حلالها انواع بسیاری دارند که در ادامه آنها را مشاهده میکنید.
حلال قطبی
در این بخش میخواهیم بدانیم منظور از قطبی بودن در حلال چیست و به چه چیزی اشاره دارد. «حلال قطبی» (Polar Solvent) نوعی از حلال است که دارای بار جزئی یا «گشتاور دوقطبی» (Dipole Moment) بزرگی است. در این حلال در پیوند بین اتمها اختلاف الکترونگاتیوی بسیاری وجود دارد و این تفاوت قابل اندازهگیری است. حلال قطبی میتواند یونها و ترکیبات قطبی را در خود حل کند.
برای مثال مولکول آب را که حلالی بسیار معروف است در نظر بگیرید. آب از اتمهای دو عنصر هیدروژن و اکسیژن تشکیل شده است. مقدار الکترونگاتیوی هیدروژن برابر با ۲٫۱ است، در حالی که اکسيژن، الکترونگاتیوی برابر با ۳٫۵ دارد. در این صورت اتمهای اکسیژن که الکترونگاتیوتر هستند، الکترونها را به سمت خود میکشند و دو قطب مثبت و منفی ایجاد میشود.
حلالهای قطبی مولکولهایی قطبی هستند که از «پیوند هیدروژنی» (Hydrogen Bond) به عنوان رابط استفاده میکند. حلالهای قطبی بهطور معمولا تاثیر حلکنندگی خود را با شکستن «پیوند کووالانسی» (Covalent Bonds) در حلشونده و تشکیل یون از آن میگذارند. حلالهای قطبی در سیستمهای داروسانی پرکاربردترین هستند که از جمله میتوان به آب و الکل اشاره کرد.
حلال ناقطبی
«حلال ناقطبی» (Nonpolar Solvent) فاقد ویژگی دوقطبی است و در صورت دوقطبی بودن نیز مقدار آن بسیار اندک است. گرچه این دسته از حلالها، نمیتوانند به تنهایی دوقطبی ایجاد کنند، با این حال از برهمکنش «دوقطبی-دوقطبی القایی» (Induced Dipole Dipole) بهره میبرند و حلشوندهها را در خود حل میکنند.
حلالهای ناقطبی دارای «ثابت دیالکتریک» بین ۱ تا ۲۰ هستند. مثالهایی از این نوع حلالها، کربن تترا کلرید با فرمول شیمیایی و کلروفرم با فرمول هستند. حلشوندههای یونی و قطبی در این حلالها حل نمیشوند یا انحلالپذیری بسیار کمی در آنها دارند. از جمله حلشوندههایی که در حلال ناقطبی حل میشوند روغنها، چربیها و اسیدهای چرب هستند.
مثالی از حلال ناقطبی را در ادامه مورد بررسی قرار میدهیم. بنزن با فرمول شیمیایی ، مایعی است که به عنوان حلال در واکنشهای شیمیایی به کار میرود. اتم کربن دارای الکترونگاتیوی برابر با ۲٫۵ و اتم هیدروژن برابر با ۲٫۱ است. در این صورت اختلاف الکترونگاتیوی آنها بسیار کم و برابر با ۰٫۴ است. بنابراین پیوند بین کربن و هیدروژن ناقطبی است و بنزن نیز ناقطبی در نظر گرفته میشود.
برای اینکه آشنایی کاملتری با حلالهای قطبی و ناقطبی به دست بیاورید، پیشنهاد میکنیم ویدیوی آموزشی زیر را مشاهده کنید:
حلال آپروتیک
در این بخش میخواهیم بدانیم معنای آپروتیک بودن در حلال چیست و به چه ویژگی اشاره دارد. «حلال آپروتیک» (Aprotic Solvent) که با نام حلال بیپروتون هم شناخته میوشد حلالی است که از خود پروتون آزاد نمیکند اما میتواند به دو صورت عملکرد داشته باشد. حلال آپروتیک میتواند مانند حلالی ساده عمل کند که در آن مقدار قطبیت با توجه به ثابت دیالکتریک اندازهگیری شده، قابل توجه است. همچنین میتواند گیرنده پروتون باشد. حلالهایی که نمیتوانند به عنوان دهنده پیوند هیدروژنی عمل کنند، حلال آپروتیک نامیده میشوند.
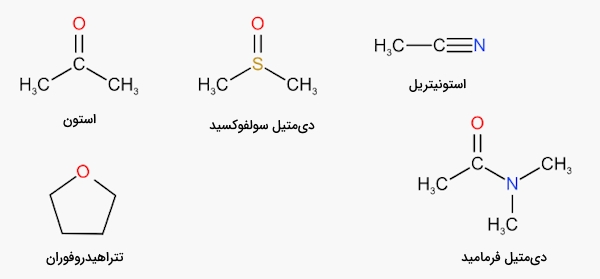
حلالهای آپروتیک، مایعاتی قطبی هستند که فاقد اتمهای هیدروژن تفکیکپذیر هستند و در آنها قطعات شیمیایی مانند و حضور ندارد. بنابراین گروهایی مانند هیدروکسیل و آمین در آنها حضور ندارد و نمیتوانند پیوند هیدروژنی تشکیل دهند. حلالهای آپروتیک مانند حلالهای پروتیک توانایی حل کردن یونها را در خود دارند. ترکیباتی مانند اتر، متیلن کلرید و هگزان نمونههایی از حلال آپروتیک هستند.
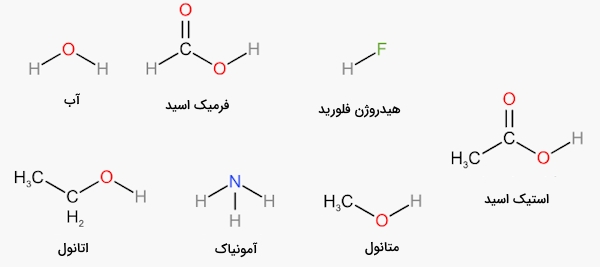
حلالهای پروتیک
«حلال پروتیک» (Protic Solvent) از مولکولهایی تشکیل شده است که میتوانند به عنوان دهنده پیوند هیدروژنی عمل کنند. کربوکسیلیک اسید، آب و الکل مثالهایی از حلالهای پروتیک هستند. ترکیباتی که میتوان آنها را با فرمول عمومی نشان داد، حلالهای پروتیک قطبی هستند. قطبیت حلالهای قطبی پروتیک از پیوند دو قطبی ناشی میشود. در این مورد هم اندازه بسیار کوچک اتم هیدروژن، هم اختلاف الکترونگاتیوی بین هیدروژن و اکسیژن تاثیرگذار است. در تصویر زیر تعدادی حلال پروتیک را مشاهده میکنید.
حلالهای آلی
«حلال آلی» (Organic Solvents) ساختاری مشابه یکدیگر دارند و در طبیعت هم بهصورت «آبگریز» (Hydrophobic)، هم «آبدوست» (Hydrophilic) حضور دارند. حلالهای آلی فرار و دارای جرم مولکولی پایینی هستند. این ترکیبات در دمای اتاق بهصورت مایع حضور دارند.
حلالهای صنعتی
حال که میدانیم حلال چیست و با انواع آن نیز آشنا شدیم، میخواهیم به حلالهایی بپردازیم که در صنایع مختلف مورد استفاده قرار میگیرند. حلالهای صنعتی از تنها یک ماده یا ترکیبی از مواد به دست میآیند و از آنها به عنوان تمیزکننده و پیشساز در تولید محصولات گوناگون استفاده میشود. در هنگام کار با این دسته از حلالها باید جوانب احتیاط را رعایت کرد و از پوشش و تجهیزات مناسب استفاده کرد. برخی از حلالهای صنعتی اشتعالپذیر و خورنده هستند و برخی دیگر نیز از جمله ترکیباتی به حساب میآيند که میتوانند باعث ایجاد سرطان شوند.
بسیاری از حلالهای صنعتی حلالهای آلی هستند که از آنها جهت تمیز کردن فلزها و لوازم آلات ماشین استفاده میشود. این حلالها مقادیر متفاوتی از سمیت دارند، بهصورتی که برخی باعث تحریک پوست و مخاط ریه و چشمها میشوند. بسیاری از آنها در صورتی که بلعیده شوند، بیماریهایی جدی ایجاد میکنند. در ادامه میخواهیم به بررسی ۳ خانواده از حلالهای آلی بپردازیم و کاربرد آنها را نیز بررسی کنیم.
حلالهای اکسیژندار
این حلالها در بخشی از ساختار خود دارای اتم عنصر اکسیژن هستند و بهطور معمول از سوختهای فسیلی به دست میآيند. «حلالهای اکسیژندار» (Oxygenated Solvents) نسبت به دیگر حلالهای صنعتی سمیت پایینی دارند. این حلالها طیف کاربرد وسیعی دارند، برای مثال در صنایع آرایشی و رنگ به کار گرفته میشوند.
با این حال این حلالها برای اینکه عملکرد مفیدی داشته باشند باید با خلوص بالا مورد استفاده قرار گیرند زیرا کمترین مقدار ناخالصی نیز میتواند روی محصول نهایی تاثیر مخربی بگذارد. به همین منظور و برای دستیابی به خلوص بالا، فرآيندهای پالایش روی آنها صورت میگیرد. از مزیتهای این دسته از حلالهای صنعتی میتوان به این مورد اشاره کرد که تولید آن به نسبت ساده و کمهزینه است.
در فهرست زیر تعدادی از حلالهای اکسیژن دار مورد استفاده در صنایع را مشاهده میکنید.
حلالهای هیدروکربنی
این دسته از حلالها از نفت خام یا سوختهای فسیلی به دست میآيند. همانطور که از نام آنها پیداست، تنها دارای هیدروژن و کربن در ساختار خود هستند و در ساختار مولکولی و تعداد زنجیرههای جانبی با یکدیگر تفاوت دارند. حلالهای هیدروکربنی مانند زیر به دو دسته اصلی طبقهبندی میشوند.
حلالهای هیدروکربنی آلیفاتیک
این دسته از حلالهای هیدروکربنهایی «راستزنجیر» (Straight Chain) هستند و بهطور عمده برای تمیز کردن فلزها مورد استفاده قرار میگیرند. مثالهایی از این حلالها شامل گازوئیل و کروزون هستند.
حلالهای هیدروکربنی آروماتیک
در «حلالهای هیدروکربنی آروماتیک» (Aromatic Hydrocarbon Solvents) ساختار حلقه بنزنی حضور دارد. این حلالها در صنایع رنگسازی برای روغنزدایی به کار میروند. همچنین از آنها در مواد شیمیایی کشاورزی مانند آفتکش استفاده میشود. بنزن و زایلن دو حلال هیدروکربنی آروماتیک با کاربرد رایج هستند.
حلالهای هالوژنی
«حلالهای هالوژنی» (Halogenated Solvents) در ساختار خود دارای اتم عنصرهای هالوژنی مانند فلوئور، ید، برم یا کلر هستند. برخلاف دو دسته دیگر حلالهای صنعتی که پیشتر به آنها پرداختیم، حلالهای هالوژنی اشتعالپذیر نیستند و برای تمیزکاری به کار میروند. با این حال برخی از این حلالها به دلیل تاثیرات مخرب خود روی محیط زیست، از رده خارج شدهاند. در فهرست زیر تعدادی از آنها را مشاهده میکنید.
- پرکلرو اتیلن
- فلوروکربنهای کلره شده
- ۱،۱،۱- تریکلرو اتان
تفاوت حلالهای آلی و حلالهای غیرآلی
عمدهترین تفاوتی که در حلالهای آلی و غیرآلی وجود دارد حضور و عدم حضور اتم کربن در ساختار آنها است. همانطور که میدانید در حلالهای آلی کربن وجود دارد و در حلالهای غیرآلی خیر. متداولترین حلال غیر آلی آب است. در فهرست زیر به تعداد بیشتری از حلالهای غیرآلی اشاره کردهایم.
- دیاکسید گوگرد
- برم تریفلوئورید
- آمونیاک
- هیدروژن فلوئورید
- اسید سولفوریک
- هیدروژن سیانید
توجه داشته باشید که حلالهای غیرآلی میتوانند هم پروتیک باشند و هم آپروتیک. این حلالهای کاربرد بسیار گستردهای در انواع صنایع و در تحقیقات شیمی دارند و از آنها در واکنشهایی استفاده میشود که در محیط آبی امکان وقوع ندارند.
حلال هسته دوست
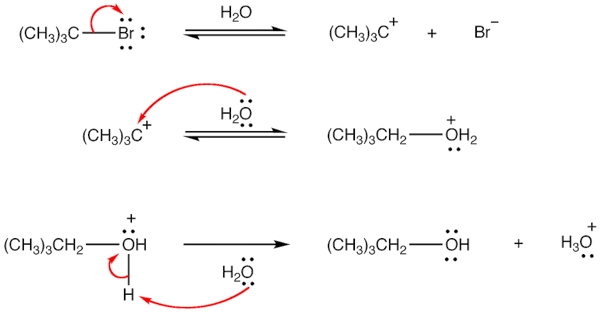
حال که میدانیم حلال چیست میخواهیم به بررسی مفهوم هستهدوستی در آن بپردازیم. «حلال هستهدوست» (Nucleophilic Solvent) حلالی است که در واکنشها به عنوان یک هستهدوست عمل میکند. از متدوالترین حلالهای هستهدوست میتوان به آب و الکل اشاره کرد. برای مثال به واکنش زیر توجه کنید.
مکانیسم واکنش و چگونگی ایفای نقش هستهدوست توسط حلال آب را میتوانید در تصویر زیر مشاهده کنید. توجه داشته باشید که در «واکنش جانشینی هستهدوستی» (Nucleophilic Substitution Reaction) حلال آب نقش هستهدوست را نیز ایفا میکند.
تفاوت حلال قطبی و ناقطبی
حال که میدانیم حلال چیست و چه انواعی دارد، میخواهیم بدانیم تفاوت حلال قطبی و ناقطبی در چه مواردی است. حلالهای قطبی دارای گشتاور دو قطبی بالایی هستند، در حالی که در حلالهای ناقطبی گشتاور دو قطبی یا وجود ندارد یا بسیار ناچیز است.
به عبارت دیگر حلالهایی که دارای جدایی بار هستند، قطبی نامیده میشود. در جدول زیر به تعدادی از حلالهای قطبی و ناقطبی اشاره کردهایم.
| حلال قطبی | حلال ناقطبی |
| آلکانها | |
| بنزن | |
| آب | تولوئن |
| استون | استیک اسید |
| متانول | کلروفرم |
| ایزوپروپانول | دیاتیل اتر |
| استونیتریل | اتیل استات |
در ادامه شاهد فهرستی خواهید بود که در آن به مهمترین تفاوتهای بین حلالهای قطبی و ناقطبی اشاره شده است.
- حلالهای قطبی دارای گشتاور دوقطبی بزرگی هستند در حالی که گشتاور دو قطبی در حلالهای ناقطبی مشاهده نمیشود. در صورت وجود نیز مقدار آن بسیار کوچک است.
- حلالهای قطبی ترکیبات قطبی را در خود حل میکنند و حلالهای ناقطبی ترکیبات ناقطبی را.
- مقدار ثابت دیالکتریک در حلالهای قطبی بالا و در حلالهای ناقطبی پایین است.
- در حلالهای قطبی جدایی بار دیده میشود و در حلالهای ناقطبی خیر.
- حلالهای قطبی از اتمهایی تشکیل میشوند که با یکدیگر اختلاف الکترونگاتیوی بالایی دارند. در حالی که اختلاف الکترونگاتیوی در حلال های ناقطبی جزئی است.
- پیوندهای موجود در حلالهای قطبی از نوع قطبی و پیوندهای موجود در حلالهای ناقطبی از نوع ناقطبی است.
همچنین برای بررسی تفاوتهای بین حلالهای قطبی و ناقطبی بهصورت سریع نیز میتوانید به جدول زیر مراجعه کنید.
| ویژگی | حلالهای قطبی | حلالهای ناقطبی |
| گشتاور دوقطبی | بزرگ | قابل اغماض |
| ترکیبات انحلالپذیر | ترکیبهای قطبی | ترکیبهای ناقطبی |
| ثابت دیالکتریک | بالا | پایین |
| جدایی بار | بله | خیر |
| نوع پیوندها | پیوند قطبی | پیوند ناقطبی |
| اختلاف الکترونگاتیوی | بالا | پایین |
توجه داشته باشید که برای توضیح قطبی بودن یک حلال، بهترین راه استفاده از مقدار ثابت دیالکتریک آن است که با قطبیت رابطه مستقیم دارد. در این مورد مثالی را مورد بررسی قرار میدهیم.
کلروفرم مولکولی چهاروجهی است که در آن اتمهای کلر دارای الکترونگاتیوی بیشتر از کربن و هیدروژن هستند. این اتمهای کلر در یه وجه یک هرم قرار دارند و بار منفی را به سمت خود میکشند. در نتیجه باعث به وجود آمدن مولکولی قطبی میشوند که جهت دوقطبی آن به سمت پایین است. گشتاور دوقطبی کلروفرم برابر با ۱٫۱۵ دبای است. با این وجود این مولکول، ناقطبی است زیرا ثابت دیالکتریک آن عدد کوچک ۴٫۸۱ فاراد بر متر است و باعث ناقطبی بودن آن میشود. با مشاهده جدول زیر میتوانید درک بهتری از حلالهای قطبی و ناقطبی داشته باشید.
| حلالهای ناقطبی | ||
| حلال | گشتاور دوقطبی | ثابت دیالکتریک |
| کلروفرم | ۱٫۱۵ | ۴٫۸۱ |
| پنتان حلقوی | ۰٫۰ | ۱٫۹۷ |
| تولوئن | ۰٫۳۱ | ۲٫۳۸ |
| دیاتیل اتر | ۱٫۱۵ | ۴٫۳۳ |
در ادامه نیز حلالهای قطبی را مشاهده میکنید. به مقدار ثابت دیالکتریک آنها توجه کنید.
| حلالهای قطبی | ||
| حلال | گشتاور دو قطبی | ثابت دیالکتریک |
| ایزوپروپیل الکل | ۱٫۶۶ | ۱۹٫۹۲ |
| متانول | ۲٫۴۷ | ۳۲٫۷ |
| ۴٫۱ | ۴۶٫۶۸ | |
| آب | ۱٫۸۷ | ۸۰٫۱ |
تشخیص حلال قطبی و ناقطبی
برای تشخیص قطبی و ناقطبی بودن یک حلال میتوان از «رنگدانه ریکارت» (Richardt's Dye) استفاده کرد. ساختار این ماده را میتوان بهصورت زیر نمایش داد.
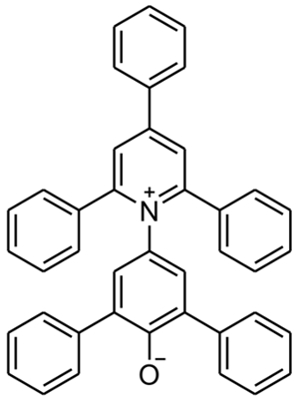
در این آزمون رنگدانه ریکارت را به حلالهای مختلف اضافه میکنند که در نتیجه آن، رنگهای متفاوتی به چشم میآید. رنگ برخی از این حلالها را میتوانید در جدول زیر مشاهده کنید.
| حلال | رنگ محلول |
| متانول | سبز / آبی |
| اتانول | آبی / بنفش |
| ۲-پروپانول | قرمز / بنفش |
| استون | نارنجی |
در صورتی که این رنگدانه به مخلوط آب و استون افزوده شود، با افزایش مقدار آب، رنگ محلول از آبی/بنفش به بنفش و سپس به قرمز/ بنفش و قرمز و در نهایت به نارنجی تبدیل میشود. بنابراین میتوان در مورد این رنگدانه به این جمعبندی رسید که با افزایش قطبیت حلال، تغییر رنگ زیر به وقوع میپیوندد.
سبز > آبی > بنفش > قرمز > نارنجی > زرد
نحوه عملکرد رنگدانه برای تشخیص حلال چیست ؟
زمانی که رنگدانه به کار رفته نور را به خود جذب میکند، یک الکترون از سر منفی ساختار آن به سر مثبت منتقل میشود و باعث میشود، حالت برانگیخته قطبیت کمتری نسبت به حالت پایه داشته باشد. از آنجا که حلالهای قطبی حالت پایه را بیشتر از حالت برانگیخته پایدار میسازند، تغییر انرژی با قطبیت حلال، افزایش پیدا میکند.
با افزایش قطبیت حلال، نور جذب شده توسط این رنگدانه از انرژی کم با طول موج بالا، به انرژی زیاد با طول موج کوتاه منتقل میشود. توجه داشته باشید که رنگ مشاهده شده، در واقع رنگ مکمل نور جذب شده است و به همین دلیل است که با افزایش قطبیت حلال تغییر رنگی را مانند آنچه در بالا آوردیم، شاهد خواهیم بود. از آنجا که افزودن آب به استون، باعث افزایش قطبیت حلال میشود، محلول استون، آب و رنگدانه، بهصورت تدریجی از آبی به نارنجی تغییر رنگ میدهد.
حلال مخلوط
تا اینجا میدانیم که حلال چیست و با انواع آن نیز آشنا شدیم اما در صورتی که یک حلال مجزا نتواند نیازهای تشکیل بلور در یک فرآيند را تامین کند از حلالهای مخلوط استفاده میشود. زوج حلالی که انتخاب میشوند، بهصورت زیر هستند.
- «حلال محلول» (Soluble Solvent): حلالی است که ترکیب مورد نظر در آن حل میشود.
- «حلال نامحلول» (Insoluble Solvent): ترکیب مورد نظر در این حلال، حل نمیشود.
دو حلالی که انتخاب میشوند باید با یکدیگر امتزاجپذیر باشند تا از این نظر محدودیتی ایجاد نکنند. در جدول زیر تعدادی از زوج حلالهایی که معمولا با یکدیگر به کار میروند را مشاهده میکنید.
| حلال اول | حلال دوم |
| متانول | آب |
| اتانول | آب |
| استون | آب |
| متانول | دیاتیل اتر |
| هگزانها | دیاتیل اتر |
| هگزانها | اتیل استات |
برای انجام «تبلور» (Crystallization) به کمک محلول مخلوط، ابتدا جامد مورد نظر را در کمترین مقدار ممکن از حلال محلول داغ حل میکنیم. سپس حلال نامحلول داغ را قطرهقطره به آن اضافه اضافه میکنیم تا جایی که محلول کدر شود. سپس مقدار اندکی از حلال محلول داغ اضافه میشود تا شفافیت محلول دوباره به دست بیاید. در این مرحله به محلول برای تشکیل رسوب زمان داده میشود.
با وجود اینکه در بسیاری موارد استفاده از این روش، نتایج خوبی به دست میدهد، به کارگیری یک حلال به جای مخلوطی از حلالها همیشه در اولویت است. برای مثال شرایطی را در نظر بگیرید که در آن مخلوطی از حلالها تحت حرارت قرار میگیرند. حلالها ممکن است با سرعتهای متفاوتی تبخیر شوند و این نسبت آنها را در حلال تغییر میدهد، در نتیجه انحلالپذیری ترکیبات نیز دستخوش تغییر میشود.

همچنین فرآيند تبلور به کمک مخلوط حلال در برخی موارد باعث ایجاد روغن میشود که در این حالت ترکیبات حل شده در بالای نقطه ذوب خود، از محلول خارج میشوند و به جای جامد، مایعی را تشکیل میدهند. در ادامه میخواهیم فرآيندی را توضیح دهیم که میتوان در آن از حلالهای مخلوط بهره برد.
این فرآیند شامل تبلور مجدد سینامیک اسید ترانس در حلال مخلوطی شامل آب و متانول است. به دو تصویر بالا دقت کنید. در تصویر شماره ۱ در هر کدام از لولههای آزمایش ۱۰۰ میلیگرم از سینامیک اسید ترانس وجود دارد. در تصویر شماره ۲، در یک لوله سینامیک اسید ترانس و آب و در دیگری سینامیک اسید ترانس و متانول وجود دارد. همانطور که مشاهده میکنید، در این مورد آب ،حلال نامحلول و متانول، حلال محلول است.
نحوه انتخاب حلال مخلوط
در ادامه نحوه انتخاب حلالهای مخلوط مناسب را آوردهایم.
- از روشی که توضیح دادیم، (۱۰۰ میلیگرم از ترکیب در ۳ میلیلیتر حلال) برای یافتن زوج حلال مناسب استفاده کنید. این زوج حلال باید بهصورتی انتخاب شوند که ترکیب مورد نظر در یکی از آنها حل شود و در دیگری خیر. توجه داشته باشید که این زوج حلال باید حتما با یکدیگر امتزاجپذیر باشند.
- در مرحله بعد ۱۰۰ میلیگرم از ترکیبی که برای تبلور در نظر دارید را در لوله آزمایش بریزید و در حالی که به آن گرما میدهید، از حلال محلول قطرهقطره به آن اضافه کنید. این کار را تا جایی انجام دهید که جامد بهطور کامل حل شود. توجه داشته باشید که با افزودن هر قطره از حلال محلول، لوله حاوی سوسپانسیون را در حمام آب گرم فرو میبریم و تا افزودن قطره بعد کمی به آن زمان میدهیم زیرا ممکن است فرآيند حل شدن آهسته باشد.
- سپس حلال نامحلول را بهصورت قطرهای به آن اضافه کنید. در این مرحله نیز باید به لوله آزمایش حرارت داده شود. این کار را تا جایی انجام میدهیم که محلول اندکی کدر شود.
- در مرحله بعد حلال محلول را قطرهقطره اضافه میکنیم تا محتویات لوله آزمایش دوباره شفافیت خود را به دست بیاورند.
- سپس به محتویات اجازه دهید تا خنک شود و به دمای محیط برسد و بعد آن را در حمام یخ غوطهور کنید و اجازه دهید تا به مدت ۱۰ الی ۲۰ دقیقه در همین حالت باقی بماند. در صورتی که بلورها مجددا خودنمایی کنند، متوجه میشویم که از این حلال مخلوط میتوان برای تبلور مجدد استفاده کرد.
- مراحلی که توضیح دادیم را میتوانید در تصاویر زیر مشاهده کنید.

ویژگیهای حلال چیست ؟
هر مادهای برای اینکه بتواند به عنوان حلال به کار رود، باید ویژگیهایی را داشته باشد. در فهرست زیر به برخی از ویژگیهای حلال اشاره کردهایم.
- حلالی که در واکنش مورد استفاده قرار میگیرد، نباید در روند واکنش و تحت شرایط مورد نیاز برای انجام آن، تخریب شود.
- نقطه جوش حلال باید برابر (در شرایط رفلاکس) یا پایینتر از دمای مورد نیاز برای واکنش باشد.
- حلال نباید با اجزای واکنشدهنده، محصولات و کاتالیزورها وارد واکنش شود. در این مورد «حلال کافت» (Solvolysis) استثنا به حساب میآيد.
انحلالپذیری چیست؟
پیشتر گفتیم که در اثر انحلال حلشونده در حلال، محلول به وجود میآيد. در این بخش میخواهیم در مورد مفهوم «انحلالپذیری» (Solubility) صحبت کنیم. به توانایی حل شدن یک ترکیب در ترکیبات دیگری مانند حلال، انحلالپذیری میگوییم. در این مورد بهتر است مفهوم دیگری را نیز بررسی کنیم. «امتزاجپذیری» (Miscibility) مفهومی است که به بررسی سهولت حل شدن یک ماده در حلال میپردازد. زمانی که دو ترکیب میتوانند کاملا در یکدیگر حل شوند و محلولی همگن را به وجود بیاورند، آن دو با یکدیگر امتزاجپذیر هستند.
به همین صورت به دو ترکیبی که بهخوبی با یکدیگر ترکیب نمیشوند تا حاصل ترکیب آنها تشکیل محلول باشد، دو ماده امتزاجناپذیر در هم گفته میشود. تمامی محلولها دارای آنتروپی مثبت در ترکیب شدن هستند در حالی که برهمکنش بین ترکیبات متفاوت میتواند از نظر انرژی هر دو حالت مطلوب و نامطلوب را داشته باشد. در صورتی که این برهمکنش نامطلوب باشد، انرژی آزاد با افزایش غلظت حلشونده، کاهش پیدا میکند.
محلول اشباع و غیراشباع
زمانی که شاهد حل شدن مقداری از حلشونده در حلال باشیم بهطوری که پس از آن مقدار بیشتری از حلشونده امکان حل شدن در حلال را نداشته باشد، میگوییم که محلول «اشباع» (Saturted) شده است. این شرایط میتواند تحت تاثیر عوامل محیطی قرار بگیرد. این عوامل شامل دما، فشار و خلوص سیستم میشوند. با افزایش انحلالپذیری، میتوانیم به محلولی دست پیدا کنیم که با نام محلول «فوق اشباع» (Super Saturated) شناخته میشود. برای افزایش انحلالپذیری میتوان دمای محلول را افزایش داد و پس از حل شدن مقدار بیشتری از حلشونده، آن را خنک کرد.
با این حال بسیاری از گازها و برخی از ترکیبات دیگر، با افزایش دما، کاهش انحلالپذیری را تجربه میکنند. انحلالپذیری مایع در مایع، نسبت به گازها و جامدات، حساسیت کمتری نسبت به تغییر دما دارد. همچنین در حالتی که بتوان همچنان مقدار بیشتری از حلشونده را در محلول حل کرد، «محلول غیراشباع» (Unsaturated Solution) نامیده میشود.
انحلالپذیری مایعات در مایعات
همانطور که پیشتر گفتیم آب متدوالترین و پرکاربردترین حلالی است که در زمینههای مختلف به کار گرفته میشود. در این بخش میخواهیم بدانیم در انحلال حلشونده مایع در حلال مایع، چه عواملی تاثیرگذار هستند.
دما
در این بخش میخواهیم به بررسی اثر دما بر انحلالپذیری بپردازیم. با افزایش دما میتوان انحلالپذیری حلشونده را افزایش داد. بهطور کلی آب، حلشوندهها را در دمای ۲۰ تا ۱۰۰ درجه سانتیگراد در خود حل میکند. در صورتی که حلشونده مایع باشد، افزایش دما باعث افزایش انحلالپذیری آن میشود.
فشار
تغییرات فشار بیشترین تاثیر را روی حلشوندههای گازی دارد و میتوان آن را در مورد حلشوندههای مایع نادیده گرفت زیرا مایعات تراکمناپذیر هستند.
انحلالپذیری جامدات در مایعات
انحلالپذیری جامدات در مایعات به ماهیت حلشونده و حلال بستگی دارد. برخی از جامدها مانند شکر و نمک بهسادگی در آب حل میشوند در حالی که انحلالپذیری جامداتی مانند نفتالن به این شکل نیست. طبق مشاهدات و آزمایشات مشخص شده است که حلشونده قطبی در حلالهای قطبی و حلشونده ناقطبی در حلالهای ناقطبی حل میشود. بنابراین ماهیت ترکیبات یکی از مهمترین عوامل تاثیرگذار روی انحلالپذیری است. با توجه به همین مشاهده، اصلی وجود دارد که میگوید شبیه، شبیه را در خود حل میکند.
هنگامی که حلشونده جامد به حلالی افزوده میشود، ذرههای جامد در حلال حل میشوند و فرآیند انحلال صورت میگیرد. همچنین ذرات حلشونده با یکدیگر برخورد میکنند و برخی از آنها از محلول جدا میشوند که این فرآیند «تبلور» (Crystallization) نامیده میشود. این محلول در نقطهای به تعادل میرسد و در آن نقطه تعداد مولکولهای حلشوندهای که وارد محلول میشود با تعداد مولکولهایی که آن را ترک میکنند، برابر خواهد بود. در نتیجه در دما و فشار ثابت، غلظت محلول ثابت باقی میماند. در ادامه میخواهیم به بررسی تاثیر دو عامل فشار و دما بر انحلالپذیری جامدات در مایعات بپردازیم.
فشار
تغییرات فشار بهندرت روی انحلالپذیری ترکیبات جامد در مایعات تاثیر میگذارد. دلیل این پدیده این است که جامدات و مایعات به مقدار بسیاری تراکمناپذیر هستتد و تحت تاثیر تغییرات فشار قرار نمیگیرند.
دما
تغییر دما نیز در کنار ماهیت حلشونده و حلال تاثیر بهسزایی روی انحلالپذیری دارد. در صورتی که فرآیند انحلال گرماگیر باشد، انحلالپذیری با افزایش دما، افزایش پیدا میکند. همچنین در صورت گرماده بودن فرآيند انحلال، افزایش دما باعث کاهش میزان انحلالپذیری میشود.
انحلالپذیری گازها در مایعات
انحلالپذیری طبق تعریف بیشترین مقدار ممکن از حلشونده است که میتواند در دمایی خاص در حلالی حل شود و این تعریف را میتوان به حل شدن گازها در مایعات نیز تعمیم داد. در انحلالپذیری گازها عواملی مانند فشار و دما در کنار ماهیت حلال و حلشونده تاثیرگذار هستند که در ادامه به بررسی آنها خواهیم پرداخت.
فشار
انحلالپذیری گازها در مایعات با افزایش فشار، افزایش پیدا میکند. برای درک بهتر تاثیر فشار روی انحلالپذیری گازها، سیستمی را در نظر میگیریم که حاوی محلولی گازی در یک حلال در ظرفی در بسته است که در حالت تعادل قرار دارند. در حالت تعادل، تعداد مولکولهای گازی که محلول را ترک میکنند با تعداد مولکولهای گازی که به آن وارد میشوند، برابر است.
حال تصور کنید با فشردهسازی مولکولهای موجود در محلول، فشار سیستم را افزایش میدهیم. در نتیجه این مولکولها به دلیل فشار وارده بر آنها، در حجم کمتری متمرکز میشوند. در این صورت تعداد مولکولهای گازی موجود در بالای محلول به ازای واحد حجم افزایش مییابد. از آنجا که تعداد مولکولهای گازی موجود در بالای محلول افزایش پیدا کرده است، سرعتی که طی آن مولکولهای گازی وارد محلول میشوند نیز افزایش پیدا میکند. در این صورت تعداد مولکولهای گازی موجود در محلول افزایش پیدا کرده است تا سیستم به تعادل جدیدی برسد. بنابراین میتوان اذعان کرد که افزایش فشار باعث افزایش انحلالپذیری گازها در مایعات میشود.
قانون هنری
«قانون هنری» (Henry's Law) بین دو عامل فشار و انحلالپذیری گازها در مایع رابطهای کمی برقرار میکند و بهصورت زیر خواهد بود.
طبق قانون هنری انحلالپذیری گاز در مایع نسبتی مستقیم با فشار جزئی گاز حاضر بالای سطح مایع یا محلول دارد. این رابطه را میتوان بهصورت زیر نمایش داد.
- : فشار جزئی گار
- : کسر مولی گاز در مایع
- : ثابت قانون هنری
بنابراین میتوان با در دست داشتن فشار جزئی گاز و ثابت قانون هنری، به فشار رسید.
دما
افزایش دما باعث کاهش انحلالپذیری گاز در مایعات میشود. مولکولهای گاز توسط فرآيندی در مایع حل میشوند که انحلال نام دارد. در این فرآيند گرما نیز نقشی مهم را ایفا میکند. با توجه به «اصل لوشاتلیه» (Le Chatelier's Principle) وقتی تعادل سیستمی به هم میخورد، سیستم در تلاش برای به دست آوردن مجدد تعادل بهصورتی عمل میکند که با عامل برهمزننده تعادل مقابله کند. بنابراین از آنجا که فرآیند انحلال گرماده است، افزایش دما با توجه به اصل لوشاتلیه باعث کاهش انحلالپذیری گاز در مایع میشود.
نکات ایمنی حلالها
تا اینجا به بررسی این مورد پرداختیم که حلال چیست و در چه مواردی کاربرد دارد. با توجه به کاربرد وسیع و گسترده آن باید به نکات ایمنی مورد نیاز در زمان کار با آن نیز آشنایی داشته باشیم. پیشتر در مواردی به خطراتی که حلالها دارند بهصورت مختصر اشاره کردیم. توجه به موارد ایمنی در هنگام کار با این مواد و در نگهداری آنها از اهمیت بالایی برخوردار است. در ادامه به بررسی نکات ایمنی مورد نیاز برای حلالها پرداختهایم.
اشتعالپذیری
بسته به میزان فراریت یک حلال، میزان اشتعالپذیری آن متفاوت خواهد بود. ترکیباتی مانند دیکلرو متان و کلروفرم در این مورد استثنا به حساب میآيند. مخلوطی از حلالها میتوانند در تماس با هوا منفجر شوند. بخارهای حلالها از هوا سنگینتر است و در پایین آن قرار میگیرند و میتوانند بدون رقیق شدن، مسافتهایی طولانی را طی کنند. توجه داشته باشید که بخارات حلالهای فرار ممکن است در بطری خالی آنها نیز باقی بماند و خطراتی را به وجود بیاورد، بنابراین باید بطریهای خالی حلالهای خطرناک را نیز با دقت و دور از گرما و شعله نگهداری کرد.
دو حلال دیاتیل اتر و کربن دیسولفید، دارای «دمای خودآتشگیری» (Autoignition Temperature) پایینی هستند که خطر ایجاد آتش توسط آنها را بسیار افزایش میدهد. دمای خودآتشگیری کربن دیسولفید کمتر از ۱۰۰ درجه سانتیگراد است و منابع دما برای آن به شدت خطرناک هستند.
به علاوه برخی از حلالها مانند متانول میتوانند با شعلههایی با دمای بسیار بالا بسوزند اما در شرایط نوری خاص قابل مشاهده نباشند و این باعث میشود تا زمان بیشتری طول بکشد تا افراد در محیط متوجه آن شوند و برای توقف آن اقدامات لازم را انجام دهند.
تشکیل پروکسید قابل انفجار
اترهایی مانند دیاتیل اتر و تترا هیدروفوران (THF) میتوانند در تماس با اکسیژن و نور، پروکسیدهایی آلی را تشکیل دهند که به شدت قابل انفجار هستند. این قابلیت در تترا هیدروفوران بیشتر از دیاتیل اتر است. در ادامه میخواهیم در مورد روند انجام این فرآيند صحبت کنیم.
هترواتمهای این ترکیبات، مانند اکسیژن، تشکیل رادیکالهای آزاد را تسهیل میکنند. رادیکال کربنی ایجاد شده، میتواند با مولکول اکسیژن وارد واکنش شود و ترکیبات پروکسیدی را تولید کند. فرآیند تولید پروکسید با وجود کمترین منبعی از نور تسریع میشود اما در عدم حضور نور نیز میتواند به آرامی پیشروی کند.
تاثیر بر بدن انسان
حلالهایی که برای بدن انسان آسیبزا هستند میتوانند باعث ایجاد مسمومیت در سیستم عصبی شوند و آسیبهایی را برای کلیه و کبد به بار بیاورند. بنابراین رعایت موارد ایمنی توسط افرادی که با حلالها سروکار دارند ضروری است.
آلودگی محیطی حلال چیست ؟
یکی از روشهایی که طی آن حلالها میتوانند به بدن انسان آسیب برسانند، ورود به خاک است. از آنجا که حلالها میتوانند مسافتی طولانی را طی کنند، آلودگی خاکها توسط آنها پدیدهای رایج به حساب میآيد. این آلودگی در صورتی که وارد سیستم آبی کره زمین بشود، تهدید بزرگی برای سلامتی به شمار میآيد. همچنین در محیطهای صنعتی امکان آلودگی محیطی از طریق بخارهای حلال نیز وجود دارد.
مثال و تمرین از حلال
حال که میدانیم حلال چیست و چه انواعی داریم، میخواهیم به بررسی تعدادی مثال به همراه پاسخ تشریحی و تمرین چندگزینهای بپردازیم.
مثال از حلال
تا اینجا دانستیم که حلال چیست و با دستهبندی انواع آن نیز آشنا شدیم. در این بخش برای افزایش درک خود از این مفهوم، تعدادی مثال را آوردهایم.
مثال اول
آیا تمامی حلالهای آلی ناقطبی هستند؟
پاسخ
خیر، تمامی حلالهای آلی ناقطبی نیستند. برای مثال استون با فرمول شیمیایی حلالی آلی با ویژگی قطبی است.
مثال دوم
اتانول حلالی قطبی است یا ناقطبی؟
پاسخ
حلال اتانول به دلیل وجود گروه هیدروکسیلی در آن مولکولی به شدت قطبی است زیرا توانایی تشکیل پیوند هیدروژنی با مولکولهای دیگر را دارد.
مثال سوم
چطور میتوان بدون در دست داشتن الکترونگاتیوی در مورد قطبی یا ناقطبی بودن حلالی اظهار نظر کرد؟
پاسخ
تشخیص قطبیت یک حلال از روی مقدار گشتاور دو قطبی آن راهحلی جایگزین است. با این حال استفاده از مقدار ثابت دیالکتریک، راهحل بهتری به حساب میآيد.
مثال چهارم
آیا ترکیبات یونی در حلالهای ناقطبی حل میشوند؟
پاسخ
خیر، حلالهای ناقطبی توانایی حل کردن ترکیبات یونی را ندارد. برای حل کردن ترکیبات یونی باید از حلال قطبی استفاده کنیم.
مثال پنجم
اهمیت آگاهی بر قطبیت مولکولها در حلال چیست ؟
پاسخ
اهمیت قطبیت یک مولکول در این است که به ما اطلاعاتی در مورد انحلالپذیری آن در حلالهای متفاوت میدهد. طبق اصل شبیه، شبیه را در خود حل میکند، حلشوندههای قطبی در حلال قطبی و حلشوندههای ناقطبی در حلال ناقطبی حل میشوند.
مثال ششم
چرا کلروفرم حلالی ناقطبی است؟
پاسخ
کلروفرم ناقطبی است زیرا دارای ثابت دیالکتریک پایینی است. ثابت دیالکتریک، مقیاسی برای قطبیت حلال به شمار میرود. بهصورتی که هرچه ثابت دیالکتریک بیشتر باشد، قطبیت حلال نیز بیشتر خواهد بود و بالعکس. یعنی هرچه مولکولی ناقطبیتر باشد، دارای ثابت دیالکتریک کوچکتری است.
مثال هفتم
چرا کربوهیدراتها مولکولهایی قطبی به حساب میآيند؟
پاسخ
مونوساکاریدها و دیساکاریدها کربوهیدراتهای سادهای هستند که مولکولهایی قطبی بهشمار میآيند زیرا در ساختار خود دارای چندین گروه عاملی هیدروکسیل هستند که باعث آبدوست بودن آنها میشود. پلیساکاریدها، کربوهیدراتهای پیچیدهای هستند و ناقطبی به حساب میآیند.
مثال هشتم
چرا آب یک حلال عمومی است؟
پاسخ
آب توانایی حل کردن ترکیبات زیادی را دارد و از این نظر از تمامی مایعات دیگر برتر است. آب مولکولی قطبی و کووالانسی است که در آن اتم هیدروژن دارای بار مثبت و اتم اکسیژن دارای بار منفی است. آب در مجاورت با هر مادهای، باعث شکستن نیروی الکتروستاتیکی نگهدارنده مولکول میشود و همین، دلیل انحلالپذیری ترکیبات بسیار در آب است.
مثال نهم
آیا مقدار روی انحلالپذیری تاثیر میگذارد؟
پاسخ
انحلالپذیری یک حلشونده میتواند روی مقدار محلول آبی تاثیر بگذارد. اگر مقدار محلولی بهصورتی باشد که هیچ بار الکتریکی خالصی توسط مولکولها تحمل نشود، انحلالپذیری به کمترین مقدار خود میرسد و شاهد تشکیل رسوب خواهیم بود.
تمرین از حلال
پس از اینکه دانستیم حلال چیست و چه انواع و کاربردی دارد، به بررسی تعدادی تمرین چندگزینهای در این مورد میپردازیم.
تمرین اول
تمرین و آزمون
تمرین دوم
تمرین و آزمون
تمرین سوم
تمرین و آزمون
تمرین چهارم
تمرین و آزمون
تمرین پنجم
تمرین و آزمون
تمرین ششم
تمرین و آزمون
تمرین هفتم
تمرین و آزمون
تمرین هشتم
تمرین و آزمون
تمرین هشتم
تمرین و آزمون
تمرین نهم
تمرین و آزمون
تمرین دهم
تمرین و آزمون
تمرین یازدهم
تمرین و آزمون
تمرین دوازدهم
تمرین و آزمون
تمرین سیزدهم
تمرین و آزمون
تمرین چهاردهم
تمرین و آزمون
تمرین پانزدهم
تمرین و آزمون
تمرین شانزدهم
تمرین و آزمون
تمرین هفدهم
تمرین و آزمون
تمرین هجدهم
تمرین و آزمون
تمرین نوزدهم
تمرین و آزمون
تمرین بیستم
تمرین و آزمون
تمرین بیست و یکم
تمرین و آزمون
سوالات متدوال در رابطه با حلال
حال که میدانیم حلال چیست و دارای چه ویژگیهایی است، میخواهیم به برخی از سوالهای پرتکرار و مهم در این زمینه پاسخ دهیم.
حلالهای قطبی چه ترکیباتی را در خود حل میکنند؟
حلالهای قطبی، ترکیبات قطبی را در خود حل میکنند. برای مثال آب به عنوان حلال، اتانول را به عنوان حلشونده در خود حل میکند.
آیا آب حلالی قطبی است؟
بله، مولکولهای آب قطبی هستند و روی اتمهای هیدروژن دارای بار جزئی مثبت و روی اتم اکسیژن دارای بار جزئی منفی هستند.
محلول اشباع چیست؟
به محلولی که توانایی حل کردن مقدار بیشتری از حلشونده را در خود نداشته باشد، محلول اشباع گفته میشود.
حلالهای ناقطبی چه ترکیباتی را در خود حل میکنند؟
طبق اصل شبیه، شبیه را در خود حل میکند، حلالهای ناقطبی مانند گازوئیل، ترکیبات ناقطبی مانند موم را در خود رحل میکنند.
آیا آب حلالی آپروتیک است؟
خیر، آب معروفترین حلال پروتیک است. حلالهای آپروتیک در ساختار خود فاقد هیدروژنی هستند که بهصورت مستقیم به اتمی الکترونگاتیو متصل شده باشد.
حلالهای آلی چه حلالهایی هستند؟
حلالهای آلی ترکیباتی بر پایه کربن هستند که توانایی حل کردن ترکیبات دیگر را دارند. ان هگزان، تترا کلرو اتیلن و تولوئن مثالهایی از این نوع حلال هستند.
آیا سرکه یک حلال است؟
خیر زیرا سرکه محلولی دو جزئی از استیک اسید و آب است و از آنجا که آب مقدار بیشتری نسبت به استیک اسید دارد، آن به عنوان حلال در نظر گرفته میشود.
جمعبندی
هدف از این مطلب مجله فرادرس این بود که بدانیم حلال چیست و چه انواعی دارد. در این مطلب با انواع حلالهای مورد استفاده در تحقیقات و صنایع آشنا شدیم. همچنین در ادامه به بررسی تعدادی تمرین پرداختیم تا درک خود از مطلب را افزایش دهیم.













بسیار عالی و مفید بود . چندین سال واژه قطبی و غیر قطبی بودن حلال ها را میشنیدم ولی درک مشخصی از آن نداشتم . ممنونم بابت اطلاعات مفید شما