تصعید چیست؟ – به زبان ساده
در مطالب قبل گفتیم که در یک دما و فشار مشخص، ماده میتواند در یکی از سه حالت مایع، جامد یا گاز قرار داشته باشد. هر کدام از این سه حالت، با توجه به شرایط دمایی ممکن است به هم تبدیل شوند و در نتیجه ماده دچار تغییر حالت شود. یکی از این تغییر حالتها، «تصعید، فرازش یا والایش» (Sublimation) است. تصعید، تغییر حالت مستقیم ماده از جامد به گاز است، بدون اینکه ابتدا جامد به مایع و سپس مایع به گاز تبدیل شود. در این مطلب از مجله فرادرس ابتدا توضیح میدهیم که تصعید چیست و پس از آشنایی با انواع تغییر حالتها و «نمودار فازی» (Phase Diagram)، با جزئیاتی که در این فرآیند اتفاق میافتد، بیشتر آشنا خواهیم شد.
- تحلیل نقش دما و فشار در وقوع تصعید بر اساس نمودار فازی را یاد میگیرید.
- تمایز اصولی بین فاز و حالت ماده در مباحث شیمی فیزیکی را میآموزید.
- بررسی مفهوم گرمای تصعید و محاسبه آنتالپی مرتبط با آن را فرا میگیرید.
- حل مسائل عددی و عملی مرتبط با فرآیند تصعید را میآموزید.
- نحوه مقایسه تصعید با فرآیند چگالش و تشخیص شرایط هر کدام را یاد میگیرید.
- دسترسی به منابع پیشرفته برای تعمیق دانش و سنجش یادگیری پیدا میکنید.


تصعید چیست؟
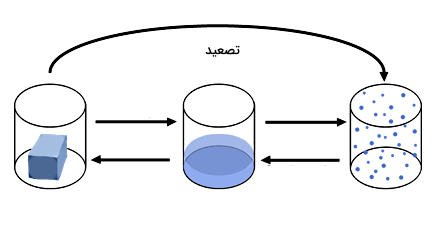
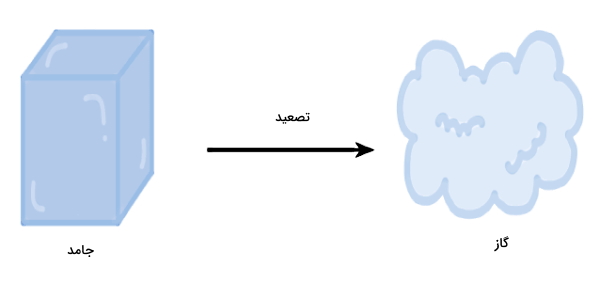
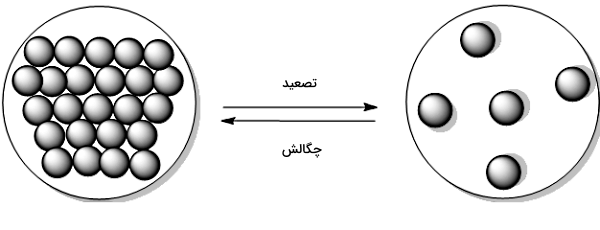
تصعید، فرازش یا والایش نوعی تغییر حالت در ماده است که در آن ماده مستقیما از جامد به گاز تبدیل میشود، یعنی ماده بدون عبور از حالت مایع، مستقیما از حالت جامد به حالت گاز تبدیل میشود. دمایی که در آن فرآیند تصعید رخ میدهد، نقطه تصعید نام دارد. تصعید «یخ خشک» (Dry Ice) در دمای اتاق و فشار اتمسفر یا تصعید «ید» (Iodine) جامد با افزایش دما نمونههایی از این نوع تغییر حالت هستند. عکس فرآیند تصعید، یعنی تغییر حالت مستقیم از گاز به جامد، «چگالش» (Deposition) نام دارد. تصعید یک تغییر فیزیکی محسوب میشود و تبدیل جامد به گاز طی یک برهمکنش شیمیایی را توصیف نمیکند.
یادگیری تصعید با فرادرس برای دانشآموزان
اگر دانشآموز هستید و میخواهید بهتر متوجه شوید که تصعید چیست، مشاهده فیلمهای آموزشی زیر در فرادرس به شما کمک میکند تا با انواع تغییر حالتهای ماده بیشتر آشنا شوید:
- فیلم آموزش علوم هشتم بخش شیمی فرادرس
- فیلم آموزش فیزیک پایه دهم فرادرس
- فیلم آموزش فیزیک دهم – مرور و حل تمرین فرادرس
- فیلم آموزش رایگان دما و گرما در فیزیک پایه دهم فرادرس
مثالهایی از تصعید
یاد گرفتیم که تصعید چیست، چه انواعی دارد و چه نوع تغییری محسوب میشود. اولین قدم برای مشاهده تصعید این است که ببینیم کدام مواد قابلیت این را دارند که مستقیما از جامد به گاز تبدیل شوند. در این بخش با ذکر چند مثال این مواد را خواهیم شناخت. اگر در مقطع متوسطه مشغول تحصیل هستید و میخواهید مباحث مربوط به تغییر حالتهای ماده را بهتر فرابگیرید، مشاهده فیلم آموزشی فیزیک پایه دهم از فرادرس را به شما پیشنهاد میکنیم که لینک آن در ادامه قرار داده است:
تصعید دیاکسیدکربن جامد یا یخ خشک
برای اینکه بهتر متوجه شویم تصعید چیست، از چند مثال رایج در این حوره استفاده میکنیم. برای نمونه، یخ خشک یا همان دی اکسیدکربن منجمد، تحت فشار اتمسفریک نرمال ۱ atm به فاز گازی تصعید میشود. چون دمای بخار تولید شده در چنین فشاری پایین است، از این فرآیند بهعنوان نوعی خنککننده نیز استفاده میشود. اگر یخ خشک داخل آب گرم قرار بگیرد، پس از تصعید مه سفید رنگی تولید میشود که در واقع مخلوطی از دیاکسیدکربن گازی و سرد با هوای مرطوبی است که طی فرآیند تصعید ایجاد شده است.

این ابر یا مه در واقع متشکل است از قطرات آب گیر افتاده در دیاکسیدکربن گازی. علت تشکیل قطرات آب این است که یخ خشک آنقدر سرد و خنک است که باعث میشود قطرات آب از هوای متراکم شده تولید شود (میعان). باید دقت شود که میزان سردی یخ خشک به قدری است که میتواند باعث سوختگی پوست دست شود. بنابراین از تماس مستقیم دست با یخ خشک اجتناب کنید.

تصعید یخ
برف و یخ در دماهایی زیر مرز جامد و مایع یا نقطه ذوب (عموما ۰ درجه) و در فشار نسبی زیر فشار در نقطه سهگانه، دچار تصعید تدریجی خواهند شد. بنابراین در حالت کلی نمیتوانیم بگوییم تصعید برای یخ همیشه رخ میدهد. برای مثال مقدار زیادی برف جمع شده در مناطق کوهستانی را در نظر بگیرید. به چنین تجمعی از برف، برفچال گفته میشود و در چنین مناطقی تصعید یخ را داریم.

در برفچال به تدریج برف کم میشود، چرا که نور خورشید روی سطح برف باعث تصعید آن خواهد شد. این پدیده در طبیعت در مناطق خاصی مانند قطب شمال و جنوب که دمای خیلی پایین و فشار خیلی بالا دارند، اتفاق میافتد. در بقیه مناطق، اغلب تغییر حالت جامد به گاز با عبور از فاز میانی مایع است. ثابت شده است در شرایط یکسان، سرعت تصعید قطعات یخ با سرعت تبخیر همان مقدار آب برابر است.
تصعید نفتالین
در ادامه یادگیری مبحث تصعید چیست، تصعید نفتالین را توضیح میدهیم. «نفتالین» (Naphthalene) یک ترکیب آلی است که معمولا در سموم دفع آفات به شکل گلولههای سفید رنگ دیده میشود. این ماده قابلیت تصعید در دمای اتاق را دارد، زیرا از مولکولهای ناقطبی ساخته شده است که تنها نیروی متصلکننده آنها به هم نیروی بین مولکولی واندروالس ضعیف است. بنابراین بهراحتی تصعید میشود.

نفتالین جامد در فشار و دمای استاندارد بهتدریج و در نقطه تصعید بحرانی، یعنی در دمایی حدود ۸۰ C با نرخ بالایی تصعید میشود. در دماهای پایین، فشار بخار نفتالین به اندازه کافی بالا هست تا باعث شود نفتالین جامد به بخار تبدیل شود.
تصعید ید
میخواهیم ببینیم رفتار ید طی فرآیند تصعید چیست. «ید» (Iodine) نیز از جمله موادی است که به تدریج تصعید میشود و با حرارتدهی در دمای استاندارد، بخار تولید میکند. تصعید ید، نفتالین و کافور را میتوانیم نمونههایی از «تصعید مولکولی» در نظر بگیریم. به این علت که در این موارد، ماده جامد از مولکولهایی ساخته شده است که توسط نیروهای بینمولکولی ضعیفی مانند نیروهای واندوالسی کنار هم نگه داشته شدهاند.

بنابراین با حرارتدهی این پیوندهای ضعیف به آسانی شکسته میشوند و مولکولها راحتتر از شبکه جامدی فرار میکنند تا به گاز تبدیل شوند. شکل بالا تصعید ید جامد در ته یک لوله آزمایش را نشان میدهد که گازی بنفش رنگ تولید کرده است. این گاز با سرد شدن در ابتدای لوله، مجددا به ذرات جامد ید چگالیده میشود.
حالتهای ماده در تصعید
برای اینکه بهتر متوجه شویم تصعید چیست، ابتدا باید حالت ماده در ابتدا و انتهای این فرآیند را بشناسیم. گفتیم در شرایط فشار نرمال، بیشتر ترکیبات شیمیایی و عناصر با توجه به دمایی که در آن قرار دارند، فقط میتوانند در یکی از سه حالت ماده یعنی مایع، جامد یا گاز در طبیعت وجود داشته باشند.
برای ماده حالت چهارمی به نام پلاسما نیز شناخته شده است که اگر تمایل دارید با مشخصات این حالت از ماده آشنا شوید، میتوانید مطلب «پلاسما در فیزیک — به زبان ساده» از مجله فرادرس را مطالعه کنید. گفتیم تصعید تغییر حالت مستقیم ماده از جامد به گاز است. بنابراین در این بخش، این دو حالت ماده و ویژگیهای آنها را توضیح میدهیم. همچنین حالت مایع را نیز بررسی خواهیم کرد تا بهتر درک کنیم چرا انتظار بر این است که در تصعید، ماده با عبور از حالت مایع، از جامد به گاز تبدیل شود. در حالی که میدانیم در تصعید چنین اتفاقی نمیافتد و ماده بهطور مستقیم از جامد به گاز تبدیل میشود.
نقش جامد در تصعید
تا اینجا میدانیم که حالتهای ماده طی فرآیند تصعید چیست. در این قسمت میخواهیم خصوصیات ماده در شروع فرآیند تصعید، یعنی حالت جامد را بررسی کنیم. در جامد اتمهای ماده در فاصله خیلی نزدیکی از هم، توسط پیوندهای قوی و در مکانهای تقریبا ثابتی نگه داشته شدهاند. چنین چینشی باعث میشود تا یک جامد دارای بالاترین درجه «سختی» (Rigidity) بین سه حالت ماده باشد، کمترین مقدار انرژی جنبشی ممکن را داشته باشد و در نتیجه، در مقابل هر گونه اعمال نیرو یا فشار مقاومت کند.
ساختار محکم جامد باعث میشود که برخلاف مایعات و گازها، قابلیت جاری شدن نداشته باشد یا بهعبارتی سیال نباشد. بنابراین یک جامد، شکل ظرفی که در آن قرار دارد را به خود نمیگیرد. همچنین قابلیت انبساط برای پر کردن کامل حجم ظرفی که در آن ریخته شده است را نیز ندارد. برخلاف مولکولهای گاز که چون نیروی بین آنها قوی نیست، با دریافت فشار ناچیزی بهآسانی متراکم میشوند، جامدات با اعمال فشار معمولی هم قابلیت تراکم ندارند.
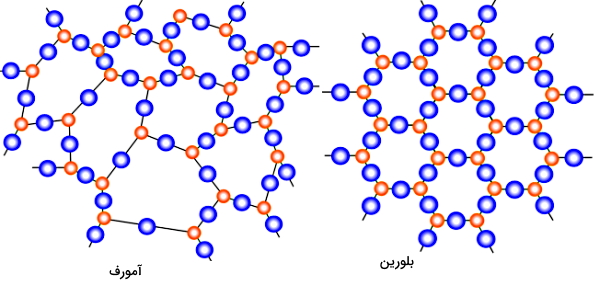
اگر قرارگیری اتمهای جامد در کنار هم به شکل یک آرایه یا شبکه منظم هندسی باشد، به چنین جامدی «جامد بلورین» (Crystalline Solid) گفته میشود. در غیر این صورت یک جامد با داشتن ساختار یا شبکه نامنظم، «جامد آمورف یا بیشکل» (Amorphous Solid) نامیده میشود. اکثر فلزات و بلورهای یخ، نمونههایی از جامد بلورین و شیشه نمونهای از جامد بیشکل محسوب میشود. در شکل زیر تفاوت ساختار منظم یک جامد بلورین و ساختار نامنظم یک جامد آمورف را مشاهده میکنید.
نقش مایع در تصعید
یاد گرفتیم خصوصیات ماده در شروع تصعید چیست. مایعات شکل ظرفی که در آن قرار دارند را به خود میگیرند، تراکمناپذیر محسوب میشوند و مستقل از میزان فشاری که دریافت میکنند، دارای حجم ثابتی هستند. پس تنها حالتی از ماده که حجم ثابتی دارد اما شکل ثابتی نه، مایع است. مولکولهای ماده در حالت مایع توسط پیوندهای بینمولکولی کنار هم نگه داشته میشوند. ذرات یک مایع میتوانند آزادانه اطراف هم حرکت کنند، به همین خاطر مایع شکل ظرفی که در آن قرار دارد را به خود میگیرد.
برخلاف گازها، مولکولهای مایع تمام فضا یا حجم ظرف را پر نمیکنند. معمولا چگالی حالت مایع یک ماده به چگالی حالت جامد آن نزدیک و از چگالی گازی آن خیلی بیشتر است. به همین علت است که مایع و جامد را در دستهبندی ماده چگال قرار میدهند. از طرفی، چون مایع و گاز هر دو قابلیت جاری شدن یا جریان یافتن را دارند، این دو حالت ماده سیال یا شاره نامیده میشوند. در واقع علت سیال بودن مایع و گاز، ضعیف بودن نیروهای جاذبه بین ذرات تشکیلدهنده این دو حالت از ماده است.
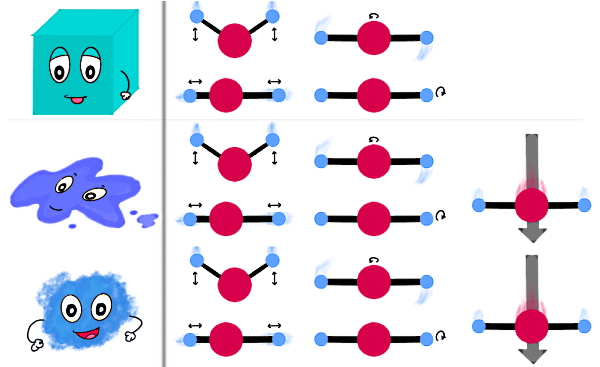
طبق نکتهای که در مورد سیال بودن مایع و گاز گفتیم، اگر به شکل بالا دقت کنید برای مایعات و گازها علاوهبر حرکت نوسانی و چرخشی، امکان حرکت انتقالی هم برای ذرات تشکیلدهنده این دو حالت ماده وجود دارد. با اینکه آب بهعنوان مرسومترین مایع روی زمین فراوان است، اما بهطور کلی مواد در حالت مایع نسبت به دو حالت دیگر کمتر وجود دارند. علت این مسئله این است که شکلگیری مایعات در بازه محدودی از فشار و دما انجام میشود. بیشترین موادی که در جهان شناخته شدهاند، در حالت گاز هستند که در بخش بعدی راجعبه خصوصیات آن توضیح میدهیم.
نقش گاز در تصعید
در این قسمت میخواهیم ببینیم حالت نهایی ماده در تبرید چیست. گفتیم ماده طی فرآیند تصعید از حالت اولیه جامد به حالت نهایی گاز تبدیل میشود. یک گاز خالص میتواند شامل اتم، مولکولهای شامل یک نوع اتم یا عنصر و ترکیبات مولکولی شامل چند نوع اتم باشد. اما یک گاز مخلوط مثل هوا، از مخلوط چند گاز خالص تشکیل شده است. ذرات تشکیلدهنده یک گاز خالص، آزادانه و بهسرعت در تمام جهات حرکت میکنند. برخلاف جامدات، به علت فاصله زیادی که این ذرات از هم دارند، رسانای حرارتی و الکتریکی خوبی محسوب نمیشوند.
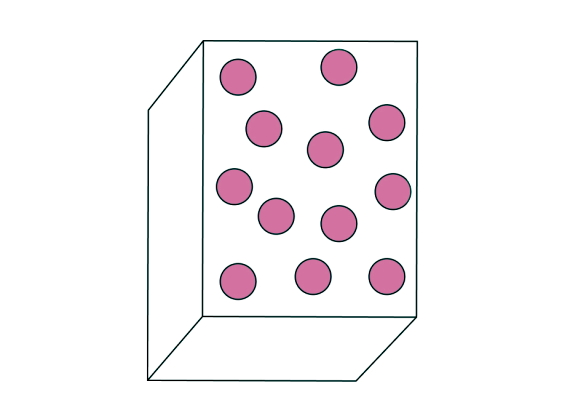
تمایز اصلی گازها با مایعات و جامدات در این است که ذرات گاز در فاصله خیلی دوری از هم قرار دارند. بنابراین، ذرات گاز تمام حجم ظرفی که در آن قرار میگیرند را پر میکنند و قابلیت تراکمپذیری یا انبساط خوبی دارند. از جمله عناصر شیمیایی که در فشار و دمای استاندارد در حالت گازی پایداراند، میتوانیم به اکسیژن (O2)، نیتروژن (N2)، هیدورژن (H2) و دو هالوژن فلوئور (F2) و کلر (Cl2) اشاره کنیم.
در انتهای این قسمت، خواص سه حالت ماده را جهت مقایسه سریعتر در جدول زیر خلاصه کردهایم:
| گاز | مایع | جامد |
| ذرات خیلی از هم دور و بهسرعت در حال حرکت تصادفی در تمام جهات | ذرات تقریبا نزدیک به هم و در حال لغزش روی هم در جهات مختلف | ذرات خیلی نزدیک به هم و در حال نوسان در مکانهای تقریبا ثابت |
| شکل متغیر | شکل متغیر (شکل ظرفی که در آن ریخته میشود را دارد) | شکل ثابت |
| حجم متغیر (حجم محفظهای که در آن قرار دارد را پر میکند) | حجم ثابت | حجم ثابت |
با توجه به آنچه که در مورد حالتهای ماده گفتیم، چون خواص حالت مایع بهنوعی وسط طیف خواص جامد و گاز قرار میگیرد، انتظار داریم ماده برای تبدیل شدن از جامد به گاز، ابتدا از حالت مایع عبور کند. اینکه در تصعید چنین اتفاقی رخ نمیدهد، یکی از خصوصیات جالبتوجه این تغییر حالت از ماده است که آن را از سایر تغییر حالتها متمایز کرده است. در بخش بعدی در مورد این مبحث بیشتر صحبت خواهیم کرد.
تغییر حالت تصعید
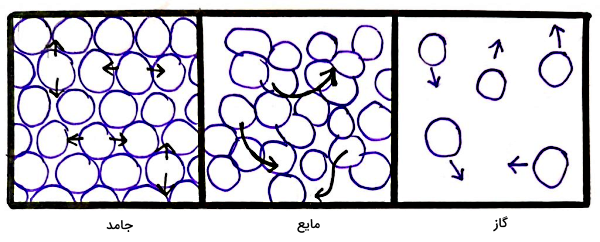
پس از اینکه با حالتهای ماده آشنا شدیم، حالا بهتر متوجه میشویم که تغییر حالت تصعید چیست. تغییر حالت ممکن است بین مایع و جامد، مایع و گاز یا جامد و گاز انجام شود. در شکل زیر سه حالت ماده را از چپ به راست بهصورت جامد، مایع و گاز مشاهده میکنید که تغییر حالتهای نشان داده شده با پیکان عبارتاند از ذوب، انجماد، تبخیر، میعان، تصعید و چگالش.
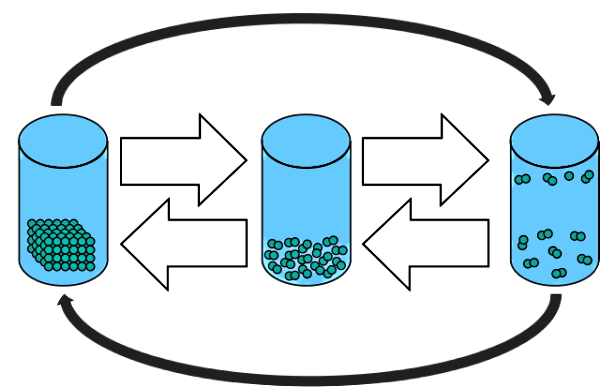
| تغییر حالت بین جامد و گاز | تغییر حالت بین مایع و گاز | تغییر حالت بین جامد و مایع | |||
| چگالش | تصعید | میعان | تبخیر | ذوب | انجماد |
| گاز به جامد | جامد به گاز | گاز به مایع | مایع به گاز | جامد به مایع | مایع به جامد |
تغییر حالت مواد، بر اثر کاهش یا افزایش دما رخ میدهد و چون مواد مختلف در طبیعت شامل اتمهای مختلفی هستند، در نتیجه برهمکنشهای متفاوتی با هم ایجاد میکنند. این مسئله باعث میشود دمای تغییر حالت هر ماده از دیگری متمایز باشد. برای مثال دمای جوش آب (۱۰۰ C) از دمای جوش الکل (۸۲٫۵ C) بیشتر است. پس عامل تغییر حالت تغییرات دمایی است، اما کمیت دیگری به نام فشار هم در نحوه انجام تغییر حالت موثر است.
اثر فشار بخصوص در تغییر حالت تصعید مشهود است. در فشار نرمال، تبدیل حالت جامد به گاز معمولا با عبور از حالت مایع بهعنوان «حالت میانی» (Intermediate State) انجامپذیر است. اما اگر فشار بخار جامدی از «فشار نسبی» (Partial Pressure) محیط اطرافاش بیشتر باشد، امکان تصعید این جامد یعنی تبدیل حالت مستقیم از جامد به گاز وجود دارد.
اگر نمودار فازی را برای مواد مختلف بررسی کنیم، طبق پیشبینی این نمودار حرارت دادن ماده جامدی که دارای فشاری کمتر از فشار «نقطه سهگانه» (Triple Point) است، باعث میشود این ماده به گاز تبدیل شود یا تصعید شود. به عبارت دیگر، برای اینکه بهتر متوجه شویم کدام مواد برای تصعید مناسباند، بهتر است ابتدا به نمودار فازی هر ماده توجه کنیم تا بیشتر متوجه تاثیر فشار در فرآیند تصعید شویم.
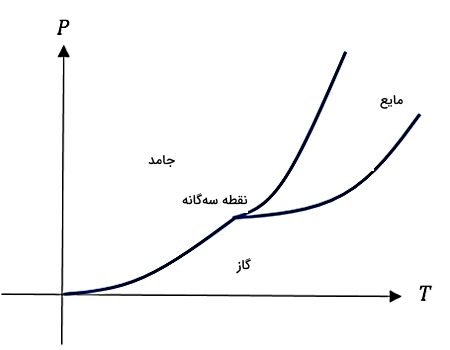
اگر فشار نقطه سهگانه برای یک ماده خیلی زیاد باشد، در این حالت احتمال اینکه این ماده در فاز مایع وجود داشته باشد، خیلی کم است. در نتیجه چنین مادهای برای تصعید یا تبدیل مستقیم جامد به گاز بسیار مناسب است. شکل بالا تصویری از یک نمودار فاز نوعی و نقطه سهگانه را نشان میدهد. در بخشهای بعدی این مطلب حتما در مورد نمودار فازی و اهمیت نقطه سهگانه توضیح خواهیم داد.
در متون مختلف بهجای تغییر حالت از عبارت «تبدیل فاز» (Phase transition) نیز استفاده میشود. همچنین در مبحث تصعید، درک نموداری به نام نمودار فازی ماده بسیار مهم است. بنابراین اولین قدم برای درک عمیقتر مبحث تصعید، دانستن تفاوت فاز و حالت است که در بخشهای بعدی به آن پرداختهایم.
تفاوت فاز با حالت چیست؟
برای اینکه بدانیم تفاوت تغییر حالت با تبدیل فاز تصعید چیست، لازم است ابتدا تفاوت فاز و حالت را بدانیم. مخلوطی از آب و روغن را در نظر بگیرید. هر دو ماده آب و روغن از نظر حالت مایع محسوب میشوند، پس مخلوط آب-روغن نیز یک حالت یعنی حالت مایع دارد. ولی از نظر فازی، آب-روغن یک مخلوط دو فازی است. در واقع فاز به ناحیه یا بخشی از ماده گفته میشود که در سراسر آن، خواص فیزیکی یکنواختی مانند چگالی، میزان مغناطیسی شدن یا ترکیب شیمیایی داشته باشیم.

گرمای تصعید چیست؟
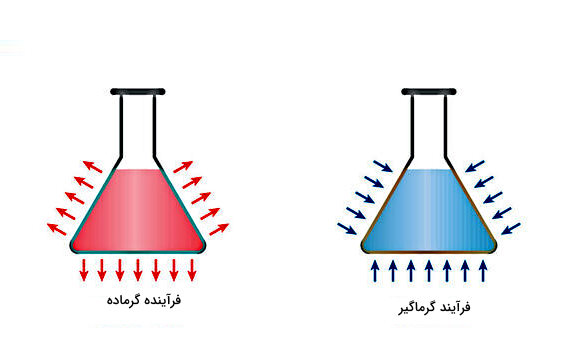
پس از اینکه به انواع تغییر حالت در مواد اشاره کردیم، در ادامه میخواهیم ببینیم اثر دریافت گرما در تصعید چیست. برای انجام تصعید لازم است تمام نیروهای قوی بین مولکولها یا هر نوع دیگر از ذرات تشکیلدهنده جامد مانند یون شکسته شوند تا این ذرات بتوانند در قالب فاز گازی از شبکه جامد فرار کنند. بنابراین چون انجام چنین تغییر حالتی نیازمند جذب انرژی اضافی است، آن را «گرماگیر» (Endothermic) مینامند. پس تصعید یک فرآیند گرماگیر است.
فرآیند گرماگیر فرآیندی شیمیایی یا فیزیکی است که در آن گرما از محیط اطراف جذب میشود. بنابراین «آنتالپی» (Enthalpy) یا «انرژی داخلی» (Internal Energy) ماده طی فرآیند گرماگیر افزایش خواهد یافت و انتظار داریم که دمای ماده نیز زیاد شود، در حالی که دمای محیط اطراف آن کم شده است. معکوس چنین فرآیندی، فرآیند گرماده است که باعث افزایش دمای محیط اطراف میشود.
پس انتظار داریم طی فرآیند تصعید، آنتالپی ماده زیاد شود. معمولا به آنتالپی تصعید یک ماده، گرمای تصعید هم گفته میشود. تعریف دقیقتر گرمای تصعید برابر است با مقدار انرژی که لازم است به یک مول جامد در فشار ثابت اضافه شود تا مستقیما به گاز تبدیل شود. بنابراین برای تصعید یک جامد، لازم است مقداری انرژی به شکل گرما یا کار مصرف شود. اینکه اندازه این انرژی چقدر است، به خصوصیات ماده بستگی دارد.
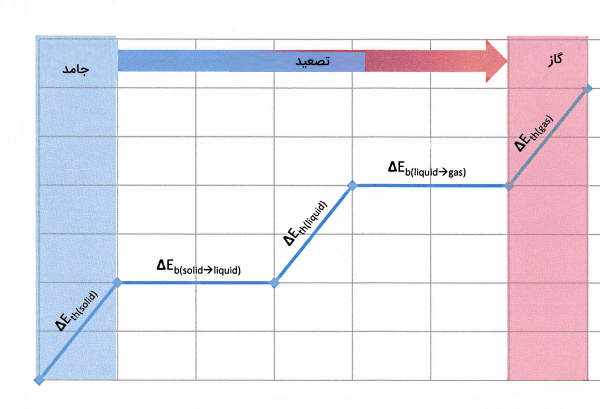
نکته مهم این است که این انرژی باید برای انجام سه فرآیند زیر طبق ترتیب گفته شده، کافی باشد:
- ابتدا لازم است ماده به حداکثر «ظرفیت گرمایی» (Heat Capacity) خود در حالت جامد برسد.
- سپس تمام پیوندهایی که ذرات تشکیلدهنده جامد را کنار هم نگه داشته است، از بین برود.
- در انتها تمام اتمهایی که حالا هیچ پیوندی با هم ندارند را بهگونهای برانگیخته کند که به حداکثر ظرفیت گرمایی خود در حالت گازی برسند.
در شکل بالا، نمودار تغییرات دمای یک ماده (محور قائم) برحسب تغییرات انرژی آن (محور افقی) رسم شده است. این نمودار بهخوبی نشان میدهد برای تصعید یک ماده چقدر انرژی لازم است. اگر بخواهیم آنتالپی تصعید را طبق این شکل محاسبه کنیم، میتوانیم تغییرات انرژی زیر را با هم جمع کنیم:
- : گرمای تصعید
- : تغییرات انرژی گرمایی
- : انرژی پیوندی
در رابطه بالا تغییرات انرژی گرمایی یا برابر است با حاصلضرب تغییرات دمایی ماده () برحسب واحد کلوین در ظرفیت گرمایی حالت خاصی از ماده ():
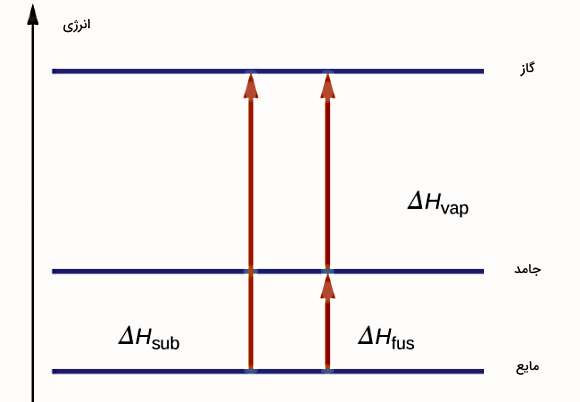
همچنین انرژی پیوندی یا برابر است با مقدار انرژی که یک گروه از اتمها باید جذب کنند تا یک تغییر فاز رخ دهد و ماده از حالتی با انرژی پایینتر به حالتی با انرژی بالاتر برود. بنابراین با اینکه در تصعید عبور از فاز میانی مایع نداریم، اما گرمای لازم برای انجام این فرآیند همان مقداری است که در صورت عبور از فاز میانی نیاز است و به همان صورت هم محاسبه میشود.
محاسباتی که انجام شد، شکل دقیقتر آنتالپی تصعید بود. ولی بهطور کلی و با تقریب میتوانیم طبق شکل بالا اندازه تغییرات انرژی یا آنتاپی تصعید را برابر با مجموع گرمای ذوب و تبخیر در نظر بگیریم. در این شکل آنتالپی را برای سه نوع تغییر حالت مختلف شامل برای تبخیر، برای انجماد و برای تصعید میتوانید مقایسه کنید.
تصعید، یک تغییر فیزیکی
در بخشهای گذشته آموختیم تصعید چیست، انواع تغییر حالت مواد و نمودار فازی را توضیح دادیم و یاد گرفتیم که تصعید فرآیندی گرماگیر محسوب میشود. در این بخش میخواهیم ببینیم از نظر فیزیکی یا شیمیایی بودن، نوع فرآیند تصعید چیست. بنابراین لازم است با انواع تغییرات فیزیکی و شیمیایی و خصوصیات آنها آشنا شویم. خواهیم دید که تمام تغییر حالتهای ماده در گروه تغییرات فیزیکی قرار میگیرند. بنابراین تصعید نیز یک تغییر فیزیکی است که در آن حالت ماده عوض میشود.
پس اگر جامدی طی یک واکنش شیمیایی به گاز تبدیل شد، این واکنش تصعید در نظر گرفته نمیشود. برای مثال تجزیه حرارتی کلرید آمونیوم جامد به کلرید هیدروژن (گازی) و آمونیاک (گاز)، یک تغییر شیمیایی محسوب میشود و تصعید نیست. فرآیند سوختن شمع که حاوی موم پارافین (جامد) است و به گاز دیاکسید کربن و بخار آب تبدیل میشود نیز تصعید نیست، بلکه یک واکنش شیمیایی با اکسیژن محسوب میشود.
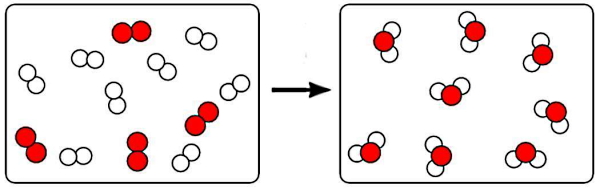
یکی از مهمترین تفاوتهای تغییرات فیزیکی و شیمیایی این است که در تغییر شیمیایی، یک محصول جدید تولید میشود. برای مثال در شکل بالا اگر ذرات سفید را یک نوع مولکول و ذرات قرمز را مولکول دیگری در نظر بگیریم، پس از انجام تغییر در سمت راست تصویر ذرات سفید و قرمز از هم جدا شدهاند و هر ذره قرمز به دو ذره سفید چسبیده است. بنابراین چنین تغییری که تولید محصول متفاوتی کرده است، قطعا یک نمونه تغییر شیمیایی است. فرآیندهایی مانند سوختن، پوسیدگی، زنگزدگی یا گوارش همگی تغییر شیمیایی محسوب میشوند. در حالی که آب شدن بستنی یا جوشیدن آب، خرد کردن یک ماده یا بریدن آن تغییر فیزیکی است.
انواع تصعید
تا اینجا آموختیم که تصعید چیست و چگونه انجام میشود. در این بخش میخواهیم ببینیم انواع تصعید به چه صورت است. با اینکه تصعید تعریف سادهای دارد، اما اغلب تشخیص اینکه چه نوع فرآیندی تصعید در نظر گرفته میشود، دشوار است. برای مثال اگر بخواهیم فرآیند تصعید را با تبخیر مقایسه کنیم، بهجز اینکه تصعید تغییر حالت ماده از جامد به گاز است در حالی که تبخیر تغییر حالت از مایع به گاز، جزئیات این دو فرآیند نیز متفاوت است.
تبخیر (Vaporization) شامل دو مرحله است، مرحله اول تبخیر از سطح مایع یا Evaporation و مرحله بعد، تشکیل حباب در داخل مایع در نقطه جوش است که اصطلاحا جوشیدن یا Boiling نام دارد. میخواهیم برای تصعید نیز مراحل مشابهی را در نظر بگیریم.
اگر به نمودار فازی دقت کنیم، تصعیدی که در سمت چپ مرز گاز و جامد، یعنی در نقطه سهگانه یا مرز مایع و جامد اتفاق میافتد، «تصعید تدریجی» (Gradual Sublimation) نامیده میشود. این ناحیه معادل است با مرحله اول در تبخیر که به آن اشاره کردیم. دقت کنید استفاده از کلمه تدریجی در اینجا، به معنای سرعت انجام فرآیند تصعید نیست.
اما تصعیدی که دقیقا در مرز جامد و گاز یا همان نقطه بحرانی تصعید اتفاق میافتد، «تصعید سریع» (Rapid Sublimation) نامیده میشود. این بخش با مرحله جوشیدن در تبخیر معادل است. مجددا تاکید میکنیم که کلمات سریع و تدریجی در این دو نوع تصعید ربطی به نرخ یا سرعت انجام تصعید ندارند.
حل مثال در مورد تصعید
در این قسمت با حل دو مثال عددی و استفاده از روابط ترمودینامیکی، بهتر متوجه خواهیم شد که تصعید چیست.
مثال ۱
محققان ۱۰ gr ید (I2) را در یک محفظه عایق قرار داده و آن را حرارت میدهند. اگر تمام ید داخل محفظه تصعید شود، حجم نهایی بخار ید را در شرایط دما و فشار استاندارد محاسبه کنید. همچنین تعداد مولهای ید را نیز با استفاده از وزن مولکولی آن بهدست آورید.
پاسخ
شرایط دما و فشار استاندارد معادل است با دمای ۰ C و فشار ۱ atm. ابتدا تعداد مولهای ید را حساب میکنیم. با توجه به اینکه جرم مولی ید با برابر است، پس تعداد مولهای ید میشود جرم تقسیم بر جرم مولی آن:
از طرفی طبق قوانین ترمودینامیکی میدانیم که یک مول از هر گازی، حجمی برابر با ۲۲٫۴ لیتر در شرایط استاندارد دارد. پس حجم این مقدار مول از بخار ید در شرایط استاندارد خواهد شد:
بنابراین تقریبا ۰٫۸۸۳ لیتر از حجم اولیه بخار ید، پس از تصعید ۱۰ gr ید خالص در فشار و دمای استاندارد باقی مانده است.
مثال ۲
در یک محفظه باز در دمای اتاق (دمای ۲۵ C و فشار ۱ atm) حدود ۰٫۰۵ gr ید در هر دقیقه تصعید میشود. اگر در ابتدا ۱۰ gr ید در این محفظه قرار داده شده باشد، مقدار ید باقی مانده پس از ۲ ساعت چقدر است؟
پاسخ
با توجه به اطلاعاتی که در صورت سوال داده شده است، میتوانیم نرخ تصعید را بهصورت و مقدار ید اولیه در حالت جامد را در نظر بگیریم. با توجه به این نرخ پس از ۲ ساعت یا مقدار ید تصعید شده برابر خواهد شد با:
حالا با کم کردن مقدار ید تصعید شده از ید اولیه، میتوانیم جرم ید باقیمانده را محاسبه کنیم:
بنابراین پس از گذشت دو ساعت زمان، ۴ گرم از ید باقی خواهد ماند.
تصعید و چگالش
در بخش های قبل یاد گرفتیم مثالهای تصعید چیست. در این قسمت به فرآیند معکوس تصعید، یعنی تبدیل گاز به جامد که چگالش نام دارد، اشاره میکنیم. در چگالش هم مانند تصعید خیلی مهم است که تغییر حالت ماده مستقیما از گاز به جامد انجام شده باشد، بدون اینکه فاز میانی مایع تشکیل شود.
چگالش زمانی اتفاق میافتد که فشار گاز یا بخار از فشار محیط کمتر است. این مسئله موجب میشود که گاز متراکم شده و به جامد تبدیل شود. تبدیل بخار نفتالین به کریستالهای میلهای شکل جامد روی سطوح سرد یا تبدیل بخار ید به بلورهای ید در اثر سرد شدن، نمونههایی از چگالش است. در بخش بعد خواهیم دید که چگونه از فرآیندهای تصعید و چگالش در کنار هم، بهمنظور خالصسازی ترکیبات آلی یا چاپ روی سطوح استفاده میشود.
مثال معمول دیگر برای فرآیند چگالش، تشکیل «یخبندان» (Frost) در طبیعت است. زمانی که هوای مرطوب با یک سطح سرد برخورد میکند، یخبندان ایجاد خواهد شد. منظور از سطح سرد، سطحی است که دمای آن زیر دمای انجماد آب (۲۷۳ K) است. به این ترتیب بخار آب از حالت گازی به جامد تبدیل خواهد شد. معمولا روی سطح ماشین یا گیاهانی که در محیط بیرون از خانه در روزهای سرد قرار دارند، یخبندان مشاهده میشود.

کاربرد تصعید چیست؟
در این بخش با توضیح دو نمونه مثال، توضیح میدهیم که کاربردهای تصعید چیست. از جمله کاربردهای مهم تصعید در «خالصسازی» (Purification) مواد است، به این صورت که ترکیبات ناخالصی داخل ماده که قابلیت تصعید در شرایط مشابه را ندارد، با این تکنیک از ماده اصلی جدا میشوند.
خالصسازی
در این قسمت با جزئیات بیشتری توضیح میدهیم که خالصسازی با تصعید چیست. شیمیدانها از تصعید بهعنوان تکنیکی برای خالصسازی ترکیبات جامد استفاده میکنند. گفتیم در تصعید جامد بدون عبور از فاز مایع، به گاز تبدیل میشود. در خالصسازی با تصعید، فاز گازی تشکیلشده در برخورد با سطوح سرد به جامد تبدیل میشود (چگالش) تا در نهایت جامد خالص شده موردنظر را بهدست آوریم. از این روش برای خالصسازی داروها، عطرها و افزودنیهای خوراکی استفاده میشود.
سادهترین دستگاه تصعید را میتوان با تهیه یک ارلن خلاء ساخت. در این نوع ارلن مطابق شکل زیر علاوهبر دهانه اصلی، یک بازوی دیگر هم در گردن ارلن قرار دارد که آن را به لوله خلاء متصل میکنند. همچنین برای انجام فرآیند چگالش، نیاز است یک لوله سرد (که میتواند به یک شلنگ حاوی آب یخ یا هر ماده سردکننده دیگری متصل باشد) در دهانه ارلن قرار داده شود.

پس از قرار دادن جامد ناخالص ته این ارلن و کاهش فشار داخل آن، ماده روی «هات پلیت» (Hot Plate) به دقت حرارت داده میشود. منظور از دقت در حرارتدهی این است که کنترل شود ماده ذوب نشود یا نجوشد. کم کم ماده جامد شروع به تصعید خواهد کرد و با رسیدن فاز گازی تولید شده به لوله سرد در دهانه ارلن، گاز بهسرعت تبدیل به جامد میشود. بنابراین میتوان ماده خالص را با متوقف کردن حرارتدهی و حذف خلاء، از روی سطح سرد لوله جمعآوری کرد.
در شکل سمت راست ماده جامد تشکیلشده داخل لوله سرد در دهانه ارلن خلاء را مشاهده میکنید. در این روش ناخالصیهای غیرقابل بخار شدن ته ارلن باقی میمانند. برای داشتن بازدهی بیشتر در روند خالصسازی، معمولا حرارتدهی با اعمال یک گرادیان دما انجام میشود. این روش کمک میکند تا انواع مختلف ناخالصی جداسازی شوند. همچنین با کنترل دما در راستای لوله سرد، اپراتور قادر است از شکلگیری فرآیند میعان با پمپ کردن ترکیبات به خارج از سیستم، جلوگیری کند.

در اکثر روشهای تصعید مانند این تکنیک به فشار پایین نیاز است. نیاز به فشار پایین برای تصعید به این علت است که با کاهش فشار، نقطه تصعید نیز کاهش خواهد یافت. بنابراین برای اینکه ترکیبات آلی بدون ذوب شدن تصعید شوند، فشار کاهش یافته اغلب لازم است. تصعید در خلاء به شکلی که توضیح داده شد، روش مناسبی برای خالصسازی ترکیبات آلی با نقطه ذوب پایینتر به منظور کاربرد در صنعت الکترونیک مواد آلی است. در این حوزه به موادی با خلوص خیلی بالا (بیشتر از ۹۹٫۹۹ درصد) برای تامین استانداردها نیاز است.
چاپ تصعیدی
برای اینکه ببینیم کاربرد دیگر تصعید چیست، به توضیح «چاپ تصعیدی» (Sublimation Printing) میپردازیم. این صنعت به تصعید دیجیتالی هم معروف است و از آن در تزئین علامتها و بنرها استفاده میشود. اساس این روش در استفاده از فرآیند تصعید است که در آن از دما و فشار برای تبدیل جامد به گاز طی یک فرآیند گرماگیر و بدون عبور از فاز مایع، استفاده میشود. مزیت چاپ تصعیدی این است که میتواند تمام رنگها را به سطوح مختلف شامل انواع منسوجات و سطوح پوشیده شده با مواد پلیمری منتقل کند.

برخلاف روشهای سنتی چاپ مانند «چاپ جوهری» (Inkjet Printing) یا «چاپ سیلک» (Screen Printing) در چاپ تصعیدی جوهر مایع نداریم، بلکه از رنگدانههای جامد مخصوصی استفاده میشود که با حرارتدهی به گاز تبدیل خواهند شد. روند کار به این صورت است که پیش از شروع تصعید، طرح موردنظر بهصورت دیجیتالی ایجاد میشود. سپس این طرح روی کاغذ تصعید با استفاده از جوهرهای جامد حساس به حرارت چاپ میشود.
نحوه چاپ به این شکل است که جوهر طی حرارتدهی به گاز تبدیل میشود که بر اثر ترکیب با سطحی از جنس پلیاستر و پس از سرد شدن، رنگ نهایی ثابت میشود. در واقع در بخش سردسازی، گاز به جامد تبدیل میشود (چگالش). در این تکنیک رنگ جوهر به بخشی از مواد پارچه تبدیل میشود و در نتیجه با شستشو قابل پاک شدن نیست.

تصعید در نمودار فازی
گفتیم برای اینکه بهتر متوجه شویم تصعید چیست، باید با نمودار فازی آشنا شویم. نمودار فازی نشاندهنده شرایط ترمودینامیکی مانند دما و فشار است که فازهای مختلف یک ماده مانند جامد، مایع یا گاز در آن ایجاد میشوند. در دو بعد، معمولا نمودار فشار برحسب دما همان نمودار فازی است. طبق انتظاری که از نمودار فازی داریم، برای مادهای مانند آب تغییر فازهای مختلفی در شرایط خاص دما و فشار خواهیم داشت که عبارتاند از:
- ذوب (تبدیل یخ به آب)
- جوش (تبدیل آب به بخار)
- میعان (تبدیل بخار به قطرات آب)
- انجماد (تبدیل آب به بخ)
- تصعید (تبدیل مستقیم یخ به بخار، بدون عبور از فاز مایع)
خطوط قرمز رنگ روی نمودار فازی آب، نشاندهنده خطوط تعادلی هستند. در راستای خطوط تعادلی، هر دو فاز ماده با هم وجود دارند. کمترین تغییری در فشار یا دما باعث میشود فاز ماده عوض شود. خط AB خط تعادلی بخار-یخ، خط BC خط تعادلی بخار-آب و خط BD خط تعادلی آب-یخ است. کاربرد نمودار فازی این است که اگر برای مثال دما و فشار آب را بدانیم، میتوانیم با مراجعه به این نمودار فاز دقیق آب را تشخیص دهیم.
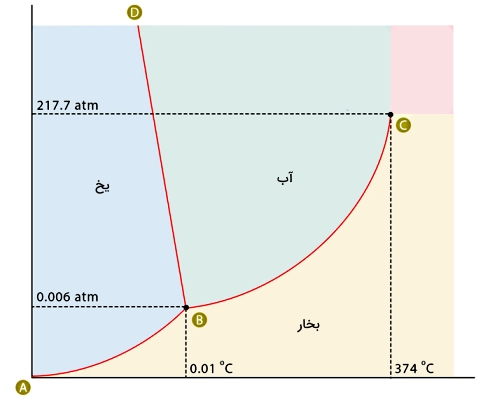
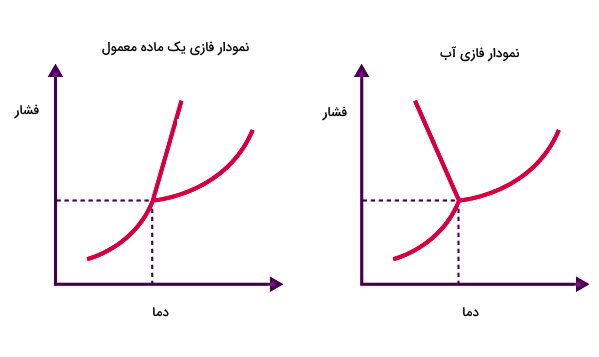
اگر بخواهیم نمودار فازی آب را با بقیه مواد مقایسه کنیم، یک تفاوت مهم این است که شیب خط تعادلی آب-یخ منفی است، در حالی که برای اکثر مواد این خط دارای شیب مثبت است. این تفاوت در نمودار فازی آب به این معناست که در مورد آب نقطه ذوب با افزایش فشار، کاهش مییابد.
نقطه سهگانه چیست؟
در ادامه یادگیری خود در مورد اینکه تصعید چیست، در این قسمت مفهوم نقطه سهگانه را توضیح میدهیم. در مباحث ترمودینامیکی، نقطه سهگانه یک ماده به دما و فشاری گفته میشود که در آن سه فاز ماده یعنی مایع، جامد و گاز در تعادل ترمودینامیکی هستند. به این ترتیب اگر منحنیهای فشار برحسب دما یا همان نمودار فازی را برای تغییر حالتهای تصعید، ذوب و تبخیر رسم کنیم، نقطهای که در آن این سه منحنی یکدیگر را قطع میکنند، همان نقطه سهگانه است.
| ماده | فشار (kPa) | دما (K) |
| آمونیاک | ۶٫۰۶ | ۱۹۵٫۴ |
| آرسنیک | ۳۶۲۸ | ۱۰۹۰ |
| کربن (گرافیت) | ۱۰۱۳۲ | ۴۷۶۵ |
| ید | ۱۲٫۰۷ | ۳۸۶٫۶۵ |
| آب | ۰٫۶۱۱ | ۲۷۳٫۱۶ |
نکته خیلی مهم:
اگر مقادیر دما و فشار در جدول بالا را مقایسه کنید، برای برخی از مواد مثل «کربن» (Carbon) یا «آرسنیک» (Arsenic) مقدار فشار نقطه سهگانه خیلی بالا است. فشار نقطه سهگانه معادل کمترین فشاری است که در آن ماده میتواند به حالت مایع باشد. بنابراین احتمالا یافتن این دو ماده در حالت مایع دشوار باشد. در نتیجه، برای این دو ماده تصعید از حالت جامد فرآیند معمولتری نسبت به تبخیر از حالت مایع است.
پس اینجا میتوانیم متوجه شویم که چرا در تصعید تاکید داریم تبدیل مستقیم جامد به گاز رخ میدهد. همانطور که از جدول بالا مشخص است، این اتفاق برای تمام مواد ممکن نیست. لذا برخی جامدات ابتدا به فاز میانی (مایع) تبدیل میشوند و سپس از مایع به گاز تبخیر دارند. اما گروه دیگری مانند کربن و آرسنیک، مستقیما از جامد به گاز تصعید میشوند.
یک نقطه مهم دیگر در نمودار فازی، «نقطه بحرانی» (Critical Point) است. نقطه بحرانی دمایی است که در آن علیرغم اعمال فشار، فاز گاز ماده قابل بازگشت به فاز مایع نیست. در شکل زیر، نقطه بحرانی و نقطه سهگانه برای یک نمودار فازی نمایش داده شده است.
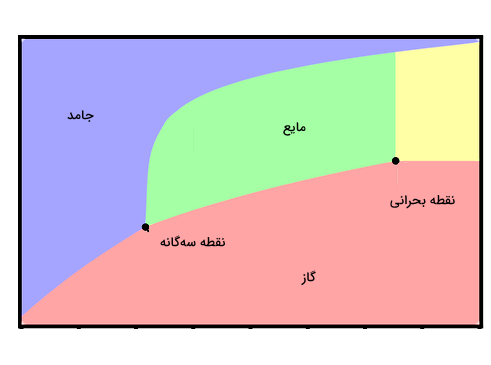
بنابراین اولین نکته مهم برای داشتن یک فرآیند تصعید موفق این است که انتخاب نوع جامد طبق نمودار فازی درست انجام شود. مرحله بعدی حرارت دادن جامد تا دمایی فراتر از نقطه تصعید آن است، در حالی که فشار آن پایین نگه داشته شده است. البته عواملی مانند مساحت سطح جامد، جریان هوا و مدت زمانی که جامد در معرض شرایط دمایی و فشار قرار میگیرد نیز در داشتن یک تصعید مطلوب موثر هستند. برای مثال خرد کردن جامد به قطعات کوچکتر، باعث افزایش مساحت سطح و در نتیجه، سریعتر انجام شدن فرآیند تصعید خواهد شد.
یادگیری پیشرفته تصعید با فرادرس
پس از اینکه آموختید تصعید چیست، چنانچه تمایل دارید اطلاعات بیشتری در زمینه کاربردهای این فرآیند در مهندسی مواد یا مباحث ترمودینامیکی و شیمی مرتبط با این نوع تغییر حالت بهدست آورید، مشاهده فیلمهای آموزشی زیر از فرادرس را به شما پیشنهاد میکنیم:
- فیلم آموزش شیمی عمومی فرادرس
- فیلم آموزش شیمی عمومی ۱ و ۲ مرور و حل مساله فرادرس
- فیلم آموزش رایگان آشنایی با انواع تغییرات فیزیکی فرادرس
- فیلم آموزش جداسازی اجزای مخلوط ها در شناسایی ترکیبات آلی فرادرس
- فیلم آموزش شناسایی ترکیبات آلی فرادرس
- فیلم آموزش اصول استخراج فلزات (پیرومتالورژی) فرادرس
آزمون تصعید
در انتهای این مطلب از مجله فرادرس پس از اینکه کاملا یاد گرفتید تصعید چیست، آزمونی را برای شما تهیه کردهایم تا با پاسخ به سوالات آن یادگیری خود را بیازمایید. در انتهای آزمون با کلیک بر روی بخش «دریافت نتیجه آزمون» میتوانید نمره نهایی خود را مشاهده کنید.
تمرین و آزمون
کدام گزینه تغییر حالت بین جامد و گاز است؟
تصعید
تبرید
چگالش
گزینه اول و سوم درست است.
گزینه آخر صحیح است. تصعید و چگالش دو تغییر حالت بین فاز جامد و گاز هستند. تبرید تغییر حالت محسوب نمیشود.
در طول فرآیند چگالش برای اتمهای ماده چه اتفاقی میافتد؟
سرعت حرکت آنها کم میشود و به هم نزدیکتر میشوند.
سرعت حرکت آنها کم میشود و از هم دورتر میشوند.
سرعت حرکت آنها زیاد میشود و به هم نزدیکتر میشوند.
سرعت حرکت آنها زیاد میشود و از هم دورتر میشوند.
گزینه اول صحیح است. در چگالش عکس فرآیند تصعید، حالت ماده از گاز به جامد عوض میشود. بنابراین انتظار داریم سرعت ذرات تشکیلدهنده گاز با کاهش دما کم شود و در نتیجه به هم نزدیکتر شوند تا بهتدریج ساختار محکم و چگال جامد را شکل دهند.
کدام مورد زیر مثالی از تصعید و چگالش محسوب نمیشود؟
آب شدن بستنی
تشکیل ابر سفید دور یخ خشک
ناپدید شدن نفتالین
یخ زدن برگ گیاهان در سرما
گزینه اول درست است. آب شدن یا ذوب بستنی نمونهای از تغییر حالت ذوب است. ناپدید شدن نفتالین جامد و بخار شدن یخ خشک هر دو مثالهایی از تصعید هستند و یخ زدن برگ گیاهان، نمونهای از چگالش است که با کاهش شدید دما اتفاق میافتد.
کدام جمله درست است؟
تصعید یک تغییر شیمیایی است.
در خالصسازی جامدات با استفاده از تصعید، جامد خالص شده بر اثر انجماد مایع داخل ارلن تشکیل میشود.
چگالش یک تغییر فیزیکی است.
در فرآیند چاپ تصعیدی، خشک شدن رنگ روی پارچه در نتیجه میعان است.
گزینه سوم درست است. گفتیم که انواع تغییر حالتهای ماده شامل تصعید و چگالش جزء تغییرات فیزیکی محسوب میشوند نه شیمیایی. پس گزینه اول اشتباه و گزینه سوم صحیح است.
علت نادرست بودن گزینه دوم این است که در خالصسازی با تصعید، بخار تشکیل شده طی فرآیند تصعید با سرد شدن به جامد خالص شده تبدیل میشود که این همان فرآیند چگالش است. همچنین در گزینه آخر، چاپ تصعیدی بهصورت ترکیبی از فرآیندهای تصعید و چگالش انجام میشود.
یخ جامد با حرارتدهی به کدام مورد تبدیل میشود؟
یخ خشک
آب
بخار
گزینه دوم و سوم درست است.
کدام گزینه در مورد تصعید و چگالش درست است؟
حرارتدهی ماده جامدی که در فشاری زیر فشار نقطه سهگانه است، آن را به بخار یا گاز تبدیل میکند.
تبدیل گاز به جامد فرآیندی گرماگیر است.
برای موادی مانند کربن یا آرسنیک انجام فرآیند تبخیر از تصعید آسانتر است.
فشار نقطه سهگانه برای موادی مثل آرسنیک و کربن خیلی کم است.
کدام گزینه تصعید است؟
تبدیل کلرید آمونیوم جامد به کلرید هیدروژن گازی و آمونیاک بر اثر حرارتدهی
تبدیل دیاکسیدکربن جامد به بخار
تشکیل یخبندان در طبیعت
تبدیل بخار نفتالین به کریستالهای میلهای شکل جامد روی سطوح سرد
آنتالپی تصعید برابر است با:
مجموع گرمای ذوب و گرمای تبرید
مجموع گرمای تبخیر و گرمای میعان
مجموع گرمای تبخیر و گرمای چگالش
مجموع گرمای ذوب و گرمای تبخیر
علت اینکه نفتالین به آسانی تصعید می شود چیست؟
نیروهای ضعیف واندروالسی بین مولکولهای غیرقطبی این ماده
بالا بودن نقطه سهگانه این ماده نسبت به فشار و دمای معمول
گزینه اول و دوم هر دو درست هستند.
هیچکدام
کدام مورد از عوامل موثر در تصعید نیست؟
فشار
دما
سطح مقطع
همه موارد













ید مانع تخمیر نمیشود ، ولی از ایجاد سویه های قوی از باکتری های مفید در سبزیجات تخمیرشده جلوگیری میکند.
نمک ها به صورت طبیعی ید دارند.
کاهو چینی با نمک قدیمی تخمیر کردم.بیمار را درمان کرد.
نمک تمام شد.
نمک جدید همان مارک آوردم، تخمیر شد، ولی روی بیمار تاثیر نگذاشت.
نمک در جای گرم برای چند روز گذاشتم تا ید تصعید شود.
ولی باز هم تاثیری نداشت .
به نظر شما علت چیست
با سلام؛
ید در غلظتهای پایین اثر محسوسی بر تخمیر ندارد. اگر مقدار زیادی ید استفاده شود ممکن است رشد باکتریها را محدود کند اما جلوگیری از سویههای قوی ادعایی بدون منبع علمی است. گرما یا فشار باعث از بین رفتن و تصعید ید نمیشود زیرا ید در نمک به صورت ترکیبات پایدار یدات یا یدید وجود دارد. استفاده از دما و فشار بالا روشی برای حذف ید از نمک خانگی نیست. هیچ روش ایمنی برای حذف ید از نمک خانگی وجود ندارد.
با تشکر از همراهی شما با مجله فرادرس
درود بر شما.
مقاله خیلی قابل فهم و علمی بود.
خیلی خوب?