نقطه سه گانه (Triple Point) – به زبان ساده


تمام مواد یک «نقطه سه گانه» (Triple Point) دارند. نقطه سه گانه یک ماده، نقطهای است که در آن، سه فاز ماده (جامد، مایع و گاز) به صورت همزمان با یکدیگر در حال تعادل ترمودینامیکی هستند. نقطه سه گانه، محلی است که خطوط ذوب، تبخیر و تصعید در نمودار فشار بر حسب دما (P-T)، با یکدیگر برخورد میکنند. در واقع همانطور که بیان شد، در این نقطه، سه فاز ماده با یکدیگر در حالت تعادل قرار دارند.
در دو نمودار مهم دیگر ترمودینامیک یعنی نمودار فشار بر حسب حجم (P-V) و نمودار دما بر حسب حجم (T-V)، نقطه سه گانه به صورت یک خط دیده میشود و «خط سه گانه» (Triple Line) نامیده میشود.

توجه شود که خط ذوب آب، شیب منفی دارد و این موضوع به دلیل ویژگی خاص آب است. در واقع با افزایش فشار، دمای ذوب یخ کاهش پیدا میکند. این موضوع با خطچین سبز در نمودار P-T شکل بالا نشان داده شده است.
نکته بسیار مهمی که باید به آن اشاره کرد این است که خط ذوب تنها در سه ماده آب، آنتیموان و بیسموت شیب منفی دارد و در باقی مواد شیب خط ذوب در نمودار P-T، مثبت است. نمودار تعادل فازی (نمودار P-T) مربوط به آب در شکل زیر نشان داده شده است.
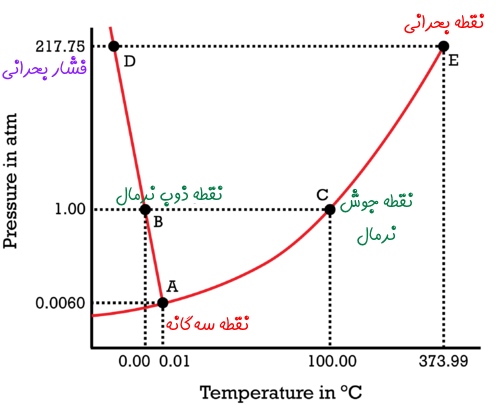
در شکل بالا، دما و فشار نقطه سه گانه، جوش و ذوب آب به خوبی نشان داده شده است. این شکل حس فیزیکی خوبی را نسبت به حالتها و دماهای مختلف در اختیار ما قرار میدهد.
در ادامه چند نکته اساسی در مواجه با نقطه سه گانه ذکر میشود.
نکته اول این است که اگر به مادهای که فشار آن کمتر از فشار نقطه سه گانه است، گرما بدهیم، از فاز جامد به گاز تبدیل میشود. این فرایند را «تصعید» (sublimation) مینامند.
نکته دومی که از نمودار P-T و با توجه به مفهوم نقطه سه گانه میتوان متوجه شد، این است که اگر در فشاری بالاتر از فشار نقطه سه گانه قرار داشته باشیم و به ماده گرما بدهیم، در صورتی که ماده در فاز جامد باشد، به مایع تبدیل میشود و در صورتی که ماده در فاز مایع باشد به گاز تبدیل میشود. همانطور که میدانید انتقال از فاز جامد به مایع را ذوب و انتقال از فاز مایع به گاز را تبخیر مینامند.
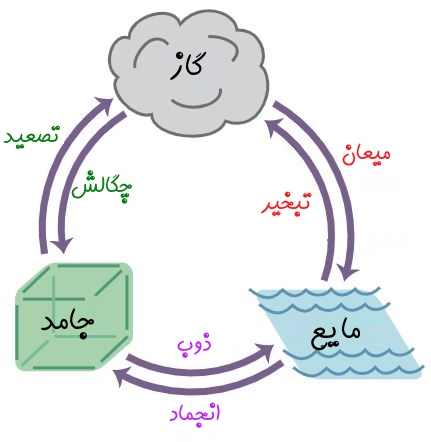
نکته سوم و چهارم مربوط به افزایش فشار در فرایندهای هم دما است. در واقع اگر یک ماده فرایند همدمایی را در دمایی پایینتر از دمای نقطه سه گانه طی کند و طی این فرایند فشارش افزایش پیدا کند، از فاز بخار به فاز جامد تبدیل میشود و اگر همان ماده فرایند همدمای خود را در دمایی بالاتر از دمای نقطه سه گانه انجام دهد و هنگام انجام این فرایند فشارش افزایش یابد، از فاز بخار به فاز به مایع تبدیل میشود.
همانطور که میدانید و در شکل بالا نیز نشان داده شده، فرایند انتقال از فاز بخار به جامد را چگالش و تبدیل فاز بخار به مایع را میعان مینامند. این دو فرایند گرمازا هستند.
مشابه نکته سه و چهار میتوان حالتی را بیان کرد که ماده فرایند هم دما را با کاهش فشار طی میکند؛ در واقع این ماده در یک فرایند هم دما منبسط میشود. در صورتی که فرایند ذکر شده در دمایی پایینتر از دمای نقطه سه گانه رخ دهد، ماده از فاز جامد به بخار تبدیل میشود و در صورتی که این فرایند در دمایی بالاتر از دمای نقطه سه گانه رخ دهد، ماده از فاز مایع به بخار تبدیل میشود.
همانطور که اشاره شد، فرایند انتقال از فاز جامد به بخار را تصعید و تبدیل فاز مایع به بخار را تبخیر مینامند. این دو فرایند گرماگیر هستند.
نکته بسیار مهم دیگری که باید به آن اشاره کرد این است که انتروپی مشخصه یک ماده در نقطه سه گانه مقداری برابر با صفر دارد.
نقطه دیگری که در نمودار تعادل فازی مشخص شده، نقطه بحرانی است. در این نقطه، دو فاز ماده قابل تمایز نیستند. نقطه بحرانی نقطه انتهای منحنی تعادل فازی (برای مثال منحنی P-T که در ابتدای این بحث نشان داده شد) را بیان میکند. این نقطه را با یک دما و یک فشار بحرانی نمایش میدهند. دمای بحرانی با نماد Tcr و فشار بحرانی با نماد Pcr نشان داده میشود. این موضوع در مطالب «نقطه بحرانی» به صورت دقیق مورد مطالعه قرار میگیرد.
در صورتی که به مباحث ارائه شده، علاقهمند هستید و قصد یادگیری در زمینههای مطرح شده در فیزیک پایه و مکانیک را دارید، آموزشهای زیر به شما پیشنهاد میشوند:
- مجموعه آموزشهای دروس مهندسی مکانیک
- مجموعه آموزشهای دروس مهندسی شیمی
- مجموعه آموزشی نرمافزارهای مهندسی مکانیک
- پیوستگی و بقای جرم در سیالات — از صفر تا صد
- آنتروپی — از صفر تا صد
- ترمودینامیک — از صفر تا صد
- نقطه بحرانی (Critical Point) در ترمودینامیک -- به زبان ساده
^^











