کروماتوگرافی اندازه طردی چیست؟ — به زبان ساده
کروماتوگرافی اندازه طردی که به نام کروماتوگرافی فیلتراسیون ژلی هم شناخته میشود، روشی برای جداکردن مولکولها از یکدیگر بر اساس اندازه متفاوت آنها است. این روش جداسازی یکی از ملایمترین انواع کروماتوگرافی است، چراکه تغییری در ساختار مولکولها ایجاد نمیکند. در ادامه توضیحاتی کاملی در خصوص این کروماتوگرافی و روشهای بهبود عملکرد آن ارائه میشود.
کروماتوگرافی اندازه طردی چیست؟
کروماتوگرافی اندازه طردی روشی آزمایشگاهی برای جداسازی مواد بر اساس اندازه آنها در محلول است بدون اینکه برهمکنش شیمیایی میان مولکولهای نمونه و سطح رزینها ایجاد شود.
در این روش مولکولهای محلول در یک سیال از ژلی یا ماده معدنی غیرقابل انعطافی متشکل از بیدهای (رزین یا ماتریکس) متخلخل با اندازه مشخص عبور میکند. مولکولهای کوچک درون حفره میروند ولی مولکولهای بزرگتر به سرعت از لابهلای بیدهای ستون خارج میشوند. در نتیجه مولکولهایی در مراحل اول، از بید خارج شدهاند، اندازه و وزن مولکولی بیشتری نسبت به سایر سایر مولکولهای محلول دارند. براساس تفاوت در زمان خروج مولکولها از ستون، آنها را از یکدیگر جدا میکنند.
برای درک بهتر مطالب نوشته شده در این مقاله بهتر است با تعریف چند اصطلاح در کروماتوگرافی آشنا شویم.
- حجم بستر (Bed Volume): به حجم کل مواد جامد و مایع درون ستون گفته میشود. در واقع مجموع «حجم خالی» (Void Volume) و حجم بیدهای داخل ستون است. به آن «حجم ستون» ( Column Volume) هم میگویند.
- حجم خالی (Void Volume): به فاز متحرک در ستون کروماتوگرافی گفته میشود.
- فاز ساکن (Stationary Phase): به ذرات درون ستون کروماتوگرافی گفته میشود که نمونه (فاز متحرک) از آن عبور میکند. در این نوع کروماتوگرافی منظور از فاز ساکن، بیدها و رزینهای متخلخل درون ستون است.
- زمان بازداری (Retention Time): مدت زمانی که نمونه در داخل ستون میماند.
کروماتوگرافی اندازه طردی چگونه کار میکند؟
بخشهای متخلخل درون ستون SEC ذرات کروی متخلخل هستند. اصطلاحا به این ذرات «بید» (Bead) یا رزین گفته میشود. این بیدها همچنین فاقد واکنشپذیری و جذب مواد هستند. برای شروع کار، ابتدا این بیدها توسط محلول بافری متعادلسازی میشوند. این محلول منافذ ماتریکس و فضای خالی بین بیدها را پر میکند.
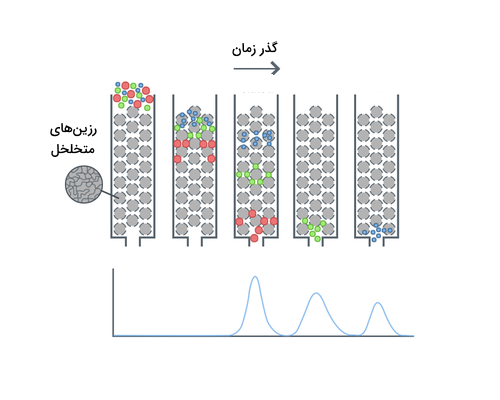
سپس نمونهای که در بافر حل شده است به داخل ستون ریخته میشود. مولکولهایی که اندازه آنها از منافذ بید بزرگتر باشد به داخل بید منتشر نمیشود و خیلی زود ستون را ترک میکنند. از طرفی مولکولهایی با اندازه کوچکتر، در منافذ بید قرار میگیرند و دیرتر از سایر مواد ستون را ترک میکنند. تصویر زیر نمایی از نحوه کار کروماتوگرافی اندازه طردی ارائه میدهد.
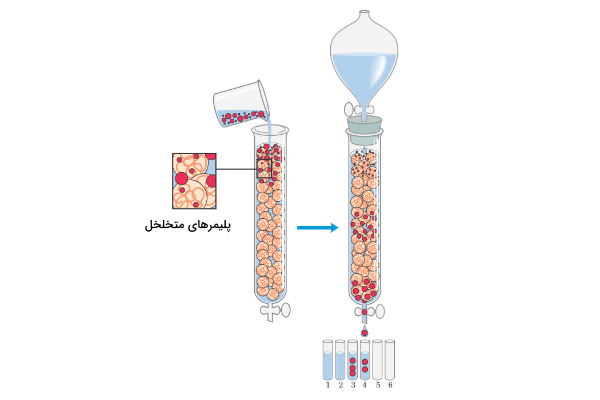
محتویات ستون کروماتوگرافی اندازه طردی چیست؟
معمولا در این نوع کروماتوگرافی از دو ماده زیر استفاده میکنند.
- شیشه یا سیلیکون متخلخل
- ژلهای آلی مثل پلیمرهای دکستران، آگارز، پلیآکریل آمید و غیره.
انتخاب نوع بیدهای درون ستون به اندازه و ویژگیهای شیمیایی نمونه بستگی دارد. برای مثال زیستژل 0-10 برای جداسازی نمونههایی با وزن مولکولی بین 5000 تا 17000 واحد استفاده میشود.
معمولا برای خارج کردن نمونه از داخل ستون از نیروی جاذبه استفاده میشود. سرعت جریان در داخل ستون با افزایش اندازه ذرات افزایش مییابد. برای ذراتی با اندازه کوچک، سرعت کمتر خواهد بود. جدول زیر نمونهای از بیدهای داخل ستون SEC را نشان میدهد.
| ماده | نام تجاری | محدوده وزن مولکولی |
| دکستران | Sephadex G-10 | 0 تا 700 |
| Sephadex G-25 | 1000 تا 5000 | |
| Sephadex G-50 | 1500 تا 30000 | |
| پلی آکریلآمید | Bio-gel P-2 | 100 تا 1800 |
| Bio-gel P-6 | 1000 تا 6000 | |
| Bio-gel P-60 | 3000 تا 60000 | |
| آگارز | Sepharose 2B | $$2times 10^{6}$$ تا $$25times 10^{6}$$ |
| Sepharose 4B | $$3times 10^{5}$$ تا $$3times 10^{6}$$ | |
| Sepharose 6B | $$ 10^{4}$$ تا $$20times 10^{6}$$ |
بیشتر رزینهایی که برای اهداف بررسی مولکولها استفاده میشود از جنس سیلیکون یا آگارز هستند. آگارز از منابع طبیعی گرفته میشود و شامل تعداد کمی از گروههای یونی و آبگریز است که میتوانند با مولکولهای نمونه برهمکنش کنند. رزینهای سیلیکون نیز گروههای «سیلانول» (Silanol) دارند که برای جلوگیری از واکنش آنها با مولکولهای نمونه، قبل از استفاده باید پوشانده شوند.
علاوه بر این، رزینهای آگارز چند بار مصرف هستند ولی رزینهای سیلیکونی نمیتوانند شستشو با NaOH را تحمل کنند. مشخصات رزینهای سیلیکونی و آگارز در جدول زیر با یکدیگر مقایسه شدهاند.
| ویژگی | رزین سیلیکون | رزین آگارز |
| ترکیب شیمیایی | $$SiO_2$$ | پلیساکارید |
| نیاز به پوشش سطحی | سیلانولها پوشانده میشوند. | نیاز ندارد. |
| مقاومت در برابر تغییرات pH | 2 تا 8 | 1 تا 12 |
| ویژگی مکانیکی | محکم، مقاوم در برابر فشار بالا | مقاومت بهدلیل وجود اتصالات عرضی بدست میآید. |
| تخلخل | قابل کنترل | قابل کنترل |
کاربرد کروماتوگرافی اندازه طردی چیست؟
به طور کلی SEC به عنوان کروماتوگرافی با «وضوح» (Resolution) کم در نظر گرفته میشود چون معمولا نمیتواند مولکولهای مشابه را از یکدیگر جدا کند. با این حال روشی خوبی برای جداسازی مولکولهایی است که با روشهایی نظیر «کروماتوگرافی تبادل یونی» (Ion Exchange Chromatography) و «کروماتوگرافی برهمکنش آبگریز» (Hydrophobic Interaction Chromatography) جدا نشدهاند. از اینرو، از این روش برای گام آخر تفکیک مولکولها از یکدیگر یا مرحله «پولیش» (Polishing) استفاده میشود.
کاربرد اصلی SEC جداسازی و بررسی پروتئینها و سایر پلیمرهای محلول در آب، «نمکزدایی» (Desalting) و همچنین «تعویض بافر» (Buffer Exchange) است. از این شیوه جداسازی برای خالصسازی شکرها، پلیپپتیدها، ویروس، پروتئین، آنزیم، هورمون، آنتیبادی، نوکلئیکاسید و غیره نیز استفاده میشود.

چه عواملی بر تفکیک نمونه در کروماتوگرافی اندازه طردی تاثیر میگذارند؟
برای تفکیک بهتر پیکهای حاصل از نمونه در کروماتوگرافی اندازه طردی باید عواملی مثل ترکیب بافر، اندازه ذرات نمونه و منافذ، طول ستون، گرانروی نمونه و حجم آن و همچنین سرعت جریان را بهینه کرد. این عوامل و نحوه اثر آنها روی تفکیک پیکها در ادامه توضیح داده میشوند.
ترکیبات بافر
ترکیبات بافر و نمونه مهمترین عواملی هستند که روی رزولوشن کروماتوگرافی تاثیر میگذارند. عواملی مانند میزان گروههای باردار و آبگریز پروتئین و همچنین سایز آن جداسازی پروتئین را تحت تاثیر قرار میدهد. بافرهایی که برای جداسازی پروتئینها استفاده میشوند معمولا pH بین 6 تا 8 دارند چون معمولا پروتئینها در این pH پایدار هستند. محلول بافری متشکل از 50 mM سدیم فسفات و 150 mM سدیم کلرید با pH معمولا به خوبی در SEC کار میکنند.
علاوه بر این، عواملی مثل قدرت یونی بافر نیز بر جداسازی پروتئینها توسط SEC اثر میگذارند. قدرت یونی بالا زمان بازداری را برای پروتئینهایی با بار مثبت کاهش و برای پروتئینهایی با بار منفی افزایش میدهد.اگر قدرت یونی خیلی بالا باشد ممکن است باعث افزایش پیوند هیدروفوب بین رزین و پروتئین شود که بر زمان بازداری، ناحیه پیک و رزولوشن تاثیر میگذارد. چند نکته در رابطه بافر در ادامه آمده است.
- از آب و مواد شیمیایی با کیفیت بالا استفاده کنید.
- محلول بافری قبل از استفاده باید از فیلتر 0٫45 μm یا 0٫22 μm عبور کند.
- گازهای موجود در محلول بافری باید قبل از استفاده خارج شوند چون حبابها میتوانند منافذ رزین را مسدود کنند.
- بافر و ستون باید دمای یکسانی داشته باشند. تغییر ناگهانی در دما برای مثال اضافه کردن بافری در دمای اتاق به ستونی که تازه از اتاق سرد بیرون آمده منجر به ایجاد حباب در رزینها شده و کیفیت کروماتوگرافی را کم میکند.
- نمونه باید شفاف و فاقد ذرات قابل دیدن باشد خصوصا زمانی که با ذراتی به اندازه 34 μm یا کوچکتر کار میکنید. برای جدا کردن ذرات بزرگ از نمونه میتوانید از فیلتر سرنگی استفاده کنید.
گرانروی نمونه
افزایش گرانروی نمونه تاثیری بر میزان رزولوشن کروماتوگرافی ندارد اما میتواند فشار پشت ستون را افزایش دهد. بهتر است که برای نمونههایی با گرانروی بالا یا دمای کم از سرعت جریان کم استفاده شود و نمونه نیز رقیق شود. برای مثال نمونه آلبومین سرم انسان معمولا نباید غلظتی بیش از 70 mg/mL داشته باشد. توجه کنید که گرانروی با تغییر دما تغییر میکند.
در جدول زیر نمونهای از محدوده سرعت جریان در ستون در دما و گرانروی متفاوت در ستون 30 با نام تجاری Superdex آورده شده است.
| دما | بافر | سرعت جریان |
| 20 تا 25 درجه سانتی گراد | آب | 1٬2 |
| 30٪ استونیتریل | 1٬2 | |
| 10٪ گلیسرول | ۰٫۶ | |
| 40٪ متانول | ۰٫۶ | |
| 20٪ اتانول | ۰٫۶ | |
| 4 تا 8 درجه سانتیگراد | آب | ۰٫۶ |
| 30٪ استونیتریل | ۰٫۶ | |
| 10٪ گلیسرول | ۰٫۳ | |
| 40٪ متانول | ۰٫۳ | |
| 20٪ اتانول | ۰٫۳ |
حجم نمونه
در کروماتوگرافی SEC حجم نمونه باید حدودا 0٫۳٪ از حجم بستر باشد تا نتیجه مطلوب حاصل شود. البته در برخی نمونهها که پیکها از هم به خوبی جدا میشوند میتوان حجم نمونه را افزایش داد.
سرعت جریان
یکی دیگر از عوامل مهمی که میتواند بر رزولوشن کروماتوگرافی تاثیر بگذارد سرعت جریان است. این مسئله در جداسازی پروتئینها بسیار اهمیت دارد. اگر نتیجه کروماتوگرافی تفکیک کمی بین پیکهای پروتئین نشان داد، اولین اقدام کاهش سرعت جریان است.
سرعت کم جریان به مولکولهای کوچک فرصت میدهد که در منافذ رزین نفوذ کنند و تفکیک بهتر انجام شود. البته کم کردن سرعت جریان در نمونههایی با مولکولهای کوچک ممکن است اثر بدتری روی تفکیک آنها بگذارد.
محاسبات در کروماتوگرافی اندازه طردی
مدت زمانی که مولکول برای عبور از ستون احتیاج دارد به اندازه هیدرودینامیک و شکل ماکرومولکولها نسبت به اندازه و شکل منافذ رزینها در فاز ساکن بستگی دارد. ماکرومولکولهای کوچک بیشتر از ماکرومولکولهای بزرگ در منافذ رزین باقی میمانند. در نتیجه، مولکولهایی با حجم هیدرودینامیک بزرگتر زودتر از مولکولهای کوچک از ستون خارج میشوند.
حجمی از سیال که مولکول موجود در آن از ستون خارج میشود را «حجم بازداری» (Retention Volume) میگویند و با $$V_{R}$$ نشان میدهند. حجم بازداری به پارامترهای فیزیکی ستون بستگی دارد. این پارامترها شامل موارد زیر هستند.
- «طول ستون» (Length)
- «حجم خالی» (Void Volume): به حجم مایع درون ستون گفته میشود و با $$V_{0}$$ نشان داده میشود.
- «حجم فاز ساکن» (Volume of Stationary Phase): با $$V_{I} $$ نشان داده میشود.
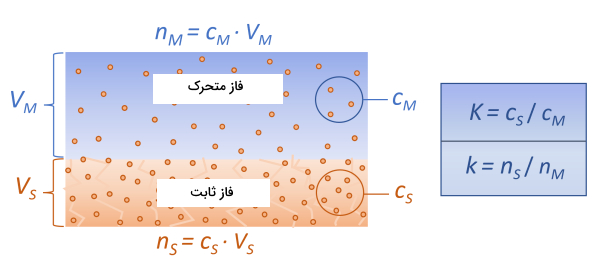
برای توضیح نحوه جداسازی هنگام حرکت ماکرومولکولها در ستون، فرض میکنیم که انتقال ماکرومولکولها بین فاز متحرک و ثابت بسیار سریع است و بلافاصله به تعادل دینامیکی میرسد. میزان غلظت در فاز ساکن ($$C_{S} $$) و فاز متحرک ($$C_{M} $$) در سراسر ستون ثابت است که به نسبت آن ضریب جداسازی میگویند و با فرمول زیر نشان میدهند.
$$K=\frac{C_{S}}{C_{M}}$$
زمانی که غلظت بسیار کم است، ضریب جداسازی مستقل از غلظت ماکرومولکولها در فاز متحرک است و فقط به اندازه منافذ بستگی دارد. در جداسازی واقعی نسبت تعداد مولکولها بین دو فاز ساکن و متحرک را «ضریب جداسازی» (Partition Ratio) یا «فاکتور بازداری» (Retention Factor) مینامند و با k نشان میدهند. در این شرایط حجم فاز ساکن و متحرک و همچنین غلظت مولکولهای آنها در جداسازی نقش داردند و از طریق فرمول زیر محاسبه میشوند.
$$k=\frac{n_{S}}{n_{M}}=\frac{V_{S}C_{S}}{V_{M}C_{M}}=Kfrac{V_{S}}{V_{M}}$$
با استفاده از ضریب جداسازی k، بخش جداسازی مولکول مورد نظر در فاز متحرک ($$X_{M}$$) به آسانی از طریق فرمول زیر بدست میآید.
$$X_{M}=\frac{n_{M}}{n_{S}+n_{M}}=\frac{V_{M}C_{M}}{V_{S}C_{S}+V_{M}C_{M}}=\frac{1}{\frac{V_{S}}{V_{M}}K+1}=\frac{1}{k+1}$$
این بخش همچنین از طریق میانگین زمانی که مولکول در هر فاز طی میکند نیز محاسبه میشود. کل میانگین زمانی که مولکول در فاز متحرک طی میکند برابر با میزان زمانی ($$t_{S}$$) است که مولکول حفظ نشده در ستون میگذراند. در حالی که میانگین زمانی که مولکول در فاز ساکن ($$t_{S}$$) میگذراند برابر با زمان بازداری ($$t_{R}$$) منهای زمان در فاز متحرک است.
$$X_{M}=\frac{t_{M}}{t_{M}+t_{S}}=\frac{t_{M}}{t_{R}}=\frac{V_{M}}{V_{R}}$$
و
$$X_{M}=\frac{t_{S}}{t_{M}+t_{S}}=1-X_{M}=\frac{t_{R}-t_{M}}{t_{M}}=\frac{V_{R}-V_{M}}{V_{R}}$$
اگر فرض کنیم که زمان بازداری ($$t_{R}$$) به طور مستقیم با حجم بازداری ($$V_{R}$$) مرتبط است، ضریب جداسازی از طریق فرمول زیر محاسبه میشود.
$$k=\frac{t_{S}}{t_{M}}=\frac{t_{R}-t_{M}}{t_{M}}=\frac{V_{R}-V_{M}}{V_{R}}$$
وقتی فرمولهای بدست آمده را با یکدیگر ترکیب کنیم، فرمول زیر را بدست میآوریم که با استفاده از آن میتوان حجم بازداری یک ماکرومولکول را پیشبینی کرد.
$$\frac{V_{S}}{V_{R}}K+frac{V_{M}}{V_{R}}=1$$
$$V_{R}=KV_{S}+V_M=KV_1+V_0=KV_T+V_0(1-K)$$
نمکزدایی و تعویض بافر با استفاده از کروماتوگرافی اندازه طردی
نمکزدایی از نمونه و تعویض بافر آن مثالی از جداسازی گروهی با استفاده از SEC هستند. هدف از این کار، جداکردن مولکولهای کوچک مانند نمکها از مولکولهای بزرگی مثل پروتئین است. مثالهایی از جداسازیهای گروهی با استفاده از SEC در ادامه ارائه شدهاند.
- حذف فنولرد از محیط کشت
- حذف نوکلئوتیدهای آزاد در محلول در توالییابی DNA
- حذف نشانههای (label) آزاد با وزن مولکولی پایین
- پایان دادن به واکنشهایی که بین واکنشدهندههایی با وزن مولکولی بالا و وزن مولکولی پایین انجام میشوند.
- حذف فراورده، کوفاکتور و مهارکننده از آنزیم
- حذف نشانههای رادیواکتیو مانند $$\left[\alpha^{-32}Pright]$$ آدنوزینتریفسفات (ATP)
نمکزدایی و تعویض بافر میتواند در شرایط زیر انجام داد.
- قبل از خالصسازی: به منظور انتقال نمونه به بافر مناسب تا مولکولهای مورد نظر به ستون اتصال پیدا کنند.
- در مراحل میانی خالصسازی: قبل از کروماتوگرافی تبادل یونی برای کاهش دادن قدرت یونی پروتئین مدنظر و اتصال آن به ستون کروماتوگرافی انجام میشود.
- بعد از خالصسازی: به منظور خنثیکردن pH آنتیبادیهای خارج شده از ستون کروماتوگرافی تمایلی یا به منظور تنظیم شرایط پروتئین خالصشده انجام میشود.
- قبل از بررسیها: به منظور حذف نمکهای اضافی از نمونه که میتوانند باعث خطهای موجدار یا نوارهای کشیده در «الکتروفورز» (Electrophoresis) شود و بازدهی «وسترنبلات» (Western Blot) را کاهش دهد.
مزایای استفاده از کروماتوگرافی اندازه طردی برای نمکزدایی چیست؟
برای نمکزدایی از محلول میتوان از دو روش دیالیز و کروماتوگرافی استفاده کرد. استفاده از کروماتوگرافی SEC برای نمکزدایی از محلول مزایای فراوانی نسبت به روش «دیالیز» (Dialysis) دارد. در روش دیالیز باید از حجم زیادی از بافر استفاده کرد که سرعت نمکزدایی را پایین میآورد. همچنین احتمال از دست رفتن نمونه در روش دیالیز وجود دارد. کروماتوگرافی SEC با توجه به مزایایی که در بخش زیر توضیح داده شده، میتواند مشکلات موجود در روش دیالیز را حل کند.
- برای نمکزدایی با استفاده از کروماتوگرافی اندازه طردی، میتوان تا 30٪ از حجم ستون را از حجم نمونه استفاده کرد. برای اینکار شرکتها ستونهای آماده ارائه میدهند که نمکزدایی را در ستونهای کوتاه ممکن میکند. در این ستونها سرعت نمکزدایی بالا میرود (معمولا کمتر از 5 دقیقه).
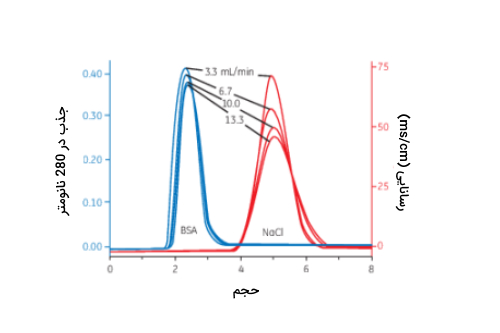
- «بازیابی» (Recovery) زیستمولکولها نیز در روش SEC معمولا بالای 95٪ است. البته نوع مولکول نمونه، نوع ستون و روش خالصسازی میتوانند در بازیابی مولکول تاثیر بگذارند. غلظت پایین مولکول مورد نظر در نمونه معمولا باعث کاهش بازیابی آن میشود. در تصویر زیر نمودار تفکیک پروتئین از نمک با روش SEC نشان داده شده است.
انتخاب رزین برای نمکزدایی یا تعویض بافر در کروماتوگرافی اندازه طردی
برای نمکزدایی و تغییر بافر معمولا از رزینهای «سفادکس» (Sephadex) استفاده میشود. این رزینها تنوع بالایی دارند و از اتصال عرضی بین دکستران و «اپیکلروهیدرین» (Epichlorohydrin) ساخته شدهاند. انواع رزینهای سفادکس و کاربرد آنها در جدول زیر مشخص شدهاند.
| رزین | اندازه منافذ (μm) | کاربرد |
| Sephadex G-10 | 40 تا 120 | جداسازی مولکولهای کوچک مانند پپتیدها از مولکولهای کوچکتر |
| Sephadex G-25 | با توجه به نوع آن بین 20 تا 300 | مناسب بیشتر جداسازیهای گروهی مانند نمکها از مولکولهایی با وزن بیش از 5000 |
| Sephadex G-50 | 20 تا 80 | مناسب جداسازی مولکولهایی با وزن بیش از 30000 از مولکولهای با وزن کمتر از 1500 |
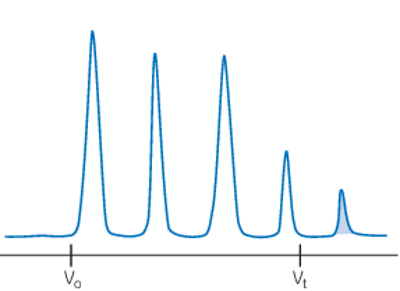
حل مشکلات پیک در کروماتوگرافی اندازه طردی
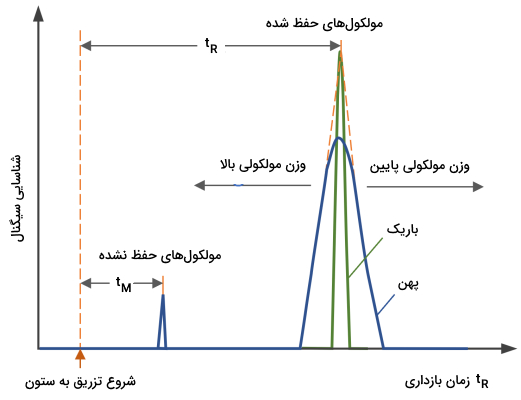
در این بخش مشکلاتی که ممکن است در تفکیک مولکولها به شیوه SEC اتفاق بیافتد را بررسی میکنیم و برای آن راه حلهایی ارائه میدهیم. تصویر زیر بهترین حالت از تفکیک مولکولها در کروماتوگرافی SEC نشان میدهد.
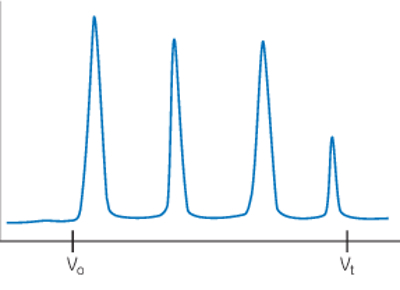
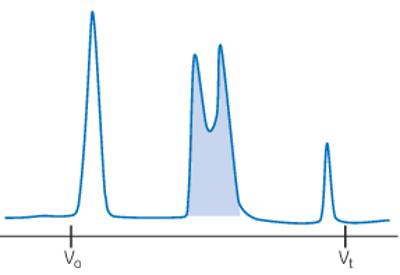
تفکیک ضعیف
تفکیک در کروماتوگرافی به جدا شدن کامل پیکهای مربوط به مولکولهای مختلف گفته میشود. هر چه پیکها به هم نزدیکتر باشند جداسازی یک مولکول خاص به صورت خالص سختتر است. عوامل مختلفی منجر به تفکیک ضعیف در کروماتوگرافی SEC میشوند. این عوامل در جدول زیر خلاصه شدهاند.
| علت احتمالی | راهحل |
| گرانروی بالای نمونه | نمونه را با بافر رقیق کنید. غلظت محلول پروتئینی را کمتر از 50 mg/ml نگه دارید. |
| نمونه حاوی ذرات | دوباره ستون را متعادلسازی کنید. نمونه را از فیلتری با قابلیت کم اتصال به پروتئین عبور دهید. |
| ستون کثیف | ستون را تمیز و متعادلسازی کنید. |
| انتخاب رزین نامناسب | از روی نمودار اختصاصیت رزینها، رزین مناسب انتخاب کنید. |
| حجم زیاد نمونه | حجم نمونه را کم کنید. |
| سرعت جریان بالا | سرعت جریان را کاهش دهید. |
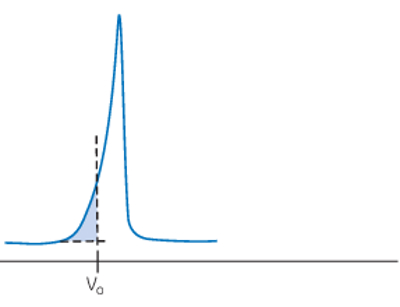
پیک دنبالهدار
پیک نامتقارن «دنبالهدار» (Tailing) زمانی ایجاد میشود که ستون تحت فشار کم یا سرعت جریان پایینی قرار گرفته باشد. برای حل این موضوع دقت کنید که ستون به طور یکنواخت فشرده شود.
پیک دنبالهدار میتواند در اثر یکنواخت اضافه نکردن نمونه به ستون یا واکنش دادن مولکولهای نمونه با ستون ایجاد شود. علت و راهحلهای پیشنهادی برای پیکهای دنبالهدار در جدول زیر خلاصه شده است.
| علت احتمالی | راهحل |
| فشار کم اعمال شده روی ستون | عملکرد ستون را بررسی کنید. دوباره با سرعت جریان بیشتر تفکیک را انجام دهید.
از ستون آماده استفاده کنید. |
| گرانروی بالای نمونه | نمونه را در بافر شروع رقیق کنید. |
| آلودگی ستون | ستون را با روشهای پیشنهاد شده تمیز کنید. |
| حجم بالا در سیستم کروماتوگرافی | لولهها و اتصالات را برای وجود حجم غیرضروری بررسی کنید. |
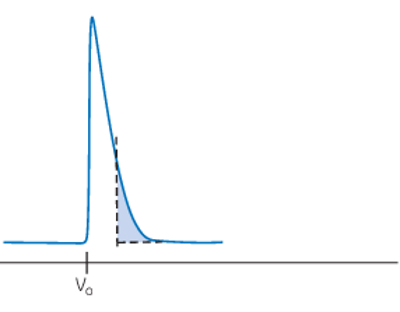
پیک جلوزده
پیکهای نامتقارن «جلوزده» (Fronting) میتواند در اثر متراکمشدن بیش از حد ستون در اثر فشار یا سرعت جریان زیاد اتفاق بیافتد. قلههایی که قبل از «حجم خالی» (Void Volume) ایجاد میشوند، نشاندهنده وجود کانال در ستون هستند. علت و راهحلهای پیشنهادی برای پیکهای جلوزده در جدول زیر خلاصه شده است.
| علت احتمالی | راهحل |
| ستون بیش از حد پر شده است. | حجم نمونه را کاهش دهید. |
| فشار بالای اعمل شده روی ستون | عملکرد ستون را بررسی کنید. دوباره با سرعت جریان کمتر تفکیک را انجام دهید.
از ستون آماده استفاده کنید. |
| وجود کانال در ستون | میزان ماده آبکی رزین را کاهش دهید. |
| آلودگی ستون | ستون را با روشهای پیشنهاد شده تمیز کنید. |
شویش دیرهنگام (Late Elution)
پیکهایی که بعد از یکبار خالی شدن حجم ستون ایجاد میشوند، نشاندهنده وجود واکنش ناخواسته مولکولهای نمونه با رزین هستند. برای حل این مشکل یک مرحله شستوشو اضافه کنید یا میزان زمان شویش را افزایش دهید تا مولکولهایی که دیر از ستون خارج میشوند هم زمان لازم برای خارج شدن داشته باشند. عوض کردن ترکیبات بافر هم میتواند به حل این مشکل کمک کند.
تاریخچه کشف و نامگذاری کروماتوگرافی اندازه طردی
مفهوم جداسازی مولکولها از یکدیگر بر اساس سایز توسط روش کروماتوگرافی، اولین بار توسط «سینج» (Synge) و «تیسلیوس» (Tiselius) مطرح شد. آنها متوجه خارج شدن مولکولهای کوچک از سوراخهای زئولیت شدند. غربال مولکولی واژهای بود که مکبین برای تعریف ویژگی زئولیت استفاده کرد. پس از آن از این کلمه برای تعریف روشی که امروزه به آن کروماتوگرافی اندازه طردی میگوییم، استفاده شد. «کروماتوگرافی اندازه طردی» (Size-exclusion Chromatography | SEC) با نامهای دیگر زیر نیز شناخته میشود.
- Liquid-exclusion Chromatography
- Exclusion Chromatography
- Gel-filtration Chromatography
- Gel-permeation Chromatography
- Steric Exclusion Chromatography

جمعبندی
کروماتوگرافی اندازه طردی روشی آزمایشگاهی برای جداسازی مولکولها براساس تفاوت در اندازه آنها است. داخل ستونهای کروماتوگرافی اندازه طردی رزینهایی متخلخل معمولا از جنس سیلیکون یا آگارز (با اندازه منافذ معین) قرار گرفتهاند.
مولکولهایی با اندازه کوچک به داخل این منافذ میروند ولی مولکولهای بزرگ بدون ورود به این منافذ از ستون خارج میشود. از تفاوت زمان خارج شدن این مولکول میتوان برای خالصسازی مولکول استفاده کرد. از این کروماتوگرافی بیشتر برای جداسازی پروتئینها از مولکولهای کوچکتر، نمکزدایی و همچنین تعویض بافر استفاده میشود.