تکنیک های مهندسی ژنتیک — مهارت های لازم برای موفقیت در رشته ژنتیک

مهندسی ژنتیک به دستکاری مصنوعی، تغییر و ترکیب مجدد DNA یا سایر مولکولهای اسید نوکلئیک به منظور اصلاح موجودات یا تغییر جمعیت موجودات گفته میشود. به طور سنتی، انسانها با کنترل تولید مثل و انتخاب نسل بعدی موجودات با ویژگیهای دلخواه، ژنومها را به طور غیرمستقیم دستکاری کردهاند. مهندسی ژنتیک شامل دستکاری مستقیم یک یا چند ژن است که در آن با استفاده از تکنیک های مهندسی ژنتیک، اغلب ژنی از گونه دیگر به ژنوم موجود زنده اضافه میشود تا فنوتیپ مورد نظر را به دست آورد.
مهندسی ژنتیک چیست و چه کاربردی دارد؟
مهندسی ژنتیک اصطلاحی است که اولین بار در دهه 1970 برای توصیف زمینه در حال ظهور فناوری DNA نوترکیب و برخی از چیزهایی که در حال وقوع بود به زبان ما وارد شد. در واقع مهندسی ژنتیک، به طور کلی، به این معنی است که پژوهشگران قطعات DNA را گرفته و آنها را با قطعات دیگر DNA ترکیب میکنند که البته این اتفاق در طبیعت رخ نمیدهد اما پژوهشگران با استفاده از تکنیک های مهندسی ژنتیک در آزمایشگاه و داخل لولههای آزمایشگاهی، کار خود را انجام میدهند. استفاده از تکنیک های مهندسی ژنتیک منجر به تولید محصولات مهم پزشکی از جمله انسولین انسانی، هورمون رشد انسانی، واکسن هپاتیت B، و همچنین رشد ارگانیسمهای اصلاح شده ژنتیکی مانند گیاهان مقاوم به بیماری شده است.
همانطور که اکثر افراد میدانند، فناوری DNA نوترکیب با چیزهای بسیار ساده، شبیه سازی قطعات بسیار کوچک DNA و رشد آنها در باکتریها شروع شد و این روزها به یک زمینه عظیم تبدیل شده است که در آن کل ژنومها میتوانند شبیه سازی شده و از سلولی به سلول دیگر با استفاده از تکنیک های مهندسی ژنتیک مختلف تغییر یافته و منتقل شوند، که سلولهای تکثیر شده در ادامه نیز همگی تغییر خواهند یافت.

تاریخچه مهندسی ژنتیک
اصطلاح مهندسی ژنتیک در ابتدا به تکنیکهای مختلفی اشاره داشت که برای اصلاح یا دستکاری موجودات زنده از طریق فرایندهای وراثت و تولید مثل استفاده میشد. به این ترتیب، این اصطلاح شامل انتخاب مصنوعی و همه مداخلات تکنیکهای پزشکی، از جمله لقاح مصنوعی، لقاح آزمایشگاهی (به عنوان مثال، نوزادان در لوله آزمایش)، شبیه سازی و دستکاری ژن است. در اواخر قرن بیستم، این اصطلاح به طور خاص به روشهای فناوری DNA نوترکیب (یا شبیه سازی ژن)، که در آن مولکولهای DNA آمده از دو یا چند منبع یا درون سلولها یا در شرایط آزمایشگاهی ترکیب شده و سپس در ارگانیسمهای میزبان که قادر به انتشار آنها هستند وارد میشوند اشاره کرد.
این امکان برای فناوری DNA نوترکیب با کشف آنزیمهای محدودکننده در سال 1968 توسط میکروبیولوژیست سوئیسی ورنر آربر پدیدار شد. سال بعد میکروبیولوژیست آمریکایی Hamilton O. Smith آنزیمهای محدود کننده نوع II را تخلیص کرد، که مشخص شد برای تکنیک های مهندسی ژنتیک به دلیل توانایی آنها برای شکافتن یک محل خاص در DNA (بر خلاف آنزیمهای محدود کننده نوع I، که DNA را در مکانهای تصادفی جدا میکنند) ضروری هستند.
با استفاده از کار اسمیت، دانیل ناتانس زیست شناس مولکولی آمریکایی در پیشبرد تکنیک نوترکیبی DNA کمک کرد و نشان داد که آنزیمهای نوع II میتوانند در مطالعات ژنتیکی مفید باشند. مهندسی ژنتیک مبتنی بر نوترکیبی در سال 1973 توسط بیوشیمیدانهای آمریکایی استنلی کوهن و هربرت بایر، کسانی که برای اولین بار DNA را به قطعاتی تقسیم کردند، دوباره قطعات مختلف را به هم پیوستند و ژنهای جدید را جهت تکثیر در باکتری E. coli وارد کردند، آغاز شد.

تکنیک های مهندسی ژنتیک
برای درک تکنیک های مهندسی ژنتیک مورد استفاده برای کار با اسیدهای نوکلئیک، به یاد داشته باشید که اسیدهای نوکلئیک ماکرومولکولهایی هستند که از نوکلئوتیدها (قند، فسفات و باز نیتروژنی) ساخته شده و با پیوندهای فسفودی استر به هم متصل شده اند. گروههای فسفات روی این مولکولها هریک دارای بار منفی خالص هستند. مجموعه کاملی از مولکولهای DNA در هسته را ژنوم مینامند. DNA دارای دو رشته مکمل است که توسط پیوندهای هیدروژنی بین بازهای مزدوج پیوند خورده است.
این دو رشته را میتوان با قرار گرفتن در معرض دمای بالا (دناتوراسیون DNA) از هم جدا و با خنک سازی مجدداً بازسازی کرد. DNA میتواند توسط آنزیم DNA پلیمراز تکثیر شود. برخلاف DNA که در هسته سلولهای یوکاریوتی قرار دارد، مولکولهای RNA از هسته خارج میشوند. رایج ترین نوع RNA که مورد تجزیه و تحلیل قرار میگیرد RNA پیام رسان (mRNA) است زیرا نشان دهنده ژنهای کد کننده پروتئین است که به طور فعال بیان میشوند. در ادامه به بررسی تکنیک های مهندسی ژنتیک میپردازیم.
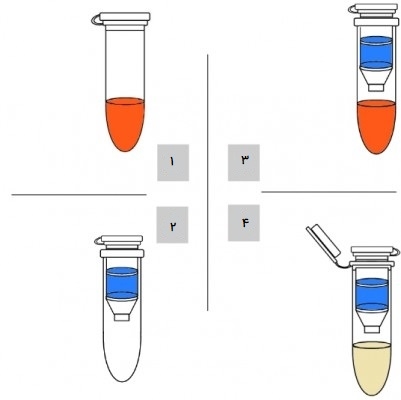
استخراج DNA و RNA
برای مطالعه یا دستکاری اسیدهای نوکلئیک، ابتدا DNA یا RNA باید جدا شده یا از سلولها استخراج شود. این را میتوان از طریق تکنیکهای مختلف انجام داد. اکثر تکنیکهای استخراج اسید نوکلئیک شامل مراحل شکستن سلول و استفاده از واکنشهای آنزیمی برای از بین بردن همه ماکرومولکولهای نامطلوب (مانند تخریب مولکولهای ناخواسته و جداسازی از نمونه DNA) است. سلولها با استفاده از بافر لیزکننده (محلولی که بیشتر حاوی مواد شوینده است) شکسته میشوند. لیز شدن به معنای شکسته شدن است. این آنزیمها در بسیاری از تکنیک های مهندسی ژنتیک مورد استفاده قرار میگیرند و مولکولهای لیپیدی را در غشای سلول و هسته از هم جدا میکنند. ماکرومولکولها با استفاده از آنزیمهایی مانند پروتئازهایی که پروتئینها را تجزیه میکنند و ریبونوکلئازها (RNase) که RNA را تجزیه میکنند، غیرفعال میشوند.
سپس DNA با استفاده از الکل رسوب میکند. DNA ژنومی انسان معمولاً به صورت یک توده سفید و ژلاتینی قابل مشاهده است. نمونهها را میتوان سالها در دمای 80- درجه سانتی گراد ذخیره کرد. تجزیه و تحلیل RNA برای مطالعه الگوهای بیان ژن در سلولها انجام میشود. RNA به طور طبیعی بسیار ناپایدار است زیرا RNA ها معمولاً در طبیعت وجود دارند و غیرفعال کردن آنها بسیار مشکل است. شبیه به DNA، استخراج RNA شامل استفاده از بافرها و آنزیمهای مختلف برای غیرفعال سازی ماکرومولکولها و حفظ RNA است.
الکتروفورز ژل
از آنجا که اسیدهای نوکلئیک در pH خنثی یا بازی در یک محیط آبی، یونهای دارای بار منفی هستند، میتوانند توسط یک میدان الکتریکی متحرک شوند. الکتروفورز ژل یکی از تکنیک های مهندسی ژنتیک است که برای جداسازی مولکولها بر اساس اندازه با استفاده از این بار یونی استفاده میشود و ممکن است به صورت کروموزوم یا قطعات کامل از هم جدا شوند. اسیدهای نوکلئیک در شکاف نزدیک الکترود منفی ماتریکس ژل متخلخل بارگذاری شده و به طرف الکترود مثبت در انتهای مخالف ژل کشیده میشوند.
مولکولهای کوچکتر سریعتر از مولکولهای بزرگتر در منافذ ژل حرکت میکنند. این تفاوت در میزان مهاجرت، قطعات را بر اساس اندازه جدا میکند. نمونههای استاندارد با وزن مولکولی مشخص وجود دارند که میتوانند در کنار مولکولها ران شوند تا مقایسه اندازه انجام شود. اسیدهای نوکلئیک در ماتریکس ژل را میتوان با استفاده از رنگهای مختلف فلورسنت یا رنگی مشاهده کرد. قطعات متمایز اسید نوکلئیک بر اساس اندازه آنها به صورت نوارهایی در فواصل خاصی از بالای ژل (انتهای الکترود منفی) ظاهر میشوند.

تکثیر قطعات اسید نوکلئیک با واکنش زنجیره ای پلیمراز (PCR)
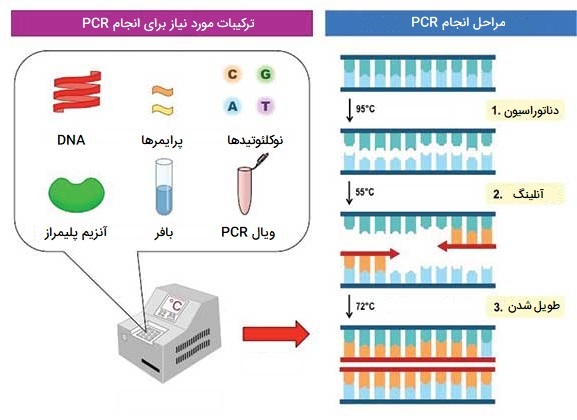
واکنش زنجیرهای پلیمراز (PCR) از تکنیک های مهندسی ژنتیک است که برای تکثیر مناطق خاصی از DNA به منظور تجزیه و تحلیل بیشتر استفاده میشود. PCR در آزمایشگاهها برای شبیه سازی قطعات ژنی جهت تجزیه و تحلیل بیماریهای ژنتیکی، شناسایی DNA خارجی آلاینده در نمونه و تکثیر DNA برای تعیین توالی استفاده میشود.
کاربردهای عملیتر شامل تعیین والدین، وراثت و تشخیص بیماریهای ژنتیکی است. در این تکنیک آغازگرها یا پرایمرها قطعات کوتاه DNA مکمل هر انتهای دنباله هدف با DNA ژنومی، Taq پلیمراز و دئوکسی نوکلئوتیدها ترکیب میشوند. فرآیند PCR شامل سه مرحله است:
- دناتوراسیون، که دو رشته نوکلئوتیدی مولکول DNA را از هم جدا میکند.
- اتصال اولیه، که در آن آغازگرها به DNA تک رشتهای متصل میشوند.
- طویل شدن، که در آن نوکلئوتیدها به آغازگرها در جهت ’5 به ’3 برای ایجاد یک کپی دو رشتهای از DNA هدف اضافه میشوند.
هر چرخه حدود چند دقیقه طول میکشد، بنابراین چرخههای تکراری میتوانند مقادیر زیادی از یک توالی DNA خاص را در چند ساعت و نه چند روز تولید کنند. با این حال، برخی از جزئیات در مورد توالی نوکلئوتیدی که باید کپی شود باید از قبل مشخص باشد، این تکنیک به مقادیر کمی از آلودگی نیز حساس است و لازم است که در شرایط استریل انجام گیرد.
انواع PCR برای رسیدن به اهدفت مختلفی وجود دارند به عنوان مثال، PCR ترانس کریپتاز معکوس (RT-PCR) مشابه PCR است، اما cDNA قبل از شروع PCR از قالب RNA ساخته میشود. در این تکنیک اولین قدم این است که با استفاده از نوکلئوتیدهای DNA روی mRNA، رشته الگوی DNA اصلی (که cDNA نامیده میشود) را دوباره تولید کنید. این فرایند رونویسی معکوس نامیده میشود و این امر مستلزم وجود آنزیمی به نام ترانس کریپتاز معکوس است. پس از ساخت cDNA، میتوان از PCR معمولی برای تکثیر آن استفاده کرد.
Real-time PCR
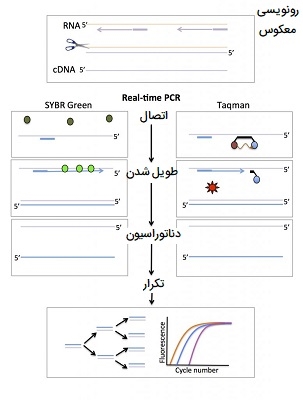
Real-time PCR به دلیل دارا بودن محدوده دینامیکی وسیع، به یکی از پرکاربردترین روشهای اندازه گیری ژن تبدیل شده است، این روش دارای حساسیت فوق العاده است، میتواند بسیار اختصاصی توالی مورد نظر باشد، پردازش پس از تکثیر تقریبا لازم ندارد و برای افزایش توان عملیاتی نمونه مناسب است. با این حال، استفاده بهینه از این مزایا مستلزم درک روشنی از بسیاری از گزینههای موجود برای اجرای آزمایش PCR در زمان واقعی است. این تکنیک برای تشخیص تغییرات کوچک در بیان ژن، حساسیت بیشتری نسبت به ریزآرایهها دارد اما به RNA ورودی بیشتری نیاز دارد. یکی از کمبودهای اصلی آن این است که توالی ژن هدف مورد نظر باید مشخص باشد، بنابراین از Real-time PCR فقط برای مطالعه ژنهای شناخته شده میتوان استفاده کرد. مراحل Real-time PCR را در ادامه توضیح داده ایم.
- اولین مرحله در واکنش PCR در زمان واقعی تبدیل RNA به DNA مکمل (cDNA) است. این فرایند به عنوان رونویسی معکوس شناخته میشود.
- در مرحله بعد از «گزارشگران فلورسنت» (Fluorescent Reporters) و واکنش PCR برای تکثیر و تشخیص ژنهای خاص استفاده میشود. معمولاً از دو نوع گزارشگر فلورسنت به نام کاوشگرهای SYBR green و Taqman استفاده میشود.
کاوشگرهای SYBR green و Taqman
SYBR green رنگی است که فقط هنگامی متصل میشود که به DNA دو رشتهای (یعنی محصول PCR) متصل باشد. کاوشگرهای Taqman از یک پروب اسید نوکلئیک مخصوص ژن ساخته شده اند که به مولکولهای «گزارشگر» (Reporter) و «خاموش کننده» (Quencher) متصل شده است. این کاوشگر بین پرایمر فوروارد و ریورس به DNA متصل میشود. در حالی که گزارشگر و خاموش کننده به پروب متصل هستند، خاموش کننده فلورسانس ساطع شده توسط گزارشگر را جذب میکند. در مرحله طویل شدن واکنش PCR، کاوشگر تخریب میشود، گزارشگر را آزاد میکند و اجازه میدهد فلورسانس آن تشخیص داده شود. مزیت روش Taqman این است که میتوان کاوشگرهایی با گزارشگرهای رنگی مختلف را در سنجشهای چندگانه ترکیب کرد.
برای هر دو روش SYBR green و Taqman، میزان فلورسانس در یک نمونه به صورت Real-time تشخیص داده میشود و بر اساس شماره چرخه ترسیم میشود. میزان فلورسانس متناسب با مقدار محصول PCR است. نقطه زمانی که فلورسانس به یک آستانه مشخص میرسد نسبت به سطح بیان ژن است. طراحی آزمایشات PCR در زمان واقعی مستلزم آگاهی از توالی ژن و در نظر گرفتن انواع کنترلها است.
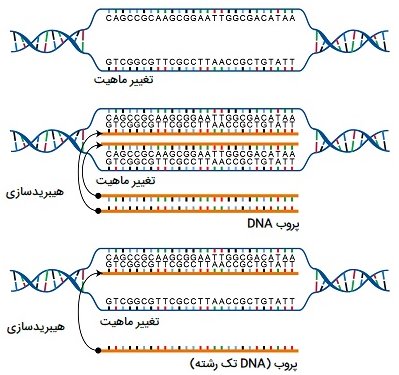
هیبرید سازی، نورترن بلاتینگ و ساترن بلاتینگ
نمونههای اسید نوکلئیک، مانند DNA ژنومیک و عصاره RNA قطعه قطعه شده، میتوانند از نظر وجود توالیهای خاص مورد بررسی قرار گیرند. قطعات کوتاه DNA به نام پروب برای کمک به تشخیص، با رنگهای رادیواکتیو یا فلورسنت طراحی و برچسب گذاری شده اند. الکتروفورز ژل قطعات اسید نوکلئیک را با توجه به اندازه آنها جدا میکند. سپس قطعات موجود در ژل بر روی غشای نایلونی در یک روش موسوم به لکه گذاری (بلاتینگ) منتقل میشوند. قطعات اسید نوکلئیک که به سطح غشا متصل شده اند را میتوان با توالیهای پروب خاص با برچسب رادیواکتیو یا فلورسنت مشخص کرد. وقتی DNA به غشای نایلونی منتقل میشود، این تکنیک را «ساترن بلاتینگ» (Southern blotting) مینامند. هنگامی که RNA به غشای نایلونی منتقل میشود، آن را «نورترن بلاتینگ» (Northern blotting) مینامند. از ساترن بلاتینگ برای تشخیص وجود برخی توالیهای DNA در یک ژنوم معین و از نورترن بلاتینگ برای تشخیص بیان ژن استفاده میشود.
در واقع از بین تکنیک های مهندسی ژنتیک از ساترن بلاتینگ برای یافتن توالی خاصی در نمونه DNA استفاده میشود. قطعات DNA بر روی یک ژل جدا شده، به غشای نایلونی منتقل شده و با یک پروب DNA مکمل توالی مورد نظر انکوبه میشوند. نورترن بلاتینگ شبیه به ساترن بلاتینگ است، اما RNA به جای DNA روی ژل ران میشود. در وسترن بلاتینگ، پروتئینها روی ژل ران میشوند و با استفاده از آنتی بادیها تشخیص داده میشوند.
کلونینگ
کلونینگ یا شبیه سازی مولکولی از تکنیک های مهندسی ژنتیک است که مناطق مورد نظر یا قطعات یک ژنوم را بازتولید میکند و امکان دستکاری و مطالعه ژنها را فراهم میآورد. به طور کلی، کلمه کلونینگ به معنی ایجاد یک ماکت کامل است. با این حال، در زیست شناسی، ایجاد دوباره یک موجود کامل را «شبیه سازی تولید مثل» (Reproductive cloning) مینامند. مدت ها قبل از تلاش برای کلون سازی کل موجود، محققان یاد گرفتند که چگونه مناطق مورد نظر یا قطعات ژنوم را تولید کنند، روشی که به آن «شبیه سازی مولکولی» (Molecular cloning) میگویند. شبیه سازی قطعات کوچک ژنوم امکان دستکاری و مطالعه ژنهای خاص (و محصولات پروتئینی آنها) یا مناطق غیر کد کننده را به صورت جداگانه فراهم میکند.
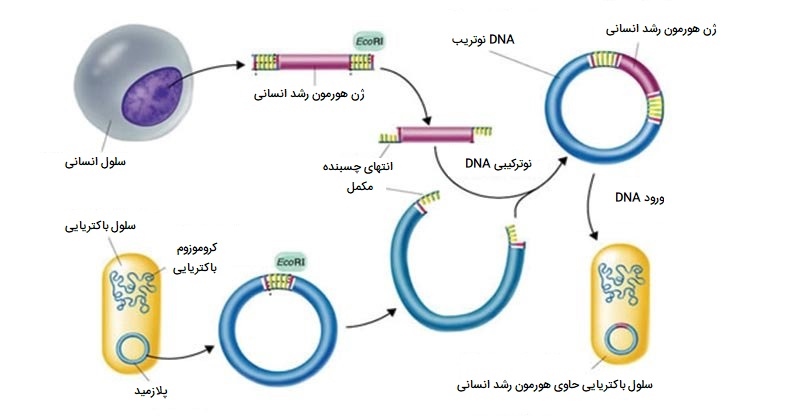
پلاسمید (که وکتور نیز نامیده میشود) یک مولکول DNA کوچک دایرهای است که مستقل از DNA کروموزومی تکثیر میشود. در کلونینگ، از مولکولهای پلاسمید میتوان برای تهیه حاملی استفاده کرد که در آن قطعه DNA مورد نظر را وارد کنید. پلاسمیدها معمولاً برای تکثیر به میزبان باکتریایی معرفی میشوند. در زمینه کلونینگ باکتریایی، قطعه DNA از ژنوم انسان (یا ژنوم ارگانیسم دیگری که در حال مطالعه است) به عنوان DNA خارجی (یا تراریخته) نامیده میشود تا از DNA باکتری میزبان متمایز شود.
پلاسمیدها به طور طبیعی در جمعیتهای باکتریایی (مانند اشریشیا کولی) ایجاد میشوند و دارای ژنهایی هستند که میتوانند صفات مطلوبی را برای ارگانیسم مانند مقاومت به آنتی بیوتیکها ایجاد کنند (توانایی تحت تأثیر قرار نگرفتن آنتی بیوتیکها). پلاسمیدها به عنوان وکتورهایی برای کلونینگ مولکولی و تولید در مقیاس بزرگ ترکیبات مهمی مانند انسولین و هورمون رشد انسانی مورد استفاده قرار گرفته و مهندسی شده اند. یکی از ویژگیهای مهم وکتورهای پلاسمیدی سهولت معرفی قطعه DNA خارجی از طریق محل شبیه سازی چندگانه (MCS) است. MCS یک توالی DNA کوتاه است که شامل چندین جایگاه است که میتوان آنها را با اندونوکلئازهای محدود کننده متداول مختلف برش داد.
اندونوکلئازهای محدود کننده توالی DNA خاص را تشخیص داده و آنها را به شیوهای قابل پیش بینی قطع میکنند. این آنزیمها به طور طبیعی توسط باکتریها به عنوان یک مکانیسم دفاعی در برابر DNA خارجی تولید میشوند. بسیاری از اندونوکلئازهای محدودکننده در دو رشته DNA بریدگی مبهمی ایجاد میکنند، به گونهای که انتهای برش دارای یک قطعه تک رشتهای 2 یا 4 نوکلئوتیدی آویزان باشد. از آنجا که این برآمدگیها میتوانند با برجستگیهای مکمل متصل شوند، به آنها «انتهای چسبنده» (Sticky Ends) میگویند. آنزیمی به نام لیگاز DNA به طور دائم از طریق پیوندهای فسفودی استر به قطعات DNA میپیوندد. به این ترتیب، هر قطعه DNA ایجاد شده توسط برش اندونوکلئاز محدود کننده را میتوان بین دو انتهای DNA پلاسمیدی که با همان اندونوکلئاز محدود کننده بریده شده است، پیوند داد.
Western - blotting
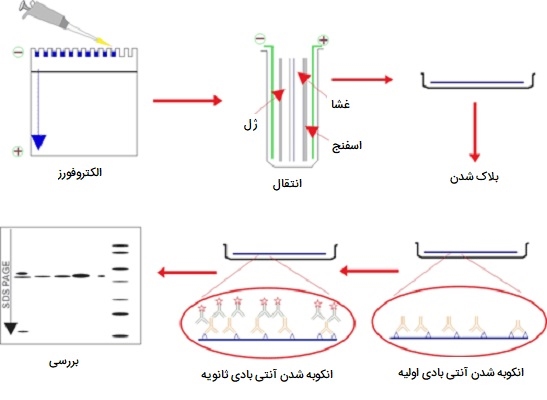
وسترن بلات یک روش آزمایشگاهی مهندسی ژنتیک است که برای تشخیص مولکولهای پروتئینی خاص از بین مخلوط پروتئینها استفاده میشود. این مخلوط میتواند شامل تمام پروتئینهای مرتبط با بافت یا نوع سلولی خاص باشد. وسترن بلات همچنین میتواند برای ارزیابی اندازه پروتئین مورد علاقه و اندازه گیری میزان بیان پروتئین مورد استفاده قرار گیرد. این روش به دلیل شباهت آن با روش ابداع شده قبلی که به عنوان ساترن بلات شناخته میشود، نامگذاری شد. اولین قدم در وسترن بلات این است که نمونه پروتئین را با مخلوط شویندهای به نام سدیم دودسیل سولفات مخلوط کنید، که باعث میشود پروتئینها در زنجیرهها و لایههای خطی منبسط شده و سپس دارای بار منفی شوند.
در مرحله بعد، مولکولهای پروتئین با توجه به اندازه آنها با استفاده از روشی به نام الکتروفورز ژل جدا میشوند. پس از جداسازی، پروتئینها از ژل به غشای لکه دار منتقل میشوند. اگرچه این مرحله همان چیزی است که بر اساس آن به این تکنیک وسترن بلات گفته میشود، اما این اصطلاح معمولاً برای توصیف کل روش استفاده میشود. پس از اتمام انتقال، غشا تمام نوارهای پروتئینی را که روی ژل قرار دارد حمل میکند. در مرحله بعد، غشا تحت تیماری به نام «بلوکه کردن» (Blocking) قرار میگيرد كه از بروز هرگونه واكنش غير اختصاصی جلوگيری میكند.
سپس غشا با یک نوع آنتی بادی به نام آنتی بادی اولیه انکوبه میشود که به طور خاص به پروتئین مورد نظر متصل میشود. پس از انکوباسیون، هر آنتی بادی اولیه بدون پیوند شسته میشود و غشا مجدداً انکوبه میشود، اما این بار با آنتی بادی ثانویه که به طور خاص آنتی بادی اولیه را تشخیص داده و به آن متصل میشود. آنتی بادی ثانویه به یک آنزیم گزارشگر که رنگ یا نور تولید می کند پیوند خورده است ، که اجازه می دهد به راحتی تشخیص داده شود و تصویربرداری شود. مراحل مربوط به این تکنیک اجازه میدهند تا پروتئین خاصی از میان مخلوطی از پروتئینها تشخیص داده شود.
SDS - page چیست؟
به جداسازی ماکرومولکولها در یک میدان الکتریکی الکتروفورز گفته میشود. یکی از تکنیک های مهندسی ژنتیک برای جداسازی پروتئینها با الکتروفورز ژل پلی اکریل آمید سدیم دودسیل سولفات (SDS - PAGE) است که در آن، از ژل پلی اکریل آمید ناپیوسته به عنوان یک محیط پشتیبانی و دودسیل سولفات سدیم (SDS) برای تغییر رنگ پروتئینها استفاده میشود. رایج ترین سیستم مورد استفاده همچنین روش Laemmli نامگذاری شده است از بریتانیا Laemmli، که اولین کسی بود که مقالهای را با استفاده از SDS - PAGE در یک مطالعه علمی منتشر کرد. SDS (که لوریل سولفات نیز نامیده میشود) یک شوینده آنیونی است، به این معنی که هنگام حل شدن، مولکولهای آن دارای بار منفی خالص در محدوده وسیعی از pH هستند.
یک زنجیره پلی پپتیدی مقادیر SDS را متناسب با جرم مولکولی زنجیره به خود متصل میکند. بارهای منفی SDS بیشتر ساختار پیچیده پروتئینها را از بین میبرد و به شدت به سمت یک آند (الکترود با بار مثبت) در یک میدان الکتریکی جذب میشود. ژلهای پلی آکریل آمید مولکولهای بزرگتر را به سرعت مولکولهای کوچکتر از حرکت باز میدارند. از آنجایی که نسبت بار به جرم در بین پلی پپتیدهای دناتور شده (تخریب شده) با SDS تقریباً یکسان است، جداسازی نهایی پروتئینها تقریباً کاملاً به تفاوت در جرم مولکولی نسبی پلی پپتیدها بستگی دارد. در یک ژل با چگالی یکنواخت، فاصله مهاجرت نسبی یک پروتئین متناسب با لگاریتم جرم آن است. جداسازی پروتئین با SDS - PAGE میتواند برای برآورد جرم مولکولی نسبی، تعیین فراوانی نسبی پروتئینهای اصلی در نمونه و تعیین توزیع پروتئینها بین ذرات استفاده شود. خلوص نمونههای پروتئینی را میتوان ارزیابی کرد و پیشرفت یک نمونه شستشو یا تخلیص را میتوان دنبال کرد.
میتوان از روشهای مختلف رنگ آمیزی برای تشخیص پروتئینهای کمیاب و یادگیری ویژگیهای بیوشیمیایی آنها استفاده کرد. از تکنیکهای تخصصیتر مانند وسترن بلات، الکتروفورز دو بعدی و نقشه برداری پپتیدی میتوان برای تشخیص محصولات ژنی بسیار کمیاب، یافتن شباهت بین آنها و تشخیص و جداسازی ایزوآنزیمهای پروتئینها استفاده کرد.

ساخت DNA نوترکیب
در تکنیک های مهندسی ژنتیک به پلاسمیدهایی که DNA خارجی در آنها وارد شده است، مولکولهای DNA نوترکیب گفته میشود زیرا به طور مصنوعی ایجاد شده اند و در طبیعت وجود ندارند. آنها همچنین مولکولهای کایمریک نامیده میشوند زیرا منشاء قسمتهای مختلف مولکولها را میتوان در گونههای مختلف موجودات بیولوژیکی یا حتی سنتز شیمیایی جستجو کرد. پروتئینهایی که از مولکولهای DNA نوترکیب بیان میشوند، پروتئینهای نوترکیب نامیده میشوند. همه پلاسمیدهای نوترکیب قادر به بیان ژن نیستند. ممکن است لازم باشد DNA نوترکیب به وکتور دیگری (یا میزبان) منتقل شود که برای بیان ژن بهتر طراحی شده است.
پلاسمیدها همچنین ممکن است برای بیان پروتئینها فقط زمانی تحریک شوند که توسط عوامل محیطی خاصی تحریک شوند تا دانشمندان بتوانند بیان پروتئینهای نوترکیب را کنترل کنند. کلونینگ امکان تقویت و بازیابی یک بخش DNA خاص از یک نمونه DNA پیچیده بزرگ مانند ژنوم را میدهد. پس از انجام این تکنیکها و تکثیر ژن مورد نظر نوبت به ساخت کتابخانه ژنی میرسد. کتابخانه ژنی مجموعه بزرگی از توالیهای DNA شبیه سازی شده از یک ژنوم است. از نظر تئوری، یک کتابخانه ژنومی حداقل یک نسخه از هر توالی ژنوم یک موجود را شامل میشود.
برای بررسی ساختار یک کروموزوم معین یا شبیه سازی ژنهای خاص، ممکن است کتابخانههایی از زیرمجموعهای از کل ژنوم (به عنوان مثال، یک کروموزوم واحد) تهیه شوند. اولین قدم این است که ژنوم را با استفاده از روشهای فیزیکی یا آنزیمهای محدودکننده، تجزیه یا قطعه قطعه کنید. سپس قطعات به وکتورهای مناسب وصل شده و در جمعیت سلول میزبان مناسب کلون میشوند. یک کتابخانه cDNA (DNA مکمل) حاوی DNA تهیه شده از mRNA موجود در جمعیت سلولی معین با استفاده از آنزیمهای ترانس کریپتاز معکوس است که DNA تک رشتهای از mRNA تولید میکند و همچنین DNA پلیمراز که DNA تک رشتهای را به DNA دو رشتهای تبدیل میکند.
cDNA حاصل نشان دهنده ژنهای بیان شده در جمعیت سلولی به عنوان زیر مجموعهای از کل ژنوم است و میتوان با استفاده از یک وکتور و سلول میزبان مناسب، آن را کلون کرد. cDNA شامل اینترون یا توالی نظارتی نخواهد بود زیرا در حین پردازش از RNA حذف میشوند. یک کتابخانه cDNA میتواند با استفاده از PCR ترانس کریپتاز معکوس (RT - PCR) نیز تهیه شود.
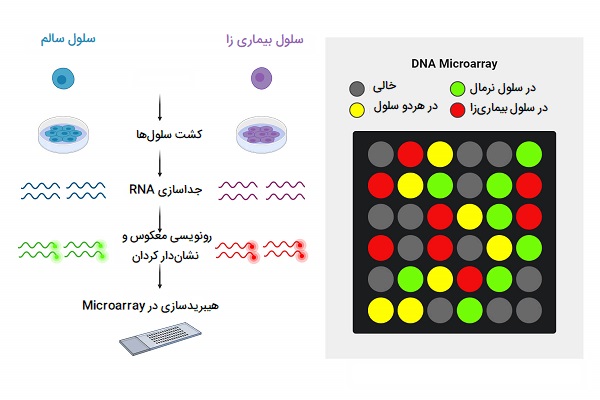
Microarrays
یکی از تکنیک های مهندسی ژنتیک «ریزآرایهها» (Microarrays) بوده که مجموعهای از پروبهای DNA هستند که معمولاً در موقعیتهای مشخص به یک سطح جامد مانند یک سطح لغزنده شیشهای متصل میشوند که قطعات DNA نمونه را میتوان هیبرید کرد. کاوشگرها عموماً الیگونوکلئوتیدهایی هستند که بر روی اسلاید (Agilent) با جوهر چاپ شده یا درجا (Affymetrix) سنتز میشوند. DNA تک رشتهای یا قطعات RNA مقابل از نمونه مورد علاقه در شرایط سختی بالا به ریزآرایه DNA هیبرید میشوند. میزان هیبریداسیون تشخیص داده شده برای یک پروب خاص متناسب با تعداد قطعات اسید نوکلئیک در نمونه است.
آرایه های یک رنگ و دو رنگ
یک ملاحظه اصلی طراحی در آزمایش ریزآرایه این است که آیا بهتر است که سطح بیان هر نمونه را در ریزآرایههای جداگانه (آرایه یک رنگ) اندازه گیری کنید یا سطوح بیان نسبی را بین یک جفت نمونه در یک ریزآرایه (آرایه دو رنگ) مقایسه کنید. عملکرد کلی آرایههای یک رنگ و دو رنگ مشابه است. در دو میکرو آرایه رنگی، دو نمونه بیولوژیکی (نمونه آزمایشی/آزمایشی و نمونه کنترل/مرجع) با رنگهای مختلف فلورسنت، معمولاً سیانین 3 (Cy3) و سیانین 5 (Cy5) برچسب گذاری شده اند. پس از این هیبریداسیون رقابتی، اندازه گیری فلورسانس به طور جداگانه برای هر رنگ انجام میشود و نشان دهنده فراوانی هر ژن در یک نمونه (نمونه آزمایشی، Cy5) نسبت به نمونه دیگر (نمونه شاهد، Cy3) است. دادههای هیبریداسیون به عنوان نسبت سیگنالهای فلورسنت Cy5/Cy3 در هر پروب گزارش شده است. در مقابل، در ریزآرایههای یک رنگ، هر نمونه برچسب گذاری شده و در یک ریزآرایه جداگانه هیبرید میشود و مقدار مطلق فلورسانس را برای هر پروب بدست میآید.
محدودیت های Microarrays
این مورد از تکنیک های مهندسی ژنتیک مبتنی بر هیبریداسیون دارای توان عملیاتی بالا و نسبتاً ارزان بوده، اما دارای چندین محدودیت است که در ادامه آنها را بیشتر بررسی میکنیم.
- تکیه بر دانش موجود در مورد توالی ژنوم
- سطح پس زمینه بالا به دلیل هیبریداسیون متقابل
- محدوده دینامیکی محدود تشخیصی به دلیل سیگنالهای پس زمینه و اشباع
- مقایسه سطوح بیان در آزمایشهای مختلف اغلب دشوار است و میتواند به روشهای پیچیده عادی سازی نیاز داشته باشد.
ان جی اس یا Next Generation Sequencing
برخلاف روشهای ریزآرایه، تکنیک های مهندسی ژنتیک مبتنی بر توالی یابی مستقیماً توالی اسید نوکلئیک یک مولکول DNA یا cDNA مشخص را تعیین میکنند. اولین تلاش عمده برای تعیین توالی DNA، پروژه ژنوم انسان بود. این پروژه که از توالی یابی نسل اول استفاده میکند، که به عنوان تعیین توالی Sanger (روش خاتمه زنجیرهای) شناخته میشود، 13 سال به طول انجامید، 3 میلیارد دلار هزینه داشت و در سال 2003 به پایان رسید. در مقایسه با توالی یابی معمولی سنگر با استفاده از الکتروفورز مویرگی، تکنیک توالی یابی موازی خوانده شده کوتاه یک رویکرد اساساً متفاوت است که در آن قابلیت توالی یابی انقلابی ایجاد کرد و روشهای توالی یابی نسل دوم یا توالی یابی نسل بعدی (NGS) که دادههای بیشتری را با هزینه مکرر کمتر ارائه میدهد را راه اندازی کرد.
انواع فناوری های NGS
توالی یابی Illumina (Solexa)، با شناسایی همزمان بازهای DNA کار میکند، زیرا هر باز یک سیگنال فلورسنت منحصر به فرد منتشر میکند و آنها را به یک زنجیره اسید نوکلئیک اضافه میکند. روش دیگر توالی یابی Roche 454 است که این روش بر اساس «توالی سنجی پیرو» (Pyrosequencing)، تکنیکی است که آزادسازی پیروفسفات را دوباره پس از آنکه نوکلئوتیدها توسط پلیمراز در رشته جدیدی از DNA ترکیب شدند با استفاده از فلورسانس تشخیص میدهد. روش بعدی یونی تورنت یا توالی یابی پروتون / PGM است که در توالی یونی تورنت آزادسازی مستقیم H+ (پروتونها) را از ترکیب بازهای جداگانه توسط DNA پلیمراز اندازه گیری میکند و بنابراین با دو روش قبلی متفاوت است زیرا نور را اندازه گیری نمیکند. در ادامه هر کدام را به طور جداگانه بررسی کرده ایم.
توالی یابی Illumina
در NGS، تعداد زیادی از خواندنهای کوتاه در یک حرکت دنبالهدار میشوند. برای انجام این کار، ابتدا نمونه ورودی باید به بخشهای کوتاه تقسیم شود. طول این بخشها بستگی به ماشینهای توالی یابی خاص مورد استفاده دارد. در توالی یابی Illumina، خواندن ۱۵۰ - ۱۰۰ جفت باز استفاده میشود. قطعات تقریباً طولانیتر به آداپتورهای عمومی متصل میشوند و با استفاده از آداپتورها روی یک اسلاید متصل میشوند. PCR برای تکثیر هر قطعه خواندنی انجام میشود و یک نقطه با تعداد زیادی نسخه از همان قطعه ایجاد میکند. سپس آنها را به صورت تک رشتهای جدا میکنند تا توالی یابی شوند.
توالی یابی Roche 454
توالی یابی Roche 454 میتواند خواندنهای بسیار طولانی تری نسبت به Illumina ترتیب دهد. مانند Illumina، این روش کار را با توالی یابی چندین قطعه خواندنی همزمان با خواندن سیگنالهای نوری و افزودن بازها انجام میدهد. همانطور که در Illumina انجام میگیرد DNA یا RNA تا 1 کیلوبایت به قطعات خواندنی کوتاهتر تقسیم میشوند. آداپتورهای عمومی به انتها اضافه میشوند و آنها روی «بیدها» (beads) به صورت یک قطعه DNA روی هر بید متصل میشوند. سپس قطعات با استفاده از آغازگرهای مشخص کننده آداپتور با PCR تکثیر میشوند. سپس هر مهره یا بید در یک چاهک منفرد قرار میگیرد. بنابراین هر چاهک دارای یک بید منفرد است که در بسیاری از نسخههای PCR از یک توالی پوشیده شده است. چاهکها همچنین حاوی DNA پلیمراز و بافرهای توالی یابی هستند.
توالی یابی جریان شدید یونی یا توالی یابی PGM
بر خلاف Illumina و Roche 454، توالی یابی جریان شدید یونی و توالی یابی یون پروتون از سیگنالهای نوری استفاده نمیکنند. در عوض، آنها از این واقعیت استفاده میکنند که افزودن dNTP به پلیمر DNA، یون H+ را آزاد میکند. مانند سایر انواع NGS، ورودی DNA یا RNA به صورت تکه تکه شده و در اینجا حدود 200 جفت باز است. آداپتورها اضافه میشوند و یک مولکول روی بید قرار میگیرد. مولکولها بر روی بید توسط PCR امولسیون تکثیر میشوند و هر بید در یک چاهک منفرد قرار میگیرد.
مزایای NGS
توالی یابی نسل بعدی (NGS) که به عنوان توالی یابی با توان بالا نیز شناخته میشود، اصطلاحی است که برای توصیف تعدادی از فناوریهای مختلف توالی یابی مدرن استفاده میشود. این فناوریها امکان توالی یابی DNA و RNA را بسیار سریعتر و ارزانتر از توالی یابی سنگر که قبلاً استفاده میشد، میدهد و به این ترتیب تحولی در مطالعه ژنومیک و زیست شناسی مولکولی ایجاد کرد. چهار مزیت اصلی NGS نسبت به توالی کلاسیک Sanger در ادامه توضیح داده شده اند.
- اندازه نمونه کمتر. NGS به طور قابل توجهی ارزانتر، سریعتر بوده و به میزان کمتری DNA نیاز دارد و از توالی یابی Sanger دقیقتر و قابل اطمینانتر است. برای تعیین توالی Sanger، مقدار زیادی DNA الگو برای هر قطعه خواندنی مورد نیاز است در حالی که در NGS، یک توالی را میتوان از یک رشته واحد بدست آورد. در هر دو نوع توالی یابی، چندین نسخه پلکانی برای ساخت و ساز و اعتبار سنجی توالی گرفته میشود.
- سرعت بالاتر. NGS از دو جهت سریعتر از توالی یابی Sanger است. در مرحله اول، واکنش شیمیایی ممکن است با تشخیص سیگنال در برخی از نسخههای NGS ترکیب شود، در حالی که در تعیین توالی Sanger این دو فرایند جداگانه هستند. در مرحله دوم و بسیار مهمتر، فقط یک خوانِش (حداکثر 1 کیلو بایت) میتوان در یک زمان در تعیین توالی Sanger گرفت، در حالی که NGS به طور گستردهای موازی است و اجازه میدهد 300 میلیون جفت باز DNA در یک اجرا روی یک تراشه واحد خوانده شود.
- هزینه کمتر. کاهش زمان، نیروی انسانی و معرفها در NGS به این معنی است که هزینهها بسیار کمتر است. اولین توالی یابی ژنوم انسان 300 میلیون پوند هزینه داشت. با استفاده از روشهای توالی یابی مدرن سنگر، با کمک دادههای توالی شناخته شده، هنوز هزینه توالی یابی ژنوم کامل انسان 6 میلیون پوند است. امروزه تعیین توالی ژنوم انسان با Illumina کمتر از 1000 پوند هزینه دارد.
- دقت بیشتر. تکرارها ذاتی NGS هستند، زیرا هر خواندن قبل از تعیین توالی تکثیر میشود و به دلیل این که بر روی بسیاری از خواندنهای کوتاه همپوشانی متکی است، بنابراین هر بخش از DNA یا RNA چندین بار توالی یابی میشود. همچنین ، به دلیل اینکه بسیار سریعتر و ارزانتر است، میتوان تکرارهای بیشتری را نسبت به توالی یابی Sanger انجام داد. تکرارهای بیشتر به معنای پوشش بیشتر است که منجر به توالی یابی دقیقتر و قابل اطمینانتری میشود، حتی اگر خواندنهای تکی برای NGS دقت کمتری داشته باشند. توالی یابی سنگر میتواند برای خواندن توالیهای بسیار طولانیتر استفاده شود. با این حال، ماهیت موازی بودن NGS به این معنی است که خواندنهای طولانیتر را میتوان از بسیاری از خواندنهای کوتاه پیوسته ایجاد کرد.

توالی یابی RNA
توالی یابی RNA یا RNA - Sequencing یکی از تکنیک های مهندسی ژنتیک و در واقع کاربرد فناوریهای توالی یابی نسل بعدی برای مولکولهای cDNA است. این امر با رونویسی معکوس از RNA به منظور بدست آوردن اطلاعات در مورد محتوای RNA نمونه به دست میآید. بنابراین، توالی یابی RNA مجموعهای از روشهای آزمایشگاهی است که مولکولهای cDNA مشتق شده از مولکولهای RNA را تولید میکند و به دنبال آن ساخت کتابخانه و تعیین توالی عمیق موازی را انجام میدهد.
کاربردهای توالی یابی RNA
توالی یابی RNA از جمله تکنیک های مهندسی ژنتیک است که آن را میتوان برای طیف وسیعی از سوالات علمی به کار برد. توالی یابی RNA تک سلولی به تازگی به عنوان راهی برای مطالعه فرآیندهای بیولوژیکی پیچیده، ناهمگونی سلولی و تنوع، به ویژه در زمینههای زیست شناسی سلولهای بنیادی و علوم عصبی مطرح شده است. در ادامه درباره کاربردهای مهم توالی یابی RNA بیشتر توضیح داده ایم.
- پروفایل بیان ژن بین نمونهها
- مطالعه رویدادهای «چسباندن جایگزین» (Alternative Splicing) یعنی گنجاندن و حذف جداگانه اگزونها در محصول RNA فرآوری شده پس از چسباندن بخش RNA پیش ساز که مرتبط با بیماریها است.
- شناسایی «بیان مخصوص آللها» (Allele-specific Expression)، چندشکلیهای تک نوکلئوتیدی مرتبط با بیماری (SNPs) و ادغام ژنها برای درک بیشتر، به عنوان مثال در انواع علل مبتنی بر جهش در سرطان.
مزایای توالی یابی RNA
توالی یابی RNA چندین مزیت نسبت به روشهای مبتنی بر هیبریداسیون ارائه میدهد که در ادامه در مورد آنها توضیح داده ایم.
- توالی یابی RNA دارای حساسیت بالاتری برای ژنهایی است که در سطح پایین یا بسیار بالا بیان میشوند و دامنه پویایی بالاتری از سطوح بیان وجود دارد که میتوان رونویسیها را بر روی آنها تشخیص داد ( محدوده بیش از 8000 برابر).
- توالی یابی RNA با اطلاعات قبلی از ژنوم ارگانیسم محدود نمیشود. علاوه بر این، میتوان آن را در گونههایی انجام داد که ژنوم آنها هنوز در دسترس نیست و توالی یابی RNA را برای ارگانیسمهای غیر مدل جذابتر میکند.
- توالی یابی RNA جزئیات بی سابقهای (با دقت تا ۱ نوکلئوتید) در مورد ویژگیهای رونویسی، مانند مناطق جدید رونویسی شده، چسباندن جایگزین و بیان اختصاصی آللها ارائه میدهد.
- سرانجام، در حالی که به خوبی شناخته شده است که ریزآرایهها دارای سوگیری هیبریداسیون متقاطع هستند، توالی یابی RNA بی طرفانه در نظر گرفته میشود. با این حال، چندین مطالعه سوگیری محتوایی گوانین - سیتوزین را در دادههای توالی یابی RNA و توالی یابی RNA مشاهده کرده اند میتواند از ابهام نقشه برداری برای سکانسهای متناقض ناشی شود.
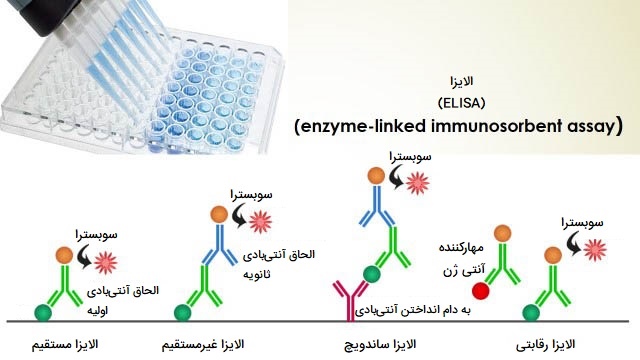
الایزا چیست؟
ELISA یا «روش ایمونوسوربنت مرتبط با آنزیم» (Enzyme-Linked Immunosorbent Assay) یکی از تکنیک های مهندسی ژنتیک و میکروبیولوژی و روشی سنجشی مبتنی بر پلیت است که برای تشخیص و تعیین مقدار مواد محلول مانند پپتیدها، پروتئینها، آنتیبادیها و هورمونها طراحی شده است. نامهای دیگری مانند آنزیم ایمونواسی (EIA) نیز برای توصیف این فناوری استفاده میشود. در ELISA، آنتی ژن (ماکرومولکول هدف) بر روی سطح جامد (میکرو پلیت) بیحرکت می شود و سپس با آنتی بادی متصل به آنزیم گزارشگر ترکیب میشود.در این روش تشخیص با اندازهگیری فعالیت آنزیم گزارشگر از طریق انکوباسیون با بستر مناسب برای تولید یک محصول قابل اندازه گیری انجام میشود.
مهمترین عنصر ELISA برهم کنش آنتی بادی و آنتی ژن است. اگرچه انواع زیادی از ELISA توسعه یافته و در شرایط مختلف مورد استفاده قرار گرفته است، اما همه آنها به عناصر اساسی یکسانی بستگی دارند که در ادامه آنها را بیان کرده ایم.
- «پوشش و جذب» (Coating/capture). به تثبیت مستقیم یا غیر مستقیم آنتی ژنها به سطح چاههای میکرو پلیت پلی استایرن گفته میشود.
- «بلاک کردن پلیت» (Plate blocking). به افزودن پروتئین بیربط یا مولکول دیگر برای پوشاندن تمام نقاط غیر اشباع اتصال سطوح چاههای میکروپلیت گفته میشود.
- «پروب سازی و ردیابی» (Probing/detection). به معنی انکوباسیون با آنتی بادیهای اختصاصی آنتی ژن که به آنتی ژنها متصل میشوند.
- «اندازه گیری سیگنال» (Signal measurement). تشخیص سیگنال تولید شده از طریق برچسب مستقیم یا ثانویه بر روی آنتی بادی خاص صورت میگیرد.
متداول ترین برچسبهای آنزیمی عبارتند از پراکسیداز ریشه خردل (HRP) و آلکالین فسفاتاز (AP). مجموعه زیادی از بسترها برای انجام ELISA با مزدوج HRP یا AP به صورت تجاری در دسترس هستند. انتخاب بستر به حساسیت سنجش مورد نیاز و ابزارهای موجود برای تشخیص سیگنال (اسپکتروفتومتر، فلورومتر یا لومینومتر) بستگی دارد.
انواع روش های الایزا
فرمتهای مختلف ELISA به صورت مستقیم، غیر مستقیم و ELISA ساندویچی هستند. گام کلیدی، تثبیت آنتی ژن موردنظر است که با جذب مستقیم به پلیت آزمایش یا به طور غیر مستقیم از طریق آنتی بادی جذب کننده که به پلیت متصل شده است، انجام میشود. سپس آنتی ژن به طور مستقیم (آنتی بادی اولیه نشان دار) یا غیرمستقیم (مانند آنتی بادی ثانویه نشان دار) شناسایی میشود. پرکاربردترین فرمت سنجش ELISA روش ساندویچ ELISA است که به طور غیرمستقیم حضور آنتی ژن مورد نظر را تثبیت کرده و غیر مستقیم تشخیص میدهد.به این نوع سنجش، سنجش ساندویچ میگویند زیرا آنالیت مورد اندازه گیری بین دو آنتی بادی اولیه متصل است و هر یک اپی توپ متفاوتی از آنتی ژن (آنتی بادی گیرنده و آنتی بادی تشخیصی) را تشخیص میدهد.
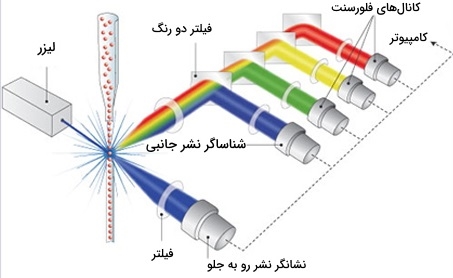
فلوسایتومتری چیست؟
فلوسایتومتری یکی از تکنیکها در آزمایشگاههای تحقیقاتی است که برای تشخیص و اندازه گیری خصوصیات فیزیکی و شیمیایی جمعیتی از سلولها یا ذرات استفاده میشود. در این فرایند، یک نمونه حاوی سلولها یا ذرات در سیال معلق شده و به دستگاه فلوسایتومتر تزریق میشود. فلوسایتومتری یک روش ثابت شده برای شناسایی سلولهای محلول را ارائه میدهد و بیشتر برای ارزیابی خون محیطی، مغز استخوان و سایر مایعات بدن استفاده میشود. مطالعات فلوسایتومتری برای شناسایی و تعیین کمیت سلولهای ایمنی و مشخص کردن بدخیمیهای خونی مورد استفاده قرار میگیرد. آنها میتوانند موارد زیر را اندازه گیری کنند:
- اندازه سلول
- دانه دار بودن سلولی
- DNA کل
- سنتز شدههای جدید
- بیان ژن DNA
- گیرندههای سطحی
- پروتئینهای داخل سلولی
- سیگنال گذرا
توانایی انجام این اندازه گیریها در بازه زمانی بسیار سریع یکی از مزایای کلیدی فرآیند فلوسایتومتری است. آنها میتوانند حداکثر سه تا شش ویژگی را تعیین کنند یا اجزاء در یک نمونه واحد، سلول به سلول، در حدود 10،000 سلول، در کمتر از یک دقیقه تعیین شوند.
روش فلوسایتومتری
در این روش سوسپانسیون سلولی در مرکز یک جریان مایع باریک و پر سرعت جریان مییابد. جریان به گونهای تنظیم شده است که بین سلولها نسبت به قطر آنها فاصله زیادی ایجاد شود. یک مکانیسم ارتعاشی جریان سلولها را مجبور میکند تا به قطرات جداگانه تبدیل شوند. سیستم به گونهای تنظیم شده است که احتمال کمی برای بیش از یک سلول در هر قطره وجود دارد. درست قبل از شکستن جریان به قطرات کوچک، جریان از یک ایستگاه اندازه گیری فلورسانس عبور میکند که در آن ویژگی فلورسنت مورد علاقه هر سلول اندازه گیری میشود. یک حلقه شارژ الکتریکی درست در نقطهای قرار میگیرد که جریان به قطرات تبدیل میشود. بر اساس اندازه گیری شدت فلوئورسانس بلافاصله یک بار بر روی حلقه قرار میگیرد و بار مخالف هنگام خروج از جریان روی قطرات به دام میافتد.
در برخی از سیستمها، بار مستقیم به جریان اعمال میشود و قطره جدا شده بار همان علامت جریان را حفظ میکند. پس از قطع شدن قطرات، جریان به حالت خنثی باز میگردد. آنتی بادی مخصوص پروتئین سطح سلولی خاص با مولکول فلورسنت همراه است و سپس به مخلوطی از سلولها اضافه میشود. مرحله بعدی فرایند فلورسانس است، در حالی که سلولهای خاصی از پرتو لیزر عبور میکنند و تحت نظارت قرار میگیرند. بر اساس اینکه آیا آنتی بادی دارای برچسب فلورسنت بر روی سلول است یا خیر، قطرات حاوی یک سلول واحد دارای بار مثبت یا منفی هستند. سپس قطرات حاوی یک سلول توسط یک میدان الکتریکی تشخیص داده میشوند و با توجه به بار آنها به لولههای جداگانه منتقل میشوند تا امکان جداسازی آسان سلولها با آنتی بادی فلورسنت مشخص شود.
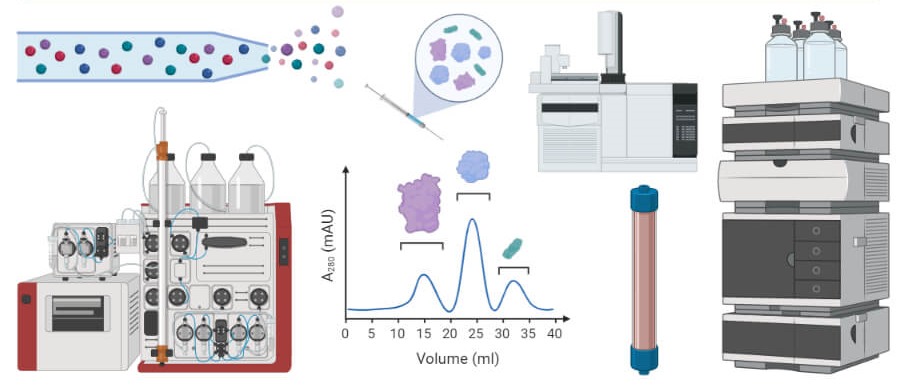
کروماتوگرافی
کروماتوگرافی یکی از تکنیک های مهندسی ژنتیک و شیمی است که برای جداسازی اجزای مخلوط به کار میرود. برای شروع فرآیند، مخلوط در مادهای به نام فاز متحرک حل میشود که آن را از طریق ماده دوم به نام فاز ساکن منتقل میکند. اجزای مختلف مخلوط با سرعتهای متفاوتی از مرحله ثابت عبور میکنند و باعث جدا شدن آنها از یکدیگر میشود. ماهیت فازهای متحرک و ثابت مشخص میکند که کدام مواد سریعتر یا کندتر حرکت میکنند و نحوه جداسازی آنها چگونه است.
این زمانهای مختلف سفر را زمان نگهداری مینامند. کروماتوگرافی نام خود را از تکنیکی که برای اولین بار در اواخر قرن 19 برای جدا کردن رنگدانهها در مخلوط پیچیده استفاده شد، گرفته است. بزرگترین مولکولهای مخلوط آهستهتر حرکت میکنند در حالی که کوچکترین آنها جلوتر حرکت میکنند و باعث میشود فاز ساکن نوارهای رنگی گسسته ای متناسب با هر جزء از مخلوط ایجاد کند.
انواع کروماتوگرافی
باید گفت که امروزه در آزمایشگاههای مدرن، جنبه جداسازی رنگها دیگر مرتبط نیست، اما اصول یکسانی اعمال میشود. با حل کردن ترکیبی از مواد مورد نظر در یک فاز متحرک و انتقال آن از طریق یک فاز ثابت، اجزای مخلوط را میتوان بر اساس سرعت متفاوت سفر از یکدیگر جدا کرد. با تغییر فاز متحرک، فاز ساکن یا عامل تعیین کننده سرعت سفر طیف گستردهای از روشهای کروماتوگرافی ایجاد شده است که هر کدام دارای اهداف متفاوتی بوده و برای مخلوطهای مختلف ایده آل هستند. برخی از رایج ترین اشکال کروماتوگرافی به شرح زیر است.
- در کروماتوگرافی گازی (GC)، مخلوط مورد نظر بخار شده و طی یک مرحله ثابت (معمولاً یک ستون جداسازی فلز یا شیشه) با یک گاز بیاثر معمولاً نیتروژن یا هلیوم منتقل میشود. مولکولهای بزرگتر در مخلوط بیشتر طول میکشد تا از ستون عبور کرده و در انتهای دور به آشکارساز برسند.
- در کروماتوگرافی مایع (LC)، مخلوط مورد نظر در یک مایع حل شده و از یک فاز ثابت جامد عبور میکند که اغلب از یک ماده سیلیس ساخته شده است. انواع مختلفی از کروماتوگرافی مایع بسته به قطبهای نسبی فازهای متحرک و ثابت (فاز عادی در مقابل فاز معکوس) و این که آیا فاز متحرک تحت فشار است (با کارایی بالا) وجود دارد.
- در کروماتوگرافی لایه نازک (TLC)، فاز ساکن یک لایه نازک از مواد جامد است که معمولاً بر پایه سیلیس است و فاز متحرک مایعی است که مخلوط مورد نظر در آن حل میشود. کروماتوگرافی لایه نازک دارای مزیت عکاسی خوب است و خروجی آن را به راحتی کمی سازی میکند.
- کروماتوگرافی تبادل یونی اجزای مخلوط را بر اساس میزان بار آنها، علاوه بر اندازه یا به جای اندازه آنها، جدا میکند. در اصل، یونهای دارای بار مثبت (کاتیون) یا منفی (آنیون) با استفاده از فازهای ثابت مختلف و فازهای متحرک pH متفاوت جدا میشوند.
کاربردهای کروماتوگرافی
کروماتوگرافی میتواند به عنوان یک ابزار تجزیه و تحلیل مورد استفاده قرار گیرد و خروجی آن را به یک آشکارساز که محتویات مخلوط را میخواند وارد کند. همچنین میتواند به عنوان یک ابزار تصفیه استفاده شود و اجزای مخلوط را برای استفاده در سایر آزمایشها یا روشها جدا کند. به طور معمول، کروماتوگرافی تحلیلی از مقدار بسیار کمتری از ماده نسبت به کروماتوگرافی برای تصفیه مخلوط یا استخراج اجزای خاصی از آن استفاده میکند. به عنوان مثال، استخراج فاز جامد نوعی کروماتوگرافی مایع است که در آن از فازهای متحرک مختلف به ترتیب برای جدا کردن اجزای مختلف مخلوطی که در فاز جامد به دام افتاده اند استفاده میشود.
به عنوان مثال، استخراج فاز جامد نوعی کروماتوگرافی مایع است که در آن از فازهای متحرک مختلف به ترتیب برای جدا کردن اجزای مختلف مخلوطی که در فاز جامد به دام افتاده اند استفاده میشود. کروماتوگرافی به عنوان یک تکنیک تصفیه نقش عمدهای در آزمایشگاههای پتروشیمی و شیمی آلی و ژنتیک دارد، که میتواند یکی از مقرون به صرفه ترین روشها برای حذف ناخالصیها از محلولهای آلی باشد، به ویژه اگر اجزای مخلوط حساس به حرارت باشند.