انواع آمینو اسید — هر آنچه باید بدانید

آمینواسیدها زیرواحدهای یکی از مهمترین پلیمرهای آلی یعنی پروتئینها هستند و در بدن تمام موجودات زنده وجود دارند. این مولکولها بر اساس نیاز بدن، نوع زنجیره جانبی و ترکیب حاصل از تجزیه آنها به انواع مختلفی تقسیم میشوند. در این مطلب علاوه بر معرفی انواع آمینو اسید ها در بدن، ساختار و نقش آنها در انسان، گیاهان و باکتریها را توضیح میدهیم.
آمینو اسید چیست ؟
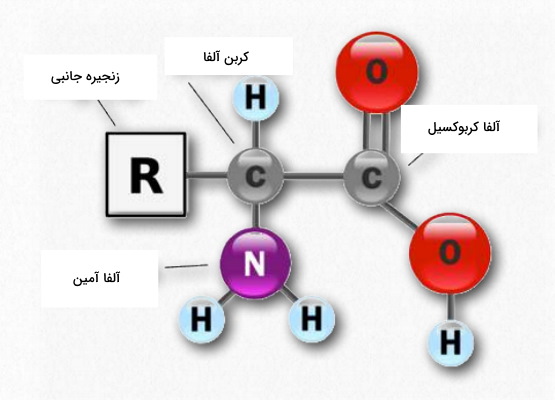
آمینو اسیدها گروهی از ترکیبات آلی هستند که در ساختار اصلی آنها از یک کربن متصل به گروه عاملی کربوکسیل و آمین، یک اتم هیدروژن و یک زنجیره جانبی تشکیل میشود. گلایسین سادهترین آلفا آمینو اسید شناخته شده با یک اتم هیدروژن در زنجیره جانبی است. بیش از ۱۰۰ نوع از این مولکول در طبیعت شناخته شده که تنها ۲۰ نوع از آنها در جانوران وجود دارند.
تفاوت L و D آمینو اسید
کربن موجود در ساختار اصلی آمینو اسیدها کایرال است. به این معنی که چهار گروه متفاوت متصل شده به این اتم، سبب میشود نور قطبیده تابیده شده به آن در دو جهت مختلف تغییر مسیر دهد. به همین دلیل این مولکولها دو ایزومر فضایی L و D دارند. ایزومرهای L نور قطبیده را خلاف جهت عقربههای ساعت (Left) و ایزمرهای D نور قطبیده را در جهت عقربههای ساعت (Right) میچرخاند. L آمینو اسید ها ایزومرهایی هستند که در ساختار پروتئين شرکت میکنند.

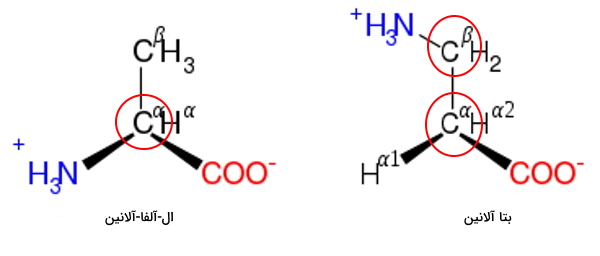
تفاوت آلفا و بتا آمینو اسید
در نامگذاری ترکیبات آلی، نزدیکترین کربن به گروه عاملی کربن آلفا نام دارد و کربنهای بعدی به ترتیب $$\beta$$، $$\gamma$$ و ... نامگذاری میشوند. در بتاآمینواسیدها برخلاف آلفا آمینواسیدها، گروههای عاملی کربونیل و آمین به یک کربن متصل نیستند. بتا آلانین تنها بتا آمینواسیدی است که در طبیعت وجود دارد اما در ساختار پروتئين و پپتید شرکت نمیکند. این آمینواسیدها معمولا برای کاربردهای صنعتی تولید میشوند. این ترکیبات پایداری ساختار دوم پپتیدهای صنعتی را افزایش میدهند.
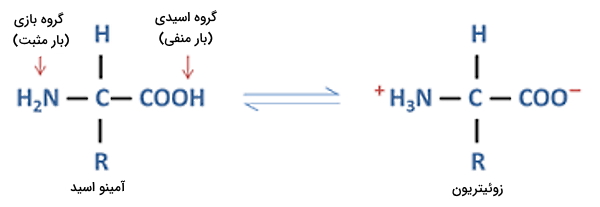
بار آمینو اسید در بدن
«زوئیتریون» (Zwitterion) گروهی از یونها هستند که در ساختار آنها دو گروه عاملی بار بار مثبت و منفی وجود دارد اما بار مجموع مولکول در آنها خنثی است. آمینواسیدها یکی از متداولترین انواع این یون هستند. در pH طبیعی بدن انسان (۷٫۴) گروه کربوکسیل این مولکولها با از دست دادن یک هیدروژن بار منفی و گروه آمین با دریافت یک هیدروژن بار مثبت دارد. به همین دلیل بار کلی آمینو اسید و پروتئینی که از آن ساخته میشود وابسته به بار زنجیره جانبی است.
انواع آمینو اسید چیست ؟
آمینواسیدها بر اساس ضرورت مصرف آنها در رژیم غذایی و انواع گروههای R متصل به ساختار اصلی، در گروههای مختلفی قرار میگیرند.
- مصرف در رژیم غذایی: آمینو اسیدهای ضروری در بدن تولید نمیشوند و باید از رژیم غذایی دریافت شوند. آمینواسیدهای غیرضروری، در بدن سنتز میشوند. بعضی بیماریها مسیرهای متابولیسمی آمینواسیدهای ضروری را مختل میکند وفرد نیاز دارد آمینواسیدهای غیرضروری را از رژیم غذایی دریافت کند.
انواع آمینو اسیدهای ضروری انواع آمینو اسید های غیرضروری هیستیدین آلانین ایزولوسین آرژینین لوسین آسپارتیکاسید متیونین سیستئین فنیل آلانین آسپارژین تروئونین گلوتامیکاسید تریپتوفان گلوتامین والین گلایسین سلنوسیستئین پرولین سرین تیروزین - گروه R یا زنجیره جانبی: آمینو اسیدها بر اساس ساختار شیمیایی زنجیره جانبی به گروههای ناقطبی، کربوکسیلیک، آمینی، آروماتیک و هیدروکسیلی تقسیمبندی میشوند.
زنجیره جانبی (R) آمینو اسید ناقطبی آلانین، گلایسین، ایزولوسین، لوسین، متیونین، پرولین و والین کربوکسیل آسپارتیکاسید و گلوتامیکاسید آمین آرژینین،هیستیدین و لیزین حلقه آروماتیک فنیل آلانین، تریپتوفان و تیروزین هیدروکسیل سرین، تروئونین و تیروزین
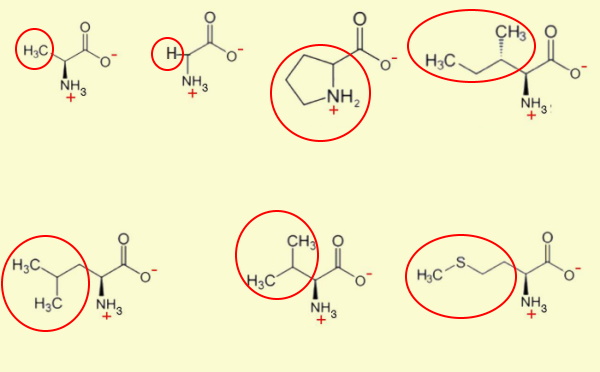
آمینو اسید ناقطبی
زنجیره جانبی این آمینواسیدها از ساختارهای ناقطبی تشکیل میشود.
- آلانین (Ala | A) یکی از فراوانترین آمینواسیدهای موجود در پروتئينها با زنجیره جانبی $$-CH_3$$ است. ایزومر D این مولکول آلی در دیواره سلولی باکتریها به کار میرود. L آلانین در بدن انسان از پیرووات (مولکول آلی سهکربنه) ساخته میشود. GCU، GCC، GCA و GCG کدهای mRNA آلانین هستند.
- گلایسین (Gly | G) سادهترین آمینو اسید با یک اتم هیدروژن در زنجیره جانبی و تنها آمینو اسید غیرکایرال است. زنجیره جانبی کوچک این مولکول سبب میشود، در محیطهای آبگریز و آبدوست فعال باشد. GGU، GGC، GGA و GGG، کدهای mRNA گلایسین هستند.
- ایزولوسین (Ile | I) آمینواسید ناقطبی با زنجیره جانبی آبگریز و کایرال ($$-CH(CH_3)CH_2CH_3$$) است که با کدهای AUU، AUC و AUA بیان میشود.
- لوسین (Leu | L) با زنجیره جانبی شاخهدار ($$-CH_2CH_3(CH_3)_2$$) و آبگریز، تنها آمینواسید ضروری است که سنتز پروتئين در ماهیچه را به طور مستقیم تحریک میکند. مسمومیت لوسین در اثر مصرف زیاد این آمینواسید ایجاد میشود و با اسهال، التهاب پوستی، زوال عقل و مرگ بیمار همراه است. UUA، UUG، CUU، CUC، CUA و CUG شش کدون این آمینواسیدها هستند.
- متیونین (Met | M) یکی از دو آمینواسید گوگردی با زنجیره جانبی آبگریز ($$-CH_2CH_2SCH_3$$) است. AUG تنها کدون این آمینو اسید است. میتونین اولین آمینواسید برای شروع تمام پروتئینهای یوکاریوتی است و میتواند سنتز پروتئين را مهار کند. متیونین شروعکننده سنتز پروتئين در پروکاریوتها، با فرمالدهید ترکیب میشود.
- پرولین (Pro | P) تنها آمینو اسیدی است که زنجیره جانبی آن با آمین ساختار اصلی، حلقه تشکیل میدهد. تشکیل حلقه، چرخش اتمها حول محور پیوند را کاهش میدهد. در نتیجه حضور این آمینو اسید در پروتئين، انعطاف و تغییرات کنفورماسیونی پروتئین را کاهش خواهد داد. حضور پرولین در توالی آمینواسیدی، تشکیل ساختارهای دوم آلفا هلیکس و بتا-شیت را مختل میکند. CCU، CCC، CCA و CCG کدونهای یا رمزههای پرولین هستند.
- والین (Val | V) از انواع آمینواسیدهای ضروری انسان است که در گیاهان تولید میشود. در بیماری گلبول قرمز داسیشکل، والین با گلوتامیکاسید جایگاه شش هموگلوبین جایگزین میشود. GUU، GUC، GUA و GUG، کدهای mRNA والین هستند.
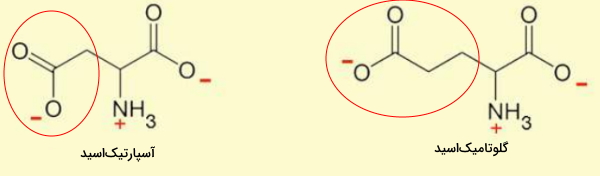
آمینو اسید های کربوکسیلسک
آسپارتیکاسید و گلوتامیکاسید، دو آمینو اسید با گروههای جانبی کربوکسیل هستند که به آنها آمینو اسیدهای اسیدی گفته میشود.
- آسپارتیکاسید (Asp | D) بدن انسان از انتقال آمین به اگزالواستات تولید میشود. ثابت تفکیک (pKa) زنجیره جانبی ($$-CH_2COOH$$) این اسید ۳٫۹ است و در pH بدن بار منفی دارد. GAU و GAC دو کدون آسپارتیکاسید هستند.
- گلوتامیکاسید (Glu | E) از انتقال آمین به آلفا-کتوگلوتارات تولید میشود. این آمینواسید در بدن نقش انتقالدهنده عصبی دارد و زنجیره جانبی ($$-CH_2CH_2COOH$$) آن مثل آسپارتیکاسید در pH بدن، بار منفی دارد.
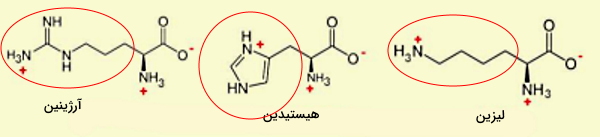
آمینو اسید آمینی
آرژینین، هیستیدین و لیزین، سه آمینو اسیدی هستند که علاوه بر آمین زنجیره اصلی، حداقل یک گروه آمینی در زنجیره جانبی آنها قرار دارد.
- آرژینین (Arg | R) یکی از آمینواسیدهایی است که در شرایط مختلف مصرف آن در رژیم غذایی ضروری است. برای مثال بدن نوزادان نارس توانایی سنتز این آمینواسید را ندارد، به علاوه در عفونتهای خونی، سوختگی نیاز به مصرف آرژینین افزایش مییابد. زنجیره جانبی آرژینین ($$-(CH_2)_3NH-C(NH)NH_2$$) از سه گروه آمینی و در pH بدن بار مثبت دارد. CGU، CGC، CGA، CGG، AGA و AGG، شش کدون آرژینین در mRNA هستند.
- هیستیدین (His/H) تنها آمینو اسیدی است که زنجیره جانبی ($$-CH_2-C_3H_3N_2$$) آن از یک حلقه ایمیدازول تشکیل شده است. ثابت تفکیک زنجیره جانبی این آمینواسید، ۶ است. به همین دلیل این آمینو اسید در جایگاه فعال بسیاری از آنزیمها قرار دارد و کاتالیزهای اسیدی و بازی را تسهیل میکند.
- لیزین (Lys | K) آمین موجود در زنجیره جانبی ($$-(CH_2)_4NH_2$$) این آمینواسید سبب بار مثبت این مولکول در pH بدن میشود. به علاوه زنجیره جانبی این آمینواسید بسیار واکنشپذیر است و بسیاری از تغییرات پس از ترجمه ازجمله اضافه شدن گروههای استیل، متیل و کربوکسیل روی آن انجام میشود. لیزین یکی از آمینو اسیدهایی است که در مرغداری به غذای حیوانات اضافه میشود.
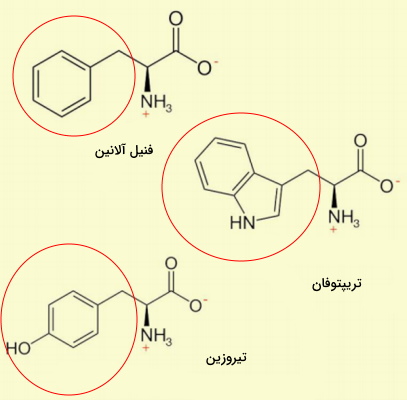
آمینو اسید های آروماتیک
حلقه آروماتیک، حلقهای پنج یا ششکربنه است که کربنهای آن با پیوند دوگانه به هم متصل هستند. زنجیره جانبی در سه آمینو اسید فنیل آلانین، تریپتوفان و تیروزین از حلقه آروماتیک تشکیل شده است.
- فنیل آلانین (Phe | F) آمینواسید ناقطبی و ضروری بدن و پیشماده مسیر سنتز تیروزین در بدن انسان است. جهش در آنزیمهای متابولیسم این آمینواسید منجر به بیماری فنیل کتونوریا میشود. UUU و UUC کدونهای فنیل آلانین هستند.
- تریپتوفان (Trp | W) یکی از انواع آمینو اسیدهایی است که در بدن انسان تولید نمیشود. این آمینو اسید پیشماده تولید هورمون سروتونین، ویتامین نیاسین و هورمون گیاهی اکسین است. زنجیره جانبی تریپتوفان از اندول (یک حلقه پنجکربنه متصل به حلقه چهارکربنه نیتروژندار) تشکیل شده میشود.
- تیروزین (Tyr | Y) یکی از مهمترین آمینو اسیدهای ساختار پروتئين است که فسفوریلاسیون آن بهوسیله آنزیمهای کینازی نقش مهمی در پیامرسانیهای سلول بر عهده دارد. به علاوه این آمینواسید پیشماده مسیرهای سنتز دوپامین و اپینفرین، هورمونهای تیروئیدی و ملانین است. هیدروکسیل متصل به حلقه آروماتیک در زنجیره جانبی، امکان ایجاد پیوند هیدروژنی با مولکولهای آب، فسفوریلاسیون و شرکت در واکنشهای اکسایش را فراهم میکند.
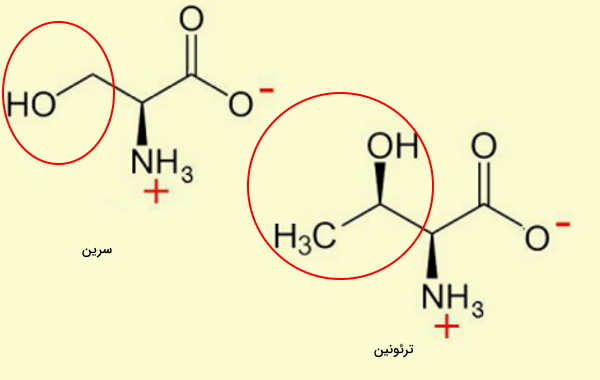
آمینو اسید های الکلی
وجود گروه هیدروکسیل (OH) در زنجیره جانبی آمینو اسیدهای الکلی سبب قطبی شدن این مولکولها میشود و تشکیل پیوند هیدروژنی و انجام واکنشهای فسفوریلاسیون را تسهیل می کند. سرین، تروئونین و تیروزین سه آمینو اسید الکلی هستند.
- سرین (Ser | S) با زنجیره جانبی ($$-CH_2OH$$) پیشماده بسیاری از ترکیبات زیستی مهم از جمله بازهای پورین و پیریمیدین، اسفنگولیپیدها و فولات و یکی از آمینواسیدهای هدف برای فسفوریلاسیونهای پس از ترجمه است. UCU، UCC، UCA، UGC، AGU و AGC کدونهای سرین هستند.
- تروئونین (Thr | T) یکی از انواع آمینو اسید است که در بدن انسان تولید نمیشود. این آمینو اسید با اتصال گروههای قندی به اتم اکسیژن زنجیره جانبی، در تشکیل گلیکوپروتئينها نقش دارد. همچنین این آمینو اسید با زنجیره جانبی $$-CH(OH)CH_3$$، پیشماده یکی از مسیرهای سنتز گلایسین در بدن است. ACU، ACC، ACA و ACG کدونهای تروئونین هستند.
آمینو اسید های متفاوت
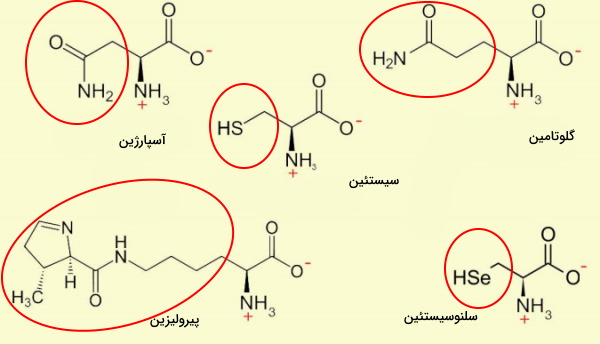
آسپارژین، گلوتامین، سیستئین، پیرولیزین و سلنوسیستئین، آمینو اسیدهایی هستند که در هیچ یک از گروههای بالا دستهبندی نمیشوند. زنجیره جانبی این آمینو اسیدها از یک پیوند آمیدی یا عناصری گوگرد و سلنیوم تشکیل شده است.
- آسپارژین (Asn | N) این آمینو اسید از اضافه شدن گروه آمین گلوتامین به اسیدآمینه آسپارتات در بدن ساخته میشود. آسپارژین به دلیل وجود کربوکسامید در زنجیره جانبی، مولکولی قطبی است. مالات حاصل از تجزیه این آمینو اسید وارد چرخه کربس میشود. AAU و AAC کدهای mRNA آسپارژین هستند.
- گلوتامین (Gln | Q) این آمینو اسید قطبی ازجمله آمینواسیدهای ضروری است اما دریافت آن از رژیم غذایی برای افرادی که تمرینهای ورزشی حرفهای و طولانیمدت انجام میدهند و افراد مبتلا به اختلالهای گوارشی لازم است. کربوکسامید زنجیره جانبی این مولکول در pH طبیعی بدن یونی نمیشود. CAA و CAG دو کدون گلوتامین هستند. این آمینو اسید از اضافه شدن آمین به گلوتامات نیز تولید میشود. گلوتامین فراوانترین آمینو اسید موجود در خون و یکی از معدود آمینواسیدی است که از سد خونیمغزی عبور میکند.
- سیستئین (Cys | C) تنها آمینو اسیدی است که در زنجیره جانبی آن گروه عاملی سولفیدریل یا تیول (SH) وجود دارد. دریافت این آمینواسید غیرضروری در رژیم غذایی نوزادان، سالمندان و افرادی که اختلالهای متابولیک دارند ضروری است. زنجیره جانبی سیستئین با ایجاد پیوند دیسولفیدی (R−S−S−R′) نقش حیاتی در تشکیل ساختارهای دوم پروتئین دارد. به علاوه سیستئین یکی از سه اسیدآمینه (به همراه گلایسین و گلوتامیکاسید) موجود در تریپپتید «گلوتاتیون» (Glutathione) است که در کبد ساخته میشود و از آسیب بافتهای بدن بهوسیله رادیکالهای آزاد جلوگیری میکند.
- پیرولیزین (Pyl | O) یکی از آمینو اسیدهای غیرمعمول است که در بدن انسان کد ژنتیکی برای آن وجود ندارد و به ندرت در تشکیل پروتئینها شرکت میکند. این آمینو اسید در آرکیباکتریهای تولیدکننده متان وجود دارد و یکی از زیرواحدهای آنزیمهای تولیدکننده متان است.
- سلنوسیستئین (Sec | U) آمینواسید موجود در پروتئینهای سلنیومی هستند که در تمام موجودات زنده وجود دارند. زنجیره جانبی سلوسیستئین شبیه به سیستئین است با این تفاوت که فلز سلنیوم جایگزین عنصر گوگرد میشود. این آمینو اسید بخشی از زنجیره پلیپپتیدی ۲۵ پروتئین انسانی ازجمله آنزیمهای گلوتاتیون پروکسیداز و تیوردوکسی ردوکتاز (آنزیم کاهنده گروه عاملی تیول) است.
آمینو اسید های غیرپروتئینی
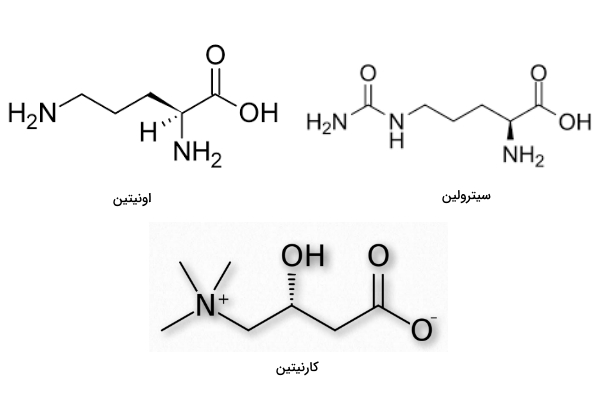
بعضی آمینواسیدها در ساختار پروتئین شرکت نمیکنند. اورنیتین و سیترولین، دو نوع متدوال آمینو اسیدهای غیرپروتئینی و از ترکیبات حد واسط در چرخه اوره هستند.
- اورنیتین: اورنیتین پیشماده سنتز آرژینین است. این اسید آمینه در بعضی از مکملهای غذایی برای کاهش ضعف ماهیچه استفاده میشود.
- سیترولین: سیترولین از تجزیه آرژینین ایجاد میشود.
- کارنیتین: یکی از آمینو اسیدهای غیر پروتئینی است که در کبد از متیونین و لیزین ساخته میشود و ایزومر L شکل فعال آن است. کارنیتین در انتقال اسیدهای چرب به میتوکندری برای اکسایش نقش دارد.
- اسید چرب موجود در سیتوپلاسم با اتصال به استیل کوآنزیم A فعال میشود.
- کارنیتین در فضای بین غشایی میتوکندری و بهوسیله آنزیم کارنیتین آسیل ترانسفراز I، جایگزین استیل کوآ خواهد شد.
- ترکیب کارنیتین-اسید چرب بهوسیله ترانسلوکاز غشای داخلی میتوکندری وارد ماتریکس میتوکندری میشود.
- در نهایت کارنیتین آسیل ترانسفراز II، کارنیتین را با استیل کوآ جایگزین میکند.
واکنش های آمینو اسیدها
مهمترین واکنش آمینو اسیدها، واکنش تراکمی بین دو اسید امینه و تشکیل پیوند پپتیدی است. این واکنش تراکمی اساس تشکیل یکی از مهمترین پلیمرهای ساختاری و عملکردی بدن یعنی پروتئينها است.
تشکیل پیوند پپتیدی
دو آمینو اسید در یک واکنش تراکمی با هم ترکیب میشوند و یک مولکول آب تولید میکنند. این واکنش بین گروه OH کربوکسیل و H آمین انجام میشود. پیوند کووالانسی ایجاد شده بین دو آمینواسید، یک پیوند آمیدی به نام پیوند پپتیدی است. این واکنش در ریبوزمهای شبکه اندوپلاسمی زبر و با مشارکت tRNA ها انجام میگیرد. فعالیت اسید و بازی گروه آمین و کربوکسیل آمینواسید با تشکیل پیوند پپیتیدی خنثی میشود و بار کلی پروتئين به نوع زنجیره جانبی آمینواسیدها بستگی دارد.
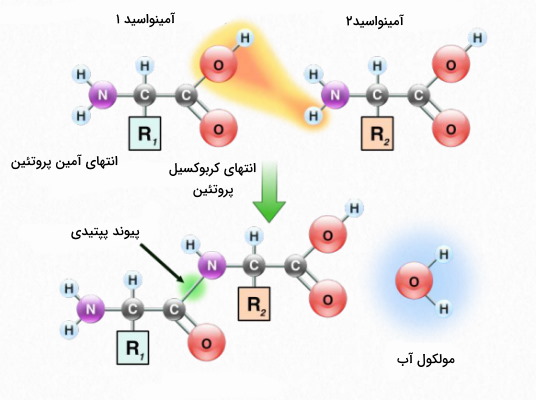
آمینو اسیدها ممکن است به شکل دوتایی (دیپپتید)، چندتایی (اولیگوپپتید | کمتر از ۵۰ آمینواسید) و چند صدتایی (پلیپپتید | بیش از ۵۰ آمینواسید) با هم پیوند دهند. پروتئينها مولکولهای زیستی هستند که از یک یا چند زنجیره پلیپپتیدی تشکیل میشوند.
اکسایش سیستئین
اکسایش برگشتناپذیر تیول موجود در زنجیره جانبی سیستئین، یکی از واکنشهای مهم در تشکیل ساختار دوم و چهارم پروتئین است. در نتیجه این واکنش، تیول موجود در زنجیره جانبی دو سیستئین کنار هم، پیوند کوالانسی به نام پیوند دیسولفیدی تشکیل میدهند. این پیوند سبب افزایش پایداری پروتئین میشود و در بسیاری از پروتئينهای ترشحی انسان وجود دارد.
$$R-SH+HS-R^primerightarrow R-S-S-R^prime+2H^++2e^-$$
سیستین، آمینواسیدی است که از دیسولفیدی بین دو سیستئين به وجود میآید. در بیماری ژنتیکی سیستینوریا، اختلال در جذب سیستین منجر به دفع زیاد این آمینواسید همراه ادرار میشود. به دلیل انحلالپذیری کم، این اسیدآمینه در مجاری اداراری، مثانه و کلیه رسوب میکند و بلورهایی تشکیل میدهد که به آنها سنگ گفته میشود. برای درمان این بیماری معمولا از پنیسلین آمین استفاده میشود. این مولکول با سیستئین کمپلکسی تشکیل میدهد که انحلالپذیری بیشتری در آب دارد و سیستئين را همراه ادرار دفع میکند.
عملکرد آمینواسیدها
آمینو اسیدها یا مولکولهای مشتق از آنها، علاوه بر شرکت در ساختار پروتئين در مسیرهای پیامرسانی سلولی شرکت میکنند. برای مثال، $$\gamma$$-بوتیریکاسید (GABA مشتق از گلوتامیکاسید)، سروتونین (مشتق از تریپتوفان) و هسیتامین (مشتق از هیستیدین) انتقالدهندههای عصبی بدن هستند. همچنین، تیروکسین (هورمون مشتق از تیروزین و ترشح شده از غده تیروئید پستاندارن)، ملاتونین (مشتق از تریپتوفان) و اندول استات اسید (مولکول مشتق از تریپتوفان در گیاهان) دو هورمون مشتق از آمینو اسید هستند.
- $$\gamma$$بوتیریکاسید (GABA): GABA یکی از انتقالدهندههای عصبی مغز است که ایجاد پتانسیل عمل در نورونها و انتقال پیام بین آنها را مهار میکند.
- سروتونین: ۵-هیدروکسی تریپتامین یا سروتونین یکی از انتقالدهندههای عصبی است که از اضافه شدن یک گروه هیدروکسیل (OH) به تریپتوفان تشکیل میشود. این انتقالدهنده عصبی در بافت روده، پلاکتهای خون و ماستسلها وجود دارد اما تجمع آن در هیپوتالاموس و بخش میانی مغز بیشتر است و تغییر غلظت آن در این نواحی با تغییرات خلق همراه است.
- ملاتونین: ملاتونین هورمونی است که از غدد کوچک موجود در بخش میانی مغز در پستانداران، پرندگان، خزندگان و دوزیستان ترشح میشود. ملاتونین به کمک گیرندههای نوری چشم، در تنظیم چرخه خواب انسان نقش دارد. رتینای چشم، شدت نور را تشخیص میدهد و پیام عصبی آن ابتدا به هیپوتالاموس و سپس به غدههای ترشحکننده ملاتونینی در مغز انتقال مییابد. شدت نور زیاد (نور روز) ترشح ملاتونین را متوقف و تاریکی (شب) ترشح آن را تحریک میکند.
- هیستامین: هیستامین ترکیبی است که با حذف گروه کربوکسیل از آمینواسید هیستیدین به وجود میآید. این ترکیب در بسیاری از جانوران، گیاهان، باکتریها و سم حشرات وجود دارد. این ترکیب تقریبا در تمام بافتهای انسانی، در وزیکولهای ستوپلاسمی ماستسلها و بازوفیلهای خون ذخیره میشود. هیستامین در سیستم ایمنی و عصبی بدن نقش دارد.
- سیستم ایمنی: یکی از ترکیبهای شیمیایی اصلی در پاسخ به آلرژی هیستامین است. ترشح این ماده در پاسخ به آلرژنها منجر به انقباض ماهیچه صاف ریه، گشاد شدن رگها و افزایش نفوذپذیری دیواره آنها، کاهش فشار خون میشود.
- سیستم عصبی: هیستامین در سیستم عصبی آزاد شدن استیل کولین، نوراپینفرین و سروتونین را تنظیم میکند.
- تیروکسین: تیروکسین ($$T4$$) یکی از دو هورمون اصلی غده تیروئید است. این هورمون مصرف اکسیژن و متابولیسم بافتهای مختلف بدن را تنظیم میکند. تیروزین از اتصال مولکول ید به آمینو اسید تیروزین (متصل به پروتئین تیروگلوبین) تولید میشود. پرکاری تیروئید (هایپرتیروئیدیزم) به افزایش تولید و ترشح این هورمون در بدن و کمکاری تیروئید (هیپوتیروئیدیزم) به کاهش ترشح آن گفته میشود.
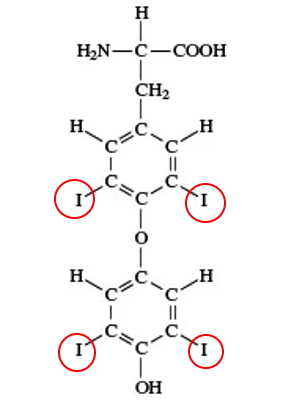
- اندول استات اسید: این ترکیب که از تغییر ساختار آمینو اسید تریپتوفان تشکیل میشود، یکی از هورمونهای گیاهی مهم از خانواده اکسینها است. این هورمون فرایندهای رشد و تکامل سلولهای گیاهی ازجمله تقسیم سلولی، رشد طولی سلول، تمایز سلول گیاهی، چیرگی راسی و پاسخ به محرکهای محیطی (نور، گرانش زمین و پاتوژنها) را تنظیم میکند.
انواع آمینو اسید های غیراستاندارد کدامند ؟
دو دسته از انواع آمینو اسید، در این گروه قرار دارند. آمینواسیدهایی که پس از ترجمه و تشکیل پروتئین با اضافه شدن گروههای عاملی یا عناصر فلزی مختلف به آنها تغییر میکنند و آمینو اسیدهایی که در ساختار پروتئین شرکت ندارند. برای مثال، پروتروموبین یکی از پروتئینهای اصلی در واکنشهای انعقاد خون است که از آمینواسید تغییرشکلیافته $$\gamma$$-کربوکسی گلوتامیکاسید تشکیل میشود. این آمینواسید تمایل زیادی برای اتصال به کلسیم دارد و لخته شدن خون را تسهیل میکند. ۴-هیدروکسی پرولین و ۵-هیدروکسی لیزین دو آمینو اسید غیراستانداری هستند که در ساختار کلاژن وجود دارند. اضافه شدن فسفات و گروههای قندی دو دسته از فرایندهای پس از ترجمه هستند که آمینواسیدها را تغییر میدهند.
اضافه شدن فسفات به آمینو اسید
فسفوریلاسون برگشتپذیر اسیدهای آمینه یکی از مهمترین تغییرات پس از ترجمه است که نقش تنظیمی در بسیاری از پروتئینهای عملکردی و متابولیسمی به خصوص آنزیمهای یوکاریوتی دارد. در این واکنش مولکول فسفات به OH موجود در زنجیره جانبی سرین، تروئونین یا تیروزین متصل میشود و با تولید مولکول آب، به آمینو اسید گروه فسفات اضافه میکند. از بین این سه آمینو اسید سرین بیشتر از همه و تیروزین کمتر از همه فسفوریله میشود.
اضافه شدن گروههای قندی به آمینو اسید
گلیکوپروتئینها از اتصال گروههای کربوهیدراتی به انواع آمینواسیدها، در تغییرات پس از ترجمه تشکیل میشوند. این گروههای قندی با اتصال به گروه O یا N زنجیره جانبی آمینواسیدها در شبکه اندوپلاسمی یا جسم گلژی، گلیکوپروتئين تشکیل میدهند.
- اتصال O: گروه قندی به اکسیژن موجود در سرین، تروئونین، هیدروکسی لیزین و هیدروکسی پرولین متصل میشود. گالاکتوز، N-استیل گلوکزآمین، فوکوز و سیالیکاسید از قندهای متداولی هستند که با اتصال O به آمینواسید اضافه میشوند. این اتصال معمولا در گلیکوپروتئینهای ترشحی وجود دارد و گلیکوپروتئینهای موسین (پروتئین اصلی مخاط) از این نوع است.
- اتصال N: در این نوع اتصال، گروههای قندی به نیتروژن موجود در آسپارژین متصل میشوند و معمولا در تغییرات پس از ترجمه پروتئینهای سیتوپلاسمی یا هسته انجام میشود. مانوز، N-استیل گالاکتوزآمین، زایلوز و فوکوز ازجمله قندهایی هستند که با اتصال N به آمینواسد اضافه میشوند.
تجزیه آمینو اسیدها در بدن انسان
انواع آمینو اسید ها یکی از منابع انرژی در افرادی که رژیم غذایی کم کربوهیدرات دارند یا در مواقع گرسنگی زیاد هستند. ترکیب حاصل از تجزیه این مولکولها وارد چرخههای تولید گلوکز (گلوکوژنیک) یا استیل کوآنزیم A (کتوژنیک) میشود. تیروزین، تریپتوفان، فنیل آلانین، ایزولوسین و تروئونین، از هر دو مسیر تجزیه میشوند.
- آمینو اسیدهای گلوکوژنیک: ترکیب حاصل از این تجزیه پیرووات یا یکی از ترکیبات چرخه کربس است.
- پیرووات: آلانین، سیستئین، گلایسین، سرین، تروئونین و تریپتوفان
- اگزالواستات: آسپارژین و آسپارتات
- فومارات: آسپارتات، فنیل آلانین و تیروزین
- سوکسینیل کوآ: ایزولوسین، متیونین، تروئونین و والین
- $$\alpha$$ کتوگلوتارات: آرژینین، گلوتامات، گلوتامین، هیستیدین و پرولین
- آمینو اسیدهای کتوژنیک: ترکیب حاصل از این تجزیه استیل کوآ یا استواستیل کوآ است که در سنتز اسیدهای چرب شرکت میکند.
- آستیل کوآ: لوسین، ایزولوسین و تریپتوفان
- استواستیل کوآ: لوسین، لیزین، فنیل آلانین، تریپتوفان و تیروزین
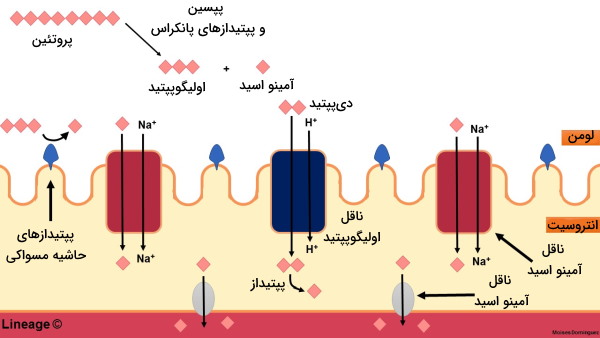
جذب آمینو اسیدها در بدن
بیشتر آمینو اسیدها در دئودئوم روده کوچک و بهوسیله همانتقالی با یون سدیم جذب میشوند. ناقل پروتئينی این مولکولها بر اساس نوع زنجیره جانبی (اسیدی، بازی، خنثی و ایمینواسید) متفاوت است. انرژی لازم برای انتقال این ماده به سیتوپلاسم سلول، بهوسیله اختلاف غلظت سدیم دو طرف غشای پلاسمایی فراهم میشود. همزمان با این ناقل، پمپ سدیم-پتاسیم-ATPآز (Na-K ATPase) برای حفظ اختلاف غلظت، یون سدیم را از سلول خارج میکند. به علاوه، ورود سدیم به سلول با ورود آب و یون کلر به مایع میانبافتی و سپس جریان خون همراه است. بخش اندکی از انواع آمینو اسیدهای موجود در رژیم غذایی به شکل دی و تریپپتید وارد سلولهای روده و در آنجا تجزیه میشوند. این مولکولها پس از ورد به سلول در دو مسیر شرکت میکنند.
- تعداد کمی از آنها ازجمله گلوتامات اکسید شده و انرژی تولید میکنند.
- بیشتر آنها وارد جریان خون و برای سنتز پروتئین به اندامهای مختلف منتقل میشوند.
مکمل آمینو اسید چیست ؟
مکملهای آمینو اسید، ترکیبی از ۹ اسیدآمینه ضروری بدن (لیزین، لوسین، تریپتوفان، هیستیدین، ایزولوسین، متیونین، فنیل آلانین، تروئونین و والین) هستند. این آمینو اسیدها از رژیم غذایی غنی از پروتئين دریافت میشوند اما در بعضی افراد ازجمله افراد تحت درمان به دلیل بیماری سرطان و ورزشکاران حرفهای پزشک مصرف مکمل تجاری آنها را توصیه میکند. آمینو اسیدهای شاخهدار (لوسین، ایزولوسین و والین | BCAAs) بیشترین کاربرد را در مکملهای افزایش حجم و قدرت انقباض ماهیچه دارند.
آنالیز آمینواسیدها
برای تعیین انواع آمینو اسید های موجود در یک پروتئین و بررسی ویژگیهای یونی و انحلالپذیری آنها روشهای متنوعی وجود دارد. یکی از روشهای متداول این آنالیز از سه مرحله تشکیل شده است.
- هیدرولیز پروتئين به زیرواحدهای آمینو اسیدی: در این مرحله به کمک اسید، پیوند پپتیدی بین آمینو اسیدها شکسته میشود. این مرحله را میتوان با استفاده از $$ HCl$$ ۶ نرمال، دمای بسیار بالا (۱۱۰ درجه سانتیگراد) و در حدود ۳ روز انجام داد.
- جداسازی آمینواسیدها: روشهای کروماتوگرافی تعویض یونی، کروماتوگرافی گازی، HPLC و الکتروفرورز مویرگی برای جداسازی آمینواسیدها از مخلوط مرحله قبل استفاده میشوند. علاوه بر این روشها میتوان از نشانگرهای فلوئورسنت ازجمله O-فتالدهید برای شناسایی و جداسازی آمینواسیدها استفاده کرد. این روش حساسیت بیشتری نسبت به روشهای قبلی دارد و مقادیر پیکومتری آمینواسید در مخلوط را شناسایی میکند.
- تعیین مقدار آمینو اسید: پس از جداسازی آمینواسیدها میتوان مقدار آنها در کل پروتئین را تعیین کرد.
انواع آمینو اسید در کشاورزی
گیاهان برای رشد و تولید ترکیبات آلی خود نیاز به عناصر نیتروژن، پتاسیم و فسفر دارند. در کشاورزی برای کمک به رشد بهتر گیاه این عناصر به شکل کودهای شیمیایی یا طبیعی به خاک اضافه میشوند. علاوه بر این عناصر معدنی، انواع آمینو اسید یکی از ترکیباتی هستند که اضافه شدن آن به خاک سبب بهبود رشد گیاهان و محصولات کشاوزی میشود. این ترکیبات در صنعت، با هیدرولیز یا تجزیه آنزیمی پروتئینهای جانوری و گیاهی تولید میشود. بر پروتئينسازی به انجام فرایندهای زیر در گیاه کمک میکند.
- کمک به فتوسنتز: رنگیزه پروتئینی کلروفیل، نقش مهمی در فتوسنتز دارد. مکملهای آمینواسیدی با افزایش تولید این پروتئین، رشد گیاه را افزایش میدهند.
- تولید هورمونهای گیاهی: هورمونهای گیاهی مولکولهای پروتئینی هستند که رشد و پاسخ به تنشهای محیطی را تنظیم میکنند. اضافه کردن آمینو اسیدها به خاک مثل افزایش تولید کلروفیل، تولید این پروتئینها را افزایش میدهد.
- بهبود فعالیت میکروبها: میکروبهای موجود در خاک اعضای اصلی چرخه کربن، نیتروژن، فسفر و گوگرد هستند. این موجودات برای رشد و تکثیر خود مانند سایر جانداران به آمینواسیدها نیاز دارند. درنتیجه اضافه کردن آمینو اسید به کشاورزی، رشد این میکروبها و عناصر موردنیاز گیاه را افزایش میدهد.
- منبع نیتروژن: میتواند از اضافه کردن آمینو اسید به خاک به جای کودهای نیتروژین استفاده کرد که منبع نیتروژن گیاه برای سنتز ترکیبات آلی هستند.
- کمک به جذب مواد غذایی: آمینو اسید، عناصر فلزی موجود در خاک را به دام میاندازد (کیلیت میکند) و از شسته شدن آن بهوسیله آب و نفوذ به سطحهای پایینی جلوگیری میکند. کلسیم یکی از عناصر است که آمینو اسیدهای خاک، جذب آن را افزایش میدهند. افزایش جذب کلسیم، تشکیل آوندها، و در نتیجه جذب آب و مواد غذایی را افزایش میدهد.
- کاهش تنشها: تولید و تجمع آمینو اسیدها در تنشهای محیطی افزایش مییابد. پرولین یکی از آمینو اسیدهایی است که تقریبا در تنشهای تمام گونههای گیاهی، تجمع آن بافتی آن افزایش مییابد.
نقش آمینو اسیدها در گیاهان
علاوه بر سنتز پروتئینها که نقش اصلی آمینو اسیدها در تمام موجودات است، آمینو اسیدهای گیاهی در فرایندهای دیگری نقش دارند.
- L-پرولین اثر تنشهای محیطی را کاهش میدهد و سرعت برگشت به رشد عادی گیاه را با تقویت دیواره سلولی افزایش میدهد.
- L-گلایسین و L-گلوتامیکاسید از پیشسازهای مهم سنتز کلروفیل هستند. این دو آمینواسید با بهدام انداختن عناصر فلزی، جذب آنها در ریشه را افزایش میدهد.
- L-متیونین پیشساز هورمون گیاهی اتیلن است، که در رسیدن میوه نقش دارد.
- L- آرژینین پیشماده هورمون سیتوکین است که رشد سلول، جوانههای جانبی و ریزش برگها را تنظیم میکند.
نقش آمینو اسیدها در فرایندهای مختلف گیاهی در جدول زیر آمده است.
| آمینو اسید | فرایند گیاهی |
| ضد تنش | پرولین، هیدروکسی پرولین |
| عامل کیلیتکننده | سیستئین، گلوتامین، گلایسین، هیستیدین، لیزین |
| مقاومت در برابر هوای سرد | آلانین، آرژینین |
| رشد گیاه، گرده افشانی | هیدروکسی پرولین، پرولین |
| تحریک رشد | گلوتامین، گلایسین |
| پیشساز اکسین | سرین، تریپتوفان، والین |
| پیشساز کلروفیل | گلوتامیکاسید |
| تقسیم سلولی | آرژینین |
| تشکیل بافت چوبی و لیگنین | فنیل آلانین |
| سنتز اتیلن | متیونین |
| جوانهزنی | آسپارژین، آرژینین |
| پیشساز هورمون | متیونین، تریپتوفان |
| مقاومت در برابر ویروسها | آلانین |
آمینو اسیدهای باکتری
باکتریها ۲۰ آمینو اسید استاندارد را میسازند. این ترکیبات علاوه بر شرکت در ساختار پروتئينها منبع کربن و نیتروژن باکتری هستند. برای مثال باکتری ایکلی در شرایط رشد هوازی از آمینو اسیدهای سرین، آسپارتات، سیستئین، گلایسین، گلوتامات و آلانین و در شرایط رشد بیهوازی از آمینو اسیدهای سرین، آسپارتات، سیستئین و آسپارژین برای منبع نیتروژن و کربن استفاده میکند. حضور سایر آمینو اسیدها در محیط کشت این باکتری، رشد آن را مهار میکند.
آمینو اسیدهای غیرمعمول باکتری
ایومز L، شکلی از آمینو اسید است که در ساختارهای پروتئينی تمام موجودات شرکت میکند. اما در باکتری علاوه بر این ایزومر، D آمینو اسیدها ساخته میشوند و نقش مهمی در استحکام و تنظیم مسیرهای سنتز پپتیدوگلایکان دیواره سلولی دارند. D-آلانین و D-گلوتامین آمینواسیدهای غیرمعمولی هستند که در ساختار پپتیدوگلایکان شرکت میکنند.
کمبود آمینو اسیدهای ضروری
بدن انسان برای تشکیل پروتئينهای ساختاری و عملکردی، انجام واکنشهای شیمیایی، انتقال مواد غذایی، جلوگیری از بیماریها و بسیاری از فعالیتهای دیگر به آمینواسیدها نیاز دارد. کمبود آمینواسیدهای ضروری منجر به کاهش ایمنی بدن، مشکلات گوارشی، افسردگی، مشکلات بارداری، کاهش هشیاری و رشد کند کودکان میشود. برای مثال هیستیدین، آمینواسیدی است که در واکنشهای بدن به هیستامین تبدیل میشود و نقش مهمی در پاسخ به آلرژنها دارد. کمبود این آمینو اسید منجر به کمخونی خواهد شد. منبع دریافت این آمینو اسیدها در رژیم غذایی پروتسينهای حیوانی ازجمله گوشت قرمز، تخممرغ و لبنیات و منبع گیاهی این ترکیبات سویا، حبوبات و آجیلها است.
سنتز آمینو اسیدها
اولین دستهبندی کاربردی در بررسی سنتز آمینو اسیدها، تقسیمبندی به انواع ضروری و غیرضروری است. چراکه مسیرهای سنتز آمینواسیدهای ضروری در بدن انسان وجود ندارد و این مولکولها بهوسیله باکتریها و گیاهان تولید میشوند. دستهبندی دوم بر اساس اولین پیشمادهای است که مسیر سنتز را شروع میکند. در لیست زیر آمینو اسیدهای ضروری با * نشان داده شدهاند.
- $$\alpha$$ کتوگلوتارات: گلوتامات، گلوتامین، پرولین و آرژینین
- ۳-فسفوگلیسرات: سرین، گلایسین و سیستئین
- اگزالواستات: آسپارتات، آسپارژین، متیونین*، تروئونین*، لیزین* و ایزولوسین*
- پیرووات: آلانین، والین* و لوسین*
- فسفوانول پیرووات یا اریتروز ۴-فسفات: تریپتوفان*، فنیل آلانین* و تیروزین
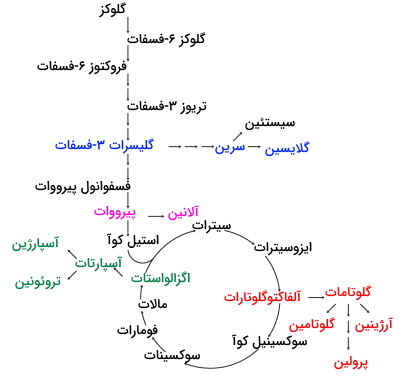
سنتز آمینو اسید از $$\alpha$$ کتوگلوتارات
گلوتامات، گلوتامین، پرولین و آرژینین آمینواسیدهای غیرضروری هستند که از ترکیبات کتونی چرخه کربس و با «انتقال گروههای آمینی» (Transamination) به وسیله آنزیمهای آمینوترانسفراز تولید میشوند. گلوتامات از اضافه شدن آمین به یک کتواسید و تولید میشود و خود پیشماده گلوتامین و پرولین است.
$$α-ketoacid + NH_4^+ ⇄ amino acid+ α-ketoglutarate$$
- گلوتامین: آنزیم گلوتامین سنتتاز با استفاده از یک مولکول ATP و یون آمونیوم ($$NH_4^+$$) گلوتامات را به گلوتامین تبدیل میکند. این آنزیم بهوسیله گلایسین، سرین، هیستیدین و تریپتوفان، AMP، CTP، کربومائیل فسفات و گلوزآمین ۶-فسفات مهار میشود.
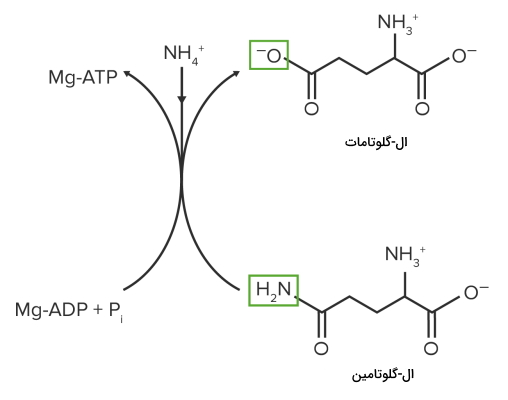
سنتز گلوتامین از گلوتامات. به تغییر گروههای عاملی توجه کنید. - پرولین: گلوتامات پس از سه مرحله واکنش به پرولین تبدیل میشود.
- اضافه شدن فسفات: در این مرحله گلوتامات بهوسیله آنزیم گلوتامات-۵-کیناز و گلوتامات-۵-سمیآلدهید دهیدروژناز و با مصرف یک مولکول ATP و NADH به گلوتامات-۵-سمیآلدهید تبدیل میشود.
- اکسایش و جدا شدن فسفات: در این مرحله از حلقوی شدن خودبهخودی گلوتامات-۵-سمیآلدهید، ۱-پیرولین-۵-کربوکسیلیکاسید تولید میشود.
- کاهش: در مرحله آخر این مسیر، پرولین-۵-کربوکسیلات ردوکتاز، ترکیب حلقوی مرحله قبل را با مصرف یک مولکول NADH به پرولین تبدیل میکند.
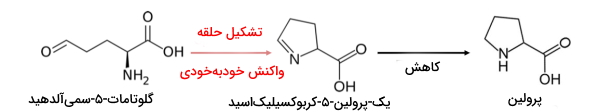
مراحل سنتز پرولین
- آرژینین: آرژینین از چهار مسیر برگشتپذیر در بدن انسان سنتز میشود.
- آرژینینوسوکسینات محصول حدواسط واکنش سیترولین و آسپارتات با مصرف ATP است. این ترکیب با از دست دادن بخش سوکسینات به آرژینین تبدیل میشود.
- جدا شدن متیل ترکیب «دیمتیل آرژینین نامتقارن» (Asymmetric Dimethylarginine | ADMA)
- واکنش اورنیتین و اوره که منجر به تولید آرژینین و آب میشود.
- واکنش سیترولین با نیتریکاکسید و آب که با مصرف یک مولکول $$NADP^+$$ آرژینین تولید میکند.
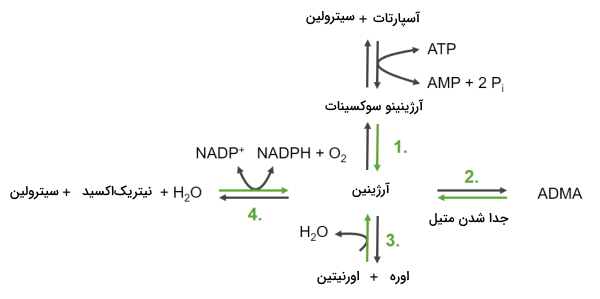
سنتز آمینو اسید از ۳-فسفوگلیسرات
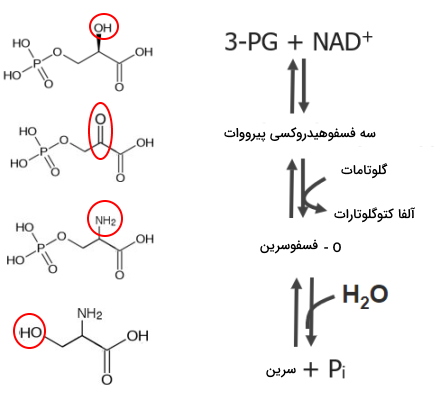
سه آمینو اسید غیرضروری بدن از ۳-فسفوگلیسرات تولید میشوند. سرین اولین آمینواسید تولید شده از این ترکیب است که در سنتز گلایسین و سیستئین نقش دارد.
- سرین: سرین در یک مسیر سهمرحلهای تولید میشود.
- اکسایش ۳-فسفوگلیسرات: در این مرحله سرین بهوسیله آنزیم فسفوگلیسرات دهیدروژناز به ۳-فسفوهیدروکسی پیرووات تبدیل میشود. غلظت سرین، عامل محدودکننده این آنزیم است.
- اضافه شدن آمین به ۳-فسفوهیدروکسی پیرووات: فسفوسرین ترانسآمیناز در این مرحله ۳-فسفوهیدروکسی پیرووات را به O-فسفوسرین تبدیل میکند.
- هیدرولیز O-فسفوسرین: در این مرحله فسفوسرین فسفاتاز با جدا کردن گروه عاملی فسفات را از O-فسفوسرین سرین را تولید میکند.
- گلایسین: برای تشکیل گلایسین، سرین هیدروکسی متیل ترانسفراز در واکنشی با حضور تتراهیدروفولات، یک گروه هیدروکسی متیل از سرین جدا میکند.
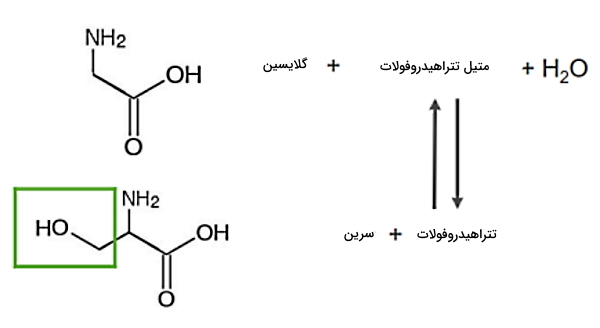
- سیستئین: سیستئین از ترکیب سرین و هموسیستئین و در دو مرحله تشکیل میشود.
- آنزیم سیستاتیونین بتاسنتتاز با تشکیل یک مولکول آب، هموسیستئین و سرین را ترکیب و سیستاتیونین تولید میکند.
- با فعالیت آنزیم گاما لیاز و مصرف آب، سیستئین و آلفا کتوگلوتارات از سیستاتیونین به وجود میآید.
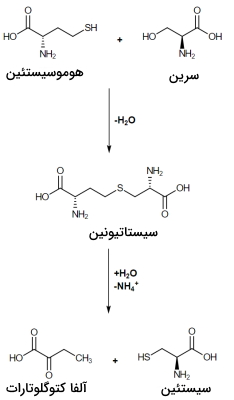
سنتز آمینو اسید از اگزالواستات
اگزالواستات یکی از ترکیبات چرخه کربس و پیشماده تعدادی از آمینواسیدهای ضروری و غیرضروری است. آسپارتات و آسپارژین تنها انواع آمینو اسید های غیرضروری هستند که در بدن انسان از این ترکیب ساخته میشوند.
- آسپارتات: آنزیمهای آمینوترانسفراز با انتقال گروه آمین از آمینواسیدهای دیگر به اگزالواستات، در تشکیل آسپارتات شرکت میکند.
- آسپارژین: این آمینو اسید با انتقال آمین و بهوسیله آنزیم آسپارژین سنتتاز از آسپارتات تولید میشود.
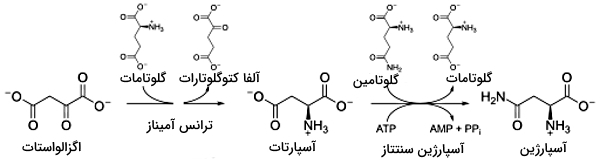
سنتز آمینواسیدها از پیرووات و فسفوانول پیرووات
آلانین و تیروزین تنها انواع آمینو اسید های غیرضروری هستند که به ترتیب از پیرووات و فسفوانول پیرووات تشکیل میشوند.
- آلانین: این آمینو اسید در یک مسیر دومرحله تولید میشود.
- آنزیم گلوتامات دهیدروژناز با مصرف NADH و آمونیاک به گلوتامات تبدیل میشود.
- آنزیمهای آمین ترانسفراز، گروه آمین گلوتامات را به پیرووات حاصل از گلیکولیز منتقل میکنند.
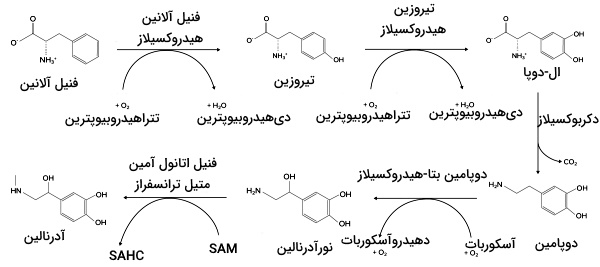
- تیروزین: تیروزین ازجمله آمینو اسیدهای آروماتیک است که از فنیل آلانین تولید میشود. پیشماده فنیل آلانین در گیاهان فسفوانول پیرووات است. آنزیم فنیل آلانین دهیدروکسیلاز، تبدیل فنیل آلانین به تیروزین را کاتالیز میکند.
نقص آنزیمهای تولید آمینواسید
تغییر در ساختار یا عملکرد آنزیمهای مسیر سنتز و تجزیه انواع آمینو اسید ها در انسان منجر به بروز مشکلات فراوانی در تعادل مسیرهای زیستی و هموستازی بدن میشود. یکی از بهترین راههای کنترل این بیماریها حذف پروتئینها از رژیم غذایی با نظارت پزشک است. چهار بیماری زیر از متداولترین اختلالهایی است که به دلیل نقصهای آنزیمی ایجاد میشود.
- فنیل کتونوریا (Phenylketonuria | PKU): جهش در ژن آنزیم فنیل آلانین هیدروکسیلاز، تبدیل فنیل آلانین به تیروزین را مهار و منجر به تجمع فنیل آلانین در بدن میشود. مصرف پروتئين و آسپارتام در افراد مبتلا به این بیماری باید کنترل شده و با نظارت پزشک باشد. تجمع فنیل آلانین در بدن بیماری منجر به ایجاد مشکلات زیر میشود.
- مشکلات سیستم عصبی ازجمله تشنج
- مشکلات پوستی ازجمله اگزما
- بوی بد عرق و ادرار
- رشد کند
- بیماری ادرار شیره افرا (Maple Syrup Urine Disease): جهش ژنتیکی در آنزیم دهیدروژناز $$\alpha$$ کتواسیدهای شاخهدار (BCAAs) منجر به تجمع والین، لوسین و ایزولوسین در خون و ادرار میشود. ناتوانی شناختی، بوی شیرین ادرار و انقباض غیرارادی ماهیچهها از عوارض این بیماری است. در موارد حاد این بیماری ممکن است بیمار به پیوند کبد نیاز داشته باشد.
- هموسیستینوریا (Homocystinuria): نقض آنزیم سیستاتیون $$\beta$$ سنتتاز بیماری نادر اما شدیدی است که منجر به تجمع متیونین و هموسیستئین در خون و ادرار انسان میشود. اختلالهای زیر در افراد مبتلا به این بیماری به وجود میآید.
- رشد کند
- بیماریهای رگ
- پوکی استخوان
- آلکاپتونوریا (Alkaptonuria): آلکاپوتونوریا یا بیماری ادرار سیاه، در اثر نقص یکی از آنزیمهای مسیر تجزیه تیروزین و فنیل آلانین - «هموجنیستیکاسید داکسیژناز» (Homogentisic Acid Dioxygenase) - که ایجاد میشود. نقص این آنزیم تجزیه تیروزین به فومارات را مهار میکند. افراد مبتلا به این بیماری دچار مشکلات زیر میشوند.
- تغییر رنگ بافت پیوندی به مشکی-آبی
- تجمع کلسیم در بافتهای مختلف
- روماتیسم
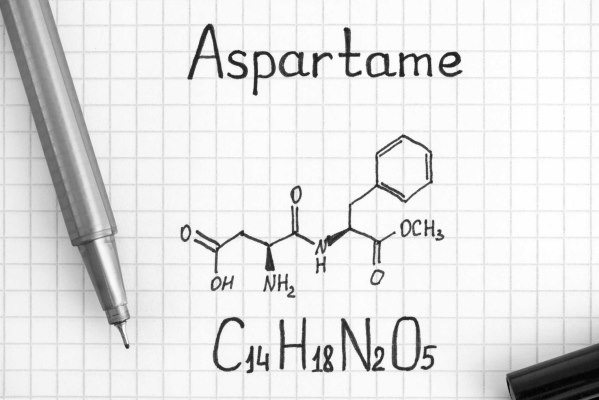
آیا آسپارتام آمینواسید است ؟
آسپارتام، شیرینکننده کمکالری است که در صنایع غذایی به جای ساکاروز استفاده میشود. این ماده دیپپتیدی از دو آمینواسید آسپارتیک اسید و فنیل آلانین است و از تجزیه آن در بدن مقدار کمی متانول نیز تولید میشود. آسپارتام شیرنکننده اصلی در محصولات رژیمی و محصولات تولید شده برای افراد مبتلا به دیابت است.
جمعبندی
آمینواسیدها ازجمله ترکیبات آلی هستند که نقش اصلی آنها تشکیل پروتئينهای ساختاری و عملکردی در سلولهای یوکاریوتی و پروکاریوتی است. به علاوه انواع آمینو اسید ها در تنظیم فرایندهای سلولی و انتقال پیامها نقش دارند. همچنین از تجزیه آنها در بدن انسان پیشماده گلوکز و اسیدهای چرب تولید میشود. آمینو اسیدها بر اساس نیاز بدن به دو دسته ضروری (در بدن ساخته نمیشود و باید از رژیم غذایی دریافت شود) و غیرضروری (در بدن ساخته میشود و در موارد خاص دریافت آن از رژیم غذایی ضروری است) تقسیم میشوند.
سوالات متداول
در این بخش به سوالات متداول پیرامون انواع آمینو اسید ها و نقش آنها در بدن پاسخ میدهیم.
انواع آمینو اسید بازی کدام است ؟
زنجیره جانبی آرژینین، هیستیدین و لیزین خاصیت بازی دارد. زنجیره جانبی آرژینین (pKa = ۱۲٫۵) این آمینواسید را تبدیل به قویترین آمینواسید بازی میکند. لیزین و آرژینین به دلیل پروتون اضافی زنجیره جانبی، در pH طبیعی بدن یک بار مثبت دارند.
آمینو اسیدهای استاندارد کدامند ؟
آمینو اسیدهای استاندارد، انواعی از این مولکول هستند که برای تشکیل پروتئین در بدن به کار میروند. آسپارژیکاسید، گلوتامیکاسید، آرژینین، هیستیدین، لیزین، سرین، تروئونین، متیونین و سیستئین ازجمله این آمینو اسیدها هستند.
چند آمینو اسید استاندارد در بدن انسان وجود دارد ؟
طبق تعریف قدیمی ۲۰ آمینو اسید استاندارد در بدن انسان وجود دارد. این مولکولها در بدن تولید یا از رژیم غذایی دریافت میشوند. اما مطالعات جدید، سلنوسیستئین را عضو بیستویکم این گروه از آمینواسیدها میداند که در مسیرهای زیستی تولید میشود و از آمینواسیدهای تغییرشکلیافته در واکنشهای پس از ترجمه نیست. پیرولیزین یکی دیگر از آمینواسیدهای استاندارد است که در پایان ترجمه نقش دارد.