نظریه اتمی — به زبان ساده

دانشمند انگلیسی، «جان دالتون» (John Dalton)، دانشمندی است که برای اولین، نظریه اتمی را ارائه داد. این نظریه، مفاهیم مختلفی را مرتبط با جهان قابل مشاهده ما توصیف میکند. مفاهیمی همچون ترکیب یک دستبند ساخته شده از طلای خالص و تفاوت دستبند طلا و نقره از جمله این مفاهیم به شمار میآیند. همچنین، اینکه چه اتفاقی در اثر مخلوط شدن طلای خالص با مس خالص رخ میدهد نیز از جمله مواردی است که نظریه اتمی به درک آنها کمک میکند. پیش از توضیح نظریه اتمی، نظریههایی را بیان میکنیم که دالتون از آنها به عنوان پایه نظریه خود استفاده کرد. این نظریهها عبارتند از قانون بقای جرم و «قانون نسبتهای معین» (Law of Constant Composition).
قانون بقای جرم
قانون بقای جرم بیان میکند که جرم کلی قبل از انجام واکنش شیمیایی، با جرم کلی بعد از واکنش برابر است. به عبارت دیگر، در جریان واکنش شیمیایی، جرم حفظ میشود. قانون بقای جرم در نتیجه آزمایش احتراق، توسط «آنتوان لاوازیه» (Antoine Lavoisier) فرمولبندی شد. او در آزمایش خود متوجه شد که جرم مواد قبل از این آزمایش، با جرم فرآوردههای حاصل، برابر است.
درک چنین مفهومی برای دانشمندان در گذشته دشوار بود. اگر این قانون حقیقت داشت، پس چطور بود که قطعه چوبی بعد از سوختن، به خاکستری با حجم کم تبدیل میشد چراکه به وضوح، قطعه چوب، وزن بیشتری از خاکستر داشت. از طریق این مشاهدات بود که دانشمندان بیان میکردند که در این میان، جرمی از دست رفته است. با این وجود، تصویر زیر نشان میدهد که سوزاندن چوب از قانون بقای جرم پیروی میکند. دانشمندان در مشاهدات خود، گازهای تولید شده را در نظر نگرفته بودند.
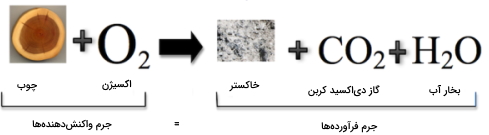
قانون نسبت های معین
«جوزف پروست» (Joseph Proust) برای اولین بار قانون نسبتهای معین را ارائه داد. این قانون بیان میکند که اگر یک ترکیب را به اجزای سازنده آن تقسیم کنیم، فارغ از مقدار یا منبع ماده اصلی، جرم این اجزا همواره یک نسبت ثابتی خواهند داشت. تصویر زیر به خوبی این قانون را نشان میدهد زیرا ۳۱ گرم و ۸ گرم هر دو به یک نسبت دارای هیدروژن و اکسیژن هستند.
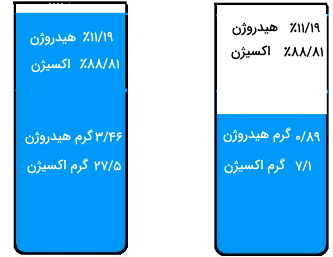
نظریه اتمی دالتون
حال که با قوانین بقای جرم و نسبتهای معین آشنا شدیم، نظریه اتمی دالتون را به شکل دقیقتری در زیر ارائه میکنیم. نظریه اتمی دالتون شامل موارد زیر است.
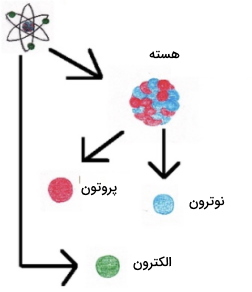
- هر عنصر شیمیایی از ذرات بسیار کوچلی تشکیل شده است که نمیتوان آنها را با چشم غیرمسلح مشاهده کرد. به این ذرات، اتم میگویند. اتمها نه بوجود میآیند و نه از بین میروند. در تصویر زیر، اتم هلیوم نشان داده شده است.
- تمامی اتمهای یک عنصر در جرم و سایر خواص، مشابه یکدیگر هستند اما اتمهای یک عنصر با اتمهای سایر عناصر متفاوت است. به طور مثال، طلا و نقره جرمها اتمی و خواص متفاوتی دارند.
- در هر ترکیب، عناصر مختلف در یک نسبت ساده (عدد صحیح) با یکدیگر ترکیب میشوند. به طور مثال نمیتوان گفت نصف یک اتم کربن با دو اتم هیدروژن ترکیب میشود و مولکول متان را تشکیل میدهد. البته از نسبتهای غیرصحیح میتوان در حل مسائل استوکیومتری و انواع روشهای موازنه در معادله شیمیایی استفاده کرد.
نظریه اتمی به ما در درک بهتر مطالب بالا کمک میکند. به طور مثال، یک دستبند طلا، از تعدادی اتم تشکیل شده و به همین ترتیب، دستبند نقره نیز از اتمهایی تشکیل شده است. این تفاوت به دلیل تفاوت در اتمهای این دو ماده بوجود میآید. البته نظریه اتمی دالتون در همه موارد صحیح نبود. قانون اول زمانی رد شد که دانشمندان در فرآیندی موسوم به «شکافت هستهای» موفق شدند اتم را به اجزای کوچکتر تقسیم کنند.
قانون دوم زمانی نقض شد که دانشمندان کشف کردند تمامی اتمهای یک عنصر، جرم یکسانی ندارند و ایزوتوپهای مختلفی از یک اتم وجود دارد. البته این تناقضات سبب کنار گذاشتن نظریه اتمی نشد چراکه این نظریه به درستی، قانون بقای جرم و قانون نسبتهای معین را توصیف میکند. نظریه اتمی سبب ارائه «قانون نسبتهای چندگانه» (Law of Multiple Proportions) شد.
قانون نسبت های چندگانه
قانون نسبتهای چندگانه بیان میکند که اگر دو عنصر، بیش از یک ترکیب را تشکیل دهند، جرم یک عنصر در ترکیب با جرم ثابت عنصر دوم، نسبتهای کوچک و صحیح تشکیل میدهد که این مورد در قانون سوم نظریه دالتون به شکلی صحیح بیان شده است.
کشف الکترون
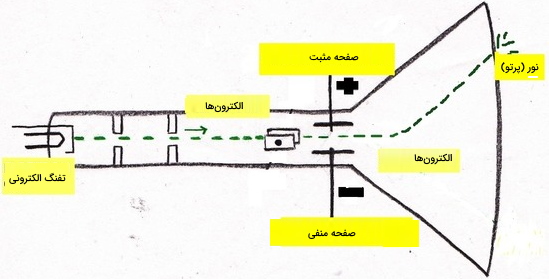
اولین لوله پرتو کاتدی (CRT) توسط «مایکل فارادی» (Michael Faraday) اختراع شد. پرتوهای کاتدی به پرتوهایی میگویند که توسط یک قطب منفی (کاتد) گسیل میشوند. این اتفاق در اثر گذردهی جریان الکتریکی از داخل لولهای شیشهای بدون هوا کشف شد. پرتوهای کاتدی تولید شده توسط CRT با چشم قابل رویت نیستند به همین دلیل موادی از جنس فسفر با خاصیت فسفرسانس در انتهای دستگاه مورد استفاده قرار میگیرند که مسیر این پرتوها را مشخص میکند.
این مواد نشان دادند که پرتوهای کاتدی در یک مسیر مستقیم حرکت میکنند و خواص آنها به جنس کاتد (طلا، نقره و ...) بستگی ندارد. خاصیت مهم دیگر پرتوهای کاتدی این است که توسط میدان الکتریکی و مغناطیسی منحرف میشوند و این انحراف مشابه انحراف مواد باردار با بار منفی است. به دلیل این مشاهدات، «جان تامسون» (John Thomson) به این نتیجه رسید که پرتوهای کاتدی، ذراتی با بار منفی هستند که در تمامی اتمها وجود دارند.
در تصویر زیر نحوه تاثیر میدان مغناطیسی بر پرتوهای کاتدی نشان داده شده است. پرتوهای کاتدی همواره جذب قطب مثبت و توسط قطب منفی دفع (منحرف) میشوند.
مدل کیک کشمشی
بعد از کشف الکترون توسط تامسون، او «مدل کیک کشمشی» (Plum Pudding Model) را برای یک اتم ارائه داد. این مدل بیان میکرد که الکترونها در درون مادهای با بار مثبت، پراکنده شدهاند که میتوان آنها را مانند یک کیک کشمشی تصور کرد. کشمشها درون این کیک، نقش بار منفی و کیک نقش مواد با بار مثبت را دارند.

کشف پروتون
در سال 1909، «ارنست رادرفورد» (Ernest Rutherford) به کمک ذرات آلفا، مجموعه آزمایشهایی را ترتیب داد تا به مطالعه ساختار داخلی اتمها بپردازد. رادرفورد میدانست ذرات آلفا به طور ویژهای سنگینتر از الکترونها و دارای بار مثبت هستند. با توجه به مدل کیک کشمشی، رادرفورد پیشبینی کرد که ذرات موجود در پرتو آلفا باید بدون انحراف از داخل ماده عبور کنند و تنها تعداد کمی از این ذرات منحرف شوند. در حقیقت، بر اساس مدل کیک کشمشی، ذرات تنها زمانی منحرف میشدند که با الکترونها برخورد کنند و بر اساس مدل کیک کشمشی، احتمال این رخداد، بسیار کم بود.
رادرفورد برای بررسی نظریه خود، پرتو آلفا را به ورقه نازکی از طلا تابید. اطراف ورقه طلا نیز، ورقهای از سولفید روی قرار داد. این ورقهها به هنگام تابیده شدن ذرات آلفا، نوری از خود ساطع کردند. با این وجود، این آزمایش، نتایجی را تولید کرد که در تضاد با نظریه رادرفورد بودند.
رادرفورد مشاهده کرد که بیشتر ذرات آلفا از میان ورقه طلا عبور کردهاند اما برخی ذرات نیز انحراف کمی داشتهاند. همچنین، برخی ذرات، انحراف بسیار زیادی را تجربه کردهاند و برخی دیگر نیز به طور کامل از مسیر، برگشت داده شدهاند. در تصویر زیر، پیشبینی رادرفورد در خصوص کیک کشمشی (تصویر بالا) و نتایج مشاهده شده از برگشت پرتوها (تصویر پایین) نشان داده شده است.
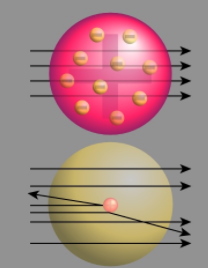
رادرفورد برای توضیح این تناقضها، مدلی موسوم به «مدل هستهای» (Nuclear Model) را ارائه داد. در این مدل، بارهای مثبت در محدودهای بسیار کوچک با نام «هسته» در مرکز اتم نگهداری شدهاند و خارج از هسته اتم، فضایی بزرگ و خالی وجود دارد. این مدل بیان میکرد که ذرات مثبتی در داخل هسته وجود دارند اما نمیتوانست این ذرات را تعریف کند. رادرفورد این ذرات را به هنگام انجام آزمایش گسیل ذرات آلفا بر اتمهای نیتروژن در سال ۱۹۱۹ کشف کرد. در این آزمایش، در اثر برخورد اتمهای نیتروژن و پرتوهای آلفا، پروتون آزاد شد.
کشف نوترون
در سال 1933، «جیمز چادویک» (James Chadwick)، تابش جدیدی را کشف کرد که حاوی ذرات خنثی بود. مشخص شد که این ذرات خنثی از هسته اتم ناشی شدهاند و این کشف آخر (نوترون) سبب تکمیل مدل اتمی شد.
مدل اتمی بور و گام های اولیه در مدل کوانتومی اتم
نظریه اتمی و مدل اتمی ارائه شده دو مشکل اساسی داشت. اول اینکه برخلاف سیارات که به دور خورشید میچرخند، الکترونها ذراتی باردار هستند. یک بار الکتریکی به هنگام شتابگیری، امواج الکترومغناطیس گسیل میکند. این باری که در اطراف هسته چرخش میکند باید به طور مداوم انرژی از دست بدهد و در کسری از ثانیه، به هسته برخورد کند. مشکل دوم این بود که مدل ارائه شده نمیتوانست پیکها (قلهها) مشاهده شده ناشی از طیفهای گسیل و جذب مشاهده شده اتمها را توصیف کند.
تئوری کوانتوم در اوایل قرن بیستم، انقلابی را در فیزیک بوجود آورد و در آن زمان، «ماکس پلانک» (Max Planck) و آلبرت اینشتین بیان کردند که انرژی نور در مقادیر مشخص و گسستهای موسوم به کوانتا (مفرد کوانتوم) جذب یا گسیل میشود. «نیلز بور» (Niels Bohr) از این ایده در مدل اتمی خود استفاده کرد.
در مدل اتمی بور، الکترون، تنها میتوانست در یک مدار مشخص با تکانه زاویهای و انرژی ثابت، گردش کند و فاصله آن از هسته با انرژی آن متناسب بود. بر اساس این مدل، الکترون، دیگر امکان سقوط بر روی هسته را نداشت زیرا نمیتوانست به صورت پیوسته، انرژی از دست بدهد بلکه میتوانست بین سطوح ثابت انرژی، به سرعت، «گذار» (Transition) داشته باشد. در اثر این اتفاق نیز نور با فرکانسی متناسب با تغییر انرژی، جذب یا گسیل میشود.
مدل اتمی بور، مدل کاملی نبود و تنها میتوانست طیف خطی هیدروژن را توضیح دهد و در توصیف اتمهایی با بیش از یک الکترون، ناتوان بود. علاوه بر این، با پیشرفت علم طیفسنجی، طیفهای دیگری نیز از هیدروژن بدست آمد که مدل اتمی بور نمیتوانست آنها را توضیح دهد.
کشف ایزوتوپ
به هنگام آزمایش فرآوردههای ناشی از واپاشی پرتوزا، «فردریک سودی» (Frederick Soddy) متوجه شد که در هر محل از جدول تناوبی ممکن است بیش از یک عنصر وجود داشته باشد. این اتمها که در تعداد نوترون با یکدیگر تفاوت داشتند، نام «ایزوتوپ» را توسط «مارگارت تاد» (Margaret Todd) دریافت کردند.
معرفی آموزش علوم تجربی پایه هشتم - بخش شیمی
آشنایی با نظریه اتمی و مدلهای اتمی در دروس دوره متوسطه، اهمیت بالایی دارد و به همین منظور، «فرادرس» دورهای ۵ ساعته را در قالب شش درس منتشر کرده است که به بخش شیمی علوم تجربی پایه هشتم اختصاص دارد. این آموزش، برای کسانی مناسب است که میخواهند علاوه بر آشنایی با نظریه اتمی و مدلهای مختلف اتمی، بخش شیمی علوم تجربی را نیز بهتر یاد بگیرند.
در درس یکم این آموزش، انواع مخلوطها و روش جداسازی مواد بیان میشود که از جمله مباحث آن میتوان به محلول، کلوئید و همچنین سوسپانسیون و شناساگرهای اسید و باز اشاره کرد.
درس دوم و سوم، تغییر شیمیایی و تغییر فیزیکی به همراه مثالهای آن مورد بررسی قرار میگیرد و در درس چهارم و پنجم با نظریه اتمی و مدلهای اتمی و تعریف اتم و مولکول، آشنا خواهید شد. درس ششم نیز به تعریف یونها و کاتیون و آنیون اختصاص دارد که در انتهای آن، نحوه تشکیل نمک طعام نیز بررسی میشود.
مدل کوانتومی اتم
در تکمیل نظریه اتمی دالتون در نهایت به مدل کوانتومی اتم میرسیم. در سال ۱۹۴۲، «لوییس دو بروی» (Louis de Broglie) بیان کرد که تمامی ذرات متحرک، خاصه ذرات زیراتمی همچون الکترون، به نوعی رفتاری موجیشکل از خود نشان میدهند که «اروین شرودینگر» (Erwin Schrödinger) با مطالعات خود در نهایت، معادله شرودینگر را در این خصوص ارائه داد. این معادله، الکترون را به صورت یک تابع موج به جای یک ذره نقطهای توصیف میکرد.
معادله شرودینگر توانست بسیاری از طیفهای مختلف عناصر را توصیف کند. یکی از منتقدان شرودینگر به نام «مکس بورن» (Max Born) بیان کرد که تابع موج شرودینگر، نه خود الکترون بلکه حالات احتمالی آنرا توصیف میکند و بنابراین میتوان از آن برای محاسبه احتمال یافتن الکترون در هر نقطه از اطراف هسته استفاده کرد. این اتفاق سبب معرفی دوگانگی موج-ذره شد. این نظریه بیان میکرد که الکترون میتواند رفتاری هم به صورت ذره و هم به صورت موج از خود بروز دهد. به طور مثال میتواند به صورت یک موج، شکست داشته و مانند ذره، دارای جرم باشد.
در نتیجه توصیف الکترون به صورت موجی سبب شد تا نتوان به صورت ریاضی، مکان و تکانه یک الکترون را به طور همزمان بدست آورد که این موضوع به اصل عدم قطعیت هایزنبرگ (برگرفته شده از نام دانشمند) معروف است و سبب حذف مدل اتمی بور با تمام جزئیات آن شد. مدل اتمی جدید، محل یک الکترون را بر اساس احتمالات بیان میکند.
یک الکترون را میتوان به صورت بالقوه در هر فاصلهای از هسته پیدا کرد اما بسته به سطح انرژی آن، این الکترون در نواحی مخصوصی در اطراف هسته نسبت به سایر الکترونها حضور دارد. به این الگوی حضور، اوربیتال اتمی میگویند که در شکلهای مختلف کروی، دمبلیشکل و ... دیده میشوند.













سلام مجله بی نقص بود ولی یک سوال تو اوایل متن آمده که در واکنش سوختن چوب جرم چوب و اکسیژن با فرآورده ها ( بخار آب و خاکستر و دی اکسید کربن ) برابر است در این صورت قانون E=mc2 نقض میشه چون جرم واکنش دهنده و فرآورده یکی هست در حالی که مقداری انرژی به صورت گرمایی و نورانی آزاد شده همچنین قانون بقای انرژی نیز نقض میشه که میگه انرژی نه به وجود میاد و نه از بین میره بلکه از شکلی به شکل دیگر تبدیل میشه
با سلام،
به هنگام سوختن چوب میتوانیم از رابطه معروف اینشتین یعنی E=mc2، استفاده کنیم. هنگام سوختن چوب، این تصور اشتباه وجود دارد که تمام ان پس از سوختن به انرژی تبدیل میشود.زیرا پس از سوختن چوب تنها چیزی که باقی میماند مقدار کمی خاکستر سبک است. آیا تمام چوب پس از سوختن به انرژی تبدیل شده است؟ خیر. واکنش شیمیایی بین اکیژن داخل هوا و چوب، محصولات دیگری نیز تولید میکند. ابتدا، تما آب داخل چوب تبخیر میشود، بنابراین، جرم آن کاهش کاهش مییابد. دود برخاسته از آتش ترکیبی شیمیایی است که بخش عمده آن را دیاکسیدکربن تشکیل میدهد. در واقع، تمام کربن داخل چوب در دود برخاسته از آن به هنگام سوختن، یافت میشود. عنصرهای دیگر نیز به محصولات جانبی تبدیل میشوند. در نتیجه، پس از سوختن چوب چیزی به جز کمی خاکستر باقی نمیماند.
چوب پس از سوختن به شکل دیگری از ماده تبدیل میشود. تنها شکلهای انرژی که به هنگام سوختن چوب مشاهده میشوند، عبارت هستند از:
. انرژی گرمایی
. انرژی نورانی
. انرژی صوتی
اگر مقدار انرژی کل به هنگام سوختن چوب در رابطه E=mc2 قرار دهیم، مقدار جرم بهدست آمده در مقایسه با تکه چوب اولیه، بسیار کوچکتر خواهد بود. به عنوان مثال، ۱۷۰۴ کیلوگرم چوب به هنگام سوختن، انرژی معادل ۲۵۳۲۱۳۴۰۴۶۳ ژول تولید میکند. این مقدار انرژی آزاد شده منجر به از دست دادن 2.7 \times 10 ^ {-7} کیلوگرم جرم در ماده میشود. این عدد بسیار کوچک است. این عدد به اندازهای کوچک است که گویا هیچ جرمی از بین نرفته است. اگر تمام جرم چوب به انرژی تبدیل میشد، مقدار انرژی آزاد شده معادل انفجار بمب اتم بود.
با تشکر از همراهی شما با مجله فرادرس
سلام خسته نباشید،یک سوال داشتم،مگه ما نمیگیم یک الکترون را میتوان به صورت بالقوه در هر فاصلهای از هسته پیدا کرد؟ این جمله تناقض نداره با این جمله که میگه انرژی الکترون در اتم کوانتومی است و الکترون نمیتونه تو هر فاصله ای از هسته باشه؟
با سلام؛
به طور معمول احتمال حضور الکترون در یک محل بررسی میشود. با این وجود، برای درک بهتر این موضوع باید با مفهوم رفتار موجی و ذرهای و معادلات شرودینگر آشنا باشید که به همین دلیل، مطالعه مطلب «فیزیک کوانتوم چیست ؟ — از مفاهیم تا کاربردها به زبان ساده» پیشنهاد میشود.
با تشکر از همراهی شما با مجله فرادرس
سلام و وقت بخیر
دو تا سوال خدمت شما داشتم
اول اینکە اگر ٪99٫99 اتم فضای خالیست پس چرا ما توسط جاذبەی زمین بە مرکز زمین سقوط نمیکنیم درحالیکە بیستر فضای زمین خالیست؟ و یا چرا نور در بدن ما رد نمیشه درحالیکه نور میتونه در فضای خالی به راحتی رد بشه؟
سوال دومم اینە که آیا الکترون در نزدیک هستە سرعتش بیشتره یا کمتر؟ اگر بیشترە پس چرا الکترونهایی که نزدیک هسته هستند انرژی هایشان کمتر است که در حالت پایهاند و پایدارتر هستند؟ آیا سرعتشان هم کمتر است؟
با سلام؛
از همراهی شما با مجله فرادرس سپاسگزاریم. در خصوص سوال اول باید گفت نور بسته به انرژی تابشی، از بدن و انواع تودهها میتواند عبور کند که نحوه عملکرد دستگاههای تصویربرداری نیز بر همین اساس بنا شده است. در رابطه با سقوط به مرکز زمین هم ذکر این نکته ضروری است که باید اندازهها را در مقیاس بسیار کوچک بررسی کنید که شامل مولکولهای بزرگتر هم میشوند اما به طور کلی، سطح زمین از سقوط جلوگیری میکند. به بیان ساده، نیروی عمود بر سطح بر نیروی گرانش غلبه و از سقوط جلوگیری میکند.
در رابطه با سوال دوم باید گفت در مدلهای قبلی اتم فرض بر این بود که الکترونها به دور هسته چرخش میکنند اما با معرفی دوگانگی موج-ذره، همانطور که در متن نیز بیان شده است، میتوان احتمال حضور الکترون را در هر نقطه بسته به سطح انرژی مشخص کرد که پر شدن الکترونها در این سطوح، از اصل طرد پائولی پیروی میکنند.
با تشکر