هسته اتم یا نوکلید (Nuclide) — به زبان ساده

در مقاله «اتم -- به زبان ساده» با اتم و ساختار کلی آن آشنا شدیم. دیدیم که اتمها از الکترونها، پروتونها و نوترونها ساخته شدهاند. الکترونها خود ذرات بنیادی هستند که بر اساس دیدگاه شبه کوانتومی بور، در مدارهایی با انرژی مشخص و گسسته به دور هسته اتم گردش میکنند. از دیدگاه فیزیک کوانتومی، مکان الکترونها به طور دقیق مشخص نبوده و تنها میتوان احتمال حضور را تخمین زد. به مکانهایی که احتمال حضور الکترون در آنجا نسبت به دیگر مکانها بیشتر است، اوربیتال میگویند.
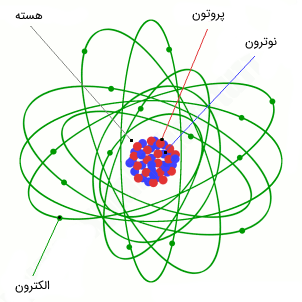
همچنین دیدیم که پروتونها و نوترونها در هسته اتم جای میگیرند. پروتونها و نوترونها ذراتی بنیادی نبوده و خود از ذرات کوچکتری موسوم به کوارک تشکیل شدهاند. در این مقاله در نظر داریم تا با زبانی ساده، کمی بیشتر به مقوله هسته اتم (Atomic Nucleus) یا نوکلید (Nuclide) بپردازیم.
کشف هسته اتم
الکترون با بار الکتریکی منفی در حدود سال 1897 توسط تامسون (J. J. Thomson) کشف شد. در آن زمان دانشمندان و محققان ذهنیت دقیقی از ساختار اتم نداشتند. از آنجایی که اتم در حالت عادی از لحاظ الکتریکی خنثی بود، دانشمندان پیشبینی میکردند که اتم باید دارای ذراتی با بار الکتریکی مثبت باشد تا بار الکتریکی منفی الکترونها را خنثی کند.

در آن زمان مدل اتمی کیک کشمشی تامسون که بیان میکرد بارهای مثبت و منفی به تعداد مساوی و به طور تصادفی در حجم اتم پراکنده شدهاند را قبول داشتند.

آزمایش ورقه طلا
در حدود سال 1911 رادرفورد (Ernest Rutherford) به همراه همکارانش آزمایش جالب توجهی انجام دادند که منجر به کشف هسته اتم شد. امروزه در اکثر مراجع، آزمایش مذکور به آزمایش ورقه طلا موسوم است. در آن زمان مشخص شده بود که عناصر خاصی موسوم به رادیواکتیو وجود دارند که خودبهخود ذراتی را تابش و خود به عناصر دیگری تبدیل میشوند. یکی از این عناصر اتم رادون (Radon) بود که ذرات پرانرژی آلفا (alpha : α) را با انرژی حدود $$5.5\ MeV$$ تابش میکند و خود به عنصر دیگری تبدیل میشود. جهت آشنایی با ساختار الکترونی گاز رادون به مقاله «گاز نجیب -- به زبان ساده» مراجعه فرمایید.
امروزه میدانیم که ذرات آلفا (α)، در واقع هسته اتم هلیوم هستند. به عبارت دیگر اتم هلیوم با عدد اتمی ۲ که الکترونهای خود را از دست داده باشد ($$^4 He^{+2}$$)، ذره آلفا (α) را تشکیل میدهد. ذرات آلفا (α) حدود 7300 مرتبه از الکترون سنگینتر بوده و دارای بار الکتریکی $$+2e$$ هستند.
به طور خلاصه، رادرفورد و همکارانش مطابق با شماتیک شکل (4)، یک محفظه شیشهای حاوی گاز رادون را به عنوان منبع تولید ذرات آلفا (α) در نظر گرفتند.
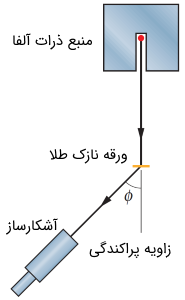
ذرات آلفا (α) پرانرژی به سمت ورقه نازکی از طلا هدایت میشدند. رادرفورد و همکارنش با محاسبه میزان زاویه پراکندگی ذرات آلفا (α) به نتایج بسیار جالب توجهی دست یافتند. میزان پراکندگی ($$\phi$$) ذرات آلفا (α) برحسب تعداد ذرات آلفا (α) مشاهده شده را میتوان در نمودار زیر نشان داد.
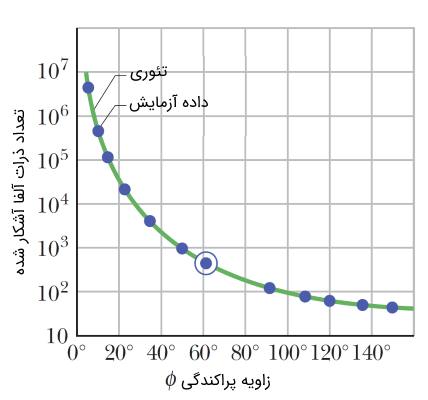
نتایج آزمایش ورقه طلا
مطابق با نمودار شکل فوق، ۳ نتیجه بسیار مهم زیر را میتوان اتخاذ کرد:
- تعداد بسیار زیادی از ذرات آلفا (α) با زاویه بسیار کم یا بدون آنکه تغییری در مسیر خود ایجاد کنند، از ورقه نازک طلا عبور کردند. این امر بدین منزله است که بیشتر حجم اتم را فضای خالی تشکیل میدهد.
- تعداد قابل توجهی از ذرات آلفا (α) با میزان زاویه قابل توجهی پراکنده میشوند. از آنجا که ذرات آلفا دارای بار الکتریکی مثبت هستند، میتوان نتیجه گرفت که این پراکندگی به دلیل نیروی دافعه بین بار مثبت اتم و ذرات آلفا (α) است. همچنین بارهای مثبت اتم، در مکان یا محدوده کوچکی قرار دارند.
- تعداد کمی از ذرات با زاویهای حدود 180 درجه به سمت عقب پراکنده میشوند. این امر که مهمترین نتیجه آزمایش ورقه طلا را تشکیل میدهد، بیان میکند که جرم سنگینی که بیشتر جرم اتم را شامل میشود، در نقطهای متمرکز قرار دارد.
به طور خلاصه از نتایج فوق بر میآید که بیشتر وزن اتم در مرکز آن با بار الکتریکی مثبت قرار گرفته است. شکل زیر، شماتیکی از رفتار ذرات آلفا (α) را به هنگام برخورد با ورقه نازک طلا نشان میدهد.
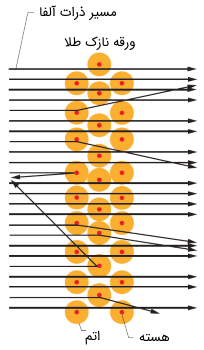
رادرفورد بر اساس نتایج آزمایش مذکور، مدل اتمی خود را ارائه کرد که البته دارای نارساییهایی نیز بود. با آنکه از مدل اتمی رادرفورد، اتم ناپایدار نتیجه میشد، اما دیدگاه وی آغازی بر مدل شبه کوانتومی بور و مدل موفق و دقیق کوانتومی است.
مدل اتمی رادرفورد
- اتم ساختاری است که از لحاظ الکتریکی خنثی بوده و بخش قابل توجهی از جرم اتم در فضایی کوچک در مرکز اتم، موسوم به هسته با بار الکتریکی مثبت متمرکز شده است. به عبارت دیگر حجم هسته با جرم زیاد در مقابل حجم کل اتم بسیار کوچک بوده و بیشتر حجم اتم را فضای خالی تشکیل میدهد. دقت داشته باشید که مدل اتمی رادرفورد در سال 1911 صحبتی از پروتون و یا نوترون نکرده و تنها وجود هسته اتم را پیشبینی میکند.
- الکترونها با بار الکتریکی منفی به دور هسته بار مثبت در مسیرهایی دایرهای و ثابت موسوم به مدار در حال گردش هستند. مجموع بار مثبت هسته با مجموع بار الکترونها برابر بوده تا یکدیگر را خنثی کنند. نیروی الکترواستاتیکی قوی، الکترونها و هسته را در کنار یکدیگر نگه میدارد.

لازم به ذکر است که یکی از نارساییهای مهم مدل اتمی رادرفورد، ناپایدار بودن اتم براساس نظریه الکترومغناطیس ماکسول بود. نظریه الکترومغناطیس کلاسیک بیان میکند که ذرات باردار در حال حرکت، انرژی خود را به صورت موج الکترومغناطیسی تابش میکنند. حال بنابر مدل اتمی رادرفورد که بیان میکند، الکترون با بار الکتریکی منفی به دور هسته اتم در حال چرخش است، باید تابش کرده و پس از اتمام انرژی، در نهایتاً به سمت هسته سقوط کند.
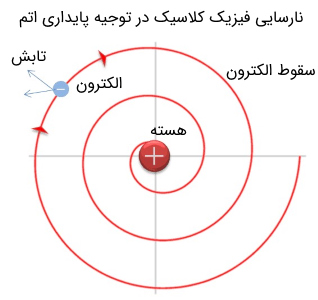
کشف پروتون
از لحاظ تاریخی کشف پروتون را نیز میتوان به رادرفورد نسبت داد. پس از آزمایش موفق ورقه طلا در سال 1911، رادرفورد ثابت کرد که هسته اتم هیدروژن در هستههای اتمهای دیگر نیز وجود دارد. در تاریخ علم، غالباً این نتیجه رادرفورد را کشف پروتون در نظر میگیرند.
رادرفورد با شلیک ذرات پرانرژی آلفا (α) به هوا که غالب آن از اتمهای نیتروژن تشکیل شده است، توانست توسط آشکارسازها اثراتی از هسته اتم هیدروژن را آشکار کند. پس از تکرار این آزمایش با نیتروژن خالص، رادرفورد دریافت که هستههای اتم هیدروژن تنها میتوانند از اتمهای نیتروژن نتیجه شده باشند. به عبارت دیگر، اتمهای نیتروژن باید حاوی هسته اتم هیدروژن باشند.
لازم به ذکر است که آزمایش فوق را میتوان نخستین آزمایش و واکنش هستهای در تاریخ دانست. در این آزمایش، اتمهای نیتروژن توسط بمباران ذرات آلفا (α) دچار تجزیه هستهای شده و پس از جدا شدن هسته اتم هیدروژن (همان پروتون)، تبدیل به اکسیژن ۱۷ میشوند.
$$\large ^{14}N + \alpha \rightarrow ^{17}O + p$$
(1)
از آنجایی که رادرفورد میدانست هیدروژن سادهترین و سبکترین عنصر واحد سازنده دیگر عناصر در جهان است، تصمیم گرفت نامی خاص را به هسته اتم هیدروژن اختصاص دهد. رادرفورد بیان کرد که هسته اتم هیدروژن، به عنوان سبکترین عنصر، تنها دارای یک ذره است. در نتیجه نام یونانی پروتون به معنی نخستین را برای آن انتخاب کرد.
لازم به ذکر است که ایزوتوپ اتم هیدروژن ($$_1^1H$$) که به وفور در طبیعت یافت میشود (پایدارترین)، تنها دارای یک پروتون و یک الکترون است. اتم هیدروژن نوترون نداشته و ایزوتوپهای آن به نامهای دوتریوم ($$_1^2D$$) و تریتیم ($$_1^2T$$) دارای نوترون هستند. ایزوتوپ $$_1^1H$$ به پروتیون نیز معروف است.
نوترون (Neutron)
رادرفورد با انجام آزمایشهایی بیشتر متوجه شد که جرم هسته اتم، تقریباً دوبرابر تعداد پروتونهای آن است. از آنجایی که بار الکتریکی پروتونها مثبت بوده و یک اتم در حالت عادی خنثی است، رادرفورد پیشبینی کرد که ذراتی با جرم هماندازه پروتون و از لحاظ الکتریکی خنثی باید در هسته اتم وجود داشته باشند تا کمبود جرم هسته اتم راجبران کنند.
در حدود سال 1932 میلادی، جیمز چادویک (James Chadwick) آزمایشی ترتیب داد و اتمهای برلیوم را با ذرات پرانرژی آلفا (α) بمباران کرد. با انجام این آزمایش وی متوجه شد که ذراتی پرانرژی با عمق نفوذ بالا از اتمهای برلیوم به بیرون ساطع میشوند که در میدان الکترومغناطیسی نیز منحرف نمیشوند.

چادویک ابتدا فرض کرد که احتمال ذرات ساطع شده مذکور از جنس امواج الکترومغناطیسی با انرژی بالا ایکس ($$X$$) یا گاما هستند. اما با اندازهگیری سرعت ذرات مذکور، متوجه شد که سرعتشان در حدود یک دهم سرعت نور است. چادویک بر اساس مشاهدات خود، این ذرات را که جرمی هماندازه پروتون دارند و از لحاظ الکتریکی نیز خنثی هستند، نوترون نامید. منشأ نوترونهای آزاد شده، هسته اتم است.
برخی از خواص هسته اتم (نوکلید)
در این بخش در نظر داریم تا اطلاعاتی کلی را در خصوص هسته اتم ارائه کنیم.
واژه شناسی هسته اتم
در فیزیک و مهندسی هستهای غالباً به هسته اتم، نوکلید (Nuclide) یا نوکلئید یا نوکلاید میگویند. به بیانی ساده نوکلید، اتمی با ساختار ویژه از هسته است (اتم بدون الکترون). یک عنصر شیمیایی میتواند چند نوکلید مختلف با تعداد نوترونها و ترازهای انرژی مختلف داشته باشد. دقت داشته باشید که نوکلیدهای یک عنصر شیمیایی دارای تعداد پروتون یکسان بوده و تنها در تعداد نوترونها با یکدیگر متفاوت هستند. لازم به ذکر است که نوکلید (نوکلئید)های مختلف یک عنصر، در واقع ایزوتوپهای یکدیگر هستند.
همانطور که در بخش قبل بیان کردیم، هسته اتم از پروتونها و نوترونها تشکیل شده است. در فیزیک هستهای، به پروتون و نوترونهای تشکیل دهنده یک هسته اتم، نوکلئون (Nucleons) میگویند.
نوکلیدها به طور خاص با عدد جرمی $$A$$ متمایز میشوند. همانطور که در دو مقاله «اتم -- به زبان ساده» و «عدد اتمی، عدد جرمی و ایزوتوپ — به زبان ساده» دیدیم، عدد جرمی $$A$$ مجموع عدد اتمی $$Z$$ و عدد نوترونی $$N$$ است. تعداد پروتونهای یک هسته اتم یا نوکلید، به عدد اتمی یا عدد پروتونی موسوم است. همچنین به تعداد نوترونهای یک هسته اتم یا نوکلید، عدد نوترونی میگویند.
$$\large A = Z + N$$
(2)
نمایش نوکلیدها
جهت نمایش هسته اتم یا همان نوکلیدها، از همان نماد شیمیایی موجود در جدول تناوبی عناصر به همراه عدد جرمی $$A$$ استفاده میکنند. غالباً به صورت استانداردی جهانی، عدد جرمی $$A$$ را به صورت اندیسی در بالا و سمت چپ نماد شیمایی هسته اتم مینویسند. به طور مثال برای یک نوکلید یا هسته اتم طلا داریم:
$$\huge ^{197}Au$$
عبارت فوق هسته اتم یا نوکلیدی از عنصر طلا را بیان میکند که عدد اتمی یا عدد پروتونی آن، 79 و عدد نوترونی آن $$N = 197 - 79 = 118$$ است.
همانطور که پیشتر اشاره کردیم، نوکلیدهایی با عدد اتمی یا عدد پروتونی یکسان $$Z$$ که در عدد نوترونی $$N$$ متفاوت هستند، ایزوتوپ (Isotopes) نامیده میشوند. به طور مثال هسته اتم یا نوکلید طلا دارای 36 ایزوتوپ از $$^{173}Au$$ تا $$^{204}Au$$ است.
از میان ۳۶ ایزوتوپ مختلف هسته اتم طلا، تنها ایزوتوپ $$^{197} Au$$ پایدار (stable) بوده و دیگر ایزوتوپها ناپایدار و رادیواکتیو هستند. ایزوتوپهای ناپایدار به رادیونوکلیدها (radionuclides) یا نوکلیدهای پرتوزا نیز موسوم هستند. رادیونوکلیدها به دلیل ناپایداری، دچار واپاشی (Decay or Disintegration) شده و با تابش ذرات به هسته اتم یا نوکلید دیگری تبدیل میشوند.
در جدول (۱) زیر خواص برخی از نوکلیدها آمده است.
| هسته یا نوکلید | عدد پروتونی $$Z$$ | عدد نوترونی $$N$$ | عدد جرمی $$A$$ | پایداری | جرم ($$amu$$) | اسپین | انرژی بستگی ($$\frac{ MeV }{ u }$$) |
| $$\large ^{1} H$$ | 1 | 0 | 1 | 99.985% | 1.007825 | $$\frac{ 1 }{ 2 }$$ | - |
| $$\large ^{7} Li$$ | 3 | 4 | 7 | 92.5% | 7.016004 | $$\frac{ 3 }{ 2 }$$ | 5.60 |
| $$\large ^{31} P$$ | 15 | 16 | 31 | 100% | 30.973762 | $$\frac{ 1 }{ 2 }$$ | 8.48 |
| $$\large ^{84} Kr$$ | 36 | 48 | 84 | 57.0% | 83.911507 | 0 | 8.72 |
| $$\large ^{120} Sn$$ | 50 | 70 | 120 | 32.4% | 119.902197 | 0 | 8.51 |
| $$\large ^{157} Gd$$ | 64 | 93 | 157 | 15.7% | 156.923957 | $$\frac{ 3 }{ 2 }$$ | 8.21 |
| $$\large ^{197} Au$$ | 79 | 118 | 197 | 100% | 196.966552 | $$\frac{ 3 }{ 2 }$$ | 7.91 |
| $$\large ^{227} Ac$$ | 89 | 138 | 227 | 21.8 $$\ y$$ | 227.027747 | $$\frac{ 3 }{ 2 }$$ | 7.65 |
| $$\large ^{239} Pu$$ | 94 | 145 | 239 | 24100 $$\ y$$ | 239.052157 | $$\frac{ 1 }{ 2 }$$ | 7.56 |
در جدول فوق، میزان پایداری برای ایزوتوپهای پایدار بر حسب درصد (فراوانی در طبیعت یا حالتهای ساده) و برای نوکلیدهای پرتوزا (رادیونوکلید) برحسب نیمه عمر بیان میشود. همچنین بر اساس قرارداد، جرم را به صورت جرم اتمی (جرم هسته + جرم الکترونها) بیان میکنند.
انواع نوکلید
در فیزیک و مهندسی هستهای نوکلیدها را میتوان براساس تفاوت در دو عدد اتمی $$Z$$ و عدد اتمی $$N$$ در گروههایی به شرح ذیل تقسیم بندی کرد. این تقسیمبندی اولین بار توسط کومان (Truman P. Kohman) ارائه شد.
ایزوتوپ (Isotope)
همانطور که در بخش قبل بیان کردیم، نوکلیدهایی هستند که عددی اتمی یا عدد پروتونی $$Z$$ در آنها یکسان و در عدد نوترونی $$N$$ با یکدیگر متفاوت هستند. از آنجا که در ایزوتوپها، عدد اتمی یکسان است، همه آنها در یک خانه از جدول تناوبی عناصر قرار میگیرند.
به عبارت دیگر میتوان گفت که ایزوتوپها، شکلهای مختلفی از یک عنصر شیمیایی هستند. به طور مثال $$^{12} C$$، $$^{13} C$$ و $$^{14} C$$ سه ایزوتوپ از عنصر کربن هستند.
ایزوتون (Isotone)
نوکلیدهایی که دارای عدد نوترونی $$N$$ یکسان ولی در عدد اتمی یا عدد پروتونی $$Z$$ با یکدیگر متفاوت هستند، ایزوتونهای یکدیگر محسوب میشوند. به طور مثال چهار نوکلید $$_{19}^{39} K$$، $$_{18}^{38} Ar$$، $$_{17}^{37} Cl$$ و $$_{16}^{36} S$$ همگی دارای ۲۰ نوترون بوده و در تعداد پروتونها با یکدیگر متفاوت هستند.
ایزوبار (Isobar)
نوکلیدهایی که دارای عدد جرمی $$A$$ یکسان ولی در عدد اتمی یا عدد پروتونی $$Z$$ متفاوت هستند، ایزوبارهای یکدیگر محسوب میشوند. به طور مثال نوکیلدهای $$_{9}^{17} F$$، $$_{8}^{17} O$$ و $$_{7}^{17} O$$ هر سه دارای عدد جرمی ۱۷ بوده و در تعداد پروتونها با یکدیگر متفاوت هستند.
هسته آینهای (Mirror Nuclei)
اگر تعداد پروتونها و نوترونهای یک نوکلید به ترتیب با تعداد نوترونها و پروتونهای یک نوکلید دیگر برابر باشد، آن دو نوکلید را هسته آینهای یکدیگر مینامند.
به طور مثال: $$[ _{8}^{14} O\ ,\ _{6}^{14} C]$$ یا $$[ _{2}^{3} H\ ,\ _{1}^{3} H]$$ هسته آینهای یکدیگر هستند.
ایزودیافر (Isodiapher)
نوکلیدهایی که در عدد جرمی $$A$$ و عدد اتمی $$Z$$ با یکدیگر متفاوت بوده ولی اختلاف تعداد نوترون و پروتونهایشان برابر است، ایزودیافرهای یکدیگر نامیده میشوند.
به طور مثال دو نوکلید $$_{98}^{238} U$$ و $$_{90}^{234} Th$$ با اختلاف تعداد نوترون و پروتون $$N - Z = 54$$ ، ایزودیافرهای یکدیگر هستند.
ایزومر هستهای (Nuclear isomer)
نوکلیدهایی که تعداد پروتونها و نوترونهایشان با یکدیگر برابر بوده ولی سطح انرژی یا حالتهای برانگیختگی متفاوتی داشته باشند، ایزومرهای هستهای یکدیگر نامیده میشوند. لازم به ذکر است که ایزومرهای هستهای، از لحاظ شیمیایی ایزوتوپهای یکدیگر محسوب میشوند ولی از نقطه نظر فیزیک هستهای، دو نوکلید متفاوت هستند.
ساماندهی نوکلیدها
همانطور که پیشتر اشاره کردیم، نوکلیدهایی با تعداد پروتون یکسان، در واقع ایزوتوپهایی از یک عنصر شیمایی هستند. جدول تناوبی عناصر، که بر اساس افزایش عدد اتمی $$Z$$ و ساماندهی خواص شیمیایی (مربوط به الکترون) عناصر شکل یافته است، نمیتواند جهت ساماندهی ایزوتوپ یا به طور کلی نوکلیدها به کار رود. چرا که خواص هستهای ایزوتوپها (نوکلیدها) با یکدیگر متفاوت است.
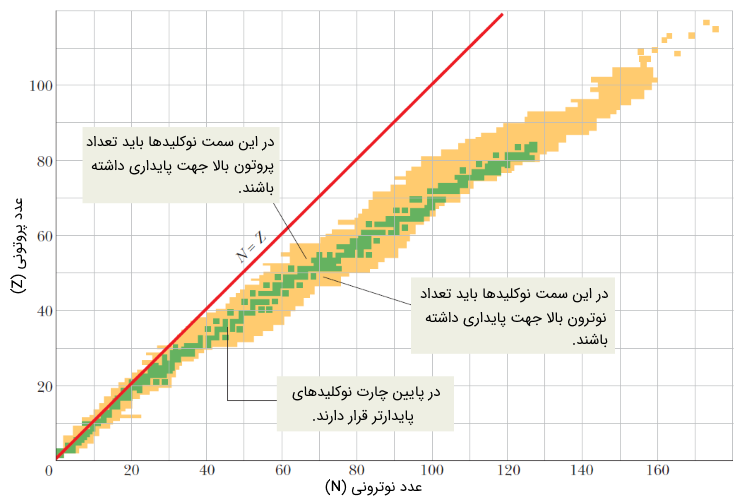
از این حیث، شیمیدانان و فیزیکدانان و مهندسان هستهای نیاز به جدول یا چارتی جداگانه جهت بررسی خواص هستهای نوکلیدهای متفاوت دارند. چارت نوکلیدی (nuclidic chart) در شکل زیر نشان داده شده است. توجه شود که به دلیل تعداد بسیار بالای نوکلیدها، نمیتوان نماد آنها را در شکل نشان داد. شکل زیر نمایی کلی از چارت نوکلیدی است. قسمتی از این چارت در شکل (12) نشان داده شده است. جهت مشاهده چارت نوکلیدها با تمام جزئیات روی این لینک (+) کلیک کنید.
بررسی چارت نوکلیدی
همانطور که در شکل فوق مشاهده میکنید، چارت نوکلیدی بر مبنای دو عدد پروتونی $$Z$$ و عدد نوترونی $$N$$ رسم شده است. نوکلیدهای پایدار به رنگ سبز و رادیونوکلیدها به رنگ زرد در چارت نوکلیدی نشان داده شدهاند.
همانطور که از شکل (11) مشخص است، نوکلیدهای ناپایدار یا همان رادیونوکلیدها در هر دو سمت نوکلیدهای پایدار (سبز رنگ) و در انتهای چارت ($$N$$ و $$Z$$ بالا) قرار دارند. نوکلیدهای پایدار نیز تمایل دارند تا به خط $$Z = N$$ نزدیکتر شوند. به عبارت دیگر، نوکلیدهایی که در آنها تعداد پروتونها با تعداد نوترونها برابر است، پایدار هستند. با توجه به شکل، بدیهی است، نوکلیدهایی که از خط $$Z = N$$ دور میشوند به سمت ناپایداری میروند.
نوکلیدهای سنگین به نوکلیدهایی گفته میشود که تعداد نوترونهای آنها بسیار بیشتر از تعداد پروتونهای آنها باشد. به طور مثال هسته اتم یا نوکلید $$^{179} Au$$ از نوع نوکلید سنگین بوده که دارای 79 پروتون و 118 نوترون است. در برخی موارد نوکلیدهای سنگین میتوانند پایدار باشند.
در شکل (12) قسمت کوچکی از چارت نوکلیدی نشان داده شده است. در این شکل هسته اتم یا نوکلید $$^{179} Au$$ در مرکز قرار داشته و به دلیل پایداری به رنگ سبز نشان داده شده است. در فیزیک هستهای معمولاً نوکلیدهای پایداری همراه یک عدد درصدی بیان میکنند. این عدد میزان فراوانی نسبی (به طور طبیعی) نوکلید را در سیاره زمین بیان میکند.
برخی از نوکلیدهای بسیار سنگین به نسبت پایدار بوده و طول عمر طولانی دارند. نوکلیدهای ناپایدار یا رادیونوکلید به همراه عددی که بیانگر نیمه عمر آنها است بیان میشوند. جهت آشنایی با محاسبه نیمه عمر، به مقاله «نیمه عمر -- به زبان ساده» مراجعه فرمایید. بدیهی است که نیمه عمر کمتر به معنای ناپایداری بیشتر است.
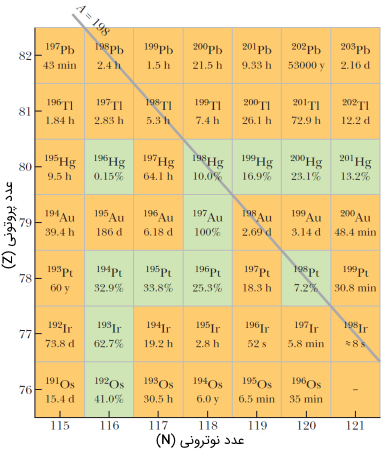
خط خاکستری رنگ $$A = 198$$ در چارت فوق، ایزوبارهایی با عدد جرمی 198 نشان میدهد. همانطور که در بخش قبل بیان کردیم، ایزوبارها، هسته اتم یا نوکلیدهایی هستند که در عدد جرمی یکسان ولی در عدد اتمی با یکدیگر متفاوت هستند.
لازم به ذکر است که بسیاری از نوکلیدها با عدد اتمی بالای 92 به صورت مصنوعی و در آزمایشگاهها تشکیل شدهاند. در سیاره زمین، نوکلیدهایی با عدد اتمی بالای 92 به طور طبیعی یافت نمیشوند.
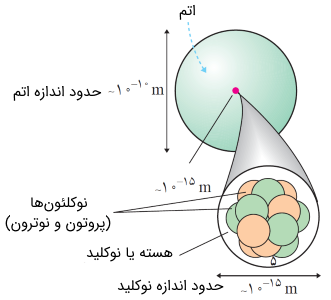
شعاع اتمی (Nuclear Radii)
ابعاد هسته اتم یا نوکلیدها در مرتبه فمتومتر (femtometer) یا $$10^{-15}\ m$$ است. در فیزیک هستهای هر یک فمتومتر را اصطلاحاً یک فرمی (fermi) میگویند.
$$\large 1\ Femtometer\ =\ 1\ fermi\ =\ 1\ fm\ =\ 10^{-15}\ m$$
(3)
ساختار و اندازه هسته اتم یا نوکلیدها را میتوان با بمباران کردن آنها توسط الکترونها پر انرژی (حداقل ۲۰۰ مگا الکترون ولت) محاسبه کرد. این مقدار انرژی زیاد از این لحاظ است که طول موج دوبروی وابسته به ذرات، کوچکتر از ساختار هسته اتم یا نوکلید شود.
هسته اتم یا نوکلیدها همانند خود اتمها سطح مشخص و خوش تعریفی ندارند. با این اوصاف آزمایشهای پراکندگی الکترونهای پر انرژی از هسته اتم یا نوکلیدها این امکان را به ما میدهند که هسته اتم را همانند خود اتمها کروی فرض کنیم. شعاع موثر (effective radius) هسته اتم یا نوکلید به صورت زیر بیان میشود.
$$\large r = r_{0} A^{ \frac{ 1 }{ 3 } }$$
(4)
در عبارت فوق، $$A$$ عدد جرمی بوده که مجموع عدد پروتونی $$Z$$ و عدد نوترونی $$N$$ تعریف میشود. $$r_{0}$$ نیز مقداری ثابت در حدود $$r_{0} \approx 1.2\ fm$$ است. همانطور که مشاهده میکنید، نوع اتم یا عنصر در رابطه فوق هیچ نقشی ندارد در واقع با توجه به رابطه فوق، شعاع هسته اتم را تنها با تعداد نوکلئونهایش (تعداد پروتون و نوترون) میتوان تقریب زد.
لازم به ذکر است که رابطه فوق، برای هسته یا نوکلیدهای هالهای (halo nuclides) قابل استفاده نیست. نوکلیدهای هالهای، نوکلیدهایی با تعداد نوترون زیاد هستند که در دهه 1980 میلادی در آزمایشگاهها به طور مصنوعی ساخته شدند.
شعاع نوکلیدهای هالهای بزرگتر از مقدار پیشبینی شده توسط رابطه $$r = r_{0} A^{ \frac{ 1 }{ 3 } }$$ است. چرایی این امر در این است که برخی از نوترونها در کنار پروتونها در مرکز نوکلید (هسته) قرار نداشته و به صورت هالهای در اطراف آن قرار میگیرند. نوترونهایی که به صورت هاله در یک نوکلید قرار میگیرند، با انرژی کمتری نسبت به نوترونهای مرکزی، میتوانند آزاد شوند.
یکی از مثالهای معروف نوکلید هالهای، سنگینترین ایزوتوپ اتم لیتیوم یعنی $$^{11}Li$$ است. شعاع موثر این نوکلید توسط معادله $$r = r_{0} A^{ \frac{ 1 }{ 3 } }$$ به درستی قابل محاسبه نیست.
جرم اتمی
فیزیکدانان جرم تقریبی الکترون، پروتون و نوترونها با دقت خوبی محاسبه کردند. همانطور که میدانید جرم پروتون و نوترون حدود ۲۰۰۰ برابر جرم یک الکترون است. با این اوصاف جرم یک اتم را غالباً جرم هسته یا جرم نوکلید آن تشکیل میدهد.
| نام ذره | جرم (کیلوگرم - kg) | بار الکتریکی (کولن - C) | جرم نسبی | بار نسبی |
| پروتون | $$1.672622 \times 10^{-27}$$ | $$1.602\times10^{-19}$$ | $$1$$ | $$+1$$ |
| نوترون | $$1.674929 \times 10^{-27}$$ | $$0$$ | $$1$$ | $$0$$ |
| الکترون | $$9.109\times10^{-31}$$ | $$1.602\times10^{-19}$$ | $$\frac{1}{2000}$$ | $$-1$$ |
از آنجایی که جدا کردن تمامی الکترونهای یک اتم بسیار دشوار است (یا شاید نشدنی برای اتمهای سنگین)، محاسبه دقیق جرم هسته اتم یا نوکلید امکانپذیر نبوده و تنها میتوان به صورت تقریبی آن را تعیین کرد.
در علوم پایه فیزیک و شیمی، غالباً جرم اتمی را با واحد جرم اتمی (atomic mass units) بیان میکنند. در این سیستم، یک دوازدهم جرم اتم کربن ۱۲ را واحد یا یکای جرم اتمی مینامند و آن را در با نماد $$amu$$ یا $$u$$ نمایش میدهند. در واقع جرم اتمی ایزوتوپ طبیعی کربن ۱۲ ($$^{12}C$$) به طور دقیق $$12u$$ است. واحد جرم اتمی $$u$$ بر حسب کیلوگرم به صورت زیر است:
$$\LARGE 1\ u\ =\ 1.660\ 538\ 86\ \times\ 10^{-27}\ kg$$
(5)
| ذره | یکای جرم اتمی $$u$$ |
| پروتون | $$1.007276$$ |
| نوترون | $$1.008664$$ |
| الکترون | $$5.4858 \times 10^{-4}$$ |
همانطور که بیان کردیم، محاسبه دقیق جرم هسته اتم یا جرم یک نوکلید به دلیل حضور الکترونها امکانپذیر نیست. با این اوصاف با استفاده از عدد جرمی $$A$$ میتوانیم جرم هسته اتم را محاسبه کنیم. همانطور که در فوق مشاهده کردید، میتوانیم هر $$1u$$ را برابر با جرم یک پروتون و یا نوترون در نظر بگیریم. با این اوصاف جرم هسته اتم یا نوکلید به صورت زیر قابل تخمین است:
$$\large Nuclear\ Masses\ = A\ \times u = A \times 1.66053886 \times 10^{-27}$$$$
(6)
به عنوان مثال، جرم هسته اتم یا نوکلید $$^{197} Au$$ تقریباً برابر با $$197u$$ است. این عدد بسیار نزدیک به جرم اتمی دقیق آن یعنی $$196.966552u$$ است. همانطور که در دو جدول بالا مشاهده کردید، جرم پروتون اندکی از جرم نوترون کمتر است.
در مقاله «همارزی جرم و انرژی -- به زبان ساده» دیدیم که آلبرت اینشتین (Albert Einstein)، جرم و انرژی را مطابق با رابطه $$E = m c^{2}$$ یکسان دانست. به عبارت دیگر، ماهیت جرم، انرژی است. به عبارت دیگر اگر جرم کل مادهای در واکنشی به مقدار $$\triangle m$$ تغییر کند، مقدار انرژی آزاد شده یا جذب شده طبق رابطه $$E = \triangle m c^{2}$$ قابل محاسبه است.
لازم به ذکر است که انرژیهای هستهای غالباً برحسب مضربهایی از مگا الکترون ولت (MeV) بیان میشوند. در نتیجه، رابطه زیر را میتوانیم جهت تبدیل یکای جرم به انرژی به کار ببریم.
$$\large C^{2} = 931.494\ 013\ MeV / u$$
(7)
در فیزیک و مهندسی هستهای اغلب جرم اتم را به وسیله افزونی جرم اتم (atom’s mass excess) به کار میبرند. افزونی جرم اتم که غالباً با نماد Δ نمایش داده میشود، به صورت زیر قابل محاسبه است. در این رابطه، $$M$$ جرم واقعی اتم (برحسب amu) و $$A$$ عدد جرمی هسته اتم است.
$$\large \triangle = M - A$$
(8)
انرژیهای بستگی هستهای (Nuclear Binding Energies)
در بخش قبل به هنگام محاسبه جرم هسته اتم یا نوکلید $$^{197} Au$$ دیدیم که مقدار به دست آمده ($$197u$$)، کمی بیشتر از مقدار واقعی آن ($$196.966552u$$) بود. در واقع جرم هسته اتم ($$M$$) از مجموع جرم تک تک پروتون و نوترونهای آن ($$\sum m$$) کمتر است.
مطابق با رابطه همارزی جرم و انرژی، انرژی جرمی هسته اتم $$M c^{2}$$ از انرژی جرمی کل $$\sum m c^{2}$$ (مجموع پروتون و نوترونهای فردی) کمتر است. اختلاف این دو انرژی، به انرژی بستگی هستهای موسوم است که آن را با $$\triangle E_{be}$$ نمایش میدهند. یعنی:
$$\large \triangle E_{be} = \sum ( m c^{2} ) - M c^{2}$$
(9)
نکته مهمی که در اینجا باید به آن توجه داشته باشید، این است که انرژی بستگی هستهای، انرژی نیست که در هسته اتم یا نوکلید وجود داشته باشد. این انرژی، صرفاً اختلاف انرژی جرمی هسته اتم ($$M c^{2}$$) و انرژی جرمی نوکلئونهای ($$\sum m c^{2}$$) آن است. به عبارت دیگر، میتوان گفت که اگر بتوانیم هسته اتم یا نوکلید را به نوکلئونهای آن تجزیه کنیم، در واقع هر نوکلئون (پروتون یا نوترون) آن را جدا کنیم، باید به آن انرژی برابر با $$\triangle E_{be}$$ منتقل کنیم.
انرژی بستگی هستهای معیاری مناسب جهت درک چگونکی پایداری هسته اتم است و نشان میدهد که تجزیه هسته اتم به نوکلئونهایش بسیار دشوار است.
انرژی بستگی بر نوکلئون
معیاری بهتر جهت سنجش پایداری یا انسجام هسته، انرژی بستگی بر نوکلئون (binding energy per nucleon) است که آن را با $$\triangle E_{ben}$$ نمایش میدهند.
جهت محاسبه $$\triangle E_{ben}$$، میتوانیم انرژی بستگی هسته ($$\triangle E_{be}$$) را بر عدد جرمی $$A$$ آن تقسیم کرد. یعنی:
$$\large \triangle E_{ben} = \frac{ \triangle E_{be} }{ A }$$
(10)
در واقع، $$\triangle E_{ben}$$ انرژی را میتوان متوسط انرژی لازم جهت تجزیه یک هسته یا نوکلید به نوکلئونهایش در نظر گرفت.
در نمودار شکل (14)، انرژی بستگی بر نوکلئون بر حسب عدد جرمی $$A$$ برای چندین هسته اتم یا نوکلید رسم شده است.
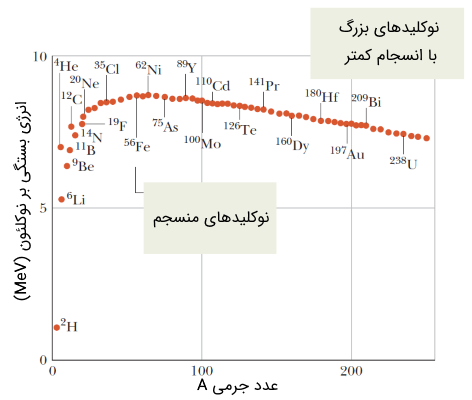
همانطور که در شکل فوق مشخص است، نوکلیدهایی که در قسمت بالایی نمودار قرار دارند دارای انرژی بستگی بر نوکلئون بیشتری بوده و در واقع پایدارتر، منسجمتر یا همبستهتر هستند.
نوکلید نیکل $$^{62} Ni$$ دارای بالاترین انرژی بستگی بر نوکلئون در حدود $$8.79460\ MeV/nucleon$$ است. ذره آلفا یا همان نوکلید هلیوم، به نسبت همسایهاش لیتویم $$^{6} Li$$ دارای انرژی بستگی بیشتری بوده و پایدارتر است.
تحلیل نمودار
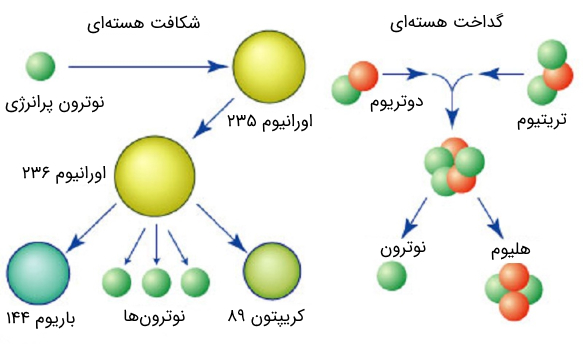
هستههای اتم یا نوکلیدهایی که در سمت راست و انتهای نمودار قرار دارند، دارای انسجام کمتری نسبت به نوکلیدها در قله نمودار هستند. این نوکلیدها نظیر اورانیوم 238، میتوانند به دو نوکلید سبکتر، واقع در نقاط مرکزی نمودار تجزیه شوند. چنین فرآیندی به شکافت هستهای (fission) موسوم است.
شکافت هستهای به طور خودبهخودی (بدون نیاز به انرژی اولیه) در هستههای سنگین (عدد جرمی بالا) نظیر اورانیوم 237 میتواند رخ دهد. فرآیند شکافت هستهای در سلاحهای هستهای که در آنها تعداد زیادی اورانیوم (uranium) یا پلوتونیوم (plutonium) یکباره شکافته میشوند، انرژی بسیار زیادی را تولید میکند.
عکس عمل شکافت هستهای که معنی شکافته شدن هسته اتم یا نوکلید و تجزیه آن به نوکلیدهای سبکتر است، گداخت یا همجوشی هستهای (fusion) نام دارد. هسته اتم یا نوکلیدهای سبکتر که در سمت چپ نمودار شکل (14) قرار دارند، میتوانند با یکدیگر ترکیب شوند و هستهای سنگینتر را در نزدیکی قله نمودار تشکیل دهند. به عبارت دیگر هسته دو اتم به یکدیگر جوش میخورد. با توجه به مقدار عددی انرژی بستگی بر نوکلئون، بدیهی است که جهت رخ دادن فرآیند همجوشی هستهای، انرژی بسیار بالایی نیاز است. جهت آشنایی با تفاوتهای دو فرآیند هستهای شکافت و همجوشی به مقاله «تفاوت بین شکافت و همجوشی هستهای چیست؟» مراجعه فرمایید.
مثال: محاسبه انرژی بستگی بر نوکلئون
در این مثال قصد داریم تا با محاسبه انرژی بستگی بر نوکلئون هسته $$^{120} Sn$$ آشنا شویم. لازم به ذکر است این محاسبات ساده برای هر هسته یا نوکلیدی کاربرد دارند.
مطابق با رابطه (10)، با تقسیم انرژی بستگی $$\triangle E_{be}$$ بر عدد جرمی $$A$$ میتوانیم انرژی بستگی بر نوکلئون $$\triangle E_{ben}$$ را محاسبه کنیم. در بخشهای فوق دیدیم که انرژی بستگی برابر با اختلاف انرژی جرمی هسته ($$M c^{2}$$) و انرژی جرمی کل نوکلئونهای تشکیل دهنده هسته ($$\sum m c^{2}$$) است. یعنی:
$$\large \triangle E_{ben} = \frac{ \triangle E_{be} }{ A } = \frac{ \sum ( m c^{2} ) - M c^{2} }{ A }$$
(11)
با توجه به جدول (1) یا چارت نوکلیدی، هسته $$^{120} Sn$$ دارای عدد پروتونی $$Z = 50$$ و عدد نوترونی $$N = 70$$ است. بدیهی است که عدد جرمی نیز برابر با $$A = Z + N = 120$$ است. به عبارت دیگر، هسته یا نوکلید از ۵۰ پروتون منفرد و ۷۰ نوترون منفرد تشکیل شده است.
$$\large ( ^{120} Sn\ Nucleus )\ \rightarrow\ 50 ( Separate\ Protons ) + 70 ( Separate\ Neutrons )$$
(12)
حال نیاز داریم تا مقادیر فوق را جهت محاسبه جرم هسته $$^{120} Sn$$، به صورت انرژی جرمی بیان کنیم. همانطور که پیشتر اشاره کردیم، اندازهگیری جرم اتم خنثی (هسته + الکترونها) از اندازهگیری جرم هسته آسانتر بوده و از این حیث به طور قرارداری انرژیهای بستگی را با جرمهای اتمی بیان میکنند. با این اوصاف سمت چپ رابطه (12) را به صورت یک اتم خنثی $$^{120} Sn$$ در نظر میگیریم.
بدین منظور جهت سازگاری و ایجاد تعادل با 50 پروتونی که در سمت راست رابطه وجود دارد، ۵۰ الکترون به سمت چپ رابطه مذکور اضافه میکنیم. این ۵۰ الکترون با ۵۰ پروتون ترکیب شده و ایجاد ۵۰ اتم منفرد هیدروژن میکنند. در نتیجه:
$$\large ( ^{120} Sn\ Atom )\ \rightarrow\ 50 ( Separate\ H Atoms ) + 70 ( Separate\ Neutrons )$$
(13)
از جدول (1) یا چارت نوکلیدی جرم اتم $$^{120} Sn$$ برابر با $$119.902197u$$ و جرم اتم هیدروژن برابر با $$1.007825u$$ است. با توجه به رابطه (9) و جایگذاری جرم نوترون برحسب $$amu$$ داریم:
$$\large \begin{equation} \begin{aligned} \Delta E_{ \mathrm{be} } &= \Sigma \left( m c^{2} \right ) - M c^{2} \\ &= 50 \left( m_{ \mathrm{H} } c^{2} \right ) + 70 \left( m_{\mathrm{n}} c^{2} \right ) - M_{\mathrm{sn}} c^{2} \\ &= 50 ( 1.007825 \mathrm{u} ) c^{2} + 70 ( 1.008665 \mathrm{u}) c^{2} \\ &-(119.902197 \mathrm{u}) c^{2} \\ &= (1.095603 \mathrm{u}) c^{2} \end{aligned}\end{equation}$$
(14)
با توجه به رابطه (7) و جایگذاری مقدار $$c^{2}$$ انرژی بستگی به صورت زیر نتیجه میشود:
$$\large \triangle E_{be} = 1.095603\ u \times 931.494013\ \frac{ MeV }{ u } = 1020.5\ MeV$$
(15)
حال به سادگی با تقسیم $$\triangle E_{be}$$ بر عدد جرمی $$A = 120$$ انرژی بستگی بر نوکلئون را محاسبه میکنیم. همانطور که پیشتر اشاره کردیم، این انرژی به هر نوکئون منفرد (پروتون یا نوترون منفرد) در هسته یا نوکلید وارد میشود.
$$\large \triangle E_{ben} = \frac{ \triangle E_{be} }{ A } = \frac{ 1020.5\ MeV }{ 120\ Nucleon } = 8.50\ MeV / Nucleon$$
(16)
ترازهای انرژی هسته اتم
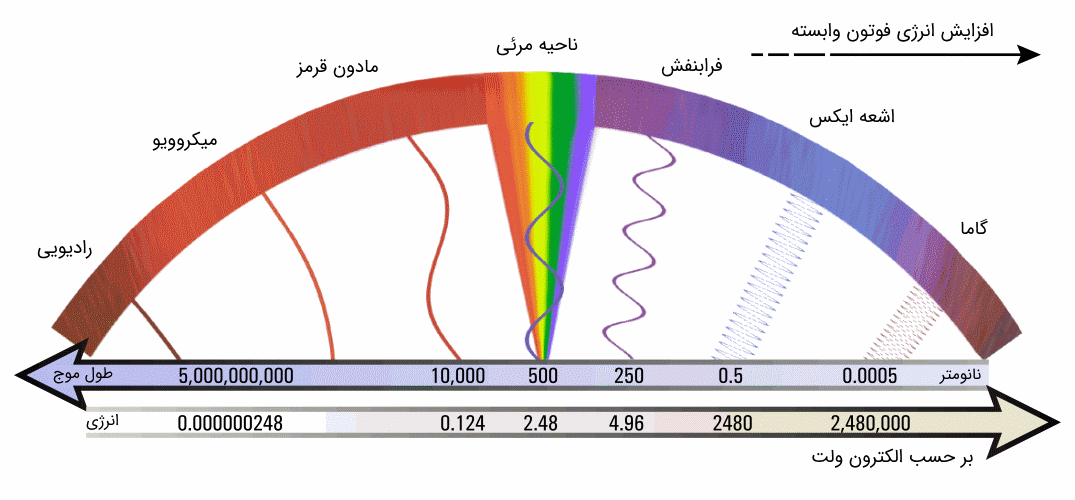
انرژی هسته اتم، همانند انرژی خود اتم (انرژی الکترونها) به صورت گسسته یا کوانتیده است. به عبارت دیگر، هسته اتم تنها میتواند مقداری کوانتیده و معینی از انرژی را داشته باشد. شکل زیر، ترازهای کوانتیده انرژی را برای نوکلید کمجرم $$^{28} Al$$ نشان داده است.
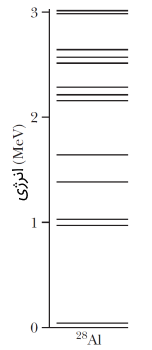
همانطور که در شکل فوق، مشاهده میکنید، انرژی ترازهای هسته اتم در مرتبه مگا الکترون ولت هستند. این در حالی است که ترازهای انرژی الکترون برای اتمها در مرتبه الکترون ولت است. در خصوص اتمها دیدیم که اگر الکترون بین ترازهایی با انرژی مشخص گذار انجام دهد، فوتونی (بسته انرژی) با انرژی اختلاف دو تراز، تابش میکند. در خصوص هستههای اتم نیز این امر صادق است. با توجه به اختلاف انرژی دوتراز در هسته اتم، اگر نوکلئونی بین ترازها گذار انجام دهد، انرژی فوتون تابش شده در محدوده امواج الکترومغناطیسی با فرکانس بسیار بالای گاما است.
خاصیت مغناطیسی هسته اتم
هسته اتم یا نوکلیدها نیز دارای اسپین (spin) یا تکانه زاویهای هستهای ذاتی (intrinsic nuclear angular momentum) هستند و گشتاور مغناطیسی هستهای ذاتی (intrinsic nuclear magnetic moment) وابسته دارند. تکانه زاویهای هسته از نظر بزرگی تقریباً برابر با تکانه زاویهای الکترونها در اتم است.
اما گشتاور مغناطیسی هستهای، بسیار کوچکتر از گشتاورهای مغناطیسی اتمی هستند.
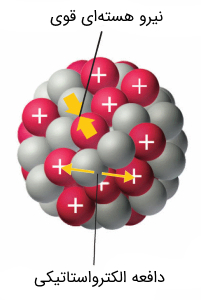
نیروی هستهای
همانطور که میدانید، پروتونها دارای بار مثبت هستند. در نتیجه مطابق با قانون کولن بر یکدیگر نیروی دافعه وارد میکنند. از آنجایی که فاصله میان این پروتونها در هسته اتم، بسیار کوچک است، اندازه این نیرو دافعه مطابق رابطه قانون کولن بزرگ میشود. سوالی که در اینجا مطرح میشود، این است که چگونه پروتونها در هسته اتم با وجود چنین نیروی دافعهای کنار یکدیگر جای گرفتهاند؟!
در حال حاضر مباحث فیزیک هستهای و ذرات بنیادی بیان میکنند که نیروی هستهای که نوترون و پروتونها را کنار یکدیگر در حجم بسیار کوچکی کنار یکدیگر نگه داشته است، نیرویی کوتاهبرد (short range) بوده و از سطح هسته فراتر نمیرود. نیروی مذکور، نیرویی بنیادی و طبیعی نیست. بلکه نیرویی ثانویه یا اثری سرریز (spillover) شده از نیرویی بسیار قوی (strong force) است که کوارکها (quarks) را به یکدیگر پیوند میزند.
به بیان ساده، پروتونها و نوترونها برخلاف الکترونها، ذرات بنیادی نبوده و خود از کوارکها تشکیل شدهاند.
جهت مفهومتر شدن اثر سرریز شده، مثال جاذبه میان مولکولهای خنثی را در نظر بگیرید. این نیروی جاذبه، اثری سرریز شده از نیروی الکتریکی کولنی است که درون هر مولکول میان اتمها وجود دارد.
چگالی ماده هستهای
در برخی از مراجع به هسته اتم یا نوکلیدها که از تعدادی پروتون و نوترون ساخته شدهاند، ماده هستهای میگویند. از این حیث چگالی ماده هستهای (Density of nuclear matter) برای نوکلیدها تعریف میشود. در ادامه قصد داریم تا به این موضوع بپردازیم.
بر اساس تعریف چگالی در فیزیک پایه، چگالی یک هسته یا نوکلید را میتوان از تقسیم جرم هسته بر حجمش محاسبه کرد ($$\rho = \frac{ m }{ V }$$).
از آنجایی که جرم ذره پروتون با جرم ذره نوترون تقریباً برابر است، میتوان جرم هر یک را برابر با $$m$$ فرض کرد. از آنجایی که هسته یا نوکلید به تعداد عدد جرمی $$A$$ دارای نوکلئون (پروتون و نوترون) است، جرم کل هسته را میتوان به صورت $$Am$$ بیان کرد. با کروی فرض کردن هسته داریم:
$$\large \rho = \frac{ m }{ V } = \frac{ Am }{ \frac{ 4 }{ 3 } \pi r^{3} }$$
(17)
با توجه به رابطه (4)، شعاع $$r = r_{0} A^{1 / 3}$$ را در رابطه فوق جایگذاری میکنیم. در نتیجه:
$$\large \rho = \frac{ m }{ V } = \frac{ Am }{ \frac{ 4 }{ 3 } \pi r_{0}^{3} A} = \frac{ m }{ \frac{ 4 }{ 3 } \pi r_{0}^{3} }$$
(18)
همانطور که ملاحظه کردید، عدد جرمی $$A$$ (تعداد نوکلئونها) از رابطه فوق حذف شد. به عبارت دیگر رابطه فوق برای هر نوکلیدی که شعاع آن را بتوان از رابطه $$r = r_{0} A^{1 / 3}$$ محاسبه کرد، صادق است. با جایگذاری جرم تقریبی هر نوکلئون داریم:
$$\large \rho = \frac{ 1.67 \times 10^{ - 2 7 }\ kg }{ \frac{ 4 }{ 3 } \pi \times ( 1.2 \times 10^{ - 1 5 }\ m )^{3} } \approx 2 \times 10^{17} kg/m^{3}$$
(19)
از مقدار عددی فوق پی میبریم که چگالی ستارههای نوترونی که تنها از نوترونها تشکیل شدهاند، چقدر زیاد است.
اگر این مطلب برای شما مفید بوده است، آموزشهای زیر نیز به شما پیشنهاد میشوند:
- مجموعه آموزشهای فیزیک
- آموزش فیزیک مدرن با رویکرد حل مساله
- مجموعه آموزشهای شیمی
- آموزش نظریه اتم ها در مولکول ها با نرم افزار محاسباتی AIM2000
- پله پتانسیل (Potential Step) — به زبان ساده
- طیف الکترومغناطیسی -- به زبان ساده
- میزر (Maser) -- به زبان ساده
^^











با سلام
لطفا به سوالات مخاطبان توجه کنید
منبع اصلی طوفان های خورشیدی کجای آن است؟
آیا ستاره های نوترونی پاد ماده در داخل خود تولید می کنند یا بعدا در اطراف سیاه چاله ها وستاره های نوترونی این ماده اسرارآمیز تشکیل می شود؟
آیا گرمای سطح خورشید ناشی از فعل وانفعالات هسته ی آن یاداخل این ستاره (اطراف هسته)می باشد؟
درخورشید چند نوع انرژی هسته ای موجود است؟
نیروی هستهای چه مقدار با انرژی هسته ای متناوب است؟