استیک اسید چیست؟ – به زبان ساده + فرمول و کاربرد
استیک اسید به خانواده کربوکسیلیک اسید تعلق دارد و از آن در صنعت یا در مواد خوراکی مانند سرکه استفاده میشود. اسید استیک با نامهای دیگری مانند اتانوییک اسید یا جوهر سرکه شناخته میشود و در دسته اسیدهای ضعیف قرار میگیرد. البته با وجود اینکه این اسید قدرت بالایی ندارد اما در صورتیکه غلظت آن بالا باشد میتواند برای ریه، چشمها، بینی و گلو خطرناک باشد. در این مطلب برای اینکه بیشتر با استیک اسید آشنا شوید به ساختار، خواص فیزیکی و شیمیایی آن ازجمله pH، کاربرد و همچنین رعایت نکات ایمنی به هنگام استفاده از این اسید میپردازیم.
- ساختار مولکولی و ویژگیهای شیمیایی استیک اسید را یاد میگیرید.
- روشهای صنعتی و زیستی تولید استیک اسید را خواهید آموخت.
- با کاربردهای خانگی و صنعتی اسید استیک آشنا میشوید.
- میآموزید واکنشهای مهم شیمیایی اسید استیک چگونه انجام میشوند.
- نکات ایمنی و خطرات احتمالی کار با اسید استیک را یاد خواهید گرفت.
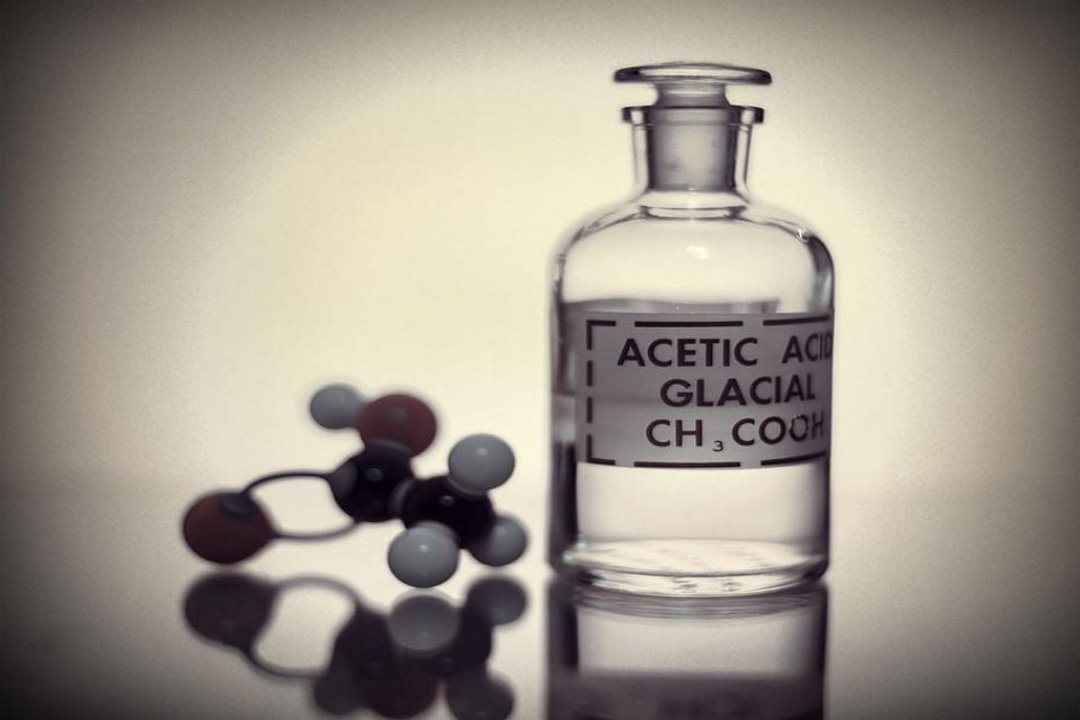
استیک اسید چیست ؟
ماده آلی اتانوییک اسید مایعی بیرنگ است که بوی تندی دارد و با فرمول شیمیایی نمایش داده میشود. البته فرمول اتانوییک اسید با حالتهای دیگر ، و نیز نمایش داده می شود. در این فرمولها گروه عاملی COOH خانواده کربوکسیلیک اسید را نشان میدهند.
این اسید نام خود را از کلمه لاتین «acetum» به معنای سرکه گرفته است و بلور یا کریستال آن استات نام دارد. این اسید از اتصال یک هیدروکربن متیل به کربوکسیل تشکیل شده و به همین دلیل در دسته ترکیبات آلی به شمار میرود. اتانوییک اسید با یک نماد رایج به نام AcOH نشان داده میشود.

استیک اسید گلاسیال چیست ؟
در صورتیکه غلظت اتانوییک اسید بالا و مقدار آب در محلول آن کم باشد یعنی دیگر رقیق نباشد به آن «استیک اسید گلاسیال» (Glacical acetic acid) یا استیک اسید گلایسیال میگویند. یعنی اگر غلظت استیک اسید به ۹۹/۵٪ باشد به آن استیک اسید گلاسیال گفته میشود. ازجمله ویژگیهای مهم اسید گلاسیال میتوان به خورنده بودن آن اشاره کرد.
نقطه جوش و ذوب اسید گلاسیال به ترتیب برابر با ۱۱۷/۹ درجه سانتیگراد (۲۴۴/۲ فارنهایت) و ۱۶/۶ درجه سانتیگراد (۶۱/۹ فارنهایت) هستند. در اسید گلاسیال چیزی حدود یک درصد آب دارد در حالیکه اسید استیک بسیار رقیق است (یعنی حجم آب در آن بالاست). گلاسیال اسید در صنعت کاربردهای بسیار متنوعی دارد که ازجمله آنها میتوان به دو مورد زیر اشاره کرد:
- حضور گلاسیال اسید به عنوان مواد اولیه برای تولید سایر محصولات
- در نقش حلال برای تهیه سایر محصولات شیمییایی
ساختار استیک اسید
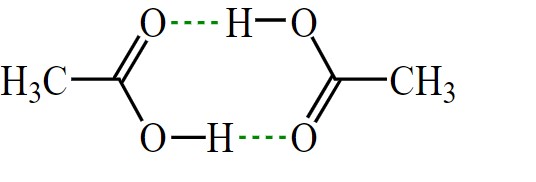
در اتانوییک اسید جامد مولکولها زنجیره را ایجاد میکنند و مولکولهای مجزا از طریق پیوندهای هیدروژنی به هم متصل میشوند. وجود پیوند هیدروژٰنی سبب میشود که اتانوییک اسید در فاز بخار در دمای ۱۲۰ درجه سانتی گراد (۲۴۸ فارنهایت) باعث تشکیل دیمرها شود. البته دیمرها تحت شرایط خاص در فاز مایع - محلولهای رقیق با حلالهایی که پیوند در آنها از نوع هیدروژنی نیست - نیز تشکیل میشوند.
در تصویر زیر دیمرهای مربوط به اسید استیک آورده شده که خطچینهای سبزرنگ مربوط به پیوندهای هیدروژنی است.
اتانوییک اسید، مونوکربوکسیلیک اسید آلی ساده است که ۲۴ الکترون ظرفیت دارد. از این ۲۴ الکترون ۸ جفت الکترون به اشتراک گذاشته میشوند و ۱۶ الکترون پیوندی هستند. در این صورت ساختار لوییس اتانوییک اسید به شکل زیر خواهد بود.
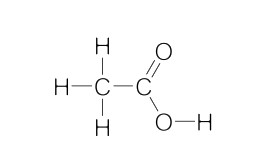
همان طور که در تصویر فوق مشخص است در این ساختار پیوندهای C-H، C-C، O-H، C-O و C=O وجود دارد. هیبریداسیون کربن و کربن به ترتیب و است.
خواص فیزیکی و شیمیایی استیک اسید
در جدول زیر مهمترین خواص فیزیکی و شیمیایی اسید استیک به صورت خلاصه فهرست شده است.
| نام اسید | استیک اسید یا اتانوییک اسید یا جوهر سرکه |
| شکل هندسی | صفحات تریگونال و تتراهدرال |
| فرمول شیمیایی رایج | |
| نقطه اشتعال (درجه سانتیگراد) | ۴۰ |
| نقطه ذوب (درجه سانتیگراد) | ۱۶/۶ |
| نقطه جوش (درجه سانتیگراد) | ۱۱۷/۹ |
| چگالی () | ۱/۰۴۹ |
| جرم مولی () | 60/1 |
| درجه انحلالپذیری در آب | در آب به خوبی حل میشود. |
| pH (محلول یک مولار) | ۲/۴ |
معادله یونش استیک اسید
هیدروژن مرکزی گروه کربوکسیل در کربوکسیلیک اسیدها ازجمله اتانوییک اسید میتواند از طریق معادله یونش که در زیر آورده شده است از مولکول جدا شود.
همانطور که در معادله فوق مشخص است در اثر این واکنش یک پروتون آزاد میشود پس در این صورت اسید استیک خاصیت اسیدی را دارد و یک مونوپورتیک اسید ضعیف به شمار میرود. در محلولهای آبی قدرت یونش اسید استیک برابر ۴/۷۶ است.
کاربردهای استیک اسید چیست ؟
اسید استیک در صنعت و مواد غذایی کاربردهای بسیاری دارد که متناسب با هر کاربرد شیوه تولید آن متفاوت خواهد بود. برخی از مهمترین کاربردهای این اسید عبارتند از:
تهیه غذا: سرکه یک ماده غذایی رایج در خانههاست که اتانوییک اسید یکی از اجزای اصلی آن به شمار میرود. اغلب از سرکه برای ترشی و چاشنی در سالادها استفاده می کنند. همچنین از سرکه میتوان در تهیه غذاهای گوشتی به عنوان عاملی برای کنترل آلودگی آنها استفاده کرد.
شستشو و تمیزکنندگی: جوهر سرکه در بسیاری از منازل به عنوان پاککننده برای پنجرههای شیشه، قهوهسازها و غیره به کار میروند. همچنین به عنوان عاملی برای از بین بردن میکروبها از سطوح ظرفها در ماشین ظرفشویی و همچنین سرویس بهداشتی مورد استفاده قرار میگیرد.

علفکش: اسید استیک با غلظتهای ۱۰ تا ۲۰ درصد میتواند به عنوان علفکش برای علفهای هرز در باغچهها و چمنها مورد استفاده قرار بگیرد. زمانیکه جوهر سرکه به عنوان علفکش به کار میرود تنها علفهای هرز را از بین میبرد و روی ریشه آن ها تاثیری نمیگذارد بنابراین علفها امکان رشد دوباره دارند.
کاربردهای صنعتی اسید گلاسیال
کاربردهای صنعتی اسید گلاسیال عبارتند از:
- وینیل استات، فایبرهای سلولوزی و پلاستیکها: از اسید استیک برای تهیه بسیاری از مواد شیمیایی ازجمله وینیل استات، «استیک انیدرید» (acetic anhydride) - اسیدی که آب ندارد و در حضور آب به همان اسید استیک تبدیل میشود. - و استرهای استات استفاده میشود.
- وینیل استات برای تولید پلیوینیل استات - پلیمری که در رنگها، چسبندهها، پلاستیکها و نساجی به کار میرود- مورد استفاده قرار میگیرد.
- استیک انیدرید برای ساخت فایبرهای سلولوز استات و پلاستیکهایی که برای فیلمهای عکاسی مورد استفاده قرار میگیرند به کار میرود.
- اسید استیک همچنین در واکنش شیمیایی برای تولید اسید ترفتالیک (PTA) که برای ساخت رزین پلاستیک PET به کار میرود، شرکت میکند. این رزین پلاستیکی در ساخت فایبرها، ظرفهای نگهداری غذا، بطریهای نوشابه و سایر نوشیدنیها و همچنین فیلمهای پلاستیکی کاربرد دارد.
- حلالها: اسید استیک همانند اتانول یک حلال آبدوست است و همه ترکیباتی را مانند خاک، گوگرد، ید، کلورفروم، هگزان و ترکیباتی که با آب حل می شوند را در خود حل میکند.
- داروسازی و ویتامینها: در صنعت داروسازی برای تولید ویتامینٰها، آنتیبیوتیکها، هورمونها و سایر محصولات از اسید استیک استفاده میشود.
- صنایع غذایی: اسید استیک اغلب به عنوان پاککننده و ضدعفونیکننده در کارخانههای مواد غذایی مورد استفاده قرار میگیرد.
- سایر کاربردها: نمکهای اسید استیک، انواع لاستیکها و مواد شیمیایی عکاسی از اسید استیک ساخته شدهاند. اتانوییک اسید و نمک سدیم آن معمولا به عنوان نگهدارنده غذایی در صنایع غذایی کاربرد دارد.
واکنشهای مهم اسید استیک اسید
در این قسمت به برخی از واکنشهای مهم اتانوییک اسید با سایر ترکیبات شیمیایی مانند جوش شیرین یا اتانول میپردازیم تا بیشتر بتوانید با شیمیایی این اسید آشنا شوید.
واکنش استیک اسید با جوش شیرین
این نوع واکنش از نوع واکنش جانشینی دوگانه (ترکیب اسید و باز) است زیرا جوش شیرین خاصیت اسیدی و بازی دارد. در اثر این واکنش گاز کربن دیاکسید و به عنوان نمک استات تشکیل میشود. گاز کربن دیاکسید باعث ایجاد کف خواهد شد که در تصویر زیر این کف به خوبی نشان داده شده است.

در واکنش زیر همانطور که مشاهده میشود جای با عوض میشود که در اثر این جابجایی به وجود میآید.
واکنش تجزیه
زمانیکه دمای اتانوییک اسید در اثر حرارت دیدن به ۴۴۰ درجه سانتیگراد میرسد واکنش تجزیه رخ میدهد. در اثر تجزیه، کربن دیاکسید و متان یا «اتنون» (Ethenone) و آب تشکیل میشود که در واکنشهای زیر نشان داده شدهاند.
واکنش اسید استیک با آب
ترکیب اسید استیک با آب در زیر آورده شده است. در اثر این واکنش هیدروژن موجود در اسید آزاد میشود و با آب وکنش میدهد. طی این واکنش، یون هیدرونیوم و اتانوات آزاد میشوند.
واکنش اتانول و اسید استیک
در واکنش زیر ترکیب اتانوییک اسید را با اتانول نشان میدهد که اغلب این واکنش در حضور سولفوریک اسید به عنوان کاتالیست انجام میشود. در اثر این واکنش اتیل اتانوات (اتیل استات) به عنوان استر با فرمول شیمیایی و آب تشکیل میشوند.
در این واکنش:
- سولفوریک اسید (H_2SO_4) به عنوان کاتالیست نقش دارد.
- زمانیکه در لوله آزمایش به اتانوییک اسید، اتانول و سولفوریک اسید اضافه میشود باید به کف لوله چند ضربه وارد کرد تا همه این مواد به خوبی در هم ترکیب شوند.
- لوله آزمایش حاوی مخلوط فوق را باید به یک بشر حاوی آب که بر روی هیتر آمایشگاهی (حمام آب گرم) قرار دارد انتقال داد. لوله آزمایش به مدت ۵ دقیقه باید در این حالت بماند.
- سپس لوله آزمایش را از بشر باید خارج کرد و محتویات آن را به درون بشر حاوی آب ریخت.
- در نهایت لایهای انحلالناپذیر در آب بر روی سطح آب تشکیل میشود. این لایه همان استر است که بوی شیرینی هم دارد.
واکنش اسید استیک با سود
در این واکنش ابتدا مقداری از سدیم هیدروکسید (باز قوی) در لوله آزمایش ریخته میشود. سپس به آن محلول فنول فتالئین ـ شناساگر برای تیتراسیون است - را اضافه میکنند و همانطور که در تصویر زیر نشان داده شده است رنگ آن بنفش میشود.

در نهایت مقداری از اتانوییک اسید به محلول بنفشرنگ اضافه می شود. همانطور که در تصویر زیر مشخص است با افزودن اتانوییک اسید رنگ بنفش محو میشود. به این واکنش، واکنش خنثی شدن میگویند. از آنجا که سدیم هیدروکسید به عنوان باز قوی عمل میکند همه یونهای جدا شده از اسید را خنثی میکند و pH محلول را بالا میبرد.
این واکنش ترکیبی اسید و باز از نوع ترکیب باز قوی با اسید ضعیف است و به این دلیل که قدرت یونش اتانوییک اسید پایینتر از قدرت یونش سدیم هیدروکسید است pH محلول بازی خواهد شد.

واکنش خنثی شدن این اسید و باز در زیر نشان داده شده است.
واکنش اتانوییک اسید با منیزیم
برخی از فلزات مانند منیزیم، روی و آهن زمانیکه در معرض اسید استیک قرار بگیرند دچار خوردگی میشوند. در اثر این واکنش نمکهای استات به وجود میآیند. واکنش منیزیم با اتانوییک اسید در زیر نشان داده شده است.
در واکنش فوق منیزیم استات است.
واکنش اسید استیک با فلزات قلیایی
فلزات قلیایی با اسید استیک واکنش میدهند و نمکهای استات تشکیل میدهند، در واکنش زیر واکنش مربوط به پتاسیمهیدروکسید با اسید استیک نشان داده است.
روشهای تولید استیک اسید
اتانوییک اسید ضعیف به روشهای مختلفی تولید میشود که در ادامه به معرفی برخی از این روشها میپردازیم. ازجمله روشهای تولید اتانوییک اسید میتوان به روشهای زیر اشاره کرد:
کربونیلاسیون متانول
یکی از روش های رایج تولید اتانوییک اسید، کربونیلاسیون متانول است. در این روش متانول و کربن مونوکسید با هم واکنش میدهند تا اتانوییک اسید طبق معادله شیمیایی که در زیر آورده شده است تولید شود. این فرایند شامل متیل یدید یا یدومتان است و طی سه مرحله اسید استیک را تولید میکند.
نکتهای که درباره این روش وجود دارد این است که کمپلکس کربونیل فلز باید به عنوان کاتالیست برای مرحله دوم مورد استفاده قرار بگیرد. سه مرحله واکنش در کربونیلاسیون متانول به صورت هستند.
دو فرایند مربوط به کربونیلاسیون متانول وجود دارند که عبارتند از: کاتالیست روبیدیم و کاتالیست ایریدیم. فرایند اولی با نام «فرایند مونسانتو» (Monsanto process) و دیگری با نام « فرایند کاتیوا» (Cativa process) شناخته میشود.

فرایند کاتیوا نسبت به فرایند مونسانتو از لحاظ تولید آلاینده، آلاینده کمتری ایجاد میکند و بازدهی بالاتری دارد. به همین دلیل نسبت به فرایند مونسانتو برای تولید اسید استیک بیشتر کاربرد دارد.
در هر دو فرایند از آب استفاده میشود اما مقدار آن در فرایند کاتیوا کمتر است به همین دلیل واکنش آب - گاز کمتر رخ میدهد و محصولات کمتری را تولید میشود. یعنی در این حالت مقدار اسید استیک کمتری تولید میشود. با تغییر شرایط واکنشی میتوان اسید گلایسیال را در همان کارخانه با روش کاتالیست روبیدیم تولید کرد.
اکسایش استالدهید
قبل از اینکه فرایند مونسانتو به یک روش تجاری برای تولید جوهر سرکه تبدیل شود، اسید استیک را اغلب با روش اکسایش استالدهید تولید میکردند. این روش بعد از کربونیلاسیون متانول دومین روش مهم و پرکاربرد برای تولید این اسید محسوب میشود البته همچنان با روش قبلی از قابل رقابت نیست. استالدهید میتواند توسط هیدراسیون «استیلین» (Asetylene) به وجود آید.
ترکیبات نفتا یا بنزین سبک به آسانی توسط اکسیژن یا هوا اکسیده میشوند و پراکسید را تولید میکنند که در اثر تجزیه شدن به اسید استیک طبق واکنش شیمیایی زیر تبدیل میشود. ترکیب زیر مربوط به هیدروکربن بوتان است.
در این واکنش دما و فشار به ترتیب برابر ۱۵۰ درجه سانتیگراد (۳۰۲ فارنهایت) و ۵۵ اتمسفر است. اصولا در چنین واکنشهایی دما و فشار به گونهای است که بوتان در حالت مایع نگه داشته میشود. برخی از ترکیبات برای انجام فرایند اکسایش نیاز به کاتالیستهای فلزی دارند ازجمله این ترکیبات میتوان به نمکهای نفتانت مانند منگنز، کبالت و کروم اشاره کرد.

محصولات جانبی واکنش فوق که ممکن است تشکیل شوند شامل بوتانون، اتیل استات، اسید مورچه و اسید پروونیک هستند. این محصولات جانبی از لحاظ اقتصادی و تجاری ارزش دارند و شرایط واکنش ممکن است با هدف تولید بیشتر این محصولات در صورت نیاز تغییر کند.
البته جداسازی اتانوییک اسید از محصولات واکنشی هزینه این روش تولید را بالا میبرد. استیل استات، اسید مورچه و فرمالدهید نقطه جوش کمتری از اسید استیک دارند و این موضوع باعث میشود این محصولات به راحتی توسط فرایند تقطیر از اسید استیک جدا شوند.
استفاده از کاتالیستهای مدرن باعث میشود بازده تولید اسید استیک با استفاده از این روش بالاتر برود (بیش از ۹۵٪).
اکسایش اتیلن
استالدهید ممکن است که توسط اتیلن به وسیله «فرایند واکر» (Wacker process) تولید شود و در نهایت همانند واکنش فوق اکسیده شود. این فرايند معمولا در حضور یک کاتالیست ازجمله پالادیوم و پلیاسید ناهمگن صورت میگیرد.
تخمیر اکسیداتیو
باکتریهای خانواده «استوباکتر» (Acetobacter) اسید استیک را به شکل جوهر میتوانند تولید کنند. این باکتریها در حضور اکسیژن به مقدار کافی میتوانند از غذاهای تخمیری سرکه را تولید کنند. مواد غذایی تخمیری شامل سیب، مالت، برنج، غلاتهای تخمیر شده و سیبزمینی میتوانند باشند. صورت کلی واکنشهای شیمیایی که توسط این باکتریها صورت میگیرد به صورت زیر است:
محلول رقیق الکل با استوباکتر ترکیب و در مکانی گرم که هوا در آن جریان دارد نگهداشته میشود. بعد از چند ماه طی این واکنش سرکه به وجود میآید. کارخانههایی که سرکه را به این روش در مقیاس صنعتی تولید میکنند سرعت این فرایند را توسط دمیدن اکسیژن به باکتری بالا میبرند.

تخمیر بیهوازی
گونههایی از باکتریهای بیهوازی ازجمله خانواده باکتریهای «کلوستریدیوم» (Clostridium) یا «استوباکتریوم» (Acetobacterium) میتوانند قندها را به صورت مستقیم و بدون استفاده از اتانول به عنوان واسطه به اسید استیک تبدیل کنند. واکنشی که برای تولید اسید استیک توسط این باکتری صورت میگیرد در زیر آورده شده است:
این باکتریهای «استوژنیک» (Acetogenic) اسید استیک را به وسیله ترکیبات یک کربندار شامل متانول، کربن مونوکسید یا ترکیبی از کربن دیاکسید و هیدروژن تولید میکنند. واکنش کربن دیاکسید با هیدروژن در زیر آورده شده است.
قدرت باکتریهای کلوستریدیوم برای متابولیسم قند به طور مستقیم حاکی از این است که این دسته از باکتریها در مقایسه با اکسیدکنندههای اتانول مانند استوباکتر عملکرد بهتری را برای تولید اسید استیک از خود نشان میدهند. اگرچه، باکتری کلوستریدیوم مقدار اسید استیک کمتری را در مقایسه با استوباکتر تولید میکند.
خطرات اسید استیک برای بدن
در صورتی که اتانوییک اسید غلیظ باشد به دلیل خورندگی بالا برای پوست بسیار خطرناک است زیرا موجب سوختگی پوست میشود.
استنشاق کردن بخارات اسید استیک با غلظت 10 ppm به مدت طولانی (۸ ساعت به بالا) میتواند چشمها، بینی، ریه و گلوی فرد را تحریک کند. بنابراین زمانی که با این اسید به خصوص با غلظتهای بالای آن سروکار دارید آن را زیر هود قراردهید و همه فرایندهای آزمایشگاهی با این اسید را درزیر هود انجام دهید. علاوه بر این موضوع حتما به هنگام کار با اسید از وسایل ایمنی مانند دستکش، ماسک و عینکهای ایمنی استفاده کنید.
سوالات متداول در رابطه با استیک اسید
در این قسمت به سوالات متداولی که در رابطه با اسید استیک پرسیده میشود پاسخ داده شده است.
اسید استیک قطبی است یا ناقطبی ؟
قطبی. زیرا در ساختار این اسید پیوند دوگانه اکسیژن وجود دارد که الکترونگاتیوی آن از کربن بیشتر است. بنابراین اختلاف الکترونگاتیوی اکسیژن و کربن باعث تشکیل دوقطبی در پیوند اکسیژن- کربن میشود که این دو قطبی شامل بار مثبت و منفی آنهاست. همچنین اسید استیک ساختاری نامتقارن دارد بنابراین قطبی است.
آیا اسید استیک یک اسید قوی است؟
خیر. یک اسید ضعیف است. این اسید تنها در صورتی تمام یون هیدروژن خود را آزاد میکند که با یک باز قوی واکنش دهد.
استیک اسید چگونه تولید می شود ؟
اسید استیک به روشهای مختلف و متعددی میتواند در صنعت تولید شود. ازجمله این روشها میتوان به واکنش متانول با هیدروژن یدید و اضافه کردن کربن مونواکسید به محصول این واکنش یعنی متیل یدی اشاره کرد. در اثر این واکنش استیل یدید به وجود می آید که در نهایت در اثر هیدرولیز شدن آن، اتانوییک اسید حاصل میشود.
آیا استیک اسید همان جوهر سرکه است؟
جوهر سرکه محلولی از اسید استیک در آب بوده که ۵ تا ۸ درصد حجمی آن اسید است.
اسید استیک در کجاها کاربرد دارد ؟
اتانوییک اسید، اسیدی است که هم در صنایع غذایی و هم در صنعت کاربرد دارد اما به طور کلی بیشترین کاربرد آن در جوهر سرکه است. همچنین در صنعت بیشترین کاربرد آن برای تولید مونومر وینیل استات است که به اختصار به صورت VAM نشان داده شده است.
در ساختار لوییس اتانوییک اسید چند الکترون ظرفیت وجود دارد؟
در جوهر سرکه برای محاسبه تعداد الکترونهای ظرفیت باید الکترونهای ظرفیت هیدروژن، اکسیژن و کربن را محاسبه کرد. تعداد این الکترونها به ترتیب برابر ۴، ۶ و ۱ است. حال با ضرب کردن هر کدام از این الکترونها در تعداد اتم مربوطه، الکترونهای ظرفیت اتانوییک اسید برابر ۲۴ خواهد بود.
نحوه انحلالپذیری اسید استیک در آب چگونه است؟
جوهر سرکه یک مولکول قطبی است که یک سر آبدوست نیز دارد. از طرفی آب هم یک مولکول قطبی است. میدانیم که مولکولهای قطبی در قطبی حل میشوند پس میتوان گفت که جوهر سرکه در هر نسبتی در آب حل میشود.
اسید استیک چند ظرفیتی است ؟
ظرفیت این اسید به دلیل آزاد شدن تک پروتون مثبت، تک ظرفیتی بوده و برابر یک بار مثبت است.
آیا استیک اسید برای سلامتی خطرناک است؟
توجه داشته باشید با وجود اینکه اتانوییک اسید یک اسید ضعیف است اما غلظتهای بالای آن (بالای ۲۵٪) میتواند آسیبهای جدی را به پوست وارد کند. استنشاق بخارات اتانوییک اسید میتواند چشمها، گلو و بینی را تحریک کند.
سرفه، تنگی نفس، سردرد، تب و سرگیجه ازجمله علائمی هستند که فرد در صورت مسمومیت با این اسید از خود نشان می دهد. به همین دلیل توصیه میشود کارگران یا سایر افرادی که با اتانوییک اسید در آزمایشگاه سر و کار دارند به هنگام کار با این اسید از تمامی وسایل ایمنی مانند دستکش، عینک ایمنی و ماسک استفاده کنند.












