عنصرها به چند دسته تقسیم می شوند؟ — تقسیم بندی عناصر + مثال

به طور قطع، با جدول تناوبی و عنصرهای نمایش داده شده در آن آشنا هستید. عنصرها به عنوان سادهترین ترکیبهای شیمیایی با اتمهای یکسان توصیف میشوند. عناصر در حالت کلی به سه دسته فلزات، نافلزات و شبهفلزات تقسیمبندی میشوند. با دانستن نوع دستهبندی عنصر، بسیاری از ویژگیهای آن را پیشبینی خواهیم کرد. در این مطلب، در ابتدا دستهبندی کلی عناصر توضیح داده خواهد شد و در ادامه به پرسش عنصرها به چند دسته تقسیم می شوند پاسخ میدهیم. سپس، در مورد تقسیمبندی عناصر در جدول تناوبی، تقسیمبندی عناصر نادر خاکی و تقسیمبندی عناصر واسطه صحبت میکنیم.
عنصرها به چند دسته تقسیم می شوند ؟
عنصرها در حالت کلی به سه دسته فلزات، نافلزات و شبیه فلزات دستهبندی میشوند. در ادامه، در مورد هر کدام از این دستهها توضیح داده میشود و سپس ويژگیهای هر دسته با جزئیات بیان خواهند شد.
فلزات
عنصرهای فلزی به خوبی جریان الکتریکی را از خود عبور میدهند. در میان سه دسته عناصر، فلزات بزرگترین دستهبندی را تشکیل میدهند. در حقیقت بیشتر عنصرها فلز هستند. در ادامه جایگاه این دسته از عنصرها در جدول تناوبی نشان داده خواهد شد. سدیم، مس، نقره مثالهایی از عناصر فلزی هستند.
نقطه ذوب فلزات به نسبت بالا است. بنابراین، بیشتر آنها در دمای اتاق جامد هستند. تنها استثنا جیوه است. این عنصر در دمای اتاق مایع خواهد بود. همچنین، فلزات علاوه بر آنکه رسانای خوب جریان الکتریکی هستند، گرما را به راحتی از خود عبود میدهند. به همین دلیل از آنها برای ساخت وسایل پختوپز استفاده میکنند. فلزات به راحتی الکترون از دست میدهند، اما آن را به آسانی به دست نمیاورند. در نتیجه، انرژی یونش پایینی دارند. فلزات ویژگیهای مهم دیگری نیز دارند. بیشتر آنها درخشان، شکلپذیر و چکشخوار هستند. چکشخواری بدان معنا است که عنصر فلزی به شکلها و فرمها متفاوتی در خواهد آمد. چکشخواری فلز مس در تصویر زیر نشان داده شده است.

ویژگیهای اصلی فلزات به صورت زیر خلاصه شدهاند:
- بیشتر عنصرها در جدول تناوبی فلز هستند.
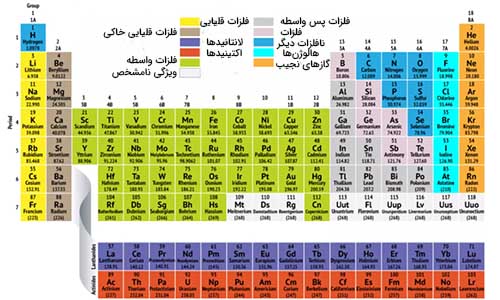
- فلزات شامل فلزات قلیایی، فلزات واسطه، لانتانیدها، اکتینیدها و فلزات قلیایی خاکی هستند.
- فلزات و نافلزات در جدول تناوبی توسط خط زیگزاگی از کربن تا عنصر رادیواکتیو رادون از یکدیگر جدا شدهانند.
- این عناصر و عنصرهای کنار آنها در جدول تناوبی، نافلزات یا نارساناها هستند.
- عنصرهای سمت چپ خط، نیمهرسانا یا شبهفلز هستند.
نافلزات
نافلزات یا نارساناها عناصری هستند که جریان الکتریکی را از خود عبور نمیدهند. پس از فلزات، نافلزات بزرگترین دسته عنصرها در جدول تناوبی هستند. این عناصر به طور عمده در سمت راست جدول تناوبی قرار گرفتهاند. هلیوم، کربن و اکسیژن از جمله عنصرهای غیرفلزی هستند.
به طور کلی، ویژگیهای نافلزات در مقابل ویژگیهای عناصر فلزی است. عنصرهای نافلز تمایل به تغییر بیشتری در مشخصات خود نسبت به عناصر فلزی خواهند داشت. به عنوان مثال، نافلزات به طور نسبی نقطه جوش پایینی دارند. بنابراین، بیشتر آنها در دمای اتاق، گاز هستند. اما، نافلزات متعددی نیز مانند کربن و فسفر، به شکل جامد خواهند بود. نافلز دیگری مانند برم (Br) در دمای اتاق مایع است.
به طور کلی، نافلزات رساناهای ضعیف گرما هستند. در حقیقت، از آنها ممکن است برای ساخت عایقها استفاده شود. یه عنوان مثال، هوا به طور عمده از عناصری مانند اکسیژن و نیتروژن تشکیل شده است. این دو عنصر نافلز هستند. بنابراینِ هوا نیز نارسانا است. آیا تاکنون به ژاکتهای پشمی دقت کردهاید. فاصله بین نقاط بافته شده در ژاکت از بستههای هوا تشکیل شده است. بنابراین، در هوای سرد با پوشیدن این ژاکتهای گرم، از خروج گرمای بدن جلوگیری میکنیم.
جامدات نافلزی تیره، کدر و شکننده هستند. مهمترین ويژگیهای نافلزات در ادامه خلاصه شده است:
- تعداد عنصرهای نافلز نسبت به فلزی در جدول تناوبی کمتر است.
- بیشتر نافلزات در قسمت راست جدول تناوبی قرار گرفتهاند.
- گوگرد، کربن، تمامی هالوژنها، فسفر، هیدروژن، اکسیژن، سلنیوم، نیتروژن و گازهای نجیب از مهمترین مثالهای عنصرهای نافلزی هستند.
- در جدول تناوبی، نافلزات در سمت چپ هالوژنها و سمت راست شبهفلزات قرار گرفتهاند.
- از آنجایی که گازهای نجیب و هالوژنها نافلز هستند، از آنها به عنوان نارسانا یا نافلز یاد میشود.

شبه فلزات
شبهفلزات عناصری هستند که در جدول تناوبی بین دستهبندی فلزات و نافلزات قرار گرفتهاند. همچنین، این گروه از عناصر، مانند بور، سیلیکون و ژرمانیوم، کوچکترین گروه بین سه گروه کلی در انواع عناصر هستند.
برخی از ویژگیهای شبهفلزات شبیه فلزات و بعضی از مشخصات آنها شبیه نافلزات است. به عنوان مثال، بسیاری از شبهفلزات جریان الکتریکی را در دماهای خاصی هدایت میکنند. به این شبهفلزات، نیمهرسانا میگویند. سیلیکون یکی از مهمترین مثالهای نیمهرساناها است. از این نیمهرسانا برای ساخت تراشههای کامپیوتری استفاده میکنند. همچنین، این عنصر یکی از فراوانترین شبیه فلزات بر روی زمین است. این عنصر مانند فلز درخشان و مانند نافلز شکننده است. مهمترین ویژگیهای شبهفلزات در زیر خلاصه شده است:
- شبهفلزات گروه کوچکی از عناصر را در جدول تناوبی تشکیل میدهند. این عنصرها در امتداد خط زیگزاگ جداکننده فلزات از نافلزات هستند.
- بور، سیلیکون، ژرمانیوم، آرسنیک و تلریوم از مهمترین مثالهای عنصرهای شبهفلزی هستند.
- شبهفلزات الکترونخواهی و انرژی یونش متوسطی دارند.
اکنون میتوانید به پرسش عنصرها به چند دسته تقسیم می شوند پاسخ دهید. در ادامه، مقایسه کلی سه دسته کلی عناصر توضیح داده شده است.
مقایسه فلزات، نافلزات و شبه فلزات
مهمترین ویژگیهای فلزات، نافلزات و شبهفلزات در بالا توضیح داده شد. جدول زیر این سه دسته از عنصرها را به طور خلاصه با یکدیگر مقایسه میکند.
| مشخصات | فلزات | شبهفلزات | نافلزات |
| تعریف | عناصر فلزی رسانندگی الکتریکی بالا و انرژی یونش پایینی دارند. | مشخصات عناصر شبهفلزی مابین مشخصات فلزات و نافلزات قرار گرفته است. | عناصر نافلزی رسانندگی الکتریکی پایین و انرژی یونش بالایی دارند. |
| رسانندگی گرمایی | بالا | متوسط | کم |
| انرژی یونش | کم | متوسط | بالا |
| هدایت الکتریکی | بالا | متغیر | کم |
| مثال | قلع، مس و روی (زینک) | بور، سیلیکون و آرسنیک | هیدروژن، اکسیژن و کربن |
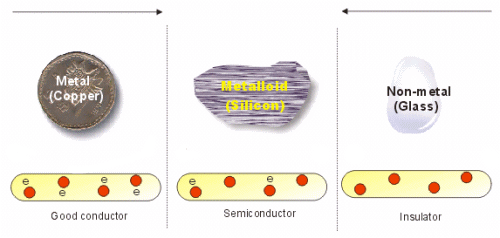
همچنین، گفتیم که فلزات بر خلاف نافلزات جریان الکتریکی را به خوبی از خود عبور میدهند. تصویر زیر هدایت الکتریکی این سه دسته از عناصر را به خوبی نشان داده است. همانگونه که در این تصویر مشاهده میکنید، هدایت الکترونها در عنصر فلزی به آسانی صورت میگیرد. در مقابل، در عنصر نافلز، الکترونها هدایت نمیشوند یا هدایت منظمی ندارند. هدایت الکترونها در عناصر شبهفلزی مابین فلزات و نافلزات قرار گرفته است.
تاکنون به پرسش عنصرها به چند دسته تقسیم می شوند پاسخ دادیم، در ادامه، در مورد تقسیمبندی عناصر در جدول تناوبی صحبت میکنیم.
عناصر جدول تناوبی به چند دسته تقسیم می شوند ؟
همانگونه که در مطالب بالا گفتیم، عنصرها در حالت کلی به سه دسته فلزات، نافلزات و شبهفلزات تقسیم میشوند.
از بین این سه دسته، عناصر فلزی بزرگترین بخش جدول تناوبی را به خود اختصاص دادهاند. پس آز آن، عنصرهای نافلزی و شبهفلزی به ترتیب بخشهای دیگر جدول تناوبی را تشکیل دادهاند. اما، تقسیمبندی جدول تناوبی با جزییات بیشتری انجام شده است.
دانشمندان قرنها قبل درک بسیار ابتدایی از جدول تناوبی عنصرها داشتند. اما در اواخر قرن نوزدهم میلادی، دانشمندی روسی به نام دیمیتری مندلیف (Dmitri Mendeleev) اولین مقاله خود بر روی طبقهبندی عناصر براساس وزن اتمی را چاپ کرد. در آن زمان تنها ۶۰ عنصر شناخته شده بودند. اما مندلیف به این نکته پی برد که طبقهبندی عناصر براساس وزن اتمی سبب قرار گرفتن نوع خاصی از عنصرها در فاصلههای منظم یا تناوبی میشود.
امروزه، در حدود ۱۵۰ سال پس از مقاله مندلیف، شیمیدانها به طور رسمی ۱۱۸ عنصر را میشناسند و هنوز از جدول تناوبی مندلیف برای نظم دادن به آنها استفاده میکنند. جدول تناوبی با سادهترین اتم یعنی هیدروژن آغاز شده است. در ادامه، مابقی عناصر با استفاده از عدد اتمی منظم شدهاند. به تعداد پروتونهای هر عنصر، عدد اتمی میگوییم. نظم عنصرها مطابق با افزایش جرم هر اتم است. اما استثناهایی نیز وجود دارند.
جدول تناوبی از ۱۸ ستون و هفت سطر تشکیل شده است. هر سطر نشاندهند یک تناوب است. تناوب هر عنصر بیانگر تعداد ترازهای انرژی دربرگیرنده الکترون است. به عنوان مثال، سدیم در سومین دوره تناوب قرار گرفته است. این بدان معنا است که تراز انرژی اول این عنصر از یک الکترون تشکیل شدهاند. اگر به سمت پایین جدول حرکت کنیم، تناوبها بلندتر خواهند بود. زیرا تعداد الکترونهای بیشتری برای پر کردن ترازهای انرژی بیرونی لازم است.
ستونهای جدول تناوبی نشاندهنده گروههای عناصر هستند. به طور کلی، عنصرهای قرار گرفته در یک گروه رفتار و مشخصات شبیه به یکدیگر دارند. دلیل این امر آن است که تعداد الکترونهای قرار گرفته در خارجیترین لایه یکسان است. لایه آخر عناصر گروه ۱۸، که در قسمت راست جدول قرار دارند، کامل است. بنابراین، این عناصر به ندرت در واکنشهای شیمیایی شرکت میکنند.
همانگونه که گفته شد، عنصرها در حالت کلی به دو دسته فلزات یا نافلزات تقسیم میشوند. اما خط تقسیمکننده آنها مبهم است. فلزات به طور معمول هدایتکنندههای خوب گرما و جریان الکتریکی هستند. زیرگروه فلزات براساس مشخصات مشابه و خواص شیمیایی این مجموعهها است.
گروه های جدول تناوبی
در حالت کلی عناصر در جدول تناوبی به یازده دسته تقسیم میشوند. در ادامه، در مورد هر یک از این دستهها به اختصار توضیح میدهیم.
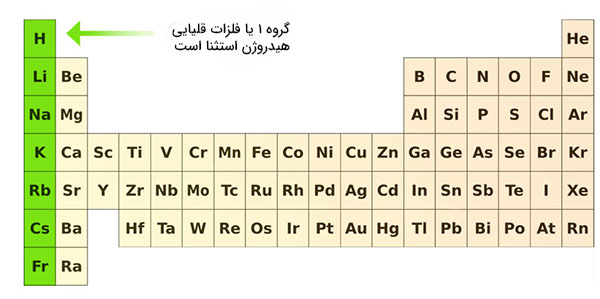
فلزات قلیایی
به اولین ستون جدول دقت کنید. این ستون همان اولین گروه جدول تناوبی و شامل فلزات قلیایی است. عناصر قرار گرفته شده در این گروه درخشان و به قدری نرم هستند که با چاقو به راحتی بریده میشوند. این فلزات با لیتیوم شروع و با «فرانسیوم» (Francium) تمام میشوند. این عناصر به شدت واکنشپذیر هستند و به هنگام تماس با أب شعلهور یا حتی منفجر خواهند شد. بنابراین، شیمیدانها آنها را در نفت نگهداری میکنند.
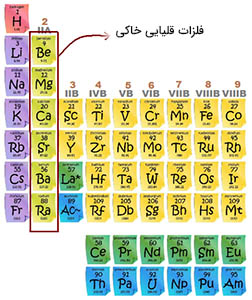
فلزات قلیایی خاکی
فلزات قلیایی خاکی عناصر گروه دوم جدول تناوبی هستند. عنصر آغاز کننده این گروه برلیوم و عنصر پایانی رادیوم است. هر کدام از این عنصرها دو الکترون در بیرونیترین تراز انرژی دارند. از این رو، فلزات قلیایی خاکی به اندازه کافی واکنشپذیر هستند. بنابراین، یافتن هر کدام از این عنصرها به تنهایی در طبیعت بسیار سخت خواهد بود. اما، واکنشپذیری این عناصر از فلزات قلیایی کمتر است. در مقایسه با عناصر گروه ۱، واکنشهای شیمیایی عناصر گروه دوم جدول تناوبی کندتر و با گرمای کمتری اتفاق میافتند.
لانتانیدها
گروه سوم بسیار بزرگتر است. بنابراین، به بیشتر از یک ستون نیاز دارد. در نتیجه، این گروه از جدول اصلی خارج شده و در ستونی مجزا در انتهای آن گذاشته شده است. عناصر شماره ۵۱ تا ۷۱ گروه لانتانیدها را تشکیل میدهند. رنگ آنها نقرهای متمایل به سفید است و در تماس مستقیم با هوا تیره خواهند شد.
اکتینیدها
اکتینیدها نیز مانند لانتانیدها در قسمت پایینی جدول تناوبی و در زیر آنها قرار گرفتهاند. این گروه از عنصر شماره ۸۹ به نام «اکتینیوم» (Actinium) تا عنصر شماره ۱۰۳ به نام لارنسیوم (Lawrencium) تشکیل شده است. از میان عنصرهای این گروه تنها توریوم و اورانیوم به طور طبیعی و به مقدار کافی بر روی زمین یافت میشوند. تمامی آنها رادیواکتیو هستند. دو گروه لانتانیدها و اکتینیدها با یکدیگر تشکیل گروهی به نام فلزات واسطه داخلی را میدهند.
فلزات واسطه
اکنون به بدنه اصلی جدول برمیگردیم. گروههای باقیمانده ۳ تا ۱۲ مابقی فلزت واسطه را نمایش میدهند. این عناصر سخت اما چکشخوار، درخشان و رسانای خوب جریان الکتریکی هستند. این عناصر تمام آنچه از مشخصات یک فلز میدانید را دارا هستند. بسیاری از معروفترین فلزاتی که در جهان شناختهشده هستند و بسیاری از افراد آنها را میشناسند. به عنوان مثال، نقره، طلا، آهن و پلاتینیوم در این دسته قرار گرفتهاند. از آنجایی که این گروه، دسته بزرگی در جدول تناوبی است، توضیحات بیشتری در مورد نحوه قرارگیری و ویژگیهای عناصر قرار گرفته در آن میدهیم.
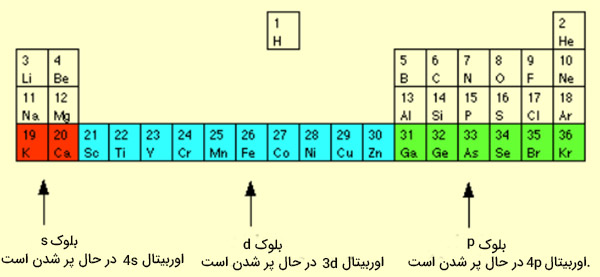
نکته: عنصرها در جدول تناوبی به سه دسته کلی بلوک s، بلوک d و بلوک p تقسیم میشوند. عناصر واسطه در بلوک d قرار میگیرند.
تاکنون به پرسش عنصرها به چند دسته تقسیم می شوند پاسخ دادیم. فهمیدیم که فلزات یکی از بزرگترین دستهها است که به دستهبندی کوچکتری تقسیم میشود. فلزات واسطه یکی از این دستهبندیها است.
فلز واسطه چیست ؟
در طول روز تماس زیادی با فلزات واسطه داریم. آهن در همه جا استفاده میشود. تیتانیوم در ساخت محصولات سبک و بادوام مانند قاب دوچرخه یا جواهرات بسیار مفید خواهد بود. کروم به عنوان لایهای محافظ بر روی وسایل و تجهیزات لولهکشی مورد استفاده قرار میگیرد. در نتیجه، این دسته از فلزات کابردهای بسیاری در زندگی روزمره دارند.
در این گروه از عناصر، اوربیتال d نیمهپر است. عناصر بلوک d در گروه های ۳ تا ۱۱، عنصرهای واسطه هستند. به عنصرهای بلوک f فلزات واسطه داخلی (اکتینیدها و لانتانیدها) گفته میشود. دلیل این امر آن است که اوربیتال d قبل از اوربیتالهای f تا حدی پر شده است. اوربیتالهای d با خانواده مس پر میشوند (گروه ۱۱). به همین دلیل، گروه ۱۲ فلزات واسطه نیستند. اما، عناصر گروه ۱۲ برخی از ویژگیهای شیمیایی نشان داده شده توسط فلزات واسطه را به نمایش میگذارند. بنابراین، بعضی از شیمیدانها آنها را در دسته فلزات واسطه طبقهبندی میکنند.
عنصرهای بلوک d به گروههای زیر دستهبندی میشوند:
- سری اول فلزات واسطه از Sc تا Cu.
- سری دوم فلزات واسطه از Y تا Ag.
- دسته سوم فلزات واسطه (عنصر La تا عناصر Hf تا Au).
- دسته چهارم فلزات واسطه. اکتینیوم یا Ac اولین عنصر این دسته است و عناصر Rf تا Rg نیز در این دسته قرار گرفتهاند.
عنصرهای قرار گرفته در بلوک f به صورت زیر طبقهبندی شدهاند:
- عنصرهای Ce تا Lu که سری لانتانید را تشکیل میدهند.
- عناصر Th تا Lr که سری اکتینید را تشکیل دادهاند.
لانتانوم به دلیل آرایش الکترونی میتواند اولین عضو از سری سوم فلزات واسطه باشد. اما از انجایی که مشخصات این عنصر به عنصرهای لانتانید بسیار نزدیک است، به عنوان یک عنصر لانتانید در نظر گرفته میشود. به طور مشابه، آرایش الکترونی اکتینیوم، این عنصر را در سری چهارم فلزات واسطه و به عنوان عنصر اول قرار میدهد. اما، به دلیل مشخصات شیمیایی در سری اکتینیدها قرار داده شده است.
ذکر این نکته مهم است که عنصرهای Sc با اوربیتال خالی d و Zn با اوربیتال پر شده d به طور کلی در دسته فلزات واسطه قرار نمیگیرند. اما سوالی که ممکن است مطرح شود آن است که مشخصات کلی فلزات واسطه چیست؟
ویژگی های کلی عناصر واسطه
ویژگیهای کلی عنصرهای واسطه در امتداد هر سطر از جدول تناوبی مشاهده میشود. این ویژگیهای عبارتند از:
- این عنصرها ترکیبات و یونهای رنگی تشکیل میدهند. این رنگ به وسیله انتقال الکترونهای d-d توضیح داده میشود.
- شکاف انرژی بین عددهای اکسایش ممکن به نسبت کوچک است. از این رو، فلزات واسطه عددهای اکسایش زیادی خواهند داشت.
- بسیاری از ترکیبات پارامغناطیس از این عناصر تشکیل شدهاند. دلیل این امر الکترونهای جفت نشده در اوربیتال d است.
- انواع مختلفی از لیگاندها میتوانند با این عناصر پیوند شیمیایی تشکیل دهند. بنابراین، دسته زیادی از کمپلکسهای پایدار توسط عنصرهای واسطه تشکیل میشوند.
- نسبت بار به شعاع این عناصر زیاد است.
- این عناصر سخت هستند و چگالی بالایی دارند.
- نقطههای ذوب و جوش بالایی دارند.
- این عناصر رسانای خوب جریان الکتریکی هستند.
- تعدادی از عنصرهای واسطه فعالیت کاتالیزوری خوبی از خود نشان می دهند.
شعاع یونی اتمی در عناصر واسطه
شعاع اتمی و یونی در عنصرهای واسطه از گروه ۳ به ۶ کاهش مییابد. دلیل این امر ابر الکترونی ضعیف تشکیل شده توسط تعداد کمی از الکترونهای d است. عنصرهای قرار گرفته در گروههای ۷ تا ۱۰ شعاع اتمی مشابه و عنصرهای گروههای ۱۱ و ۱۲ شعاع بزرگتری دارند. دلیل این امر آن است که بار هسته با دافعه الکترون - الکترون خنثی میشود.
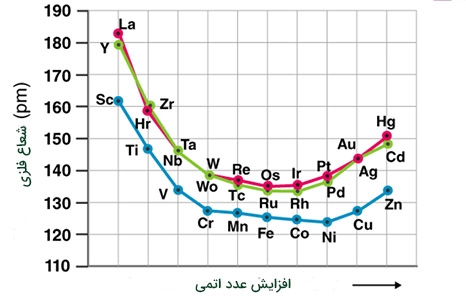
انرژی یونش
به انرژی لازم برای رهایی الکترون ظرفیت، انرژی یونش گفته میشود. هر چه بار موثر هسته بر روی الکترونها بزرگتر باشد، انرژی یونش عنصر بیشتر خواهد بود. به همین دلیل، انرژی یونش عنصرهای واسطه نسبت به عناصر سری s بزرگتر است. ذکر این نکته مهم است که فلزات قلیایی و قلیایی خاکی در سری s قرار میگیرند.
انرژی یونش عنصر رابطه تنگاتنگی به شعاع اتمی آن دارد. اتمهایی با شعاع کوچکتر، انرژی یونش بیشتری نسبت به اتمهای با شعاع اتمی بزرگتر دارند. انرژی یونش فلزات واسطه به هنگام حرکت در امتداد یک سطر افزایش مییابد.
حالت های اکسایش
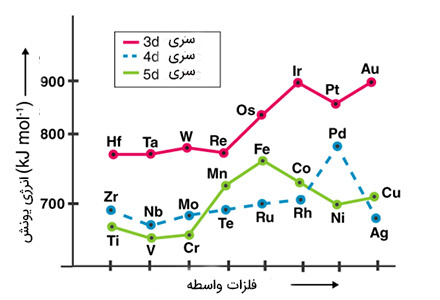
فلزات واسطه به دلیل دارا بودن عددهای اکسایش مختلف ترکیبات متفاوتی را تشکیل میدهند. تعدادی از عددهای اکسایش مشاهده شده در سری اول این عنصرها در شکل زیر نشان داده شده است.
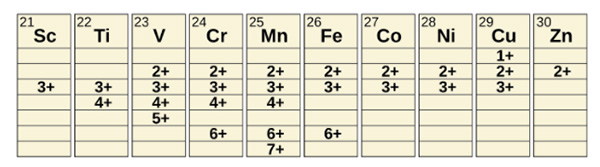
اکنون به سری اول عناصر واسطه دقت کنید. به هنگام حرکت از سمت چپ به راست، در ابتدا تعداد حالات اکسایش افزایش مییابد و پس از رسیدن به مقدار بیشینه در اواسط جدول تناوبی، تعداد آنها کاهش خواهد یافت. مقدار عددهای اکسایش در جدول تناوبی مقدارهای معمولی هستند. مقدارهای شناخته شده دیگری نیز وجود دارند. حتی ممکن است ترکیبات جدیدی سنتز شوند. به عنوان مثال، در سال ۲۰۱۴ پژوهشگران عدد اکسایش جدیدی از ایریدیوم (۹+) را سنتز کزدند.
برای عناصر اسکاندیوم تا منگنز (نیمه اول سری اول فلزات واسطه)، بالاترین عدد اکسایش مربوط به از دست دادن تمامی الکترونها در هر در اوربیتال s و d لایههای ظرفیت است. به عنوان مثال، یون تیتانیوم هنگامی تشکیل میشود که اتم تیتانیوم الکترونهای 3d و 4s را از دست میدهد. بالاترین عددهای اکسایش پایدارترین شکلهای اسکاندیوم، تیتانیوم و وانادیوم هستند. اما، برداشتن تمامی الکترونهای ظرفیتِ فلزات امکانپذیر نیست.
به فلز آهن با عددهای اکسایش $$Fe^{2+}$$ و $$Fe^{3+}$$ دقت کنید. هنگامی که فلزی ترکیب یونی تشکیل میدهد، فرمول ترکیب ایجاد شده به انرژی فرآیند بستگی دارد. در کل، ترکیب تشکیل شده ترکیبی است که بیشترین انرژی در فرآیند تشکیل آن أزاد شده است. هر چه انرژی آزاد شده بیشتر باشد، ترکیب تشکیل شده پایدارتر خواهدبود. اصطلاحهای مختلفی برای انرژی وجود دارند، اما مهمترین آنها عبارتند از:
- مقدار انرژی مورد نیاز برای یونیزه کردن فلز ( جمع انرژیهای یونش مختلف).
- مقدار انرژی مورد نیاز هنگامی که ترکیبی تشکیل میشود.
هر چه بار یونی بزرگتر باشد، الکترونهای بیشتری باید جدا شوند. بنابراین، انرژی یونش بزرگتر خواهد بود.
عناصر سریهای دوم و سوم در عددهای اکسایش بالاتر، پایدارتر هستند. در حالت کلی، شعاع اتمی در حرکت به سمت پایین گروه افزایش مییابد. در نتیجه، یونهای سریهای دوم و سوم از یونهای سری اول بزرگتر هستند. چدا کردن الکترونهایی که در فاصله دورتری از هسته قرار گرفتهاند راحتتر از الکترونهایی است که در فاصله نزدیکتری نسبت به هسته قرار دارند. به عنوان مثال، مولیبدن و تنگستن، دو عنصر مربوط به گروه ششم جدول تناوبی، در محلول آبی دارای عدد اکسایش ۶+ هستند. اکنون عنصر کروم را در نظر بگیرید. این عنصر سبکترین عنصر گروه ششم است. کروم در آب تشکیل یون پایدار $$Cr^{3+}$$ را میدهد. اما در غیاب هوا یون $$Cr^{2+}$$ با پایداری کمتری تشکیل خواهد شد. ترکیب کروم با گوکرد، سولفیدی با بالاترین عدد اکسایش کروم و با فرمول $$Cr_2 S_3$$ تشکیل میدهد. یون $$Cr^{3+}$$ در این ترکیب قرار دارد.
نقطه ذوب و نقطه جوش
نقطههای ذوب و آنتالپیهای مولی فلزات واسطه در مقایسه با عناصر گروه اصلی بالاتر هستند.
آرایش الکترونی
آرایش الکترونی اتمها در ردیف اول عناصر واسطه کم و بیش یکسان است. این ردیف با اسکاندیوم آغاز شده است. به هنگام حرکت از چپ به راست اوربیتالهای 3d به تدریج پر میشوند. اما، این پر شدن منظم نیست. در دو عنصر مس و کروم جمعیت اوربیتالهای 3d با کسب الکترون از لایه 4s افزایش مییابد. این مورد نکته مهمی را در مورد انرژیهای اوربیتالی سری اول عناصر واسطه نشان میدهد. در کروم، دو اوربیتال 3d و 4s اشغال شدهاند. اما پر شدن هیچکدام نسبت به دیگری الویتی ندارد. از این رو، مقدارهای انرژی این دو اوربیتال در این سطر به یکدیگر بسیار نزدیگ هستند.
اکنون فلز مس را در نطر بگیرید. اوربیتال 3d پر است. اما تنها یک الکترون اوربیتال 4s را پر کرده است. بنابراین، انرژی اوربیتال 3d از اوربیتال 4s کمتر است. در نتیجه، در حرکت از پتاسیم به سمت روی، مقدار انرژی اوربیتال 3d از زیاد به کم تغییر خواهد کرد. اما، آرایش الکترونی اتمهای تنها توسط انرژی اوربیتالی تعیین نخواهد شد. در کروم، انرژی اوربیتالی 4s پایینتر از 3d قرار گرفته است. از این رو، آرایش الکترونی پیشنهادی برای این عنصر به صورت $$[Ar] 3d^4 4s^2$$ است. گرچه، به دلیل دافعه الکترونی بین الکترونهای بیرونی، آرایش الکترونی به صورت $$[Ar] 3d^5 4s^1$$ خواهد بود. در این ساختار تمامی الکترونها در اوربیتالهای خارجی جفتشده هستند.
به آرایش الکترونی عناصر سری یکم دقت کنید:

همانگونه که مشاهده میکنید، پر شدن اوربیتال d به طور کامل منظم نیست. برای دو عنصر مس و کروم، این پر شدن منظم شکسته شده است. این نکته را به یاد داشته باشید که به هنگانم تشکیل یون، در ابتدا الکترونهای 4s جدا خواهند شد. به دو مثال زیر توجه کنید:
مثال ۱: آرایش الکترونی $$CO^{ 2+}$$ را بنویسید.
آرایش الکترونی عنصر Co به صورت زیر نوشته میشود:
$$Co \rightarrow [Ar] 3d^74s^2$$
هنگامی که این عنصر دو الکترون را از دست بدهد به یون $$CO^{ 2+}$$ تبدیل خواهد شد. این دو الکترون از لایه خارجی 4s جدا میشوند.
$$Co^ { 2+} \rightarrow [Ar] 3d^7$$
مثال ۲: آرایش الکترونی $$v^{ 3+}$$ را بنویسید.
آرایش الکترونی عنصر V به صورت زیر نوشته میشود:
$$V \rightarrow [Ar] 3d^3 4s^2$$
هنگامی که این عنصر سه الکترون را از دست بدهد به یون $$V^{ 3+}$$ تبدیل خواهد شد. این ۳ الکترون ابتدا از لایه خارجیتر 4s و سپس از لایه داخلیتر 3d جدا میشوند.
$$V^{3+} \rightarrow [Ar] 3d^2 $$
فلزات پس واسطه
آلومینیوم (Al)، گالیوم (Ga)، ایندیوم (In)، قلع (Sn)، سرب (Pb)، و بیسموت (Bi) و تمام عنصرهای قرار گرفته در گروههای ۱۳ تا ۱۷ فلزات پس واسطه هستند. این عناصر برخی از مشخصههای فلزات واسطه را دارند، اما نسبت به آنها نرمتر و رسانای ضعیفتر جریان الکتریکی هستند.
هالوژن ها
این عناصر در گروه ۱۷ یا گروه هفتم از عناصر اصلی جدول تناوبی قرار گرفتهاند. این عناصر از نظر شیمیایی بسیار فعال هستند و تمایل به تشکیل پیوند با فلزات قلیایی دارند. با ترکیب فلز قلیایی با عنصری از گروه هالوژنها نمکهای مختلفی تشکیل میشوند. به عنوان مثال، نمک خوراکی که مصرف میکنید حاصل پیوند فلز سدیم با عنصر کلر از گروه هالوزنها است.
گازهای نجیب
گازهای نجیب در گروه ۱۸ یا گروه هشتم از عناصر اصلی جدول تناوبی قرار دارند. این عناصر بیرنگ، بیبو، و غیرفعال هستند. عنصر جدیدی به نام «اوگانسون» بیشتر مشخصههای گازهای نجیب را دارد. از این رو، شیمیدانها این عنصر را در این گروه قرار دادهاند. اما توجه به این نکته مهم است که نیمهعمر اندازهگیری شده این عنصر در حد میلیثانیه است. بنابراین، ویژگیهای آن به طور مستقیم آزمایش نشده است.
تاکنون به پرسش عنصرها به چند دسته تقسیم می شوند با ذکر مثال پاسخ دادیم. فهمیدیم که عناصر به سه دسته کلی فلزات، نافلزات و شبهفلزات دستهبندی شدهاند. اما طبقهبندی عنصرها در جدول تناوبی بیشتر است. به عنوان مثال، فلزات به گروههای کوچکتر فلزات قلیایی، قلیایی خاکی، واسطه و پس واسطه تقسیم میشوند. اما آیا تاکنون این سوال برایتان مطرح شده است که چه رابطهای بین تعداد الکترونهای عناصر و طبقهبندی آنها وجود دارد؟ در ادامه به این پرسش پاسخ خواهیم داد.
طبقه بندی عنصرها و تعداد الکترون ها
اگر در جدول تناوبی از چپ به راست حرکت کنیم، هر عنصر نسبت به عنصر قرار گرفته در سمت چپ خود یک پروتون اضافهتر خواهد داشت. از آنجایی که اتمها همیشه از نظر الکترونی خنثی هستند، در ازای هر پروتونی که به آن اضافه شود، یک الکترون نیز اضافه خواهد شد. همانگونه که میدانیم الکترونها در ابتدا به پایینترین تراز انرژی تا پر شدن آن اضافه میشوند. الکترونهای بعدی در تراز انرژی بالاتر قرار میگیرند.
اضافه شدن الکترونها در امتداد جدول تناوبی توضیح میدهد که چرا عنصرها از فلز به شبه فلز و سپس به نافلز تغییر میکنند. تصویر زیر دوره دوم جدول تناوبی را نشان میدهد. لیتیوم فلز، بور شبهفلز و فلور و نئون نافلز هستند. تراز انرژی داخلی برای هر چهار عنصر پر شده است. این تراز تنها یک اوربیتال دارد و حداکثر دو الکترون را در خود نگه میدارد. تراز بعدی چهار اوربیتال دارد و حداکثر هشت الکترون در آن قرار خواهند گرفت. لیتیوم تنها یک الکترون در این تراز دارد. همچنین، بور سه الکترون، فلور هفت و نئون هشت الکترون در این تراز دارند.
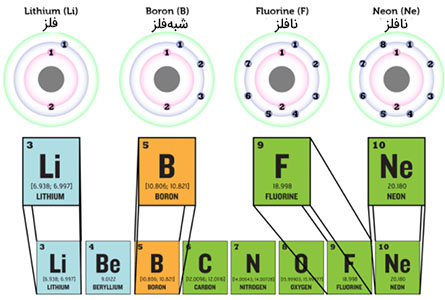
همانگونه که در مطالب بالا گفته شد تعداد الکترونهای لایه آخر یا تعداد الکترونهای ظرفیت تاثیر مستقیمی بر میزان فعالیت شیمیایی عنصر میگذارد. همچنین، تعداد الکترنهای ظرفیت نشاندهنده آن است که آیا عنصر موردنظر رسانای جریان الکتریکی است یا خیر. به دستهبندی زیر توجه کنید:
- لایه خارجی در فلزاتی مانند لیتیوم تقریبا خالی است. این دسته از عناصر تمایل دارند تا با از دست دادن تعداد اندک الکترونهای ظرفیت، به لایه بعدی که پر است برسند. در نتیجه، فلزات از نظر شیمیایی بسیار فعال و رسانای خوب جریان الکتریکی هستند.
- شبهفلزاتی مانند بور لایه بیرونی نیمهپر دارند. این دسته از عناصر به منظور رسیدن به لایه یا تراز انرژی پر باید تعداد زیادی الکترون از دست بدهند با به دست بیاورند. بنابراین، این دسته از عناصر از نظر شیمیایی بسیار فعال نیستند. همچنین، آنها در مقایسه با فلزات رسانای ضعیفتر جریان الکتریکی هستند.
- لایه یا تراز ارژی بیرونی برخی از نافلزات، مانند برم، به نسبت پر است. آنها برای رسیدن به لایه الکترونی پر، تمایل به کسب الکترون دارند. در نتیجه، این دسته از نافلزات از نظر شیمیایی بسیار فعال هستند. از آنجایی که آنها تنها الکترون میپذیرند ولی الکترونی را از دست نمیدهند، نارسانای جریان الکتریکی هستند.
- مابقی نافلزات، مانند نئون، دارای لایه الکترونی پر هستند. الکترونهای این عناصر در پایدارترین ساختار خود قرار گرفتهاند. بنابراین، از نظر شیمیایی غیرفعال و نارسانای جریان الکتریکی هستند.
اکنون میدانیم که عنصرها به چند دسته تقسیم می شوند اما دستهبندی عناصر براساس اتحادیه بینالمللی شیمی محض و کاربردی (International Union of Pure and Applied Chemistry) یا IUPAC چگونه است؟
دسته بندی عناصر براساس آیوپاک چیست ؟
براساس دستهبندی آیوپاک عناصر به دستههای فلزات قلیایی، قلیایی خاکی، واسطه، پتیکوژنها، کالکوژنها، هالوژنها، گازهای نجیب، لانتانیدها، اکتینیدها، فلزات نادر خاکی، عناصر واسطه داخلی و عنصرهای گروه اصلی تقسیم شدهاند.
تاکنون ۱۱۸ عنصر با ویژگیهای شیمیایی و فیزیکی متفاوت شناخته شدهاند. با توجه به این ویژگیها عنصرها به دستههای مختلفی تقسیم شدهاند. براساس طبقهبندی انجام شده توسط آیوپاک عنصرها به دستههای زیر تقسیم شدهاند:
- فلزات فلیایی: عناصر گروه یک جدول تناوبی مانند لیتیوم، سدیم و پتاسیم.
- فلزات قلیایی خاکی: فلزات گروه ۲ مانند کلسیم.
- فلزات واسطه: عناصر گروههای ۳ تا ۱۱ یا ۳ تا ۱۲.
- پنیکتوژنها: عناصر گروه ۱۵ مانند نیتروژن و فسفر.
- کالکوژنها: عناصر گروه ۱۶ مانند اکسیژن و گوگرد.
- هالوژنها: عناصر گروه ۱۷ مانند فلو و کلر.
- گازهای نجیب: عناصر گروه ۱۸ مانند هلیوم، نئون و آرگون.
- لانتانیدها: عناصر شماره ۵۷ تا ۷۱.
- اکتینیدها: عناصر شماره ۸۹ تا ۱۰۳.
- فلزات نادر خاکی: این دسته شامل Sc و Y و لانتانیدها هستند.
- عناصر واسطه داخلی: عنصرهای بلوک f.
- عنصرهای گروه اصلی: عناصر گروههای ۱ تا ۲ یا ۱۳ تا ۱۸ به جز هیدروژن.
همچنین با توجه به درصد فلزی، نافلزی یا شبهفلزی عنصر دستهبندی دیگری نیز انجام میشود.
برای آشنایی با نماد شیمیایی عناصر مختلف خواندن مطلب «نماد شیمیایی عناصر چیست ؟ + همه نماد عناصر» توصیه میشود.
تقسیم بندی عناصر نادر خاکی چیست ؟
در دسته بندی انجام شده توسط آیوپاک، به فلزات نادر خاکی اشاره شد. این عناصر در سطری جداگانه در قسمت پایین جدول تناوبی قرار گرفتهاند. این عناصر شامل پانزده عنصر لانتانیدها به همراه اسکاندیم و ییتریوم هستند. این عناصر در ساخت وسایل با تکنولوژی بالا مورد استفاده قرار میگیرند.
مثال های دسته بندی عناصر
در ادامه سوالات چند گزینهای به منظور درک بهتر پرسش عنصرها به چند دسته تقسیم می شوند مطرح خواهد شد.
مثال اول دسته بندی عناصر
کدام گروه از عناصر پایدار و از نظر شیمیایی غیرفعال هستند؟
- فلزات قلیایی خاکی
- گازهای نجیب
- لانتانیدها
- فلزات قلیایی خاکی
پاسخ: گزینه ۲، گازهای نجیب.
مثال دوم دسته بندی عناصر
کدامیک از مشخصههای زیر متعلق به فلزات نیست؟
- آنها با غیرفلزات تشکیل ترکیبات یونی میدهند.
- یونهای منفی تشکیل میدهند.
- رسانای خوب جریان الکتریکی هستند
- چکشخوار هستند.
پاسخ: گزینه ۲، تشکیل یونهای منفی میدهند.
مثال سوم دسته بندی عناصر
کدام گروه در جدول تناوبی متعلق به فلزات قلیایی خاکی است؟
- گروه ۱
- گروه ۲
- گروه ۱۸
- گروه ۱۷
- گروه ۳
پاسخ: گزینه ۲، گروه ۲.
مثال چهارم دسته بندی عناصر
عناصر کدام گروه در جدول تناوبی با آب واکنش میدهند؟
- گروه ۱۷
- گروه ۳
- گروه ۱
- گروه ۲
- گروه ۱۸
پاسخ: گزینه ۳، گروه ۱.
مثال پنجم دسته بندی عناصر
عناصر کدام گروه در جدول تناوبی عددهای اکسایش مختلفی دارند؟
- گروه ۱۷
- گروه ۸
- گروه ۱۸
- گروه ۲
- گروه ۱
پاسخ: گزینه ۲، گروه ۸.
معرفی فیلم آموزش علوم تجربی - پایه هفتم
مجموعه فرادرس در تولید و محتوای آموزشی خود اقدام به تهیه فیلم آموزش علوم تجربی - پایه هفتم برای دانشآموزان پایه هفتم کرده که این مجموعه آموزشی از پانزده درس تشکیل شده است.
در این مطلب سعی کردیم به پرسش عنصرها به چند دسته تقسیم می شوند پاسخ دهیم. برای آشنایی بیشتر با این مبحث، تماشای دروس سوم و چهارم این مجموعه آموزشی توصیه میشود. در درس سوم، مبحث اتمها و الفبای مواد تدریس خواهد شد. مواد پیرامون ما را در درس چهارم فرا خواهید گرفت.
- برای دیدن فیلم آموزش علوم تجربی - پایه هفتم + اینجا کلیک کنید.
جمع بندی
در این مطلب به پرسش عنصرها به چند دسته تقسیم می شوند پاسخ دادیم. فهمیدیم که در حالت کلی عناصر به سه دسته فلزات، نافلزات و شبهفلزات طبقهبندی شدهاند. فلزات بزرگترین گروه جدول تناوبی هستند. در ادامه، به ترتیب نافلزات و شبهفلزات قرار گرفتهاند.










