مبانی ژنتیک مولکولی — به زبان ساده و خلاصه

در معنای لغوی، ژنتیک مولکولی شاخهای از ژنتیک است که با ساختار و عملکرد ژنها در سطح مولکولی سروکار دارد. اصطلاح ژنتیک مولکولی گاهی اوقات به یک نظریه بنیادی اشاره دارد که ادعا میکند ژنها تمام فرآیندهای حیات را از طریق تولید پلی پپتیدها (پروتئینها) هدایت میکنند، گاهی اوقات به یک تئوری اساسی نسبتاً کمتری در مورد بیان و تنظیم ژنها در سطح مولکولی و گاهی اوقات به یک روش تحقیقاتی اطلاق میشود که مبتنی بر استراتژیهای تحقیقاتی در نظریه اساسی ژنها است. در این مطلب مبانی ژنتیک مولکولی به صورت اجمالی توضیح داده شدهاند.
ژنتیک مولکولی چیست؟
ژنتیک مولکولی یک زیرشاخه از زیستشناسی است که نحوه تفاوت در ساختارها یا بیان مولکولهای DNA را به عنوان تغییر در موجودات نشان میدهد. ژنتیک مولکولی مطالعه فرایندهایی است که طی آنها اطلاعات بیولوژیکی ذخیره، کپی، ترمیم و رمزگشایی میشود تا پروتئین و سایر مولکولهای زیستی در سلولها و بافتها ایجاد شود. محققان در مباحث مختلف تحت عنوان مبانی ژنتیک مولکولی نحوه عملکرد ژنوم و ژنها را با استفاده از تکنیکهای مختلف، در سطح مولکولی بررسی میکنند.
کاربرد ژنتیک مولکولی چیست؟
آشنایی با مبانی ژنتیک مولکولی بینش جدیدی در مورد ماهیت ژنها و پروتئینها و رابطه بین آنها فراهم میکند. رویکردهای بیوشیمیایی و فیزیولوژیکی میتوانند نشان دهند که یک بیماری چگونه بر عملکرد سلولها، بافتها، اندامها و افراد جامعه تأثیر میگذارد. ژنتیک مولکولی با استفاده از ابزارهای آزمایشگاهی زیستشناسی مولکولی، مهندسی ژنتیک و دستورزی ژنتیکی تغییرات ساختار و توالی ژنهای انسانی را به تغییرات عملکردی در عملکرد پروتئین و در نهایت به سلامت و بیماری مرتبط میکند. از ژنتیکی مولکولی برای شناسایی گونهها و حتی گاهی جمعیت مبدا از یک نمونه با منشأ ناشناخته استفاده کرد.
پیشرفت فناوریهای ژنومی در حال رسیدن به نقطهای است که محققان قادر به تشخیص دقیق تغییرات ژنتیکی در بیماران، با هزینه کمتر خواهند بود و این پیشرفت نویدبخش تغییر اساسی در علم پزشکی است. اگرچه دانشمندان همچنان ناشناختههای بسیار و چگونگی تفسیر و رفع ابهام دادههای به دست آمده از کل ژنوم هستند و پژوهشگران همچنان برای پیشبرد تحقیقات و تکمیل مبانی ژنتیک مولکولی تلاش میکنند.
مبانی ژنتیک مولکولی
علم ژنتیک با ژنها، تنوع ژنتیکی، بیان ژتن، جهش ژنی و وراثت سروکار دارد. مبانی ژنتیک مولکولی از آن جهت مهم است که بسیاری از بیماریها در اثر جهشها یا تغییرات در سطح ژن یا هریک از مراحل تکثیر، رونویسی و بیان آنها اتفاق میافتند. مبانی ژنتیک مولکولی و ابزارهای مطالعه آن امکان بررسی عملکرد ژنها، جهش و تغییرات فنوتیپی را فراهم میکنند.
ساختار مولکولی DNA، رونویسی DNA، فرایند ترجمه و تولید پروتئین، آسیبشناسی مولکولی، همانندسازی و تکثیر DNA و مکانیسمهای ترمیم DNA، مکانیسمهای کنترل ژن از جمله سیگنالینگ، ماهیت تنوع ژنتیکی در جمعیتهای طبیعی و اینکه چگونه بر تکامل تأثیر میگذارد از جمله مباحث مهم ژنتیک مولکولی هستند. سیستمهای مورد مطالعه در مبانی ژنتیک مولکولی شامل تمام موجودات زنده است، هرچند که نتایج این مطالعات به طور مستقیم یا غیرمستقیم به سلامت انسان نیز مربوط میشوند.
از طریق تجزیه و تحلیل ژنها میتوان به بینش در مورد پیدایش عملکرد پروتئینها دست یافت. ارزیابی و مقایسه توالی DNA یک ژن با توالی نوع وحشی یا طبیعی آن و در نهایت، عملکرد پروتئین مربوط به جهشهای ژنی، منجر به کشف علل اختلال عملکرد اندامها و بیماریهای ژنتیکی میشود. مبانی ژنتیک مولکولی مرور اساسی ژنتیک و رابطه بین ژنها، پروتئینها و فنوتیپ را برجسته میکند. در این مبحث علاوه بر یادگیری تئوریهای ژنتیک مولکولی، انواع روشهای آزمایشگاهی مبانی ژنتیک مولکولی نیز آموزش داده میشوند.
ساختار مولکولی DNA
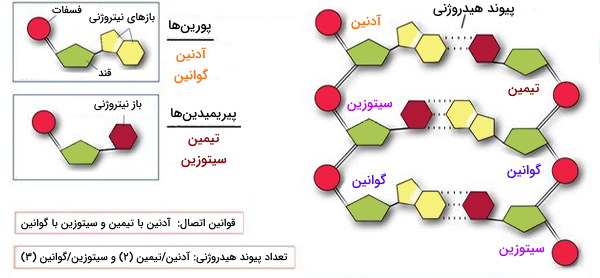
اساسیترین پیشنیاز برای یادگیری مبانی ژنتیک مولکولی درک ساختار مولکولی DNA است. تمام صفات ارثی موجودات زنده توسط مواد ژنتیکی یعنی ژنوم، یک اسید نوکلئیک طولانی به نام دئوکسی ریبونوکلئیک اسید (DNA) تعیین میشود. DNA از 3 × 109 نوکلئوتید تشکیل شده است. هر نوکلئوتید از یک قند (دئوکسی ریبوز)، یک باز نیتروژنی که میتواند آدنین (A)، گوانین (G)، سیتوزین (C) یا تیمین (T) باشد و یک گروه فسفات تشکیل شده است. این چهار باز نیتروژندار به دو گروه تقسیم میشوند:
- پورینها (A و G) دارای دو حلقه هتروسیکلین متصل به هم
- پیریمیدینها (C و T) دارای یک حلقه هتروسیکلیک
باقیماندههای قند و فسفات متوالی با پیوندهای فسفودیاستر (نوعی پیوند کووالانسی) به یکدیگر متصل میشوند و ستون فقرات مولکول DNA را تشکیل میدهند، همچنین هر باز نیتروژنی به هر قند متصل میشود. پایداری DNA در درجه اول به پیوندهای کووالانسی قوی که اتمهای تشکیل دهنده ستون فقرات خطی را به هم متصل میکنند و سپس به میانکنشهای غیر کووالانسی ضعیف بین مولکولها، وابسته است. در عین حال، به دلیل بارهای گروه فسفات موجود در هر نوکلئوتید، DNA مجموعا بار منفی دارد و بنابراین در آب بسیار محلول است.
DNA به صورت یک مارپیچ دوتایی است که در آن دو مولکول DNA توسط پیوندهای هیدروژنی ضعیف در کنار هم نگه داشته میشوند. پیوند هیدروژنی طبق قاعده واتسون - کریک بین دو باز متقابل در دو رشته DNA به وجود میآید. باز A با دو پیوند هیدروژنی به باز T و باز G با ۳ پیوند هیدروژنی به باز C متصل میشود. بنابراین دو رشته در واقع مکمل یکدیگر هستند. از آنجا که پیوندهای فسفو دی استر، اتمهای کربن شماره 3 و 5 شماره باقی مانده قند را به هم پیوند میدهند، انتهای هر رشته DNA دارای یک قند انتهایی است که در آن اتم کربن شماره 5 به باقی مانده قند دیگر متصل نباشد، بنابراین انتهای '5 نامیده میشود. سمت دیگر مولکول نیز انتهای '3 نام دارد.
دو رشته DNA غیر موازی هستند زیرا همیشه به گونهای با هم مرتبط میشوند که جهت '5 → '3 یک رشته DNA مخالف جهت رشته مکمل است. برای توصیف توالی DNA، توالی بازهای یک رشته معمولاً در جهت '5 → '3 خوانده میشوند که جهت همانندسازی DNA و همچنین رونویسی نیز هست.
کروماتین و کروموزوم
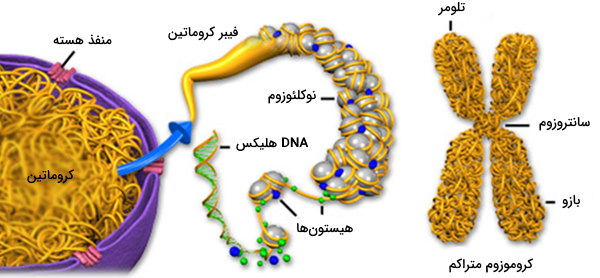
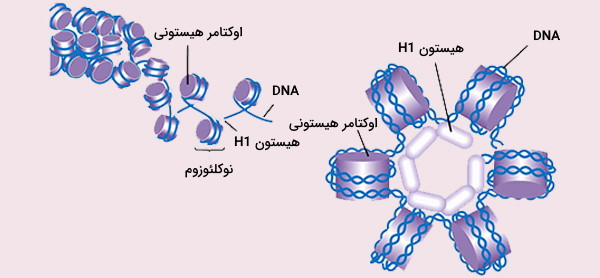
مبحث بعدی در مبانی ژنتیک مولکولی سازماندهی DNA در کروماتین و کروموزوم است. طول DNA انسان تقریباً 2 متر تخمین زده شده است. برای اینکه این مقدار از اسیدنوکلئیک در هسته 10 میکرومتری سلولهای انسان قرار بگیرد، باید به شدت متراکم شود. مارپیچ مضاعف DNA حداقل تحت دو سطح از پیچخوردگی قرار میگیرد، اولین سطح شامل پیچ خوردن در اطراف یک هسته مرکزی حاصل از هشت پروتئین هیستونی است که در نتیجه واحدهایی به نام نوکلئوزوم ایجاد میشوند. این نوکلئوزومها توسط بخشهایی از «DNA رابط» (Linker DNA) به هم متصل میشوند. دومین سطح پیچ خوردگی، شامل پیچ و تاب خوردن خود رشته نوکلئوزومها و ایجاد به یک فیبر کروماتین است.
طی مراحل مختلف چرخه سلولی، چگالی DNA متفاوت است. به عنوان مثال، در طول اینترفاز، الیاف کروماتین به شکل حلقههای طویل سازمان مییابد، در حالی که در متافاز، DNA در حدود یک ده هزارم متراکم شده و کروموزوم شکل میگیرد. در انسان 24 کروموزوم مختلف وجود دارد، که کروموزومهای 1 تا 22 اتوزوم و کروموزومهای بعدی به نام X و Y جنسی هستند. از آنجا که انسان دیپلوئید است، DNA دو نسخه دارد که از هر والد یک نسخه به ارث رسیده است و در نهایت 46 رشته کروماتید را میسازند. از جمله عناصر اصلی توالی DNA در هر کروموزوم عبارتند از:
- سانترومر: محل انقباض محل اتصال کروماتیدهای خواهر و اتصال کروموزومها به دوک میتوزی
- تلومر: بخشی که انتهای کروموزومها را پوشانده است.
- نقطه همانندسازی: جایی که همانندسازی DNA آغاز میشود.
کروماتین در دو حالت یوکروماتین (Euchromatin) یا بسیار متراکم هتروکروماتین (Heterochromatin) درون هسته وجود دارد. سطح تراکم بر وضعیت رونویسی مناطق DNA مربوطه تأثیر میگذارد، در حالت یوکروماتین، DNA از نظر همانندسازی و رونویسی فعال و در حالت هتروکروماتین غیر فعال است. ساختار هتروکروماتینی نیز دو حالت دائمی و غیر دائمی دارد که به ترتیب مناطق غیر فعال ژنوم در سلولهایی با عملکرد مختلف و مناطق غیر فعال ژنوم در مراحل مختلف از بیان ژن را میسازند. در زیر میکروسکوپ نوری، مناطق یوکروماتین و هتروکروماتین به ترتیب به صورت نوارهای روشن و تاریک در کروموزومهای متافاز مشاهده میشوند.
DNA ژنومی شامل مناطق کُدکننده و مناطق غیر کُدکننده است. مناطق غیر کدکننده در جمع شدن DNA، تشکیل کروموزوم، سازماندهی کروماتین در هسته، تنظیم رونویسی و موارد دیگر نقش دارند. مناطق کدکننده مسئول رونویسی از مولکولهای RNA و در نهایت سنتز پروتئین هستند. کروموزومهای یوکاریوتی اغلب بسیار طویل بوده و ریشههای تکرار متعددی دارند که در امتداد هر کروموزوم پراکنده شدهاند. همانندسازی در یوکاریوتها، مانند باکتریها دو جهته است. یک جفت چنگال همانندسازی از هر مبدأ کپیبرداری شروع میشوند و سپس هریک از دو چنگال در جهت مخالف حرکت میکنند. برآمدگیهای DNA در مرحله تکثیر، حباب همانندسازی نامیده میشوند.
هیستون چیست؟
ژنوم انسان هاپلوئید تقریباً شامل 3 میلیارد جفت باز DNA است که در 23 کروموزوم قرار دارند. سلولهای بدن به جز تخمک و اسپرم، دیپلوئید و دارای 23 جفت کروموزوم هستند یعنی در مجموع 6 میلیارد جفت باز DNA در سلول انسان وجود دارند. از آنجا که طول هر جفت باز در حدود 0/34 نانومتر است، بنابراین درون هر سلول دیپلوئید حدود 2 متر DNA وجود دارد. تخمین زده میشود که بدن انسان حدود 50 تریلیون سلول و در نتیجه در هر انسان 100 تریلیون متر DNA وجود دارد. خورشید 150 میلیارد متر از زمین فاصله دارد و هریک از ما DNA کافی برای طی این فاصله از اینجا به خورشید و بازگشت بیش از 300 بار، یا برای 2/5 میلیون بار گردش به دور زمین بر محور استوا را داریم.
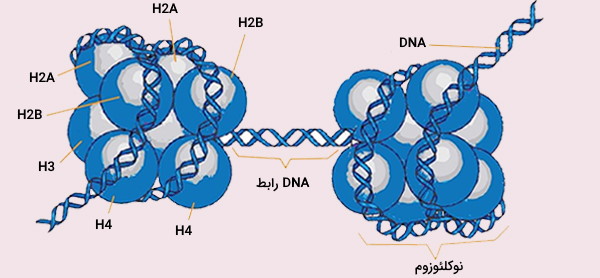
چگونه ممکن است این مقدار از DNA درون هر سلول جای بگیرد؟ پاسخ این سوال با بهرهگیری از مبانی ژنتیک مولکولی امکانپذیر است. وجود پروتئینهای خاصی که DNA کروموزومی را در هسته میکروسکوپی متراکم میکنند، امکان قرارگیری این مقدار از اسیدنوکلئیک را در هسته به وجود میآورد. این پروتئینها هیستون نامیده میشوند و مجموعه پروتئین - DNA حاصل، كروماتین نام دارد. هیستونها درون هسته، انرژی (عمدتا به شکل فعل و انفعالات الکترواستاتیک) را برای جمع شدن DNA فراهم میکنند. هیستونها خانوادهای از پروتئینهای کوچک و دارای بار مثبت هستند که با اسامی H1 ،H2A ،H2B ،H3 و H4 نامیده میشوند. DNA که به دلیل وجود گروههای فسفات بار منفی دارد، بسیار محکم به هیستونها متصل میشود.
هیستونهای H2A ،H2B ،H3 و H4 به عنوان هیستونهای اصلی و هیستونهای H1 و H5 به عنوان هیستونهای اتصال دهنده شناخته میشوند. هیستونهای هستهای به صورت دیمر هستند. سه آلفاهلیکس که توسط دو حلقه به هم متصل شدهاند، ساختار مارپیچی است که امکان تعامل بین دیمرهای مشخص را، به ویژه به صورت سر - دم (که به آن موتیف دست نیز گفته میشود) فراهم میکند. سپس چهار دیمر مجزا حاصل از هم جمع میشوند و یک هسته نوکلئوزوم هشت ضلعی را تشکیل میدهند که قطر آن تقریباً 63 آنگستروم است.

حدود 146 جفت باز (جفت باز) DNA در اطراف این ذره هسته 1/65 بار در یک دور از سوپرهلیکس چپ گرد پیچیده میشود تا ذرهای به عرض حدود 100 آنگستروم ایجاد کند. هیستون H1 نوکلئوزوم را در محلهای ورود و خروج DNA متصل میکند، بنابراین DNA را در جای خود قفل کرده و اجازه میدهد یک ساختار منظمتر تشکیل شود. ابتداییترین شکل نوکلئوزوم، دانههای 10 نانومتری روی رشته هستند که DNA به دور نوکلئوزومها با تقریباً 50 جفت باز DNA هر جفت نوکلئوزوم را جدا میکند (که به آن DNA linker نیز گفته میشود).
ساختارهای منظمتر شامل فیبر 30 نانومتری (زیگزاگ نامنظم) و الیاف 100 نانومتری هستند که در سلولهای طبیعی یافت میشوند. طی تقسیم میتوز و میوز، کروموزومهای متراکم از طریق فعل و انفعالات بین نوکلئوزومها و سایر پروتئینهای تنظیم کننده همانندسازی تجمع مییابند. هیستونها پنج نوع میانکنش با DNA دارند که عبارتند از موارد زیر:
- پلهای نمکی و پیوندهای هیدروژنی بین زنجیرههای جانبی اسیدهای آمینه (به ویژه لیزین و آرژنین) و اکسیژنهای گروه فسفات در DNA
- دوقطبیهای هلیکس از آلفا هلیکسها در H2B ،H3 و H4 باعث بار مثبت خالص در محل تعامل با گروههای فسفات با بار منفی روی DNA میشوند.
- پیوندهای هیدروژنی بین ستون فقرات DNA و گروه آمید در زنجیره اصلی هیستونها
- میانکنش غیر قطبی بین قندهای هیستون و دئوکسی ریبوز DNA
- قرارگیری غیر اختصاصی دم انتهایی H3 و H2B در هر دو شیار کوچک مولکول DNA
تغییرات هیستونی (Histone Modifications) مانند متیلاسیون، فسفوریلاسیون، استیلاسیون، یوبی کوئیتینه شدن و عکس آنها که هریک بر روی نوع مشخصی از هیستون و بر روی جفت باز جیگاه معینی صورت میگیرند، از جمله مکانیسمهای مهم در تنظیم بیان ژنها هستند. این تغییرات به ویژه در اپی ژنتیک مورد مطالعه قرار میگیرند.
واریانت های هیستونی
واریانتهای هیستونی نمونههای غیر آللی هستند که جایگزین هیستونهای هستهای در نوکلئوزومها میشوند. هیستونها و انواع آنها تا حد زیادی در هریک از گونهها محافظت شده هستند. انواع مختلفی از هیستونهای H2A ،H2B و H3 شناسایی شدهاند اما شواهد اندکی برای وجود انواع H4 در پستانداران وجود دارند. برخلاف هیستونهای اصلی، واریانتهای هیستونی مستقل از همانندسازی هستند و بدون توجه به تقسیم سلولی، تولید و به نوکلئوزومها اضافه شوند.
هیستونها به تکثیر وابسته هستند و فقط در مرحله S از چرخه سلولی و با همانندسازی DNA، بیان میشوند. اما واریانتهای هیستونی در همه مراحل چرخه سلولی تولید میشوند و نقش منحصر به فردی در سلولها پس از میتوز مانند نورونها را نشان میدهد.
نوکلئوزوم چیست؟
واحد ساختاری تکرار شونده و عملکردی کروماتین، نوکلئوزوم است که هشت پروتئین هیستون و حدود 146 جفت باز DNA دارد. کروماتین زیر میکروسکوپ الکترونی شبیه دانههای تسبیح دیده میشود. در هر نوکلئوزوم، دو عدد از هریک از هیستونهای H2A ،H2B ،H3 و H4 با هم یک اکتامر هیستونی تشکیل میدهند که تقریباً 1/7 مرتبه به دور DNA (حدود 146 جفت باز) میپیچد. با افزودن یک پروتئین H1 دیگر به این مجموعه، نوکلئوزوم به اندازه ۲۰ جفت باز دیگر به دور اکتامر میپیچد و ساختاری به نام کروماتوزوم تشکیل میشود.
با توجه به اینکه هر کروموزوم به طور متوسط بیش از 100 میلیون جفت باز دارد، هر کروموزوم حاوی صدها هزار نوکلئوزوم است و این نوکلئوزومها با بخشی DNA (به طور متوسط حدود 20 جفت باز) که بین آنها قرار دارد (DNA رابط) به یکدیگر مرتبط هستند. مقدار DNA موجود در هر نوکلئوزوم با تیمارسازی کروماتین توسط آنزیم DNAase تعیین شده است. هیستونها با اضافه شدن گروههای استیل (استیلاسیون)، متیل (متیلاسیون) یا فسفات توسط آنزیمهای خاصی، دچار تغییراتی میشوند که در نحوه بیان ژن و خاموش و روشن شدن آنها نقش دارند. در مبانی ژنتیک مولکولی ساختار نوکلئوزوم با جزئیات بررسی میشود.
ساختار ژن
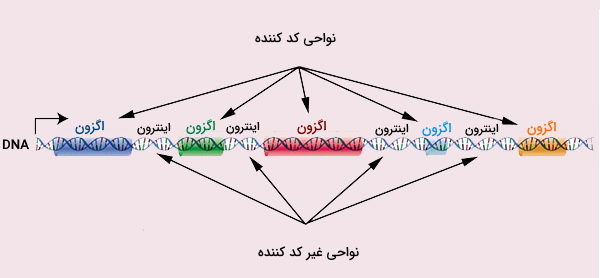
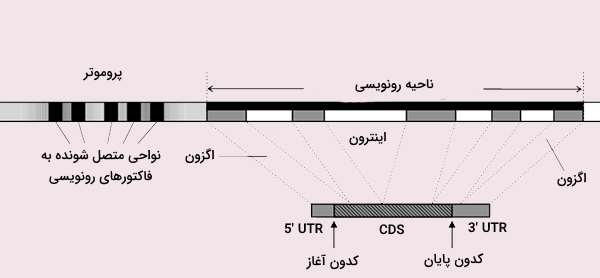
ژنها اصلیترین مبحث در مبانی ژنتیک مولکولی و بخشهایی از DNA هستند که یک پلیپپتید را کد میکنند. تخمین زده میشود که ژنوم انسان تقریباً 20000 ژن مختلف داشته باشد. طور خاص، هر ژن حاوی مناطق نظارت و کدکننده است که به ترتیب رونویسی آنها را برای محصول پلیپپتیدی تنظیم میکنند. منطقه تنظیم کننده بیان ژن، پروموتر نام دارد که ماشین رونویسی (شامل آنزیمها و پروتئینهای خاص آغازگر رونویسی) در این ناحیه به DNA متصل میشود. از سایر مناطق نظارتی میتوان منطقه افزایشدهنده را نام برد که بیان ژن را در بافتها یا سلولهای مختلف تنظیم میکنند و تا چندین هزار باز در بالادست یا پایین دست کدون وجود دارند.
مناطق کدکننده شامل دو ناحیه متوالی به نام اگزون و اینترون هستند. طول و تعداد اگزونها در ژنهای مختلف متفاوت است. اینترون نواحی پراکنده بین اگزونها و توالیهای غیر کدکننده هستند که بیشترین درصد یک ژن را تشکیل میدهند. تخمین زده میشود که 80 درصد از ژنوم انسان بیان میشود اما محصول تنها 2 درصد از این مقدار، پروتئین است.
همانندسازی چیست؟
درک فرایند همانندسازی در یوکاریوتها و پروکاریوتها یکی از زمینههای مطالعاتی و تحقیقاتی مبانی ژنتیک مولکولی است. در ژنوم انسان تقریباً ۳ میلیارد جفتباز وجود دارد که همه آنها باید هنگام تقسیم سلول با دقت کپی شوند. مکانیسمهای اصلی تکثیر DNA در موجودات زنده مشابه است. مکانیسم تکثیر DNA یوکاریوتیک مشابه همانندسازی پروکاریوتی DNA است. با این وجود، تکثیر DNA یوکاریوتی به دلیل تفاوت در اندازه DNA، ساختارهای انتهایی خطی منحصر به فرد DNA به نام تلومر و بستهبندی متمایز DNA با مجتمعهای هیستونی، نکات ویژهای دارد. برخلاف پروکاریوتها، اکثر یوکاریوتها به جز مخمر موجوداتی چند سلولی هستند.
بنابراین، تکثیر DNA در یوکاریوتها یک فرایند بسیار تنظیم شده است و معمولاً به سیگنالهای خارج سلولی برای هماهنگی تقسیمات سلولی در بافتهای مختلف نیاز دارد. سیگنالهای خارجی در مرحله G1 چرخه سلولی منتقل میشوند و سنتز سایکلینها (Cyclins) را در سلول هدف فعال میکنند. سایکلینها مجتمعهایی با کینازهای وابسته به سیکلین (CDK) تشکیل میدهند که به نوبه خود باعث تحریک سنتز پروتئینهای خاصی در فاز S، مانند DNA پلیمرازها و تیمیدیلات سنتاز میشوند.
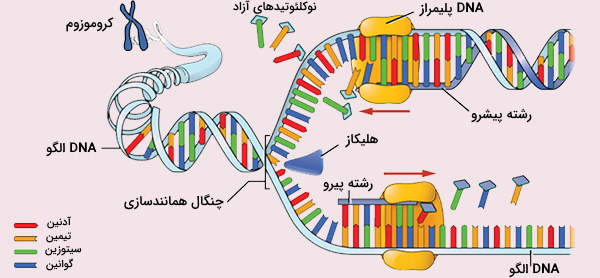
شروع همانندسازی DNA در یوکاریوتها با اتصال کمپلکس شناسایی مبدأ (ORC) به ریشههای همانندسازی در مرحله G1 چرخه سلولی آغاز میشود. سپس مجموعه ORC به عنوان بستری برای تشکیل مجتمعهای پیش تکرار بسیار پیچیده (pre - RC) عمل میکند. تشکیل پیش-RCها شامل مونتاژ پروتئین 6p (Cdc6p) چرخه تقسیم سلولی، فاکتور تکثیر DNA Cdt1p، مجموعه نگهداری مینی کروموزوم (Mcm 2p - 7p) و سایر پروتئینها است. Pre - RCهای ایجاد شده در مرحله G1 طی انتقال چرخه سلولی از G1 به S با عمل دو کیناز وابسته به سیکلین (CDK) و کیناز وابسته به Dbf4 (DDK) به مجموعه شروع تبدیل میشوند.
تشکیل یک مجموعه آغازین که شامل فعالیت هلیکاز است، مارپیچ دوگانه DNA را در محل مبدا باز میکند. کمپلکس DNA پلیمراز α - پریماز اولین آغازگر را سنتز میکند. همانندسازی DNA در رشته پیشرو و قطعات اوکازاکی در رشته پیرو را آغاز میکند. علاوه بر پلیمراز α-پریماز، دو DNA پلیمراز δ و ε، برای تکثیر DNA مورد نیاز است. پلیمراز δ اصلیترین پلیمراز در سنتز رشتههای پیشرو است. پلیمرازها δ و ε عمدهترین پلیمرازها در سنتز رشته پیرو هستند. این در DNA رشته پلیمراز I و III در سنتز پروکاریوتهای رشتهای مشابه است.
در یوکاریوتها، قطعات اوکازاکی تولید شده در طی سنتز رشته پیرو کوتاهتر از آنهایی است که در E. coli وجود دارد (تا 200 باز در یوکاریوتها در مقابل تا 2000 باز در E. coli). همچنین، تکثیر DNA یوکاریوتی با تشکیل تعداد زیادی چنگال همانندسازی از ریشههای متعدد برای تکمیل تکثیر DNA در زمان موجود در مرحله S چرخه سلولی آغاز میشود. دو تفاوت کلیدی DNA یوکاریوتی و پروکاریوتی، وجود مجتمعهای هیستونی و تلومر است. هیستونها مسئول سازمان ساختاری DNA در کروموزومهای یوکاریوتی هستند.
بار مثبت هیستونها، به دلیل وجود تعداد زیادی باقیمانده لیزین و آرژنین، یکی از ویژگیهای اصلی این مولکولها است که باعث اتصال محکم آنها به DNA میشود. همانطو که گفته شد یک جفت از هر چهار هیستون (H2A ،H2B ،H3 و H4) با هم ترکیب میشوند و یک دانه هشت پروتئینی ایجاد میکنند که رشته DNA به دور آن پیچ میخورد. این ساختار مهره مانند نوکلئوزوم نام دارد. قطر نوکلئوزوم 10 نانومتر و تقریباً شامل 200 جفت باز است. هر نوکلئوزوم توسط یک بخش کوتاه DNA (پیوند دهنده) و یک هیستون دیگر (H1) به نوکلئوزوم مجاور مرتبط میشود.
DNA موجود در نوکلئوزوم با تشکیل ساختارهای ضخیمتری به نام کروماتین بیشتر متراکم میشود و این متراکمسازی باید آنقدر افزایش یابد تا در نهایت DNA به شکل کروموزوم در مرحله متافاز میتوز در بیاید. علی رغم این بستهبندی متراکم، DNA در کروموزومها باید در طول تکثیر و بیان ژن برای پروتئینهای تنظیمکننده قابل دسترسی باشد. در سطح بالاتری از سازماندهی DNA، کروموزومها به مناطقی تقسیم میشوند که یوکروماتین و هتروکروماتین نام دارند. به نظر میرسد رونویسی ژنها فقط در نواحی یوکروماتین محدود شده، در حالی که DNA در مناطق هتروکروماتین از نظر ژنتیکی غیرفعال است.
طی همانندسازی DNA، مجموعههای هیستونی سازنده نوکلئوزومها، از هم جدا میشوند. رشته پیشرو هیستونهای قدیمی را حفظ میکند بنابراین رشته پیرو فاقد کمپلکسهای هیستونی است و برای آن، هیستونهای جدید ساخته و مونتاژ میشوند. از آنجا که هیستونها تمایل بیشتری برای DNA دو رشتهای دارند، با پلیمریزه شدن مکمل رشته پیرو، اکتامرهای هیستونی تازه سنتز شده به آن اضافه میشوند.
سنتز رشته پیرو در هر انتهای DNA به یک پرایمر نیاز دارد تا تکثیر در جهت '5 تا '3 درجه انجام شود. این در انتهای DNA غیرممکن میشود و هر بار که کروموزوم تکثیر میشود بخشی از آغازگر RNA در انتهای '5 هر دو رشته پیشرو و پیرو از بین میرود. از آنجا که DNA در کروموزومهای یوکاریوتی یک مولکول خطی است، در انتهای DNA مکمل رشته پیرو، همانندسازی دچار مشکل خواهد شد. بنابراین، در هر بار تقسیم میتوز، DNA موجود در کروموزومها کوتاهتر میشوند. برای جلوگیری از نابود شدن اطلاعات ضروری ژنتیکی در هنگام تکثیر، انتهای DNA در کروموزومها حاوی ساختارهای خاصی به نام تلومر هستند.
در مبانی ژنتیک مولکولی تلومرها که عامل اصلی پیری سلول هستند نیز مورد بررسی قرار میگیرند. تلومرهای انسانی توالیهای انتهایی و تکراری (TTAGGG) n هستند و اندازه معمول آنها 15 تا 20 کیلوبایت در بدو تولد است. در هر دور تکثیر DNA، توالی تلومر کروموزومهای یوکاریوتی کوتاه میشود. این مورد در مورد سلولهای سوماتیک طبیعی وجود دارد و تعداد تکثیر DNA / تقسیمات سلولی با زمان مرگ سلول ارتباط دارد. با این حال، سلولهای زایایی و سلولهای سرطانی حاوی آنزیمهایی به نام تلومراز برای گسترش '5 انتهای رشتههای پیرو هستند. گسترش توالی تلومر توسط تلومراز در این سلولها به ادامه حیات آنها کمک میکند.
تلومراز انسانی یک رونویسی از نوع معکوس است که حاوی کششی کوتاه از توالی RNA به صورت AUCCCAAUC است. این توالی کوتاه RNA به عنوان الگویی برای پسوند تلومر عمل میکند و نقش اصلی را در پیشبرد رشته دارد. وقتی تکثیر DNA به پایان رسید، تلومراز به انتهای '3 رشته پیشرو متصل میشود. این جفتسازی پایه را با توالی کوتاه توالی RNA که تلومراز حمل میکند برقرار خواهد کرد و یک توالی 6 نوکلئوتیدی (GGTTAG) به انتهای '3 رشته اضافه میکند. پس از اتمام همانندسازی رشته پیشرو، رشته پیرو در انتهای '3 توسط تلومراز، DNA پلیمراز آلفا انتهای '5 رشته پیرو را تکمیل میکند.
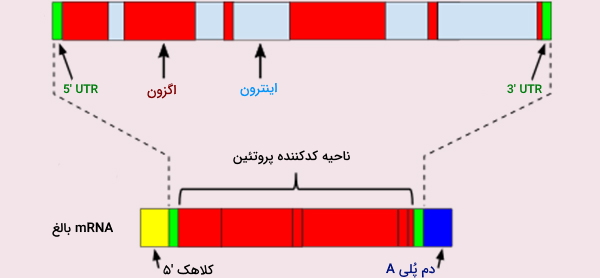
رونویسی چیست؟
انتقال اطلاعات از DNA به سطح پروتئین به صورت مرحلهای انجام گرفته و با رونویسی ژن به mRNA آغاز میشود. به طور خاص، ماشین رونویسی (از جمله RNA پلیمراز و انواع مختلف رونویسی) به پروموتر ژن متصل میشود، مارپیچ دوتایی در آن مکان باز میشود و یک رشته مولکول mRNA اولیه تک رشتهای (hn - RNA)، مکمل آن توالی ژن، سنتز میشود.
RNA در مقابل DNA، یک اسیدنوکلئیک تک رشتهای است که به جای دئوکسیریبوز و یوراسیل به جای تیمین، حاوی ریبوز است. مولکولهای ناهمگن mRNA، یک سری مراحل پردازش از جمله کلاهک '5، دم پلی A (50 تا250 مولکول آدنین و پروتئین 70kDa) در انتهای '3 و اتصال، برای حذف توالیهای اینترون را طی میکنند. اتصال متناوب نیز میتواند اتفاق بیفتد که اگزونهای خاصی را حذف میکند و به تنوع پروتئینهایی که هر ژن کد میکند را کمک میکند.
ترجمه چیست؟
مولکولهای mRNA بالغ در سلول به پروتئینها ترجمه میشوند. این فرآیند مهم در مبانی ژنتیک مولکولی در سیتوپلاسم و با کمک ریبوزومها صورت میگیرد که مجموعهای از RNAها و پروتئینهایی به نام ریبونوکلئوپروتئینها هستند. ریبوزومها به دو زیر واحد تقسیم میشوند: زیر واحد کوچکتر به mRNA متصل میشود، در حالی که زیر واحد بزرگتر به tRNA متصل میشود که حامل اسیدهای آمینه است. وقتی ریبوزوم خواندن mRNA را به پایان رساند، این دو زیر واحد از هم جدا میشوند.
به طور خاص، ریبوزومها mRNA را متصل میکنند و از طریق آن به عنوان کدونهای سه گانه خوانده میشوند که معمولاً با یک سه گانه AUG (کدون شروع) پایین دست محل اتصال ریبوزوم شروع میشود. برای هر کدون، ریبوزوم، با کمک عوامل شروع، یک مولکول tRNA مکمل را استخدام میکند که به نوبه خود حامل یک اسید آمینه خاص است. هر کدون اسیدآمینه خاصی را کد کرده و از آنجا که اسیدهای آمینه به زنجیره پپتید در حال رشد متصل میشوند، شروع به جمع شدن به شکل صحیح میکنند.
فرآیند ترجمه با کدونهای توقف UAA ،UGA یا UAG به پایان میرسد. سپس زنجیره پلیپپتیدی از ریبوزوم به عنوان یک پروتئین آزاد میشود. در برخی موارد، زنجیره پلیپپتیدی جدید برای تولید پروتئین عملکردی به پردازش اضافی نیاز دارد. پروتئینها به نوبه خود میتوانند تحت طیف وسیعی از تغییرات پس از ترجمه قرار بگیرند. نقش نهایی آنها در فیزیولوژی سلول میتواند بسیار متغیر و شامل نقش ساختاری، آنزیمی، هورمونی، سیگنالی، انتقال دهنده یا ارتباطی باشد.
پردازش ژن چیست؟
یکی از جالبترین بخشهای مبانی ژنتیک مولکولی پردازش ژن (Gene Splicing) یا پیرایش ژن است. این فرایند پس از رونویسی و روی RNA صورت میگیرد که در آن یک ژن میتواند پروتئینهای متعددی را کد کند. پردازش ژن در یوکاریوتها قبل از ترجمه mRNA و با حذف و اضافه کردن قطعاتی از آن صورت میگیرد. پردازش ژن مبحث مهمی در مبانی ژنتیک مولکولی است که تنوع پروتئین را در سلولها بافتها و افراد مختلف توضیح میدهد.
طی یک رویداد متصل کننده ژن، رونویسی پیش mRNA از یک ژن میتواند منجر به تولید انواع مختلف mRNA شود که چندین پروتئین عملکردی تولید میکنند. بنابراین پردازش، ظرفیت کدگذاری ژنوم را افزایش میدهد و همچنین باعث سنتز ایزوفرمهایی میشود که از نظر ساختاری و عملکردی متمایز هستند. در سلولهای انسانی، حدود 40 تا 60 درصد از ژنها شناخته شدهاند که میتوانند تحت پردازش ژن قرار بگیرند.
RNA چیست؟
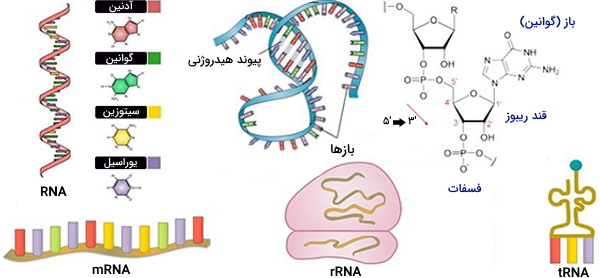
ریبونوکلئیک اسید (RNA) یک ماکرومولکول بیولوژیکی مهم است که در تمام سلولهای بیولوژیکی وجود دارد و در مبانی ژنتیک مولکولی مورد مطالعه قرار میگیرد. متداولترین انواع RNA اصولاً در سنتز پروتئینها نقش دارند که برخی دستورالعملهای موجود در ژن را از DNA که حاوی کدهای ژنتیکی مورد نیاز است حمل میکنند (mRNA) و برخی دیگر در فراخوانی اسیدهای آمینه (tRNA) و همچنین انواعی از آنها در ساختار ریبوزوم (rRNA) که محل تولید پلیپپتیدها است نقش دارند. در برخی ویروسها، RNA به جای DNA، اطلاعات ژنتیکی را به همراه دارد. نوع RNA، عملکرد آن در سلول را مشخص میکند.
جدا از منطقه کدگذاری مولکولهای RNA پیامرسان یا همان mRNA که به پروتئین ترجمه خواهند شد، سایر عناصر RNA سلولی در فرایندهای مختلف نقش دارند که شامل تنظیم بیان ژن در مرحله رونویسی و پس از رونویسی، سنجش دما، لیگاند و کنترل ترجمه است. RNA متشکل از نوکلئوتیدهای ریبوز (بازهای نیتروژنی متصل به یک قند ریبوز) است که توسط پیوندهای فسفودیستر متصل شده و رشتههایی با طولهای مختلف را تشکیل میدهد. بازهای ازته در RNA آدنین، گوانین، سیتوزین و یوراسیل است که جایگزین تیمین در DNA میشود.
قند ریبوز RNA یک ساختار حلقوی است که از پنج کربن و یک اکسیژن تشکیل شده است. وجود یک گروه هیدروکسیل متصل به گروه دوم کربن در مولکول قند ریبوز، RNA را مستعد هیدرولیز میکند. این عدم توانایی شیمیایی RNA، در مقایسه با DNA که یک گروه −OH واکنشی در همان موقعیت بر روی بخش قند (دئوکسی ریبوز) ندارد، تصور میشود که یکی از دلایل تکامل DNA به عنوان حامل ترجیحی اطلاعات ژنتیکی در اکثر موارد باشد. ارگانیسمها ساختار مولکول RNA توسط R.W. Holley در سال 1965 توصیف شد.
RNA معمولاً به صورت یک بیوپلیمر تک رشتهای وجود دارد. با این حال، وجود توالیهای خود مکمل در رشته RNA منجر به جفت شدن باز داخل زنجیره و تا شدن زنجیره ریبونوکلئوتید به فرمهای پیچیده ساختاری متشکل از برآمدگی و مارپیچ میشود. ساختار سه بعدی RNA برای پایداری و عملکرد آن حیاتی است. قند ریبوز و بازهای نیتروژندار به روشهای مختلف توسط آنزیمهای سلولی که گروههای شیمیایی (به عنوان مثال، گروههای متیل) را به زنجیره متصل میکنند، در صورت نیاز اصلاح میشود.
چنین تغییراتی باعث ایجاد پیوندهای شیمیایی بین مناطق دور در رشته RNA میشود و منجر به انقباضات پیچیده در زنجیره RNA میشود که ساختار RNA را بیشتر تثبیت میکند. مولکولهایی با تغییرات ساختاری ضعیف و تثبیت ممکن است به راحتی از بین بروند. به عنوان مثال، در یک مولکول انتقالدهنده RNA (tRNA) که فاقد یک گروه متیل (tRNAiMet) است، تغییر در موقعیت 58 زنجیره tRNA، مولکول را ناپایدار و از این رو غیرفعال میکند. زنجیره غیرفعال توسط مکانیسمهای کنترل کیفیت tRNA سلولی از بین میرود.
RNAها همچنین میتوانند مجتمعهایی با مولکولهای معروف به ریبونوکلئوپروتئین (RNP) تشکیل دهند. نشان داده شده است که بخش RNA حداقل یک RNP سلولی به عنوان یک کاتالیزور بیولوژیکی عمل میکند، عملکردی که قبلا فقط به پروتئینها نسبت داده شده بود. از میان انواع مختلف RNA، شناختهشدهترین آنها شامل RNA پیام رسان (mRNA)، RNA انتقال دهنده (tRNA) و RNA ریبوزومی (rRNA) هستند که در همه موجودات وجود دارند. این و سایر انواع RNA در درجه اول واکنشهای بیوشیمیایی، مشابه آنزیمها را انجام میدهند.
برخی از انواع RNA، عملکردهای نظارتی پیچیدهای در سلولها دارند که در مبانی ژنتیک مولکولی مورد مطالعه قرار میگیرند. RNAها به دلیل درگیر شدن در بسیاری از فرایندهای نظارتی، فراوانی و عملکردهای متنوع، نقش مهمی در فرآیندهای سلولی طبیعی و بیماریها دارند. در سنتز پروتئین، mRNA کدهای ژنتیکی را از DNA در هسته به ریبوزومها، مکانهای ترجمه پروتئین در سیتوپلاسم، حمل میکند. ریبوزومها از rRNA و پروتئین تشکیل شدهاند. زیر واحدهای پروتئین ریبوزوم توسط rRNA کدگذاری شده و در هسته ساخته میشوند. پس از تولید و تجمع آنها، به سیتوپلاسم و در محلی به عنوان تنظیمکنندههای اصلی ترجمه منتقل خواهند شد و کد حمل شده توسط mRNA را میخوانند.
توالی سه باز ازته در mRNA ترکیب یک اسید آمینه خاص در توالی تشکیلدهنده پروتئین را مشخص میکند. مولکولهای tRNA (که گاهی اوقات RNA محلول یا فعالکننده نیز نامیده میشود) که حاوی کمتر از 100 نوکلئوتید است، آمینو اسیدهای مشخص شده را به ریبوزومها میرساند، جایی که آنها به پروتئین ها متصل میشوند. RNAها را میتوان به طور کلیتری به انواع کدکننده (cRNA) و RNA غیر کدکننده (ncRNA) تقسیم کرد. ncRNAها دو نوع دارند، ncRNAهای هاوسکیپینگ (tRNA و rRNA) و ncRNAهای نظارتی که بیشتر بر اساس اندازه طبقهبندی میشوند.
ncRNAهای طویل (lncRNA) حداقل 200 نوکلئوتید و ncRNAهای کوچک کمتر از 200 نوکلئوتید دارند. ncRNAهای کوچک به میکروNA ،(miRNA) RNAR هستهای کوچک (snoRNA)، RNA هستهای کوچک (snRNA)، siRNA و piRNA تقسیم میشوند. miRNAها انواع دیگری از mRNA هستند که طول آنها حدود 22 نوکلئوتید است و در تنظیم ژن در اکثر یوکاریوتها عملکرد مهمی دارند. آنها میتوانند با اتصال به mRNA هدف و مهار ترجمه، مانع (سکوت) بیان ژن شوند، در نتیجه از تولید پروتئینهای عملکردی جلوگیری میکنند.
بسیاری از miRNAها نقش مهمی در سرطان و سایر بیماریها دارند. به عنوان مثال، miRNAهای مهاركننده تومور و آنكوژنیک (شروع كننده سرطان) میتوانند ژنهای منحصر به فرد هدف را تنظیم كرده و منجر به تومورزایی و پیشرفت تومور شوند. RNA حلقوی (circRNA) از سایر انواع RNA منحصر به فرد است زیرا انتهای '5 و '3 آن به هم پیوند خورده و یک حلقه ایجاد میکنند به همین دلیل در برابر تخریب واسطه اگزونوکلئاز مقاوم است و احتمالاً از اکثر RNA خطی سلولها پایدارتر است.
circRNA با برخی بیماریها مانند سرطان، آترواسکلروزیس، آلزایمر و پارکینسون ارتباط دارد. circRNAها از بسیاری از ژنهای رمزگذار پروتئین تولید میشوند و برخی میتوانند به عنوان الگوهای سنتز پروتئین، مشابه mRNA عمل کنند. آنها همچنین میتوانند به miRNA متصل شوند و از اتصال مولکولهای miRNA به اهداف آنها جلوگیری میکند. علاوه بر این RNA حلقوی نقش مهمی در تنظیم رونویسی و انعطافپذیری جایگزین ژنهای کدکننده خود دارند. در مبانی ژنتیک مولکولی انواع RNA و نقش آنها در عملکرد سلول بررسی میشوند و ابزارهای مطالعاتی و آزمایشگاهی خوبی برای بسیاری از پژوهشها هستند.
تنظیم بیان ژن چیست؟
به دلیل مکانیسم تنظیم بیان ژن، هر نوع سلول در بدن دارای مجموعهای متفاوت از ژنهای فعال است، علی رغم این واقعیت که تقریباً تمام سلولهای بدن دقیقاً DNA مشابهی دارند. این الگوهای مختلف بیان ژن باعث میشوند که انواع مختلف سلولها دارای پروتئینهای مختلفی باشند و هر نوع سلول به طور خاص برای انجام فعالیتهای خاص خود تخصص یافته شود.
الگوی بیان ژن در سلول توسط مجموعهای از پیامهای داخل و خارج سلول تنظیم میشود مانند پروتئینهایی که از سلول مادری به ارث میرسد، آسیب DNA و مقدار ATP که داخلی هستند و پیامهای خارج سلولی همچون سیگنالهای شیمیایی سلولهای دیگر، سیگنالهای مکانیکی ماتریکس خارج سلول و سطح مواد مغذی. مسیرهای مولکولی که به دنبال هریک از این پیامها درون سلول شکل میگیرند، در نهایت منجر به تغییر در بیان یا میزان بیان ژنهای مختلف میشوند. بیان ژن در یوکاریوتها مراحل زیادی دارد که تقریباً در تمام این سطوح و همچنین در نقاط مختلف ژن قابل تنظیم هستند. مکانیسمهای متعدد تنظیم بیان ژن عبارتند از:
- قابلیت دسترسی به کروماتین: ساختار کروماتین (DNA و پروتئینهای سازمان دهنده آن) قابل تنظیم است. کروماتین بازتر یا ریلکس یک ژن را برای رونویسی بیشتر در دسترس قرار میدهد.
- تنظیم بیان ژن در مرحله رونویسی: رونویسی برای بسیاری از ژنها یک نکته تنظیم کننده اصلی است. مجموعهای از پروتئینهای فاکتور رونویسی به توالیهای DNA خاص در ژن یا نزدیک آن متصل میشوند و رونویسی آن را به یک RNA تقویت یا سرکوب میکنند.
- تنظیم بیان ژن در مرحله پردازش RNA: اتصال، کلاهکگذاری و افزودن یک دم پلی A به یک مولکول RNA میتواند تنظیم و از هسته خارج شود. mRNAهای مختلف ممکن است از همان mRNAهای مشابه با اتصال متناوب ساخته شوند.
- پایداری RNA: طول عمر یک مولکول mRNA در سیتوزول بر میزان پروتئین های تولید شده از آن تأثیر میگذارد. RNAهای کوچک نظارتی به نام miRNA می توانند به mRNA های هدف متصل شده و باعث خرد شدن آنها شوند.
- تنظیم بیان ژن در مرحله ترجمه: تنظیم کنندهها ممکن است ترجمه mRNA را افزایش داده و یا آن را مهار کنند. به عنوان مثال ، miRNAها گاهی اوقات مانع ترجمه mRNAهای هدف خود میشوند (به جای اینکه باعث خرد شدن آنها شوند).
- فعالیت پروتئین: پروتئینها میتوانند تغییرات مختلفی از جمله خرد شدن یا برچسبگذاری در گروههای شیمیایی را داشته باشند. این تغییرات را میتوان تنظیم کرد که ممکن است بر فعالیت یا رفتار پروتئین تأثیر بگذارند.
اگرچه تمام مراحل بیان ژن قابل تنظیم هستند اما نقطه کنترل اصلی بسیاری از ژنها، هنگام رونویسی است. تفاوت در تنظیم ژن، انواع مختلف سلول را در ارگانیسم چند سلولی از نظر ساختار و عملکرد منحصر به فرد میکند. اگر یک مرحله را بزرگنمایی کنیم، تنظیم ژن کمک میکند برخی از تفاوتهای شکل و عملکرد بین گونههای مختلف با توالی ژنی نسبتاً مشابه را با استفاده از مبانی ژنتیک مولکولی توضیح دهیم. به عنوان مثال، ژنوم انسانها و شانپانزهها تقریباً 98/8 درصد در سطح DNA یکسان هستند.
توالی رمزگذار پروتئین برخی ژنها بین انسان و شانپانزه متفاوت است و به تفاوت بین گونهها کمک میکند. با این حال، محققان اعتقاد دارند که تغییرات تنظیم ژن نقش عمدهای در تفاوت انسانها و شانپانزهها از یکدیگر دارد. به عنوان مثال، برخی از مناطق DNA که در ژنوم شانپانزه وجود دارد اما در ژنوم انسان نیست، حاوی توالیهای تنظیمکننده ژن شناخته شدهای هستند که زمان، محل یا میزان بیان ژن را کنترل میکنند.
تغییرات ژنی
تنوع ژنتیکی به تفاوت ژنتیکی بین افراد درون یا بین جمعیتهای مختلف در مبانی ژنتیک مولکولی اشاره دارد. این تنوع همان چیزی است که هر فرد را در ویژگیهای فنوتیپی منحصر به فرد خود میکند. تنوع ژنتیکی در مقیاسهای مختلفی از تغییرات ناگهانی در کاریوتایپ انسان تا تغییرات تک نوکلئوتیدی اتفاق میافتد. این تغییرات را میتوان در چند شکل و جهش تقسیم کرد. چندشکلیها به عنوان گونههایی یافت میشوند که در کمتر از 1 درصد از جمعیت عمومی یافت میشوند. به علت فراوانی زیاد بعید به نظر میرسد عامل بیماری ژنتیکی باشند.
با این حال، آنها میتوانند همراه با سایر عوامل ژنتیکی و محیطی، بر استعداد بیماری، پیشرفت بیماری یا پاسخ به درمانها تأثیر بگذارند. سه نوع رایج از چندشکلیها عبارتند از SNPها که تغییراتی در بازهای DNA هستند که به طور متوسط تقریباً در هر 1000 باز در ژنوم رخ میدهد. توزیع آنها همگن نیست و بیشتر در مناطق غیر کد کننده که فشار انتخابی کمتری وجود دارد بیشتر اتفاق میافتد. بیشتر SNPها خنثی هستند. با این حال تصور میشود 3 تا 5 درصد نقش عملکردی دارند، یعنی بر فنوتیپ فردی که آنها را حمل میکند تأثیر میگذارد.
SNPها بسته به تأثیر آنها در سطح پروتئین، میتوانند به صورت مترادف (کدگذاری برای همان آمینو اسید توالی DNA نوع وحشی) یا غیر مترادف (کدگذاری آمینو اسید متفاوت از توالی DNA نوع وحشی) مشخص شوند. ایندلها شکاف یا حذفهای کوچکی هستند که طول آنها از 1 تا 10 هزار جفت باز است، اگرچه اکثریت آنها فقط شامل چند نوکلئوتید میشوند. آنها با داشتن بیش از 3 میلیون ایندل کوتاه در پایگاههای داده عمومی، دومین نوع متداول در تغییر در ژنوم انسان به دنبال SNPها به حساب میآیند.
CNV تغییراتی در تعداد کپی مناطق DNA است. آنها میتوانند شامل از دست دادن یک یا هر دو نسخه از یک منطقه از DNA یا وجود بیش از دو نسخه از این منطقه باشند. آنها میتوانند در اثر حذف، تقویت، وارونگی یا اضافه شدن DNA ایجاد شده و اندازه آنها از 1 کیلو بایت (1000 باز) تا چند مگابایت باشد. SNPها، ایندلها و CNVها میتوانند به ارث برسند یا از نو به وجود بیایند.
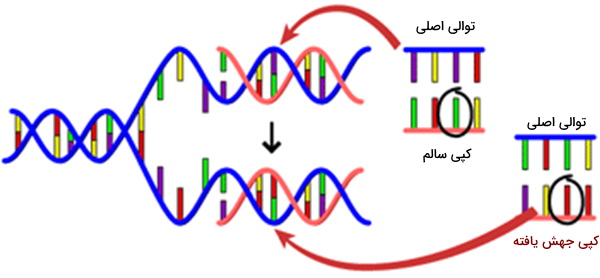
از طرف دیگر، جهشها نادر هستند (برخی از آنها به عنوان تغییرات با فرکانس کمتر از 1 درصد در جمعیت عمومی تعریف میشوند، اگرچه موارد استثنایی زیادی نیز در این قانون وجود دارد) تغییرات در توالی DNA که میتواند پروتئین حاصل را تغییر دهد، بیان را مختل یا مهار کند از ژن یا عملکرد ژن و سطح پروتئین و ساختار را تحت تأثیر قرار نمیدهد. اگرچه در طی این سالها تعاریف مختلفی در نظر گرفته شده است اما برای بیشتر دانشمندان جهش با بیماری مترادف شده است. جهشها میتوانند در هنگام تکثیر DNA یا در نتیجه آسیب DNA از طریق عوامل محیطی از جمله نور خورشید، دود سیگار و تابش ایجاد شوند.
جهش ژنتیکی چیست؟
جهش، تغییر در ماده ژنتیکی (ژنوم) سلول یک موجود زنده که کم و بیش ماندگار است و میتواند به نسل بعدی منتقل شود. جهش در DNA سلول بدن ارگانیسم چند سلولی (جهش سوماتیک) ممکن است منتقل شود با تکثیر DNA به سلولهای فرزندان منتقل میشود و از این رو سلولها دارای عملکرد غیرطبیعی هستند. جهش در سلولهای تخمک یا اسپرم (جهشهای سلولهای زایا) ممکن است فرزندان فردی را به وجود آورد که تمام سلولها آن جهش را حمل میکنند، که منجر به اختلالات ارثی همچون فیبروز کیستیک خواهد شد.
جهش یا به صورت تصادفی و حین تقسیم سلولی یا در اثر قرار گرفتن در معرض تابش الکترومغناطیسی با انرژی بالا (به عنوان مثال اشعه ماورا بنفش یا اشعه X) یا در اثر مواد شیمیایی بسیار واکنشپذیر و استرس اکسیداتیو رخ میدهد. از آنجا که جهشها تغییرات تصادفی هستند، انتظار میرود که اکثراً مضر باشند اما برخی از آنها ممکن است در محیطهای خاص مفید باشند. در واقع به طور کلی، جهش منبع اصلی تغییر ژنتیکی و عامل اولیه تکامل با انتخاب طبیعی است.
جهش میتواند در هر ناحیهای از مولکول DNA رخ دهد اما اثرگذارترین جهشها درون ژن اتفاق میافتند. کانونهای جهش بخشهایی از DNA هستند که در معرض تغییرات ژنتیکی قرار دارند. افزایش حساسیت این مناطق DNA به جهش به فعل و انفعالات بین عوامل ایجاد کننده جهش، ساختار و عملکرد توالی DNA و آنزیمهای درگیر در ترمیم، تکثیر و اصلاح DNA نسبت داده میشود. ژن معمولاً از یک منطقه تنظیم کننده تشکیل شده که وظیفه روشن و خاموش کردن رونویسی ژن را در زمانهای مناسب در طول رشد بر عهده دارد و یک منطقه کد کننده که حامل کد ژنتیکی ساختار یک مولکول عملکردی یعنی پروتئین است.
جهشهایی که توالی DNA را تغییر میدهند، میتوانند باعث تغییر در توالی اسید آمینه شوند و از این طریق عملکرد پروتئین را کاهش داده یا آن را غیرفعال کنند. تغییر در توالی DNA در منطقه تنظیم کننده ژن میتواند بر زمان و در دسترس بودن پروتئین ژن تأثیر منفی بگذارد و همچنین منجر به اختلال جدی در عملکرد سلول شود. بسیاری از جهشها خاموش هستند و هیچ تأثیر آشکاری را در سطح عملکرد نشان نمیدهند. برخی جهشهای خاموش در DNA بین ژنها وجود دارند یا از نوعی هستند که هیچ تغییر قابل توجهی در اسید آمینه ایجاد نمیکنند.
جهشها انواع مختلفی دارند که در مبانی ژنتیک مولکولی به دقت بررسی میشوند. به طور مثال تغییرات درون ژنها را جهشهای نقطهای مینامند. سادهترین انواع تغییر در جفتهای تک باز است که به آنها تعویض جفت باز میگویند. بسیاری از اینها یک آمینو اسید نادرست را در موقعیت مربوطه در پروتئین رمزگذاری شده جایگزین میکنند و از این تعداد زیادی منجر به تولید پروتئین تغییر یافته میشوند. برخی از تعویضهای جفت باز یک کدون توقف ایجاد میکنند.
وجود کدون پایان در جایی به غیر از انتهای ژن منجر به تولید یک پروتئین با ساختار ناقص یا غیرعملکردی میشود. نوع دیگری از جهش ساده، حذف یا اضافه شدن جفتهای تک باز، عموماً بر پروتئین تأثیر عمیقی میگذارد، زیرا سنتز پروتئین که با خواندن کدونها از ابتدا تا انتهای ژن انجام میشود. دیگر، پرتاب میشود این تغییر منجر به تغییر فریم در خواندن ژن میشود به طوری که همه اسید آمینهها از جهش به بعد نادرست هستند. ترکیبات پیچیدهتری از جایگزینی بازها، اضافه شدن و حذفها نیز میتواند در برخی از ژنهای جهشیافته مشاهده شود.
جهشهایی که بیش از یک ژن را شامل شوند جهشهای کروموزومی نام دارند زیرا بر ساختار، عملکرد و وراثت کل مولکولهای DNA یا کروموزوم در حالت متراکم، تأثیر میگذارند. غالباً این جهشهای کروموزومی ناشی از یک یا چند شکست همزمان در مولکولهای DNA ژنوم (احتمالاً در اثر قرار گرفتن در معرض تابش انرژی) است، و در بعضی موارد با پیوستن مجدد معیوب همراه است. برخی از نتایج حذف بزرگ، تکثیر، وارونگی و جابجایی است.
در یک گونه دیپلوئید (گونهای مانند انسان که در هسته هر سلول دو مجموعه کروموزوم دارد)، حذف و تکثیر تعادل ژن را تغییر میدهد و اغلب منجر به تولید محصول غیرطبیعی میشود. وارونگی و جابجایی فاقد از دست دادن و افزایش است و از نظر عملکرد طبیعی است مگر اینکه در داخل یک ژن شکسته شود. با این حال، در میوز (بخشهای هستهای ویژهای که در طی تولید گامتها اتفاق میافتد، به عنوان مثال تخمکها و اسپرمها)، جفت شدن معیوب یک کروموزوم معکوس یا جابجا شده با یک مجموعه عادی میتواند منجر به تولید گامتهایی با ژن حذف شده یا مضاعف شود.
از دست دادن یا افزایش کل کروموزوم منجر به نوعی ناهنجاری به نام آنوپلوئیدی میشود. یکی از نتایج آشنای آنوپلوئیدی سندرم داون است، یک اختلال کروموزومی که در آن فرد با کروموزوم 21 اضافی متولد میشود (و از این رو سه نسخه از آن کروموزوم را به جای دو نسخه معمول، به همراه دارد). نوع دیگر جهش کروموزومی، افزایش یا از دست دادن مجموعههای کامل کروموزوم است. مجموعه کروموزوم اضافی منجر به پلیپلوئیدی میشود یعنی وجود سه، چهار یا تعداد بیشتری کروموزوم به جای دو مجموعه معمول. پلیپلوئیدی نیروی قابل توجهی در تکامل گونههای جدید گیاهان و حیوانات بوده است.
موضوع مهم بعدی در مبانی ژنتیک مولکولی نواحی جابجا شونده هستند. بیشتر ژنومها عناصر DNA متحرک (Mobile DNA Elements) دارند. این عناصر متحرک توالیهای DNA هستند که میتوانند موقعیت خود را درون ژنوم را تغییر دهند. اگرچه عملکرد بیولوژیکی آنها تا حد زیادی قابل ارزیابی نیست، DNA حاصل از عناصر متحرک تقریبا نیمی از ژنوم انسان را تشکیل میدهند. جابجایی این عناصر میتواند باعث جهش شود یا به این دلیل که عنصر در برخی از نقاط مهم مانند یک ژن میرسد یا به این دلیل که جهشهای کروموزومی در مقیاس بزرگ را از طریق ترکیب مجدد بین جفت عناصر متحرک در مکانهای مختلف ایجاد میکند.
یکی از عناصر متحرک ژنی، توالیهای تکراری DNA به نام ترانسپوزون (Transposon) هستند که توانایی انتقال از یک مکان به مکان دیگر را در ژنوم دارند. حرکت ترانسپوزونها میتواند منجر به جهش، تغییر در بیان ژن، القای مجدد آرایش کروموزومها و به دلیل افزایش تعداد کپی، افزایش اندازه ژنوم شود. توانایی ترانسپوزونها در افزایش تنوع ژنتیکی در کنار توانایی ژنوم در مهار فعالیت آنها، منجر به ایجاد تعادل میشود. عناصر قابل انتقال بخشی مهم از تکامل و تنظیم ژن در تمام موجودات حامل این توالیها هستند.
در سطح جمعیت، آللهای جهش یافته افزایش پیدا میکنند، مفهومی که تحت عنوان فشار جهش توصیف میشود. میزان جهش برای ژنها و ارگانیسمهای مختلف متفاوت است. در ویروسهای RNA مانند ویروس نقص ایمنی انسانی (HIV)، تکثیر ژنوم در سلول میزبان با استفاده از مکانیزمی مستعد خطا صورت میگیرد. از این رو، میزان جهش در این ویروسها زیاد است.
با این حال، سرنوشت آللهای جهش یافته فردی هرگز قطعی نیست. بیشتر آنها به طور تصادفی حذف میشوند. در برخی موارد، آلل جهش یافته میتواند به طور تصادفی فراوانی افزایش یابد و سپس افرادی که آلل را بیان میکنند میتوانند مورد انتخاب مثبت یا منفی قرار بگیرند. از این رو برای هر ژن فراوانی یک آلل جهش یافته در یک جمعیت با ترکیبی از فشار جهش، انتخاب و شانس تعیین میشود.
نوترکیبی چیست؟
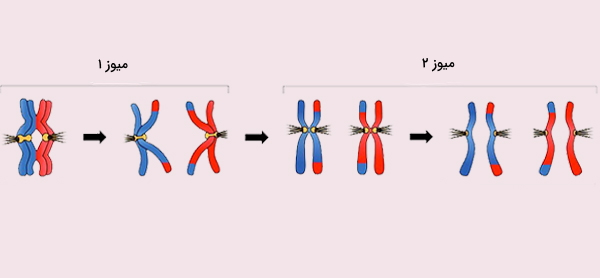
نوترکیبی ژنتیکی (همچنین به عنوان تغییر ژنتیکی شناخته میشود) مواد ژنتیکی بین ارگانیسمهای مختلف است که منجر به تولید فرزندان با ترکیبی از صفات میشود که با خصوصیات موجود در هریک از والدین متفاوت هستند. در یوکاریوتها، ترکیب مجدد ژنتیکی در طی میوز میتواند منجر به مجموعه ای جدید از اطلاعات ژنتیکی شود که میتواند از والدین به فرزندان منتقل شود. بیشتر ترکیبات به طور طبیعی اتفاق میافتد. در طول میوز در یوکاریوتها، نوترکیبی ژنتیکی شامل جفت شدن کروموزومهای همولوگ است که با انتقال اطلاعات بین کروموزومها دنبال شود.
در حین میوز، سیناپس (جفت شدن کروموزومهای همولوگ) به طور معمول مقدم بر ترکیب ژنتیکی است. نوترکیبی ژنتیکی توسط آنزیمهای مختلف کاتالیز میشود. نوترکیبها آنزیمهای کلیدی هستند که مرحله انتقال رشته را در هنگام ترکیب مجدد کاتالیز میکنند. RecA، عامل نوترکیبی موجود در اشریشیا کلی، مسئول ترمیم شکستگی دو رشته DNA (DSB) است. در مخمر و موجودات دیگر یوکاریوتی دو تركیب وجود دارد كه برای ترمیم DSB مورد نیاز است. پروتئین RAD51 برای ترکیب میتوزی و میوز مورد نیاز است، در حالی که پروتئین ترمیم کننده DNA به نام DMC1، خاص ترکیب مجدد میوز است. در آرکی باکترها، ارتولوگ پروتئین RecA باکتریایی RadA است.
انتقال اطلاعات ممکن است بدون تبادل فیزیکی انجام شود (بخشی از مواد ژنتیکی از یک کروموزوم به کروموزوم دیگر کپی میشود، بدون اینکه کروموزوم اهدا کننده تغییر کند). یا با شکستن و اتصال مجدد رشتههای DNA که مولکولهای جدیدی از DNA را تشکیل میدهد. نوترکیبی همچنین ممکن است در طی میتوز در یوکاریوتها اتفاق بیفتد، جایی که به طور معمول شامل دو کروموزوم خواهر پس از همانندسازی کروموزومی است.
در این حالت، ترکیبات جدید آلل تولید نمیشوند زیرا کروموزومهای خواهر معمولاً یکسان هستند. در میوز و میتوز، ترکیب مجدد بین مولکولهای مشابه DNA (توالی همولوگ) رخ میدهد. در میوز، کروموزومهای همولوگ غیر خواهری با یکدیگر جفت میشوند به طوری که ترکیب مجدد به طور مشخص بین همولوگهای غیر خواهر رخ میدهد. در سلولهای میوتیک و میتوزی، ترکیب مجدد بین کروموزومهای همولوگ مکانیسم رایجی است که در ترمیم DNA استفاده میشود. تبدیل ژن، فرآیندی که طی آن توالیهای همولوگ یکسان میشوند نیز تحت بازترکیب ژنتیکی قرار میگیرند.
نوترکیبی ژنتیکی و ترمیم DNA ترکیبی نیز در باکتریها و آرکی باکترها که از تولید مثل غیرجنسی استفاده میکنند، رخ میدهد. نوترکیبی را میتوان به طور مصنوعی در شرایط آزمایشگاهی (in vitro) القا کرد و DNA نوترکیبی را برای اهداف شامل تولید واکسن تولید کرد. نوترکیبی در ارگانیسمها با سیستم ایمنی تطبیقی نوعی از ترکیبات ژنتیکی خاص است که به سلولهای سیستم ایمنی کمک میکند تا به سرعت متنوع شوند تا پاتوژنهای جدید را بشناسند و با آنها سازگار شوند.
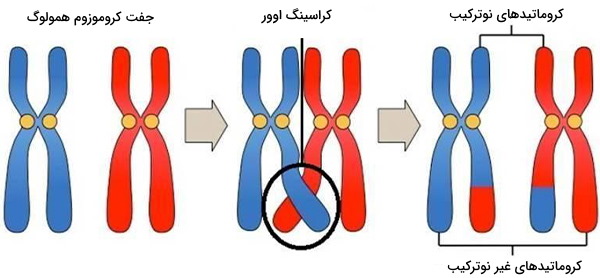
کراسینگ اوور چیست؟
در یوکاریوتها، ترکیب مجدد در طول میوز با کراسینگاوور کروموزومی تسهیل میشود. روند متقاطع شدن کروماتیدها منجر به داشتن فرزندان از ژنهای ترکیبی متفاوت از والدین آنها میشود و گاهی میتواند آللهای کایمری جدید تولید کند. به هم ریختگی ژنهای ایجاد شده توسط نوترکیبی باعث افزایش تنوع ژنتیکی میشود. همچنین به ارگانیسمهایی با تولید مثل جنسی اجازه میدهد تا از Muller's ratchet که در آن ژنومهای یک جمعیت غیرجنسی، حذف ژنتیکی به روشی غیر قابل برگشت تجمع مییابد، جلوگیری شود. کراساور کروموزومی شامل ترکیب مجدد بین کروموزومهای زوجی به ارث رسیده از هریک از والدین است، که به طور کلی طی میوز اتفاق میافتد.
در پروفاز I هر چهار کروماتید موجود در کروموزومهای خواهری، فشرده با یکدیگر قرار دارند. مکانهای همولوگ در دو کروماتید میتوانند از نزدیک با یکدیگر جفت شوند و ممکن است اطلاعات ژنتیکی را مبادله کنند. از آنجا که نوترکیبی میتواند با احتمال کم در هر مکان در امتداد کروموزوم رخ دهد، فراوانی ترکیب مجدد بین دو مکان به فاصله جدا کننده آنها بستگی دارد. بنابراین، برای ژنهایی که به اندازه کافی از یک کروموزوم دور هستند، مقدار تلاقی به اندازه کافی زیاد است تا ارتباط بین آللها را از بین ببرد. ردیابی حرکت ژنهای حاصل از کراساوورها برای متخصصان ژنتیک کاملاً مفید به اثبات رسیده است.
از آنجا که دو ژن نزدیک به هم کمتر از ژنهایی که فاصله بیشتری دارند از هم جدا میشوند، میتوان حدس زد که دو ژن روی یک کروموزوم از هم فاصله دارند، اگر بدانند که فرکانس کراسینگاوورها چیست. متخصصان ژنتیک نیز میتوانند از این روش برای استنباط وجود ژنهای خاص استفاده کنند. گفته میشود که ژنهایی که به طور معمول در طول ترکیب مجدد با هم میمانند، با هم مرتبط هستند. از یک ژن در یک جفت پیوند یافته میتوان بعنوان یک مارکر برای استنباط حضور ژن دیگری استفاده کرد. این به طور معمول برای تشخیص وجود ژن عامل بیماری استفاده میشود.
فرکانس نوترکیبی بین دو مکان مشاهده شده مقدار عبور از بین دو مکان ژنی مرتبط است و به فاصله متقابل مکانهای ژنی مشاهده شده بستگی دارد. برای هر مجموعه ثابت از شرایط ژنتیکی و محیطی، نوترکیبی در یک منطقه خاص از یک ساختار پیوندی (کروموزوم) تمایل دارد که ثابت باشد و این امر در مورد ارزش عبور بیش از حد که در تولید نقشههای ژنتیکی استفاده میشود، صدق میکند. کراسینگاوور میتواند بین توالیهای DNA غیر همسان رخ دهد که باعث جابجایی کروموزومی و گاهی منجر به سرطان میشود.
مهندسی ژنتیک چیست؟
مهندسی ژنتیک یکی دیگر از مباحث کاربردی مبانی ژنتیک مولکولی و فرآیند استفاده از فناوری نوترکیب DNA (rDNA) برای تغییر در ترکیب ژنتیکی موجود زنده است. به طور سنتی و غیر مستقیم با کنترل تولید مثل و انتخاب فرزندانی با صفات مورد نظر، ژنوم طی نسلها دستاری میشود. مهندسی ژنتیک شامل دستکاری مستقیم یک یا چند ژن است. اغلب اوقات، ژنی از گونه دیگر به ژنوم ارگانیسم اضافه میشود تا فنوتیپ مورد نظر را به دست آورد. مهندسی ژنتیک دستکاری، اصلاح و ترکیب مجدد DNA یا سایر مولکولهای اسید نوکلئیک به منظور اصلاح ارگانیسم یا جمعیت است.
اصطلاح مهندسی ژنتیک در ابتدا به تکنیکهای مختلفی در مطالعات مبانی ژنتیک مولکولی گفته میشد که برای اصلاح یا دستکاری موجودات زنده از طریق فرایندهای وراثت و تولید مثل استفاده می شود. به همین ترتیب، این اصطلاح هم انتخاب مصنوعی و هم همه مداخلات فنون زیست پزشکی از جمله تلقیح مصنوعی، لقاح آزمایشگاهی، شبیهسازی و دستکاری ژن را شامل میشود. در اواخر قرن 20، این اصطلاح به طور خاص به روشهای فن آوری DNA نوترکیب (یا شبیهسازی ژن) اشاره دارد که در آن مولکولهای DNA از دو یا چند منبع یا در سلولها یا ازمایشگاهی ترکیب میشوند و سپس وارد ارگانیسمهای میزبان میشود که در آنها قادر به تکثیر هستند.
با کشف آنزیمهای محدودکننده در سال 1968 توسط میکروبشناس سوییسی، ورنر آربر، امکان تولید فناوری نوترکیب DNA پدیدار شد. سال بعد میکروبیولوژیست آمریکایی هامیلتون اسمیت آنزیمهای به اصطلاح محدودکننده نوع II را خالص کرد که مشخص شد برای مهندسی ژنتیک برای توانایی آنها در شکافتن یک محل خاص در DNA (در مقابل آنزیمهای محدودکننده نوع I که DNA را جدا میکند) ضروری است.
با استفاده از کار اسمیت، زیستشناس مولکولی آمریکایی به نام دانیل ناتانز، به پیشرفت فناوری ترکیب مجدد DNA در سالهای 1970 تا 1991 کمک کرد و نشان داد که آنزیمهای نوع II میتوانند در مطالعات ژنتیکی و تکمیل کردن مبانی ژنتیک مولکولی مفید باشند. مهندسی ژنتیک مبتنی بر نوترکیبی در سال 1973 توسط استنلی N. کوهن و هربرت دبلیو بویر، بیوشیمیستهای آمریکایی که از اولین کسانی بودند که DNA را به قطعات تقسیم کردند، دوباره به قطعات مختلف پیوستند و ژنهای جدید را در باکتری E. coli وارد کردند که بعدا همانندسازی شد.
بیشتر فناوری DNA نوترکیب شامل قرار دادن ژنهای خارجی در پلاسمیدهای سویههای آزمایشگاهی مشترک باکتریها است. اگرچه پلاسمید مخزن اصلی اطلاعات ژنتیکی ارگانیسم نیست اما توانایی هدایت سنتز پروتئین را دارد و مانند DNA کروموزومی، تولید مثل میکنند و به باکتریهای جدید منتقل میشوند. بنابراین، با قرار دادن DNA خارجی (به عنوان مثال، یکی از ژنهای یک پستاندار) در یک باکتری، محققان میتوانند تعداد زیادی نسخه ژن را تولید کنند. به علاوه اگر ژن وارد شده، سنتز پروتئین را هدایت کند، باکتری اصلاح شده پروتئین مورد نظر را با بیان DNA خارجی تولید میکند.
مهندسی ژنتیک موجب پیشرفت در درک بسیاری از جنبههای نظری و عملی عملکرد و سازمان ژن به عنوان یکی از مهمترین بخشهای مبانی ژنتیک مولکولی شده است. از طریق تکنیکهای DNA نوترکیب، باکتریهایی ایجاد شدهاند که توانایی سنتز انسولین انسانی، هورمون رشد انسانی، آلفا اینترفرون، واکسن هپاتیت B و سایر مواد مفید پزشکی را دارند. گیاهان ممکن است از نظر ژنتیکی تنظیم شوند تا بتوانند نیتروژن را تثبیت کنند. بیماریهای ژنتیکی را میتوان با جایگزینی ژنهای ناکارآمد با ژنهایی که عملکرد طبیعی دارند اصلاح کرد.
با این وجود، نگرانی ویژه در مورد این دستاوردهای مبانی ژنتیک مولکولی متمرکز شده است زیرا ممکن است منجر به ورود صفات نامطلوب و احتمالاً خطرناک به میکروارگانیسمهایی شود که قبلا فاقد آنها بودند به عنوان مثال، مقاومت در برابر آنتی بیوتیکها، تولید سموم یا تمایل به ایجاد بیماری. از طرفی دستورزی ژنتیکی در انسان نگرانیهای اخلاقی به ویژه در مورد استفاده از آن برای تغییر صفاتی مانند هوش و زیبایی ایجاد کرده است.
کلونینگ چیست؟
کلونینگ یا شبیهسازی حوزه مهمی از مبانی ژنتیک مولکولی و فرآیند تولید یک کپی از نظر ژنتیکی یک سلول یا یک ارگانیسم است. شبیهسازی اغلب در طبیعت اتفاق میافتد. به عنوان مثال، هنگامی که یک سلول بدون هیچگونه تغییر ژنتیکی یا ترکیب مجدد، خود را به صورت غیرجنسی تکثیر میکند. ارگانیسمهای پروکاریوتی با استفاده از شکافت یا تقسیم دو تایی نسخههای مشابه از نظر ژنتیکی را ایجاد میکنند. در ارگانیسمهای یوکاریوتی، تمام سلولهایی که تحت میتوز قرار میگیرند مانند سلولهای پوستی و سلولهای دستگاه گوارش، کلون هستند. تنها استثناها گامتها (تخمک و اسپرم) هستند که تحت میوز و بازترکیب ژنتیکی قرار میگیرند.
در تحقیقات زیست پزشکی، کلونینگ به طور گستردهای به معنای تکثیر هر نوع ماده بیولوژیکی برای مطالعه علمی است مانند یک قطعه DNA یا یک سلول فردی. به عنوان مثال، بخشهایی از DNA با روشی معروف به واکنش زنجیرهای پلیمراز یا PCR، تکنیکی که به طور گستردهای در تحقیقات اساسی بیولوژیکی استفاده میشود، به صورت نمایی تکثیر میشوند. نوع شبیهسازی که در بسیاری از بحثهای اخلاقی مورد توجه قرار میگیرد، شامل تولید جنین کلون شده است که از نظر ژنتیکی با موجوداتی که از آن گرفته شده یکسان است. از جنین کلون شده برای تحقیق، درمان یا اهداف تولید مثلی استفاده میشود.
کلونینگ با اهداف باروری
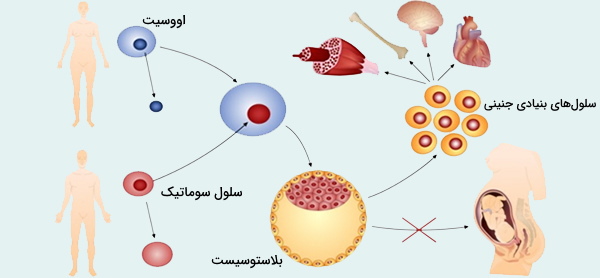
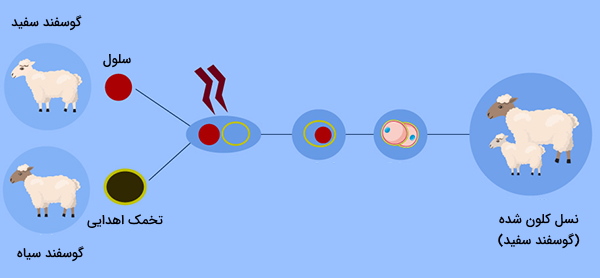
شبیهسازی یکی از مبانی ژنتیک مولکولی شامل کاشت جنین حاصل از سلولهای سوماتیک در رحم واقعی یا مصنوعی است. آزمایشات باروری با کلونینگ برای بیش از 40 سال از طریق فرآیند تقسیم جنین انجام شد که در آن یک جنین تک سلولی در مرحله اولیه به صورت دستی به دو سلول جداگانه تقسیم میشود و سپس به عنوان دو جنین یکسان رشد میکند. تکنیکهای شبیهسازی باروری در دهه 1990، پس از تولد دالی که از طریق فرآیند SCNT تولید شده است، دستخوش تغییراتی شد.
این فرایند مستلزم برداشتن کل هسته از سلول سوماتیک ارگانیسم است و به دنبال آن هسته را درون سلول تخم مرغی که هسته خودش را برداشته است وارد میکند (هستهسازی). وقتی هسته سوماتیک درون تخمک قرار گرفت، تخمک با جریان الکتریکی ملایم تحریک شده و تقسیم میشود. بنابراین یک جنین شبیهسازی شده، اساساً جنینی از یک دوقلوی یکسان از ارگانیسم اصلی، ایجاد میشود. روند SCNT از دهه 1990 تحت تصفیه قابل توجهی قرار گرفته است و روشهایی برای جلوگیری از آسیب تخم در حین استخراج هسته و قرار دادن هسته سلول سوماتیک ایجاد شده است.
به عنوان مثال استفاده از نور قطبی، تجسم محل هسته سلول تخمک و استخراج هسته را تسهیل میکند، در نتیجه یک تخمک سالم و زنده ایجاد میشود و میزان موفقیت SCNT افزایش مییابد. شبیهسازی باروری با استفاده از SCNT بسیار مضر در نظر گرفته میشود زیرا جنینهای رویانی که از طریق SCNT شبیهسازی شدهاند به ندرت از بارداری زنده میمانند و معمولاً با نقایص مادرزادی متولد میشوند. تیم دانشمندان ویلموت به 277 تلاش برای ایجاد دالی نیاز داشت.
به همین ترتیب، در سال 2007 تلاشها برای استفاده از مبانی ژنتیک مولکولی جهت تولید یک کلون میمون ماکاک شامل 100 جنین شبیهسازی شده، کاشته شده در 50 میمون ماده ماکاک بود که هیچیک از آنها بارداری مناسبی را ایجاد نکردند. در ژانویه سال 2008، دانشمندان استماگن، یک شرکت تحقیق و توسعه سلولهای بنیادی در کالیفرنیا، اعلام کردند که آنها 5 جنین انسانی را با استفاده از SCNT کلون کردهاند و جنینها تا مرحلهای رسیدهاند که میتوانند در رحم کاشته شوند. با این حال، دانشمندان پس از پنج روز، به منظور انجام تجزیه و تحلیل مولکولی روی آنها، جنینها را از بین بردند.
کلونینگ با اهداف درمانی
در کلونینگ از جنینهای کلون شده به منظور استخراج سلولهای بنیادی استفاده میشود. کلونینگ درمانی امکان پرورش سلولهای بنیادی را دارد که از نظر ژنتیکی با بیمار یکسان هستند. سلولهای بنیادی را می توان تحریک کرد تا به بیش از 200 نوع سلول در بدن انسان متمایز شوند. سپس سلولهای متمایز شده را می توان به بیمار پیوند زد تا سلولهای بیمار یا آسیبدیده را جایگزین کند بدون اینکه خطر رد پیوند توسط سیستم ایمنی بدن وجود داشته باشد.
از این سلولها میتوان برای درمان بیماریهای مختلفی از جمله بیماری آلزایمر، پارکینسون، دیابت شیرین، سکته مغزی و آسیب نخاعی استفاده کرد. سلولهای بنیادی میتوانند برای مطالعات آزمایشگاهی رشد طبیعی و غیرطبیعی جنین یا آزمایش داروها برای بررسی سمی بودن یا نقصهای مادرزادی استفاده شوند.
پیشرفت در تحقیقات مبتنی بر مبانی ژنتیک مولکولی و درمان با کلونینگ در انسان نسبت به پیشرفتهای حاصل در باروری با کلونینگ در حیوانات کندتر بوده است. این امر در درجه اول به دلیل چالشهای علمی و مجادله اخلاقی ناشی از تهیه تخم صرفاً برای اهداف تحقیق است. به علاوه، توسعه سلولهای بنیادی همهتوان القایی که از سلولهای سوماتیک مشتق شدهاند که از طریق ورود فاکتورهای خاص ژنتیکی به هسته سلولها، مجدداً به حالت جنینی برنامهریزی شدهاند، استفاده از روشهای شبیهسازی و تخمکهای انسانی را به چالش کشیده است.
اومیکس چیست؟
اومیکس (Omics) یکی از مباحث مطرح شده در مبانی ژنتیک مولکولی است که به طور کلی هدف از آن شناسایی و کمی کردن کلیه مولکولهای بیولوژیکی مشابهی است که در ساختار، عملکرد و پویایی سلول، بافت یا ارگانیسم نقش دارند. شاخههای علمی که به عنوان اومیکس شناخته میشوند، بر اساس حوزه مورد مطالعه از ترکیب نام آنها با پسوند -omics مانند ژنومیکس، پروتئومیکس، متابولومیکس، متاژنومیکس و ترانسکریپتومیکس ساخته میشوند.
هدف حوزههای مختلف Omics در مبانی ژنتیک مولکولی بررسی کمی و کیفی مولکولهای بیولوژیکی است که در تعیین ساختار، عملکرد و پویایی ارگانیسم نقش دارند. پسوند مربوطه -ome برای مطالعه زمینههایی مانند ژنوم، پروتئوم یا متابولوم استفاده میشود. پسوند -ome همانطور که در زیستشناسی مولکولی استفاده میشود، به نوعی کلیت اشاره دارد.
ژنومیکس ساختار، عملکرد، تکامل و نقشهبرداری از ژنومها را مورد مطالعه قرار میدهد و هدف از آن توصیف و تعیین کمیت ژنها است که تولید پروتئینها را با کمک آنزیمها و مولکولهای پیامرسان هدایت میکنند. ترنسکریپتوم (Transcriptome) مجموعه کلیه مولکولهای RNA پیامرسان در یک سلول، بافت یا ارگانیسم و شامل مقدار یا غلظت هر مولکول RNA علاوه بر شاخصهای مولکولی است. اصطلاح پروتئوم به مجموع تمام پروتئینهای موجود در سلول، بافت یا ارگانیسم گفته میشود.
پروتئومیکس علمی است که پروتئینها را در ارتباط با خصوصیات بیوشیمیایی و نقشهای عملکردی آنها و چگونگی تغییر مقادیر، تغییرات و ساختار آنها در طی رشد و در پاسخ به محرکهای داخلی و خارجی بررسی میکند. متابولوم نشان دهنده مجموعه تمام متابولیتهای موجود در یک سلول، بافت، اندام یا ارگانیسم بیولوژیکی است که محصولات نهایی فرآیندهای سلولی هستند. متابولومیکس علمی است که تمام فرایندهای شیمیایی متابولیتها را مطالعه میکند.
متابولومیکس نیز یکی دیگر از مباحث ژنتیک مولکولی است که اثر انگشت مولکولهای شیمیایی را مطالعه میکند که فرآیندهای سلولی خاص در طول فعالیت آنها ایجاد میکند. متابولومیکس تمام پروفایلهای متابولیت مولکول کوچک است.










عالی بود،ممنونم از زحمات شما
سلام امکانش هست فایل pdf را برای من ارسال کنید با تشکر
سلام خیلی عالی بود. یه سوال داشتم. اطلاعات وراثتی در کدام قسمت نوکلئوتید ثبت می شود؟
سلام امکانش هست فایل pdf را برای من ارسال کنید با تشکر