انواع PCR (پی سی آر) — از صفر تا صد

واکنش زنجیرهای پلیمراز (PCR) تکنیکی است که برای تکثیر بخشهای کوچک DNA استفاده میشود. PCR مبتنی بر استفاده از توانایی DNA پلیمراز در سنتز رشته جدید DNA مکمل رشته الگوی ارائه شده است. طیف گستردهای از انواع PCR وجود دارند و هر یک دارای مزایا و محدودیتهایی هستند. در این مقاله به بیان مقدمهای از PCR، ترکیبات مورد نیاز برای انجام واکنش، مراحل انجام آن و بررسی انواع PCR میپردازیم.
PCR چیست؟
واکنش زنجیرهای پلیمراز (PCR) یک روش قدرتمند برای تقویت بخشهای خاصی از DNA است که متمایز از شبیهسازی و تکثیر در سلول میزبان است. این روش از نظر بیوشیمیایی به صورت In Vitro یعنی در شرایط آزمایشگاهی انجام میشود. PCR توسط کاری مولیس در سال 1983 اختراع شد. وی در سال 1993 جایزه نوبل شیمی را با مایکل اسمیت به اشتراک گذاشت.
در انواع PCR از آنزیم DNA پلیمراز استفاده میشود که سنتز DNA را از لایههای دِاُکسی نوکلئوتید بر روی یک الگوی DNA تکرشتهای هدایت میکند. DNA پلیمراز هنگامی که به DNA الگوی طولانیتری تکثیر میشود، نوکلئوتیدها را به انتهای ’3 یک الیگونوکلئوتید طراحی شده اضافه میکند.
به طور معمول هدف از PCR تولید ناحیهای از ساختار DNA مورد نظر به اندازهای است که بتوان آن را تجزیه و تحلیل یا به روش دیگری استفاده کرد. به عنوان مثال، DNA تکثیر شده با انواع PCR ممکن است برای توالی یابی ارسال شده، با الکتروفورز ژل نمایان شود یا برای آزمایشات بیشتر در یک پلاسمید (DNA حلقوی) کلون شود. انواع PCR در بسیاری از زمینههای زیستشناسی و پزشکی از جمله تحقیقات زیستشناسی مولکولی، تشخیص پزشکی و حتی برخی از شاخههای زیست محیطی استفاده میشود.
اجزای تشکیل دهنده انواع PCR
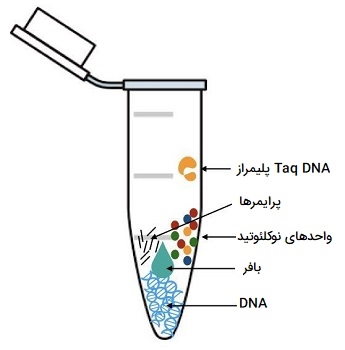
برای شکلگیری یک واکنش PCR و تکثیر ژن مورد نظر نیاز به مواد و اجزای متنوعی داریم تا تکثیر ژن به درستی انجام گرفته و مراحل انجام دادن آن بدون نقص و کامل باشد. علاوه بر رشته اصلی DNA نیاز به مواد دیگری از جمله آنزیم داریم تا قطعات کوچک نوکلئیک اسید در کنار هم چیده شده و قطعات جدید را از روی رشته الگو بسازند. در ادامه به بررسی مواد تشکیل دهنده یک واکنش PCR میپردازیم.
- الگوی DNA. نمونهای بوده که حاوی توالی DNA هدف است. در ابتدای واکنش، درجه حرارت بالا به مولکول DNA دو رشتهای اصلی اعمال میشود تا رشتهها از هم جدا شوند.
- آنزیم DNA پلیمراز. نوعی آنزیم که رشتههای جدید DNA مکمل توالی هدف را سنتز میکند. اولین و متداولترین این آنزیمها استفاده از Taq DNA پلیمراز است، در حالیکه Pfu DNA پلیمراز به دلیل حساسیت بالاتر هنگام کپی کردن DNA، به طور گستردهای استفاده میشود. اگرچه این آنزیمها اندکی متفاوت بوده، اما هر دو دارای دو قابلیت هستند که آنها را برای انواع PCR مناسب میکند: میتوانند با استفاده از الگو و آغازگرها (پرایمرها) رشتههای جدیدی از DNA تولید کنند و مورد بعدی مقاوم به حرارت هستند. در ریل تایم PCR رونویسی معکوس صورت میگیرد به این ترتیب که قبل از PCR با تبدیل RNA نمونه به cDNA توسط آنزیم «ترانس کریپتاز معکوس» (Reverse transcriptase) انجام میشود.
- آغازگرها. پرایمرها یا آغازگرها قطعات کوتاه DNA تک رشتهای مکمل توالی هدف هستند. DNA پلیمراز به کمک این رشتههای کوتاه، سنتز رشته الگوی DNA را شروع میکند.
- واحدهای منفرد نوکلئوتیدها. dNTP ها یا دِاُکسی نوکلئوتید تری فسفاتهایی مانند بازهای C ، T ، A و G که اساساً بلوکهای سازنده رشتههای DNA جدید هستند با کنار هم قرار گرفتن به صورت پشت سر هم، رشتههای جدید DNA را میسازند.
- یون منیزیم. یون منیزیم (Mg دو بار مثبت) به عنوان یک فاکتور برای فعالیت DNA پلیمرازها با ایجاد اختلاط dNTP در حین پلیمریزاسیون عمل میکند. یونهای منیزیم در محل فعال آنزیم، تشکیل پیوند فسفودی استر را بین ′OH - 3 یک آغازگر و گروه فسفات یک dNTP کاتالیز میکنند. علاوه بر این، Mg دو بار مثبت با ایجاد ثبات در بارهای منفی روی نردبان DNA فسفاته، ایجاد اتصال بین آغازگرها و الگوهای DNA را تسهیل میکند.
- بافر. انواع PCR در بافرها انجام میشوند که یک محیط شیمیایی مناسب برای فعالیت DNA پلیمراز را فراهم میکنند. pH بافر معمولاً بین 8 تا 9/5 است و اغلب توسط Tris - HCl تثبیت میشود. توجه داشته باشید که DNA پلیمرازها اغلب با بافرهای PCR همراه هستند که برای فعالیت آنزیم قوی بهینه شدهاند. بنابراین توصیه میشود برای دستیابی به نتایج بهینه PCR از بافر ارائه شده همراه کیت استفاده کنید.
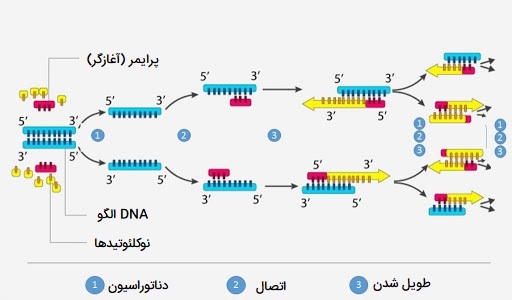
مراحل PCR چیست؟
به طور معمول، هدف از انجام PCR تولید کافی از ناحیه DNA هدف است که بتوان آن را تجزیه و تحلیل یا به روش دیگری استفاده کرد. این منطقه DNA میتواند هر چیزی باشد که پژوهشگر به آن علاقه دارد. به عنوان مثال، ممکن است ژنی باشد که محقق میخواهد عملکرد آن را بفهمد یا یک مارکر ژنتیکی است که توسط دانشمندان پزشکی قانونی برای مطابقت DNA صحنه جرم با مظنونان استفاده میشود.
از انواع PCR در بسیاری از زمینههای زیستشناسی و پزشکی از جمله تحقیقات زیستشناسی مولکولی، تشخیص پزشکی و حتی برخی از شاخههای زیست محیطی استفاده میشود. PCR عمدتاً بر اساس یک سری چرخه حرارتی و خنک کننده 20 تا 40 تکرار برای تسهیل تکثیر DNA توسط واکنش آنزیمی صورت میگیرد. بنابراین، یک چرخه حرارتی PCR با 40 تکرار، تعداد 1،099،511،627،776 نسخه DNA را از یک نسخه الگو تولید میکند. PCR به طور کلی دارای مراحل مختلفی است که شامل موارد زیر هستند:
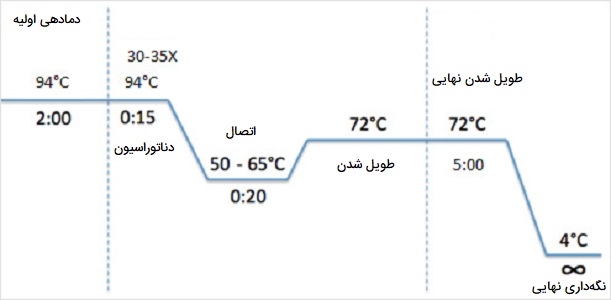
آماده سازی اولیه
«آماده سازی اولیه» (Initialization) واکنشی است که در آن به مدت 2 الی 10 دقیقه در دمای 94 - 96 درجه سانتیگراد گرم میشود (یا در صورت استفاده از DNA پلیمرازهای بسیار مقاوم در برابر حرارت 98 درجه سانتیگراد). این مرحله باعث فعال شدن DNA پلیمراز و سایر واکنشدهندهها در واکنش شده و همچنین باعث دناتوره شدن سایر آلودگیها (در صورت وجود) در مخلوط میشود. در برنامههایی مانند غربالگری کلنی، از مقدار کمی سلول میتوان به طور مستقیم به عنوان الگو استفاده کرد که این مرحله اولیه باعث لیز سلولها و آزادشدن DNA شده و پروتئینهای سلولی دیگر از جمله انواع آنزیم DNase که باعث اختلال در روند PCR میشوند را دناتوره میکند.
دناتوراسیون
در «دناتوراسیون» (Denaturation) رشته الگوی DNA در انواع PCR ، واکنش به مدت 20 تا 30 ثانیه تا 94 درجه سانتیگراد گرم میشود و این گرما پیوندهای هیدروژنی ضعیفی که رشتههای DNA را در یک مارپیچ بهم میچسباند، شکسته و اجازه میدهد رشتهها از هم جدا شوند و DNA تکرشتهای ایجاد میشود.
اتصال
پرایمرها الیگونوکلئوتیدهایی هستند که میتوانند به توالی خاص الگوی DNA متصل شوند تا تکثیر DNA پلیمراز را هدایت کنند. در مرحله «اتصال» (Annealing) برای اتصال آغازگرها را به DNA تک رشتهای الگو، دمای واکنش معمولاً به مدت ۲۰ تا 40 ثانیه در دمای ۵۰ تا ۶۵ درجه سانتیگراد کاهش مییابد. دمای مطلوب برای اتصال بستگی به دمای ذوب (Tm) آغازگرها دارد: دمایی که در آن نیمی از دوبلکس DNA جدا میشود تا یک رشته شود.
اگر درجه حرارت اتصال خیلی زیاد تنظیم شود، پرایمر نمیتواند به خوبی متصل شود و اگر درجه حرارت آنلینگ پایین باشد، آغازگرهای غیر اختصاصی متصل شده و منجر به تکثیر غیر اختصاصی میشوند. غلظت آغازگر در مخلوط واکنش معمولاً بسیار بیشتر از رشته الگوی DNA است، بنابراین هیبریداسیون پرایمر - الگو نسبت به اتصال مجدد رشتههای DNA بسیار بیشتر است. به محض اینکه پرایمر به الگو وصل شود، DNA پلیمراز میتواند ترکیب کردن dNTPها را بر روی الگو آغاز کند.
طویل شدن
سپس واکنش در مرحله «طویل شدن» (Extension) تا 72 درجه سانتیگراد (دمای مطلوب برای عملکرد DNA پلیمراز) گرم میشود. DNA پلیمراز آغازگرها را گسترش میدهد و با استفاده از DNA هدف به عنوان الگو، نوکلئوتیدها را به ترتیب به پرایمر اضافه میکند. در این مرحله، DNA پلیمراز شروع به ترکیب dNTP ها در جهت ’5 به ’3 روی رشته سنتزی میکند. این یک رشته DNA تازه سنتز شده و مکمل رشته الگو است. دمای مطلوب طویل شدن برای DNA پلیمرازهای مختلف متفاوت است. Taq DNA پلیمراز معمولی (مقاوم در برابر حرارت) به طور ایدهآل در دمای ۷۲ تا ۷۸ درجه سانتیگراد کار میکند. مدت زمان طویل شدن هم به طول DNA الگوی اصلی، آمپلیکون مورد نظر و سرعت آنزیم DNA پلیمراز بستگی دارد. DNA پلیمرازهای معمولی با سرعت تولید ۱ تا ۱/۵ کیلوباز (۱۵۰۰ - ۱۰۰۰ عدد نوکلئوتید) در یک دقیقه در دمای مطلوب آن رشتههای جدید را پلیمریزه میکنند.
طویل شدن نهایی
در مرحله «طویل شدن نهایی» (Final Elongation) مخلوط واکنش در آخرین چرخه طولانی شدن در دمای ۷۲ تا ۷۸ درجه سانتیگراد (دمای کار مطلوب برای اکثر پلیمرازها) به مدت ۵ - ۱۵ دقیقه نگهداری میشود. این مرحله اطمینان میدهد که DNA تک رشتهای باقی مانده پس از آخرین چرخه PCR به طور کامل طویل شده است.
نگه داری نهایی
در مرحله آخر «نگه داری نهایی» (Final Hold) برای مدت زمان نامشخصی به منظور ذخیره کوتاه مدت، دمای مخلوط واکنش به ۴ تا 15 درجه سانتیگراد کاهش مییابد. این دما باعث شده که تا زمان برداشتن نمونهها از داخل دستگاه ترموسایکلر توسط کاربر، نمونههای DNA تکثیر شده سالم باقی مانده و دناتوره نشوند.
برای تنظیم کردن دستگاه ترموسایکلر برای یک واکنش PCR معمولی باید ۳ مرحله دناتوره شده، اتصال و طویل شدن در 25 تا 35 بار تکرار تنظیم شوند که بسته به طول ناحیه DNA کپی شده، به طور کلی 2 تا 4 ساعت کل واکنش طول میکشد. اگر واکنش کارآمد باشد (خوب کار کند)، منطقه هدف میتواند از یک یا چند نسخه به میلیاردها نسخه برسد. برای بررسی اینکه آیا قطعه DNA هدف به طور صحیح تکثیر شده است یا خیر، الکتروفورز ژل یک روش سریع برای بررسی اندازههای مولکولی (در جفت باز) محصولات تکثیر شده است. اندازه محصول تکثیر شده در انواع PCR با مقایسه آن با DNA ladder (نشانگر وزن مولکولی حاوی قطعات DNA در اندازههای شناخته شده) تخمین زده میشود.
بسیاری از عوامل میتوانند در واکنش PCR تداخل ایجاد کنند. بهینهسازی برخی از آنها آسان است (به عنوان مثال شرایط سیکل حرارتی و غلظت Mg دوبار مثبت)، در حالی که سایر دستگاریها و تنظیمات پیچیدهتر بوده و برای مقابله با آن نیاز به تجربی کافی است(به عنوان مثال طراحی آغازگر و اجزای مواد افزودنی بافر PCR). به طور کلی، عوامل مهم در انواع PCR شامل الگوهای DNA، آنزیم DNA پلیمراز ، طراحی آغازگر، اجزای بافر، مواد افزودنی و بازدارندهها و شرایط سیکل حرارتی هستند.
دستگاه PCR چیست؟
ترموسایکلرهای حرارتی یا ماشینهای PCR با تنظیم دما در برنامههای دورهای، DNA را تکثیر میکنند. این ابزار بسیار تخصصی به عنوان یک ابزار مهم در کاربردهای مولکولی، به مرور از پیشرفت در زمینه طراحی و مکانیک مانند افزایش امنیت درب، قابلیت اطمینان بلوک حرارتی، عملکرد سخت افزار و موارد دیگر بهرهمند شده است. بلوکهای حرارتی به راحتی قابل تعویض هستند تا قالبهای مختلف نمونه مانند لولههای تک، چاهکهای نواری و چند لوله را به طور همزمان در خود جای دهند. برخی از مدلها همچنین دارای دو بلوک یا چند بلوک هستند که به طور مستقل برای انجام آزمایشهای همزمان چندگانه کار میکنند. دامنه دمایی ویژگی مهمی است که باید هنگام انتخاب یک ترموسایکلر مورد توجه قرار گیرد، که معمولاً بیشترین دما در آن 99 درجه سانتیگراد و کمترین دما 4 درجه سانتیگراد است.
ابزارهای پیچیدهتر تا 0 درجه سانتیگراد نیز سرد میشوند، این ویژگی هنگام در نظر گرفتن زمان ماندگاری نمونه مهم است. دربهای گرم شونده قابل برنامهریزی ویژگی مهمی است که تبخیر مایع را به حداقل میرساند تا اطمینان حاصل شود که گرما به طور مساوی در واکنشهای حساس انواع PCR اعمال میشود. دستگاههای ترموسایکلر به طور فزایندهای، سطوح مختلفی از اتصال را، با برخی از مدلها از جمله پورتهای USB و دسترسی به اینترنت برای به اشتراکگذاری دادهها و دسترسی از راه دور ارائه میدهند.

به طور کلی در زیستشناسی مولکولی از این دستگاهها برای تعیین توالی DNA، کلونینگ، تولید پروبها، کمیسازی DNA و RNA، مطالعه الگوهای بیان ژن، تشخیص مکانهای دارای برچسب توالی و بسیاری از تکنیکها استفاده میشود. از ترموسایکلر میتوان در پروتکلهایی استفاده کرد که به کنترل بسیار سخت درجه حرارت مانند گرمایش اسلایدهای بافتی برای هیبریداسیون درجا نیاز است. افزایش دمای کنترلشده توسط یک ترموسایکلر امکان مطالعه سینتیک وابسته به دما را فراهم میکند. به عنوان مثال، علاوه بر بهینهسازی پروتکل انواع PCR، یک ترموسایکلر با ویژگی گرادیان امکان تعیین درجه حرارت مطلوب برای هر فعالیت آنزیمی را فراهم میکند.
تاریخچه دستگاه PCR
در آغازِ این فناوری در اوایل دهه 1980، تکثیر DNA توسط PCR یک فرایند زمانبر و پرزحمت بود. مراحل سیکلهای حرارتی به صورت دستی انجام میشد که شامل انتقال مکرر نمونههای DNA در میان سه حمام آب بزرگ بود که در دمای مختلف برای دناتوراسیون، آنلینگ و طویل شدن قرار داده شده بود. از آنجا که در آن زمان DNA پلیمرازهای پایدار در برابر حرارت معمولاً در دسترس نبودند، پس از هر دور مقدار آنزیم باید دوباره پر شود. بنابراین مهندسان شروع به ابداع ابزاری کردند که انجام همه مراحل را در یک سایکلر حرارتی داشته باشد که روند کار به صورت خودکار به انواع PCR کمک میکند. اولین ماشین خودکار تولید شده، موسوم به Mr. Cycle، با استفاده از دستگاههای کنترل مایعات و حمامهای آب، نیاز به افزودن آنزیم تازه به صورت دستی را برطرف کرد.

در سال 1987 اولین سایکلر حرارتی تجاری به نام TC1 DNA Thermal Cycler از شرکت Perkin Elmer Cetus، با قابلیت برنامهریزی گرمایش و سرمایش نمونهها با استفاده از یک بلوک فلزی، در دسترس قرار گرفت. در سال 1988، اولین استفاده از آنزیم مقاوم در برابر حرارت Taq DNA پلیمراز در PCR، با استفاده از سایکلر حرارتی TC1، گزارش شد. این اتفاق راه را برای استفاده از PCR در طیف گستردهای از زمینههای علمی و همچنین نوآوری در سایکلرهای حرارتی هموار کرد که انقلابی در تحقیقات زیستشناسی مولکولی ایجاد کردند. از زمان معرفی سایکلر حرارتی TC1، پیشرفت فنی قابل توجهی در مورد ویژگیهای مختلف تجهیزات برای بهبود انواع PCR حاصل شده است که در ادامه به هر کدام میپردازیم.
انواع PCR با نمونه برداری بهتر
در ابتدای توسعه چرخههای حرارتی، سیستم خنککننده متکی به یک کمپرسور لوله کشی بزرگ بود، که داشتن یک ابزار با اندازه کوچک و مناسب را غیرممکن میکرد. در حال حاضر از بلوکهای Peltier حالت جامد در سایکلرهای حرارتی برای گرم کردن و خنکسازی با کنترل جهت جریان الکتریکی استفاده میشود. سیستمهای پیشرفته Peltier میتوانند بلوک را با سرعت بالایی گرم و خنک کنند (به عنوان مثال 6 درجه سانتیگراد در ثانیه)، PCR سریع ما را قادر میسازد تا تعداد PCR بیشتری را در روز انجام دهیم. به همین ترتیب، درب گرم شده در حال حاضر یکی از ویژگیهای مشترک سایکلرهای حرارتی برای جلوگیری از تبخیر و چگالش نمونههای PCR در هنگام اجرا است.
قبل از ورود انواع دستگاه دارای درب گرم شده، نمونهها با روغن معدنی پوشانده میشدند تا به همان هدف برسند. علاوه بر ناخوشایند و نامرتب بودن، روکشهای روغنی مقدار نمونهای را که میتوان در برنامههای پاییندستی استفاده کرد، محدود میکند، زیرا برای جلوگیری از انتقال روغن، بخشی از نمونه باید خارج میشد. به همین ترتیب، بسیاری از دستگاههای سایکلر حرارتی امروز با در نظر گرفتن انعطافپذیری در تولید نمونه ساخته شدهاند. یک سایکلر حرارتی رو میزی با بلوکهای قابل تعویض ممکن است مثلاً از یک تا 480،000 واکنش تکثیر داشته باشد.

انواع PCR با بهینه سازی دقیق تر
از آنجا که اتصال آغازگرها به دنباله هدف برای بدست آوردن نتایج موفقیت آمیز انواع PCR حیاتی است، درجه حرارت برای مرحله اتصال اغلب به بهینهسازی نیاز دارد. برای بررسی دماهای مختلف به طور همزمان، «بلوکهای با شیب حرارتی» (gradient thermal blocks) ایجاد شدهاند، که برای تنظیم درجه حرارت کم و زیاد مطلوب در اطراف نقطه انلینگ نظری در دو انتهای یک بلوک فلزی طراحی شدهاند.
همچنین فناوری بهتر از گرادیان نیز در دسترس است که در آن بلوکهای فلزی جداگانه عایق شده جایگزین یک بلوک میشوند. این امکان کنترل دقیقتر دما را برای بهینهسازی سریعتر فراهم میکند. علاوه بر فناوری بلوک، الگوریتمهای کنترل دمای نمونه در طول سالها بهبود یافتهاند. برای دستیابی به گرمایش و سرمایش یکنواخت نمونههای انواع PCR از مدلهای پیچیده ریاضی برای تنظیم دقیقتر دمای بلوک استفاده میشود. این نوآوری علاوه بر دمای بلوک حرارتی، شامل اندازهگیری دمای نمونهها نیز است.
انواع PCR با پروتکل های سریع تر
PCR سریع به پروتکلهایی گفته میشود که سرعت کلی اجرای PCR را بطور چشمگیری تسریع میکنند، به طور معمول زمان اجرا را از تقریباً 2 ساعت به کمتر از 40 دقیقه کاهش میدهد، باعث صرفهجویی در وقت و افزایش توان تولید میشود. فناوریهای سایکلر حرارتی که انواع PCR سریع را فعال میکنند عبارتند از:
- پیشرفت در عناصر Peltier برای نرخ شیبدهی سریعتر و همچنین گرمایش و سرمایش بلوک و نمونهها.
- الگوریتمهای بهبودیافته برای کنترل و پیشبینی بهتر دمای نمونه.
این پیشرفتهای ابزاری، همراه با نوآوری در مواد مصرفی انواع PCR و لولههای پلاستیکی PCR با مشخصات دیواره فوق العاده نازک و همچنین DNA پلیمرازهای بسیار پردازش شده، انواع PCR سریع را به طور قابل توجهی بهبود بخشیده است.

انواع PCR با راه اندازی آسان تر
سایکلرهای حرارتی امروزه برای برنامهنویسی آسان پروتکلهای PCR طراحی شدهاند. پروتکلهای انواع PCR اغلب بر اساس DNA هدف، توالیهای آغازگر، DNA پلیمرازهای استفاده شده و اهداف آزمایشی متفاوت هستند. بنابراین، چرخههای حرارتی مجهز به رابطهای کاربری بصری، مانند صفحههای لمسی و ویژگیهای برنامهدهی آسان، امکان تنظیم سریعتر و کارآمد پروتکل را دارند. پیشرفتهای اخیر همچنین امکان دسترسی راحت به دستگاههای سایکلر حرارتی را در هر زمان و از هر مکان با استفاده از دستگاه تلفن همراه یا رایانه رومیزی فراهم میکند. اتصال به فضای ابری، قابلیت دسترسی بیشتر را در اختیار شما قرار داده و آزادی ایجاد و به اشتراکگذاری پروتکلها و همچنین برنامهریزی، شروع یا توقف و نظارت بر اجرای PCR را فراهم کرده است. در ادامه برخی از معروفترین دستگاههای PCR حال حاضر موجود در دنیا را بررسی میکنیم.
دستگاه سایکلر حرارتی T100 C از Bio-Rad
سایکلر حرارتی T100 یک دستگاه PCR کوچک است که مجموعهای از ویژگیهای مناسب را در یک وسیله کوچک ارائه میدهد. این سایکلر حرارتی جمع و جور دارای یک رابط کاربری صفحه لمسی بصری است تا اجرای PCR را آسان کند. فناوری حرارتی گرادیان به شما امکان میدهد تا در یک بار اجرا، واکنش خود را به سرعت بهینه کنید. سیستم T100 با طراحی قوی خود یک سیکل ساز حرارتی شخصی قابل اعتماد است که عملکردی استثنایی را برای سالها ارائه میدهد. ویژگیها و مزایای سایکلر حرارتی T100 در ادامه بیان شده است.
- صفحه لمسی بصری. برنامهدهی آسان با استفاده از یک صفحه لمسی رنگی بزرگ و رابط بصری را ممکن کرده است.
- نتایج سازگار. طراحی قوی عملکرد موثر و سازگار اجرای برنامه را تضمین میکند.
- بهینهسازی آسان. این سیکل حرارتی شیبدار امکان بهینهسازی سریع PCR را با استفاده از یک شیب حرارتی منحصر به فرد فراهم میکند.
- مدیریت پروتکل آسان. پروتکلها را میتوان با استفاده از پوشههای شخصی یا درایو فلش USB سازمان داد.
- صرفه جویی در اشغال فضا. T100 یک سایکلر حرارتی جمع و جور است که برای گذاشتن در هر آزمایشگاهی متناسب است.
دستگاه Real - Time PCR لمسی CFX96
سیستم لمسی CFX96 یک سیستم تشخیصی Real-Time PCR قدرتمند، دقیق و انعطافپذیر است. این ابزار PCR در زمان واقعی شش کاناله (پنج رنگ و یک کانال FRET) فناوری نوری پیشرفته را با کنترل دقیق دما ترکیب میکند تا بتواند تشخیص حساس و قابل اعتماد برای واکنشهای تکی یا چندتایی را ارائه دهد. در استفاده از این دستگاه، سریعاً بر روی صفحه لمسی LCD یکپارچه، اجراها را کنترل کرده و ردیابیهای تکثیر را کنترل کنید یا از نرم افزار CFX Maestro استفاده کنید تا آزمایش خود را به راحتی و بصری طراحی کرده و نتایج را از طریق رایانه متصل تجزیه و تحلیل کنید. با تشخیص حداکثر پنج هدف، عملکرد سایکلر حرارتی بینظیر، عملکرد مستقل و نرم افزاری بینظیر و قدرتمند را دارا است. از مهمترین ویژگیهای این دستگاه در ادامه توضیح داده شده است.
- قابلیت تنظیم سریع. این دستگاه Real-Time PCR دارای قابلیت نصب آسان بوده و اپتیک آن در کارخانه کالیبره شده است.
- استفاده از نمونه و معرف را به حداقل میرساند. تا 5 هدف چند منظوره با حجم نمونه تا 10 میکرولیتر.
- قابلیت بهینه کردن واکنشها تنها در یک بار اجرای واکنش را دارد.
- دادهها سریعتر قابل تجزیه و تحلیل هستند.

کاربرد تکنیک PCR
PCR طیف گستردهای از کاربردها را شامل میشود، نه تنها در تحقیقات اساسی بلکه در زمینههای تشخیص پزشکی، پزشکی قانونی و کشاورزی نیز نقش دارد. برخی از کاربردهای PCR عبارتند از: بیان ژن، بررسی (تشخیص) ژنوتیپ، کلونینگ، جهشزایی تجزیه و تحلیل متیلاسیون، توالییابی، علوم پزشکی، پزشکی قانونی و کاربردی. در ادامه هر کدام به طور مفصلتر توضیح داده شدهاند.
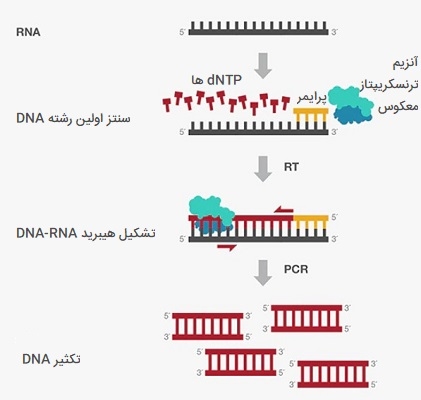
کاربرد انواع PCR دربیان ژن
تغییرات بیان ژن در بین انواع سلولها، بافتها و ارگانیسمها در یک زمان خاص معمولاً توسط PCR بررسی میشود. در این فرآیند، RNA از نمونههای مورد نظر جدا شده و از طریق رونویسی معکوس، RNA پیام رسان (mRNA) به DNA مکمل (cDNA) تبدیل میشود. سطح اصلی mRNA را میتوان از مقدار cDNA تکثیر شده در PCR تعیین کرد. این فرآیند همچنین به عنوان PCR رونویسی معکوس یا RT - PCR شناخته میشود. ممكن است «PCR نقطه پایانی» (End - point PCR) برای کمیسازی بیان RNA از بین محصولات تکثیر شده، در یک ژل انجام شود، اگرچه این یك روش نیمه كمی است.
به عنوان مثال، cDNA ورودی به صورت پشت سر هم رقیق شده و سپس تکثیر میشود. بازده PCR نقطه پایانی ژنهای ورودی مختلف بر روی یک ژل قابل مشاهده شده و سپس شدت باند با توجه به یک «ژن رفرنس خانهدار» (Housekeeping Gene Reference) برای تخمین سطح بیان نسبی ژن هدف تکثیر شده کمی و نرمالسازی میشود. امروزه PCR در زمان واقعی یا qPCR عمدتا جایگزین PCR نقطه پایانی شده است تا نتایج قابل اعتماد و کمی بیان ژن را بدست آورد، در PCR کمی و رونویسی معکوس بیشتر در این باره توضیح داده شده است.
کاربرد انواع PCR درتغییر ساختار ژنتیکی
از PCR میتوان برای تشخیص تغییرات توالی در آللها در سلولهای خاص یا ارگانیسمها استفاده کرد. به عنوان مثال میتوان تغییر ساختار ژنتیکی موجودات تراریخته مانند موشهای دارای ژن «حذف شده» (knock-out) یا موشهای دارای ژن «وارد شده» (knock-in) را بررسی کرد. مجموعههای پرایمر برای مناطق ژنی مورد نظر و ارزیابی تغییرات ژنتیکی بر اساس وجود یا عدم وجود آمپلیکون یا طول آن طراحی شدهاند. برای تشخیص جهشهای نوکلئوتیدی خاص، توالیهای تقویتشده باید بیشتر مورد تجزیه و تحلیل قرار گیرند. به عنوان مثال، تعیین توالی آمپلیكونهای PCR یک رویكرد برای مطالعه تغییرات تک نوكلئوتیدی (SNVs) و چندشكلیهای یك نوكلئوتیدی (SNPs) است. برای جلوگیری از ورود جهشهای ناخواسته در طی انواع PCR قابل انجام، DNA پلیمرازهای با صحت بالا توصیه میشوند. تغییر ساختار ژنتیکی توسط انواع PCR همچنین جنبه اساسی تجزیه و تحلیل ژنتیکی جهش در سرطان و وراثت است.
کاربرد انواع PCR درکلونینگ
PCR به طور گستردهای در شبیهسازی قطعات DNA مورد علاقه، طی یک تکنیک معروف به نام PCR کلونینگ استفاده میشود. در PCR کلونینگ مستقیم، ناحیه مورد نظر منبع DNA (به عنوان مثال gDNA ، cDNA ، DNA پلاسمید) تکثیر شده و در حاملهای سازگار با طراحی خاص قرار میگیرد. از طرف دیگر آغازگرها ممکن است در انتهای ’5 خود برای دستکاری بیشتر قبل از قرار دادن با نوکلئوتیدهای اضافی طراحی شوند. نمونههایی از این توالیهای الحاقی شامل سایتهای محدودکننده برای کلونینگ از طریق «هضم - برش» ( Restriction - Digestion) و «بستن» (Ligation)، توالیهای سازگار با وکتور برای «کلونینگ مستقل از اتصال» (Ligation - Iindependent Cloning) و توالیهای نوترکیبی برای مونتاژ چند قطعه است.
از آنجا که آغازگرها در جهت ’3 به ’5 سنتز میشوند، سنتز ناموفق یا ناقص این الیگوهای DNA، توالیهای ’5 کوتاه ایجاد میکنند. بنابراین، برای اطمینان از کلونینگ موفقیتآمیز قطعه PCR شده مورد نظر، خالصسازی توصیه میشود تا نه تنها عوامل اضافی از سنتز بلکه DNAهای چند نوکلوئوتیدی با طول کامل اضافی نیز حذف شوند. علاوه بر آمادهسازی درج قطعه ژنی، PCR نیز یک روش مفید پس از کلونینگ برای غربالگری است که آیا کلنیها درون خود قطعه مورد نظر را حمل میکنند یا خیر.

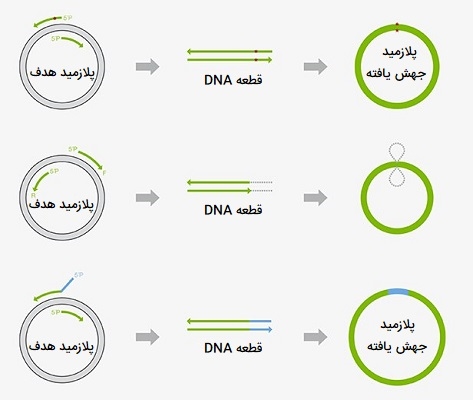
کاربرد انواع PCR درجهش زایی
یکی از مزایای انواع PCR کلونینگ، توانایی ورود جهشهای مورد نظر به ژن مورد نظر از طریق شبیهسازی، برای مطالعات «جهشزایی» (Mutagenesis) است. در «جهشزایی به سمت سایت» (Site-directed Mutagenesis)، آغازگرهای PCR به گونهای طراحی شدهاند که جهشهای جایگزینی، حذف یا درج بازها را در یک توالی خاص ترکیب کنند. محصول انواع PCR حاوی جهش معرفی شده، به صورت دایرهای دو انتهای آن به هم متصل شده، یک پلاسمید مدور را بازسازی کرده و برای ورود به سلولهای مورد نظر استفاده میشود. ملاحظات مهم برای آزمایشهای جهشزایی سایت هدایت شده عبارتند از:
- طراحی آغازگر: در طراحی پرایمرهای جهشزا لازم است که توالی جهشیافته را در نزدیکی وسط آغازگر قرار دهید، یا حداقل 7 - 8 نانومتر از انتهای ’3 دور باشد. این شرایط اجازه میدهد تا طویل شدن از سمت ’۳ کارآمد و از عدم تطابق بازهای تصحیح شده (طی فعالیت اگزونوکلئازی ’3 → ’5) توسط DNA پلیمراز شود. خالصسازی آغازگرهای PCR برای به حداکثر رساندن جهشزایی و کارایی کلونینگ توصیه میشود.
- انتخاب DNA پلیمراز: استفاده از DNA پلیمراز با قابلیت اطمینان بالا برای تولید قطعات PCR با جهش مورد نظر بدون ایجاد خطاهای ناخواسته بسیار مهم است. همچنین، DNA پلیمراز انتخاب شده باید بتواند تمام طول DNA الگو را تقویت کند.
- پارامترهای PCR: در صورت انتخاب ژن کوتاهتر برای انواع PCR و کوتاهتر کردن چرخههای انجام PCR تعداد خطاهای ایجاد شده در PCR نیز کاهش مییابد. برای حفظ دقت توالی هنگام تکثیر DNA طولانیتر یا به دست آوردن بازده بالاتر از چرخههای PCR کمتر، یک DNA پلیمراز با قابلیت اطمینان بسیار بالا برای انجام فرآیند توصیه میشود. برای معرفی چندین سایت جهش، میتوان آغازگرهای جهشزا با توالی همولوگ همپوشان را برای انواع PCR طراحی کرد. انتهای همولوگ آمپلیکونها به صورت جهتدار ترکیب میشوند و در نتیجه یک پلاسمید با جهشهای چندگانه مورد نظر ایجاد میشود. این روش میتواند نه تنها برای ایجاد جهش در یک پلاسمید بلکه برای تکثیر با یک PCR بیش از حد طولانی نیز دنبال شود، همچنین برای جلوگیری از میزان خطای بالاتر در تقویت انواع PCR طولانی مدت نیز کاربرد دارد.
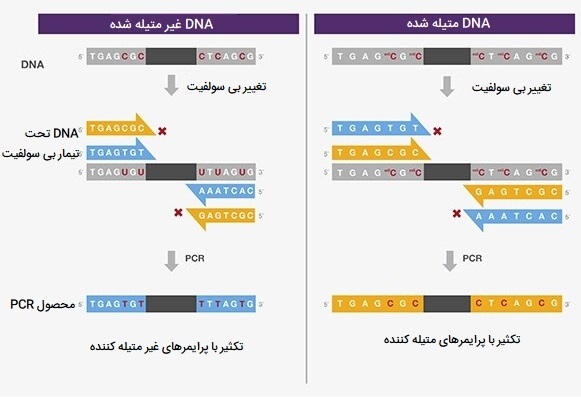
کاربرد انواع PCR در متیلاسیون
برای بررسی متیلاسیون اختصاصی منبع میتوان از انواع PCR استفاده کرد. در روشی به نام «PCR مخصوص متیلاسیون» (methylation-specific PCR) (MSP)، دو جفت آغازگر برای تمایز وضعیت متیلاسیون محل مورد نظر طراحی شده است. در PCR مخصوص متیلاسیون، نمونههای DNA ابتدا با بیسولفیت تیمار میشوند تا سیتوزین غیر متیله شده (C) به اوراسیل (U) تبدیل شود. سیتوزین متیله شده بدون تأثیر تیمار بیسولفیت باقی میماند. برای شناسایی سایتهای متیله شده، یک جفت آغازگر با گوانین (G) طراحی شده تا با سیتوزین متیله شده در دنباله هدف جفت شود. برای شناسایی مکانهای غیر متیله شده، جفت دیگری از آغازگرها با آدنین (A) طراحی میشود تا در مولکولهای «تبدیل شده به بیسولفیت» ( bisulfite-converted) با U جفت شود (و سپس در دورههای بعدی PCR با تیمین (T) جفت شود).
از نمونه PCR تکثیر شده مثبت حاصل از اتصال آغازگر برای تعیین حالت متیلاسیون منبع استفاده میشود. از آنجا که MSP وابستگی زیادی به ویژگی پرایمر نسبت به توالی تبدیل شده به بیسولفیت (bisulfite-converted) دارد، طراحی آغازگر نقشی اساسی در موفقیت آزمایشی دارد. اول، سایتهای اتصالدهنده آغازگر باید حاوی بقایای حساس به متیلاسیون باشند تا توالیهای متیلهشده در مقابل غیر متیله شده قابل تشخیص باشند. دوم، آغازگرهای غیر متیله شده به طور معمول غنی از AT هستند و بنابراین برای امکان اتصال اختصاصی باید طولانی باشند (به عنوان مثال بزرگتر از ۳۰ نوکلئوتید) و Tm بیشتر از ۶۰ درجه سانتیگراد داشته باشند. علاوه بر این، توالیهای با AT بالا اغلب به تشکیل پرایمر - دایمر، ترکیب شدن غیر منطبق، لغزش DNA پلیمراز و خطای تکثیر منجر میشوند.
بنابراین، DNA پلیمراز انتخاب شده باید بتواند الگوهای با طیف گستردهای از محتوای AT / GC را تکثیر کند. سوم، اختصاصیت پرایمر باید به صورت تجربی با متیلاسیون توالیهای شناخته شده و ناشناخته برای ارزیابی نتایج مثبت کاذب بررسی شود. برای کمک به تمیز دادن حالتهای متیلاسیون با عدم تطابق جفت باز، توصیه میشود آغازگرهای متیلاسیون و غیر متیلاسیون را با یک جفت G - A یا T - C در انتهای ’3 آنها طراحی کنید. به جای Endpoint PCR، میتوان از Real-time PCR با PCR مخصوص متیلاسیون برای تجزیه و تحلیل کمی بیشتر متیلاسیون استفاده کرد.با استفاده از Real-time PCR، تجزیه و تحلیل منحنی ذوب آمپلیکونهای PCR یک روش مبتنی بر PCR برای تشخیص وضعیت متیلاسیون محل مورد نظر است.
کاربرد انواع PCR در پزشکی ، پزشکی قانونی و علوم کاربردی
علاوه بر تحقیقات اساسی، فناوریهای مبتنی بر انواع PCR هر روز در تشخیصهای بالینی، تحقیقات پزشکی قانونی و بیوتکنولوژی کشاورزی استفاده میشود. این برنامهها به عملکرد قابل اعتماد، حساسیت فوقالعاده و مشخصات دقیق نیاز دارند. به همین ترتیب، سایکلرهای حرارتی و معرفها باید مطابقت داشته و به طور خاص برای این اهداف طراحی شوند. نمونههایی از تشخیص مولکولی شامل آزمایش ژنتیکی، تشخیص جهشهای سرطانزا و آزمایش بیماریهای عفونی است. در پزشکی قانونی، شناسایی انسان توسط انواع PCR متکی بر تکثیر تکرارهای پشت سرهم کوتاه منحصر به فرد (STR) در gDNA است تا افراد را از یکدیگر متمایز کند. در کشاورزی، PCR نقش اساسی در تشخیص پاتوژن مواد غذایی، ژنوتیپ گیاهان برای تولید مثل و آزمایش GMO دارد.
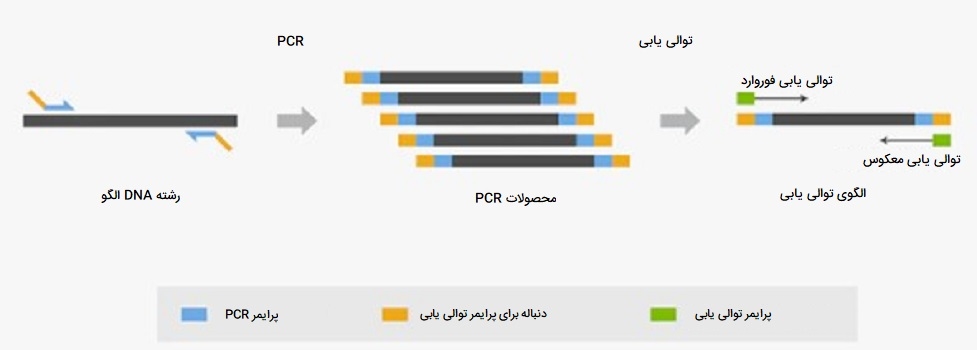
کاربرد انواع PCR در توالی یابی
PCR یک روش نسبتاً ساده برای غنیسازی DNA الگو برای تعیین توالی است. انواع PCR با صحت بالا برای تهیه الگوهای تعیین توالی به منظور حفظ دقت توالی DNA بسیار توصیه میشود. در «توالییابی سنگر» (Sanger sequencing)، قطعات تکثیر شده با PCR، خالص شده و تحت واکنشهای تعیین توالی قرار میگیرند. آغازگرهای انواع PCR را میتوان در انتهای ’5 آنها با محل اتصال متداول برای پرایمرهای تعیین توالی (به عنوان مثال، M13 یا T7 سایت اتصال پرایمرهای یونیورسال) برچسب گذاری کرد تا جریان کار توالییابی را ساده کند.
در توالییابی نسل بعدی (NGS)، انواع PCR به طور گستردهای برای ساخت کتابخانههای توالییابی DNA استفاده میشوند. در تهیه کتابخانه NGS، نمونههای DNA با PCR غنی میشوند (وقتی مقدار DNA شروع اندک باشد) و با آداپتورهای توالییابی برچسبگذاری میشوند. علاوه بر صحت بالا، DNA پلیمراز به کار رفته باید حداقل خطا در تکثیر را برای ایجاد کتابخانههای توالییابی کیفیت بالا نشان دهد.
انواع PCR کدام ها هستند؟
انواع PCR و تکنیکهای مرتبط با انجام آنها طی سالهای اخیر به لطف تطبیق پذیری این روشها منجر به توسعه انواع مختلفی از فناوری PCR شده است که هر کدام دارای کاربردهای ویژهای بوده و در تحقیقات خاصی مورد استفاده قرار میگیرند. در ادامه این مقاله برخی از پرکاربردترین انواع PCR را مورد بررسی قرار داده و کاربرد هر کدام را نیز توضیح دادهایم.
Real-time PCR
Real - time PCR یا «پی سی آر کمی» (qPCR) به یکی از پرکاربردترین روشهای تعیین مقدار ژن تبدیل شده است زیرا دامنه دینامیکی زیادی دارد، دارای حساسیت فوق العادهای است، میتواند اختصاصی هر توالی باشد، پردازش پس از تکثیر در آن تقریباً کم است و امکان افزایش نمونه خروجی در آن وجود دارد. ظهور Real - time PCR و real-time RT-PCR زمینه اندازهگیری بیان ژن را به طرز چشمگیری تغییر داده است. Real - time PCR تکنیک جمع آوری دادهها در کل فرآیند PCR است، بنابراین تکثیر و بررسی DNA را در یک مرحله انجام میدهد. این امر با استفاده از انواع مواد شیمیایی فلورسنت که ارتباط غلظت محصول PCR با شدت فلورسانس را به دست میآورند، حاصل میشود. واکنشها با نقطه زمانی (یا چرخه PCR) مشخص میشوند که در آنجا تکثیر ژن هدف برای اولین بار شناسایی میشود.
PCR معمولی یک فرایند زمانبر است که در آن محصولات PCR از طریق الکتروفورز ژل تجزیه و تحلیل میشوند. Real - time PCR با ارائه تشخیص زمان واقعی محصولات در مرحله تصاعدی تکثیر، تجزیه و تحلیل ژنها را تسهیل میکند. در این روش غلظت اسید نوکلئیک موجود در نمونه با استفاده از رنگ فلورسنت یا استفاده از الیگونوکلئوتیدهای دارای مارکر فلورسنت کمی شده و به صورت اعداد قابل دستیابی است. Real - time PCR در بررسی ژنوتیپ و تعیین کمی عوامل بیماریزا، تجزیه و تحلیل میکرو RNA، تشخیص سرطان، آزمایش بار میکروبی و تشخیص GMO ها مورد استفاده قرار میگیرد.
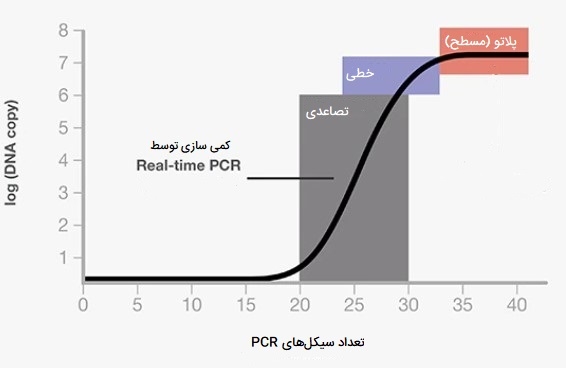
اگرچه مدلهای مختلف Real-time PCR موجود است اما همه ویژگیهای مشترکی دارند از جمله وجود یک سیستم عامل ترموسیکلر استاندارد همراه با یک منبع تحریک (معمولاً لیزر یا لامپ تنگستن)، دوربینی برای تشخیص فلورسانس و کامپیوتر و نرم افزار برای پردازش دادهها. بسته به منبع تحریک موجود و فیلترهای تشخیصی، ممکن است از انواع رنگهای فلورسنت در qPCR استفاده شود. در دو روش معمول استفاده از Real-time PCR، به ترتیب از کاوشگرهای سایبر گرین (رنگی که به DNA دو رشته متصل میشود اما به DNA تکرشتهای متصل نمیشود و در صورت اتصال، فلورسانس ساطع میکند) و پروبهای TaqMan استفاده میشود. برخی از ویژگیهای این روش مهم از انواع PCR عبارتند از:
- هر دو عمل تکثیر و تشخیص محصول در یک ظرف واکنش بدون باز شدن درب آن انجام میشود. این امر احتمال آلودگی متقابل نمونهها به محصول تکثیر شده را بسیار کاهش میدهد.
- در مقایسه با انواع PCR های دیگر، ابزار Real-time PCR نه تنها قادر به اندازهگیری محصول تکثیر شده (آمپلیکون) است، بلکه قادر است مقدار محصول را نیز به صورت کمی نشان دهد و بدین ترتیب تعداد نسخههای هدف در نمونه اصلی قابل تعیین است.
- مقدار زمان مورد نیاز برای تکمیل سنجش Real-time PCR در مقایسه با سنجشهای معمولی انواع PCR بطور قابل توجهی کمتر است زیرا زمان مورد نیاز برای تشخیص پس از PCR محصول تکثیر شده با استفاده از کاوشگرهای فلورسنت حذف میشود. همچنین، برخی از سیستمها قادر به انجام چرخههای حرارتی سریع بر اساس طراحی ابزار هستند و در کمتر از 20 تا 30 دقیقه محصول را تشخیص میدهند.
روش های تشخیص در Real-time PCR
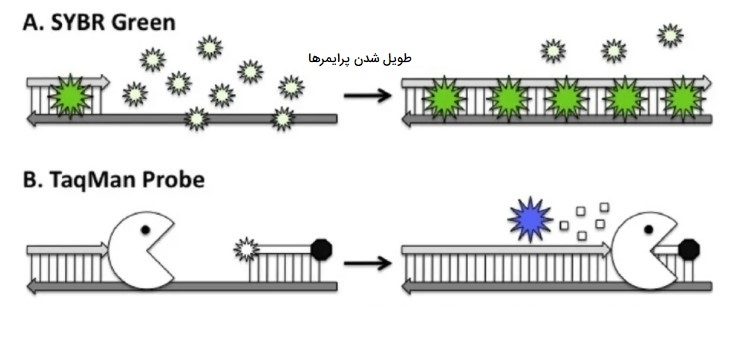
در حال حاضر، طیف وسیعی از مواد شیمیایی فلورسنت برای تشخیص آمپلیکون استفاده میشود. مواد شیمیایی رایجتری را میتوان به دو دسته تقسیم کرد: موادی که شامل اتصال غیر اختصاصی یک رنگ فلورسنت (به عنوان مثال، SYBER Green I) به DNA دو رشتهای هستند و دسته دوم کاوشگرهای فلورسنت که به طور خاص به هدف مورد علاقه متصل میشوند. تعدادی از روشهای Real-time PCR شرح داده شده است، اما دو روش به عنوان محبوبترینها ظاهر شدهاند.
PCR با استفاده از SYBR
سبز «سایبر» (SYBR) رنگی است که به DNA دو رشتهای متصل شده اما به DNA تک رشتهای متصل نمیشود سپس در صورت اتصال، فلورسانس ساطع میکند. در طی چرخه PCR، با تولید بیشتر و بیشتر محصول دو رشتهای که رنگ سبز SYBR به آن متصل شده و فلورس میشود، مقدار فزاینده سیگنال فلورسنت تولید میشود. میزان فلورسانس واکنش در هر زمان خاص با تعداد مولکولهای DNA دو رشتهای موجود در واکنش ارتباط مستقیم دارد. با این حال، نقطه ضعف روش سبز SYBR این است که به همه محصولات دو رشتهای در واکنش متصل می شود و فلورسانس ساطع میکند خواه محصولات اختصاصی باشد یا محصولات غیر اختصاصی، دایمرهای آغازگر یا سایر مصنوعات تقویت کننده باشد.
TaqMan PCR (’5 روش نوکلئاز)
TaqMan PCR از پروب نوکلئیک اسید دارای برچسب رنگی استفاده میکند که مکمل بخشی داخلی از DNA هدف است. این کاوشگر دارای برچسب رنگی به یکی از رشتههای الگو نزدیک و پایین دست یکی از دو آغازگر PCR بازپخت میشود.این کاوشگر با دو قسمت فلورسنت برچسب گذاری شده است، گزارشگر (فلوروفور) به انتهای ’5 کاوشگر و «خاموشکننده» (Quencher) به انتهای ’3 آن متصل است. هنگامی که گزارشگر و خاموشكننده به یكدیگر متصل میشوند، خاموشکننده فلورسنت رنگ گزارشگر را كاهش میدهد زیرا انرژی را از طریق مكانیزمی به نام «انتقال انرژی تشدید فلورسانس» (FRET) جذب میكند. با این حال، در طی PCR، آنزیم Taq پلیمراز با گسترش آغازگر روی رشته هدف پروب، پروب متصل شده را از طریق عملکرد اگزونوکلئازی ’5 به ’3 آن جابجا و تخریب میکند.
بدین ترتیب فلوروفور از اتصال مولکولی خود به خاموشکننده و فلورسنس آزاد میشود. با تولید محصولات بیشتر PCR، کاوشگرهای دارای برچسب رنگی بیشتر مناطق هدف را برای اتصال پیدا میکنند که در نهایت منجر به آزاد شدن مولکول گزارشگر در طی فرایند تقویت بعدی میشود. آزاد شدن رنگهای گزارشگر با افزایش شدت سیگنال فلورسنت متناسب با میزان آمپلیکون سنتز شده منعکس میشود. از هر کدام از کاوشگرهای SYBR green یا TaqMan استفاده کنید، رابطه بین شدت سیگنال و مقدار الگو در یک واکنش Real-time PCR، یک وسیله قابل اطمینان را، هم برای سنجش کمی اسیدهای نوکلئیک و هم برای سنجش وجود یا عدم وجود توالیهای ژنی اختصای فراهم میکند.
کاربرد Real-time PCR
Real-time PCR امکان محاسبه غلظت رشته الگوی آغاز را فراهم میکند و بنابراین، یک ابزار تحلیلی است که اغلب در ارزیابی تعداد کپی DNA، بار ویروسی، تشخیص SNP و «تشخیص آللی» (Allelic Discrimination) مورد استفاده قرار میگیرد. وقتی با PCR رونویسی معکوس (RT-PCR) فرایند شروع شد، qPCR ابزاری قدرتمندی برای اندازهگیری بیان mRNA و استاندارد طلایی برای تایید دادههای بیان ژن در «ریزآرایه» (microarray) است. از مزایای قابل توجه Real-time PCR میتوان به توانایی آن در اندازهگیری غلظت DNA در محدوده وسیع، حساسیت بالا و توانایی آن در پردازش همزمان چند نمونه و ارائه اطلاعات فوری اشاره کرد.
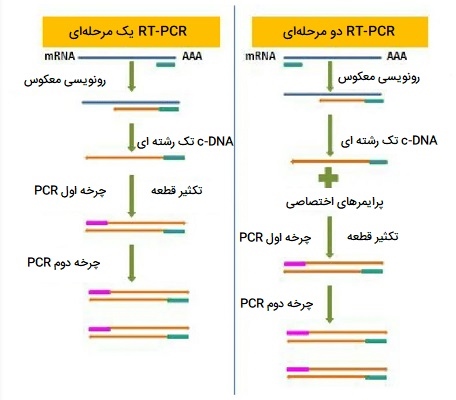
RT - PCR
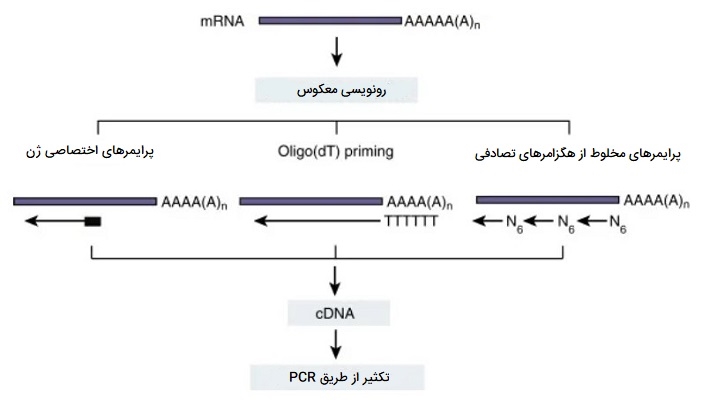
RT - PCR یا PCR ترنسکریپتاز معکوس یک روش تغییر یافته PCR معمولی است که به موجب آن مولکولهای RNA ابتدا به مولکولهای DNA مکمل (cDNA) تبدیل میشوند که میتوانند توسط PCR تکثیر شوند. در RT-PCR ، الگوی RNA ابتدا با استفاده از آنزیم ترنسکریپتاز معکوس به DNA مکمل (cDNA) تبدیل میشود. سپس cDNA به عنوان الگویی برای تکثیر نمایی با استفاده از PCR عمل میکند. RT-PCR میتواند در یک لوله یا به صورت دو مرحلهای در لولههای مختلف انجام شود. روش یک مرحلهای برای احتمال کمتر آلودگی و تغییرات زیاد موثرتر است. در هر دو مورد، ابتدا RNA به cDNA رونویسی معکوس میشود و سپس به عنوان الگویی برای تکثیر PCR استفاده میشود. از RT-PCR در تحقیقات مختلفی از جمله درج ژن، تشخیص بیماری ژنتیکی و تشخیص سرطان استفاده میشود.
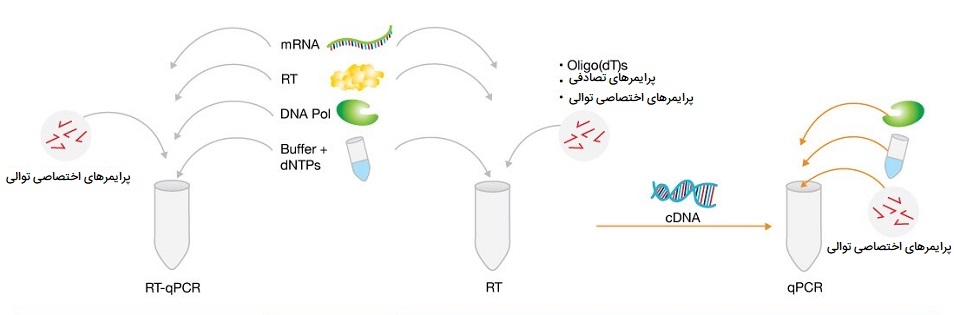
آغازگرهای مورد استفاده برای سنتز cDNA میتواند آغازگرهای غیر اختصاصی توالی باشد (مخلوطی از هگزامرهای تصادفی یا آغازگرهای الیگو-dT) یا آغازگرهای اختصاصی توالی. در روش استفاده از آغازگرهای غیر اختصاصی توالی: هگزامرهای تصادفی مخلوطی از تمام ترکیبات احتمالی شش توالی نوکلئوتیدی است که میتواند به طور تصادفی به mRNA متصل شده و رونویسی معکوس کل استخر RNA را آغاز کند. یا آغازگرهای الیگو - dT مکمل دُم پُلی A مولکولهای mRNA هستند و اجازه سنتز cDNA را فقط از مولکولهای mRNA میدهند. پرایمرهای توالی خاص محدودترین موارد هستند زیرا آنها برای اتصال انتخابی به مولکولهای mRNA مورد علاقه طراحی شدهاند، که رونویسی معکوس را به یک فرآیند خاص هدف تبدیل میکند.
RT-PCR یک مرحله ای
در این حالت از انواع PCR ترنسکریپتاز معکوس، سنتز cDNA و PCR در ظرف واکنش تنها در یک بافر واکنش معمول انجام میشود. آغازگرهای اختصاصی ژن، سنتز cDNA و تکثیر یک هدف خاص را هدایت میکنند. از مزایای اصلی واکنش یک مرحلهای میتوان به حداقل برداشت از نمونه، کاهش زمان سرهم بندی واکنش و انجام واکنش در لوله بسته، کاهش احتمال خطاهای پیپتینگ و آلودگی اشاره کرد. کیفیت و کمبود نمونههای RNA بر کارایی RT- PCR یک مرحلهای تأثیر میگذارد. محصول سنتز شده cDNA پس از یک مرحله RT-PCR قابل ذخیره نیست، بنابراین به منظور تکرار واکنشها یا ارزیابی بیان ژنهای دیگر، مقدار بیشتری از نمونه RNA اصلی مورد نیاز است.
RT-PCR دو مرحله ای
در RT-PCR دو مرحلهای، سنتز cDNA با استفاده از هگزامرهای تصادفی، آغازگرهای Oligo - dT یا آغازگرهای خاص ژن انجام میشود که مخلوطی از مولکولهای cDNA را میدهد. cDNA های سنتز شده بدین ترتیب با استفاده از آغازگرهای خاص تکثیر میشوند. در این حالت از انواع PCR ترنسکریپتاز معکوس، cDNA در یک واکنش سنتز میشود و سپس از مقدار cDNA برای آزمایش PCR بعدی استفاده میشود. این به مرحله اضافی لوله باز، دستکاری بیشتر در لوله پیپت و زمان عملی بیشتر نیاز دارد که ممکن است منجر به تغییرپذیری بیشتر و آلودگی بیشتری شود. cDNA باقیمانده را میتوان برای استفاده در آینده، یا کم کردن بیان چندین ژن از یک نمونه RNA / cDNA، ذخیره کرد.
کاربردهای انواع PCR ترنسکریپتاز معکوس
بسیاری از ویروسهای مهم از نظر بالینی دارای ژنوم متشکل از RNA هستند، RT-PCR برای تشخیص چنین ویروسهایی مفید است. RT-PCR همچنین برای تشخیص علل ویروسی مننژیت و «مننژوانسفالیت» (Meningoencephalitis) مانند انتروویروسها و «ویروس نیل غربی» (West Nile virus) استفاده شده است. RT - PCR برای تشخیص ویروسهای زیر استفاده میشود:
- «ویروس دنگ» (Dengue virus)
- «ویروس حنا» (Hantavirus)
- ویروس متاپنومو انسانی
- سندرم تنفسی حاد شدید (SARS)
از روشهای کمی RT-PCR معمولاً برای تشخیص بار ویروسی HIV و HCV (مقدار این ویروسهای موجود در خون بیمار) استفاده میشود. همچنین با هدف قرار دادن rRNA آنها میتوان از RT-PCR برای شناسایی سایر میکروارگانیسمها (باکتریها، انگلها و قارچها) استفاده کرد. این روش بهتر از تشخیص DNA است، زیرا وجود RNA بیشتر با وجود ارگانیسمهای زنده مرتبط است. تشخیص mRNA با استفاده از RT- PCR به مطالعه بیان ژن میکروارگانیسمها و سلولهای میزبان انسانی کمک میکند.
تفاوت انواع PCR کمی و RT-qPCR
از PCR کمی (qPCR) برای شناسایی، مشخص کردن و کمیسازی اسیدهای نوکلئیک برای کاربردهای متعدد استفاده میشود. معمولاً، در RT- qPCR، رونوشت RNA با رونویسی معکوس ابتدا در cDNA، همانطور که در بالا توضیح داده شد، کمی شده و سپس qPCR متعاقباً انجام میشود. همانند PCR استاندارد، DNA با 3 مرحله تکرار تکمیل میشود: دناتوراسیون، اتصال و طویل شدن. با این حال، در qPCR، برچسب گذاری فلورسنت با پیشرفت PCR، جمع آوری دادهها را امکانپذیر میکند. این روش به دلیل طیف وسیعی از روشها و مواد شیمیایی موجود، فواید بسیاری دارد. در qPCR مبتنی بر رنگ (به طور معمول سبز)، برچسب زدن فلورسنت با استفاده از یک ماده اتصال دهنده dsDNA کمیسازی مولکولهای DNA تکثیرشده را امکان پذیر میکند.
در طول هر چرخه، فلورسانس اندازهگیری شده، سیگنال فلورسانس متناسب با مقدار DNA تکثیرشده افزایش مییابد و از این رو DNA در «زمان واقعی» کمی میشود. معایب qPCR مبتنی بر رنگ این است که فقط یک هدف میتواند در یک زمان بررسی شود و این رنگ به هر ds-DNA موجود در نمونه متصل میشود. در qPCR مبتنی بر کاوشگر، بسیاری از اهداف میتوانند به طور همزمان در هر نمونه شناسایی شوند، اما این امر به بهینهسازی و طراحی یک کاوشگر خاص هدف، که علاوه بر آغازگرها نیز استفاده میشود، نیاز دارد. انواع مختلفی از طرحهای پروب در دسترس است، اما متداولترین نوع آن، یک پروب هیدرولیز بوده که شامل استفاده از فلوروفور و «خاموشکننده» (Quencher) است.
انتقال انرژی رزونانس فلورسانس (FRET) در حالی که کاوشگر سالم است از انتشار فلوروفور از طریق کوئنچر جلوگیری میکند. با این حال، در طول واکنش PCR، پروب در حین گسترش آغازگر و تکثیر توالی خاص که به آن ملزم است، هیدرولیز میشود. شکاف پروب، فلوروفور را از خرد کن جدا کرده و منجر به افزایش فلورسانس وابسته به تکثیر میشود. بنابراین، سیگنال فلورسانس از یک واکنش qPCR مبتنی بر پروب متناسب با مقدار توالی هدف پروب موجود در نمونه است. از آنجا که qPCR مبتنی بر پروب خاصیت بیشتری نسبت به qPCR مبتنی بر رنگ دارد، اغلب فناوری استفاده شده در سنجشهای تشخیصی qPCR است.
Multiplex PCR چیست؟
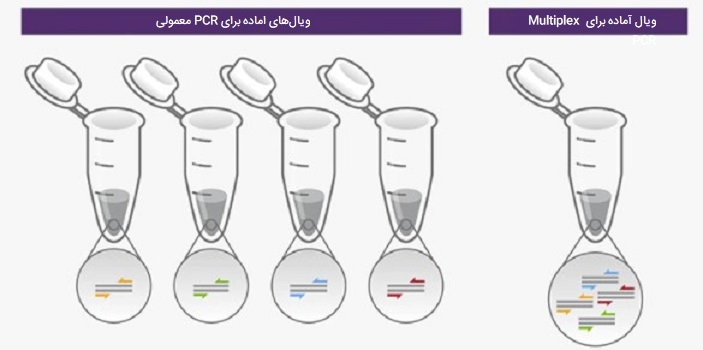
PCR چندگانه یا Multiplex PCR حالتی از انواع PCR است که در آن بیش از یک توالی هدف با استفاده از چندین مجموعه آغازگر در یک مخلوط PCR تکثیر میشود. PCR چندگانه این امکان را فراهم میکند که تکثیر چندین قطعه ژنی را به جای تستهای آزمایشی خاص برای هر کدام، به طور همزمان انجام دهید. این فناوری اولین بار توسط چمبرلین و همکاران برای تشخیص دیستروفی عضلانی دوشن (1988) استفاده شد. Multiplex PCR یک روش کم هزینه، سریع و بدون نیاز به فضای زیاد برای تجزیه و تحلیل ژنتیکی است که مانند توالی یابی باید چندین بار تکرار شود. این به مقدار کمی DNA (10تا 200 نانوگرم) به عنوان الگوی شروع نیاز دارد و میتواند روی نمونههایی با کیفیت DNA کمتر از حد مطلوب نیز انجام شود. گرچه multiplex PCR مزایای بسیاری دارد، اما بهینهسازی آن به همان اندازه چالش برانگیز است.
در حالی که در این روش از انواع PCR از چندین جفت پرایمر استفاده میشود، آغازگرهای یک جفت میتوانند با آغازگرهای جفت دیگر تعامل داشته باشند. از آنجا که هر جفت پرایمر میتوانند نیازهای مختلفی داشته باشند، یک دمای ذوب مطلوب (Tm) و ΔG یکسان وجود ندارد. هنگام طراحی پرایمرهای تکثیر کننده برای multiplex PCR، فاکتورهای مختلفی باید در نظر گرفته شود از جمله:
- طول آغازگرها: طول آغازگرها باید بین 18 تا 25 نوکلئوتید باشد.
- دمای ذوب (Tm): Tm آغازگرها باید یکسان یا در حد 1 - 2 درجه سانتیگراد باشد.
- محتوای GC: محتوای GC آغازگر باید مناسب باشد (50 - 55 درصد).
- توالی مکمل متقابل: برای جلوگیری از تداخل در روند تکثیر DNA، پرایمرها باید فاقد توالی مکمل متقابل باشند.
علاوه بر این، از مناطق با توالیهای کوتاه تکرار شونده، معروف به چندشکلیهای تکنوکلئوتیدی (SNPs) و مناطق با همسانی بالا باید اجتناب شود زیرا ممکن است بر روی کارآیی تقویت PCR و کارایی تکثیر اثر منفی بگذارد. این روش از انواع PCR مزایای قابل توجهی از جمله: کنترل کنندههای تکثیر داخلی از صحت نتایج منفی PCR به ما اطمینان میدهند.
مزایای Multiplex PCR
ابتدا میتوان استراتژیهایی را شامل کنترل داخلی برای PCR توسعه داد. به عنوان مثال، یک جفت آغازگر میتواند به توالیهای موجود در تمام باکتریهای هم خانواده مرتبط هدایت شود و جفت آغازگر دوم را میتوان به یک توالی خاص ژن مورد علاقه هدایت کرد. آمپلیکون (قطعه اسیدنوکلئیکی) کنترل همیشه باید پس از انواع PCR قابل تشخیص باشد. عدم وجود کنترل نشان میدهد که شرایط PCR برآورده نشده است و آزمایش نیاز به تکرار دارد.
حتی اگر عوامل بیماریزا از گروههای مختلف طبقهبندی باشند، ممکن است در یک واکنش واحد پاتوژنهای زیادی شناسایی شوند. یکی دیگر از مزایای multiplex PCR توانایی جستجوی اهداف مختلف با استفاده از یک واکنش است. جفت پرایمرهای اولیه را که به توالیهای خاص ارگانیسمها یا ژنهای مختلف هدایت میشوند، میتوان کنار هم قرار داد تا استفاده از لولههای واکنش متعدد به حداقل برسد. به عنوان مثال، شناسایی عوامل ویروسی (مانند، ویروس هرپس سیمپلکس، انتروویروس، ویروس نیل غربی) که باعث مننژیت یا انسفالیت میشوند با استفاده از روش PCR چندگانه انجام میگیرد.
کاربردهای Multiplex PCR
این حالت از انواع PCR کاربردهای بسیاری دارد، multiplex PCR با موفقیت در بسیاری از شاخهها مانند بررسی ژنوتیپ، تجزیه و تحلیل جهش و چند شکلیها، تجزیه و تحلیل STR ریزماهوارهها، تشخیص عوامل بیماریزا یا ارگانیسمهای اصلاحشده ژنتیکی و غیره استفاده شده است. در آزمایشگاههای تشخیصی، multiplex PCR برای تشخیص میکروارگانیسمهای مختلفی که باعث بیماریهای مشابه هستند، مفید است به کار میرود که در ادامه چند مورد از آنها را ذکر کردهایم.
- تشخیص «آنفلوانزا» (H. influenzae)، «پنومونی» (S. pneumoniae) و «مننژیت» (N. meningitidis) شایعترین علل مننژیت باکتریایی در نمونه مایع نخاعی (CSF)
- تشخیص عوامل ویروسی مننژیت و مننژوآنسفالیت
- شناسایی و تمایز پولیوماویروسهایی که انسان را آلوده میکنند.
- تشخیص باکتریهایی که باعث عفونت گوش میانی، ذات الریه و غیره میشوند.
واکنشهای PCR چندگانه به ویژه هنگامی که تعداد پاتوژنهای احتمالی محدود باشد بسیار مفید هستند. اما در این روش از انواع PCR مخلوط کردن آغازگرهای مختلف خصوصاً با افزایش تعداد جفتهای پرایمرهای مختلف میتواند باعث ایجاد تداخل در روند تکثیر شود. توالییابی پشت سر هم مناطق بزرگ ژنومی توسط PCR چندگانه میتواند باعث ایجاد واکنش متقابل بین جفتهای پرایمر به دلیل همپوشانی آنها شود.
این روش از انواع PCR مستعد آلودگی بوده و حساسیت شدید PCR تو در تو با مشکلات خاص خود همراه است به این دلیل که زمان بیشتری را برای دستکاری نمونه نیاز دارد. آلودگی بیشتر در حین انتقال محصول دور اول به لوله دوم برای دور دوم تکثیر رخ میدهد. همچنین روش پرهزینهای است چراکه این روش از انواع PCR شامل استفاده از دو واکنش جداگانه برای رسیدن به یک نتیجه است. در صورت تکرار سنجشها یا در صورت بروز آلودگی، هزینه به طور چشمگیری افزایش مییابد.

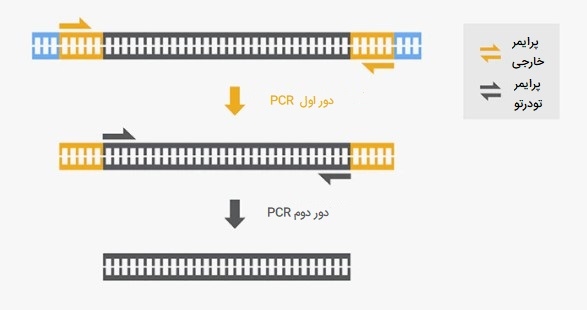
Nested PCR
این حالت از انواع PCR روشی است که برای افزایش حساسیت و اختصاصیت واکنش سنجش طراحی شده است. Nested PCR یا پی سی آر تو در تو شامل استفاده از دو مجموعه آغازگر است که مکمل یک ژن هدف بوده و در دو واکنش پی در پی PCR کار میکنند. در این روش از انواع PCR اولین مجموعه آغازگرها به منظور ترمیم توالیهای بالادست مجموعه دوم آغازگرها طراحی شدهاند، در حالی که مجموعه دوم آغازگرها با توجه به اولین مجموعه آغازگرها به صورت داخلیتر یا تو در تو قرار دارند. رویکرد سنتی PCR تو در تو به صورت انجام تعدادی از چرخههای PCR با استفاده از اولین مجموعه آغازگرها و سپس باز کردن ظرف واکنش و افزودن مجموعه آغازگرهای تو در تو و دوم برای اجرای چرخه دوم PCR بود. مشکل عمده این روش، آلودگی آمپلیکون در آزمایشگاه و از دست دادن اختصاصیت سنجش است.
برای حل این مسئله واکنشهای PCR تو در تو با یک لوله (STNPCR) ایجاد شده است، که در آن هر دو مجموعه آغازگرها به ظرف واکنش اولیه اضافه شده و یک PCR طولانی انجام میشود. آمپلیکونهای این روش از انواع PCR با الکتروفورز کردن مخلوط واکنش در ژل آگارز آغشته به 2 درصد اتیدیوم بروماید همراه با یک نشانگر وزن مولکولی مشاهده میشوند. PCR های تو در تو بعضاً به دلیل عدم تطابق آغازگرها برای جبران PCR ناکارآمد دور اول ضروری هستند، بنابراین اگر بتوانیم از آغازگرهای منطبق برای دور اول استفاده کنیم، در بسیاری از شرایط ممکن است نیازی به Nested PCR نباشد.
مزایای Nested PCR
این حالت از انواع PCR تکثیر غیر اختصاصی توالی هدف را کاهش میدهد و به این دلیل است که پرایمرهای تو در تو در هیچ پرایمر - دایمر یا مصنوعات غیر اختصاصی تولیدشده در PCR اولیه، مکانهای اتصال را پیدا نخواهند کرد. آغازگرهای تو در تو تنها محصول خاصی را که در PCR اولیه تولید میشود را ترمیم کرده، بنابراین اختصاصی بودن PCR را حفظ میکنند.
کاربردهای Nested PCR
از Nested PCR برای بهبود حساسیت سنجش، در بسیاری از انواع PCR استفاده شده است. این به ویژه برای نمونههای اسید نوکلئیک تحت بهینهسازی، مانند نمونههایی که از بافت تعبیه شده در فرمالین و پارافین استخراج میشود، مفید است. در این روش از انواع PCR ثابت شده است که میکروارگانیسمها در مقادیر بسیار کمی وجود دارند. مثلا در تشخیص «ریکِتسیا» (Rickettsia)، «بارتونِلا» (Bartonella) و ارگانیسمهای مشابه در خون (باکتریمی) و بافتها، تشخیص ویروس هرپس و انتروویروس در مایع نخاعی و تشخیص «مایکوباکتریو توبرکلوزیس» (M. tuberculosis) در نمونه خلط سینه مناسب هستند.
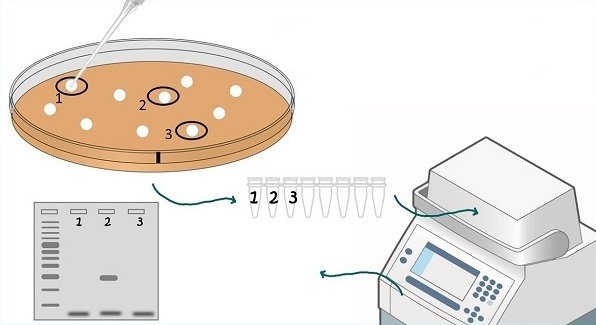
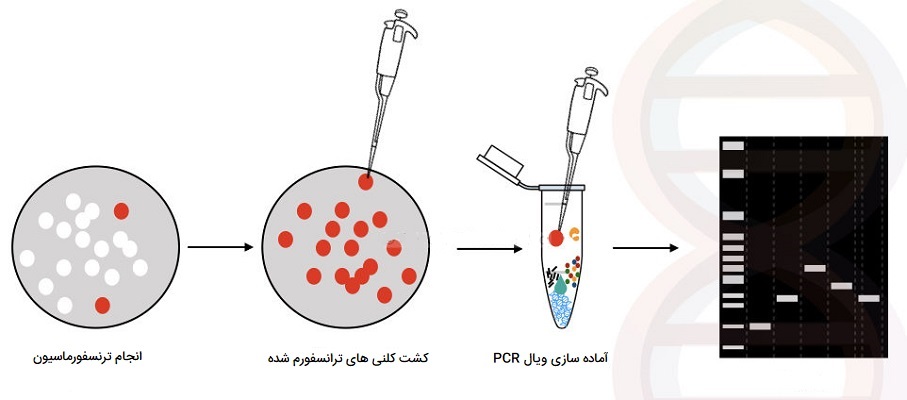
Colony PCR
شبیهسازی مولکولی نیاز به روشی برای غربالگری کلنیها برای اطمینان از ورود ژن مورد نظر دارد. به طور سنتی این کار با هضم توسط آنزیم محدودکننده انجام میشود. PCR میتواند همان کار را در زمان کمتری و با هزینه اندک انجام دهد. مراحل کلیدی کلنی PCR عبارتند از: 1) طراحی آغازگرها برای تشخیص وجود امپلیکون مورد نظر. 2) یک واکنش PCR استاندارد (آغازگرها، dNTP ها، پلیمراز) با استفاده از مواد رویی باکتریهای لیز شده به عنوان الگو تنظیم کنید و 3) برای تجزیه و تحلیل اندازه محصول، محصول PCR خود را روی ژل ران کنید.
طراحی آغازگرهای کلنی PCR
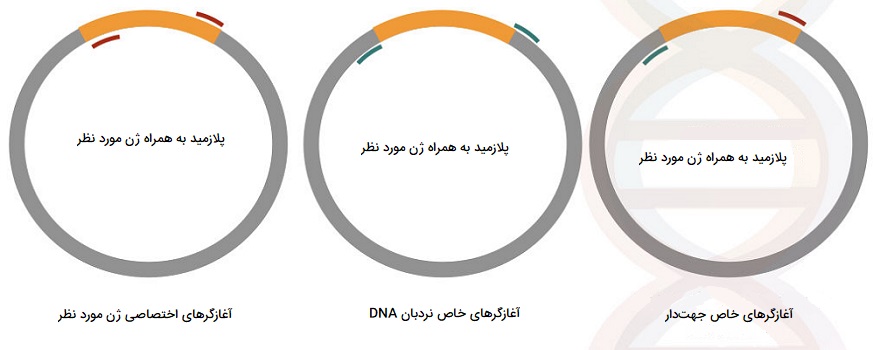
اولین و شاید مهمترین مرحله برای کلنی PCR، طراحی آغازگرها است. سه راهکار برای طراحی آغازگر وجود دارد: 1) آغازگرهای اختصاصی ژن مورد نظر، 2) آغازگرهای خاص نردبان دی ان ای ۳) آغازگرهای خاص جهتدار. آغازگرهای اختصاصی ژن مورد نظر طراحی شدهاند تا به دنباله قطعه ژنی خاص متصل شوند. در این روش یک کلون مثبت، ژن را تکثیر میکند و یک کلون منفی منجر به هیچ محصولی نمیشود. علاوه بر این در این روش فقط حضور ژن قابل تایید است و جهت صحیح آن را نمیتوان ارزیابی کرد.
گزینه دوم طراحی آغازگرهای مخصوص نردبان دی ان ای است. این آغازگرها به منظور اتصال به جایگاههای کناری ژن طراحی شدهاند. یک کلون مثبت محصولی با اندازه بزرگتر تولید کرده و یک کلون منفی بدون قطعه ورودی است. این نوع جفت آغازگر میتوانند به شما نشان دهند که اندازه قطعه ژنی درست است یا نه. این نوع جفت آغازگر همچنین برای غربالگری کلونهای ایجاد شده با همان رشته دی ان ای اما حاوی قطعات ژن ورودی مختلف بسیار مناسب است. هنگامی که پرایمرها را برای اتصال به خارج از جایگاه کلونینگ طراحی میکنید، مهم نیست که توالی قطعه درجشده چیست، زیرا به شما امکان میدهد از همان جفت آغازگر برای نمایش تعداد زیادی قطعه ژنی درجشده استفاده کنید. نکته منفی استفاده از این نوع آغازگرها این است که اطلاعاتی راجع به جهت قطعه وارد شده ارائه نمیدهند.
مورد سوم آغازگرهای مخصوص جهتیابی ژن هستند که اگر به اطلاعاتی در مورد جهت قرار دادن قطعه دی ان ای نیاز دارید، ممکن است طراحی آغازگرهای جهتدار خاص را در نظر بگیرید. کلونینگ انتهای غیرچسبنده دی ان ای نمونهای از مواردی است که ممکن است بخواهید از جهت قطعه وارد شده اطلاع یابید. در این روش یکی از جفت پرایمرهای طراحی شده به ناحیه کناری قطعه دی ان ای مورد نظر متصل شده و پرایمر دیگر به خود قطعه دی ان ای متصل میشود.
نحوه انجام کلنی PCR
تنظیم واکنشهای کلنی PCR تقریباً مشابه تهیه واکنش PCR استاندارد است: الگو، آغازگرها، پلیمراز و dNTP را ترکیب کرده و سپس با یک برنامه استاندارد چرخه دمایی PCR آن را با دستگاه ترموسایکلر انکوبه کنید. یک تفاوت اساسی این است که DNA پلاسمید باید از باکتری آزاد شود تا به عنوان الگوی PCR عمل کند. پرداختن به این و چند نکته دیگر در مورد PCR کلنی در زیر بیان شده است.
- آماده سازی الگو: یک کلنی را با یک لوپ استریل یا نوک پیپت انتخاب کرده و در مقدار کمی آب استریل بچرخانید. در کل 3 تا 10 کلنی را برای آزمایش انتخاب کنید، این بستگی به تعداد کلنیهای روی پلیت دارد. هرچه تعداد بیشتری در زمینه وجود داشته باشد، کلنیهای بیشتری برای غربالگری نیاز دارید.
- ذخیره کلونها برای کشت بعدی: در این مرحله، میخواهید برای استفاده بعدی کلونهای خود را ذخیره کنید. به چند روش میتوانید این کار را انجام دهید. اگر قرار است در همان روز تجزیه و تحلیل PCR کشت کلنیهای خود را انجام دهید، میتوانید باقیمانده سوسپانسیون کلنیها را ذخیره کرده و از آنها برای شروع کشت کلونهای مثبت خود استفاده کنید. اگر میخواهید کلونهای خود را طولانی مدت ذخیره کنید، فقط کلنیها را روی یک پلیت LB به صورت خطی کشت دهید، برای شروع کشتهای مایع میتوانید از همین پلیت استفاده کنید. سرانجام، میتوانید با کلونهایی که انتخاب میکنید، کشتهای مایع یک شبه را شروع کرده و فقط از کلنیهای مثبتی که پیدا کردهاید کشت تهیه کنید. ناگفته نماند که حتما از آنتی بیوتیک مناسب برای انتخاب کلنیها باید استفاده کنید.
- لیزر باکتریها و تنظیم واکنشهای PCR: سوسپانسیون باکتری - آب باقی مانده به عنوان الگویی برای واکنش PCR شما عمل میکند. شما در این مرحله فقط به لیزر باکتریها نیاز دارید تا DNA پلاسمید را با جوشاندن مختصر نمونه قبل از استفاده یا اضافه کردن مستقیم حجم کمی از نمونه به واکنش PCR، آزاد کنید. در مرحله حرارتدهی اولیه ۹۴ درجه واکنش PCR، باکتری لیز میشود و سپس حضور یک آنزیم Taq دی ان ای پلیمراز استاندارد در لوله واکنش کافی است.
- کنترلها: کنترلها می توانند آزمایشی کامل کنند یا آن را به کلی خراب کنند. بهترین کنترلها برای کلنی PCR همان مواردی هستند که برای تأیید اینکه آیا آغازگرهای کلنی PCR کار میکنند، استفاده میشود: دی ان ای کامل وکتور با قطعه مورد نظر و بدون آن. اینها مرجع سریعی هستند که میتوانید هنگام استفاده از محصولات PCR روی ژل برای تعیین اینکه آیا کلنیها قطعه مورد نظر را دارند یا نه، استفاده کنید. آنها همچنین به عنوان کنترلکننده واکنش PCR شما عمل میکنند. ران کردن لوله کنترل بدون الگو برای تشخیص آلودگی DNA نیز روش خوبی است.
تجزیه و تحلیل اندازه محصول PCR روی ژل
اکنون که PCR شما تکمیل شده است، زمان آن رسیده است که محصولات را روی ژل آگارز ران کنید تا اندازه آنها تعیین شود. قبل از ریختن نمونهها داخل چاهکهای ژل، حتماً از استاندارد وزن مولکولی مناسب به عنوان مرجع استفاده کرده و نمونهها را با استفاده از رنگ حاوی گلیسرول، رنگ کرده و آماده ران کنید. هنگام استفاده از آغازگرهای اختصاصی درج (1)، کلونهای مثبت (+) یک باند میدهند، در حالی که یک کلون منفی (-) باندی نمیدهد. آغازگرهای خاص دی ان ای (2) در مقایسه با کلونهای منفی، محصولات با اندازه بزرگتر را برای کلونهای مثبت (+) ارائه میدهند. (3) سرانجام، آغازگرهای مخصوص جهتیابی نتیجه را به عنوان آغازگرهای اختصاصی قطعه مورد نظر به صورت همان باند (+) یا بدون باند (-) ایجاد کرده و همچنین جهت صحیح قرارگیری قطعه مورد نظر را نیز نشان میدهند.
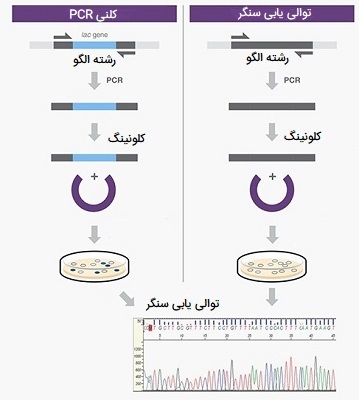
تایید توالی ژن از طریق روش سنگر
پس از شناسایی چند کلون مثبت، آخرین مرحله آمادهسازی این کلونها و ارسال پلاسمیدها برای تعیین توالی Sanger است. تعیین توالی به شما امکان میدهد توالی قطعه مورد نظر، جهت قرار دادن و توالی اتصالات بین پلاسمید و قطعه DNA را تأیید کنید. Colony PCR تعداد کلونهایی را که باید برای تعیین توالی ارسال کنید بسیار کاهش میدهد، اما به شما نمیگوید که آیا محصولات شما جهش دارند یا خیر.
نکات مهم Colony PCR
برای انجام یک کلنی پی سی آر بدون نقص و دقیق لازم است برخی از نکات را حین انجام آزمایش رعایت کنید تا بهترین نتیجه را بدست آورید، این نکات مهم در ادامه مورد بررسی قرار گرفته اند.
- کلنی را خیلی بزرگ انتخاب نکنید. تعداد زیادی باکتری میتواند واکنش PCR شما را مهار کند یا باعث شود محصولات غیر اختصاصی روی ژل شما ظاهر شوند.
- مراقب موارد مثبت کاذب (false positives) باشید. فقط به این دلیل که محصول PCR با اندازه مورد انتظار را دریافت میکنید، به این معنی نیست که جهشی در قطعه دی ان ای مورد نظر شما وجود ندارد. قبل از ادامه آزمایش، حتماً چندین کلونی مثبت برای تعیین توالی برای تأیید ترتیب قرارگیری قطعه ژنی مورد نظر ارسال کنید.
- آمپلیکون کوتاهتر بهتر است. آمپلیکونهای کوتاهتر باعث ایجاد برنامههای PCR کوتاهتر میشوند و احتمالاً در واکنش PCR که دارای بقایای باکتری است کار میکنند.
- از کنترل مثبت استفاده کنید. کنترل مثبت مناسب، باکتریهایی هستند که با همان پلاسمید مورد نظر ایجاد میشوند. اگر این کنترل محصولی را تکثیر نمیکند، پس میدانید که در تنظیم PCR یا طراحی آغازگر مشکلی وجود دارد.
- از سویه کنترل منفی استفاده کنید. سویه کنترل منفی خوب، یک کشت بدون تغییر از همان سویه باکتریهایی است که برای کلونینگ استفاده کردهاید. این نوع کنترل مخصوصاً برای آغازگرهای اختصاصی قطعه مورد نظر بسیار مهم است. اگر کنترل منفی شما محصولی با اندازه مورد انتظار را تکثیر میکند، میدانید که ژنوم باکتریهای شما از قبل دارای توالی هدف هستند.
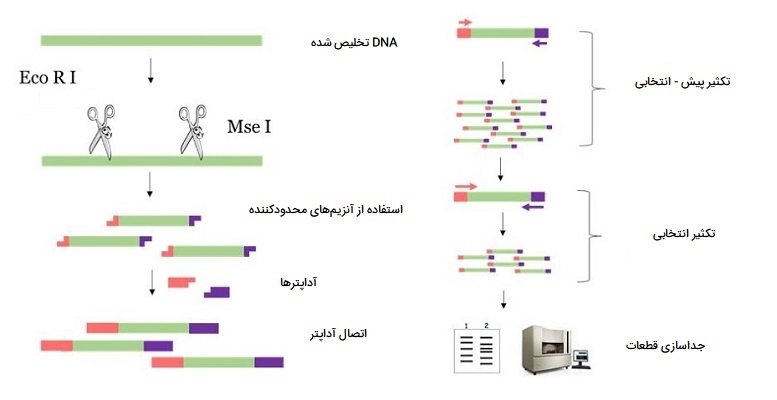
AFLP - PCR
AFLP - PCR یا AFLP ابزاری مبتنی بر PCR است که در تحقیقات ژنتیک، اثر انگشت DNA و در مهندسی ژنتیک استفاده میشود. این روش در اوایل دهه 1990 توسط Keygene توسعه یافت و در ابتدا توسط Vos و Zabeau در سال 1993 توصیف شد. AFLP از آنزیمهای محدودکننده برای هضم DNA ژنومی استفاده میکند و به دنبال آن اتصال آداپتورها به انتهای چسبنده قطعات محدودکننده انجام میشود. زیر مجموعهای از قطعات محدودکننده سپس انتخاب میشود تا تکثیر شود. این انتخاب با استفاده از آغازگرهای مکمل توالی آداپتور ژن، توالی جایگاه اتصال آنزیم محدودکننده و چند نوکلئوتید در داخل قطعات جایگاه اتصال آنزیم محدودکننده حاصل میشود.
قطعات تکثیرشده بر روی ژل آگارز الکتروفورز شده یا از طریق روشهای اتورادیوگرافی و فلورسانس یا ابزارهای توالییابی کوتاه خودکار جدا و نمایان میشوند. این روش میتواند بدون اطلاع قبلی از توالی ژنومی، تعداد زیادی از قطعات مارکر را به سرعت تولید کند. از AFLP PCR برای ارزیابی تنوع ژنتیکی درون گونهها یا برای کاربردهای مختلفی در میان گونههای نزدیک به هم مانند بررسی تکامل نژادی در سطح جمعیت و الگوهای زیست جغرافیایی، تولید نقشههای ژنتیکی و تخمین خویشاوندی بین ارقام گیاهی استفاده شده است.
اگرچه از AFLP نباید به عنوان اختصار استفاده شود، اما معمولاً از آن به عنوان «چند شکلی طول قطعه تکثیر شده» (Amplified fragment length polymorphism) یاد میشود. با این حال، دادههای بدست آمده به عنوان چند شکلیهای طولی نمرهگذاری نمیشوند، بلکه در عوض به عنوان «چندشکلیهای حضور و غیاب» (Presence-absence Polymorphisms) امتیازدهی میشوند. AFLP - PCR یک روش بسیار حساس برای تشخیص چند شکلی در DNA است. به طور جزئی، این روش به سه مرحله تقسیم میشود:
- هضم DNA کامل سلولی با یک یا چند آنزیم محدودکننده و اتصال آداپتورهای اختصاصی نیمه - سایت به تمام قطعات محدودکننده.
- تکثیر انتخابی برخی از این قطعات با دو آغازگر PCR که دارای توالیهای اختصاصی آداپتور و سایت محدودکننده هستند.
- جداسازی الکتروفورتیک آمپلیکونها روی یک ماتریس ژل و به دنبال آن تجسم الگوی باند.
کاربرد AFLP - PCR
فناوری AFLP این قابلیت را دارد که به طور همزمان چند شکلیهای مختلف را در مناطق مختلف ژنومی تشخیص دهد، همچنین بسیار حساس بوده و قابل تکرار است. در نتیجه، AFLP به طور گستردهای برای شناسایی تنوع ژنتیکی در سویهها یا گونههای نزدیک گیاهان، قارچها، حیوانات و باکتریها مورد استفاده قرار گرفته است. از این حالت از انواع PCR در آزمایشات جنایی و تشخیص هویت، همچنین برای تعیین تفاوتهای جزئی در جمعیتها و در مطالعات مرتبط با تولید نقشههای ژنتیکی برای تجزیه و تحلیل مکان کمی صفت (QTL) استفاده شده است.
مزایای بسیاری برای AFLP وجود دارد که در مقایسه با سایر فناوریهای نشانگر از جمله «DNA چند شکلی تکثیر شده تصادفی» (RAPD)، پلی مورفیسم طول قطعه محدود (RFLP) و ریزماهوارهها وجود دارد. این حالت از انواع PCR علاوه بر قابلیت تکثیر، وضوح و حساسیت بالاتر در کل ژنوم در مقایسه با سایر تکنیکها، این قابلیت را نیز دارد که همزمان بین 50 تا 100 قطعه را تکثیر کند. در نتیجه، AFLP در مطالعه گونهها از جمله باکتریها، قارچ ها و گیاهان بسیار مفید واقع شده است، جایی که هنوز چیزهای زیادی در مورد ترکیب ژنومی موجودات مختلف ناشناخته است.
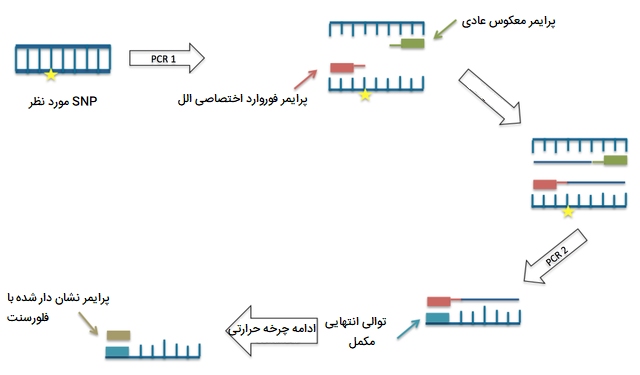
Allele-specific PCR
این حالت از انواع PCR که به PCR اختصاصی الل یا AS-PCR شهرت دارد تکنیکی مبتنی بر آغازگرهای اختصاصی آلل است که میتواند برای تجزیه و تحلیل چند شکلی تک نوکلئوتیدی استفاده شود. PCR مخصوص آللها همچنین ARMS - PCR یا سیستم جهش مقاوم در برابر تکثیر نیز نامیده میشود که مربوط به استفاده از دو آغازگر مختلف برای دو آلل مختلف است. یکی از این مجموعهها، آغازگرهای جهش یافتهای هستند که نسبت به PCR نرمال مقاوم هستند و دیگری مجموعه عادی آغازگرهایی است که در برابر واکنش جهش یافتگی PCR مقاوم هستند.
در این روش از انواع PCR ، آغازگرهای اختصاصی به این ترتیب طراحی شدهاند كه تکثیر توسط DNA پلیمراز را فقط در صورتی میتوانند انجام دهند كه نوكلئوتید در انتهای ’3 آغازگر، مکمل بازهای تشکیل دهنده DNA در توالیهای واریانت یا نوع جهش نیافته (wild-type) باشد. به این معنی که كه یك مجموعه از آغازگرها میتوانند آلل طبیعی را تقویت كنند در حالی كه سایر آغازگرها آلل جهش یافته را تقویت میكنند. این عدم تطابق به آغازگر اجازه میدهد تا یک آلل منفرد را تکثیر کند. پس از PCR و الکتروفورز، الگوهای محصولات PCR خاص باعث تمایز SNP ها میشوند. چندین روش ابتکاری برای تشخیص وجود محصول PCR خاص استفاده شده است. برخی از آنها بر اساس هیبریداسیون پروب هستند که به پروبهای مشخص شده با برچسب و تجزیه و تحلیل منحنی ذوب نیازمند لکههای اسید نوکلئیک وابسته است.
کاربرد PCR مخصوص الل
از این روش از انواع PCR به طور گستردهای در تشخیص جهش در یک ژن واحد مانند کم خونی سلول داسی شکل و تالاسمی استفاده میشود. همچنین برای تعیین مستقیم ژنوتیپهای گروه خونی ABO استفاده میشود. از AS - PCR همچنین در بسیاری از شاخههای مورد مطالعه مانند فارماكوژنتیك، اختلالات ژنتیكی، میكروبیولوژی و سایر موارد استفاده شده است. این مفهوم در تعیین SNP نسبت به سایر روشهای موجود نسبتاً ارزانتر است. طراحی آغازگر و روش بهینهسازی شده PCR در این روش از جنبههای اساسی در ایجاد یک سیستم ژنوتیپ مبتنی بر AS - PCR است.
Alu PCR
این روش از انواع PCR تکنیکی سریع و آسان برای انجام «اثر انگشت دی ان ای» (DNA fingerprinting) است که بر اساس تجزیه و تحلیل همزمان بسیاری از مکانهای ژنومی با عناصر تکرار شونده Alu که اجازه میدهد چندشکلی ژنتیکی و جهش در ژنوم انسان و پستانداران شناسایی شود، ساخته شده است. عناصر Alu کششهای کوتاهی از DNA هستند که در ابتدا با عملکرد اندونوکلئاز محدود کننده باکتری «آرتروباکتر لوتئوس» (Arthrobacter luteus) مشخص شدند، طول این عناصر کوتاه پراکنده (SINE) حدود 300 نوکلئوتید است. عناصر آلو یکی از فراوانترین عناصر قابل انتقال هستند که در کل ژنوم انسان یافت میشود و در تکامل نقش دارند و به عنوان نشانگرهای ژنتیکی مورد استفاده قرار گرفتهاند.
عناصر آلو از ژن RNA 7SL مشتق شدهاند و یک ساختار خاص متشکل از دو مونومر مشتق شده از RNA 7SL که توسط یک منطقه غنی از باز آدنین (A) که پس از واگرایی تکاملی جوندگان و انسان از هم جدا شدهاند، تشکیل شدهاند. عناصر Alu به سه زیر خانواده اصلی طبقهبندی میشوند: Alu J (قدیمیترین)، Alu S (متوسط) و Alu Y (جوانترین). این زیر خانوادههای بزرگ بیشتر بر اساس شباهت توالی به دهها زیرخانواده شاخهای طبقه بندی شدهاند. بیش از 1 میلیون نسخه از Alu در ژنوم انسان وجود دارد که بیش از 10 درصد از کل ژنوم را تشکیل میدهند.
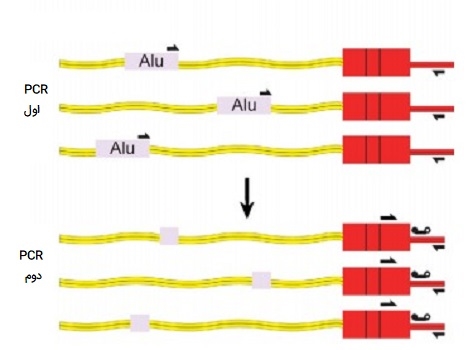
کاربرد Alu PCR
عناصر Alu به دلیل اختصاصیت گونهای، اندازه کوچک و تعداد کپی فوق العاده زیاد، اهداف مناسبی برای qPCR با هدف شناسایی سلولهای انسانی در میان سلولهای مشتق شده از سایر گونههای حیوانی هستند. در Alu PCR، از دو پرایمر دارای برچسب فلوروکروم مکمل آن توالیها برای انجام این حالت از انواع PCR استفاده میشود و محصولات PCR سپس توسط درج آلو در چندین بیماری وراثتی انسان و اشکال مختلف سرطان استفاده شده است. بنابراین، این روش از انواع PCR نقش اساسی در تشخیص بیماریهای ارثی و جهشها دارد.
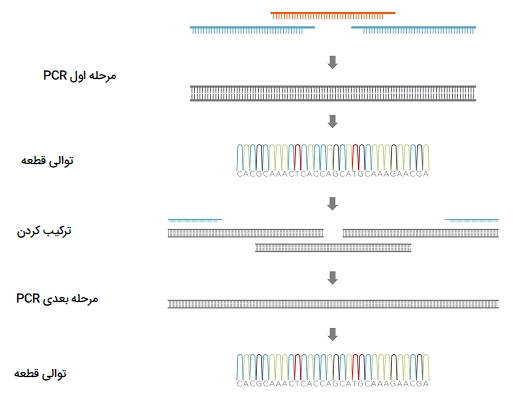
Assembly PCR
برای سرهم کردن و جوش دادن دو قطعه DNA هم اندازه ژن به صورت یک قطعه واحد برای انجام کلونینگ راحتٰتر از این حالت از انواع PCR استفاده شده و از آن به نام پی سی آر مونتاژ یا Assembly PCR نام برده میشود. به طور خلاصه، در اصل شامل PCR دو قطعه به طور جداگانه با آغازگرهایی که 20bp و سپس انجام یک مرحله PCR اضافی با استفاده از دو محصول به عنوان الگو همپوشانی دارند. این روش از انواع PCR اساساً فقط برای سهولت انجام کلونینگ است.
به جای تلاش برای PCR یا برش وکتور به دو قطعه جداگانه و سپس هضم و اتصل آنها با اندونوکلئاز، در Assembly PCR میتوان به سادگی از PCR اولین قطعه پرایمر «معکوس» (Reverse) که با قطعه دوم پرایمر «رو به جلو» (Forward) همپوشانی دارد استفاده کرد و سپس از محصول اولین واکنشهای PCR به عنوان الگویی برای واکنش مونتاژ استفاده شود. اگر قطعه ’5 پرایمر ریوِرس و قطعه ’3 پرایمر فوروارد در 20 جفت باز همپوشانی داشته باشند، محصول اولین واکنشهای PCR باید در منطقه همپوشانی ایجاد شود و محصول کامل (فیوژن ژن) را ایجاد کند.
با استفاده از آغازگر فوروارد برای قطعه اول و آغازگر ریوِرس برای قطعه دوم در واکنش مونتاژ، محصول کامل مورد نظر را تکثیر میکند. از محاسن این تکنیک این است که سریعتر از روش مونتاژ استاندارد 3 - طرفه است (زیرا برای حالت استاندارد کلونینگ، به DNA با کیفیت خوب نیاز دارید تا بتواند به خوبی کار کند که معمولاً به معنی زیر کلونسازی هر قطعه است) و به علاوه قابل اطمینانتر است (کیفیت محصول بسیار خوب است بنابراین میتوانید آن را مستقیماً در وکتور مورد نظر کلون کنید). Assembly PCR برای بهبود عملکرد پروتئین مورد نظر استفاده میشود و همچنین میتواند برای تولید مقادیر زیادی RNA برای مطالعات ساختاری یا بیوشیمیایی مورد استفاده قرار گیرد.
High Fidelity PCR
صحت انجام کار یک آنزیم پلیمراز به توانایی آن برای قرار دادن پایه درست در طی انواع PCR اشاره دارد. برعکس، اشتباه در الحاق نوکلئوتیدها به عنوان میزان خطای پلیمراز شناخته میشود. High Fidelity PCR، از یک DNA پلیمراز با میزان خطای کم استفاده میکند و منجر به درجه بالایی از دقت در تکثیر DNA مورد نظر میشود. در صورت اتصال نادرست در جایگاه فعال آنزیم پلیمراز، روند ادغام به دلیل ساختار فضایی مجموعه جایگاه فعال کند میشود. تکثیر با صحت بالا برای آزمایشاتی که نتیجه آنها به توالی درست DNA نیاز دارد مانند کلونینگ، تجزیه و تحلیل SNP، برنامههای کاربردی NGS ضروری است.
Hot start PCR
این روش از انواع PCR نوعی اصلاح شده از واکنش زنجیرهای پلیمراز معمولی است که به دلیل تکثیر غیر اختصاصی DNA در دمای اتاق (یا سردتر)، حضور محصولات نامطلوب و پرایمر - دایمر را کاهش میدهد. از آنجا که نتایج PCR بسیار مهم است، برای دستیابی به بازده بالاتر، تغییرات و اصلاحات زیادی در این روش ایجاد شده است که Hot start PCR یکی از آنها است. Hot start PCR از نظر استفاده از DNA پلیمراز برای سنتز DNA از یک الگوی تکرشته، از همان اصول PCR معمولی پیروی میکند.
با این حال، از روشهای اضافی گرمایش و جداسازی، مانند غیرفعال کردن یا مهار اتصال Taq پلیمراز و افزودن دیرهنگام Taq پلیمراز، برای افزایش عملکرد محصول و همچنین ارائه اختصاصیت و حساسیت بالاتر استفاده میشود. برخی از راههای تکمیل مخلوط Hot start PCR شامل تغییراتی در دمای پایین، استفاده از تری فسفاتهای دئوکسی ریبونوکلئوتید (dNTP) اصلاح شده و افزودن فیزیکی یکی از معرفهای اساسی پس از دناتوراسیون است که فعالیت DNA پلیمراز را مسدود میکند.
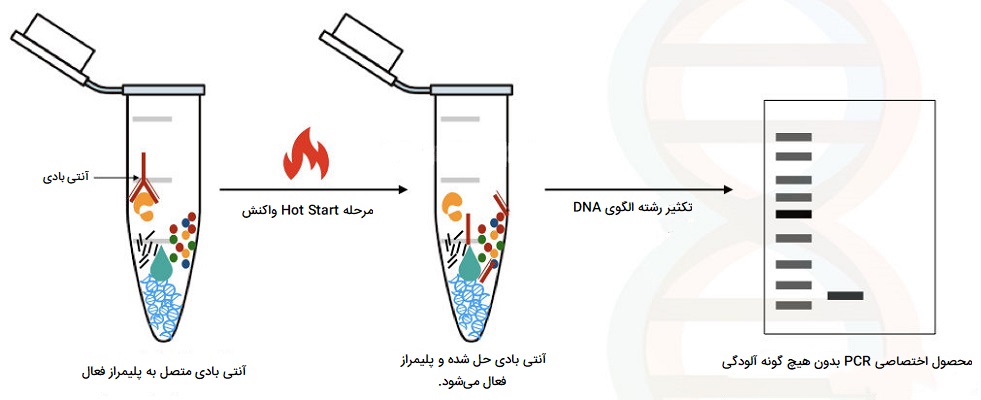
کاربرد Hot start PCR
نتایج این روش از انواع PCR از نظر پزشکی و صنعتی کاربردهای زیادی دارد. به عنوان مثال، برنامههای PCR از جمله پزشکی قانونی، آزمایشات توارث، دفاع بیولوژیکی، کلونینگ، تشخیص جهش، آزمایش ژنتیک و تعیین توالی DNA. از طریق این راه حلهای اضافی، Hot start PCR مقدار تکثیر غیر اختصاصی را که به طور طبیعی در دماهای پایینتر رخ میدهد و همچنان برای PCR معمولی مشکل است، کم میکند. این تغییرات به طور کلی کار میکنند تا اطمینان حاصل شود که آنزیمهای خاص موجود در محلول تا رسیدن به دمای مطلوب اتصال غیرفعال خواهند ماند یا مهار میشوند. مهار تشکیل محصولات غیر اختصاصی PCR، به ویژه در چرخههای اولیه، منجر به افزایش قابل توجهی در حساسیت تشخیصی توسط PCR میشود. این در کاربردهای تشخیصی PCR یا RT- PCR از اهمیت بالایی برخوردار است.
Hot start PCR از آن جهت سودمند است که به دست زدن کمتری نیاز دارد و خطر آلودگی را کاهش میدهد. Hot start PCR میتواند از نظر شیمیایی اصلاح شده یا بر اساس آنتیبادی باشد که مزایای مختلفی را برای این روش فراهم میکند. Hot start PCR از نظر شیمیایی اصلاح شده را میتوان در دمای اتاق انجام داد و با جلوگیری از اتصال آغازگرها به یکدیگر قبل از شروع فرآیند PCR و همچنین محدود کردن آغازگرهای غیر اختصاصی، تشکیل دایمرهای آغازگر را به میزان قابل توجهی کاهش میدهد. در Hot start PCR مبتنی بر آنتی بادی، آنزیم پلیمراز پس از مرحله اولیه دناتوراسیون در طی سیکل گرمایی فعال میشود، بنابراین زمان مورد نیاز انجام واکنش را کاهش میدهد.
Touchdown PCR
در این روش از انواع PCR که به TD-PCR نیز شناخته میشود روشی است که در آن دمای اولیه اتصال بالاتر از Tm بهینه پرایمرها است و به تدریج طی سیکلهای بعدی کاهش مییابد تا زمانی که بهترین دمای Tm یا دمای اتصال برسد. کاهش تدریجی دما تا دمای اتصال مجاز در طول سیکلهای PCR تکثیر قطعه ژنی مورد نظر را بهینه میکند. دمای مطلوب اتصال پرایمرها به قطعه ژنی بسیار مهم و مورد نیاز در انواع PCR است. این به طور معمول بر اساس دمای ذوب (Tm) پرایمر - الگو تعیین میشود.
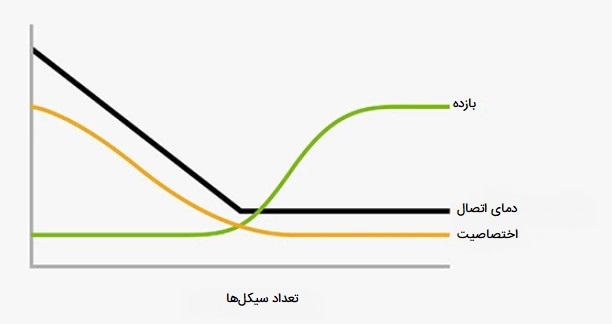
اما، Tm پرایمر به طور متفاوتی تحت تأثیر هر کدام از اجزای بافر، حتی غلظت آغازگر و الگو قرار میگیرد بنابراین مقدار Tm محاسبه شده پرایمر فقط یک تقریب است. بنابراین، یافتن دمای مناسب اتصال برای ترکیب پرایمر با رشته الگو معمولاً دشوار است. دمای پایینتر از نقطه اتصال میتواند منجر به تشکیل پرایمر - دایمر و محصولات غیر اختصاصی شود در حالی که دمای بسیار بالا به دلیل عملکرد ضعیف پرایمر، بازده تکثیر DNA را کاهش میدهد. در این روش از انواع PCR با استفاده از دمای محاسبه شده بالاتر از Tm در چرخههای اولیه، TD - PCR فقط تجمع قطعات ژنی را که بیشترین میزان مکمل بودن را با پرایمر دارند، ترجیح میدهد. هرگونه تفاوت در TM بین اتصال صحیح و نادرست، یک مزیت تصاعدی دو برابری در هر سیکل PCR ایجاد میکند.
کاربرد Touchdown PCR
TD - PCR در پروتکلهای استاندارد انواع PCR ، از جمله PCR وابسته به ترانس کریپتاز معکوس، و همچنین در تولید کتابخانههای cDNA و غربالگری چند شکلی تکنوکلئوتیدی، کاربرد گستردهای یافته است. TD-PCR مخصوصاً برای رشتههای DNA الگویی که که تکثیر آنها دشوار است مفید واقع شده اما همچنین میتوانند به طور استاندارد برای افزایش اختصاصیت و شکلگیری محصول استفاده شوند. این روش بسته به طول رشته الگو بین 90 تا 120 دقیقه طول میکشد.
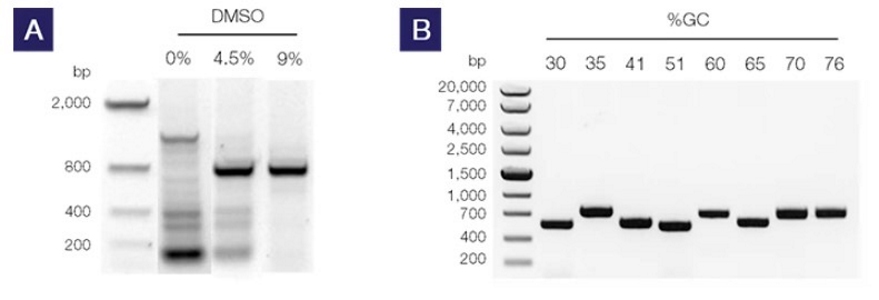
GC-Rich PCR
الگوهای DNA با محتوای GC بالا (بالای ۶۵ درصد)، به دلیل تمایل این الگوها به جمع شدن به ساختارهای ثانویه پیچیده، میتوانند بر کارایی انواع PCR تأثیر بگذارند. این به دلیل افزایش پیوند هیدروژنی بین بازهای گوانین و سیتوزین است که میتواند باعث مقاومت DNA در برابر ذوب شود. آنزیم Taq DNA پلیمراز میتواند در این ساختارهای ثانویه متوقف شود و ممکن است مانع اتصال پرایمر شده و در نتیجه تکثیر ناقص یا غیر اختصاصی ایجاد شود. در این روش از انواع PCR ، تغییر در طراحی آغازگرها و استفاده از ترکیبی از دو حالت از انواع PCR به نامهای hot start و touchdown PCR گاهی میتواند باعث بهبود کارایی تکثیر شود.
در بیشتر مواقع، یک رویه چند منظوره مانند استفاده از تقویت کننده در واکنش تکثیر DNA، تنظیم پروتکل سیکل گرمایی و در صورت لزوم طراحی مجموعههای جدید پرایمرها مورد نیاز است. در این پروتکل از مخلوطی از چهار ماده افزودنی - بتائین، دیتیوتریتول (DTT)، دی متیل سولفوکسید (DMSO) و آلبومین سرم گاو (BSA) - برای استفاده با Taq DNA پلیمراز استفاده میشود.
Long-range PCR
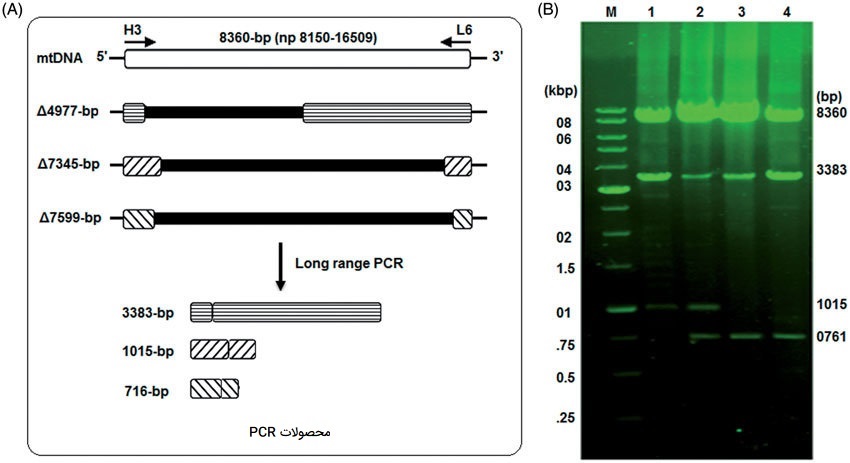
این روش از انواع PCR به تکثیر اهداف DNA با طول بیش از 5۰۰۰ نوکلئوتید اشاره دارد که به طور معمول نمیتوان با استفاده از روشهای معمول PCR آنها را تکثیر کرد. به طور سنتی، Long-range PCR با استفاده از مخلوطی از Taq DNA پلیمراز (برای طویل شدن سریع) همراه با مقدار کمی آنزیم پلیمراز تصحیح کننده (برای دقت بیشتر) انجام شده است. آنزیم تصحیحکننده، عدم تطابق DNA موجود در انتهای ’3 این رشته در حال تکثیر را ترمیم میکند، به Taq پلیمراز اجازه میدهد تا DNA را بسیار بیشتر از حالت عادی طویل کند و منجر به افزایش طول DNA میشود. Long-range PCR همچنین میتواند با استفاده از پلیمرازهای با قابلیت اطمینان بالای اصلاح شده برای اتصال DNA های طویل، باعث تکثیر دقیق و کامل قطعات طولانی حاصله شود. چه برای کلونینگ، نقشهبرداری از ژنوم یا تعیین توالی، سیستمهای انواع PCR دارای طیف وسیعی از راه حلها هستند که امکان تقویت قطعات طولانی را با سرعت و صحت بالا فراهم میکند.
کاربرد Long-range PCR
نحوه انجام واکنش، بافر واکنش PCR و بهینه شدن Taq DNA پلیمراز سه عامل اصلی برای دستیابی به موفقیت در Long-range PCR هستند. اندازه قطعه نیز به اندازه محتوای قطعه DNA مهم است، برای تشخیص ناهنجاریها در برخی بیماریها به عنوان مثال، سندرم X شکننده اندازه قطعه DNA مهم است. سندرم ایکس شکننده با گسترش غیر طبیعی منطقه غنی از GC معروف به سه قلو CGG موجود در کروموزوم X اتفاق میافتد. این منطقه بیش از حد طولانی است اما اگر آن منطقه را تکثیر کنیم و آن را با یک منطقه معمولی مقایسه کنیم، میتوانیم نتایج را تفسیر کنیم.
در این روش بر اساس اندازه هر قطعه نرمال، آللهای ناقل و بیماری را میتوان تشخیص داد. علاوه بر این، روش Long-range PCR در موارد دیگری مانند ژنوتایپینگ، انگشت نگاری DNA توالییابی DNA قطعات طولانی مطالعات تعداد کپی جهشها کاربرد دارد. در این روش از انواع PCR اختصاصیت واکنش با استفاده از صحت بالای آنزیم Taq پلیمراز افزایش مییابد و تکثیر قطعات DNA طولانیتر و همچنین مناطق غنی از GC را تسهیل میکند.
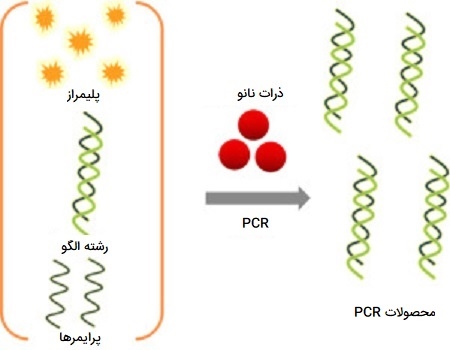
Nano - PCR
این روش از انواع PCR که به PCR به کمک ذرات نانو یا Nanoparticle-Assisted PCR نیز معروف است، شامل مواد مولکولی کوچکی است که از خصوصیات فیزیکی خاصی تشکیل شده و واکنش را تکثیر میکنند. چالشهای کار با انواع PCR معمولی فراوان است ازجمله در دسترس بودن محدود DNA در نمونه، محتوای بالای GC رشته الگو، کارایی کم و اختصاصیت پایین در تکثیر. علاوه بر این، تکثیر برخی از قطعات DNA به دلیل ساختار ثانویه و نیاز به دمای ذوب بالا بسیار دشوار است. استفاده از مواد در اندازه نانومتر (نانومواد) راه حلی ممکن برای این مشکلات ارائه داده است زیرا این مواد در مقایسه با مواد ماکروسکوپی دارای ویژگیهای فیزیکی - شیمیایی استثنایی هستند.
یکی از نظریههای مربوط به نانوذرات طلا بیان میکند که این ذرات مقداری از پلیمراز را جذب میکنند و مقدار پلیمراز باقیمانده در سیستم را مدیریت میکنند، که ممکن است در افزایش اختصاصیت واکنش لازم باشد. نظریه دیگری توضیح میدهد که آنها جفتهای پرایمر را جذب میکنند و دمای ذوب را در تشکیل دوبلکس بین آغازگرهای کاملاً جفت شده و جفت نشده کاهش میدهند که منجر به افزایش اختصاصیت و حساسیت واکنش میشود.
کاربرد Nano - PCR
در میان نانومواد متنوعی که امروزه وجود دارند، مواد مبتنی بر سیلیکون، مواد بر پایه کربن، ذرات کوانتومی نیمه رسانا (QD) و برخی فلزات به عنوان تقویت کنندههای PCR شناخته شدهاند. از این رو، PCR جدید برای استفاده از خصوصیات منحصر به فرد نانومواد طراحی شده است و به عنوان PCR با کمک نانومواد یا nanoPCR شناخته میشود. نتایج بسیاری از مطالعات نشان داده است که ترکیبی از این نانومواد و مولکولهای زیستی میتواند روند همانند سازی DNA مانند چیزی که در موجودات زنده وجود دارد با موفقیت تقلید کند. PCR به کمک نانوذرات دارای مزایای حساسیت بالا، اختصاصیت بالا و حساسیت انتخابی بالا بوده و به طور گستردهای در شناسایی ویروس و تعیین توالی ژن مورد استفاده قرار گرفته است.
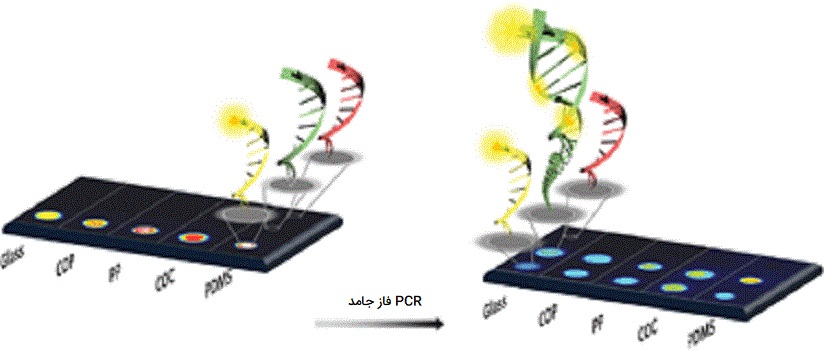
PCR فاز جامد
PCR فاز جامد یا SP-PCR یکی از انواع PCR و تکنیک منحصربه فردی است که اجازه میدهد اسیدهای نوکلئیک هدف را بر روی یک تکیهگاه جامد در جایی که یک یا هر دو پرایمر در سطح بیحرکت هستند، تقویت کند. جداسازی فضایی آغازگرها به طور قابل توجهی فعل و انفعالات آغازگر نامطلوب را به حداقل میرساند، در نتیجه از تشکیل پرایمر - دایمر جلوگیری میکند و اجازه میدهد تا «تکثیر چندگانه» (Multiplexing Amplification) بالاتر انجام شود. ایده اصلی این روش جدید اتصال انتهای ’5 پرایمرها به یک سطح است به جای اینکه اجازه دهد آغازگرها به صورت آزاد در یک محلول پراکنده و پخش شوند.
انتشار آزادانه DNA هدف، میتواند روی سطح جامد انجام شده و سپس توسط پلیمراز تکثیر صورت گیرد. کپیهای تکثیر شده به سطح متصل میشوند، در حالی که مولکول اولیه DNA پس از مرحله اتصال پرایمرها به محلول برمیگردد. انتهای آزاد مولکول کپی شده DNA با پرایمر (متصل به سطح) ترکیب شده سپس با توالی مولکول DNA مکمل شده و روند تکثیر میتواند شروع شود.
کاربرد PCR فاز جامد
این روش از انواع PCR نوع جدیدی از تکثیر DNA است که اخیراً توسط دو گروه مختلف معرفی شده است: ادسی و همکاران. بینگ و همکاران. ایده اصلی این روش جدید اتصال پرایمرها (از طریق انتهای ’5 آنها) به یک سطح جامد است (سیلیکا، بیدهای پلی استایرن و ...). با استفاده از مخلوط شیمیایی (حاوی نوکلئوتیدها و پلیمراز) و چرخههای دمایی مشابه چرخه استفاده شده در واکنش زنجیرهای پلیمراز (PCR)، میتوان با استفاده از این آغازگرها الگو DNA را تقویت کرد. واکنش زنجیرهای پلیمراز فاز جامد ابزاری است که به طور فزایندهای مورد استفاده قرار میگیرد و برای تولید DNA بیحرکت برای انواع برنامهها، از جمله توالییابی DNA با توان بالا و تجزیه و تحلیل SNP مورد استفاده قرار میگیرد.
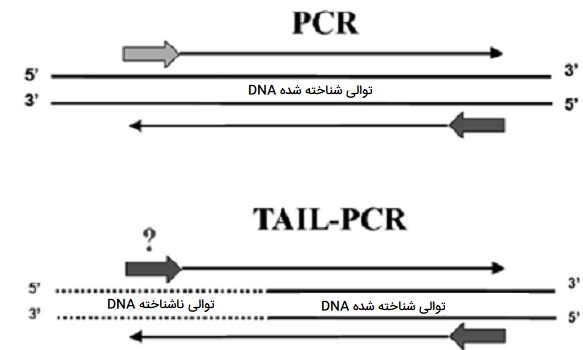
TAIL-PCR
«PCR تقارن غیر متقارن حرارتی» (Thermal Asymmetric Interlaced PCR) یا TAIL - PCR برای توالییابی و تجزیه و تحلیل قطعات DNA ناشناخته که در مجاورت توالیهای شناخته شده هستند استفاده میشود. این روش برای یافتن توالیهای تنظیمی یک ژن و شناسایی مکانهای درج در نواحی بزرگ برچسبگذاری ژنوم بسیار مناسب است. این روش از انواع PCR توسط لیو و ویتیر در سال 1995 توسعه داده شد و در آن مجموعهای از آغازگرهای «توالی تو در تو» (nested sequence-specific) را همراه با یک آغازگر «دژنره اختیاری» (Arbitrary Degenerate) یا AD کوتاهتر استفاده کردند. در این روش بازده تکثیر محصولات اختصاصی و غیر اختصاصی را از نظر حرارتی میتوان کنترل کرد. از مزایای این روش میتوان به موارد زیر اشاره کرد:
- سادگی. در این روش از انواع PCR نه دستکاریهای ویژه DNA قبل از PCR (استفاده از آنزیمهای محدودکننده و اتصال آن ها) و نه غربالگری پرزحمت پس از آن (هیبریدسازی ساترن، برچسب زدن و توسعه پرایمر، برش ژل و غیره) وجود ندارد. تجزیه و تحلیل ژل آگارز ساده میتواند اختصاصیت محصول را تأیید کند. نیاز به مقدار DNA الگو در حد نانوگرم بوده و با خلوص اندک DNA هم جواب لازم را خواهید گرفت.
- اختصاصیت بالا. در این روش نسبت محصولات غیر اختصاصی تکثیر شده بسیار کم است.
- بازدهی بالا. در ۶۰ تا ۸۰ درصد واکنشها، محصولات اختصاصی با پرایمرهای AD تولید میشوند.
- سریع بودن. چندین واکنش TAIL-PCR پشت سر هم در یک روز میتواند انجام گیرد.
- ریسک کمتر در ایجاد ساختارهای کایمریک. در این روش از انواع PCR مرحله لایگیشن (اتصال دو رشته DNA) وجود ندارد.
- توالییابی مستقیم. محصولات با اختصاصیت بالا در این روش میتوانند به طور مستقیم به واکنش توالییابی اضافه شوند.
- حساسیت بالا. در این روش از انواع PCR توالیهایی که حتی یک کپی از آنها داخل ژنوم وجود دارد نیز قابل تکثیر هستند.
کاربرد TAIL-PCR
این روش از انواع PCR دارای کارایی بالایی برای تکثیر بخشهای انتهایی درج شده از کلونهای «کروموزوم مصنوعی باکتریایی» (BAC) و «کروموزوم مصنوعی مخمر» (YAC) و کلونهای P1 (دروزوفیلا ملانوگاستر) کاربرد دارد و محصولات تکثیر شده در این روش به عنوان کاوشگرهایی برای غربالگری کتابخانه و به عنوان الگوهایی برای توالییابی مستقیم بسیار خاص و مناسب هستند و همچنین انتهای درج شده در این روش میتوانند برای نقشهبرداری کروموزوم مورد استفاده قرار گیرند. با توجه به اختصاصیت بالای این روش از انواع PCR میتوان از محصولات خالصسازی نشده آن نیز در توالییابی استفاده کرد. به علاوه از طریق TAIL - PCR میتوان توالیهای تک نسخه را از ژنوم بسیار پیچیده بازیابی کرد. جداسازی توالیهای پروموتر و تکثیرکننده یک گام اساسی در مطالعات تنظیم بیان ژن است که در این روش میتواند به سرعت انجام گیرد.
در روشهای معمول نواحی کناری ژنها که حاوی عناصر تنظیمی هستند، به طور متعارف با غربالگری کتابخانههای ژنومی با استفاده از cDNA به عنوان کاوشگر جدا میشوند که روش بسیار وقتگیری است. بر خلاف «PCR معکوس» (Inverse PCR) و «PCR با واسطه بستن» (ligation-mediated PCR)، TAIL-PCR یک روش ساده و کارآمد برای بررسیهای ژنومیک است که به مراحل استفاده از آنزیمهای محدودکننده یا لایگیشن نیازی ندارد.
SSP-PCR
«PCR آغازگر اختصاصی» (Single Specific Primer PCR) یک فناوری مبتنی بر PCR است که امکان تکثیر ژنهایی را فراهم میکند که فقط بخش جزئی از اطلاعات توالی آنها در دسترس است. این روش از انواع PCR اجازه میدهد تا بررسی ژنوم یک جهته از مناطق شناخته شده به مناطق ناشناخته کروموزوم صورت گیرد.
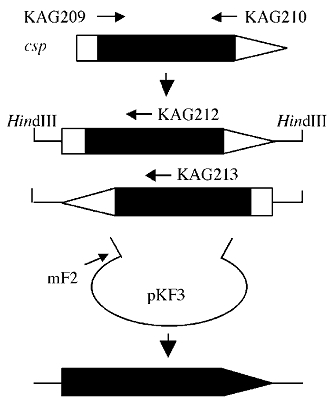
تصویر بالا، تصویر شماتیک یک پرایمر اختصاصی PCR برای کلون سازی ژن csp نشان داده شده است. قطعه جزئی 1 کیلوباز ژن csp از DNA موجود C. sordellii با آغازگرهای KAG209 و KAG210 PCR، تکثیر شد. با استفاده از کتابخانه HindIII DNA C. sordellii به عنوان رشته الگو و با mF2 واقع در pKF3 و با KAG212 یا KAG213 واقع در قطعه شناخته شده 1 کیلوباز PCR انجام شد. توالیهای نوکلئوتیدی بالادست، شناخته شده 1 کیلوباز و قطعات DNA پایین دست، یک قطعه قابل خوانش از Csp را نشان میدهند. خط پیکان دار ضخیم ژن csp را به تصویر میکشد. نواحی پر و باز نشان دهنده مناطق تعیین شده از توالی نوکلئوتید (شناخته شده) و ناشناخته هستند.
OE-PCR
«واکنش زنجیرهای پلیمراز طویل سازی همپوشان» (The overlap extension polymerase chain reaction) یکی از انواع PCR است. همچنین به آن Splicing by overlap extension / Splicing by overhang extension) SOE-PCR) نیز گفته میشود. از این روش از انواع PCR برای قرار دادن جهشهای خاص در نقاط خاص در یک توالی، یا اتصال قطعات کوچکتر DNA به یک پلی نوکلئوتید بزرگتر استفاده میشود. این روش مانند اکثر واکنشهای PCR، از دو آغازگر برای هر انتها در هر دنباله استفاده میکند. برای اتصال دو مولکول DNA، از آغازگرهای ویژه در انتهایی که قرار است به هم متصل شوند استفاده میشود. برای هر مولکول DNA، آغازگر در انتهای اتصال باید به گونهای ساخته شود که دارای یک برآمدگی ’5 برای انتهای مولکول دیگر باشد.
پس از اتصال در هنگام تکثیر، DNA توسط یک توالی جدید که مکمل مولکولی است که قرار است به آن متصل شود، گسترش مییابد. هنگامی که هر دو مولکول DNA به چنین روشی گسترش یافت، آنها مخلوط شده و یک PCR فقط با آغازگرهای انتهای دور انجام میشود. توالیهای مکمل همپوشان معرفی شده، به عنوان پرایمر عملمیکنند و دو توالی جوش میخورند. این روش در عدم نیاز به مکانهای محدود کننده نسبت به سایر تکنیکهای اتصال ژنی یک مزیت دارد. برای بدست آوردن بازده بالاتر، از برخی از آغازگرها مانند PCR نامتقارن بیش از حد استفاده میشود.
Asymmetric PCR
در یک PCR نامتقارن، واکنش ترجیحاً یک رشته DNA را در یک الگو DNA دو رشته تکثیر میکند. بنابراین مفید است که فقط به تکثیر یکی از دو رشته مکمل مانند توالییابی و هیبریداسیون پروب نیاز باشد. کل فرآیند PCR مشابه انواع PCR معمولی است، با این تفاوت که مقدار پرایمر برای رشته هدف قرار گرفته بسیار بیشتر از رشته غیر هدف است. همانطور که PCR نامتقارن به سمت جلو میرود، پرایمر محدودکننده با غلظت کم از نظر کمی در DNA دو رشتهای تازه سنتز شده گنجانیده شده است. در نتیجه، سنتز خطی DNA هدف تک رشتهای از پرایمر اضافیِ پس از تخلیه پرایمر محدودکننده تشکیل میشود.
کاربرد Asymmetric PCR
از PCR نامتقارن زیاد استفاده نمیشود زیرا بازده واکنش پایینی دارد و بهینه سازی نسبتهای پرایمر مناسب، مقدار ماده اولیه و تعداد چرخههای تکثیر سخت است. محدود کردن غلظت یک پرایمر، دمای ذوب آن را به کمتر از دمای اتصال واکنش کاهش میدهد. اخیراً این فرآیند تغییر یافته است و به عنوان Linear-After-The-Exponential-PCR (LATE-PCR) شناخته میشود که در آن پرایمر با غلظت پایین، دمای ذوب بالاتری نسبت به پرایمر با غلظت بالاتر دارد تا کارایی واکنش حفظ شود.
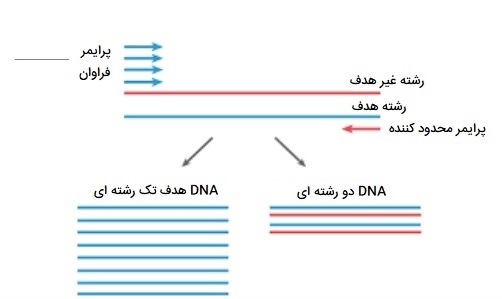
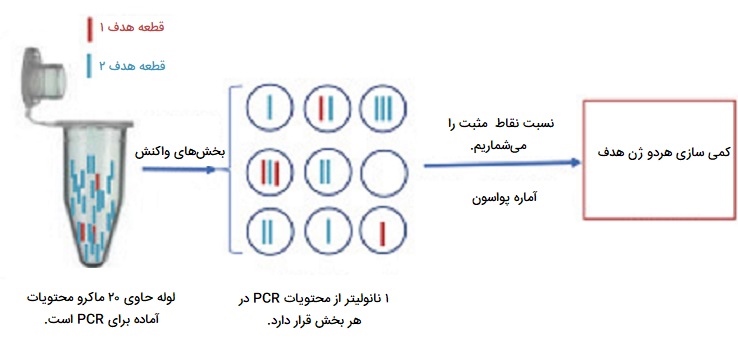
Digital PCR
PCR دیجیتال یک روش جدید برای کمی سازی مطلق اسید نوکلئیک است. در PCR دیجیتال، نمونهای از DNA یا cDNA به تعداد زیادی از پارتیشنها در چاهکها جدا شده و واکنشهای PCR در هر پارتیشن به صورت جداگانه انجام میشوند. بعضی از چاهکها حاوی مولکول هدف (مثبت) هستند و بنابراین واکنشهای مثبت PCR دارند در حالی که بعضی دیگر (منفی) ندارند و دارای واکنشهای منفی PCR هستند. PCR میتواند یک الگوی DNA را یک برابر یا میلیون برابر کند. سپس آمپلیکونها با کاوشگرهای فلورسنت هیبرید میشوند. اگر هیچ مولکول هدفمندی در آن چاهک وجود نداشته باشد، هیچ سیگنالی جمع نمیشود. در پایان، از نسبت سیگنالهای مثبت و منفی برای بررسی تعداد مطلق مولکولهای هدف در نمونه استفاده میشود.
کاربرد Digital PCR
این روش خاص از انواع PCR چندین مزیت دارد. به منابع یا کنترلهای درونزا نیاز ندارد. به دلیل تکرارهای بیشتر PCR، از دقت و حساسیت بسیار بالاتری برخوردار است. بنابراین، به طور گستردهای برای تجزیه و تحلیل تغییرات تعداد کپی، جهشهای نادر، «توالییابی نسل بعدی» (NGS) و غیره استفاده میشود.
Suicide PCR
Suicide PCR از تکثیر مثبت کاذب به عنوان اولویت اصلی خود جلوگیری میکند. PCR خودكشی در ابتدا در يک مطالعه برای بررسی وجود ميكروب Yersinia pestis در نمونههای دندانی بدست آمده از گورهای قرن 14 افرادی كه ظاهراً توسط طاعون در طی اپيدمی مرگ سياه قرون وسطايی مرده بودند، تشريح شده است. این روش نیاز دارد که هر ترکیب پرایمر فقط یک بار در PCR استفاده شود و نباید در هیچ واکنش کنترل PCR مثبت استفاده شود. این آغازگرها همیشه باید یک منطقه ژنومی را هدف قرار دهند که هرگز قبل از استفاده از این آغازگر خاص یا سایر مجموعههای آغازگر، تکثیر نشده باشد. سپس این آمپلیکون باید توالییابی شود تا هویت آن تأیید شود.
کاربرد Suicide PCR
Suicide PCR اطمینان میدهد که هیچ DNA آلوده ناشی از واکنشهای قبلی PCR در آزمایشگاه وجود ندارد، که در غیر این صورت میتواند نتیجه مثبت کاذب ایجاد کند. علاوه بر این، توالی هدف هرگز نباید قبلاً در آزمایشگاه تکثیر شود. به این ترتیب، هیچ DNA از واکنش های قبلی PCR با واکنش PCR فعلی، کنترلهای مثبت کاذب ایجاد نمیکند. از این روش از انواع PCR به طور معمول در مطالعات دیرینهشناسی (مطالعه گذشته از طریق بررسی مواد ژنتیکی حفظ شده از بقایای ارگانیک موجودات باستانی) یا سایر مطالعاتی که پرهیز از مثبت بودن کاذب و اطمینان از اختصاصیت قطعه تکثیر شده بالاترین اولویت است استفاده میشود. به عنوان مثال، PCR خودکشی برای بهبود تشخیص ریکتزیوز در نمونههای «نمونه برداری اسکار» (Eschar biopsy) گرفته شده قبل از آنتیبیوتیک درمانی استفاده شد.
VNTR PCR
تکرار پشت سر هم تعداد متغیر (VNTR) ناحیهای است که در آن توالی کوتاه نوکلئوتیدی با تکرار پشت سر هم رخ میدهد. این نوع توالیها را می توان در بسیاری از کروموزوم ها مشاهده کرد و تغییرات طول کروموزوم را نشان میدهد. بنابراین VNTR میتواند برای شناسایی والدین و هویت افراد مورد استفاده قرار گیرد. این روش از انواع PCR منطقه VNTR را هدف قرار میدهد. تجزیه و تحلیل ژنوتیپهای نمونه معمولاً از طریق سایز بندی محصولات DNA الکتروفورز شده روی ژل انجام میشود. از این حالت از انواع PCR در ژنتیک، تحقیقات زیستشناسی، پزشکی قانونی و انگشتنگاری DNA استفاده میشود. به ویژه، تجزیه و تحلیل بخشهای کوچکتر VNTR که به عنوان تکرارهای کوتاه پشت سرهم شناخته میشوند، اساس پایگاه دادههای انگشتنگاری DNA است.
Cold-PCR
تکثیر همزمان در واکنش زنجیرهای پلیمراز مبتنی بر درجه حرارت دناتوراسیون (COLD-PCR) یک فرم جدید از PCR است که به طور انتخابی انواع DNA با فراوانی کم از مخلوط توالیهای نوع وحشی و حاوی جهش (یا حاوی سویههای مختلف)، صرف نظر از نوع جهش یا موقعیت آن بر روی آمپلیکون را تکثیر میکند. اصل اساسی COLD - PCR این است که عدم تطابق منفرد نوکلئوتیدی دمای ذوب (Tm) DNA دو رشته را کمی کاهش میدهد که این خود تا حدی بستگی به زمینه توالی و موقعیت عدم تطابق دارد. درست در زیر Tm یک درجه حرارت دناتوراسیون مهم به نام (Tc) وجود دارد که در آن کارایی PCR به طور ناگهانی در نتیجه تعداد محدود آمپلیکونهای دناتوره شده افت میکند. این تفاوت در کارایی PCR، در دمای اختصاصی دناتوراسیون مشخص شده، میتواند برای غنیسازی انتخابی آللهای اقلیت (یا جهشهای با فراوانی کم) در طول دوره PCR استفاده شود. یک چرخه معمولی COLD-PCR شامل موارد زیر است:
- مرحله دناتوراسیون: DNA در دمای بالا، معمولاً 95 درجه سانتیگراد دناتوره میشود.
- مرحله اتصال میانی: تنظیم درجه حرارت میانی آنلینگ که امکان ایجاد ترکیبی از DNA آلل جهش یافته و نوع وحشی را به یکدیگر میدهد. از آنجا که DNA آلل جهشیافته مقدار کمتری از DNA مخلوط را تشکیل میدهد، بنابراین احتمال ایجاد DNA heteroduplex با DNA نوع وحشی وجود دارد.
- مرحله ذوب: این هترو دوبلکسها در دماهای پایین با آسودگی بیشتری ذوب میشوند. از این رو در Tc به طور انتخابی دناتوره میشوند در حالی که همو دوبلکس ذوب نشده و به صورت دو رشته باقی میماند.
- مرحله اتصال اولیه: DNA همو دوبلکس ترجیحاً دو رشته باقی مانده و برای اتصال آغازگر در دسترس نخواهد بود.
- مرحله طویل شدن: DNA پلیمراز رشته مکمل DNA الگو را گسترش میدهد. از آنجا که DNA هترودوبلکس به عنوان الگو استفاده میشود، بخش بیشتری از DNA نوع جزئی تقویت میشود و برای دورههای بعدی PCR در دسترس است.
کاربرد COLD - PCR
COLD - PCR (تکثیر همزمان در دمای دناتوراسیون پایینتر - PCR) با پروتکل PCR سنتی در این تفاوت است که این روش از انواع PCR میتواند آللهای اقلیت و جهشهای DNA سوماتیک سطح پایین را از مخلوطی از نوع وحشی و DNA حاوی جهش، تکثیر و شناسایی کند. بنابراین برای استفاده در یافتن جهشهای تشخیصی زودهنگام سرطان از نمونهبرداری بافت و مایعات بدن، نظارت بر نتیجه درمان و بهبود یا عود سرطان، ارزیابی بیماری باقیمانده پس از جراحی یا شیمی درمانی و پروفایلسازی مولکولی برای پیشبینی یا درمان درخور (درمان بر اساس فعل و انفعالات پیچیده در بین ویژگیهای بیمار، فیزیوپاتولوژی بیماری و متابولیسم دارو، درمان بیمار مبتلا به بیماری خاص با داروی موثر و ایمن است) برای بیماران منفرد مفید است.
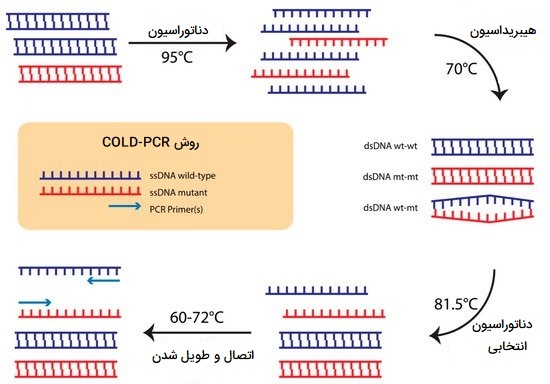
PCR هم دما
بر خلاف PCR معمولی که برای جدا کردن دو رشته DNA و سپس تکثیرقطعه مورد نیاز به یک ترموسایکلر نیاز دارد، PCR همدما میتواند DNA را در شرایط ایزوترمال بدون نیاز به دستگاه گرمایی خاص آن تکثیر کند. در این روش از انواع PCR موجود، DNA پلیمراز رشته DNA را با کمک پروتئینهای مختلف جانبی تکثیر میکند. شناسایی اخیر این پروتئینها امکان ایجاد روشهای جدید تکثیر آزمایشگاهی ایزوترمال در شرایط in vitro را فراهم کرده است که از این مکانیسمها در داخل بدن تقلید میکند. انواع مختلفی از روشهای تکثیر اسید نوکلئیک ایزوترمال مانند تکثیر اسید نوکلئیک مبتنی بر توالی، تکثیر به واسطه سیگنال فناوری RNA، تکثیر جابجایی رشته، تکثیر ایزوترمال DNA با اتصال حلقه، تکثیر جابجایی چند دمایی، تکثیر وابسته به هلیکاز، تکثیر ایزوترمال تک پرایمر و تکثیر وابسته به هلیکاز دایرهای وجود دارند.
این پروتکلهای متنوع تکثیر ایزوترمال دارای مزایای مختلفی هستند. با این حال، برخی از مزایای رایج این روش از انواع PCR است که تکنیکهای همدمایی بسیار سریع هستند و نیازی به دستگاه ترموسایکلر ندارند. بنابراین، PCR ایزوترمال برای تشخیص بالینی و معاینات ایمنی زیستی مناسب است.











با سلام و احترام
مطالب بسیار شیوا و ارزنده بود.
با تشکر
دانشجوی رشته بیوشیمی بالینی
How to set a PCR?
بسیار جامع و کامل
بسیار جامع وکامل و با بیانی بسیار ساده و قابل درک بیان شده بود . متشکر از زحمات شما
تشکر از این مطلب زیبا…