تکنیک ژل الکتروفورز — به زبان ساده

«تکنیک ژل الکتروفورز» (Gel Electrophoresis) روش آزمایشگاهی متداولی برای جداسازی مولکولهای باردار براساس اندازه، بار و جرم مولکولی آنها است. زمانی که جریان در ژل الکتروفورز برقرار است، مولکولهای باردار در طول ژل شروع به حرکت میکنند. با برقراری جریان بر روی ژل، یک سمت ژل دارای بار مثبت و سر دیگر دارای بار منفی میشود. در این حالت، مولکولهای باردار به سمت قطب مخالف خود روی ژل شروع به حرکت میکنند که به این حرکت «مهاجرت» (Migration) میگویند. ژل الکتروفورز دارای ساختار ماتریکس نفوذپذیر است، به همین دلیل است که مولکولها از میان منافذ موجود در آن میتوانند عبور و در طول ژل حرکت کنند.
معرفی تکنیک الکتروفورز
تکنیک الکتروفورز، روشی برای جداسازی و شناسایی مولکولها از طریق اعمال جریان الکتریکی است. همانطور که در بالا اشاره شد، این روش برای جداسازی مولکولهای باردار مانند RNA ،DNA و پروتئین، در آزمایشگاههای مولکولی و بیوشیمی کاربرد دارد.
ژل مورد استفاده در این تکنیک از «آگاروز» (Agarose) یا «پلیآکریلامید» (PolyAcrylamid) ساخته میشود. ساختمان ژل به صورت متخلخل است، به همین دلیل به مولکولهای مختلف با اندازههای متفاوت اجازه عبور میدهد. با کاهش و افزایش غلظت ژلهای مورد استفاده در الکتروفورز میتوان منافذ این ژل را برای جداسازی مولکولهای کوچکتر و بزرگتر مناسب کرد.
کاربردهای تکنیک ژل الکتروفورز
در آزمایشگاه یکی از مهمترین کاربردهای ژل الکتروفورز، استفاده از آن برای جداسازی مولکولهای DNA است. مولکولهای DNA به صورت استخراج شده از سلولهای مختلف یا به صورت محصول واکنشهایی مثل PCR و real time-PCR و کلونینگ ژن، با استفاده از این تکنیک قابل جداسازی هستند. شایان ذکر است که بررسی صحت انجام و کیفیت محصولات واکنش PCR تنها توسط تکنیک ژل الکتروفورز انجام میگیرد.
از ژل آگاروز به دلیل منافذ بزرگ (منافذی به قطر ۱۰۰ تا ۵۰۰ نانومتر)، بیشتر برای جداسازی مولکولهای DNA با طول بالا استفاده میشود. برای جداسازی پروتئینها نیز این تکنیک کاربرد ویژهای دارد. با توجه به اینکه روش متداول شناسایی پروتئینها تکنیکهای کروماتوگرافی است، اما استفاده از تکنیک ژل الکتروفورز نیز میتواند روشی ساده و مقرون به صرفه برای شناسایی این مولکولها باشد. برای جداسازی پروتئینها استفاده از ژل پلیآکریلامید (با منافذی به قطر ۱۰ تا ۲۰۰ نانومتر) بسیار مناسبتر است. به روش الکتروفورز با استفاده از ژل پلیآکریلامید، روش «الکتروفورز ژل پلیآکریلامید» (Polyacrylamide Gel Electrophoresis) یا PAGE میگویند. روش PAGE روشی ایدهآل برای جداسازی پروتئینها تنها براساس اندازه آنها است.
انواع الکتروفورز
الکتروفورز به دو شکل افقی و عمودی انجام میگیرد. هر کدام از این دو نوع مصارف خاص خود را دارند. یکی از تفاوتهای بین این دو نوع الکتروفورز جهت قرارگیری ژل است، به طوری که در الکتروفورز افقی ژل به صورت افقی در محیط بافر قرار میگیرد، اما در الکتروفورز عمودی ژل به صورت عمودی و درون محفظه الکتروفورز قرار گرفته است و به طور کامل با بافر در تماس نیست. ژل مورد استفاده در الکتروفورز افقی ژل آگاروز است و در الکتروفورز عمودی از ژل پلیآکریلامید استفاده میشود. در تهیه آکریلامید، اکسیژن برای پلیمریزه شدن به عنوان یک مهارکننده عمل میکند، به همین دلیل از این ژل در الکتروفورز افقی (که ژل در معرض اکسیژن هوا قرار میگیرد) نمیتوان استفاده کرد.
| ژل آگاروز | ژل پلیآکریلامید |
| از پلیساکارید جلبکهای دریایی تهیه میشود. | از ایجاد اتصالات عرضی پلیمر آکریلامید تهیه میشود. |
| درون کاست افقی شکل میگیرد. | درون کاست عمودی شکل میگیرد. |
| غیرسمی است. | سمی و خطرناک است. |
| مولکولهای بزرگ را از هم جدا میکند. | مولکولهای کوچک را از هم جدا میکند. |
| برای جداسازی DNA مناسب است. | برای جداسازی DNA و پروتئینها مناسب است. |
| دارای منافذ بزرگ است. | دارای منافذ کوچک است. |
| ساختار ساده دارد. | ساختار سخت و پیچیده دارد. |
تهیه ژل برای انجام الکتروفورز
مواد اولیه برای ژلهای الکتروفورز معمولا به صورت پودر است که در بافرهای مخصوصی حل شده و بر روی حرارت قرار میگیرد تا ذرات پودر کاملا در بافر حل شود.
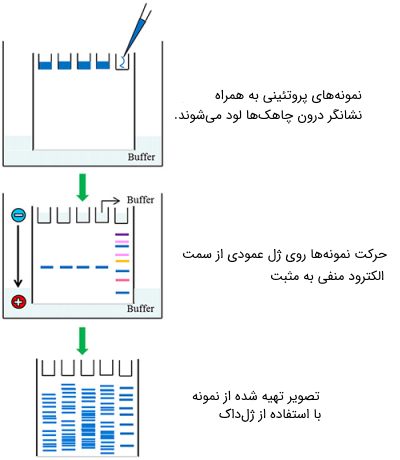
برای این منظور مقدار معینی از پودر ماده مورد نظر (براساس غلظت ژل) وزن شده و با مقدار معینی از بافر (میتواند بافر TAE یا TBE باشد) مخلوط میشود. سپس مایع ژل، ٰدرون «کاست ژل» (Casting tray) ریخته میشود و بعد از خنک شدن، ژل بسته شده و شکل میگیرد. قبل از خنک شدن ژل، در ابتدای آن، چاهکهایی برای قراردادن نمونه تعبیه میشود که این چاهکها توسط شانههایی به نام «شانه چاهک» (Well combs) ساخته میشوند.
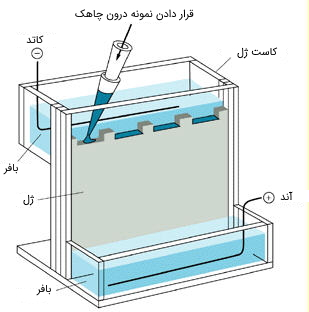
ژل درون کاست و در محفظهای به نام «تانک الکتروفورز» (Gel Box) قرار میگیرد. این تانک با بافری که عبور جریان از ژل را تسهیل میکند پر شده است. تانک توسط دو الکترود به یک منبع الکتریکی برای اعمال جریان الکتریکی متصل میشود. جهت قرارگیری الکترود طوری است که مولکولها بتوانند به سمت الکترود مخالف حرکت کنند.
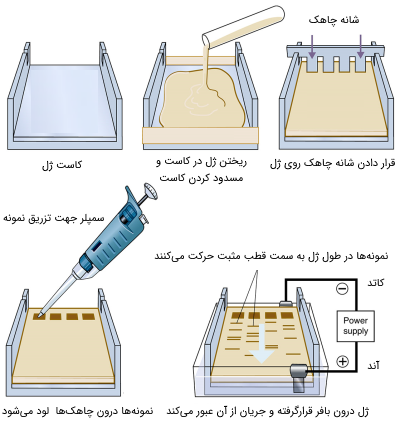
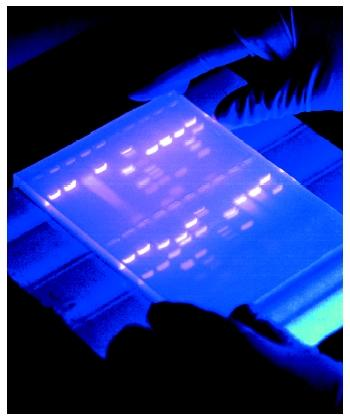
برای مشاهده و ردیابی نمونهها روی ژل، در هنگام قرار دادن یا لود کردن (Loading) آنها درون چاهک، با رنگهای قابل مشاهده با نور UV مانند «ژل رد» (Gel Red) مورد رنگآمیزی قرار میگیرند. در گذشته، از رنگهای دیگری مانند «اتیدیوم برماید» (Ethidium Bromide) برای رنگآمیزی استفاده میشد، اما به دلیل سمی و جهشزا بودن این رنگها، استفاده از آنها ممنوع شده است. پس از اتمام حرکت مولکولها به سمت قطب مخالف، جریان الکتریکی قطع میشود و ژل توسط دستگاهی به «ژل داک» (Gel Documentation) (دستگاهی که از نور UV برای آشکار سازی رنگهای فلورسنت استفاده میکند) تصویر برداری میشود.
طرز تهیه ژل آگاروز
ژل آگاروز معمولا براساس اندازه مولکولهایی که قرار است شناسایی شوند، با غلظتهای ۰٫۷ تا ۲ درصد ساخته میشود. اگر هدف از الکتروفورز صرفا جداسازی و شناسایی کیفی مولکولها باشد و یا اندازه قطعات DNA بزرگتر از ۵۰۰ جفت باز باشد، انتخاب اول برای تهیه ژل، آگاروز است.
برای ساخت ژل با غلظت ۲ درصد، ابتدا ۲ گرم از پودر آگاروز را وزن کرده و در ۱۰۰ میلیلیتر از بافر TAE یا TBE حل میکنیم. در تهیه ژلهای الکتروفورز اغلب از بافرهای TAE و TBE استفاده میشود. نکته مهم در انتخاب و استفاده از بافرها این است که همیشه از همان بافری که برای تهیه ژل استفاده میشود باید برای پر کردن تانک الکتروفورز نیز استفاده کرد. مخلوط بافر و پودر آگاروز برای انحلال بیشتر، حرارت (روی هیتر یا مایکروویو) داده میشود. حرارت باعث حل شدن تمام ذرات آگاروز در بافر میشود، به طوری که بعد از اتمام حرارتدهی، مایع شفاف و یکنواختی بدست میآید که با انتقال به کاستهای ژل (که شانه چاهک برای روی آن قرار گرفته) سرد شده و به اصطلاح ژل میبندد و برای انجام الکتروفورز آماده میشود. ژل آگاروز بیشتر در الکتروفورز افقی استفاده میشود.

مواد لازم برای تهیه بافرها
- بافر TAE یا Tris/Acetate/EDTA: برای تهیه این بافر از تریس (Tris-base)، استات (Acetate) و EDTA به همراه آب استفاده میشود.
- بافر TBE یا Tris/Borate/EDTA: برای تهیه این بافر تریس به همراه بوریک اسید (Boric acid) در آب رقیق شده و با Na2EDTA مخلوط میشود.
هر کدام از دو بافر بالا برای موارد خاصی مناسب هستند که باید با توجه به نوع مولکول مورد شناسایی و هدف از جداسازی، بافر متناسب با آنها به درستی انتخاب شود. به طور مثال، بافر TAE برای جداسازی قطعاتی از DNA با طول بلند مناسب است، در حالیکه بافر TBE برای شناسایی قطعاتی از DNA در حدود ۲Kb نتایج بهتری نشان میدهد. از آنجایی که TBE محیطی با رسانایی بالاتر از TAE ایجاد میکند، بنابراین TBE انتخاب بهتری برای الکتروفورزهای طولانی به شمار میآید. با توجه به تجربیات محققان در این زمینه، زمانی که بافر TBE مورد استفاده قرار میگیرد، باندهای بهتری نسبت به بافر TAE روی ژل مشاهده میشود. بورات یا اسید بوریک موجود در بافر TBE، مهارکننده قوی آنزیمی است و به همین دلیل، زمانی که DNA مورد شناسایی قرار است برای آزمونهای بعدی مانند کلونینگ، ریکاوری شود، استفاده از TAE گزینه بهتری است.
طرز تهیه ژل پلیآکریلامید
این ژل از پلیمرهای پلیآکریلامید که فواصل منظمی را در ژل ایجاد میکنند، تهیه میشود. ماده دیگری به نام «بیس آکریلامید» (ٰ N,N'-methylbisacrylamide) در ایجاد نوارهای عرضی (Cross-link) و منافذی با قطر یکسان در ژل نقش دارد. اولین مرحله جهت تهیه این ژل ترکیب دو ماده آکریلامید و بیس آکریلامید به همراه حجم مشخصی از آب است. این محلول برای تخلیص از فیلتر عبور داده و در دمای اتاق در فضای تاریک نگهداری میشود. بافری که اغلب در تهیه این ژل به کار میرود، بافر TBE است. «آمونیوم پرسولفات» (Ammonium Persulfate) یا APS منبع رادیکال آزاد در ژل است و زمانی که به آن ماده TEMED با فرمول N,N,N’,N’–tetramethyethylenediamine اضافه میشود، پلیمریزاسیون ژل را تسریع میکند. بنابراین، زمان افزودن آمونیوم پرسولفات و TEMED به ژل، درست قبل از ریختن محلول ژل درون کاست است. TEMED مادهای بسیار خطرناک، بدبو و جهشزا است و کار با آن باید تحت شرایط ایمنی و زیر هود شیمیایی انجام شود. از ژل پلیآکریلامید در الکتروفورز عمودی و اغلب برای جداسازی پروتئین و مولکولهای DNA کوچک و تک رشتهای استفاده میشود.
الکتروفورز مولکولهای DNA
با استفاده از تکنیک الکتروفورز قادر به شناسایی مولکولهای DNA با طولهای متفاوت هستیم. همه مولکولهای DNA دارای بار منفی هستند و هنگامی که روی ژل قرار میگیرند، با اعمال جریان الکتریکی به سمت الکترود مثبت حرکت میکنند. در این حالت، جداسازی تنها بر اساس اندازه مولکولهای DNA انجام میشود. رشتههای کوتاه DNA با سرعت بیشتری نسبت به مولکولهای بلندتر روی ژل حرکت میکنند و به همین دلیل میتوان به راحتی مولکولهای DNA با اندازههای مختلف را از هم جدا کرد. در هنگام لود کردن نمونهها درون چاهکهای ژل، با اضافه کردن رنگهای دارای فلورسنت میتوان در ادامه فرایند، نمونهها را ردیابی کرد.
گاهی رنگهای فلورسنت را قبل از ریختن ژل در قالبهای الکتروفورز با ژل مخلوط میکنند. در این حالت، در هنگام لود نمونه دیگر نیاز به اضافه کردن رنگ نیست. الکتروفورز برای مولکولهای DNA به صورت افقی انجام میگیرد که روشی سادهتر نسبت به روش عمودی است.
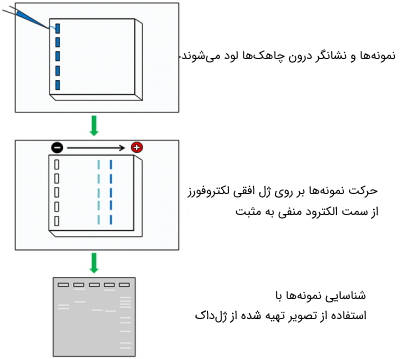
بعد از اتمام حرکت نمونهها و توقف جریان، باند مولکولهای DNA در اندازههای مختلف بر روی ژل قابل مشاهده است. برای تعیین اندازه باند نمونه، روی ژل از یک «نشانگر» (Ladder) به عنوان استاندارد استفاده میشود. نشانگر روی ژل به صورت باندهایی با طول معین نمایان بوده و با استفاده از آن اندازه باندهای نمونه بر روی ژل قابل تخمین است.

الکتروفورز پروتئینها با استفاده از الکتروفورز به روش PAGE
زمانی که پروتئینها به روش الکتروفورز از هم جدا شوند، عوامل مختلفی از جمله بار الکتریکی و اندازه مولکولها در این جداسازی دخیل هستند. اما اگر بتوان بار همه مولکولهای پروتئین را یکسان کرد و جداسازی تنها براساس اندازه پروتئینها انجام گیرد، جداسازی با دقت بالاتری انجام میشود. در روش PAGE با استفاده از حرارت دادن و اتصال دترجنت آنیونی به نام «دودسیل سولفات» (SDS) به پروتئینها، بار همه مولکولهای پروتئینی منفی میشود.
ترکیب SDS به نواحی آبگریز پروتئینها متصل شده و آنها را دناتوره (Denaturation) میکند. با این کار، در واقع SDS بار الکتریکی مولکولهای پروتئین را میپوشاند. بعد از این مرحله، با استفاده از بستر پلیآکریلامید، پروتئینها در طول ماتریکس ژل براساس اندازهشان از هم جدا میشوند.
در حالت کلی برای انجام کارهای روزمره آزمایشگاه و ارزیابی کیفی نمونهها از الکتروفورز افقی با ژل آگاروز استفاده میشود. این روش ارزانتر، سادهتر و سریعتر از روشهای دیگر قابل انجام است. اما برای دستیابی به نتایج دقیق، جداسازی مولکولهای بسیار کوچک و انجام ارزیابی کمی و آزمونهای حساس آزمایشگاهی روش الکتروفورز عمودی گزینه بهتری است.
اگر این نوشته برای شما مفید بوده است و مایل به مطالعه مطالب مشابه هستید، آموزشهای زیر به شما پیشنهاد میشود:
- مجموعه آموزشهای زیستشناسی
- آموزش زیستشناسی سلولی و مولکولی - مبانی و مفاهیم مقدماتی
- مجموعه آموزشهای دروس شیمی
- آنزیم چیست؟ -- به زبان ساده
- تعریف واکنشهای شیمیایی -- به زبان ساده
- لیپید چیست؟ -- به زبان ساده
^^










با سلام و احترام
تشکر فراوان بابت ارایه مطالب کاربردی و رایگان
جهت آزمایشگاه درس ژنتیک مولکولی نیاز به دستور العمل آزمایش هضم آنزیمی، آشنایی با الکتروفورز و استخراج پلاسمید دارم. در صورت امکان جزوه آنرا برایم ایمیل فرمایید.با سپاس
آیا می شود از تکنیک الکتروفورز برای شمارش نیز استفاده کرد
مثلا در کدام یک از نمونه ها زنوم مورد نظر بیشتر است و یا چقدر بیشتر است؟
سلام
ممنون از اطلاعات مفیدتون
یه سوال داشتم در روش شناسایی 16s rrna بعد از اینکه نمونه pcr شد و با پرایمر خودش یکی میشه و میره برا تست خطوط که مشخص میشن فقط و فقط مربوط به اون دسته rrna هستند که تکمیل هستند دیگه یا خطوط اضافی هم داریم؟
بسیار خوب.ممنون
ممنونم از اطلاعات کامل و کاربردی
بسیار عالی ومفید
کامل و مفید مرسی از شما