گروه یک جدول تناوبی چه نام دارد؟ + بررسی گروه اول به زبان ساده
گروه یک جدول تناوبی متعلق به فلزات قلیایی و عنصر هیدروژن است. فلزات قلیایی شامل عناصری ازجمله لیتیوم، سدیم، پتاسیم، روبیدیم، سزیوم و فرانسیوم هستند و آرایش الکترونی این عناصر به بلوک S ختم میشود. به همین دلیل است که هیدروژن در این گروه قرار دارد زیرا آرایش الکترونی آن همانند فلزات قلیایی است. اما یادتان باشد که عنصر هیدروژن اصولا شباهتی به سایر عناصر گروه یک ندارد و ویژگیهای آن مستقل از فلزات قلیایی است که در این مطلب به این ویژگیها خواهیم پرداخت. نام قلیایی برای فلزات گروه یک جدول تناوبی از ریشه عربی به نام (Al qali) به معنای تشکیل شده از خاکستر مشتق گرفته شده است. دلیل انتخاب این نام به این خاطر است که این عناصر با آب واکنش میدهند و یونهای هیدروکسید را بهوجود میآورند که این یونها خاصیت قلیایی دارند . در این مطلب به ویژگیهای فیزیکی و شیمیایی گروه یک جدول تناوبی میپردازیم تا با عناصر این گروه آشنا شوید.
- یاد میگیرید اعضای گروه یک جدول تناوبی را شناسایی و مقایسه کنید.
- میآموزید چگونه روندهای فیزیکی و شیمیایی این گروه را تحلیل کنید.
- یاد خواهید گرفت دلایل نامگذاری و رفتار قلیایی فلزات این گروه را توضیح دهید.
- خواهید آموخت تفاوتهای اصلی هیدروژن با سایر عناصر را توضیح دهید.
- میآموزید کاربردهای مهم و خاص هر عنصر را بررسی کنید.
- خواهید توانست تأثیر ویژگیهای ساختاری عناصر بر واکنشپذیری و کاربرد آنها را تحلیل کنید.


گروه یک جدول تناوبی
گروه یک(IA) در جدول تناوبی مربوط به هیدروژن و فلزات قلیایی شامل لیتیوم ، سدیم ، پتاسیم ، روبیدیم ، سزیوم و فرانسیم است. ازجمله شباهتها در ویژگیهای عناصر این گروه (به جز هیدروژن) میتوان به نرم بودن، براقیت، نقطه ذوب پایین، و واکنشپذیری بالا اشاره کرد. همچینین زمانی که این عناصر در معرض هوا قرار میگیرند از براقیت آنها کاسته و تیره و کدر میشوند. فلزات قلیایی به ندرت در طبیعت به صورت آزاد وجود دارند و اغلب در ترکیبات یونی یافت میشوند. همانطور که گفتیم این فلزات واکنشپذیری بالایی دارند به همین دلیل اغلب آنها را در زیر نفت یا پارافین نگهداری میکنند.

فلزات قلیایی در لایه طرفیت خود تنها یک الکترون دارند و به آرایش الکترونی ختم میشوند. این الکترون به راحتی از هسته جدا میشود که در این صورت اتم فلزات قلیایی به یون باردار ۱+ تبدیل میشوند. با توجه به قانون دوره ای عنصرها، شعاع اتمی از چپ به راست کاهش و در گروه از بالا به پایین افزایش پیدا میکند به همین خاطر بزرگترین عناصر در این گروه قرار دارند که انرژی یونش کمی نیز دارند.
حالت فیزیکی فلزات قلیایی در دمای اتاق، جامد است اما دمای ذوب بسیار پایینی دارند. عنصر لیتیوم در دمای ۱۸۱ درجه سانتیگراد، سدیم در دمای ۹۸ درجه سانتیگراد، پتاسیم در دمای ۶۳ درجه سانتیگراد، روبیدیم در دمای ۳۹ درجه سانتیگراد و سزیم در دمای ۲۸ درجه سانتیگراد ذوب میشود. فلزات قلیایی به حدی نرم هستند که به عنوان مثال سدیم و پتاسیم را میتوانند با چاقو ببرند. ترکیبات نمکی گروه یک جدول تناوبی انحلالپذیری بالایی در آب دارند.
به این دلیل که یون فلزات قلیایی در مقایسه با عناصر همان دوره بزرگ هستند و چگالی بار آنها پایین است. به همین خاطر کاتیون و آنیون به راحتی در آب از هم جدا میشوند و در حلالهای قطبی مانند آب حل میشوند. و بعد از حل شدن در آب هیدروکسیدهای فلزی، گاز هیدروژن و گرما تولید میکنند. واکنش زیر فرم کلی واکنش فلزات قلیایی با آب است.
توجه داشته باشید که ترکیب هیدروژن با گرما در اتمسفر اکسیژن ترکیب بسیار خطرناکی است زیرا منجر به انفجار میشود. واکنشپذیری فلزات قلیایی با آب در گروه از بالا به پایین افزایش پیدا میکند. به این صورت که لیتیوم در آب به جوش میآید، مقدار کمی از سدیم در آب با شدت بیشتری واکنش میدهد، مقدار کمی از پتاسیم با شدت بیشتری نسبت به سدیم در آب واکنش میدهد تا حدی که گاز هیدروژن را مشتعل میکند. واکشپذیری روبیدیم و سزیم در آب آنقدر بالاست که منفجر میشوند.
این موضوع نتیجه این است که اندازه عنصرهای شیمیایی در گروه از بالا به پایین بیشتر میشود و هرچه اندازه عنصر بیشتر شود الکترون ظرفیت از هسته دورتر خواهد بود در نتیجه به راحتی الکترون خود را از دست میدهد (انرژی یونش پایینتر).

نام گروه اول جدول تناوبی
همانطور که در قسمتهای قبلی اشاره کردیم نام گروه یک جدول تناوبی البته به جر هیدروژن قلیایی نام دارد. زیرا زمانی که این فلزات یا اکسید آنها در آب حل میشوند به خاطر آزاد شدن یون هیدروکسید که خاصیت بازی دارد محلولهای قلیایی یا همان بازی را بهوجود میآورند. به همین دلیل نام فلزات قلیایی را بر روی آنها نامگذاری کردند.
عناصر گروه اول جدول تناوبی
گروه یک جدول تناوبی دارای ۷ عنصر است که در قسمتهای قبلی به آنها اشاره کردیم بنابراین ۷ عنصر جدول تناوبی به ترتیب قرارگیری در دورهها عبارتند از :
- هیدروژن
- لیتیم
- سدیم
- پتاسیم
- روبیدیم
- سزیم
- فرانسیم
در ادامه به ویژگیها و خواص هر یک از این عنصرهای گروه یک جدول تناوبی میپردازیم.
۱. عنصر هیدروژن (H, Z=۱)
اگرچه عنصر هیدروژن در اکثر نسخههای جدول تناوبی در بالای گروه یک قرار دارد اما تفاوت بسیار زیادی را با سایر عناصر این گروه یعنی فلزات قلیایی دارد. هیدروژن توسط شیمیدان فرانسوی بسیار معروف به نام «آنتوان لاووازیه» (Antonie Lavoisier) نامگذاری شد که از یک کلمه یونانی شامل «هیدرو» (hydro) به معنای آب و «جنس» (genes) به معنای در حال تشکیل مشتق گرفته شده است. ازجمله ویژگیهای این عنصر میتوان به بیرنگ بودن، بدون بو، اشتعالپذیری بالا در دمای اتاق و شامل مولکول دو اتمی هیدروژن اشاره کرد.
مولکول هیدروژن در دمای 253- درجه سانتیگراد (معادل ۲۰ کلوین) و در دمای ۲۵۹- درجه سانتیگراد (معادل ۱۴ کلوین) به ترتیب به جوش میآید و منجمد میشود. این عنصر دارای رسانایی الکتریکی است و تحت فشار زیاد (حدود ۲ میلیون اتمسفر) میتواند به شکل فلزی تبدیل شود - فرضیهای است که ادعا میکند در سیاره مشتری هیدروژن فلزی وجود دارد- در پوسته زمین غلظت هیدروژن البته به صورت آب و ترکیبات آلی برابر ۱۵۰۰ ppm است که این موضوع باعث شده هیدروژن از لحاظ فراوانی دهمین عنصر شناخته شود.

عنصر هیدوژن در جهان یکی از فراوانترین عناصر شناخته میشود (۷۵٪ وزنی یا ۸۸٪ کل اتمهای موجود در جهان هستی)؛ همچنین در اثر ترکیب هیدروژن با هلیم، ۹۹درصد مواد طبیعی در جهان هستی تشکیل میشوند. هیدروژن، هلیوم و مقدار ناچیزی از لیتیوم در آغاز فرایند مهبانگ (Big Bang) بهوجود آمدند و توسط نیروی جاذبه در ستارهها متراکم شدند. طی واکنش هستهای هیدروژن به هلیم تبدیل میشود که باعث میشود ستارهها چشمک بزنند و براق به نظر برسند.
در خورشید، ۶۰۰ میلیون تن هیدروژن در هر ثانیه در اثر واکنش هستهای به هلیم تبدیل میشود و ۵ میلیون تن ماده را به انرژی تبدیل میکند . تبدیل هیدروژن و ایزوتوپهای آن به باعث بهوجود آوردن بمبهای هیدروژنی برپایه همجوشی هستهای میشود که حاوی لیتیوم دوترید و تریتیم است. انفجار یک بمب بر پایه همجوشی هستهای باعث آزاد کردن نوترونها میشود که این نوترونها آغازگر همجوشی هستهای دوتریم و تریتیوم هستند که در اثر این واکنش، انرژی بسیار زیادی آزاد میشود.

مطالعات نشان داده است که تلاشهای بسیاری برای کنترل کردن واکنش همجوشی هسته ای برای رسیدن به برق یا الکتریسیته صورت گرفته است اما این کار نیاز به دماهای بسیار بالایی دارد به گونه ای که فرآیند آغاز کردن واکنشهای بر پایه همجوشی هستهای در علم فیزیک تبدیل به یک چالش شده است.
به طور کلی هیدروژن نمیتواند به کاتیون تبدیل شود اما در عوض ترکیباتی را توسط پیوندهای کوالانسی به وجود میآورد. هیدروژن میتواند پیوندهایی را با بسیاری از عناصر دیگر ازجمله نیتروژن برقرار کند و ترکیباتی مانند و سایر مشتقات آن را تشکیل دهد. ازجمله عناصر دیگری که نیتروژن میتواند با آنها پیوند شیمیایی برقرار کند عبارتند از:
- اکسیژن
- گوگرد
- هالوژن ها
- کربن؛ که در تعداد بیشماری هیدروکربنهای مختلف و سایر مولکولهای آلی یافت میشوند. (تقریبا همه مولکولهای آلی شامل حداقل مقداری از اتم هیدروژن هستند.)
- لیتیوم
- کلسیوم
- و غیره
در این ترکیبات میان کاتیونهای فلزی و آنیونهای هیبریدی پیوند برقرار میشود. از آنجا که هیدروژن مانند هالوژنهاست و میتواند به یون ۱- تبدیل شود در برخی از جدولهای تناوبی عنصر هیدروژن در بالای گروه ۷ (7A) قرار دارد.
همچنین هیدروژن در اسیدها به صورت مولکولهایی شامل اتمهای هیدروژن وجود دارد که به راحتی میتواند آنها را از دست بدهد و معمولا به اکسیژن، نیتروژن یا هالوژن متصل است. زمانی که این مواد در آب حل میشوند هیدروژن را به صورت یون در آب آزاد میکنند (اغلب این یون به نام پروتون شناخته میشود) و یون هیدرونیوم را به وجود میآورند (این مفهوم یک توضیح بسیار ساده از مفهوم شیمی اسید و باز است).
ازجمله اسیدها میتوان به هیدروکلریک اسید که با نام کلریدریک اسید هم نیز شناخته میشود، سولفوریک اسید ، نیتریک اسید ، استیک اسید که جزء اصلی در سرکه به شمار میرود، فسفریک اسید، هیدروفلوئوریک اسید و غیره اشاره کرد.

برای هیدروژن سه ایزوتوپ وجود دارد که ایزوتوپ اولی مربوط به پروتونیم است. پروتونیم شامل یک پروتون درهسته خود است و این ذره فراوانترین ذره از بین ایزوتوپهای هیدروژن به شمار میرود (۹۹/۹۸۵٪ کل هیدروژن جهان). ایزوتوپ بعدی است که دوتریم نام دارد و در هسته خود یک پروتون و یک نوترون دارد و شامل ۰/۰۱۵٪ باقیمانده از هیدروژن کل جهان را شامل میشود. سومین ایزوتوپ تریتیم نام دارد و در هسته خود یک پروتون و دو نوترون نام دارد و تنها در مقادیر بسیار ناچیزی یافت میشود؛ این ایزوتوپ در اثر برهمکنش پرتوهای کیهانی بر روی گازهای اتمسفر فوقانی و انفجارهای هستهای به وجود میآید ولی از آنجا که نیمه عمر آن برابر ۱۲/۳ ساله است در اتمسفر ذخیره نمیشود.
هیدروژن در صنعت توسط واکنش زغال سنگ یا هیدروکربن با بخار در دماهای بالا تولید میشود. در اثر این واکنش شیمیایی، مونوکسید کربن و گاز هیدروژن ( ترکیبی از کربن مونوکسید و هیدروژن سنتز گاز نام دارد و میتواند در تولید نیز متانول مورد استفاده قرار بگیرد) به وجود میآید. در مقیاسهای کوچک هیدروژنمیتواند توسط واکنش میان فلزات فعال (مانند روی، کلسیم و غیره) با هیدروکلریک اسید یا توسط الکترولیز آب تولید شود.
مولکولهایی که در آنها هیدروژن با گازهایی همچون اکسیژن، نیتروژن و فلوئور پیوند ایجاد میکند دارای پیوند هیدوژنی است. یعنی نیروی جاذبه بین هیدروژن و هر یک از عناصر اکسیژن، نیتروژن و فلوئور از نوع هیدروژنی خواهد بود. پیوندهای هیدروژنی در بین انواع نیروهای دوقطبی- دوقطبی است محمترین پویند به شمار میرود البته استحکام آن از پیوند یونی و کوالانسی ضعیفتر است. دلیل بهوجود آمدن این نوع پیوند اشتراکگذاری نابرابر الکترونها در پیوندهای کووالانسی است.
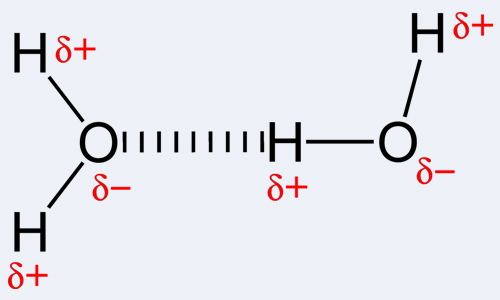
اگر در پیوند کووالانسی الکترونگاتیوی یک اتم بالاتر از اتم دیگر باشد با قدرت بیشتری الکترونهایی را که دو اتم به اشتراک گذاشتهاند را به سمت خود جذب میکند و به همین خاطر بار جزئی آن منفی و بار جزئی آن اتمی که الکترونگاتیوی پایینی دارد مثبت میشود. درنتیجه اتمی که بار جزئی آن منفی شده، اتم با بار جزئی مثبت را از مولکول همسایه به سمت خود جذب میکند. این موضوع سبب میشود که نیروی جاذبه در این دو مولکول نسبت به مولکولهای ناقطبی (مولکولهایی که در آنها تفاوت الکترونگاتیوی وجود ندارد.) بیشتر باشد.
در مولکولهایی که این نوع پیوند دوقطبی-دوقطبی وجود دارد نقطه جوش آنها بالاتر است زیرا برای شکستن این نیروی جاذبه دمای بیشتری نیاز است. در مورد ، و اتمهای اکسیژن، نیتروژن و فلوئور الکترونگاتیوی بیشتری دارند (این ۳ عنصر الکترونگاتیوترین عنصرهای شیمیایی به شمار میروند) به همین دلیل به هنگام برقراری پیوند هیدروژن با این سه عنصر، بار جزئی هیدروژن مثبت میشود و اکسیژن، نیتروژن و فلوئور بار جزئی منفی پیدا میکنند.
۲. لیتیوم (Li, Z=3)
لیتیوم فلزی نقرهایرنگ و نرم با چگالی بسیار پایین است که به شدت با آب واکنش میدهد. زمانی که عنصر لیتیوم در معرض هوا قرار میگیرد رنگ آن به سرعت تیره و کدر میشود. ریشه نام این عنصر از یک کلمه یونانی برای سنگ «لیتوس» (lithos) گرفته شده است. مقدار این عنصر در پوسته زمین به اندازه 20 ppm است و آن را به ۳۱امین عنصر فراوان در پوسته زمین تبدیل میکند. لیتیوم در سنگهای کانی اسپودمن ، پتالیت ، لپیدولیت و آمبلیگونیت یافت میشود.
لیتیوم نسبت به سایر عناصر گروه یک جدول تناوبی یک سری استثناء دارد. به عنوان مثال یون لیتیوم، چگالی بار بالایی دارد که این موضوع به دلیل کوچک بودن اندازه آن است به همین خاطر نوع پیوند در نمکهای لیتیومی به جای یوند یونی از نوع کووالانسی است. این نمکها به راحتی سایر نمکهای فلزات قلیایی در آب حل نمیشوند بنابراین نمکهای لیتویمی انحلالپذیری کمی در آب دارند. همچنین لیتیوم میتواند با عنصر کربن که مشخصه کوالانسی بالایی دارد تشکیل پیوند بدهد (ترکیبات ارگانولیتیوم). لازم به ذکر است که لیتیوم یکی از سه عنصری بود که در اثر رخداد مهبانگ در مقادیر ناچیزی به وجود آمد.

آلیاژهای آلومینیوم و منگنز لیتیوم در عین سبک بودن، بسیار قوی هستند. آلیاژهای آلومینوم- لیتیم در صنعت ساخت هواپیما، قطار و دوچرخه کاربرد دارند. همچنین باتریهای لیتیومی طول عمر بالایی دارند و بسیار سبکوزن هستند و از آنها استفاده بسیاری در دستگاههای الکترونیکی قابل حمل و رایانهها میشود.

نمکهای لیتیوم مانند لیتیوم کربنات در درمان اختلال دوقطبیها و برخی از افسردگیها کاربرد دارد همچننی در برخی از داروهای ضدافسردگی به عنوان نقش تقویتکننده کاربرد دارد. لیتیوم دوتریم در بمبهای هیدورژنی مورد استفاده قرار میگیرد. هیدروکسید لیتیوم در فضاهای بسته برای حذف کربن دیاکسید از هوا مورد استفاده قرار میگیرد. (کربن دیاکسید به شکل لیتیوم کربنیت جذب میشود)، این موضوع در زیردریاییها و فضاپیماها نقش بسیار مهمی را ایفا میکند.
سدیم (Na, Z=۱۱)
سومین عنصر در گروه یک جدول تناوبی مربوط به عنصرسدیم فلزی با ظاهری براق است. واکنش سدیم با آب به شدت سریع و از نوع انفجاری است و اگر در معرض هوا قرار بگیرد رنگ آن کدر و تیره میشود. سدیم از لحاظ فراوانی در پوسته زمین در مرتبه چهارم قرار دارد که شامل ۲/۶ درصد وزنی است؛ درآب دریا ۱/۵٪ وزنی سدیم وجود دارد. نام این عنصر از واژه انگلیسی به نام سودا گرفته شده است زیرا سودا در اکثر ترکیبات سدیمی وجود دارد. سود رختشویی (سدیم کربنات یا خاکستر سودا)، سدیم بیکربنات (جوش شیرین) و سدیم هیدروکسید (سود سوزآور) مثالهایی از ترکیبات سدیمی به شمار میروند. نماد (Na) از واژه یونانی برای عنصر ناتریوم مشتق گرفته شده است.

سدیم از کانیهای هالیت (نمک طعام یا سدیم کلرید، ) و ترونا [سدیم کربنات بیکربنات، ) و همچنین از آب دریا میتوان استخراج شود. ۶۰٪ نمکی که از این منابع به دست میآید به سدیم هیدروکسید،کلرید یا سدیم کربنات تبدیل میشود؛ ۲۰٪ نیز در صنعت غذا به عنوان ماده نگهدارنده مورد استفاده قرار میگیرد و ۲۰٪مابقی برای سایر کاربردها ازجمله ضدیخ برای جادهها استفاده میشود. همانطور که قبلا اشاره کردیم به دلیل واکنش پذیری بالای سدیم فلزی معمولا آنرا در زیر نفت یا انواع هیدروکربن مانند پارافین نگهداری میکنند.
معادله واکنش شیمیایی زیر واکنش سدیم با آب را واکنش میدهد. به این صورت که اگر مقدار کمی از سدیم را در ظرفی از آب بیندازیم بر روی سطح آب شروع به واکنش میدهد و آهسته ناپدید میشود. واکنش سدیم با آب از نوع واکنش جابجایی یگانه است که طی آن همانطور که در واکنش زیر نشان داده شده سدیم هیدروکسید را به وجود میآورد.
سدیم هیدروکسید در آب انحلالپذیر است و از این رو در آب حل میشود. این واکنش شیمیایی در صورتی که مقدار سدیم زیاد باشد میتواند بسیار خطرناک باشد. همچنین اگر دراین واکنش گرما هم وجود داشته باشد این گرما میتواند گاز هیدروژن را مشتعل کند. سدیم با گاز کلر هم نیز با سرعت بالایی واکنش میدهد و و سدیم کلرید را بهوجود میآورد. واکنش زیر ترکیب سدیم با گاز کلر را نشان میدهد.
در اثر این واکنش مقداری انرژی گرمایی آزاد میشود، به همین دلیل اغلب این واکنش را در شیشه آزمایشگاهی همراه با شن انجام میدهند تا این انرژی گرمایی آزاد شده باعث ترک خوردن ظرف آزمایشگاهی نشود.
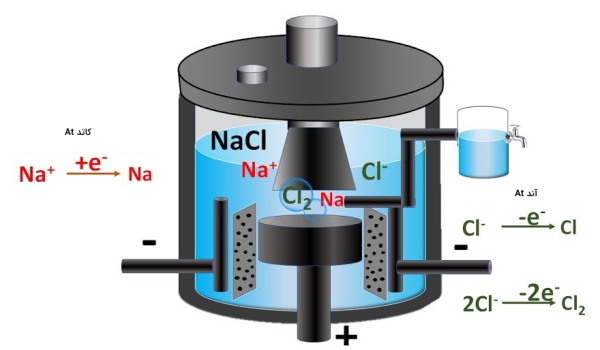
یون سدیم در بدن فشار اسمزی و فشار خون را تنظیم میکند و یونهای سدیم و پتاسیم در کنار هم نقش مهمی را در محرکهای عصبی دارند. یکی از مهمترین ترکیبات سدیم، سدیم کلرید است که به عنوان نمک طعام نیز شناخته میشود. سدیم کلرید برای مصارف تجاری از کانی هالیت، از رسوبات تشکیل شده از باستان یا آب خشک شده دریاها، یا همچنین تبخیر آب دریا تهیه میشود. این نمک در دستگاهی به نام «سلول داونز» (Dawns cell) میتواند الکترولیز شود و سدیم فلزی و گازکلر را به وجود بیاورد. طراحی این سلول به گونهاست که گاز کلر و سدیم فلزی به وجود آمده از واکنش تجزیه با هم ترکیب نمیشوند یعنی از هم جدا نگه داشته میشوند.
تصویر زیر شکل سلول داونز را برای جداسازی سدیم فلزی از کلر از مذاب سدیم کلرید با استفاده از الکترولیز نشان میدهد.
سدیم کربنات که به عنون سودا یا خاکستر سودا شناخته میشود قرنهای بسیاری است که در شستشوی لباسها به کار میرود (این ترکیب در شستشوی لباس کمک میکند که کاتیونهای فلزات باردار مانند منگنز و کلسیم از آب سخت حذف شوند). همچنین از سدیم کربنات در ساخت ظروف شیشهای، کاغذ و پاک کننده های غیر صابونی مورد استفاده قرار می گیرد. سدیم هیدروکسید که به عنوان سود سوزآور یا قلیاب - آبی که از باقیمانده خاکستر چوب به وجود میآید- شناخته میشود یک باز قوی است که در زمینههایی همچون تخلیه فاضلابها و پاککنندههای غیرصابونی نیز مورد استفاده قرار میگیرد. سدیم بیکربنات یا سدیم هیدروژن کربنات یک جزء اصلی در جوش شیرین به شمار میرود و به عنوان مخمر (خمیر مایه) در تهیه نان و سایر محصولات شیرینیپزی به کار میرود.
پتاسیم (K، Z = 19)
پتاسیم همانند سایر عناصر گروه یک جدول تناوبی که تا این قسمت ذکر شد فلزی براق و نرم است اما نسبت به لیتیم و سدیم با شدت بسیار بیشتری با آب واکنش میدهد. این فلز هم اگر در معرض اکسیژن قرار بگیرد شفافیت خود را از دست میدهد و کدر میشود. نام عنصر پتاسیم از کلمه انگلیسی (Potash) برای پتاسیم کربنات، ترکیبی که در غلظت بالا در خاکسترهای چوبی یافت میشود گرفته شده است. نماد K برای پتاسیم از نام لاتین برای عنصر «کالیم» مشتق گرفته شده است. پتاسیم از لحاظ فراوانی عنصر در پوسته زمین در مرتبه هشتم قرار دارد که این مقدار برابر ۲/۱٪ است.
ازجمله سنگهای معدنی به عنوان منبع عنصر پتاسیم، میتوان به سیلویت [پتاسیم کلرید، ]، کارنالیت [] و آلونیت [] اشاره کرد.
پتاسیم برای رشد گیاه ضروری است و به مقدار زیادی در کودها به کار میرود. در بدن، پتاسیم نقش بسیار مهمی را برای انقباض بافتهای ماهیچهای ایفا میکند. همانطور که در قسمت بالا اشاره کردیم حرکت یونهای سدیم و پتاسیم در سلولهای عصبی نقش مهمی را در محرکهای عصبی ایفا میکنند. زمانی که نمکهای پتاسیم گرم میشوند رنگ آنها به بنفش تغییر پیدا میکند به همین دلیل در آتشبازی نیز مورد استفاده قرار میگیرند.

پتاسیم همانند سدیم در زیر نفت یا ترکیبات هیدروکربنی نگهداری میشود؛ همچنین این عنصر میتواند در هوای خشک با اکسیژن ترکیب شود و را بهوجود بیاورد. همانند سدیم پتاسیم با آب واکنش میدهد و پتاسیم هیدروکسید و گاز هیدروژن را به وجود میآورد. در اثر این واکنش نیز مقداری انرژی آزاد میشود که اغلب سبب مشتعل شدن گار هیدروژن میشود.
تعداد ترکیبات پتاسیم کلرید بسیار متعدد است و ازجمله آنها میتوان به پتاسیم کلرید اشاره کرد. پتاسیم کلرید در جایگزینهای نمک مورد استفاده قرار میگیرد (به عنوان مثال با سدیم کلرید برای تغییر دادن طعم آن ترکیب میشود.). پتاسیم کربنات که به عنوان پتاس شناخته میشود در ساخت ظروف شیشهای استفاده میشود.
پتاسیم هیدروکسید که با نام سود سوزآور شناخته میشود در ساخت صابونها و پاککنندههای صابونی مورد استفاده قرار میگیرد. یکی دیگر از ترکیبات پتاسیمی، پتاسیم نیترات است که ازجمله اکسیدکنندههای قوی به شمار می رود و در پودر باروت استفاده میشود. در کنار پتاسیم نیترات، پتاسیم کلرات نیز یکی از اکسیدکنندههای بسیار قوی به شمار میرود که در کبریت و آتشبازی مورد استفاده قرار میگیرد. پتاسیم سوپراکسید با کربن دیاکسید واکنش میدهد تا پتاسیم کربنات و گاز اکسیژن را به وجود آورد. این ترکیب در دستگاههای تنفسی برای تولید اکسیژن، در معادن، زیردریایی و فضاپیماها کاربرد دارد.
روبیدیم (Rb، Z= ۳۷)
این عنصر نیز فلزی نرم و سفید است و همانند سدیم و پتاسیم با آب واکنش میدهد؛ با این تفاوت که در اثر این واکنش، گرمای بسیار بیشتری را در مقایسه با سدیم و پتاسیم آزاد میکند زیرا واکنشپذیری آن بالاتر است. نام این عنصر از یک واژه لاتین به نام «یاقوت سرخ» (Rubidius) گرفته شده است. مقداری که این عنصر در پوسته زمین قرار دارد برابر ۹۰ ppm است و از لحاظ مقدار فراوانی مرتبه بیست و دوم را دارد. این عنصر در هیچ یک از سنگهای معدنی وجود ندارد. اما به مقدار ناچیزی در لپیدولیت، پلوسیت، کارنالیت، زینوالدیت و لیوسیت یافت میشود.

نقطه ذوب روبیدیم ۳۹ درجه سانتیگراد (۱۰۲ فارنهایت) است و روبیدیم فلزی به طور خودبهخودی در هوا میسوزد. در تستهای شعله، نمکهای روبیدیم رنگ بنفش مایل به قرمز را به وجود میآورند و به همین دلیل گاهی اوقات در آتش بازی مورد استفاده قرار میگیرند. این عنصر در ساخت لولههای خلا، لولههای پرتو کاتدی (CRTs) و در برخی از ساعتهای اتمی نیز استفاده میشود.
سزیم (Cz, Z= ۸۷)
عنصر سزیم ششمین عنصر از گروه یک جدول تناوبی است که که رنگ آن نقرهای - طلایی است و در دمای ۲۸ درجه سانتیگراد (۸۲ فارنهایت) ذوب میشود. این جمله بدین معناست که عنصر سزیم با حرارت دست هم میتواند ذوب شود البته لازم به ذکر است که اینکار برای دست انسان خظرناک است. سزیم همانند سایر فلزات قلیایی با آب واکنش میدهد اما انرژی آزاد شده در اثر این واکنش بسیار بیشتر است زیرا اتمهای سزیم بزرگ هستند و و اثر هسته بر روی الکترون خارجی ضعیف است؛ بنابراین الکترون را به راحتی از دست میدهد و واکنش پذیری آن بالاتر میرود. در اثر این واکنش نیز گرمای بسیار زیادی آزاد میشود.
نام این عنصر از یک واژه لاتین به نام «سزیوس» که به معنی « آسمان آبی» است گرفته شده است. دلیل نامگذاری این عنصر به ای نام این است که نمک سزیوم زمانی که حرارت میبیند رنگ آن آبی میشود. غلظت سزیوم در پوسته زمین برابر ۳ ppm است که رتبه این عنصر را از لحاظ فراوانی به ۴۶امین عنصر میرساند. سنگ معدنی اصلی این عنصر پلوسیت است. زمانی که حضور مقادیر ناچیزی از روبیدیم در منبع سزیم وجود داشته باشد تصفیه سزیم خالص سخت تر میشود زیرا از لحاظ شیمایی شباهت بسیار زیادی به روبیدیم دارد به همین دلیل جداسازی آن از روبیدیم کاری دشوار خواهد بود.

به دلیل اینکه سزیم واکنشپذیری بالایی دارد به عنوان «جاذب» یا « گیرنده» برای جذب ناخالصیها از گازهای موجود در محفظههای خلا، لولههای پرتو کاتدی و لولههای خلا مور استفاده قرار میگیرد. برخی از نمکهای سزیوم زمانی که در معرض اشعه ایکس یا گاما قرار میگیرند از خود نوری را ساطع میکنند. همچنین این ترکیبات در سلولهای فوتوالکتریکی و ساعتهای اتمی مورد استفاده قرار میگیرد.
رادیواکتیو است و در اسلحههای هستهای و نیروگاههای هستهای کاربرد دارد. در سال ۱۹۸۶ انفجار در نیروگاه چرنوبیل منجر به آزادسازی مقدار زیادی شد. این موضوع باعث شد که آلودگی بسیاری به اروپای غربی وارد شود. نیمهعمری برابر ۳۰ سال دارد که تحت واپاشی بتا یک ایزوتوپ ناپایدار باریوم با نیمه عمر برابر ۶/۲ دقیقه را تولید میکند که پرتو یا همان اشعه گاما را برای تولید باریم حالت پایه پایدار () از خود ساطع میکند. از آنجا که یونهای سزیوم بسیار سنگین هستند، تحقیقاتی را بر روی کاربرد سزیوم در رانشهای یونی در فضاپیماها و ماهوارهها صورت گرفته است.
فرانسیم (F, Z= ۸۷) ، آخرین عنصر از گروه یک جدول تناوبی
عنصر فرانسیم فلزی کمیاب با خاصیت رادیواکتیوی است. نام آن مربوط به کشور فرانسه است زیرا فرانسه کشوری بود که برای اولین بار این عنصر را کشف کرد. این عنصر در پوسته زمین در مقادیر ناچیزی وجود دارد و یکی از عناصری است که فراوانی آن در زمین بسیار کم است به طوریکه تنها ۲۰ الی ۳۰ گرم از فرانسیوم طبیعی در کل زمین وجود دارد. مقادیر ناچیزی از این عنصر در سنگ اورانیوم وجود دارد جایی که تحت واپاشی پیاپی به وجود میآید.

همه ایزوتوپهای فرانسیم رادیواکتیو هستند و اکثر آنها نیمه عمری کمتر از پنج دقیقه را دارند. ایزوتوپ تنها ایزوتوپ این عنصر است که طولانیترین عمر را دارد و طول عمر آن برابر ۲۱/۸ دقیقه است. احتمال وجود فرانسیم توسط مندلیف به دلیل فضای خالی که در جدول تناوبی قرار داده بود پیشبینی شد. اما این عنصر تا سال ۱۹۳۹ کشف نشده بود تا اینکه مارگاریت پیری، دستیار ماری کوری در موسسه رادیوم در پاریس این عنصر را کشف کرد.
خواص گروه یک جدول تناوبی
گروه یک جدول تناوبی خواص فیزیکی و شیمیایی منحصر به فردی دارد که در ادامه به هر یک از آنها میپردازیم:
خواص فیزیکی
فلزات قلیایی رسانایی الکتریکی و حرارتی بالایی دارند، از ظاهری براق برخورارند، چکشخوار هستند و قابلیت تغییر شکل دارند. هر اتم فلز قلیایی در لایه ظرفیت خود یک الکترون دارد که این الکترون، پیوند بسیار ضعیفی در مقایسه با الکترونهای داخلی دارد. در نتیجه فلزات قلیایی زمانی که با نافلزات پیوند برقرار میکنند تمایل به از دست دادن این الکترون دارند. به عبارتی در اثر ایجاد پیوند میان فلزات گروه یک جدول تناوبی با نافلزات، فلزات قلیایی یک الکترون ظرفیت از دست میدهند و به یون یک بار مثبت تبدیل میشوند.
ترکیبات حاصل از این پیوند بلورهای مستحمی با نقطه جوش بالایی هستند که اجزا در این ترکیبات توسط پیوند یونی به هم متصل شدهاند (این نیرو حاصل نیروی جاذبه بین بارهای الکتریکی مثبت و منفی است). اگر سایر عناصر فلزی با فلزات قلیایی به صورت فلزی یا به صورت آلیاژی ترکیب شده باشند الکترونهای ظرفیت در اثر برهمکنش با هم به گونهای در کنار هم قرار میگیرند تا یک لایه طرفیت نیمهپر تحرک ایجاد شود.
مانند سایر فلزات این نوار ظرفیت نیمهپر نوار مربوط به رسانایی است و باعث می شود تا خواص فلزی همچنان حفظ شود. از لیتیم تا فرانسیم وابستگی الکترون آزاد به هسته در لایه ظرفیت کاهش پیدا میکند. بنابراین در گروه مربوط به فلزات قلیایی از بالا به پایین الکترون راحتتر از دست میرود یعنی انرژی لازم برای از دست دادن الکترون لایه ظرفیت پتاسیم در مقایسه با سدیم کمتر خواهد بود؛ به این انرژی، انرژی یونش گفته میشود. به همین دلیل است که در گروه از بالا به پایین انرژی یونش کم میشود. به طور کلی در جدول تناوبی با توجه به قانون دورهای عنصرها، عناصری که در سمت چپ و پایین جدول تناوبی قرار گرفتهاند کمترین انرژی یونش را دارند. انرژی یونش در فلزات قلیایی برای عنصر سزیم برابر ۱۲۴/۳کیلوکالری بر مول، تا ۸۹/۷ کیلوگرم بر مول برای لیتیوم (نادیده گرفتن عنصر رادیواکیتو فرانسیم) میتواند متغیر باشد.
در تصویر زیر روند تغییرات برخی از خواص فلزات قلیایی و به طور کلی همه عناصر در گروه و دوره آورده شده است.
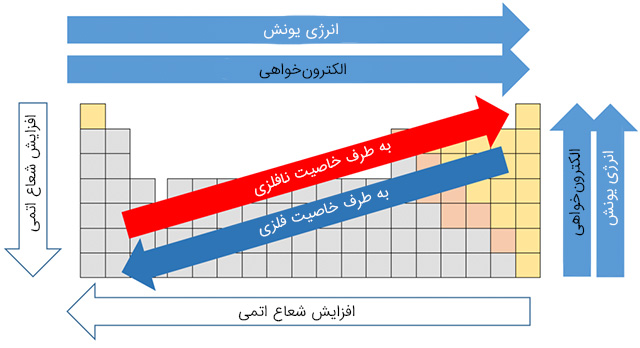
مقیاس الکترونگاتیوی عنصرها بیانگر توانایی آنهادر جذب الکترون است. در جدول تناوبی محدوده الکترونگاتیوی از ۰/۷ برای سزیم تا حداکثر ۴،۰ برای فلوئور است. یعنی سزیم کمترین و فلوئور بیشترین الکترونگاتیوی را در جدول تناوبی دارد. معمولا محدوده الکترونگاتیوی فلزات اغلب کمتر از ۲ است و فلزات گروه یک جدول تناوبی فلزاتی هستند که کمترین الکترونگاتیوی را دارند که مقدار از آن بین ۰/۷ تا ۱ است. دلیل این موضوع بخاطر این است که تمایل فلزات قلیایی تمایل به از دست دادن الکترون است و نه گرفتن الکترون! به همین دلیل الکترونگاتیوی کمی در بین عناصر جدول تناوبی دارند. به طور کلی بر اساس قانون دورهای عنصرها سمت چپ جدول تناوبی عناصری با الکترونگاتیو کمی قرار دارند. همانطور که در شکل فوق نشان داده شده است الکترونگاتیوی در دروه از چپ به راست افزایش پیدا میکند.
فلزات قلیایی در فشار اتمسفری در آرایش بلوری مکعبی (یک آرایش استاندارد برای اتمها در بلورها) با عدد همسایگی ۸ قرار دارند. نزدیکترین فاصله بین اتمها به عنوان یکی از ویژگیهای مهم بلورها، با افزایش جرم اتمی افزایش پیدا میکند. نظم آرایش اتم در بلورهای فلزی گروه یک جدول تناوبی نسبت به سایر بلورهای فلزی کمتر است. همچنین در سزیم فاصله بین اتمها از سایر فلزات بیشتر است و دلیل این امر بالا بودن جرم اتمی سزیم است.
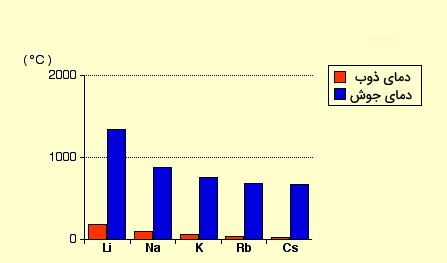
فشار بخار در فلزات قلیایی با افزایش جرم اتمی افزایش پیدا میکند. سزیم در بین فلزات قلیایی با دمای جوش ۶۷۱ درجه سانتیگراد (۱۲۴۰ فارنهایت) به عنوان عنصری بسیار فرار شناخته میشود. دمای جوش فلزات قلیایی با افزایش عدد اتمی با یک ترند خاص کاهش پیدا میکند. بنابراین در گروه یک جدول تناوبی عنصر لیتیم با دمای جوش ۱۳۱۷ درجه سانتیگراد (۲۴۰۳ فارنهایت) بیشترین نقطه جوش را دارد.
دمای ذوب فلزات قلیایی به عنوان گروهی از جدول تناوبی از سایر عناصر غیرگازی کمتر است و محدوده آن در بین دماهای ۱۷۹ درجه سانتیگراد (۳۵۴ فارنهایت) برای لیتیم و ۲۸/۵ درجه سانتیگراد (۸۳/۳ فارنهایت) برای سزیم است. از میان فلزات قلیایی تنها جیوه است که با دمای ذوب ۳۸/۹- درجه سانتیگراد (۳۸/۰۲- فارنهایت) کمتر از سزیم است. پایین بودن نقطه ذوب برای فلزات قلیایی ارتباط مستقیمی با بزرگ بودن فاصله بیناتمی در بلورهای آنها دارد و انرژی پیوند نیز با آرایش نامنظم و سست بودن پیوندها ارتباط مستقیمی نیز دارد. همین عامل علتی برای چگالی پایین، انرژی کم برای همجوشی و تغییرات کم حجمی به هنگام همجوشی فلزات است. لیتیوم، سدیم و پتاسیم چگالی کمتری از آب دارند.
بزرگ بودن اتم فلز قلیایی (در نتیجه چگالی پایین فلز) باعث میشود تنها یک الکترون با وابستگی کم به هسته در اوربیتال نوع S حضور داشته باشد. بر اساس حالت آرایش الکترونی گازهای نجیب مانند آرگون (با عدد اتمی ۱۸) تا عنصر پتاسیم (با عدد اتمی ۱۹) الکترونهای اضافه شده در اثر افزایش عدد اتمی به جای قرار گرفتن در اروبیتال کوچک 3p در اوربیتال بزرگ 4s قرار میگیرند. علاوه بر این خواص فیزیکی، در صورتی که فلزات پتاسیم، روبیدیم یا سزیم اگر در معرض فشار بالایی قرار بگیرند (بالای ۰/۵ میلیون اتمسفر یا بیشتر ) در آنها تغییر فاز رخ میدهد. در نهایت الکترونها اوربیتالهای d را به جای اوربیتاهای s برای قرار گرفتن ترجیح میدهند. بنابراین دراین حالت فلزات قلیایی به فلزات واسطه تبدیل میشوند.
فلزات قلیایی نقش مهمی را در فیزیک کوانتوم ایفا میکنند. برخی از ایزوتوپهای فلزات قلیایی مانند روبیدیم -۸۷ بوزون هستند. گازهای اتمی رقیق که حاصل ایزوتوپهای این چنین فلزات قلیایی هستند توسط میدانهای مغناطیسی یا آینههای لیزری محصور میشوند و میعانات بوز -اینشتین را تشکیل میدهند. در این حالت خوشههای اتمی در حالت تک کوانتوم هستند و رفتارهای ماکروسکوپی را از خود نشان میدهند که به طور طبیعی فقط در ذراتی با اندازه اتمی این پدیده رخ میدهد. این موضوع به خاطر اثر تداخلی و حرکت منسجم کل «ابر» در اتمهاست.
خواص شیمیایی
از آنجا که فلزات قلیایی الکتروپوزیتیو هستند (حداقل مقدار الکترونگاتیوی) با تعداد بسیاری از نانوفلزات واکنش میدهند. از نظر واکنش شیمیایی، عنصر لیتیم بیشتر از اینکه به فلزات همگروه خود شباهت داشته باشد به فلزات قلیایی خاکی یعنی گروه دوم جدول تناوبی شباهت دارد. واکنشپذیری لیتیم با آب، اکسیژن و هالوژنها نسبت به سایر فلزات قلیایی کمتر و با نیتروژن، کربن و هیدروژن بیشتر است.
واکنشهای گروه یک جدول تناوبی با اکسیژن
از آنجا که عدد اکسایش فلزات قلیایی ۱+ است، این فلزات تمایل به ایجاد بلورهای جامد یونی دارند. بنابراین، ترکیب بین فلزات قلیایی و اکسیژن (ترکیبات خنثی) میتواند بر اساس انواع گونههای اکسیژن که در واکنش شیمیایی شرکت کنند طبقهبندی شود. انواع گونههای یون اکسیژن شامل اکسید ، پراکسید ، سوپراکسید ، اوزنویید است. ترکیباتی که میتوانند با حضور فلزات قلیایی و اکسیژن به عنوان واکنشدهنده تشکیل شوند شامل مونواکسید ، پراکسید ، سوپراکسید (MO_2) و اوزنوئید (MO_3) هستند. روبیدیم و سزیم و البته پتاسیم سزکوئی اکسید را تشکیل میدهند که شامل دو آنیون پراکسید و یک سوپراکسید در هر فرمول شیمیایی است. لیتیم، تنها باعث تشکیل مونواکسید و پراکسید میشود.

لازم به ذکر است که همه فلزات قلیایی به طور مستقیم با اکسیژن واکنش میدهند؛ لیتیم و سدیم مونوکسید را تشکیل میدهند و و سنگینتر از فلزات قلیایی هستند که سوپراکسید تشکیل میدهند. نرخ واکنش فلزات قلیایی با اکسیژن یا با هوا به دو مورد زیر بستگی دراد:
- فلزات حالت فیزیکی جامد یا مایع داشته باشند.
- درجه مخلوط شدن با اکسیژن یا هوا
اگر فلز مایع باشد فلزات قلیایی میتوانند در هوا به راحتی مشتعل شوند، به مقدار زیادی گرما آزاد میکنند و دود یا بخار متراکم مربوط به اکسیژن را به وجود میآورند. انرژی آزاد (معیاری برای پایداری) اکسیدهای فلزات قلیایی در دمای ۲۵ درجه سانتیگراد (۷۷ کلوین) برابر ۱۳۳- کیلوکالری بر مول برای لیتیم اکسید تا ۶۳- کیلوکاری بر مول برای سزیم اکسید میتواند متغیر باشد. نزدیک بودن یون کوچک لیتیم به اتم اکسیژن باعث میشود هنگام تشکیل لیتیم اکسید مقدار انرژی بسیاری آزاد شود. پراکسیدهای لیتیم و سدیم میتوانند از طریق عبور اکسیژن از محلول آمونیای مایع فلزات قلیایی تشکیل شوند.
اگرچه سدیم پراکسید در تجارت توسط اکسیداسیون سدیم مونواکسید با اکسیژن تولید میشود. سدیم سوپراکسید میتواند با فشار بالای اکسیژن تشکیل شود در حالیکه که سوپراکسید روبیدیم، پتاسیم و سزیم میتوانند از طریق توسط سوختن در هوا تشکیل شوند. در مقابل، هیچ سوپراکسیدی به طور خالص برای لیتیم و همچنین برای کل فلزات قلیایی خاکی تشکیل نمیشود اگرچه گونههای سنگینتر آن در همان گروه قلیایی میتوانند به حالت پراکسید، اکسید شوند. سیانیدهای پتاسیم، روبیدیم و سزیوم که از پایداری کمی نسبت به سایر اکسیدها برخوردار هستند میتوانند توسط واکنش سوپراکسیدها با ازون به وجود آیند.
واکنشهای گروه یک جدول تناوبی با آب
همه فلزات قلیایی در مقادیر مختلفی از واکنشپذیری با توجه به درجه واکنشپذیری با آب واکنش میدهند. نرخ واکنش به درجه سطح فلزی که در معرض آب قرار دارد بستگی دارد. با قطرات کوچکی از فلز یا فیلمهای نازک فلز قلیایی واکنش میتوند حتی از نوع انفجاری باشد. نرخ واکنش آب با فلزات قلیایی با افزایش جرم اتمی افزایش پیدا میکند. با سنگینتر شدن فلزات قلیایی هیدروکسیدهایی به وجود میآید که انحلالپذیری بالایی در آب دارند؛ بنابراین آنها به راحتی از سطوح واکنشی حذف میشوند و این واکنش همچنان ادامه پیدا میکند.

واکنشی که شامل مخلوط مولی یکسانی از فلز قلیایی (یعنی تعداد اتم یا مولکولهای برابری داشته باشند) و آب باشد، طبق موازنه شیمیایی یک مول هیدروکسید فلزقلیایی و نیم مول گاز هیدروژن تشکیل میدهد.
این واکنشها به شدت گرماگیر هستند و هیدروژنی که در اثر این واکنش تشکیل میشود میتواند با اکسیژن واکنش دهد تا گرمای تولید شده را افزایش دهد.
واکنشهای گروه یک جدول تناوبی با نافلزات
شاید جالب باشد که بدانید از بین همه فلزات قلیایی تنها لیتیم است که با نیتروژن واکنش میدهد و ترکیب نیتریدی را به وجود میآورد . به این عبارت که در بین عناصر گروه یک جدول تناوبی تنها دو عنصر لیتیم و هیدروژن هستند که می توانند با نیتروژن واکنش دهند. درواقع لیتیم به فلزات قلیایی خاکی بیشتر از فلزات قلیایی شباهت دارد. لیتیم همچنین هیبرید پایداری است، درواقع سایر فلزات قلیایی هیبریدهایی را تشکیل میدهند که بیشتر واکنشپذیر هستند. لیتیم با کربن ترکیب کاربیدی را تشکیل میدهد در حالیکه سایر فلزات قلیایی کاربیدهای پایداری را تشکیل نمیدهند.
همچنین آنها با گرافیت که شکلی از کربن است واکنش میدهند تا ترکیبات بین لایهای را تشکیل دهند. (موادی که اتمهای فلزی در بین لایههای اتمهای کربن در ساختار گرافیتی قرار میگیرد). فلزات قلیایی در اتمسفر هالوژنها میتوانند بسوزند که در اینصورت هالیدها را تشکیل میدهند. این واکنش به شدت گرماده است به عنوان مثال لیتیم فلوئورید بیش از ۲۳۵ کیلوکالری بر مول انرژی آزاد میکند.
سوالات متداول در رابطه با گروه یک جدول تناوبی
در این قسمت برای اینکه گروه یک جدول تناوبی به خوبی در ذهنمان نقش ببندد سوالات مرتبط با آن به همراه پاسخ آورده شده است.
گروه یک جدول تناوبی چه نام دارد ؟
گروه یک جدول تناوبی شامل ۷ عنصر است که با نادیده گرفتن عنصر هیدروژن، ۶ عنصر فلزی دیگر باقی میماند که به آنها فلزات قلیایی میگویند. از آنجا که این فلزات در اثر واکنش با آب هیدورکسیدهایی را به وجود میآورند که خاصیت بازی یا قلیایی داند از اینرو نام آنها فلزات قلیایی است.
شباهت عنصر های یک گروه جدول تناوبی
ازجمله شباهتهای عناصر گروه یک جدول تناوبی میتوان به واکنشپذیری بالا، تمایل به از دست دادن الکترون، وجود یک الکترون در لایه ظرفیت، انرژی یونش پایین و برخی از ویژگیهای ظاهری مانند براقیت و رنگ نقرهای اشاره کرد.
روند قانون دورهای در گروه یک اصلی جدول تناوبی چیست؟
در گروه یک جدول تناوبی برای شعاع اتمی روند دورهای به این صورت است که از بالا به پایین افزایش پیدا میکند و به این صورت اثر پوششی الکترونهای درونی بیشتر میشود. به عبارتی جاذبه هته بر الکترون ظرفیت کمتر میشود و واکنشپذیری افزایش پیدا میکند. انرژی یونش، الکترونگاتیوی و الکترونخواهی نیز کاهش پیدا میکند.
ویژگی های گروه یک جدول تناوبی چیست ؟
هر گروه در جدول تناوبی از ویژگیهای منحصر به فرد خود برخوردار است که ازجمله ویژگیهای این گروه میتوان به واکنشپذیری بالا، عدم وجود در طبیعت به صورت آزاد، نگهداری در محلولهای روغنی مانند نفت، نقطه ذوب پایین، چگالی پایین نسبت به سایر فلزات، الکترونگاتیوی پایین، انرژی یونش پایین، واکنشپذیری بالا با هالوژنها، چکشخواری، نرم بودن آنها نسبت به سایر فلزات، قابلیت بالا در شکلپذیری، رسانایی الکتریکی و حرارتی بالا، بزرگترین شعاع اتمی در جدول تناوبی، رنگ نقرهای و کدر شدن آنها به هنگام قرارگیری در معرض اکسیژن یا رطوبت اشاره کرد.












