تغییر شیمیایی چیست؟ – به زبان ساده + تعریف، مثال و نشانه ها
بسیاری از مواد موجود در دنیا میتوانند دچار تغییر شود. این تغییرات میتوانند از نوع تغییر فیزیکی یا تغییر شیمیایی باشند. تغییر شیمیایی معمولا قابل برگشت نیست و باعث تغییر ساختار ماده و مولکول میشود. در صورتی که تغییر فیزیکی قابل برگشت است و ساختار ماده را تغییر نمیدهد.خواصی که ممکن است در اثر تغییر شیمیایی دچار تغییر شوند مواردی مانند دما، رنگ، بو، تشکیل رسوب یا آزاد شدن گاز طی فرایند هستند. به تغییر شیمیایی، واکنش شیمیایی نیز گفته میشود. در این مطلب از مجله فرادرس بررسی میکنیم تغییر شیمیایی چیست، چه ویژگیهایی دارد و روش شناسایی تغییر شیمیایی چیست.
- تعریف دقیق تغییر شیمیایی و ویژگیهای آن را فرا میگیرید.
- نشانههای اصلی و معیارهای تشخیص تغییر شیمیایی را یاد میگیرید.
- با مهمترین تفاوتهای تغییر شیمیایی و فیزیکی آشنا میشوید.
- نمونههای کاربردی تغییر شیمیایی در زندگی روزمره را میشناسید.
- با انواع واکنشهای شیمیایی و معادله آنها آشنا میشوید.
- خواص فیزیکی و شیمیایی مواد را بهدرستی از هم تمییز میدهید.


در ابتدای این مطلب میآموزیم تغییر شیمیایی چیست و ویژگیهای آن را بررسی میکنیم. سپس میآموزیم چگونه میتوان یک تغییر شیمیایی را تشخیص داد. سپس خواص، ویژگیها، انواع و کاربردهای این تغییر را میآموزیم. در انتهای متن به بررسی پرچالشترین سوال این موضوع یعنی بررسی حل شدن نمک در آب میپردازیم. با مطالعه این متن تا انتها، میتوانید به شکلی کامل بیاموزید تغییر شیمیایی چیست.
تغییر شیمیایی چیست؟
تغییر شیمیایی تغییری است که با آن ساختار و ترکیب ماده دچار تغییر شود. این تغییر نیاز به شکستن پیوندهای شیمیایی ماده و تشکیل پیوندهای جدید دارد. این فرایند باعث میشود ترتیب قرارگیری اتمها در ساختار مولکولی ماده تغییر کند در نتیجه ماده به وجود آمده پس از تغییر شیمیایی یک ماده جدید محسوب میشود و نوع ماده و ویژگیهای آن با ماده اولیه متفاوت خواهد بود.
مواد جدید به راحتی نمیتوانند به شکل اولیه خود بازگردند. این پیوندهای دستخوش تغییر شده از نوع بین اتمی هستند و میتوانند از نوع کووالانسی یا یونی باشند. در بیشتر تغییرهای شیمیایی تنها راه برگرداندن ماده تولید شده به شکل اولیه آن، انجام یک رشته تغییر شیمیایی جدید روی فرآورده است.
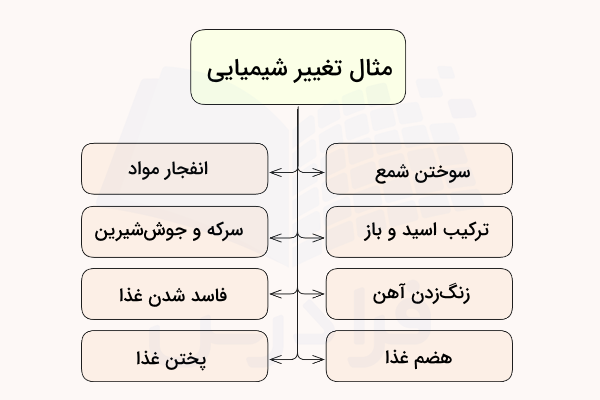
تغییرهای شیمیایی بخش جدانشدنی و مهمی از تکنولوژی، فرهنگ و نوع زندگی موجودات هستند. سوختن سوختهای مختلف، زنگ زدن آهن، ساخت شیشه، سوختن شمع، ساخت ظروف و ساخت پنیر از نمونههای وجود تغییر شیمیایی در زندگی روزمره انسانها هستند. برای مثال سوختن شمع یک تغییر شیمیایی است. پارافین شمع با اکسیژن هوا ترکیب شده و میسوزد و انرژی را به صورت گرما و نور آزاد میکند. همچنین بخار آب و کربن دی اکسید نیز از این فرایند به شکل گاز آزاد میشوند. در ادامه برخی از مثالهای تغییر شیمیایی معرفی شده است.
ویژگیهای تغییر شیمیایی چیست؟
برای فهم این موضوع که تغییر شیمیایی چیست باید به این نکته توجه کنیم که تغییر شیمیایی چند ویژگی مهم دارد که در ادامه به آنها اشاره کردهایم.
- در تغییر شیمیایی، مواد اولیه واکنش دهنده و فرآوردهها از لحاظ ترکیب شیمیایی با یکدیگر تفاوت دارند.
- در تغییر شیمیایی شاهد تغییر در فرآوردهها خواهیم بود. این تغییر میتواند آزاد شدن انرژی به صورت نور، گرما یا صدا باشد. همچنین تغییر در رنگ، بو، شکل و ظاهر مواد و تشکیل رسوب نیز از ویژگیهای تغییر شیمیایی است.
- تغییر شیمیایی قابل بازگشت نیست و نمیتوان فرآورده یک تغییر شیمیایی را به حالت اولیه برگرداند مگر اینکه فرآوردهها را دوباره تحت اثر واکنشهای شیمیایی دیگر تغییر دهیم.
یادگیری شیمی پایه هشتم با فرادرس
تغییرات شیمیایی و فیزیکی پایه فهم اصول واکنشهای شیمیایی متفاوت در فرایندهای آزمایشگاهی و طبیعی زندگی انسان هستند. برای فهم این موضوع که تغییرات فیزیکی و تغییر شیمیایی چیست ابتدا باید با مفاهیمی مانند اتم، عنصر، مولکول، پیوند شیمیایی کووالانسی و یونی، انحلال پذیری و غیره آشنا شوید. برای فهم و یادگیری این مفاهیم پیشنهاد میکنیم به مجموعه فیلم آموزش دروس پایه هشتم خصوصا آموزش علوم تجربی پایه هشتم، بخش شیمی مراجعه کنید که با زبانی ساده ولی کاربردی به آموزش این مطالب میپردازد.
همچنین با مراجعه به فیلمهای آموزشی فرادرس که لینک آنها در ادامه آورده شده است، میتوانید به آموزشهای بیشتری در زمینه تغییر فیزیکی و شیمیایی دسترسی داشته باشید.
- فیلم آموزش آشنایی با انواع تغییرات شیمیایی
- فیلم آموزش علوم تجربی پایه هشتم بخش شیمی
- فیلم آموزش مهندسی واکنشهای شیمیایی سینتیک و طراحی راکتور
تشخیص تغییر شیمیایی
گاهی وقتها مشکل میتوان حدس زد که ماده دچار تغییر شیمیایی شده است. برای تشخیص بهتر این موضوع که تغییر شیمیایی چیست، باید به عوامل شناسایی تغییر شیمیایی توجه کرد. این شناساییها از طریق بررسی دما، رنگ، بو، تشکیل رسوب و یا آزاد شدن گاز هستند. در ادامه لیستی از نشانههای تغییر شیمیایی ارائه شده است.
- تغییر دما
- تغییر رنگ
- تغییر بو
- تغییر شکل
- تشکیل رسوب
- آزاد شدن گاز

تغییر دما
در تغییرات شیمیایی، یک تغییر در دما به دلیل شکسته شدن پیوندهای شیمیایی و ایجاد پیوندهای جدید اتفاق میافتد. هنگامی که پیوندهای شیمیایی مواد واکنش دهنده میشکنند، گاهی وقتها انرژی به صورت گرما آزاد میشود و این باعث افزایش دما میشود. همچنین گاهی وقتها برعکس این موضوع اتفاق میافتد. به این صورت که شکستن پیوندهای شیمیایی ممکن است به انرژی نیاز داشته باشد و این انرژی توسط واکنش از محیط به صورت گرما دریافت شود. این پدیده باعث کاهش دمای محیط میشود. در اصطلاح به واکنشهایی که از محیط گرما میگیرند، فرایندهای گرماگیر و به واکنشهایی که گرما را آزاد میکنند واکنش گرماده میگویند.

برای مثال واکنش سوختن چوب یک واکنش شیمیایی گرماده است. در مواردی که تغییر دما محسوس نیست، تغییر دمای ایجاد شده توسط تغییر شیمیایی را میتوان با قرار دادن یک دماسنج داخل ظرف آزمایش اندازهگیری کرد. پس یکی از راههای شناسایی اینکه تغییر شیمیایی چیست، بررسی دمای واکنش است.
تغییر رنگ
تغییر رنگ مواد میتواند یکی از نشانههای تغییر شیمیایی باشد. گاهی وقتها ترکیبات برخی از مواد رنگی هستند و به دلیل شکسته شدن پیوندهای واکنشدهندهها و ایجاد مواد جدید این تغییر رنگ ممکن است اتفاق بیافتد. برای مثال زنگ آهنی که روی سطوح فلزی تشکیل میشود، باعث تغییر رنگ آنها به رنگ قرمز است. این تغییر رنگ به دلیل به وجود آمدن اکسید آهن است که یک تغییر شیمیایی محسوب میشود. به تغییر رنگ در اثر تغییر شیمیایی، تغییر ماکروسکوپی نیز میگویند زیرا با چشم غیرمسلح قابل تشخیص است. ایجاد رنگ سبز در اثر زنگ زدن فلز مس نیز یکی از این تغییرات است. باید دقت داشت که حتما تغییر رنگ در اثر تغییر شیمیایی باشد. گاهی وقتها صرفا ترکیب دو ماده رنگی و ایجاد رنگ جدید تغییر شیمیایی در نظر گرفته میشود در صورتی که ممکن است اشتباه باشد.
واکنش ایجاد زنگ آهن در ادامه آورده شده است.

تغییر بو
تغییر بو نیز یکی از ویژگیهایی است که به تغییر ساختار مولکولی مواد مربوط است. اگر در طی یک تغییر شیمیایی مادهای تولید شود که بوی خاصی داشته باشد، تغییر بو میتواند یکی از راههای تشخیص تغییر شیمیایی باشد. یکی از مثالهای واضح تغییر بو در اثر تغییر شیمیایی، بوی غذای فاسد است. انتشار بو در اثر انتشار مولکولهای ماده در هوا صورت میگیرد. برای مثال در فرایند فاسد شدن تخم مرغ، انتشار بوی بد به دلیل تشکیل و انتشار گوگرد دی اکسید است.

تشکیل رسوب
یکی دیگر از نشانههای تغییر شیمیایی میتواند تشکیل رسوب باشد. تشکیل رسوب زمانی اتفاق میافتد که از ترکیب دو محلول مایع یک جامد غیر قابل حل ایجاد میشود. به جامد ایجاد شده رسوب گفته میشود. تشکیل یک ماده جامد جدید از دو محلول مایع، نشان دهنده تغییر در ساختار مواد و تغییر شیمیایی است.
آزاد شدن گاز
آزاد شدن گاز از ترکیب دو ماده که شامل گاز نبودهاند، نشان دهنده ایجاد یک محصول جدید در فرایند تغییر شیمیایی است. برای مثال، مخلوط کردن سرکه و جوش شیرین (استیک اسید و سدیم بیکربنات) باعث آزاد شدن گاز و ایجاد کف میشود. گاز آزاد شده در این واکنش کربن دیاکسیدی است که به وجود امده است. مثال دیگری از این تغییرات شیمیایی، واکنش فلزات با اسیدها است که گاز هیدروژن آزاد میکند. باید دقت داشت که تغییر فاز ماده از مایع و جامد به گاز یک تغییر فیزیکی است و نه یک تغییر شیمیایی. بخارات حاصل از تغییرهای فیزیکی از همان نوع ماده تبخیر یا تصعید شده هستند. اما در تغییر شیمیایی گاز مشاهده شده از نوع ماده ای جدید است.

در نهایت باید اشاره کنیم مهمترین روش تشخیص تغییر شیمیایی این است که به راحتی نمیتوان ماده تولید شده را به ماده اولیه تبدیل کرد. این درحالی است که در مورد تغییرات فیزیکی، واکنشها اغلب برگشت پذیر هستند.
مثال های تغییر شیمیایی
هر واکنش شیمیایی خود نشاندهنده یک تغییر شیمیایی است. برخی از تغییرات شیمیایی رایج و مهم در ادامه آورده شده است.
- ترکیب سرکه و جوش شیرین
- ترکیب اسید و باز
- پختن تخم مرغ و مواد خوراکی
- سوختن شمع، کاغذ، چوب
- زنگ زدن آهن
- فاسد شدن مواد خوراکی
- هضم غذا
- مصرف شدن باتریهای شیمیایی
- فرایندهای متابولیک بدن
- انفجار مواد محترقه
- روشن کردن کبریت
در مقابل هر تغییری که باعث تغییر خواص ماده نشود مانند تبخیر و ذوب و تصعید، از نوع واکنش فیزیکی هستند. از نمونههای دیگر تغییر شیمیایی میتوان به آبکاری فلزات، ترش شدن شیر، فتوسنتز گیاهان، رنگکردن مو، تغییر رنگ برگ درختان و از بین بردن لکهها با وایتکس اشاره کرد.
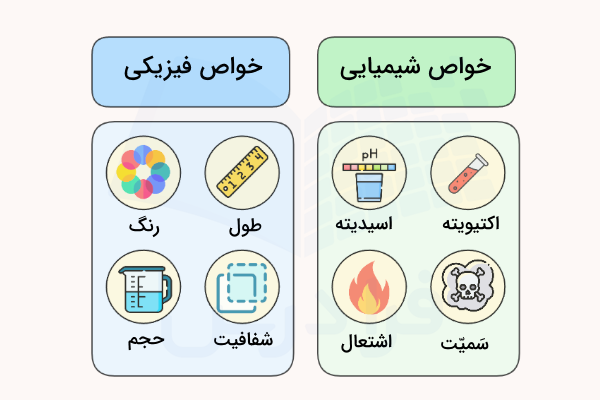
خواص فیزیکی و شیمیایی
پیشتر اشاره کردیم که تغییر شیمیایی شامل تغییر خواص شیمیایی مواد و تغییر فیزیکی شامل تغییر خواص فیزیکی مواد است. خواص شیمیایی مواد خواصی هستند که تنها با رخ دادن واکنشهای شیمیایی میتوان آنها را مشاهده کرد. در حالی که برای مشاهده و اندازهگیری خواص فیزیکی یک ماده نیازی به صورت گرفتن یک واکنش شیمیایی نیست.
خواص شیمیایی مواد
در ادامه برای بررسی بهتر اینکه تغییر شیمیایی چیست، برخی از خواص شیمیایی ترکیبات را نام میبریم.
- اشتعال پذیری مواد
- سمیت مواد
- آنتالپی تولید
- انرژی گرمایی سوختن
- عدد یا مرتبه اکسایش
- pH
- نیمه عمر
- عدد کئوردینانسیون
- کشش سطحی
- واکنش پذیری
خواص فیزیکی مواد
خواص فیزیکی مواد معمولا بدون نیاز به شکل گرفتن واکنش شیمیایی اندازهگیری میشوند. در ادامه برخی از خواص فیزیکی مواد نام برده شدهاند.
از دیگر خواص فیزیکی مواد میتوان به انعکاس پذیری، خاصیت ارتجاعی، انحلال پذیری، سختی، بار الکتریکی و ... اشاره کرد.
انواع تغییر شیمیایی چیست؟
شیمیدانها سه دستهبندی کلی برای تغییرهای شیمیایی در نظر گرفتهاند. این دستهبندیها تغییر شیمیایی معدنی، تغییر شیمیایی آلی و تغییر بیوشیمیایی هستند. در ادامه این موارد را توضیح میدهیم.

تغییرات شیمیایی معدنی
این تغییرات واکنشهای شیمیایی هستند که معولا شامل اتم کربن نیستند. از مثالهای این تغییرها میتوان به مخلوط کردن اسیدها و بازهای معدنی، اکسیداسیون ترکیبات معدنی و واکنشهای اکسایش کاهش اشاره کرد. در ادامه برخی از مثالهای تغییر شیمیایی معدنی آورده شده است.
- زنگ زدن آهن
- واکنشهای اسید و باز
- واکنشهای اکسایش و کاهش
- واکنشهای سلول الکتروشیمیایی
- تولید آمونیاک با فرایند هابر
- انفجار مواد محترقه

تغییر شیمیایی آلی
این تغییرات، واکنشهای شیمیایی هستند که شامل مواد آلی (هیدروژن و کربن) هستند. از این واکنشهای آلی میتوان به پلیمریزاسیون، متیلاسیون و هالوژناسیون ترکیبات آلی اشاره کرد. از مهمترین و رایج ترین تغییرات شیمیایی آلی (واکنش آلی) میتوان به فرایند سوختن گاز طبیعی اشاره کرد. گاز طبیعی درواقع همان متان است که به عنوان گاز شهری استفاده میشود. در این فرایند متان با اکسیژن وارد واکنش شده و کربن دی اکسید و آب تولید میکند. از گرمای آزاد شده توسط این فرایند گرماده برای پخت غذا و سایر موارد استفاده میشود.
مثالی دیگر از تغییر شیمیایی آلی فرایند فاسد شدن میوهها است. این فراین که شامل تغییرات بسیاری است، یک تغییر شیمیایی به شمار میرود. میوهها شامل مادهای به نام اتیلن هستند. با فاسد شدن میوهها، میزان اتیلن آنها افزایش مییابد. این فرایند باعث آزاد شدن آنزیمهای زیادی میشود که مسئول تغییر شیمیایی میوهها هستند که باعث نرم شدن، تغییر رنگ به دلیل شکسته شدن کلروفیل و تولید ترکیبات و گازهای با بوی خاص میشود. در ادامه برای توضیح این موضوع که تغییر شیمیایی چیست، لیستی از تغییر شیمیایی مواد آلی آورده شده است.
- تولید بنزین از فرآوردههای نفتی
- تولید نایلون و بسیاری از پلیمرها
- سنتز داروی آسپرین
- فرایندهای شامل پخت غذا
- آلودگی زدایی با صابون و دیگر شویندهها

تغییرات بیوشیمیایی
این تغییران شیمیایی بیولوژیک در ارگانیسمهای زنده صورت میگیرند. این واکنشها توسط آنزیمها و هورمونها کنترل میشوند. از مثالهای تغییر بیوشیمیایی میتوان به فوتوسنتز و فرایندهای تنفس اشاره کرد. در ادامه لیستی از نمونههای تغییر بیوشیمیایی آورده شده است.
- فرایند هضم غذا
- فوتوسنتز
- تنفس سلولی
- تغییر رنگ برگ گیاهان

تفاوت تغییر فیزیکی و تغییر شیمیایی
برای شناخت انواع واکنشها و پیشبینی فرآوردههای آنها نیاز است که بدانیم فرق تغییر فیزیکی و شیمیایی چیست. تغییر فیزیکی شامل تغییر حالت مواد (جامد مایع و گاز) به یکدیگر و یا فرایند حل شدن و مخلوط شدن مواد با یکدیگر است بدون اینکه ساختار آنها تغییر کند. برای مثال فرایند ذوب شدن یخ و تبدیل آن به آب یک تغییر فیزیکی است. در فرایندهای تغییر فیزیکی اگر انرژی به صورت گرما یا صدا یا جریان الکتریسیته صرف شود، تنها برای تغییر حالت مواد یا انحلال است.
برای مثال فرایند حل شدن شکر در آب یک تغییر فیزیکی است که با حرارت دادن تسریع میشود. همچنین فرایند ذوب شدن کره نیز یک تغییر فیزیکی است که با جذب دما انجام میگیرد. در این فرایندها نوع ماده (آب، نمک و کره) تغییری نکرده است و تنها حالت آنها تغییر کرده است. در واقع در فرایندهای فیزیکی تنها خواص فیزیکی مواد تغییر میکند و خواص شیمیایی آنها ثابت باقی میماند. این فرایندها برگشتپذیر هستند. کره را میتوان دوباه منجمد کرد و در محلول آب نمک با حرارت دادن و تبخیر آب، بلورهای نمک دوباره به صورت جامد ته نشین میشوند.
از طرف دیگر در بررسی این موضوع که تغییر شیمیایی چیست آموختیم فرایندهای تغییر شیمیایی (واکنشهای شیمیایی)، فرایندهایی هستند که ساختار مواد در آنها تغییر میکند. انرژی صرف شده یا آزاد شده در این فرایندها صرف شکستن پیوندهای شیمیایی ماده اصلی و تولید پیوندهای شیمیایی ماده جدید میشود. مثلا در فرایند سوختن نان، خواص شیمیایی آن مانند بو و مزه و رنگ تغییر میکنند. همچنین این فرایندها قابل برگشت نیستند. برای مثال نمیتوان نان سوخته را به حالت قبل برگرداند و ساختار آن تغییر میکند. در این فرایند مواد جدیدی تشکیل میشوند که شامل کربن هستند و قسمت سیاه شده و سوخته را تشکیل میدهند.

واکنش شیمیایی چیست؟
پیشتر اشاره کردیم که یک تغییر شیمیایی با تغییر خواص شیمیایی مواد همراه است. در واقع طی یک تغییر شیمیایی برای مواد، یک واکنش شیمیایی رخ داده است. واکنش شیمیایی فرایندی است که در آن یک یا تعداد بیشتری ماده (واکنش دهنده) به یک یا تعداد بیشتری از مواد جدید (فرآورده) تبدیل میشوند. این واکنشها دارای ویژگیهایی هستند که پیشتر برای تغییر شیمیایی بررسی شد. واکنش شیمیایی را میتوان از تعییر رنگ، بو، دما، خواص شیمیایی، تولید گاز یا حباب و تولید صدا یا نور شناسایی کرد.
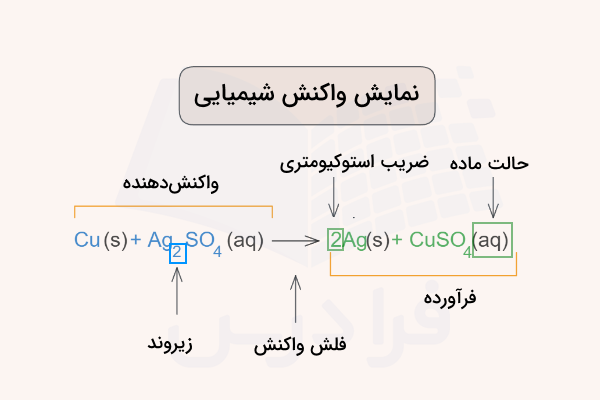
واکنشهای شیمیایی از اصول اصلی مطالعه شیمی و فرایندهای آن هستند. واکنشهای شیمیایی با شکستن و تغییر ساختار پیوندهای بین اتمهای واکنشدهندهها و تولید پیوندهای جدیدی برای فرآوردهها همراه هستند. این واکنشها با نوشتن یک معادله واکنش نشان داده میشوند. در این معادلات، واکنشدهندهها در سمت چپ و فرآوردهها در سمت راست معادله نوشته میشوند. یک فلش بین واکنشدهندهها و فرآوردهها جهت پیش رفتن واکنش را مشخص میکند. واکنشهای شیمیایی ترکیبی از نماد شیمیایی عناصر، ضرایب استوکیومتری آنها و فرمول شیمیایی مولکولهای شرکت کننده در واکنش هستند.
در نوشتن فرمول ترکیبات شیمیایی ابتدا ترکیبی که از لحاظ قطبیت مثبتتر است و کاتیون تشکیل میدهند نوشته میشود. برای مثال در ترکیب نمک خوراکی ابتدا سدیم و سپس کلر (NaCl) نوشته میشود.
تفسیر معادله واکنش شیمیایی
همانطور که اشاره شد، برای شناخت این موضوع که تغییر شیمیایی چیست باید واکنشهای شیمیایی را بشناسیم. یک معادله واکنش شیمیایی از چند علامت و نشانه تشکیل شده است که در ادامه آنها را توضیح میدهیم.
واکنشدهندهها
واکنشدهندهها موادی هستند که در سمت چپ معادله واکنش نوشته میشوند و در واقعیت با یکدیگر ترکیب میشوند تا فرآوردهها به دست بیایند. واکنشدهندهها مواد اولیهای هستند که میخواهیم تغییرات آنها را مشاهده کنیم. برای مثال در ترکیب جوش شیرین و سرکه، این دو ماده واکنش دهنده هستند.
فرآوردهها
فرآوردهها مواد نهایی هستند که در انتهای انجام شدن واکنش، باقی میمانند. این مواد خواص شیمیایی متفاوتی با فرآوردهها دارند و در معادله واکنش در سمت راست و بعد از فلش نوشته میشوند.
فلش (جهت)
فلش معادله واکنش شیمیایی نشان میدهد که واکنش در چه جهتی صورت گرفته است. گاهی واکنشهای شیمیایی میتوانند در تعادل و پویا باشند. این بدان معنی است که در مقیاسهای خیلی کوچک، فرآوردهها و واکنشدهندهها پس از مدتی مدام به یکدیگر تبدیل میشوند. در چنین حالتی فلش معادله به صورت دوطرفه () نوشته میشود. همچنین ممکن است واکنش برای انجام گرفتن نیازمند شرایط خاصی باشد. برای مثال نیاز به حرارت دیدن یا اضافه کردن کاتالیزور داشته باشد. در چنین موارد، این شرایط روی فلش معادله با علامتهای مشخص میشوند.
ضرایب استوکیومتری
اعدادی که با اندازه بزرگتر و درسمت چپ علامت شیمیایی ترکیبات و عنصرها نوشته میشوند، ضرایب استوکیومتری هستند. این اعداد مشخص میکنند چه تعدادی از هر ترکیب در معادله واکنش شرکت میکنند. این مقادیر میتوانند واحدی از اتم، مولکول، مول، گرم و ... باشند.
زیروندها
اعدادی که با اندازه کوچکتر و در سمت راست و پایین برخی از مولکولها یا اتمها نوشته میشوند، نشاندهنده تعداد اتمهای در ترکیب شیمیایی هستند. این تعداد در واقع ترکیب شیمیایی مواد را مشخص میکنند و ربطی به واکنش شیمیایی ندارند. برای مثال در ترکیب سولفات نقره همواره ۲ اتم نقره، ۱ اتم گوگرد و ۴ اتم اکسیژن () وجود دارد.
حالت مواد
گاهی وقتها در معادله واکنش شیمیایی یک یا دو حرف کوچک انگلیسی نوشته میشود که نشاندهنده حالت فیزیکی ماده است. این علامتها به شکل زیر هستند.
- «s» نشاندهنده حالت جامد است.
- «l» شاندهنده حالت مایع است.
- «g» نشاندهنده حالت گاز است.
- «aq» نشاندهنده حالت محلول در آب است.
در تصویر زیر این موارد برای واکنش فلز مس با محلول سولفات نقره مشخص شده است.
انواع واکنشهای شیمیایی
پس از آموختن این موضوع که تغییر شیمیایی چیست، باید انواع واکنشهای شیمیایی را بشناسیم. انواع مختلفی از واکنشهای شیمیایی وجود دارد که در ادامه به چند دستهبندی کلی آنها از جمله واکنشهای جابهجایی، سوختن، سنتز، تجزیه و اکسایش کاهش اشاره شده است.
واکنش سنتز
واکنش سنتز یا ترکیب مواد تغییر شیمیایی است که در آن دو یا تعداد بیشتری ماده با هم ترکیب میشوند تا یک ماده جدید تولید شود. خواص شیمیایی این ماده جدید با خواص شیمیایی واکنشدهندهها متفاوت خواهد بود.
از مثالهای این نوع واکنش شیمیایی میتوان به فرایند تولید آمونیاک اشاره کرد که معادله واکنش آن در ادامه نوشته شده است.
واکنش تجزیه
در واکنش تجزیه، پیوندهای یک ترکیب شکسته شده و به اجزای کوچکتری تجزیه میشود. در این واکنش نیز ویژگیهای شیمیایی فرآوردهها متفاوت از ترکیب اولیه است. برای مثال در واکنش تجزیه آب به وسیله هیدرولیز، دو ترکیب هیدروژن و اکسیژن تولید میشوند که هردو گاز هستند و با آب متفاوت هستند. معادله این واکنش در ادامه نوشته شده است.
واکنش جانشینی یگانه
در واکنش جابجایی یک عنصر یا ترکیب جایگزین عنصر یا ترکیبی در یک مولکول دیگر میشود. برای مثال در واکنش اسید کلریدریک با فلز روی، روی جایگزین هیدروژن اسید شده و رسوب کلرید روی را تولید میکند که این ماده جدید تولید شده، از ویژگیهای تغییر شیمیایی است. معادله این واکنش در ادامه اورده شده است.
واکنش جانشینی دوگانه
در واکنش جانشینی دوگانه دو ماده از یک ترکیب جایگزین یکدیگر میشوند و دو ماده متفاوت از فرآوردهها را به وجود میآورند. برای درک بهتر این نوع واکنش به معادله زیر توجه کنید.
در این واکنش، نقره و سدیم با یکدیگر جابهجا شدهاند و دو ترکیب جدید رسوب سفیدرنگ کلرید نقره و سدیم نیترات را تشکیل میدهند.
واکنش اکسایش کاهش (ردوکس)
این واکنشها که از دسته واکنشهای پیچیدهتر و بسیار با اهمیت شیمی هستند، عدد اکسایش مواد تغییر میکند. تغییر عدد اکسایش میتواند با تغییر بار ماده و یا دریافت و از دست دادن هیدروژن مشخص شود. عدد اکسایش با توجه به بار قراردادی عناصر نیز در ترکیبات یونی میتواند مشخص شود. برای مثال در واکنش هیدروژن و فلوئور، هیدروژن فلوئورید طی معادله واکنش زیر تولید میشود.
با توجه به اعداد اکسایش هیدروژن و فلوئور که به ترتیب ۱+ و ۱- هستند میتوان تشخیص داد که عدد اکسایش آنها در این واکنش از صفر به ۱+ و ۱- تغییر کرده است.
برای درک بهتر واکنشهای اکسیداسیون و نحوه تعیین عدد اکسایش پیشنهاد میکنیم مطلب عدد اکسایش و تعیین آن به زبان ساده را در مجله فرادرس مطالعه کنید.
واکنش سوختن
واکنشهای سوختن به دستهای از واکنشهای شیمیایی گفته میشود که طی آن یک ترکیب با اکسیژن ترکیب شده و انرژی زیادی به صورت گرما و نور ازاد میکند. هیدروکربنها (ترکیبات حاوی کربن و هیدروژن) در اثر سوختن کربن دی اکسید و آب تولید میکنند. برای مثال واکنش سوختن متان به شکل زیر است.
از دیگر واکنشهای شیمیایی میتوان به واکنشهای اسید و باز، واکنشهای پلیمریزاسیون و ... اشاره کرد.
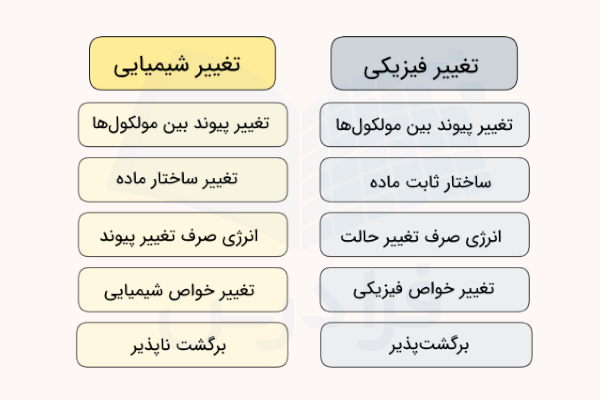
جدول تفاوت تغییر فیزیکی و شیمیایی
تغییرات فیزیکی نیز مانند تغییرهای شیمیایی از ویژگیهای خاص خود برخوردارند و گاهی تشخیص تفاوت تغییر شیمیایی و تغییر فیزیکی مشکل است. در همین راستا، تفاوتهای تغییر فیزیکی و شیمیایی را بررسی میکنیم.
| تغییر شیمیایی | تغییر فیزیکی |
| پیوندهای تغییر یافته از نوع کووالانسی، یونی و فلزی هستند. | پیوندهای تغییر یافته از نوع دوقطبی دوقطبی، هیدروژنی و پراکندگی هستند. |
| ساختار ماده اولیه تغییر یافته و ماده جدیدی تولید میشود. | ساختار ماده اولیه تغییر نمیکند. |
| انرژی دریافت شده یا آزاد شده صرف شکستن و ایجاد پیوندهای بین اتمی جدید میشود. | انرژی صرف شده یا دریافت شده صرف فرایندهای فیزیکی مانند انحلال یا تغییر حالت ماده میشود. |
| خواص شیمیایی ماده تغییر میکند. | خواص شیمیایی ماده بدوت تغییر مانده و تنها خواص فیزیکی تغییر میکند. |
| در اغلب مواد این تغییرها برگشت ناپذیر هستند. | تغییر فیزیکی همواره برگشت پذیر است. |
کاربردهای تغییر شیمیایی در زندگی
تغییر شیمیایی فرایندی است که در آن یک یا تعداد بیشتری از مواد به ماده یا مواد جدیدی تبدیل میشوند که از لحاظ ترکیب شیمیایی متفاوت از ماده اولیه است. تغییرهای شیمیایی جایگاه ویژهای در زندگی انسان دارند. از غذایی که مصرف میکنیم تا داروهایی که برای درمان استفاده میکنیم همگی به وسیله تغییرات شیمیایی آماده میشوند.
این تغییرات با شکستن و تغییر پیوندهای بین اتمها و تشکیل پیوندهای جدید شکل میگیرند. در ادامه برخی از این کاربردها نام برده شده است.
- پخت نان
- زنگ آهن
- هضم غذا
- فتوسنتز
- سوختن
- تصفیه آب
- فاسد شدن غذا
- کپک زدن نان
- آبکاری فلزات
- ترکیب سرکه و جوش شیرین
- انفجار مواد آتشبازی
- عملکرد باتری
- سیاه شدن موز
در ادامه برخی از این کاربردها را برای درک بهتر اینکه تغییر شیمیایی چیست، برمیشماریم.
پختن نان
پختن مواد غذایی میتواند به عنوان یک تغییر شیمیایی در نظر گرفته شود. این فرایندها شامل چند تغییر شیمیایی هستند که در نهایت غذا یا نانی با ویژگیهای متفاوت از مواد اولیه به دست میدهند. برای مثال در فرایند پخت نان از آرد، آب و مخمر استفاده میشود. در ترکیب مخمر و آب و تشکیل خمیر نان، فرایندی به نام تخمیر شدن انجام میگیرد که یک تغییر شیمیایی محسوب میشود. وظیفه انجام فرایند تخمیر را مخمرها به عهده دارند.

مخمرها مواد قندی دیگر مواد را مصرف کرده و درون محصول کربن دی اکسید تولید میکنند. به همین علت است که خمیر نان پس از مدت زمان مشخصی حجیم میشود. در فرایند پخت نان همچنین یک تغییر شیمیایی دیگر به نام فرایند میلارد صورت میگیرد که زنجیرهای از واکنشهای شیمیایی است که طی آنها آمینواسیدها با یکدیگر واکنش داده و کاهش فرآوردههای قندی باعث ایجاد لایه طلایی و خشک روی نان میشود.
زنگ زدن آهن
فرایند خوردگی آهن واکنشی است که در ترکیب سطح آهن با رطوبت و اکسیژن انجام میگیرد. اکسید آهن قهوهای-قرمز تولید شده در این فرایند از واکنش آهن با آب و اکسیژن موجود در هوا انجام میگیرد. این فرایند اکسیداسیون نام دارد و باعث خوردگی و کاهش استقامت آهن میشود.
هضم
در فرایند هضم بدن ما چندین تغییر شیمیایی را برای شکستن ترکیبات غذایی مصرف شده به مواد سادهتر و جذب آنها انجام میدهد. برای مثال پروتئینها به آمینو اسیدها شکسته میشوند و کربوهیدراتها به قند گلوکز تبدیل میشوند. یکی از مهمترین آنزیمها برای شکستن کربوهیدراتها به قند های کوچکتر آنزیم آمیلاز است. در معده انسان آنزیمی وجود دارد که پروتئینها را به قندهای کوچکتر میشکند و فرایند هضم آنها را آسان میکند. تمامی این موارد به علت تولید مواد جدید از مواد اولیه، تغییرهای شیمیایی هستند.

فتوسنتز
فتوسنتز فرایندی است که طی آن برخی از گیاهان، جلبکها و برخی از باکتریها، نور خورشید، کربن دی اکسید و آب را به گلوکز و اکسیژن تبدیل میکنند. این فرایند در کلروپلاست سلولهای گیاهی خصوصا در قسمت سبز آنها به نام کلروفیل انجام میگیرد. این فرایند برای ادامه حیات زمین بسیار حائز اهیمت است. این فرایند به دلیل تولید گلوکز و اکسیژن که متفاوت از مواد اولیه هستند، یک تغییر شیمیایی به حساب میآید.
سوختن
فرایند سوختن یا احتراق، یکی از مهمترین تغییرهای شمیایی است. طی این فرایند انرژی مورد نیاز بسیاری از فرایندها با سوختن مواد نفتی و هیدروکربنها به دست میآید. فرایند سوختن شامل ترکیب یک ماده قابل اشتعال با اکسیژن است که در نتیجه انجام واکنش مقادیر قابل توجهی انرژی به صورت گرما و نور و گاهی نیز صدا (در صورت انفجار) آزاد میشود. برای مثال فرایند سوختن چوب را در نظر بگیرید. چوب ترکیبی از دستهای از مواد آلی است که مهمترین آنها سلولز است. با آتش زدن چوب، حرارت تولید شده مولکولهای سلولز را به ترکیبات کوچکتری مانند بخار آب و کربن دی اکسید میشکند. معادله این واکنش به شکل زیر است.
تصفیه آب
تصفیه آب شامل مجموعه فرایندهایی از جمله خالصسازی و آلودگیزدایی آن برای مصارف آشامیدنی و خانگی و همچنین صنعتی است. فرایندهایی که در این مجموعه استفاده میشوند مواردی مانند لخته شدن، ته نشینی، تغییر اسیدیته و فلیتراسیون شیمیایی است. این فرایندها تغییرهای شیمیایی حائز اهمیتی هستند که برای تبدیل آب ناسالم به آب سالم و عاری از آلودگی استفاده میشوند.
حل شدن نمک در آب چه تغییری است؟
یکی از چالشهایی که در بررسی تغییرهای شیمیایی و فیزیکی با آن مواجه میشویم، بررسی فرایند انحلال مواد یونی و مولکولی در آب است. برخی از دانشمندان انحلال ترکیبات یونی در آب را یک تغییر شیمیایی در نظر میگیرند. ترکیبات یونی به هنگام حل شدن در آب به یونهای سازندهشان تفکیک میشوند. نمک خوراکی که ترکیبی از یونهای سدیم و کلر است، پس از انحلال در آب به این یونها شکسته شده و توسط مولکولهای آب احاطه میشود. اما از آن جا که با تبخیر کردن آب این محلول، بلورهای نمک سدیم کلراید جداسازی میشوند، به بیان کلی واکنش برگشت پذیر است و تغییر شیمیایی واضحی در آن صورت نمیگیرد بسیاری از دانشمندان آن را تغییری فیزیکی در نظر میگیرند.
فرایند انحلال ترکیبات مولکولی راحتتر قابل بررسی هستند. ترکیبات مولکولی مانند شکر هنگام انحلال به اجزا سازندهشان شکسته نمیشوند و تنها پیوندهای کووالانسی آنها جدا میشود. در نتیجه دانشمنداناین گونه فرایندها را تغییر فیزیکی در نظر میگیرند.

در نهایت برای بررسی این موارد بهتر است مجموعه کلی تغییرات خواص فیزیکی و شیمیایی را در نظر بگیریم. در تغییرهای شیمیایی ممکن است تمامی مواردی که برشمردیم اعم از تغییر رنگ، بو، مزه و ... اتفاق نیافتد. اگر هیچ کدام از این موارد اتفاق نیافتاد و فرآورده نهایی دارای ترکیب شیمیایی یکسانی با واکنشدهنده بود، آن تغییر را یک تغییر فیزیکی در نظر میگیریم.
جمعبندی
در این مطلب از مجله فرادرس آموختیم تغییر شیمیایی چیست. تمامی مواد موجود در طبیعت ممکن است دچار یک سری تغییرات شوند که آنها را بر اساس تغییر خواص میتوان به دو دسته تغییر فیزیکی و تغییر شیمیایی دستهبندی کرد. تغییر فیزیکی شامل تغییر خواص فیزیکی مانند حجم و دانسیته و حالت ماده است و ساختار شیمیایی مواد طی آن تغییر نمیکند. تغییر شیمیایی شامل تغییر ساختار ماده و شکستن پیوندهای شیمیایی و تولید پیوندهای جدید و در نتیجه یک ماده جدید است و این تغییرها برگشت پذیر نیستند. تغییرهای فیزیکی شامل انواع آلی، معدنی و بیوشیمیایی هستند و میتوان آنها را از روی تغییر رنگ، بو، مزه، دما و تشکیل رسوب تشکیل داد. برخی از تغییرهای شیمیایی رایج شامل فرایند پخت و هضم غذاها، فرایندهای احتراق، زنگ زدن آهن، فوتوسنتز، ترکیب سرکه و جوش شیرین، استفاده از باتریها و فاسد شدن مواد خوراکی است. هر تغییر شیمیایی با انجام گرفتن یک واکنش شیمیایی همراه است که به کمک معادله واکنش شیمیایی و عناصر نشان داده میشود.
آزمون تغییر شیمیایی
۱. کدام مورد توضیح دقیقی از تفاوت تغییر شیمیایی و تغییر فیزیکی ارائه میدهد؟
در تغییر فیزیکی مولکول جدیدی ساخته میشود ولی تغییر شیمیایی فقط رنگ را تغییر میدهد.
هر دو نوع تغییر باعث تغییر کامل ماده اولیه و تشکیل مواد نامشخص میشوند.
در تغییر شیمیایی ساختار ماده تغییر میکند و ماده جدیدی تولید میشود، ولی در تغییر فیزیکی، ساختار ماده همان میماند.
تغییر شیمیایی فقط شامل تغییر حالت جامد به مایع یا گاز است، اما تغییر فیزیکی این تغییرات را ندارد.
عبارت «در تغییر شیمیایی ساختار ماده تغییر میکند و ماده جدیدی تولید میشود، ولی در تغییر فیزیکی، ساختار ماده همان میماند» درست است، زیرا تغییر شیمیایی با تغییر ساختار، ترکیب و تولید مادهای جدید همراه است که معمولا برگشتناپذیر است. اما در تغییر فیزیکی، فقط حالت یا برخی ویژگیهای ظاهری تغییر میکنند و ساختار شیمیایی ماده ثابت میماند.
۲. کدام یک از نشانههای زیر در محیط واقعی بیشترین کاربرد را برای شناسایی تغییر شیمیایی دارند؟
انحراف نور، افزایش جرم، تغییر جلا، حل شدن شکر
تغییر حجم، تغییر چگالی، تغییر دما، انحلال
ذوب شدن، تبخیر، تغییر بو، شکستگی
تغییر دما، تغییر رنگ، آزاد شدن گاز، تشکیل رسوب
نشانههای «تغییر دما»، «تغییر رنگ»، «آزاد شدن گاز» و «تشکیل رسوب» همگی در مطلب بهعنوان روشهای اصلی شناسایی تغییر شیمیایی معرفی شدهاند، زیرا این نشانهها اغلب به تولید ماده جدید و تغییر ساختار شیمیایی اشاره دارند. مواردی مانند «تغییر حجم»، «تغییر چگالی»، «ذوب شدن» یا «تبخیر» عموما به تغییرات فیزیکی مربوط میشوند و کمک چندانی به تشخیص رخداد یک تغییر شیمیایی نمیکنند. همچنین «انحراف نور»، «افزایش جرم» یا «تغییر جلا» از نشانههای رایج تغییر شیمیایی بهشمار نمیروند. بنابراین ترکیب نشانههای گفته شده در عبارت درست، مهمترین ابزار شناسایی تغییر شیمیایی در محیط واقعی بهشمار میرود.
۳. کدام عامل اصلی باعث میشود تغییر شیمیایی معمولا قابل بازگشت نباشد؟
شکستن و تشکیل پیوندهای جدید شیمیایی بین اتمها
تغییر در دما و آزاد شدن انرژی بهتنهایی
حل شدن ماده در آب و مخلوط شدن فیزیکی
تغییر شکل ظاهری ماده بدون تغییر ساختار داخلی
دلیل غیرقابل بازگشت بودن اکثریت تغییرهای شیمیایی، «شکستن و تشکیل پیوندهای جدید شیمیایی بین اتمها» است. زیرا ساختار و ترکیب مولکولی ماده دگرگون میشود و ماده جدیدی با خواص متفاوت به وجود میآید. «تغییر شکل ظاهری» فقط باعث تغییر فیزیکی میشود و ماهیت شیمیایی ماده را عوض نمیکند. «تغییر دما و آزاد شدن انرژی» نشانه تغییر شیمیایی است اما بهتنهایی علت برگشتناپذیری نیست، زیرا در برخی تغییرات فیزیکی هم ممکن است رخ بدهد. «حل شدن ماده» هم معمولا تغییری فیزیکی به شمار میرود و ساختار بنیادی ماده را تغییر نمیدهد.
۴. وقتی در یک تغییر، ساختار مولکولی ماده عوض شده و مادهای با خواص جدید به وجود میآید، این تغییر غالبا در کدام طبقهبندی جای میگیرد و دلیل اصلی آن چیست؟
تغییر فیزیکی با تفکیک یونها در محلول
تغییر فیزیکی زیرا حالت ماده عوض میشود.
تغییر فیزیکی به علت تغییر شکل ظاهری
تغییر شیمیایی به علت تشکیل ماده جدید
وقتی ساختار مولکولی ماده دگرگون میشود و مادهای با خواص تازه ایجاد میگردد، این فرآیند مصداق «تغییر شیمیایی به علت تشکیل ماده جدید» است. طی این تغییر، پیوندهای شیمیایی قبلی شکسته شده و پیوندهای جدید شکل میگیرند و ماده به کلی خواص متفاوتی نسبت به ماده اولیه خواهد داشت. برعکس، در تغییرات فیزیکی معمولا ساختار شیمیایی ماده حفظ شده و فقط حالت، شکل یا ابعاد آن تغییر میکند، بدون آن که خاصیت یا ترکیب اصلی دگرگون شود. پس وقوع یک مادهی جدید و تفاوت خواص کلیدیترین نشانه تغییر شیمیایی است.
۵. در معادله واکنش شیمیایی، نقش ضرایب و زیروندها چیست و چگونه اطلاعاتی درباره مواد واکنشدهنده و فرآورده میدهند؟
ضرایب واحد جرم را تعیین میکنند و زیروندها بیانگر انرژی آزادشده هستند.
ضرایب فقط برای تعادل معادله و زیروندها فقط برای نمایش حالت فیزیکی بهکار میروند.
ضرایب نشاندهنده تعداد مولکولها یا اتمها هستند و زیروندها نوع عنصر را مشخص میکنند.
ضرایب مقدار مواد را بر حسب مول و زیروندها تعداد اجزای هر مولکول را نشان میدهند.
ضرایب در معادله واکنش شیمیایی تعداد یا مقدار مواد را بر حسب مول مشخص میکنند و ارتباط عددی بین واکنشدهندهها و فرآوردهها را نشان میدهند، در حالی که زیروندها تعداد اتمهای هر عنصر را در یک واحد ماده نمایش میدهند. گزینههای دیگر اشتباهاند. زیرا «ضرایب» به تعیین حالت فیزیکی یا جرم ماده مربوط نیستند و «زیروندها» نیز انرژی یا نوع عنصر را تعیین نمیکنند، بلکه به ساختار مولکولی مرتبطاند.
۶. در یک آزمایش شیمی، اگر حین واکنش دو ماده، تولید گاز یا رسوب مشاهده شود، این نشانه چه نوع تغییری است؟
تغییر شیمیایی زیرا ماده جدیدی ایجاد شده است.
تغییر فیزیکی زیرا واکنشدهندهها به حالت اولیه بازمیگردند.
تغییر فیزیکی زیرا پیوندهای بین مولکولی شکستهاند.
تغییر فیزیکی زیرا فقط حالت ماده عوض شده است.
مشاهده تولید گاز یا رسوب هنگام واکنش دو ماده نشان میدهد که مادهای جدید با خواص متفاوت به وجود آمده است. این ویژگیها مخصوص تغییر شیمیایی هستند زیرا پیوندهای شیمیایی قبلی شکسته و پیوندهای تازهای تشکیل میشوند. برخلاف «تغییر فیزیکی زیرا فقط حالت ماده عوض شده است»، در این حالت ساختار شیمیایی عوض میشود، نه فقط شکل یا حالت فیزیکی. همچنین برخلاف «تغییر فیزیکی زیرا پیوندهای بین مولکولی شکستهاند» یا «تغییر فیزیکی زیرا واکنشدهندهها به حالت اولیه بازمیگردند»، در تغییر شیمیایی مواد اولیه به راحتی قابل بازگشت نیستند و خواص هویت جدیدی پیدا میکنند.
۷. در مقایسه خواص فیزیکی ماده مانند نقطه ذوب و رنگ با خواص شیمیایی مانند اشتعالپذیری و PH، اصلیترین تفاوت در شیوه مشاهده یا نقش آنها در واکنشها چیست؟
خواص فیزیکی مانند اشتعالپذیری فقط با آزمایش مستقیم ماده مشخص میشوند.
ویژگیهای فیزیکی بدون نیاز به واکنش قابل مشاهدهاند، اما ویژگیهای شیمیایی فقط هنگام تغییر شیمیایی نمایان میشوند.
خواص شیمیایی مانند رنگ همواره در حالت جامد دیده میشوند.
هر دو نوع خاصیت فقط با تغییر مکانیکی قابل مشاهدهاند نه با واکنش.
مشاهده خواص فیزیکی مانند نقطه ذوب یا رنگ، بدون وقوع واکنش شیمیایی امکانپذیر است، زیرا ساختار ماده تغییر نمیکند. در مقابل، خواص شیمیایی مانند اشتعالپذیری یا pH فقط در فرایندهایی قابل شناسایی هستند که ماده وارد واکنش شده و ساختارش تغییر میکند. عبارت «ویژگیهای فیزیکی بدون نیاز به واکنش قابل مشاهدهاند، اما ویژگیهای شیمیایی فقط هنگام تغییر شیمیایی نمایان میشوند» صحیح است.
۸. در تحلیل تفاوت تغییر فیزیکی و تغییر شیمیایی از نظر ساختار مواد و رفتار انرژی، کدام عبارت صحیح است؟
در تغییر شیمیایی، ساختار مولکولی ماده تغییر میکند و انرژی به صورت نور یا گرما یا گاز آزاد میشود.
در تغییر شیمیایی، ساختار ظاهری ماده بدون تغییر ترکیب شیمیایی تغییر میکند و بازگشتپذیر است.
در تغییر فیزیکی، پیوند شیمیایی شکسته شده و مولکول جدید تشکیل میشود و انرژی شیمیایی ذخیره میشود.
در هر دو نوع تغییر، فقط حالت ماده و شکل آن بدون تغییر ساختار مولکول عوض میشود و بازگشتپذیری کامل دارد.
در تغییر شیمیایی معمولا ساختار مولکولی ماده دگرگون میشود و این امر به دلیل شکستن یا تشکیل پیوندهای شیمیایی بین اتمها رخ میدهد. در نتیجه، ماده جدیدی با خواص متفاوت بهوجود میآید و معمولا انرژی به شکل گرما، نور، صدا یا انتشار گاز آزاد میشود. عبارت «در تغییر شیمیایی، ساختار مولکولی ماده تغییر میکند و انرژی به صورت نور یا گرما یا گاز آزاد میشود» دقیقا همین ویژگیها را بیان میکند.
۹. حل شدن شکر در آب، براساس نوع تغییر به کدام دسته تعلق دارد و دلیل آن چیست؟
تغییر شیمیایی. زیرا پیوندهای یونی و کووالانسی به طور دائمی تغییر میکنند.
تغییر شیمیایی. زیرا حل شدن باعث تولید مواد جدید و برگشتناپذیر میشود.
تغییر فیزیکی. زیرا فقط ظاهر مواد تغییر و ساختار شیمیایی حفظ میشود.
تغییر فیزیکی. زیرا نمک و شکر پس از تبخیر آب به حالت اصلی خود بازمیگردند.
حل شدن شکر در آب نمونهای از تغییر فیزیکی است، زیرا پس از تبخیر آب قابل بازیابی است و ساختار شیمیایی آن تغییر نمیکند در این حالت فقط حالت فیزیکی و ظاهر تغییر میکند و مواد اولیه باقی میمانند.
۱۰. معادله واکنش شیمیایی چه کمکی به فهم دقیقتر روند یک تغییر شیمیایی میکند؟
فقط جدول تفاوت تغییر فیزیکی و شیمیایی را ارائه میدهد.
روش مشاهده آزمایشگاهی را تعیین میکند.
نحوه تبدیل واکنشدهندهها به فرآوردهها را بهطور نمادین و دقیق نمایش میدهد.
فقط انواع انرژی آزادشده را فهرست میکند.
معادله واکنش شیمیایی «نحوه تبدیل واکنشدهندهها به فرآوردهها را بهطور نمادین و دقیق نمایش میدهد»، زیرا ترکیبهای شرکتکننده، محصولات تولیدشده، ضرایب، حالتها و مسیر واکنش به صورت خلاصه و علمی در این معادله بیان میشود. این نمایش دقیق به فهم اینکه کدام پیوندها شکسته و کدام تشکیل شدهاند و نوع ماده جدید حاصل چه ویژگیهایی نسبت به مواد اولیه دارد کمک میکند.
۱۱. کدام ترکیب از نوع تغییر شیمیایی و یک نمونه کلیدی آن صحیح است؟
تغییر آلی با سنتز دارو در بدن
تغییر بیوشیمیایی با حل شدن نمک در آب
تغییر فیزیکی با سوختن شمع
تغییر معدنی با زنگ زدن آهن
پدیده «تغییر معدنی با زنگ زدن آهن» صحیح است، زیرا تفاوت شیمیایی در مواد غیرآلی بهوجود میآید و زنگ زدن آهن نمونهای شاخص از آن محسوب میشود. گزینه «تغییر آلی با سنتز دارو در بدن» اشتباه است زیرا تولید داروهای آلی در محیط انسانی یا صنعتی رخ میدهد اما در بدن فرآیندهای بیوشیمیایی جریان دارد. «تغییر بیوشیمیایی با حل شدن نمک در آب» نادرست است زیرا انحلال نمک یک تغییر فیزیکی تلقی میشود. «تغییر فیزیکی با سوختن شمع» نیز غلط است زیرا سوختن یک واکنش شیمیایی و نه فیزیکی است.
۱۲. در آزمایشگاه برای شناسایی نوع واکنش شیمیایی، کدام ویژگی دستهبندی واکنشها کلیدیتر است؟
وجود نور یا گرما در سوختن
تشکیل یک ترکیب جدید در سنتز
شکستن ماده به اجزای کوچکتر در تجزیه
تغییر عدد اکسایش در ردوکس
در واکنشهای ردوکس، تغییر عدد اکسایش عنصرها نشانه بسیار مهمی برای شناسایی این نوع واکنشها به ویژه در شرایط آزمایشگاهی است. این ویژگی به طور دقیقی نشان میدهد که واکنش انتقال الکترون رخ داده و ماهیت واکنش را مشخص میکند. سایر گزینهها، مثل آزاد شدن نور یا گرما، تشکیل یک ترکیب جدید یا شکستن ماده، ممکن است در چند نوع واکنش مشترک باشند و به تنهایی معیار قطعی برای تعیین دسته واکنش نیستند. فقط در تغییر عدد اکسایش میتوان به شکل قابل اعتمادتر واکنش ردوکس را از سایر واکنشها تشخیص داد.
۱۳. کدام ویژگی در پدیدههایی مثل پخت غذا، زنگزدن آهن و فتوسنتز، وجود دارد که آنها را به عنوان تغییر شیمیایی معرفی میکند؟
همیشه میتوان مواد را به حالت اولیه بازگرداند.
در آنها ساختار شیمیایی مواد تغییر نمیکند.
اغلب با تولید ماده جدید و تغییر ساختار همراهاند.
معمولا دما و رنگ بدون تغییر میماند.
در پدیدههایی مانند «پخت غذا»، «زنگزدن آهن» و «فتوسنتز»، ساختار شیمیایی مواد و پیوندهای آنها تغییر میکند و ماده یا مواد جدید با خواص متفاوت به وجود میآید. این ویژگی اساس تفاوت تغییر شیمیایی نسبت به دیگر تغییرهاست.














