نمونه سوال استوکیومتری
استوکیومتری در شیمی، دانش درک ارتباط بین مقادیر واکنش دهنده و فراورده، پیش و پس از واکنش است. در این مطلب از مجله فرادرس با حل چند نمونه سوال استوکیومتری، آشنایی بیشتر با مفهوم استوکیومتری پیدا خواهید کرد.
استوکیومتری چیست؟
واکنشهای شیمیایی از غذا تا درمان بیماریها و تولید سوخت و انرژی تأثیر زیادی بر زندگی انسان و محیط زیست دارند. درک تغییرات شیمیایی و مطالعه واکنشها در شیمی اهمیت زیادی دارد. با مطالعه استوکیومتری شیمیایی، درک بهتری از تغییرات شیمیایی خواهیم داشت.
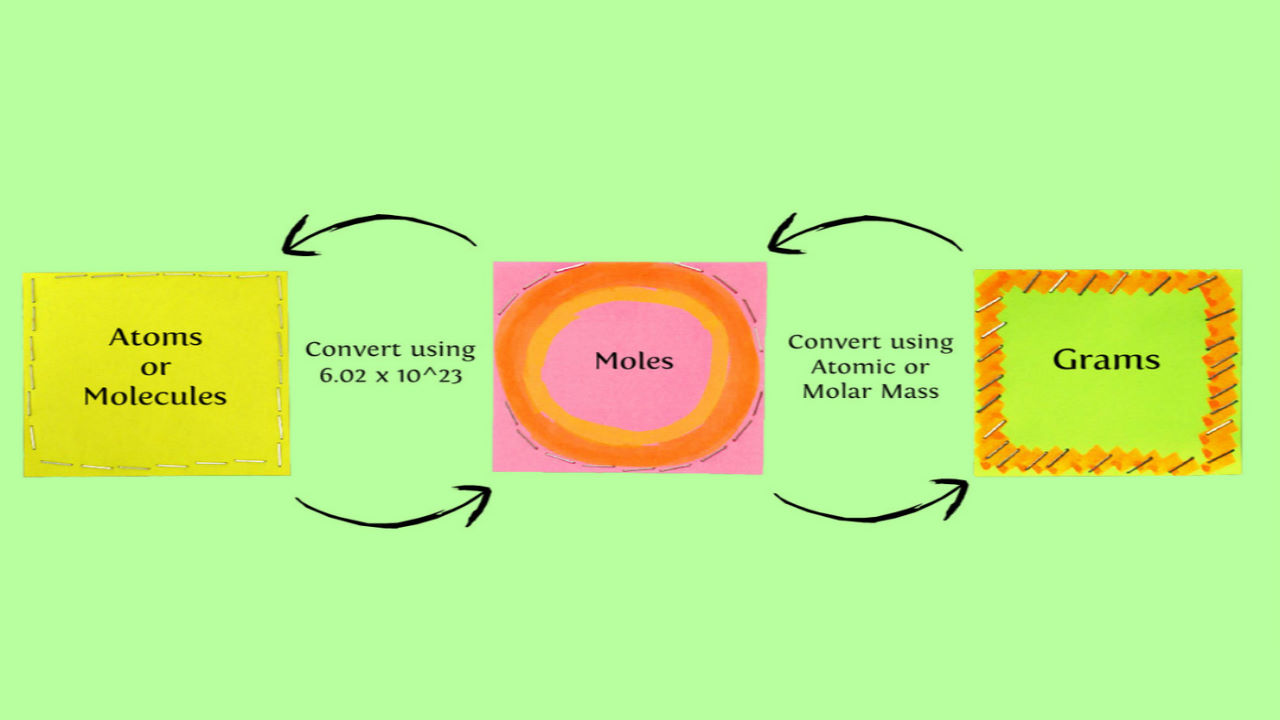
در معادلات شیمیایی تعداد مولکولها با ضرایب نشان داده میشوند. در آزمایشگاه و کاربردهای صنعتی هنگام استفاده از مواد شیمایی نمیتوان با شمارش تعداد مولکولها مقادیر مورد نیاز را بهدست آورد. برای بهدست آوردن مقدار واکنش دهندههای لازم در واکنش شیمیایی از جرم و وزن کردن آنها استفاده میکنند. برای مطالعه استوکیومتری در ابتدا باید با مفاهیم زیر آشنا شوید.
چگونه یک سوال استوکیومتری را حل کنیم؟
در استوکیومتری برای بهدست آوردن مقدار ماده مجهول از مقدار ماده معلوم باید مراحل زیر را طی کرد.
- در گام نخست باید معادله واکنش نوشته و موازنه شود.
- مقدار جرم ماده معلوم باید به تعداد مول تبدیل شود.
- سپس از نسبت مول ماده معلوم تعداد مولهای ماده مجهول را بهدست آورده شود.
- مول ماده مجهول به جرم تبدیل شود.
تعیین جرم مواد شیمیایی با استفاده از معادله شیمیایی
برای آشنایی با استوکیومتری در واکنشها بهتر است به واکنش پروپان با اکسیژن توجه کنید.
مثال واکنش پروپان با اکسیژن:
واکنش پروپان با اکسیژن موجب تولید کربن دیاکسید و آب میشود. چه جرمی از اکسیژن با ۹۶٫۱ گرم پروپان واکنش میدهد؟
معادله واکنش به صورت زیر است:
که به شکل زیر قابل تجسم است:

از معادله واکنش متوجه میشویم که ۱ مول با ۵ مول واکنش داده و ۳ مول و ۴ مول به عنوان فراورده تولید شدهاست. برای استفاده از این واکنش و بهدست آوردن مقدار جرم واکنش دهندهها و فراوردهها باید مول مواد را به جرم تبدیل کنیم. برای یافتن پاسخ سؤال ابتدا باید بپرسیم ۹۶٫۱ گرم پروپان چند مول است؟
- جرم مولی پروپان
- تبدیل گرم پروپان به مول
$$96.1 \require {cancel} \cancel{g\,C_3H_8(g)}\times\frac{1\,mol\,C_3H_8}{44.1\,\require {cancel} \cancel{g\,C_3H_8}}=2.18 mol\,C_3H_8$$
با استفاده از نسبت مولی دو عنصر در معادله واکنش مشخص است که هر مول پروپان با ۵ مول اکسیژن واکنش میدهد پس نسبت مولی آنها برای بهدست آوردن مقدار مول اکسیژن به صورت زیر است.
- نسبت مولی اکسیژن به پروپان
- محاسبه مول مورد نیاز اکسیژن
$$2.18\,mol \require {cancel} \cancel{\,C_3H_8}\times\frac{5\,mol\,O_2}{1\,mol\require {cancel} \cancel{\,C_3H_8}}=10.9\,mol\,O_2$$
هنگام محاسبه مولهای اکسیژن نسبت مولی باید طوری نوشته شود که مولهای پروپان در محاسبات با هم ساده شوند و خط بخورند. حال باید با توجه به مول بهدست آمده مقدار گرم اکسیژن را را حساب شود. جرم مولی اکسیژن ۲۳ گرم بر مول است.
- محاسبه گرم اکسیژن
$$10.9\,mol \require {cancel} \cancel{O_2}\times\frac{32\,g\,\,O_2}{1\,mol\require {cancel} \cancel{O_2}}=349\,g\,\,O_2$$
بنابراین برای واکنش ۹۶٫۱ گرم پروپان به ۳۴۹ گرم اکسیژن نیاز است.
نمونه سوال استوکیومتری واکنش
مثال اول: در فناوریهای فضایی از لیتیم هیدروکسید جامد برای حذف کربن دیاکسید استفاده میشود که در نهایت، نتیجه واکنش بین آنها، لیتیم کربنات و آب تولید میکند. ۱٫۰۰ کیلوگرم لیتیم هیدروکسید چه جرمی از کربن دیاکسید گازی را میتواند جذب کند؟
پاسخ: برای اینکه میزان جرمی که توسط ۱٫۰۰ کیلوگرم جذب میشود را بهدست آوریم ابتدا باید معادله واکنش را بنویسیم.
- نوشتن معادله واکنش:
- موازنه معادله:
- محاسبه جرم مولی : در ترکیب لیتیم هیدروکسید از هر عنصر یک مول داریم پس جرم مولی به صورت زیر محاسبه میشود.
- محاسبه مقدار مول :
$$1\require {cancel} \cancel{Kg\,LiOH}\times\frac{1000\require {cancel} \cancel{g\,LiOH}}{1\,\require {cancel} \cancel{Kg\,LiOH}}\times\frac{1\,mol\,LiOH}{23.9\require {cancel} \cancel{\,g\,LiOH}}$$
- بهدست آوردن نسب مولی:
- محاسبه مول :
$$41.8\require {cancel} \cancel{\,mol\,\,LiOH}\times\frac{1\,mol\,\,CO_2}{2\require {cancel} \cancel{\,mol\,\,LiOH}}$$
- محاسبه جرم :
$$20.9\require {cancel} \cancel{\,mol\,\,CO_2}\times\frac{44\,g\,\,CO_2}{1\require {cancel} \cancel{\,mol\,\,CO_2}}$$
بنابراین 920 گرم توسط 1.00 کیلوگرم جذب میشود.

مثال دوم: جوش شیرین معمولاً به عنوان یک ضد اسید استفاده میشود و هیدروکلریک اسید اضافی ترشح شده از معده را خنثی میکند. از شیر منیزی () که سوسپانسیون آبی منیزیم هیدروکسید است نیز به عنوان ضد اسید استفاده میشود. با توجه به معادلات زیر بین جوش شیرین و شیر منیزی در یک گرم کدام یک ضد اسید موثرتری است؟
- معادله جوش شیرین و اسید معده:
- معادله واکنش شیر منیزی با اسید معده:
پاسخ: سوال مقایسه قدرت خنثی کنندگی اسید دو ترکیب است.
- برای :
- در ابتدا باید واکنش موازنه شود:
- محاسبه جرم مولی : در ترکیب سدیم هیدروژنکربنات از اکسیژن ۳ مول و از سایر عنصرها هر کدام یک مول داریم پس جرم مولی به صورت زیر محاسبه میشود.
- محاسبه مول :
$$1\require {cancel}\cancel{\,g\,\,NaHCO_3}\times\frac{1\,mol\,\,NaHCO_3}{84.0\require {cancel} \cancel{g\,\,NaHCO_3}}$$
- نسبت مولی بین و :
- محاسبه مول :
$$1.19\times10^{-2}\require{cancel}\cancel{mol\,\,NaHCO_3}\times\frac{1mol\,\,HCl}{1\require {cancel}\cancel{mol\,\,NaHCO_3}}$$
بنابراین یک گرم مقدار مول اسید را خنثی میکند.
- برای :
در ابتدا معادله واکنش باید موازنه شود:
- محاسبه جرم مولی : در ترکیب منیزیم هیدروکسید یک مول منیزیم و ۲ مول یون هیدروکسید وجود دارد پس جرم مولی به صورت زیر محاسبه میشود.
- محاسبه مول :
$$1\require{cancel}\cancel{g\,Mg(OH)_2}\times\frac{1\,mol\,\,Mg(OH)_2}{58.32\require{cancel}\cancel{g\,\,Mg(OH)_2}}$$
- نسبت مولی بین و :
- محاسبه مول :
$$1.71\times10^{-2}\require{cancel}\cancel{mol\,Mg(OH)_2}\times\frac{2\,mol\,\,HCl}{1\require{cancel}\cancel{mol\,\,Mg(OH)_2}}$$
بنابراین یک گرم مقدار مول اسید معده را خنثی میکند. با مقایسه مقدار مول محاسبه شده برای هر ترکیب مشخص میشود که یک گرم مقدار مول بیشتری از اسید معده را خنثی میکند.

استوکیومتری واکنش دهنده محدود کننده چیست؟
برای مشخص کردن مقدار فراورده از تعدادی واکنش دهنده باید واکنش دهندهای که زودتر از سایر مواد تمام میشود را مشخص کنیم. به چنین موادی واکنش دهنده محدود کننده میگویند و مقدار فراورده به مقدار آنها بستگی دارد. با توجه به جرم واکنش دهنده و استوکیومتری میتوانیم واکنش دهنده محدود کننده را پیدا کنیم. یکی از روشهای تعیین واکنش دهنده محدود کننده در یک واکنش شیمیایی مقایسه مولهای واکنش دهندهها است.
مثالاول: برای تولید آمونیاک از ۲۵٫۰ کیلوگرم نیتروژن و ۵٫۰۰ کیلوگرم هیدروژن استفاده شدهاست. با توجه به جرم واکنش دهنده چه میزان آمونیاک تولید خواهد شد؟
| دادههای سوال | موارد مورد نیاز |
| 25.0 کیلوگرم نیتروژن | مول |
| 5.00 کیلوگرم هیدروژن | مول |
| تعیین واکنش دهنده محدود کننده | |
| معادله واکنش | |
پاسخ:
- موازنه معادله واکنش:
- محاسبه مول :برای تعیین واکنش دهنده محدود کننده و محاسبه مقدار آمونیاکی تولیدی، باید مولهای واکنش دهنده موجود را محاسبه میکنیم:
$$25\require{cancel}\cancel{KgN_2}\times\frac{1000\require{cancel}\cancel{gN_2}}{1\require{cancel}\cancel{KgN_2}}\times\frac{1molN_2}{28\require{cancel}\cancel{gN_2}}$$
- محاسبه مول :
$$5\require{cancel}\cancel{kg\,H_2}\times\frac{1000\require{cancel}\cancel{g\,H_2}}{1\require{cancel}\cancel{kg\,H_2}}\times\frac{1mol\,H_2}{2.016\require{cancel}\cancel{gH_2}}$$
از آنجایی که ۱ مول با ۳ مول واکنش میدهد، تعداد مولهای که دقیقاً با مول گاز نیتروژن واکنش میدهند برابر است با:
$$8.93\times10^2\require{cancel}\cancel{mol\,N_2}\times\frac{3mol\,H_2}{1\require{cancel}\cancel{mol\,N_2}}$$
و به همین ترتیب برای گاز نیتروژن تعداد مولهای که دقیقاً با مول گاز هیدروژن واکنش میدهد برابر است با:
$$2.48\times10^3\require{cancel}\cancel{mol\,H_2}\times\frac{1mol\,N_2}{3\require{cancel}\cancel{mol\,H_2}}$$
- تعیین واکنش دهنده محدود کننده: با توجه به مقدارهایی که داریم و مقدارهایی که محاسبه شد میتوان واکنش دهنده محدود کننده را تعیین کرد.
مقدار مول بهدست آمده برای گاز نیتروژن است و مقدار مورد نیاز برای واکنش کامل با مول گاز هیدروژن برابر با مول است، پس مشخص است که در این واکنش نیتروژن اضافه میآید.
در مقابل مقدار مول بهدست آمده برای گاز هیدروژن است و مقدار مورد نیاز برای واکنش کامل با مول گاز نیتروژن برابر با مول است، پس مشخص است که در این واکنش با کمبود هیدروژن مواجه هستیم و هیدروژن زودتر مصرف و تمام میشود.
- محاسبه مقدار آمونیاک: بنابراین، واکنش دهنده محدود کننده هیدروژن است و برای محاسبه مقدار آمونیاک تولیدی باید از نسبت مولی آمونیاک و هیدروژن استفاده کنیم.
$$2.48\times10^3\require{cancel}\cancel{mol\,H_2}\times\frac{2mol\,NH_3}{3\require{cancel}\cancel{mol\,H_2}}$$
مقدار مول آمونیاک تولید باید به کیلوگرم تبدیل شود. جرم مولی آمونیاک ۱۷ گرم است.
$$1.65\times10^3\require{cancel}\cancel{mol\,NH_3}\times\frac{17.0g\,NH_3}{1\require{cancel}\cancel{1mol\,NH_3}}$$
مثال دوم: با عبور آمونیاک گازی از روی مس (II) اکسید در دمای بالا، گاز نیتروژن تهیه میکنند. مس جامد و بخار آب از دیگر فراوردههای این واکنش هستند. اگر نمونه ای حاوی ۱۸٫۱ گرم با ۹۰٫۴ گرم واکنش داده شود به پرسشهای زیر پاسخ دهید.
- واکنش دهنده محدود کننده کدام است؟
- چند گرم تشکیل میشود؟
پیش از پاسخ دادن به سوال بهتر است ببینیم چه اطلاعاتی به ما داده شده و برای رسیدن به پاسخ چه چیزهایی نیاز داریم.
| دادههای سوال | موارد مورد نیاز |
| 18٫1 گرم | مول |
| 90٫4 گرم | مول |
| موازنه معادله واکنش | |
| معادله واکنش | |
پاسخ:
- تعیین واکنش دهنده محدود کننده
برای تعیین واکنش دهنده محدود کننده باید معادله واکنش موازنه شود.
- موازنه معادله واکنش:
- محاسبه مول :برای محاسبه مول آمونیاک نیاز به دانستن جرم مولی آن داریم که با مراجعه به جدول تناوبی جرم مولی برای برابر با ۱۷٫۰۳ گرم بر مول است.
$$18.1\require{cancel}\cancel{g\,NH_3}\times\frac{1mol\,NH_3}{17.03\require{cancel}\cancel{g\,NH_3}}$$
- محاسبه مول : جرم مولی برای برابر با ۷۹٫۵۵ گرم بر مول است.
$$90.4\require{cancel}\cancel{g\,CuO}\times\frac{1mol\,CuO}{79.55\require{cancel}\cancel{g\,CuO}}$$
با مقایسه مولهای واکنش دهندهها، واکنش دهنده محدود کننده را تعیین میکنیم تا ببینیم کدام یک اول مصرف میشود.
- بهدست آوردن نسبت مولی: باید نسبت مولی بین و در معادله موازنه شده نوشته شود که برابر با نسبت زیر است.
با توجه به مقدار مول بهدست آمده برای آمونیاک (۱٫۰۶ مول) و نسبت مولی، مقدار مول دقیق برای واکنش کامل محاسبه میشود.
$$1.06\require{cancel}\cancel{mol\,NH_3}\times\frac{3mol\,CuO}{1\require{cancel}\cancel{mol\,NH_3}}$$
بنابراین ۱٫۵۹ مول مس (II) اکسید برای واکنش کامل با ۱٫۰۶ مول گاز آمونیاک مورد نیاز است. از آنجایی که تنها ۱٫۱۴ مول مس (II) اکسید وجود دارد، مقدار محدود است و نشان دهنده این است که پیش از اینکه تمام شود مصرف میشود.
پس واکنش دهنده محدود کننده است.
- محاسبه جرم :
- بهدست آوردن نسبت مولی: باید نسبت مولی بین گاز نیتروژن تولیدی و مس (II) اکسید در معادله واکنش موازنه شده بهدست آورده شود.
- محاسبه مول :
$$1.14\require{cancel}\cancel{mol\,CuO}\times\frac{1mol\,N_2}{3\require{cancel}\cancel{mol\,CuO}}$$
جرم مولی برای برابر با ۲۸٫۰۲ گرم بر مول است. با استفاده از جرم مولی، مقدار گرم تولیدی به صورت زیر محاسبه میشود.
$$0.380\require{cancel}\cancel{mol\,N_2}\times\frac{28.02g\,N_2}{1\require{cancel}\cancel{mol\,N_2}}$$
بنابراین، از واکنش 18٫1 گرم گاز آمونیاک با 90٫4 گرم مس (II) اکسید، ۱۰٫۶ گرم گاز نیتروژن تولید میشود.

محاسبه بازده درصدی واکنش شیمیایی چیست؟
بیشترین مقدار مادهای که در یک واکنش با مصرف کامل واکنش دهنده محدود کننده میتواند تولید شود بازده نظری نامیده میشود. در عمل، به دلیل واکنشهای جانبی و عوامل مختلف، مقدار فراورده تولیدی با مقداری که محاسبه میشود برابر نیست. بازده درصدی واکنش از رابطه زیر محاسبه میشود.
۱۰۰ × (بازده نظری / بازده عملی) = بازده درصدی
در مثال پیش مقدار گرم محاسبه شده برای گاز نیتروژن (۱۰٫۶ گرم) بیشتری مقداری است که در آن واکنش میتواند تولید شود و بازده نظری واکنش است. اگر در عمل تنها ۶٫۶۳ گرم نیتروژن تولیده شده باشد بازده درصدی آن ۶۲٫۵ درصد خواهد شد که به صورت زیر محاسبه میشود.
$$\frac{6.63\,g\,\,N_2}{10.6\,g\,\,N_2}\times100\text{%}=62.5\text{%}$$
مثال سوم: متیل الکل یا متانول سادهترین الکل است که از آن به عنوان سوخت در اتومبیلهای مسابقهای استفاده میکنند و توانایی جایگزین شدن با بنزین را دارد. از ترکیب گاز کربن مونوکسید و هیدروژن میتوان متانول تولید کرد. فرض کنید ۶۸٫۵ کیلوگرم گاز کربن مونوکسید با ۸٫۶۰ کیلوگرم گاز هیدروژن واکنش داده شود.
- بازده نظری متانول را محاسبه کنید.
- اگر مقدار تولید شده متانول گرم باشد، بازده درصدی متانول چقدر است؟
| دادههای سوال | موارد مورد نیاز |
| ۶۸٫۵ کیلوگرم کربن مونوکسید | مول کربن مونوکسید |
| ۸٫۶۰ کیلوگرم گاز هیدروژن | مول گاز هیدروژن |
| گرم متانول تولید شده | تعیین واکنش دهنده محدود کننده |
| مقدار متانول تولید شده | |
| معادله واکنش | |
پاسخ:
- موازنه معادله واکنش:
- محاسبه مول گاز هیدروژن: جرم مولی برای برابر با ۲٫۰۱۶ گرم بر مول است.
$$8.60\require {cancel} \cancel {kg\,\,H_2}\times\frac{\require {cancel} \cancel {1000\,g\,\,H_2}}{\require {cancel} \cancel {1kg\,H_2}}\times\frac{1mol\,\,H_2}{\require {cancel} \cancel {2.016\,g\,H_2}}$$
- محاسبه مول کربن مونوکسید: جرم مولی برای برابر با ۲۸٫۰۲ گرم بر مول است.
$$65.5\require {cancel} \cancel {kg\,CO}\times\frac{\require {cancel} \cancel {1000g\,CO}}{\require {cancel} \cancel {1kg\,CO}}\times\frac{1mol\,CO}{\require {cancel} \cancel {28.02g\,CO}}$$
- تعیین واکنش دهنده محدود کننده: با استفاده از واکنش کامل هیدروژن و کربن مونوکسید و استفاده از نسب مولی آنها برای محاسبه متانول تولیدی میتوانیم واکنش دهنده محدود کننده را تعیین کنیم.
- مقدار متانول تولیده با نسب مولی هیدروژن
$$4.27\times10^3\require{cancel}\cancel{mol\,H_2}\times\frac{1mol\,CH_3OH}{2\require{cancel}\cancel{mol\,H_2}}$$
-
- مقدار متانول تولیده با نسب مولی کربن مونوکسید
$$2.44\times10^3\require{cancel}\cancel{mol\,CO}\times\frac{1mol\,CH_3OH}{1\require{cancel}\cancel{mol\,CO}}$$
مصرف کامل مقدار متانول کمتری تولید میکند، پس واکنش دهنده محدود کننده در اینجا گاز هیدروژن است.
- محاسبه بازده نظری متانول:
با استفاده از مقدار و نسبت مولی آن با متانول، بیشترین مقدار متانول تولیده شده را میتوان بهدست آورد.
$$4.27\times10^3\require{cancel}\cancel{mol\,H_2}\times\frac{1mol\,CH_3OH}{2\require{cancel}\cancel{mol\,H_2}}$$
با تبدیل مقدار مول به گرم، بازده نظری محاسبه میشود.
$$2.14\times10^3\require{cancel}\cancel{mol\,CH_3OH}\times\frac{32.04g\,CH_3OH}{1\require{cancel}\cancel{mol\,CH_3OH}}$$
- محاسبه بازده درصدی متانول: با استفاده از بازده نظری محاسبه شده () و بازده عملی داده شده در صورت سؤال () بازده درصدی متانول تولید شده ۵۲ درصد است که به صورت زیر محاسبه میشود.
$$\frac{3.57\times10^4\require{cancel}\cancel{g\,CH_3OH}}{6.86\times10^4\require{cancel}\cancel{g\,CH_3OH}}\times100\text{%}=52.0\text{%}$$

نمونه سوال استوکیومتری محلول
برای حل پرسشهای استوکیومتری محلولها مراحل زیر همیشه انجام میشود.
- کمیتهای موجود در سؤال به مول تبدیل میشوند.
- از ضرایب معادله واکنش موازنه شده برای محاسبه نسبتهای مولی استفاده میکنند.
- وقتی واکنشدهندهها مخلوط میشوند، واکنش دهنده محدود کننده باید تعیین شود زیرا واکنش دهنده محدود کننده مقدار فراورده را کنترل میکند.
- گونههای موجود در محلول باید مشخص شوند.
- برای محاسبه مول واکنشدهندهها باید از حجم محلول و مولاریته آن استفاده شود.
قوانین ساده حلالیت نمک ها در آب که بهتر است به خاطر بسپارید!
- نمکهای نیترات در آب محلول هستند.
- بیشتر نمکهای حاوی یونهای فلز قلیایی و یون آمونیوم محلول هستند.
- بیشتر نمکهای کلرید، برمید و یدید محلول هستند.
- نمکهای حاوی یونهای استثنا هستند.
- بیشتر نمکهای سولفات محلول هستند.
- نمکهای استثنا هستند.
- بیشتر هیدروکسیدها کم محلول هستند. نمکهای و ترکیبات مهم این گروهند. ترکیبات ، و کم محلول هستند.
- بیشتر نمکهای سولفید ، کربنات ، کرومات و فسفات، به جز سولفید کاتیونهای فلزات قلیایی کم محلول هستند.

مثال اول: چه جرمی از نیاز است تا در واکنش با ۱٫۵۰ لیتر از محلول ۰٫۱۰۰ مولار موجب شود همه یونهای به شکل رسوب کنند؟
| دادههای سوال | موارد مورد نیاز |
| مول |
پاسخ:
- یونهای موجود در محلول: در محلول مورد نظر یونهای زیر وجود دارند.
- معادله موازنه شده واکنش: باید توجه داشته باشید که در آب، محلول و نامحلول است. معادله یونی به صورت زیر است.
- یافتن مول واکنشدهنده در محلول:
پس از یافتن مقدار مول در محلول، با استفاده از نسبت مولی ۱:۱ بین و مقدار نیز ۰٫۱۵ مول محاسبه میشود. در نتیجه مقدار مول نیز برابر با ۰٫۱۵ است.
- محاسبه جرم :

مثال دوم: با مخلوط شدن محلولهای و ترکیب رسوب میکند. وقتی ۱٫۲۵ لیتر محلول با غلظت ۰٫۰۵۰۰ مولار با ۲ لیتر محلول با غلظت ۰٫۰۲۵۰ مخلوط میشود، جرم رسوبی را محاسبه کنید.
| دادههای سوال | موارد مورد نیاز |
| واکنش دهنده محدود کننده | |
پاسخ:
- معادله یونی واکنش:
- یونهای موجود در محلول: در محلول مورد نظر یونهای زیر وجود دارند.
- معادله موازنه شده واکنش: نمک در آب محلول و نامحلول است. معادله یونی به صورت زیر است.
- یافتن مول واکنشدهنده در محلول:
- یافتن واکنش دهنده محدود کننده: با توجه به نسبت مولی ۱:۱ یونهای و مقدار زودتر مصرف میشود، بنابراین، واکنش دهنده محدود کننده است.
- محاسبه جرم : با استفاده از نسب مولی بین واکنش دهنده محدود کننده و ، مقدار مول نیز محاسبه 0٫0500 میشود.
در نتیجه از مخلوط شدن دو محلول ۱۵٫۲ گرم رسوب خواهد کرد.
نمونه سوال استوکیومتری اسید و بازها
مثال سوم: دانشجویی برای استاندارد کردن محلول سدیم هیدروکسید از ۱٫۳۰۰۹ گرم پتاسیم هیدروژن فتالات حلشده در آب مقطر و فنولفتالئین به عنوان شناساگر استفاده میکند. محلول حاصل با سدیم هیدروکسید تا نقطه پایانی شناساگر تیتر میشود. تفاوت بین نقاط ابتدایی و انتهایی تیتراسیون نشان میدهد که ۴۱٫۲۰ میلی لیتر از محلول سدیم هیدروکسید برای واکنش با ۱٫۳۰۰۹ گرم KHP مورد نیاز است. غلظت محلول سدیم هیدروکسید را محاسبه کنید. جرم مولی پتاسیم هیدروژن فتالات، ۲۰۴٫۲۲ گرم بر مول است.
| دادههای سوال | موارد مورد نیاز |
| 1٫3009 گرم | مول |
| 41٫20 میلی لیتر سدیم هیدروکسید | واکنش دهنده محدود کننده |
پاسخ:
- معادله واکنش:
- یونهای موجود در محلول: در محلول مورد نظر یونهای زیر وجود دارند.
- مول :
$$1.3009\require{c}\cancel {g\,\,KHC_8H_4O_4}\times\frac{1mol\,\,KHC_8H_4O_4}{204.22\require{c}\cancel {g\,\,KHC_8H_4O_4}}$$
- تعیین واکنش دهنده محدود کننده: تا زمانی که یون هیدروکسید لازم تامین میشود واکنش دهنده محدود کننده نخواهیم داشت.
- مول : مقدار مول یون هیدروکسید به دلیل نسبت مولی برابر با برابر با است.
- محاسبه مولاریته محلول :
بنابراین، غلظت محلول سدیم هیدروکسید ۰٫۱۵۴۶ مولار است.

مثال چهارم: زیستشیمیدانی پسابِ فرایندی صنعتی که شامل تولیدات کربن تتراکلرید و اسید بنزوئیک میشود را آنالیز کردهاست. محلولی حاوی ۰٫۳۵۱۸ گرم از پساب، برای خنثیسازی به ۱۰٫۵۹ میلی لیتر با غلظت ۰٫۱۵۴۶ مولار نیاز دارد. درصد جرمی در نمونه اصلی را محاسبه کنید.
| دادههای سوال | موارد مورد نیاز |
| ۰٫۳۵۱۸ گرم پساب | مول |
| واکنش دهنده محدود کننده |
پاسخ:
- معادله موازنه شده یونی واکنش:
- یونهای موجود در محلول: در محلول مورد نظر یونهای زیر وجود دارند.
- مول :
$$10.59\require {c} \cancel {mL\,\,NaOH}\times\frac{\require {c} \cancel {1L}}{1000\require {c} \cancel {mL}}\times\frac{0.1546 mol\,\,OH^-}{\require {c} \cancel {L\,\,NaOH}}$$
- تعیین واکنش دهنده محدود کننده: تا زمانی که یون هیدروکسید لازم تامین میشود واکنش دهنده محدود کننده نخواهیم داشت.
- محاسبه جرم :
- محاسبه درصد جرمی در پساب:
$$\frac{0.1999\,\require {c} \cancel {g}}{0.3518\,\require {c} \cancel {g}}\times 100\text {%}=56.82\text {%} $$
درصد جرمی در نمونه اصلی برابر با ۵۶٫۸۲ درصد است.

نمونه سوال استوکیومتری گازها
با استفاده از قانون گازهای ایدهآل در محاسبات استوکیومتری گازها، بین مقادیر گازها و حجم آنها میتوانیم رابطهای برقرار کنیم. در این محاسبات باید اندازه فشار و دما مشخص باشد. گازها نیز مانند مواد مایع و جامد در آزمایشگاه میتوانند فراورده یا واکنش دهنده باشند، بنابراین محاسبه میزان آنها دارای اهمیت است. علاوه بر این، در صنعت به دلیل انتقال راحتتر گازها بیشتر واکنشهای مهم در فاز گازی انجام میشود.
با فرض رفتار ایدهآل برای گاز، در صورتی که فشار، حجم و دمای گازها مشخص باشد، میتوانیم محاسبات استوکیومتری را انجام دهیم. فرض کنید ۱ مول گاز ایدهآل در دمای ۲۷۳٫۲ کلوین (۰ درجه سلسیوس) و فشار ۱ اتمسفر داریم. حجم این گاز با استفاده از قانون گازهای ایدهآل به صورت زیر محاسبه میشود.
$$=\frac{(1.000\,\,\require {c} \cancel {mol})(0.08206\,\,L.\,\require {c} \cancel {atm}/\require {c} \cancel {K}\,.\, \require {c} \cancel {mol})(273.2\require {c} \cancel {K})}{1.000\,\,\require {c} \cancel {atm}}$$
حجم محاسبه شده، حجم مولی نام دارد که برای یک مول گاز ایدهال در برابر با ۲۲٫۴۲ لیتر است. شرایط دمای و فشار استاندارد یا نامیده میشود.

مثال اول: نمونهای از گاز نیتروژن در شرایط استاندارد ۱٫۷۵ لیتر حجم دارد. در این شرایط مقدار مول گاز نیتروژن چقدر است؟
پاسخ: با استفاده از حجم مولی گاز ایدهآل در مقدار مول گاز نیتروژن به صورت زیر محاسبه میشود.
مثال دوم: از تجزیه حرارتی کلسیم کربنات ، آهک تولید میشود. طبق معادله واکنش زیر اگر ۱۵۲ گرم کلسیم کربنات را حرارت دهیم چه مقدار کربن دیاکسید تولید خواهد شد.
معادله موازنه شده واکنش:
- محاسبه مول کلسیم کربنات: جرم مولی کلسیم کربنات، ۱۰۰٫۰۹ گرم بر مول است.
$$152\,\require {c} \cancel {g\,\,CaCO_3}\times\frac{1mol\,\,CaCO_3}{100.09\,\require {c} \cancel {g\,\,CaCO_3}}$$
- نسبت مولی:
- محاسبه مول کربن دیاکسید: چون نسبت مولی و در واکنش ۱:۱ است پس مول کربن دیاکسید برابر با ۱٫۵۲ است.
- محاسبه حجم کربن دیاکسید: با استفاده از حجم مولی گاز ایدهآل در مقدار مول گاز به صورت زیر محاسبه میشود.
بنابراین، تجزیه گرمایی ۱۵۲ گرم کلسیم کربنات در STP منجر به تولید ۳۴٫۱ لیتر گاز کربن دیاکسید میشود.

مثال سوم: گازهای متان و اکسیژن با شرایط زیر با یکدیگر مخلوط شدند.
- گاز متان:
- گاز اکسیژن:
با سوختن مخلوط این دو گاز، کربن دیاکسید و آب تولید میشود. در فشار ۲٫۵۰ اتمسفر و دمای ۱۲۵ درجه سلسیوس چه مقدار گاز کربن دیاکسید تولید میشود.
| ? | ||
| معادله واکنش | ||
پاسخ:
- معادله موازنه شده واکنش:
- تعیین واکنش دهنده محدود کننده: مقدار مول واکنش دهنده با استفاده از قانون گاز ایدهآل به صورت زیر محاسبه میشود.
-
- مول متان
$$n_{CH_4}=\frac{(1.65\,\require {c} \cancel {atm})(2.80\,\require {c} \cancel {L})}{(0.08206\,\,L.\,\require {c} \cancel {atm}/\require {c} \cancel {K}\,.\, \require {c} \cancel {mol})(298\require {c} \cancel {K})}$$
-
- مول اکسیژن
$$n_{O_2}=\frac{(1.25\,\require {c} \cancel {atm})(35.0\,\require {c} \cancel {L})}{(0.08206\,\,L.\,\require {c} \cancel {atm}/\require {c} \cancel {K}\,.\, \require {c} \cancel {mol})(304\require {c} \cancel {K})}$$
با استفاده از نسب مولی بین متان و اکسیژن در معادله واکنش ۱ مول به ۲ مول نیاز دارد؛ بنابراین مقدار مول اکسیژن به صورت زیر محاسبه میشود.
بنابراین، واکنش دهنده محدود کننده متان است.
- محاسبه مول : از نسبت مولی واکنش دهنده محدود کننده (متان) برای تعیین مولهای تولید شده استفاده میشود.
$$V_{(CO_2)}=\frac{(0.189\,\require {c} \cancel {mol})(0.08206\,\,L.\,\require {c} \cancel {atm}/\require {c} \cancel {K}\,.\, \require {c} \cancel {mol})(398\require {c} \cancel {K})}{2.50\,\require {c} \cancel {atm}}$$
در این شرایط ۲٫۴۷ لیتر گاز کربن دیاکسید تولید میشود.

نمونه سوال استوکیومتری آنتالپی
آنتالپی واکنش ، تغییر آنتالپی برای یک واکنش شیمیایی است که به مقدار واکنش دهندهها بستگی دارد. به عبارت دیگر، مقدار گرمایی که در واکنش شیمیایی تولید یا جذب میشود با مقدار واکنش دهندهها در ارتباط است. اندازه میتواند بازتاب دهنده مقادیر استوکیومتری واکنش دهندهها و فرارودهها باشد.
معادله واکنش سوختن پروپان که از گازهای اصلی تشکیل دهنده گاز الپیجی را در نظر بگیرید:
از این معادله میتوان دریافت که ۱ مول با ۵ مول واکنش میدهد و ۳ مول و ۴ مول تولید میشود و ۲۰۴۴ کیلوژول گرما نیز آزاد میشود. با استفاده از نسبت بین دو کمیت روابط استوکیومتری معادله به صورت زیر نوشته میشود.
یا
نسبتها نشان دهنده این است زمانی که ۱ مول و ۵ مول بهطور کامل واکنش نشان میدهند ۲۰۴۴ کیلوژول گرما آزاد میشود. با استفاده از این نسبتها میتوان بین مقادیر واکنش دهنده یا فراورده و مقدار گرمای آزاد یا جذب شده رابطهای برقرار کرد.

مثال: ۰٫۱۵۸ گرم فلز منیزیم با مقدار کافی هیدروکلریک اسید به حجم ۱۰۰٫۰ میلی لیتر گرماسنجی لیوانی را ایجاد میکنند. منیزیم به دلیل غلظت بالای اسید کاملاً واکنش میدهد و دمای محلول در نتیجه این واکنش از ۲۵٫۶ درجه به ۳۲٫۸ درجه سلسیوس افزایش مییابد. آنتالپی واکنش را محاسبه کنید. واکنش فلز منیزیم با هیدروکلریک اسید به صورت زیر است.
- چگالی محلول: ۱ گرم بر میلیلیتر
- ظرفیت گرمایی ویژه محلول: ۴٫۱۸ ژول بر گرم.سانتیگراد
پاسخ: در صورت سؤال جرم منیزیم، حجم محلول، دمای اولیه و نهایی، چگالی محلول و ظرفیت گرمایی ویژه محلول داده شدهاست و تغییر آنتالپی برای واکنش را باید پیدا کنید.
- محاسبه : برای محاسبه از رابطه زیر استفاده میشود.
-
- محاسبه جرم محلول
-
- محاسبه
در ادامه خواهیم داشت:
$$q_{soln}=1.00\times 10^2\,\require {cancel} \cancel {g}\times 4.18\,\frac{J}{\require {cancel} \cancel {g}.\require {cancel} \cancel {°C}}\times7.2\require {cancel} \cancel {°C}=3.0\times10^3\,J$$
- محاسبه : از مقدار محاسبه شده برای میتوانیم را بهدست آوریم.
- محاسبه : در فشار ثابت، آنتالپی واکنش از رابطه زیر محاسبه میشود.
-
- محاسبه مول منیزیم
$$0.158\,\require {c} \cancel {g\,\,Mg}\times\frac{1\,mol\,\,Mg}{24.31\,\require {c} \cancel {g\,\,Mg}} \\ =0.0064\,mol$$
در ادامه خواهیم داشت:
$$q_{soln}=1.00\times 10^2\,\require {cancel} \cancel {g}\times 4.18\,\frac{J}{\require {cancel} \cancel {g}.\require {cancel} \cancel {°C}}\times7.2\require {cancel} \cancel {°C}=3.0\times10^3\,J$$
استوکیومتری الکترولیز چیست؟
در سلولهای الکترولیتی از جریان الکتریکی برای انجام واکنش شیمیایی استفاده میشود و الکترونها در نقش واکنشگر عمل میکنند و بین آنها با فراورده و واکنشدهندهها رابطه استوکیومتری برقرار است. در الکترون مقدار، برحسب بار اندازهگیری میشود. با اندازهگیری بار کل جریان یافته، مقدار مول الکترونهایی سلول الکترولیتی قابل محاسبه است. این مقدار به بزرگی و زمان عبور جریان بستگی دارد.
بار کل از رابطه زیر بهدست میآید.
مقدار جریان (آمپر)×مدت زمان عبور جریان(ثانیه) = بار کل (کولن)
رابطه بین بار و مقدار مولهای الکترون با ثابت فارادی بدست میآید که از این رابطه برای حل مسائل مربوط به استوکیومتری سلولهای الکترولیتی استفاده میکنند.

مثال: با توجه به نیم واکنش زیر که مربوط به محلول حاوی است، از طلا برای آبکاری استفاده میشود. اگر جریان ۵٫۵ آمپری به مدت ۲۵ دقیقه اعمال شود چند گرم طلا آبکاری میشود.
پاسخ: مراحل محاسبه گرم طلای استفاده شده در آبکاری به صورت زیر است:
- تبدیل دقیقه به ثانیه
- محاسبه بار کل
- محاسبه تعداد مولهای الکترون با استفاده از رابطه ثابت فارادی
- محاسبه مول طلا با استفاده از استوکیومتری واکنش
- محاسبه جرم با با استفاده از جرم مولی طلا (196٫97 گرم بر مول)
$$25\,\require {cancel} \cancel {\min} \times\frac{60\,s}{1\require {cancel} \cancel {\min}} \times\frac{5.5\,C}{1\require {cancel} \cancel {s}} \times\frac{1\require {cancel} \cancel {mol\,e^-}}{96\,485\require {cancel} \cancel {C}} \\ \times\frac{1\require {cancel} \cancel {mol\,\,Au}}{3\require {cancel} \cancel {mol\,e^-}} \times\frac{196.97\,g\,\,Au}{1\require {cancel} \cancel {molAu}}$$
جمع بندی نمونه سوال استوکیومتری
در این مطلب از مجله فرادرس نمونه سوالات مختلف استوکیومتری را با یکدیگر حل کردیم. در واکنشهای شیمیایی، ماده بر اساس قانون بقای جرم نه ایجاد میشود و نه از بین میرود، بنابراین، مقدار فراورده و واکنشدهندهها با یکدیگر رابطه دارند. استوکیومتری اندازهگیری عناصر درون یک واکنش است و در واقع استفاده از ریاضیات در دانش شیمی است که با تبدیل کمیتهای مختلف برای پاسخ دادن به پرسشها، راهکاری ارائه میدهد. مهمترین و اولین قدم در حل مسائل استوکیومتری نوشتن معادله موازنه شدهاست.
آزمون نمونه سوال استوکیومتری
۱. استوکیومتری در علم شیمی چه کاربردی دارد؟
تعیین روابط مقداری بین مواد در واکنش
بررسی رنگ مواد شیمیایی در واکنش
تجدید ساختار مولکولی عناصر
افزایش سرعت واکنش شیمیایی
استوکیومتری به بررسی و تعیین روابط مقداری بین مواد شرکتکننده در واکنش شیمیایی گفته میشود؛ یعنی نسبت مقدار واکنشدهندهها و فراوردهها را بر اساس معادلات موازنه شده مشخص میکند. گزینه «تعیین روابط مقداری بین مواد در واکنش» صحیح است، در حالی که «بررسی رنگ مواد»، «افزایش سرعت واکنش» و «تجدید ساختار مولکولی عناصر» با استوکیومتری مرتبط نیستند.
۲. چرا موازنه بودن معادله واکنش شیمیایی در مسائل استوکیومتری اهمیت دارد؟
برای سادهتر کردن محاسبات جرم مولی است.
زیرا تنها بر واکنشدهنده محدود کننده تاثیر دارد.
زیرا در این حالت تعداد اتمهای هر عنصر در واکنشدهندهها و فراوردهها برابر است و این تساوی پایه همه محاسبات دقیق استوکیومتری است.
چون موجب تغییر مقدار بازده درصدی میشود.
موازنه بودن معادله واکنش اهمیت دارد زیرا در این حالت تعداد اتمهای هر عنصر در واکنشدهندهها و فراوردهها برابر است و این تساوی پایه همه محاسبات دقیق استوکیومتری است. اگر معادله نابرابر باشد، نسبتهای عددی برای محاسبه مقدار مواد صحیح بهدست نمیآید و نتایج اشتباه خواهد بود. بنابراین، «اجازه میدهد عدد اتمها و مقدار مواد با دقت محاسبه شود» صحیح است و سایر عبارات ناقص یا نامربوطاند.
۳. در حل مسائل استوکیومتری، کاربرد اصلی جرم اتمی میانگین با کاربرد جرم مولی چه تفاوتی دارد؟
جرم اتمی میانگین برای ترکیبات یونی و مولکولی و جرم مولی فقط برای گازها به کار میرود.
جرم اتمی میانگین همیشه از جرم مولی بیشتر است زیرا جرم الکترون لحاظ میشود.
جرم مولی فقط در واکنشهای آبی اهمیت دارد ولی جرم اتمی میانگین در جامدات کاربرد دارد.
جرم اتمی میانگین تنها برای یک اتم مفرد تعریف میشود ولی جرم مولی به یک مول از ماده مربوط است.
جرم اتمی میانگین ویژگی یک اتم منفرد است و جرم مولی به یک مول از ماده مربوط میشود؛ این تمایز برای محاسبات استوکیومتری ضروری است. گزینههایی مانند «جرم اتمی میانگین فقط برای ترکیبات یونی و مولکولی و جرم مولی فقط برای گازها»، «جرم اتمی میانگین همیشه از جرم مولی بیشتر است» و «جرم مولی فقط در واکنشهای آبی اهمیت دارد» نادرستاند، زیرا هر دو برای انواع مواد کاربرد دارند و نسبت عددی و اهمیت آنها متفاوت است.
۴. چرا تبدیل دقیق جرم به مول و برعکس در حل مسائل استوکیومتری اهمیت دارد؟
چون تبدیل جرم به مول نیازی به معادله موازنه شده ندارد.
زیرا تنها با اعداد صحیح میتوان واکنشهای شیمیایی را توضیح داد.
زیرا جرم همیشه مهمتر از سایر کمیتها در شیمی است.
چون مقایسه مقدار واکنشدهنده و فراورده بر اساس مول امکانپذیر است.
تبدیل صحیح جرم به مول یا برعکس در استوکیومتری اهمیت دارد زیرا تنها با دانستن مقدار مواد به صورت مول میتوان نسبت دقیق بین واکنشدهندهها و فراوردهها را تعیین کرد. کل محاسبات استوکیومتری بر مقایسه مقادیر مواد بر اساس مول و ضرایب معادلات موازنه شده استوار است. سایر گزینهها نادرستاند، زیرا اعداد صحیح به تنهایی کافی نیستند، جرم مهمتر از سایر کمیتها نیست و بدون معادله موازنه شده تبدیل جرم به مول بیمعناست.
۵. در روند حل یک پرسش استوکیومتری، استفاده مناسب از نسبت مولی مواد واکنشدهنده و فراوردهها در کدام مرحله الزامی است؟
تنها در پایان زمانی که مقدار فراورده را به واحد مناسب تبدیل میکنیم.
هنگام مقایسه تعداد مول مواد معلوم و مجهول برای یافتن مقدار ماده مجهول.
در هنگام موازنه کردن معادله شیمیایی واکنش.
زمانی که مقدار داده شده را به جرم تبدیل میکنیم.
در حل مسائل استوکیومتری، نسبت مولی مواد برای ارتباط میان مقدار داده شده و مقدار مجهول به کار میرود. این نسبت زمانی اهمیت دارد که پس از تبدیل مقدار ماده معلوم به مول، با مقایسه تعداد مولهای مواد معلوم و مجهول مقدار مورد نیاز محاسبه میشود. گزینههایی مانند «در هنگام موازنه معادله» یا «تبدیل مقدار داده شده به جرم» و «تبدیل فراورده به واحد مناسب» مستقیما با استفاده از نسبت مولی مرتبط نیستند.
۶. در حل مسائل استوکیومتری واکنش، برای تعیین واکنشدهنده محدودکننده چه روشی موثر است و این واکنشدهنده چه اثری بر مقدار نهایی فراورده دارد؟
محاسبه مول هر واکنشدهنده و مقایسه با نسبتهای معادله موازنه شده، زیرا واکنشدهندهای که زودتر تمام شود مقدار فراورده را مشخص میکند.
بر اساس جرم اولیه هر ماده و بدون توجه به معادله، فراورده را با استفاده از بیشترین جرم ممکن محاسبه میکنند.
با جمع مقدار واکنشدهندهها و تقسیم بین مواد فراورده مقدار نهایی محاسبه میشود.
همیشه واکنشدهنده با جرم کمتر محدودکننده است و مقدار فراورده را تعیین میکند.
برای تعیین واکنشدهنده محدودکننده، ابتدا مقدار هر واکنشدهنده را به مول تبدیل کرده و با ضرایب معادله موازنه شده مقایسه میکنیم. مادهای که زودتر از مقدار لازم تمام شود، واکنشدهنده محدودکننده است و مقدار فراورده بر اساس آن محاسبه میشود. روشهایی مانند استفاده از جرم اولیه تنها، فرض کمترین جرم بهعنوان محدودکننده یا جمع و تقسیم مقادیر واکنشدهندهها علمی نیست و با اصول استوکیومتری مطابقت ندارد.
۷. در صورتی که بازده عملی یک واکنش کمتر از بازده نظری باشد، بازده درصدی چه رابطهای با این دو مقدار دارد و بیانگر چیست؟
بازده درصدی تنها مقدار واکنشدهنده باقیمانده را محاسبه میکند.
بازده درصدی مجموع بازده عملی و نظری را بیان میکند و مقدار ماده مصرف شده را نشان میدهد.
بازده درصدی نسبت بازده عملی به نظری را نشان میدهد و شاخص کارایی واکنش است.
بازده درصدی تفاوت بازده نظری و عملی را به دست میدهد و بیانگر میزان مواد هدر رفته است.
بازده درصدی نسبت بازده عملی به بازده نظری را نشان میدهد و شاخص کارایی واکنش است. در محاسبات، بازده عملی بر بازده نظری تقسیم شده و در صد ضرب میشود تا میزان تحقق واکنش نسبت به مقدار تئوری مشخص گردد. گزینههایی که مجموع یا تفاوت این دو را معیار قرار میدهند یا بازده درصدی را معادل مقدار واکنشدهنده باقیمانده میدانند، نادرستاند.
۸. در حل مسائل استوکیومتری محلولها، قوانین حلالیت یونها و محاسبات مولاریته در کدام بخش اهمیت دارند؟
در بررسی تغییرات دما و تعیین سرعت واکنش
در تعیین تعداد واکنشدهندههای محدودکننده بر اساس جرم اتمی
در پیشبینی وجود یا عدم وجود رسوب و محاسبه مقدار مواد
در تعیین حجم نهایی محلول و شناسایی یون غالب
قوانین حلالیت یونها و محاسبات مولاریته برای پیشبینی تشکیل رسوب و محاسبه مقدار مواد در واکنشهای محلولی کاربرد دارند. گزینه «در پیشبینی وجود یا عدم وجود رسوب و محاسبه مقدار مواد» صحیح است، زیرا بررسی حلالیت یونها نشان میدهد آیا رسوب تشکیل میشود و استفاده از مولاریته مقدار دقیق ماده مصرفی یا تولیدی را تعیین میکند.
۹. در یک فرآیند تیتراسیون اسید و باز، برای تعیین غلظت محلول مجهول تنها با داشتن حجم و غلظت محلول استاندارد و حجم مصرفی محلول مجهول، چه روشی مناسب است؟
استفاده از نسبتهای مولی واکنش و حل معادله غلظت با دادههای حجم
محاسبه میانگین حجمهای مصرفی و ضرب آن در چگالی محلول
محاسبه جرم محلول و جایگذاری در معادله چگالی
مقایسه جرمهای مواد اولیه طبق قانون بقای جرم
روش صحیح تعیین غلظت محلول مجهول در تیتراسیون، تبدیل حجم و غلظت محلول استاندارد به تعداد مول، استفاده از نسبتهای مولی معادله برای یافتن تعداد مول محلول مجهول و سپس محاسبه غلظت آن با رابطه مولاریته است.
۱۰. برای تبدیل حجم یک گاز به مول بر اساس شرایط فشار و دما، با استفاده از معادله گاز ایدهآل چه کاری باید انجام داد؟
ابتدا حجم را بر دمای مطلق تقسیم میکنیم.
حجم، فشار و دما را در معادله گاز ایدهآل قرار میدهیم و مقدار n را محاسبه میکنیم.
فقط حجم را به لیتر تبدیل کرده و معادله را حل میکنیم.
حجم را با فشار جمع کرده و بر عدد آووگادرو تقسیم میکنیم.
برای تبدیل حجم گاز به مول، باید مقادیر حجم، فشار و دما را همزمان در معادله گاز ایدهآل (PV=nRT) جایگذاری کرده و نسبت به n معادله را حل کرد. تنها گرفتن حجم یا جمع کردن مقادیر کافی نیست و استفاده از همه این دادهها مطابق روابط معادله نتیجه درست میدهد.
۱۱. در مسائل الکترولیز، چگونه میتوان مقدار جرم ماده تولید شده در یک سلول الکترولیتی را از مقدار بار الکتریکی (کولن) محاسبه نمود؟
با استفاده از تعداد الکترون در معادله و صرفا ضرب جرم مولی در تعداد مول بار
با تقسیم مقدار بار الکتریکی بر ثابت فارادی و استفاده از معادله استوکیومتری برای یافتن جرم
با ضرب بار الکتریکی در جرم مولی و تقسیم بر ثابت فارادی بدون توجه به نسبت مولی
با جمع بار الکتریکی و جرم مولی و استفاده مستقیم از قانون بقای جرم
برای محاسبه جرم ماده حاصل از الکترولیز، ابتدا مقدار بار الکتریکی را بر ثابت فارادی (F) تقسیم میکنند تا تعداد مول الکترونها بهدست آید. سپس با استفاده از معادله موازنه شده و نسبت مولی بین الکترون و ماده، مقدار ماده تولیدی تعیین میشود.













عالی دمتون گرم