رادیواکتیو چیست؟ – به زبان ساده + مواد و خاصیت

بیشتر افراد به هنگام شنیدن کلمه رادیواکتیو دچار ترس میشوند. این پدیده نخستین بار در سال ۱۸۹۶ میلادی توسط «آنتوان هنری» (Antoine Henry Becquerel) کشف شد. این دانشمند در حال مطالعه چگونگی تیره شدن قطعهای فیلم نازک توسط اورانیوم بود که به ویژگی رادیواکتیو این عنصر پی برد. به تابش انرژی توسط هر جسمی، تشعشع گفته میشود. در این مطلب از مجله فرادرس در مورد تشعشع مواد و عناصر رادیواکتیو صحبت میکنیم و انواع تشعشع را به زبان ساده توضیح میدهیم.
رادیواکتیو چیست ؟
کلمه رادیواکتیو را بارها در زندگی روزمره شنیدهایم. رادیواکتیو از دو کلمه انگلیسی تشکیل شده است:
- radius یا ray به معنای اشعه یا اشعه تابشی
- activus به معنای فعالیت
بنابراین، رادیواکتیو به معنای فعالیت تشعشعی است. رادیواکتیو مشخصه رفتاری هسته اتمهای ناپایدار است که خودبهخود به هستههای مختلفی واپاشیده میشوند. به هنگام واپاشی هسته اولیه به هستههای ثانویه، تشعشع رخ میدهد. اتمهای مختلفی با هستههای ناپایدار وجود دارند. آنتوان هنری نخستین کسی بود که این پدیده را در سال ۱۸۹۶ میلادی مشاهده کرد. دو سال بعد، «ماری و پیر کووری» (Marie and Pierre Curie) از واژه رادیواکتیو برای تشعشع استفاده کردند. رادیواکتیو به دلیل واپاشی هسته اتم رخ میدهد. اما سوالی که ممکن است مطرح شود آن است که چرا هسته اتمی باید واپاشیده شود.
هسته اتم از پروتون با بار الکتریکی مثبت و نوترون با بار الکتریکی خنثی تشکیل شده است. در هسته اتم پایدار، تعداد پروتونها برابر نوترونها است. اما اگر تعداد نوترونها نسبت به پروتونها کمتر یا بیشتر باشد، تعادل داخل هسته اتم به هم میخورد. در نتیجه، هسته ناپایدار و از هم پاشیده میشود. توجه به این نکته مهم است که تاکنون بیش از ۳۰۰۰ هسته اتم رادیواکتیو شناخته شدهاند. این تعداد با توجه به ویژگیهایشان به گروههای مختلفی تقسیم میشوند. به عنوان مثال، تقسیمبندی ممکن است براساس نوع تشعشع انجام شود، تشعشع آلفا، بتا و گاما. عامل مهم دیگر برای تقسیمبندی مواد رادیواکتیو براساس نیمهعمر آنها انجام میشود. نیمهعمر، بازه زمانی است که پس از آن از نظر آماری، نیمی از هستههای مقدار اولیه مشخص، واپاشیده شدهاند. نیمهعمر برخی از هستههای رادیواکتیو کوتاه و برخی از آنهای طولانی است. در ادامه، در مورد این مشخصهها با جزییات بیشتری صحبت میکنیم.

هستههای رادیواکتیو ممکن است با توجه به منشا آنها نیز گروهبندی شوند:
- هستههای رادیواکتیو مصنوعی: این هستهها طی فرایندهای آزمایشگاهی به وجود میآیند. به عنوان مثال، سزیم ۱۳۷ طی فرایندهای شکافت هستهای در نیروگاههای هستهای یا «تکنیتیوم ۹۹» (Technetium 99) در کاربردهای پزشکی توسط اشعه تشکیل میشود.
- هستههای رادیواکتیو طبیعی: این هستهها در طبیعت و بدون دخالت انسان، وجود دارند. برخی از این هستهها توسط تشعشع پرتوها تولید میشوند. کربن ۱۴ مهمترین مثال از هستههای رادیواکتیو طبیعی است که از آن برای تعیین سن فسیلها استفاده میشود. برخی دیگر از این هستهها به هنگام تولد کیهان و شکلگیری ستارهها، تولید شدند. اورانیوم ۲۳۵ یکی از معروفترین هستههای رادیواکتیو در زمین است. همچنین، هسته رادیواکتیو طبیعی دیگری به نام پتاسیم ۴۰ وجود دارد که در بدن انسان یافت میشود.
در مطالب بالا گفتیم رادیواکتیو مشخصه هسته اتمهای ناپایدار است. برای داشتن درک بهتری از مفهوم رادیواکتیو، ابتدا در مورد اندازه و چگالی هسته، نقصان جرم و انرژی پیوندی، پایداری هستهای و معادلات هستهای صحبت میکنیم.
چگالی و اندازه هسته
در آزمایش پراکندگی ذرات آلفا (ذرات هلیوم) از ورقه بسیار نازکی از طلا استفاده شد. در این آزمایش، اتمهای طلا توسط ذرات آلفا بمباران شدند. ذرات آلفا مثبت هستند و در مسیری مستقیم به سمت اتمهای طلا حرکت میکنند. از آنجا که هستههای طلا نیز مثبت هستند، ذرات آلفا پس از نزدیک شدن به این هستهها از مسیر مستقیم منحرف میشوند. هر چه فاصله ذرات آلفا از هستههای طلا کمتر باشد، انحراف آنها از مسیر مستقیم بیشتر خواهد شد. تا جایی که زاویه انحراف در فاصلههای بسیار نزدیک به ۱۸۰ درجه نزدیک میشود.
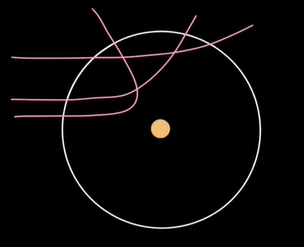
در آزمایش رادرفورد برخورد رودرروی ذرات آلفا با هستههای طلا مورد بررسی قرار گرفت. در این حالت، ذرات آلفا پس از نزدیک شدن به هستههای طلا به طور کامل تغییر مسیر میدهند (زاویه انحراف آنها برابر ۱۸۰ درجه میشود). توجه به این نکته مهم است که ذرات آلفا نمیتوانند به طور کامل به هستههای طلا نزدیک شوند، بلکه در فاصله مشخصی از آنها، در حدود $$3.2 \times 10 ^ { -14}$$ متر، ۱۸۰ درجه منحرف خواهند شد. این عدد محدوده اندازه هسته طلا را مشخص میکند. در واقع، اندازه هسته طلا نمیتواند از این عدد بیشتر باشد. به هنگام صحبت در مورد اندازه هسته میتوانیم شعاع آن را نیز در نظر بگیریم. شعاع هسته طلا نمیتواند از عدد $$3.2 \times 10 ^ { -14}$$ بیشتر باشد. بنابراین، این عدد اندازه واقعی هسته یا شعاع هسته طلا را به ما نمیدهد، اما محدود اندازه هسته را مشخص میکند.
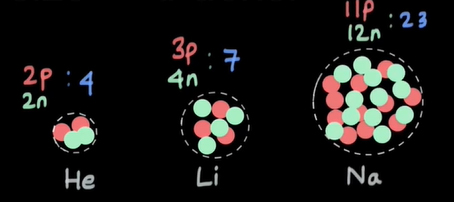
نهتنها ذرات آلفا، بلکه ذرات دیگری مانند الکترون نیز میتوانند به هسته اتمهای مختلف برخورد کنند. در تمام این آزمایشها مشخص شد که حجم هسته اتم به طور مستقیم متناسب با تعداد پروتونها و نوترونهای داخل هسته است. تعداد پروتونها و نوترونهای داخل هسته، عدد جرمی را به ما میدهد. بنابراین، حجم هسته متناسب با عدد جرمی است. هسته هلیوم با دو پروتون و دو نوترون را در نظر بگیرید. عدد جرمی هلیوم برابر ۴ است. این عدد اندازه هسته هلیوم را نیز مشخص میکند. در ادامه، هسته اتم سنگینتری مانند لیتیوم را در نظر میگیریم. هسته لیتیوم از ۳ نوترون و ۴ پروتون تشکیل شده و عدد جرمی و اندازه آن برابر هفت است. هر چه تعداد پرتونها و نوترونهای تشکیلدهنده هسته اتم بیشتر باشد، عدد جرمی و در نتیجه اندازه هسته بزرگتر خواهد بود. در واقع هر چه تعداد پروتونها و نوترونهای داخل هسته بیشتر باشد، فضای بزرگتری را اشغال میکنند.
گرچه بیشتر هستهها کروی شکل هستند، برخی از آنها شکلهای مختلفی دارند. توجه به این نکته مهم است که حتی هستههای کروی شکل، به طور کامل کروی نیستند. بنابراین، حجم بیشتر هستهها با استفاده از فرمول $$\frac { 4 } { 3 } \pi R ^ 3$$ بهدست میآید. $$R$$ در این رابطه شعاع هسته و نه اتم است. از آنجا که عدد جرمی متناسب با حجم هسته و حجم متناسب با $$R ^ 3$$ است، عدد جرمی نیز با مکعب شعاع هسته متناسب خواهد بود.
$$R ^ 3 \propto A R \propto A ^ { \frac { 1 } { 3 } }$$
اگر به جای علامت تناسب، علامت مساوی قرار دهیم، ثابتی به نام $$R_0$$ را به رابطه بالا اضافه میکنیم.
$$R = R _ 0 A ^ { \frac { 1 } { 3} }$$
شعاع هسته اتم با استفاده از رابطه بالا بهدست میآید. مقدار $$R_0$$ به صورت تجربی برابر $$1.2 \times 10^ { -15}$$ متر یا ۱/۲ فمتومتر محاسبه شده است. تا اینجا، میدانیم شعاع هسته اتم چگونه محاسبه میشود. در ادامه میتوانیم در مورد چگالی هسته صحبت کنیم. سوالی که ممکن است مطرح شود آن است که آیا با اضافه کردن نوترون و پروتون بیشتر به هسته، چگالی آن را افزایش میدهیم. چگالی از تقسیم جرم بر حجم بهدست میآید. به عنوان مثال، هسته اتم هلیوم را در نظر بگیرید. جرم هسته هلیوم برابر مجموع جرم تمام پروتونها و نوترونهای داخل هسته است.
$$\rho = \frac { m } { V} \rho = \frac { A \times 1 amu} { \frac { 4 } { 3 } \pi R ^ 3 }$$
به جای R در رابطه بالا میتوان از رابطه $$R_ 0 A ^ {\frac { 1} {3 }}$$ استفاده کرد.
$$\rho = \frac {A \times 1.6 \times 10 ^ { - 27 } kg } { \frac { 4 } { 3 } \pi R _ 0 ^ 3 A}$$
عدد جرمی، A، را میتوان از صورت و مخرج رابطه بالا حذف کرد. بنابراین، چگالی هسته برابر حاصلضرب و تقسیم تعدادی عدد ثابت است و به تعداد پروتونها و نوترونهای هسته بستگی ندارد. اگر عددهای رابطه فوق را در یکدیگر ضرب و سپس صورت و مخرج کسر را بر یکدیگر تقسیم کنیم، مقدار چگالی هسته برابر $$2.3 \times 10 ^ {1 7 } \frac { kg } { m ^ 3 }$$ بهدست میآید. شاید از خود بپرسید چرا چگالی هسته عدد ثابتی است. برای درک بهتر این موضوع، آب را در نظر بگیرید. آیا چگالی قطرهای آب با چگالی حجم زیادی از آب متفاوت است؟ خیر.
نقصان جرم و انرژی پیوندی
میدانیم هسته اتم از نوترونها و پروتونها تشکیل شده است. به عنوان مثال، اتم هلیوم را به صورت زیر در نظر بگیرید:

عدد اتمی این عنصر برابر ۲ است. بنابراین، هسته هلیوم از دو پروتون تشکیل شده است. اگر عدد جرمی یعنی ۴ را از عدد اتمی کم کنیم، تعداد نوترونهای داخل هسته بهدست میآید. با دانستن جرمهای پروتون و نوترون و جمع کردن جرمهای تمام پروتونها و نوترونها با یکدیگر، جرم تقریبی هسته هلیوم را میتوانیم بهدست آوریم. جرم پروتون برحسب amu برابر ۱/۰۰۷۲۷۶۴۷ است. از آنجا که دو پروتون در هسته هلیوم وجود دارند، عدد داده شده را باید در ۲ ضرب کنیم:
$$p^ + 1.00727647 \times 2 = 2.01455294 amu$$
جرم نوترون برحسب amu برابر ۱/۰۰۸۶۶۴۹۰ است. از آنجا که دو نوترون در هسته هلیوم وجود دارند، عدد داده شده را باید در ۲ ضرب کنیم:
$$p^ + 1.00727647 \times 2 = 2.0173298 amu$$
با جمع دو عدد بالا با یکدیگر به عدد $$4.03188274 amu$$ میرسیم. عدد بهدست آمده، جرم پیشبینی شده برای هسته هلیوم است. اما جرم اندازهگیری شده برای هسته هلیوم برابر $$4.00150608 amu$$ محاسبه شد. همانطور که دیده میشود جرم محاسبه شده کمتر از جرم پیشبینی شده است. چرا؟
عدد پیشبینی شده برای جرم هلیوم را از عدد بهدست آمده کم میکنیم:
$$4.03188274 - 4.00150608 = 0.03037666$$
عدد بهدست آمده نقصان جرم نامیده میشود.
نقصان جرم: به تفاوت جرم بین جرم واقعی هسته و جرم پیشبینی شده آن، نقصان جرم گفته میشود.
اینگونه به نظر میرسد که قسمتی از جرم هسته از بین رفته است. در واقع، نقصان جرم، هنگام تشکیل هسته به انرژی تبدیل میشود. برای آنکه بدانیم این مقدار جرم به چه مقدار انرژی تبدیل میشود از رابطه معروف اینشتین یعنی $$E = m c ^ 2$$ استفاده میکنیم. در این رابطه، جرم برحسب کیلوگرم نوشته میشود، اما جرم محاسبه شده و جرم نظری برحسب amu بیان شدهاند. بنابراین، ابتدا جرم را به کیلوگرم تبدیل میکنیم:
$$1 amu = 1.66054 \times 10 ^ { -27 } kg$$
با داشتن رابطه فوق، نقصان جرم را برحسب کیلوگرم بیان میکنیم:
$$0.03037666 amu \times \frac { 1. 66054 \times 10 ^ { -27 } kg } {1 amu} = 5.04417 \times 10 ^ { -279} kg$$
در ادامه، مقدار انرژی را بهدست میآوریم:
$$E = m c ^ 2 E = ( 5. 04417 \times 10 ^ { -29} ) ( 2.99792 \times 10 ^ 8 ) ^ 2 = 4.53346 \times 10 ^ { -12} J$$
بنابراین، به هنگام تشکیل هسته مقدار$$4. 53346 \times 10 ^ { -12} J$$ انرژی آزاد میشود. قبل از تشکیل هسته هلیوم، دو پروتون و دو نوترون به صورت جدا از هم داشتیم. برای آنکه هسته اتم هلیوم تشکیل شود، دو پروتون با بار مثبت و دو نوترون باید نزدیک یکدیگر قرار بگیرند. هنگامی که دو پروتون و دو نورتون برای تشکیل هسته کنار یکدیگر قرار میگیرند، مقداری انرژی آزاد میشود. از آنجا که انرژی به هنگام تشکیل هسته آزاد شده است، هسته تشکیل شده پایدار است. توجه به این نکته مهم است که اگر بخواهیم هسته اتمی را به اجزای تشکیلدهنده آن بشکنیم، باید به آن انرژی دهیم. انرژی داده شده به هسته برای تجزیه آن نیز برابر $$4. 53346 \times 10 ^ { -12} J$$ خواهد بود. به این انرژی، انرژی پیوندی هسته گفته میشود.
پایداری هسته و معادلات هسته ای
در مطالب بالا در مورد هسته اتم هلیوم صحبت کردیم که از دو پروتون و دو نوترون تشکیل شده است. به پروتونها و نوترونهای داخل هسته، نوکلئون گفته میشود. همچنین، میدانیم به هنگام تشکیل هسته اتم، مقداری انرژی آزاد میشود. بنابراین، هسته تشکیل شده پایدار است. با توجه به آنکه پروتونهای داخل هسته بار یکسان و مثبت دارند و یکدیگر را دفع میکنند، شاید این سوال مطرح شود که چرا هسته اتم از هم نمیپاشد. بنابراین، باید نیروی بسیار قویتری نسبت به نیروی دافعه الکترواستاتیکی بین پروتونها وجود داشته باشد که هسته اتم را نگه داشته است. این نیرو، نیروی هستهای قوی نام دارد. این نیرو بسیار بزرگتر از نیروی دافعه الکترواستاتیکی است. به این نکته توجه داشته باشید که نیروی هستهای قوی کوتاهبرد است و تنها بین نوکلئونهای داخل هسته وارد میشود. نکته مهم در اینجا، پایداری هسته است.
عدد اتمی، تعداد پروتونهای هسته اتم را بیان میکند و با Z نشان داده میشود. همچنین، تعداد نوترونهای هسته اتم را با N نشان میدهیم. نسبت تعداد پروتونها به نوترونها به صورت $$\frac { N} { Z}$$ نشان داده میشود. به عنوان مثال، در اتم هلیوم این نسبت برابر $$\frac { N } { Z} = \frac { 2 } { 2 } = 1$$ است. اگر تعداد پروتونها، Z، کمتر از ۲۰ باشد، و نسبت تعداد پروتونها به تعداد نوترونها برابر یک باشد، هسته اتم پایدار خواهد بود. بنابراین، هسته هلیوم پایدار است، زیرا تعداد پروتونها و نوترونهای آن با یکدیگر برابر هستند و همچنین تعداد پروتونهای دخل هسته کمتر از ۲۰ است.
مثال دیگری مانند کربن ۱۴ را در نظر بگیرید. تعداد پروتونهای این عنصر برابر ۶ و تعداد نوترونهای آن برابر ۸ است. نسبت تعداد نوترونها به پروتونها برای این عنصر برابر است با:
$$ \frac { N} { Z} = \frac {6} { 8}$$
همانطور که دیده میشود تعداد پروتونهای کربن بیشتر از ۲۰ و نسبت تعداد پروتونها به نوترونها مخالف یک است. بنابراین، نخستین احتمالی که برای هسته کربن ۱۴ متصور میشویم آن است که ناپایدار باشد. به بیان دیگر، هسته اتم کربن ۱۴ رادیواکتیو است و به طور خودبهخودی واپاشیده میشود. در ادامه، معادله هستهای واپاشی خودبهخودی کربن ۱۴ را مینویسیم.
$$^ { 14 } _ 6 C \rightarrow ^ { 0 } _ { - 1 } e + ^ { 14 } _ 7 N$$
همانطور که در معادله هستهای فوق دیده میشود، هسته کربن ۱۴ یک الکترون را بیرون میاندازد. از آنجا که بار الکتریکی کربن ۱۴ برابر ۶+ و بار الکتریکی الکترون خارج شده برابر ۱- است، هسته کربن ۱۴ به هسته نیتروژن تبدیل میشود. هسته نیتروژن از ۷ پرتون و ۷ نوترون تشکیل شده است، در نتیجه نسبت تعداد پروتونها به تعداد الکترونها برابر یک خواهد بود. از اینرو، هسته نیتروژن ایجاد شده پایدار است.
در معادلات هستهای، تعداد نوکلئونها ثابت باقی میماند. به عنوان مثال، در معادله واپاشی هسته کربن ۱۴، تعداد نوکلئونها در هر طرف واکنش برابر ۱۴ است. همچنین، پایستگی بار الکتریکی نیز در معادلات هستهای حفظ میشود. در معادله واپاشی هسته کربن ۱۴، بار الکتریکی در سمت چپ واکنش برابر ۶+ و در سمت راست معادله نیز برابر $$(7-1)+6$$ است. به این نکته توجه داشته باشید که کربن ۱۴ پس از انجام واکنش به نیتروژن تبدیل شده است. هسته نیتروژن از ۷ پروتون و ۷ نوترون تشکیل شده است. بنابراین، نسبت تعداد پروتونها به نوترونها برابر یک و اتم نیتروژن پایدار است.
با افزایش تعداد پروتونها، نسبت $$\frac { N} { Z}$$ تغییر خواهد کرد و برابر ۱/۵ میشود. با افزایش تعداد پروتونها در هسته به تعداد نوترونهای بیشتری نیز نیاز داریم. چرا؟ فرض کنید هسته بزرگی داریم که در آن دو پروتون وجود دارند. پروتونها توسط نیروی دافعه الکترواستاتیکی یکدیگر را دفع میکنند. اما نیروی هستهای قوی بین پروتونها، آنها را کنار یکدیگر نگه میدارد. در این حالت و در فاصله بسیار کوچک، نیروی هستهای قوی بر نیروی دافعه الکترواستاتیکی غلبه میکند. از آنجا که هسته فرض شده اندازه بزرگی دارد، پروتونهای دیگری را میتوان در نقاط مختلف آن قرار داد.
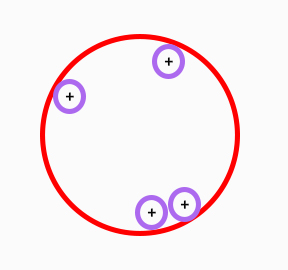
نیروی دافعه الکترواستاتیکی بین دو پروتونی که در فاصله دورتری نسبت به یکدیگر قرار دارند نیز وجود دارد. بنابراین، پروتونها یکدیگر را دفع میکنند. اما نیروی هستهای قوی به دلیل فاصله زیاد پروتونها از یکدیگر وجود ندارد. با افزایش پروتونها در هسته، نیروی دافعه الکترواستاتیکی را زیاد میکنیم. سرانجام به نقطهای میرسیم که به نیروی هستهای قوی نیاز داریم. از اینرو، باید تعداد نوترونها را داخل هسته افزایش دهیم. در نتیجه، تعادل نیرویی برقرار میشود. اگر تعداد پروتونهای هسته بیشتر از ۸۳ شود، نیروی دافعه الکترواستاتیکی به اندازهای قوی میشود که تقریبا تمام هستهها ناپایدار میشوند.
نمودار انرژی پیوندی در هسته ها
قبل از صحبت در مورد نمودار انرژی پیوندی در هستهها باید بدانیم انرژی پیوندی در هسته چیست. به مقدار انرژی لازم برای تجزیه هستهها و شکستن آنها به قسمتهای کوچکتر، انرژی پیوندی گفته میشود. به عنوان مثال، انرژی پیوندی اکسیژن ۱۶ در حدود ۱۲۸ مگا الکترونولت است. این عدد به چه معنا است؟ اگر بخواهیم تمام ۱۶ پروتون و نوترون داخل هسته اکسیژن را از یکدیگر جدا کنیم به انرژی برابر ۱۲۸ مگا الکترونولت نیاز داریم. هسته اورانیوم ۲۳۵ را در نظر بگیرید. انرژی پیوندی این هسته برابر ۱۷۸۶ مگا الکترونولت است، یعنی برای شکستن هسته اورانیوم و جدا کردن تمام پروتونها و نوترونهای داخل آن به انرژی در حدود ۱۷۸۶ مگا الکترونولت نیاز داریم.
همانطور که دیدیم انرژی پیوندی اورانیوم ۲۳۵ بیشتر از انرژی پیوندی اکسیژن ۱۶ است. آیا این بدان معنا است که اورانیوم ۲۳۵ پایدارتر از اکسیژن ۱۶ است؟ در نگاه نخست، اینگونه به نظر میرسد که اورانیوم ۲۳۵ پایدارتر از اکسیژن ۱۶ است، اما به طور قطع اکسیژن با شنیدن این پاسخ بسیار عصبانی خواهد شد. زیرا مقدار انرژی پیوندی عامل مناسبی برای مقایسه پایداری هسته اتمهای مختلف با یکدیگر نیست. برای مقایسه پایداری هستههای مختلف با هم باید از عدد یکسانی استفاده کنیم. چگونه میتوان این کار را انجام داد؟ برای انجام این کار به سوال زیر پاسخ میدهیم:
مقدار انرژی لازم برای جدا کردن یک پروتون یا یک نوترون از اکسیژن ۱۶ و اورانیوم ۲۳۵ چه مقدار است؟
با پاسخ به این پرسش به راحتی میتوانیم پایداری هستههای مختلف را با یکدیگر مقایسه کنیم. مقدار انرژی لازم برای جدا کردن ۱۶ پروتون و نوترون در اکسیژن برابر ۱۲۸ مگا الکترونولت است. بنابراین، برای بهدست آوردن مقدار انرژی لازم برای جدا کردن یک پروتون یا یک نوترون از هسته اکسیژن ۱۶ تنها کافی است که ۱۲۸ را بر ۱۶ تقسیم کنیم. بنابراین، مقدار انرژی لازم برای جدا کردن یک پروتون یا نوترون از هسته اکسیژن ۱۶ برابر ۸ مگا الکترونولت خواهد بود. این مقدار انرژی در اورانیوم ۲۳۵ برابر ۷/۶ مگا الکترونولت است. از اینرو، برای جدا کردن یک پروتون یا نوترون از هسته اورانیوم ۲۳۵ به انرژی کمتری در مقایسه با اکسیژن ۱۶ نیاز داریم. اکنون میتوانیم بپرسیم کدام هسته پایدارتر است و به راحتی اکسیژن ۱۶ را انتخاب کنیم.
نمودار انرژی پیوند برحسب عدد جرمی
در نتیجه، هنگامی که در مورد پایداری هسته اتمهای مختلف صحبت میکنیم، ابتدا باید انرژی پیوندی آنها را بر عدد جرمی تقسیم کنیم. با انجام این کار انرژی پیوندی بر واحد نوکلئون را بهدست میآوریم. با مقایسه انرژی پیوندی عنصرهای مختلف با یکدیگر به راحتی میتوانیم در مورد پایداری آنها صحبت کنیم. برای راحتی کار، نمودار انرژی پیوندی بر هر نوکلئون را برای تمام عناصر جدول تناوبی رسم و آنها را با یکدیگر مقایسه میکنیم. این نمودار در تصویر زیر رسم شده است.
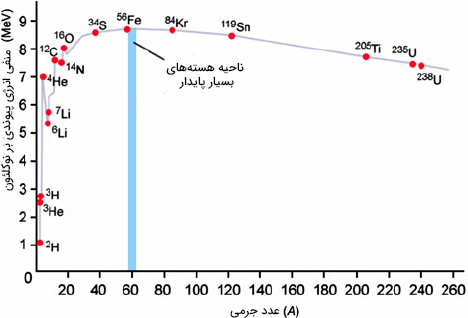
با توجه به نمودار رسم شده، در هستههای سبکتر، یعنی عدد جرمی کمتر از ۵۶، انرژی پیوندی بر نوکلئون با افزایش تعداد پروتونها و نوترونها در هسته، افزایش مییابد. به بیان دیگر، با افزایش تعداد نوترونها و پروتونهای هسته، هستهها پایدارتر میشوند. سپس، مقدار انرژی پیوندی به مقدار بیشینه خود میرسد و پس از آن با آهنگ بسیار کوچکی، کاهش مییابد. در واقع، مقدار انرژی پیوندی پس از رسیدن به مقدار بیشینه خود، کموبیش ثابت میماند. شاید این سوال در ذهن شما ایجاد شده باشد که انرژی پیوندی کدام عنصر بیشینه است. آهن ۵۶، بیشترین مقدار انرژی پیوندی بر نوکلئون را دارد. بنابراین، آهن ۵۶ پایدارترین عنصر در جدول تناوبی و جهان و مقدار انرژی پیوندی آن در حدود ۸/۵ مگا الکترونولت است.
چرا انرژی پیوندی با عدد جرمی افزایش می یابد ؟
سوال دیگری که ممکن است مطرح شود آن است که چرا انرژی پیوندی در ابتدا با افزایش عدد جرمی به سرعت افزایش و در ادامه، با آهنگ بسیار ملایمی کاهش مییابد. پاسخ به این پرسش به این موضوع مربوط میشود که نیروی هستهای قوی کوتاهبرد است. این مطلب از مجله فرادرس را با ذکر مثال بیشتر توضیح میدهیم. تعدادی هسته در تصویر زیر نشان داده شدهاند. در هر هسته به این موضوع توجه میکنیم که حذف نقطه سبزرنگ چه مقدار سخت است. هر اندازه حذف این نقطه سختتر باشد، هسته موردنظر پایدارتر خواهد بود.

در نخستین هسته، ذره سبزرنگ توسط دو ذره و ذره سبزرنگ در دومین هسته توسط چهار ذره آبی احاطه شده است. بنابراین، بیرون کشیدن ذره سبزرنگ در هسته دوم سختتر از هسته اول و در نتیجه، هسته دوم پایدارتر از هسته اول خواهد بود. از اینرو، انرژی پیوندی بر نوکلئون در هسته دوم بیشتر از هسته اول است. حالت مشابهی نیز بین هسته سوم و هسته دوم حاکم خواهد بود. تا اینجا، افزایش انرژی پیوندی با افزایش عدد جرمی را میتوان توضیح داد. هرچه تعداد نوترونها و پروتونها در هسته افزایش یابد، انرژی بیشتری برای بیرون کشیدن هر نوکلئون باید مصرف شود.
همانطور که در نمودار انرژی پیوندی مشاهده میشود این افزایش انرژی پیوندی با عدد جرمی تا عنصر آهن ادامه و پس از آن کاهش مییابد. نیروی هستهای قوی کوتاهبرد است، یعنی در فاصله بسیار کوتاهی تاثیر میگذارد. در هسته چهارم، ذرات آبی که در فاصله دورتری نسبت به ذره سبزرنگ قرار گرفتهاند، دیگر تحتتاثیر مستقیم این ذره قرار ندارند. تنها ذراتی که در فاصله بسیار نزدیکی نسبت به ذره سبزرنگ قرار گرفتهاند با آن برهمکنش میکنند. این برهمکنش به طور تقریب برابر برهمکنش بین ذره سبزرنگ و ذرات آبی در هسته سوم است. از اینرو، مقدار انرژی لازم برای بیرون انداختن ذره سبزرنگ از هسته سوم به طور تقریب برابر انرژی لازم برای بیرون انداختن ذره سبزرنگ از هسته چهارم خواهد بود. این داستان، برای هستههای پنجم و ششم نیز به کار میرود.
در نتیجه، پس از آهن ۵۶، هر چه نوکلئونهای بیشتری به هسته اضافه شوند، تعداد همسایههای نزدیک تغییر نمیکنند و انرژی پیوندی تقریبا ثابت باقی میماند. شاید از خود بپرسید انرژی پیوندی پس از آهن با نرخ بسیار کوچکی کاهش مییابد و ثابت باقی نمیماند، چرا؟ به یاد داشته باشید که نیروی دافعه دیگری در هسته وجود دارد. پروتونها با بارالکتریکی مثبت یکدیگر را دفع میکنند. کشیدن و حذف ذرات به دلیل وجود این نیروی دافعه الکترواستاتیکی، آسانتر میشود. در هستههای کوچکتر، نیروی هستهای قوی بسیار قویتر از نیروی دافعه الکترواستاتیکی است. بنابراین، نیروی هستهای پیروز میشود و میتوان از نیروی دافعه الکترواستاتیکی صرفنظر کرد. هرچه هسته بزرگتر شود، نیروی هستهای قوی از نظر اندازه ثابت باقی میماند، اما نیروی دافعه الکترواستاتیکی بین پروتونها، قویتر میشود. به این نکته توجه داشته باشید که نیروی دافعه برخلاف نیروی هستهای قوی، بلندبرد است. به همین دلیل، خارج کردن ذره سبزرنگ در هستههای بزرگتر، آسانتر میشود.
با استفاده از نمودار انرژی پیوندی بر نوکلئون حتی میتوانیم نوع واکنشهای هستهای را پیشبینی کنیم:
- در یکی از واکنشهای هستهای، هسته اتم سنگین به هسته اتمهای کوچکتر شکسته میشود. به این واکنش، واکنش شکافت هستهای میگوییم. واکنشهای شکافت هستهای یکی از واکنشهای اصلی در بمبهای هستهای است. ناحیه هستههای سنگین را در نظر بگیرید و نقطهای را به دلخواه روی نمودار انرژی پیوندی انتخاب کنید. فرض میکنیم هسته اتمی بسیار سنگین در این ناحیه به هستههای کوچکتر تقسیم میشود. هستههای سبکتر ایجاد شده در سمت چپ نمودار (هستههای سبکتر) قرار میگیرند. بر طبق نمودار انرژی پیوندی، هستههای سبکتر ایجاد شده انرژی پیوندی بیشتری دارند و پایدارتر از هسته مادر هستند. توجه به این نکته بسیار مهم است که طبیعت همواره دوست دارد به سمت پایدارتر حرکت کند. در نتیجه، انجام واکنش شکافت هستهای از نظر انرژی مطلوب است.
- شاید از خود بپرسید چرا واکنش شکافت هستهای در هستههای سبکتر رخ نمیدهد. عنصر بسیار سبکی مانند نیتروژن یا اکسیژن را انتخاب میکنیم. اگر هر یک از این دو عنصر در واکنش شکافت هستهای شرکت کنند و به هستههای کوچکتر تقسیم شوند، محصولات ایجاد شده سبکتر و پایداری کمتری نسبت به هسته اولیه دارند. از اینرو، واکنش شکافت هستهای در هستههای بسیار سبک، مطلوب نیست. بنابراین، از هستههای سبک انتظار نداریم در واکنش شکافت هستهای شرکت کنند. هستههای سبکتر در واکنشی به نام همجوشی هستهای شرکت میکنند. در این واکنش، دو هسته سبک با یکدیگر جوش میخورند و هسته سنگینتری را ایجاد میکنند. هسته سنگینتر ایجاد شده پایدارتر از هستههای اولیه شرکتکننده در واکنش همجوشی است.
انواع واپاشی رادیواکتیو چیست ؟
تا اینجا میدانیم بعضی هستهها پایدار نیستند و مقداری انرژی اضافی دارند و به دنبال راهی برای حذف این انرژی هستند. قبل از توضیح در مورد انواع واپاشیهای رادیواکتیو، ابتدا تشعشع را تعریف و انواع آن را بیان میکنیم. به تابش انرژی از هر جسمی، تشعشع گفته میشود. انواع مختلفی از تشعشع در جهان وجود دارند.
- تابش الکترومغناطیسی: تابش الکترومغناطیسی شامل امواج رادیویی، امواج ماکروویو، امواج فروسرخ، نور مریی، امواج فرابنفش، اشعه ایکس و اشعه گاما است. از امواج مایکروویو برای پختن غذا استفاده میشود. هنگامی که در معرض امواج فرابنفش قرار میگیریم دچار سوختن سطحی میشویم. بنابراین، اینگونه به نظر میرسد که تشعشعات الکترومغناطیسی خطرناک نیستند. اما در حالت کلی هنگامی که در مورد تشعشع صحبت میکنیم، معنای دیگری مد نظرمان است. آنچه بیشتر افراد به هنگام صحبت در مورد تشعشع در ذهن دارند، به تابش هستهای برمیگردد.
- تابش هستهای: تابش هستهای هنگامی رخ میدهد که ذرهای زیراتمی توسط هسته اتم تابیده میشود. تابش هستهای یا تابش رادیواکتیو به چهار نوع تقسیم میشود:
- تابش آلفا
- تابش بتا
- تابش گاما
- تابش نوترون
هر یک از تابشهای رادیواکتیو ذکر شده مشخصههای متفاوتی دارند.
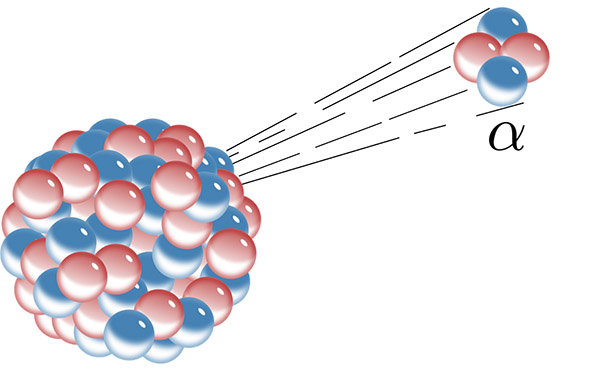
واپاشی آلفا چیست ؟
تابش آلفا هنگامی رخ میدهد که از هسته اتم ناپایدار، ذره آلفا شامل دو پروتون و دو نوترون، خارج شود. اگر به جدول تناوبی عناصر مراجعه کنیم متوجه میشویم که هسته اتم هلیوم، دو پرتون و دو نوترون دارد. بنابراین، واپاشی آلفا هنگامی رخ میدهد که عنصر فعال رادیواکتیو، اتم هلیوم را بدون الکترون به بیرون پرتاب کند. عنصری فرضی مانند $$E_1$$ را در نظر بگیرید. این عنصر p پروتون و n نوترون دارد و به صورت زیر نوشته میشود:
$$_p ^ { p + n } E_1$$
پس از واپاشی آلفا، چه اتفاقی برای این عنصر رخ میدهد؟ تعداد پروتونها و نوترونهای آن دو واحد کاهش مییابند. بنابراین، عدد جرمی آن چهار واحد کاهش خواهد یافت. از اینرو، عنصر $$E_1$$ به عنصر دیگری تبدیل میشود. در نتیجه، واکنش واپاشی آلفا به صورت زیر مینویسیم:
$$_p ^ { p + n } E_1 \rightarrow _{p - 2 } ^ { p + n - 4 } E _ 2 + _2 ^ { 4 } He$$
ذره آلفا همان ذره هلیوم است. از آنجا که هلیوم تابیده شده از هسته، الکترون ندارد، به شکل یون خواهد بود. هسته ناپایدار پس از تابش ذره آلفا یا یون هلیوم به حالت پایدار میرسد.
عدد جرمی بیشتر عناصر مانند هلیوم با عدد جرمی ۴، کربن با عدد جرمی ۱۲ یا اکسیژن با عدد جرمی ۱۶، مضربی از عدد چهار و عدد پروتونی این عناصر مضربی از عدد ۲ است. ابتدا عنصر هلیوم را در نظر میگیریم. عدد جرمی و عدد پروتونی این عنصر به ترتیب برابر ۴ و ۲ هستند. بنابراین، اتم هلیوم را میتواند به عنوان اتم پایه در نظر گرفت. عدد جرمی و عدد پروتونی کربن به ترتیب برابر ۱۲ و ۶ هستند. بنابراین، کربن میتواند از ۳ اتم هلیوم ساخته شود. در پایان، اکسیژن را در نظر میگیریم. عدد جرمی آن برابر ۱۶ و عدد پروتونی آن برابر ۸ است. از اینرو، اکسیژن میتواند از ۴ اتم هلیوم ساخته شود. در نتیجه، برای ساختن اتمی بزرگتر تنها کافی است که اتمهای هلیوم را در کنار یکدیگر قرار دهیم.
فرض کنید هسته بسیار بزرگی دارید. اندازه آن به قدری بزرگ است که شروع به تکان خوردن میکند. در این حالت، هسته ناپایدار میشود و ناگهان دو پروتون و دو نوترون (هسته هلیوم یا آلفا) را به بیرون پرتاب میکند. از آنجا که ذره آلفا ذره سنگینی است، تابش آلفا یکی از سنگینترین تابشهای شناخته شده است. همچنین، ذره آلفا به دلیل داشتن جرم زیادتر نسبت به ذرات دیگر، با سرعت کمتری حرکت میکند. سرعت خروج ذرات آلفا از هسته در حدود ۳۰ هزار کیلومتر بر ثانیه است. شاید فکر کنید این سرعت بسیار زیاد است. اما قبل از هر قضاوتی ابتدا باید سرعت حرکت ذرات دیگر را بررسی کنید. از این ویژگی میتوان برای تشخیص تابش آلفا استفاده کرد.
ذره آلفا بزرگ و بار الکتریکی آن برابر ۲+ است، بنابراین مسیر حرکت آن به هنگام عبور از میدان الکتریکی خمیده میشود. همچنین، اگر ذره آلفا از نزدیکی اتم دیگری بگذرد، الکترون آن را با احتمال زیادی جذب میکند. بنابراین، اتم موردنظر یونیزه میشود. ذره آلفا در مقایسه با ذرات دیگر، انرژی خود را زودتر از دست میدهد. در نتیجه، با سرعت کمتری حرکت میکند و در پایان متوقف میشود. این بدان معنا است که عمق نفوذ ذره آلفا بسیار کوچک است. این ذره حتی میتواند توسط دستمال کاغذی متوقف شود.
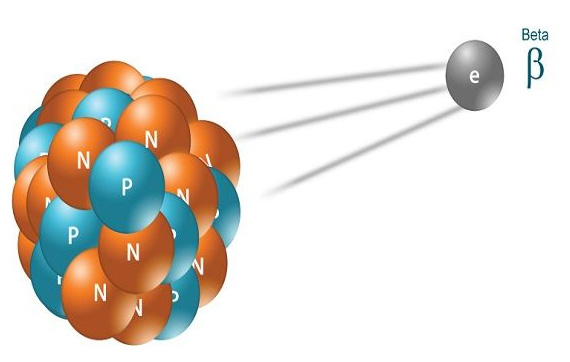
واپاشی بتا چیست ؟
همانند حالت قبل هستهای متشکل از تعدادی نوترون و پروتون را در نظر بگیرید. گاهی اوقات نوترون با خود احساس راحتی نمیکند. با خود میگوید کاش من پروتون بودم تا هسته کمی پایدارتر میشد. بنابراین نوترون وارد عمل میشود و از بار الکتریکی خنثای خود بهره میبرد و یک الکترون ساطع میکند و به پروتون تبدیل میشود. به تابش الکترون از هسته، واپاشی بتا یا واپاشی الکترونی میگوییم. به طور معمول، این تابش هنگامی رخ میدهد که یک نوترون در هسته اتم به پروتون و الکترون تبدیل شود. پروتون تولید شده داخل هسته باقی میماند، اما الکترون از آن فرار میکند. توجه به این نکته مهم است که بار ذره بتا ممکن است مثبت یا منفی باشد. اگر بار آن مثبت باشد، پوزیترون و اگر بار آن منفی باشد الکترون نام دارد. همانند واپاشی آلفا، عنصر E را با p پروتون و n نوترون در نظر بگیرید:
$$_p ^ { p + n } E$$
آیا پس از تابش الکترون از هسته، تعداد پروتونها تغییر میکند؟ بله، زیرا پس از تابش الکترون با بار منفی از هسته و برای حفظ پایستگی بار الکتریکی قبل و پس از تابش الکترون، یک پروتون داخل هسته ایجاد میشود. به بیان دیگر، در واپاشی بتا، یک نوترون به الکترون و پروتون تبدیل میشود. الکترون از هسته خارج و پروتون داخل آن باقی میماند. همچنین، از آنجا که تعداد پروتون در هسته، یک واحد افزایش و تعداد نوترون یک واحد کاهش مییابد، عدد جرمی تغییر نخواهد کرد. با توجه به آنکه تعداد پروتونها یک واحد افزایش یافته است، عنصر E پس از واپاشی بتا به عنصر دیگری تبدیل میشود.
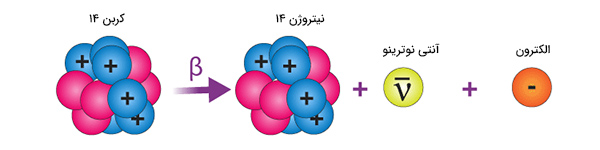
گفتیم نوترون میتواند به پروتون و الکترون تبدیل و الکترون تولید شده از هسته اتم خارج شود. نکته مهمی که در این تبدیل باید در نظر گرفته شود آن است که بار الکتریکی قبل و بعد از تبدیل نوترون باید پایسته بماند. در واکنش تبدیل نوترون به الکترون و پروتون، بار قبل و بعد از تبدیل برابر صفر است. همچنین، کمیت دیگری که باید به هنگام تبدیل نوترون به پروتون و الکترون پایسته بماند، عدد باریون است. عدد باریون نوترون برابر ۱+ و عدد باریون پروتون و الکترون به ترتیب برابر ۱+ و صفر است. از اینرو، پایستگی عدد باریون نیز حفظ شده است.
کمیت دیگری نیز به نام عدد لپتون در این فرایند باید پایسته بماند. عدد لپتون نوترون، پروتون و الکترون به ترتیب برابر صفر، صفر و ۱+ است. بنابراین، عدد لپتون قبل از تبدیل نوترون برابر صفر و پس از تبدیل آن برابر ۱+ است. از اینرو، ذره دیگری از نوع پادلپتون، نیز باید تولید شود. مشخصات ذره باید به گونهای باشد که پایستگی عدد باریون و بار الکتریکی به هم نخورند. در نتیجه، ذره موردنظر نمیتواند باریون باشد و بار الکتریکی آن برابر صفر خواهد بود. بهترین گزینه، ذره پاد الکترون نوترینو است. این ذره بدون جرم است و با سرعت بسیار زیادی حرکت میکند. بنابراین، واکنش زیر برای واپاشی الکترون یا واپاشی بتای منفی است.
تابش پوزیترون
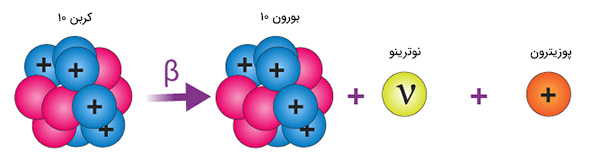
گفتیم در واپاشی بتا یا الکترون، نوترون به پروتون و الکترون تبدیل میشود. گاهی پروتون از شرایطی که دارد ناراضی است و به زندگی نوترون غبطه میخورد. بنابراین، با خود میگوید اگر به نوترون تبدیل شوم به طور قطع هسته و من شرایط بهتر و پایدارتری خواهیم داشت. در نتیجه، پروتون؛ ناراضی، یک پوزیترون (الکترون مثبت) تابش میکند. جرم پوزیترون به طور دقیق برابر جرم الکترون و بار الکتریکی آن مثبت است. پروتون پس از تابش پوزیترون به نوترون تبدیل میشود و به آرزوی خود میرسد. به خروج پوزیترون از هسته، تابش پوزیترون گفته میشود.
عنصری مانند E با p پروتون و n نوترون را در نظر بگیرید. پس از تابش پوزیترون از هسته چه اتفاقی برای این عنصر رخ میدهد؟ عنصر اولیه یک پروتون از دست میدهد و یک نوترون بهدست میآورد. بنابراین، عدد جرمی آن بدون تغییر باقی میماند. در نتیجه، در واپاشی بتا عنصر اولیه یک پروتون بهدست میآورد و در تابش پوزیترون، عنصر اولیه یک پروتون از دست میدهد.
واپاشی گاما چیست ؟
تا اینجا در مورد واپاشی آلفا، بتا و پوزیترون صحبت کردیم. واپاشی دیگری نیز وجود دارد که در آن تعداد پروتونها و نوترونهای هسته قبل و پس از واپاشی تغییر نمیکند. در این حالت مقدار قابل توجهی انرژی به شکل فوتون از هسته آزاد میشود. به تابش انرژی از هسته، واپاشی گاما میگوییم. تابش گاما به شکل بستهای از انرژی الکترومغناطیسی (فوتونها) است که توسط هسته برخی از هستههای رادیواکتیو و به دنبال واپاشی رادیواکتیو، ساطع میشود. فوتونهای گاما پرانرژیترین فوتونها در طیف الکترومغناطیسی هستند. برخلاف ذرات آلفا و بتا که جرم و انرژی دارند، اشعه گاما، انرژی خالص است. اشعه گاما مشابه نور مریی است، اما انرژی بسیار بالاتری دارد. در بیشتر موارد، این پرتو همراه با ذرات آلفا و بتا در مدت واپاشی رادیواکتیو، ساطع میشود. از این اشعه میتوان برای درمان سرطان و مطالعات کیهانشناسی استفاده کرد.
طیف الکترومغناطیسی برحسب کاهش طول موج و افزایش انرژی و فرکانس به ناحیههای زیر تقسیم میشود:
- امواج رادیویی
- امواج مایکروویو
- فروسرخ
- مریی
- فرابنفش
- اشعه ایکس
- اشعه گاما
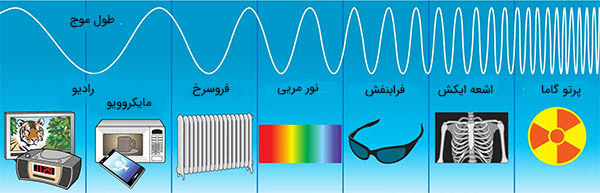
پرتوهای گاما بالا پرتوهای ایکس نرم قرار دارند. فرکانس این پرتوها در محدوده $$10^ { 19 }$$ هرتز و طول موج آنها کمتر از ۱۰۰ پیکومتر است. پرتوهای گاما و ایکس در طیف الکترومغناطیسی با یکدیگر همپوشانی میکنند. بنابراین، تمایز آنها از یکدیگر مشکل است. در برخی از رشتهها، مانند فیزیک نجوم، از خطی فرضی در طیف الکترومغناطیسی استفاده میشود. طول موجهای قرار گرفته بالای طول موجی مشخص به عنوان پرتوهای ایکس و طول موجهای قرار گرفته در پایین این خط به عنوان پرتوهای گاما طبقهبندی میشوند. انرژی پرتوهای گاما و ایکس به اندازه کافی برای آسیب رساندن به بافت زنده قوی است. اما جو زمین از ورود بیشتر پرتوهای گامای کهکشانی به سطح زمین جلوگیری میکند.
کشف پرتوهای گاما
پرتوهای گاما برای نخستین بار در سال ۱۹۰۰ میلادی توسط شیمیدانی فرانسوی به نام «پائول ویلارد» (Paul Villard) به هنگام مطالعه تشعشع عنصر رادیوم کشف شدند. سالها بعد شیمیدان و فیزیکدانی نیوزلندی به نام «ارنست رادرفورد» (Ernest Rutherford) نام پرتوهای گاما را پیشنهاد داد. این نام در ادامه نامهای ذرات آلفا و بتا انتخاب شد.

منابع تولید اشعه گاما چیست ؟
پرتوهای گاما به طور کلی توسط چهار واکنش هستهای مختلف به نامهای شکافت هستهای، همجوشی هستهای، واپاشی آلفا و واپاشی گاما تولید میشوند.
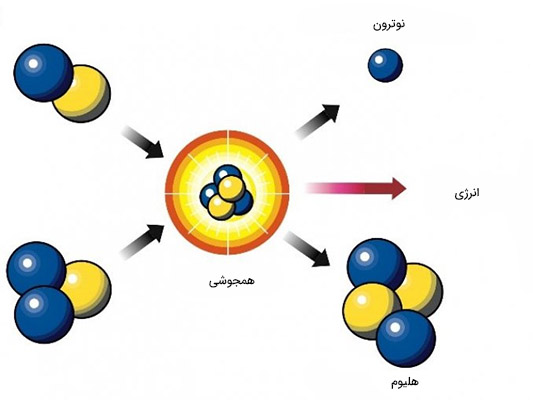
همجوشی هستهای
هجوشی هستهای فرایندی است که در ستارهها و خورشید رخ میدهد. این واکنش در فرایندی چند مرحلهای رخ میدهد که در آن چهار پروتون یا هستههای هیدروژن تحت تاثیر فشار و دمای بسیار بالا با یکدیگر ترکیب میشوند (جوش میخورند) و هسته هلیوم تشکیل میشود. هسته هلیوم از دو پروتون و دو نوترون تشکیل شده است. جرم هسته هلیوم تشکیل شده در حدود ۰/۷ مجموع جرم چهار پروتون اولیه است. بر طبق رابطه معروف اینشتین، یعنی $$ E = m C^ 2 $$& این تفاوت جرم بین پروتونهای اولیه و هلیوم نهایی به انرژی تبدیل و در حدود دوسوم این انرژی به شکل پرتوهای گاما ساطع میشود.
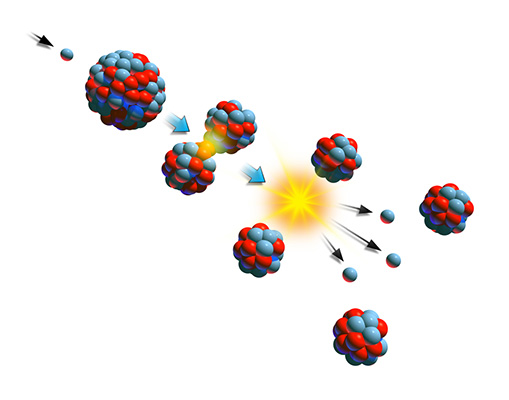
شکافت هستهای
شکاف هستهای یکی دیگر از منابع تولید پرتوهای گاما است. در طی این فرایند، هسته اتمی سنگین به دو قسمت تقریبا مساوی تقسیم میشود و هسته عناصری سبکتر تولید میشوند. در طی این فرایند، هسته اتمهای سنگینتری مانند اورانیوم یا پلوتونیوم پس از برخورد با ذرات کوچک و پرانرژی مانند نوترون، به عناصر کوچکتری مانند زنون و استرانسیوم میشکنند. همچنین، ذرات کوچکتر دیگری مانند ذرات نوترینو نیز تشکیل میشوند و به هستههای سنگین دیگر برخورد میکنند. بنابراین، واکنش زنجیرهای هستهای آغاز خواهد شد. همانند واکنش همجوشی هستهای، فرایند شکافت هستهای نیز با آزاد شدن انرژی همراه خواهد بود. زیرا جرم اولیه ذرات نهایی کمتر از جرم هسته اولیه سنگین است. تفاوت جرم به شکل انرژی جنبشی هستههای کوچکتر، نوترونها و پرتوهای گاما آزاد میشود.
واپاشی بتا و گاما
واپاشی آلفا و بتا دیگر منابع تولید پرتوهای گاما هستند. واپاشی آلفا هنگامی رخ میدهد که هستهای سنگین، هسته هلیوم ۴ را ساطع میکند و عدد اتمی آن دو واحد و وزن اتمی آن ۴ واحد کاهش مییابد. در طی این فرایند، هستهای با انرژی اضافی باقی میماند. این انرژی اضافی به شکل پرتو گاما تابیده میشود. واپاشی گاما هنگامی رخ میدهد که انرژی زیادی داخل هسته اتمی وجود داشته باشد. در نتیجه، انرژی به شکل پرتو گاما از این هسته خارج میشود. بار و ترکیب هسته ناپایدار در طی تابش گاما هیچ تغییری نخواهد کرد.
ویژگی های پرتوهای گاما چیست ؟
پرتوهای گاما شکلی از تشعشع الکترومغناطیسی و شبیه پرتوهای ایکس هستند. تنها تفاوت آنها با پرتوهای ایکس در آن است که از هستههای برانگیخته تابش میکنند. تشعشع الکترومغناطیسی میتواند به صورت جریانی از فوتونها توصیف شود. فوتونها ذراتی بدون جرم هستند که به شکل موج و با سرعت نور حرکت میکنند. هر فوتون، مقدار مشخصی انرژی دارد. تمام تشعشعات الکترومغناطیسی از فوتونها تشکیل شدهاند. همانطور که در مطالب بالا عنوان شد پرتوهای گاما بالاترین انرژی و در نتیجه، کمترین طول موج را در طیف الکترومغناطیسی دارند.
انرژی فوتونها برحسب الکترونولت اندازه گرفته میشود. انرژی پرتوهای ایکس در محدوده ۱۰۰ تا ۱۰۰ هزار الکترونولت است. انرژی فوتونهای پرتو گاما حتی از این مقدار نیز بیشتر خواهد بود. انرژی تشعشع فرابنفش از چند الکترونولت تا ۱۰۰ الکترونولت متغیر است. در نتیجه، انرژی تشعشع فرابنفش برای قرار دادن این تشعشع در محدود تشعشعات یونیزاسیون کافی نیست. انرژی بالای پرتوهای گاما باعث میشود که به راحتی از مواد مختلف، مانند بافت انسان، عبور کنند. به طور معمول، از مواد با ضخامت زیاد برای محافظت در برابر پرتوهای گاما استفاده میشود.
تفاوت پرتوهای گاما و پرتوهای ایکس چیست ؟
تفاوت اصلی میان پرتوهای گاما و ایکس در چگونگی تولید آنها است. همانطور که گفتیم پرتوهای گاما از هسته برانگیخته هستههای رادیواکتیو پس از واپاشی رادیواکتیو، ناشی میشوند. در مقابل، اشعه ایکس پس از برخورد الکترون با اتم هدف و تحریک آن ایجاد میشود. توجه به این نکته مهم است که پرتوهای کیهانی نیز از فوتونهای با انرژی بالا تشکیل شدهاند. بنابراین، به این پرتوهای نیز پرتوهای گاما گفته میشود.
قرار گرفتن در معرض اشعه گاما چه اثراتی بر سلامتی انسان دارد ؟
همانطور که در مطالب بالا گفته شد اشعه گاما عمق نفوذ زیادی دارد و از طریق یونیزاسیون و سه فرایند اثر «فوتوالکتریک» (Photoelectric effect)، «پراکندگی کامپتون» (Compton Scattering) و «جفتسازی» (Pair Production) با ماده برهمکنش میکند. از آنجا که پرتوهای گاما عمق نفوذ بالایی دارند، اثر آن میتواند در سراسر بدن رخ دهد. اما قدرت یونش آن از ذرات آلفا کمتر است. تشعشع گاما با در نظر گرفتن حفاظت در برابر تشعشع به عنوان خطری خارجی در نظر گرفته میشود.
مثال واپاشی رادیواکتیو
تا اینجا با انواع واپاشیهای رادیواکتیو مانند واپاشی آلفا، بتا و گاما آشنا شدیم. در ادامه، چند مثال در این مورد حل میکنیم.
مثال اول واپاشی رادیواکتیو
واکنش زیر کدام یک از واپاشیهای رادیواکتیو را نشان میدهد؟
$$_4 ^ { 7 } Be \rightarrow _{3 } ^ { 7 } Li + _1 ^ { 0 } e $$
پاسخ
در واکنش داده شده، برلیوم با عدد جرمی ۷ به لیتیوم با عدد جرمی ۷ تبدیل شده است. بنابراین، در واکنش هستهای فوق، عدد جرمی بدون تغییر باقی مانده، اما تعداد پروتونها از ۴ برای برلیوم به ۳ برای لیتیوم کاهش یافته است. از آنجا که جرم کلی قبل و بعد از واکنش تغییر نکرده است، واپاشی آلفا رخ نداده است. همانطور که در مطالب بالا گفته شد در واپاشی آلفا، یون هلیوم از هسته خارج میشود. بنابراین جرم هسته پس از واپاشی تغییر میکند. چه چیزی از هسته خارج شده است؟ پوزیترون. بنابراین، تابش پوزیترون رخ داده است.
مثال دوم واپاشی رادیواکتیو
واکنش زیر کدام یک از واپاشیهای رادیواکتیو را نشان میدهد؟
$$_{92 } ^ { 238 } U \rightarrow _{90 } ^ { 234 } Th + _2 ^ { 0 } He $$
پاسخ
در واکنش داده شده، اورانیوم با عدد جرمی ۲۳۸ به توریوم با عدد جرمی ۲۳۴ تبدیل شده است. بنابراین، در واکنش هستهای فوق، عدد جرمی ۴ واحد کاهش مییابد. از اینرو، در این واکنش واپاشی باید ذرهای با عدد جرمی ۴ و عدد اتمی ۲ آزاد شده باشد. آشناترین ذره، ذره آلفا یا یون هلیوم است. در نتیجه، واکنش انجام شده واپاشی آلفا است.
مثال سوم واپاشی رادیواکتیو
واکنش زیر کدام یک از واپاشیهای رادیواکتیو را نشان میدهد؟
$$_{ 53 } ^ { 131 } I \rightarrow _{34 } ^ { 131 } Xe + _ { - 1 } ^ { 0 } e $$
پاسخ
در واکنش داده شده، ید با عدد جرمی ۱۳۱ و عدد اتمی ۵۳ به زنون با عدد جرمی ۱۳۱ و عدد اتمی ۵۴ تبدیل شده است. همانطور که دیده میشود عدد جرمی و جرم قبل و پس از واپاشی تغییر نکردهاند، بنابراین نوترون به پروتون یا پروتون به نوترون تبدیل شدهاند. به علاوه، عدد اتمی پس از واپاشی، یک واحد افزایش یافته است. در نتیجه، نوترون به طور حتم به پروتون تبدیل شده است. تبدیل نوترون به پروتون با آزاد کردن الکترون همراه است. از اینرو، در واکنش هستهای فوق، واپاشی بتا رخ میدهد.
مثال چهارم واپاشی رادیواکتیو
واکنش زیر کدام یک از واپاشیهای رادیواکتیو را نشان میدهد؟
$$_{ 86 } ^ { 222 } Rn \rightarrow _{ 84 } ^ { 218 } Po + _ { 2 } ^ { 4 } He $$
پاسخ
در واکنش داده شده، رادون با عدد جرمی ۲۲۲ به پلونیوم با عدد جرمی ۲۱۸ تبدیل شده است. بنابراین، در واکنش هستهای فوق، عدد جرمی ۴ واحد کاهش مییابد. از اینرو، در این واکنش واپاشی باید ذرهای با عدد جرمی ۴ و عدد اتمی ۲ آزاد شده باشد. آشناترین ذره، ذره آلفا یا یون هلیوم است. در نتیجه، واکنش داده شده واپاشی آلفا است.
تا اینجا میدانیم رادیواکتیو و انواع واپاشی رادیواکتیو چیست. گفتیم واپاشیهای رادیواکتیو به سه گروه واپاشی آلفا، بتا و گاما تقسیمبندی میشوند. در واپاشیهای آلفا و بتا، هسته ناپایدار پس از آزاد کردن ذراتی مانند یون هلیوم، الکترون یا پوزیترون به حالت پایدار میرسد، اما در واپاشی گاما هسته اولیه مقدار قابلتوجهی انرژی تابش میکند و پایدار میشود. همچنین، با واکنشهای هستهای هر یک از این واپاشیها آشنا شدیم.
تمرین تشخیص واپاشی رادیواکتیو
واپاشی رادیواکتیو اکتینیم 227 به فرانسیم ۲۲۳ و در ادامه به رادیوم ۲۲۳ در تصویر زیر نشان داده شده است. واپاشیهای انجام شده در مرحلههای ۱ و ۲ به ترتیب برابر هستند با:
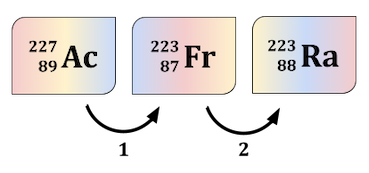
واپاشی ۱: واپاشی آلفا
واپاشی ۲: واپاشی بتا منفی (الکترون)
واپاشی ۱: واپاشی بتا منفی (الکترون)
واپاشی ۲: واپاشی آلفا
واپاشی ۱: واپاشی آلفا
واپاشی ۲: واپاشی بتا مثبت (پوزیترون)
واپاشی ۱: واپاشی بتا مثبت (پوزیترون)
واپاشی ۲: واپاشی بتا منفی (الکترون)
واپاشی ۱: واپاشی بتا مثبت (پوزیترون)
واپاشی ۲: واپاشی آلفا
برای پاسخ به این پرسش، به عدد جرمی و عدد اتمی در هر واپاشی نگاه میکنیم. واپاشی رادیواکتیو در هستههای ناپایدار به چهار دسته تقسیم میشود:
- واپاشی آلفا: در این واپاشی، ذره آلفا با دو نوترون و دو پروتون از هسته ناپایدار خارج میشود. بنابراین، عدد جرمی ۴ واحد و عدد اتمی ۲ واحد کاهش مییابد.
- واپاشی بتا منفی یا الکترون: یک نوترون در هسته ناپایدار به پروتون تبدیل میشود و یک الکترون از هسته خارج میشود.
- واپاشی بتا مثبت یا پوزیترون: یک پروتون با تابش یک پوزیترون به نوترون تبدیل میشود.
با توجه به شکل نشان داده شده در پرسش، در واپاشی یک هسته $$_{89} ^ { 227} Ac$$ به هسته $$_ { 87 } ^ { 223} Fr$$ تبدیل میشود. بنابراین، عدد جرمی ۴ واحد و عدد اتمی یا تعداد پروتونها ۲ واحد کاهش یافته است. در نتیجه، واپاشی یک از نوع واپاشی آلفا است. در واپاشی ۲، هسته $$_ { 87 } ^ { 223} Fr$$ به هسته $$_{ 88 } ^ { 223 } Ra$$ تبدیل میشود. با توجه به واکنش هستهای انجام شده عدد جرمی هیچ تغییر نکرده، اما عدد اتمی یک واحد کاهش یافته است. از اینرو، واپاشی دو، واپاشی بتا منفی یا الکترون است.
رادیوم ۲۲۸ تنها در واپاشی بتا منفی یا الکترون شرکت میکند:

هسته دختر کدام یک از گزینههای زیر است؟
$$_{229} ^ { 89 } Ac$$
$$_{228} ^ { 87 } Fr$$
$$_{228} ^ { 89 } Ac$$
$$_{227} ^ { 87 } Fr$$
$$_{224} ^ { 86 } Rn$$
در هر واپاشی رادیواکتیو، تعداد کل نوکلئونها در هر سمت واکنش، یکسان است. در نتیجه، عدد جرمی پایسته است. در واپاشی بتا منفی، یک نوترون با تابش ذره بتا منفی یا الکترون به پروتون تبدیل میشود. بنابراین، عدد اتمی یا Z یک واحد افزایش مییابد. در این پرسش باید هسته دختر را پیشبینی کنیم. هسته رادیوم یا هسته مادر پس از واپاشی بتا منفی به هسته دیگری (هسته دختر) تبدیل میشود. عدد جرمی هستههای مادر و دختر با یکدیگر یکسان و برابر ۲۲۸ هستند. همچنین، عدد اتمی هسته دختر یک واحد بیشتر از عدد اتمی هسته مادر است، ۸۹. در نتیجه، هسته دختر $$_{22۸} ^ { 89 } Ac$$ خواهد بود.
مثال اول محاسبه انرژی پیوندی
جرم هسته لیتیوم برابر $$7.01601 u$$ اندازه گرفته شده است. انرژی پیوندی هسته $$_ 3 ^ 7 Li$$ را بهدست آورید.
نکته: جرم پروتون برابر $$1.00728 u$$، جرم نوترون برابر $$1.00866 u$$ و هر u برابر $$931.5 \frac { MeV } { c ^ 2 }$$ است.
پاسخ
برای بهدست آورن انرژی پیوندی هسته $$_ 3 ^ 7 Li$$ گامهای زیر را به ترتیب طی میکنیم:
گام ۱
در مطالب بالا گفتیم هنگامی که نوکلئونها (پروتونها و نوترونها) داخل هسته اتم در کنار هم قرار میگیرند، جرم همه آنها با یکدیگر کمتر از مجموع جرم تکتک آنها با هم است. به این تفاوت جرم، نقصان جرم گفته میشود.
گام ۲
انرژی معادل این نقصان جرم یا جرم از دست رفته به عنوان انرژی پیوندی در هسته وجود دارد.
$$m_ { _ 3 ^ 7 Li} = 7.01601 u m_ p = 1.00828 u m _ n = 1.00866 u$$
هسته لیتیوم، ۳ پروتون و ۴ نوترون دارد. بنابراین نقصان جرم یا جرم از دست رفته برابر است با:
$$\triangle M = [ 3 \times m_p + 4 \times m_ n ] - m_ { _3^ 7 Li} = [ 3 \times 1.00728 + 4 \times 1.00866] - 7.01601 u = 0.04047 u$$
بنابراین، انرژی پیوندی برابر است با:
$$B . E. = \triangle M c ^ 2 = 0.04047 u \times c ^ 2 = 0.04047 \times 931.5 \frac { M eV } { c ^ 2 } \times c ^ 2 = 37. 69781 MeV \Rightarrow B. E. \approx 37.7 MeV$$
مثال دوم محاسبه انرژی پیوندی
جرم هسته اورانیوم ۲۳۵ برابر $$234.99346 u$$ اندازه گرفته شده است. انرژی پیوندی بر نوکلئون هسته $$_ {92} ^ { 235} U$$ را بهدست آورید.
نکته: جرم پروتون برابر $$1.00728 u$$، جرم نوترون برابر $$1.00866 u$$ و هر u برابر $$931.5 \frac { MeV } { c ^ 2 }$$ است.
پاسخ
برای بهدست آورن انرژی پیوندی هسته $$_ {92} ^ { 235} U$$ گامهای زیر را به ترتیب طی میکنیم:
گام ۱
در مطالب بالا گفتیم هنگامی که نوکلئونها (پروتونها و نوترونها) داخل هسته اتم در کنار هم قرار میگیرند، جرم همه آنها با یکدیگر کمتر از مجموع جرم تکتک آنها با هم است. به این تفاوت جرم، نقصان جرم گفته میشود.
گام ۲
انرژی معادل این نقصان جرم یا جرم از دست رفته به عنوان انرژی پیوندی در هسته وجود دارد. این انرژی را میتوان با استفاده از رابطه همارزی جرم-انرژی اینشتین بهدست آورد.
گام ۳
انرژی بر نوکلئون از تقسیم انرژی پیوندی بر تعداد کل نوکلئونها (عدد جرمی)بهدست میآید.
$$m_ { _ {92} ^ { 235} U} = 234.99346 u m_ p = 1.00828 u m _ n = 1.00866 u$$
هسته اورانیوم، ۹۲ پروتون و ۱۴۳ نوترون دارد. بنابراین نقصان جرم یا جرم از دست رفته برابر است با:
$$\triangle M = [ 92 \times m_p + 142 \times m_ n ] - m_ { _3^ 7 Li} = [ 92 \times 1.00728 + 143 \times 1.00866] - 234.99346 u = 1.91468 u$$
بنابراین، انرژی پیوندی برابر است با:
$$B . E. = \triangle M c ^ 2 = 1.91468 u \times c ^ 2 = 1.91468 \times 931.5 \frac { M eV } { c ^ 2 } \times c ^ 2 = 1783.52442 MeV $$
گام ۴
انرژی پیوندی بر نوکلئون برابر است با:
$$E_{ b n } = \frac { 1783.52442 MeV } { 235} = 7.58947 E$$
تمرین محاسبه انرژی پیوندی
جرم هسته کربن برابر $$11.99671 \ u$$ اندازه گرفته شده است. انرژی پیوندی هسته $$_6 ^ { 12 } C $$ را بهدست آورید.
نکته: جرم پروتون برابر $$1.00728 \ u$$، جرم نوترون برابر $$1.00866 \ u$$ و هر u برابر $$931.5 \ \frac { MeV } { c ^ 2 }$$ است.
$$83.7 \ MeV$$
$$112.4 \ MeV$$
$$92.2 \ Me V$$
$$72.5 \ MeV $$
برای بهدست آورن انرژی پیوندی هسته $$_ 6 ^ { 12 } C $$ گامهای زیر را به ترتیب طی میکنیم:
گام ۱
در مطالب بالا گفتیم هنگامی که نوکلئونها (پروتونها و نوترونها) داخل هسته اتم در کنار هم قرار میگیرند، جرم همه آنها با یکدیگر کمتر از مجموع جرم تکتک آنها با هم است. به این تفاوت جرم، نقصان جرم گفته میشود.
گام ۲
انرژی معادل این نقصان جرم یا جرم از دست رفته به عنوان انرژی پیوندی در هسته وجود دارد.
$$m_ { ^ {12} _ { 6 } C} = 11.99671 \ u \\ m_ p = 1.00828 \ u \\ m _ n = 1.00866 \ u $$
هسته کربن ۱۲، 6 پروتون و 6 نوترون دارد. بنابراین نقصان جرم یا جرم از دست رفته برابر است با:
$$\triangle M = [ 6 \times m_p + 6 \times m_ n ] - m_ { _6 ^ { 12 } C} \\ = [ 6 \times 1.00728 + 6 \times 1.00866] - 11.99671 \ u \\ = 0.09893 \ u$$
بنابراین، انرژی پیوندی برابر است با:
$$B . E. = \triangle M c ^ 2 \\ = 0.09893 \ u \times c ^ 2 = 0.09893 \times 931.5 \ \frac { M eV } { c ^ 2 } \times c ^ 2 \\ = 92.15330 \ MeV \\ \Rightarrow B. E. \approx 92.2 \ MeV$$
جرم هسته طلا ($$_ { 79 } ^ { 197 } Au$$) برابر $$196.92323 \ u$$ اندازه گرفته شده است. انرژی پیوندی بر نوکلئون هسته $$_ { 79 } ^ { 197 } Au$$ را بهدست آورید.
نکته: جرم پروتون برابر $$1.00728 \ u$$، جرl نوترون برابر $$1.00866 \ u$$ و هر u برابر $$931.5 \ \frac { MeV } { c ^ 2 }$$ است.
$$8.12 \ MeV$$
$$6.85 \ MeV $$
$$7.76 \ MeV$$
7.91 \ Me V
برای بهدست آورن انرژی پیوندی هسته $$_ { 79 } ^ { 197 } Au$$ گامهای زیر را به ترتیب طی میکنیم:
گام ۱
در مطالب بالا گفتیم هنگامی که نوکلئونها (پروتونها و نوترونها) داخل هسته اتم در کنار هم قرار میگیرند، جرم همه آنها با یکدیگر کمتر از مجموع جرم تکتک آنها با هم است. به این تفاوت جرم، نقصان جرم گفته میشود.
گام ۲
انرژی معادل این نقصان جرم یا جرم از دست رفته به عنوان انرژی پیوندی در هسته وجود دارد. این انرژی را میتوان با استفاده از رابطه همارزی جرم-انرژی اینشتین بهدست آورد.
گام ۳
انرژی بر نوکلئون از تقسیم انرژی پیوندی بر تعداد کل نوکلئونها (عدد جرمی)بهدست میآید.
$$m_ {_ { 79 } ^ { 197 } Au} = 196.92323 \ u \\ m_ p = 1.00828 \ u \\ m _ n = 1.00866 \ u$$
هسته طلا، 79 پروتون و 118 نوترون دارد. بنابراین نقصان جرم یا جرم از دست رفته برابر است با:
$$\triangle M = [ 79 \times m_p + 118 \times m_ n ] - m_ { _ { 79 } ^ { 197 } Au} \\ = [ 79 \times 1.00728 + 118 \times 1.00866] - 196.92323 \ u \\ = 1.67377 \ u$$
بنابراین، انرژی پیوندی برابر است با:
$$B . E. = \triangle M c ^ 2 \\ = 1.67377 \ u \times c ^ 2 = 1.67377 \times 931.5 \ \frac { M eV } { c ^ 2 } \times c ^ 2 $$
گام ۴
انرژی پیوندی بر نوکلئون برابر است با:
$$E_{ b n } = \frac { 1.67377 \times 931.5 \ MeV } { 197 } \\ = 7.91430 \ MeV $$
عناصر رادیواکتیو چیست ؟
عناصر رادیواکتیو زیادی در جهان وجود دارند. در این قسمت در مورد معروفترین و خطرناکترین عناصر رادیواکتیو صحبت میکنیم. عنصر رادیواکتیو، عنصری با هسته ناپایدار است. هسته ناپایدار برای رسیدن به حالت پایدار، ذرات آلفا، بتا، یا انرژی گاما تابش میکند. در نگاه نخست و در صورت عدم آشنایی با مفهوم رادیواکتیو اینگونه به نظر میرسد که عنصر رادیواکتیو، امواج رادیویی ساطع میکند. اما اکنون میدانیم اینگونه نیست. این نکته را در ذهن داشته باشید که تمام عناصر میتوانند ایزوتوپهای رادیواکتیو داشته باشند. اگر نوترون به اندازه کافی به اتمی اضافه شود، هسته اتم ناپایدار و واپاشیده میشود. به عنوان مثال، تریتیوم، ایزوتوپ رادیواکتیو هیدروژن، به طور طبیعی در ترازهای بسیار پایین قرار دارد. اما میتوان با اضافه کردن نوترون به این ایزوتوپ آن را ناپایدار کرد. به این نکته توجه داشته باشید که افزایش عدد اتمی در حالت کلی اتم را ناپایدارتر نمیکند. جدول زیر فهرست کاملی از عناصر رادیواکتیو و پایدارترین ایزوتوپ آنها را به همراه نیمهعمر هر ایزوتوپ نشان میدهد.
| عنصر | نام انگلیسی | پایدارترین ایزوتوپ | نیمهعمر پایدارترین ایزوتوپ |
| تکنسیوم | Technetium | Tc-91 | $$4.21 \times 10 ^ 6 $$ سال |
| پرومتیم | Promethium | Pm-145 | ۱۷/۴ سال |
| پولونیوم | Polonium | Po-209 | ۱۰۲ سال |
| استاتین | Astatine | At-210 | ۸/۱ سال |
| رادون | Radon | Rn-222 | ۳/۸۲ روز |
| فرانسیوم | Francium | Fr-223 | ۲۲ دقیقه |
| رادیوم | Radium | Ra-226 | ۱۶۰۰ سال |
| اکتینیوم | Actinium | Ac-227 | ۲۱/۷۷ سال |
| توریم | Thorium | Th-229 | $$7.54 \times 10 ^ 4$$ سال |
| پروتاکتینیم | Protactinium | Pa-231 | $$3.28 \times 10 ^ 4$$ سال |
| اورانیوم | Uranium | U-238 | $$4.47 \times 10 ^ 9$$ سال |
| نپتونیوم | Neptunium | Np-237 | $$2.14times 10 ^ 6$$ سال |
| پلوتونیوم | Plutonium | Pu-244 | $$8.00 \times 10 ^ 7$$ سال |
| آمریکیوم | Americium | Am-243 | ۷۳۷۰ سال |
| کوریم | Curium | Cm-247 | $$1.56 \times 10 ^ 7$$ سال |
| برکلیوم | Berkelium | Bk-247 | ۱۳۸۰ سال |
| کالیفورنیوم | Californium | Cf-251 | ۸۹۸ سال |
| اینیشتینیم | Einstenium | Es-252 | ۴۷۱/۷ روز |
| فرمیوم | Fermium | Fm-257 | ۱۰۰/۵ روز |
| مندلویوم | Mendelevium | Md-258 | ۵۱/۵ روز |
| نوبلیوم | Nobelium | No-259 | ۵۸ دقیقه |
| لارنسیوم | Lawrencium | Lr-262 | ۴ ساعت |
| رادرفوردیوم | Rutherfordium | Rf-265 | ۱۳ ساعت |
| دوبنیوم | Dubnium | Db-268 | ۳۲ ساعت |
| سیبورژیوم | Seaborgium | Sg-271 | ۲/۴ دقیقه |
| بوهریوم | Bohrium | Bh-267 | ۱۷ ثانیه |
| هاسیوم | Hassium | Hs-269 | ۹/۷ ثانیه |
| میترنیوم | Meitnerium | Mt-276 | ۰/۷۲ ثانیه |
| دارمستادتیوم | Darmstadtium | Ds-281 | ۱۱/۱ ثانیه |
| رونتژنیوم | Roentgenium | Rg-281 | ۲۶ ثانیه |
| کوپرنیسیم | Copernicium | Cn-285 | ۲۹ ثانیه |
| نیهونیوم | Nihonium | Nh-284 | ۰/۴۸ ثانیه |
| فلروویوم | Flerovium | Fl-289 | ۲/۶۵ ثانیه |
| مسکوویوم | Moscovium | Mc-289 | ۸۷ میلیثانیه |
| لیورمونیوم | Livermornium | Mv-289 | ۸۷ میلیثانیه |
| تنسی | Tennessine | ناشناخته | ناشناخته |
| اوگانسون | Oganesson | Og-294 | ۱/۸ میلیثانیه |
در جدول بالا با فهرستی از عناصر رادیواکتیو و پایداترین ایزوتوپهای آنها آشنا شدید. در ادامه، در مورد برخی از معروفترین آنها صحبت میکنیم.
اورانیوم
اورانیوم یکی از خطرناکتررین فلزات روی زمین است. این عنصر متعلق به گروه اکتینیدها در جدول تناوبی، عدد اتمی آن ۹۲ و فراوانی آن در پوسته زمین در حدود ۴۶ برابر عنصر نقره است. این عنصر با علامت اختصاری U در جدول تناوبی نشان داده میشود. برخی از مهمترین مشخصات اورانیوم عبارت هستند از:
- شعاع اتمی: شعاع اتمی اورانیوم برابر ۲۴۰ پیکومتر است.
- آرایش الکترونی: آرایش الکترونی اورانیوم به صورت $$[Rn] 7 s ^ 2 5 f ^ 3 6 d ^ 1$$ نوشته میشود.
- شعاع اتمی کووالانسی: شعاع اتمی کووالانسی این عنصر برابر ۱۹۶ پیکومتر است.
- حالتهای اکسایش: حالتهای اکسایش این عنصر برابر ۶+، ۵+، ۴+ و ۳+ هستند.
- انرژی یونش: انرژی یونش اورانیوم برابر ۶/۱۹۴ الکترونولت است.
- الکترونگاتیوی: مقیاس پائولی الکترونگاتیوی اورانیوم برابر ۱/۳۸ است.
- توصیف فیزیکی: اورانیوم عنصری جامد است.
- دستهبندی عنصری: این عنصر فلز است.
- چگالی: چگالی اورانیوم برابر ۱۸/۹۵ گرم بر سانتیمتر مکعب است. اورانیوم فلزی با چگالی بسیار بالایی دارد، به گونهای که در حدود ۷۰ درصد چگالتر از سرب، اما چگالی آن کمتر از چگالی فلز طلا است.
- نقطه ذوب: دمای ذوب این عنصر برابر ۱۴۰۸ کلوین یا ۱۱۳۵ درجه سلسیوس است.
- نقطه جوش: دمای جوش این عنصر برابر ۴۴۰۴ کلوین یا ۴۱۳۱ درجه سلسیوس است.
- فراوانی در پوسته: ۲/۷ میلیگرم بر کیلوگرم
- فراوانی اقیانوسی: $$3.2 \times 10 ^ { - 3 }$$ میلیگرم بر لیتر
اورانیوم خالص، سفید نقرهای، فلز رادیواکتیو ضعیف، سختتر از بسیاری از عناصر، چکشخوار، شکلپذیر، کمی پارامغناطیس و رسانای ضعیف جریان الکتریکی است. فلز اورانیوم در سه حالت کریستالوگرافی نشان داده میشود:
$$\alpha >\; ( 688 ^oC) >\; \beta >\; ( 766 ^oC) >\; \gamma$$
اورانیوم فلزی در صورتی که در معرض هوا قرار بگیرد با لایهای از اکسید پوشانده میشود. اسیدها، فلزات را حل میکنند و حالت اکسایش ۳+ تشکیل میدهند. این حالت به سرعت توسط آب و هوا اکسید میشود و حالتهای اکسایش بالاتر را تشکیل میدهد. قلیاییها هیچ تاثیری روی فلز اورانیوم ندارند. شاید از خود بپرسید اورانیوم فلزی چگونه تهیه میشود. این فلز میتواند با کاهش هالیدهای اورانیوم توسط فلزات قلیایی یا قلیایی خاکی یا با کاهش اکسیدهای اورانیوم توسط کلسیم، آلومینیوم یا کربن در دماهای بالا تهیه شود. همچنین، فلز اورانیوم با استفاده از الکترولیز ترکیبهای $$KUF_5$$ یا $$UF_4$$ حل شده در مخلوط نمکهای مذاب $$CaCl_2$$ و $$NaCl$$، بهدست میآید. گاهی اورانیوم با خلوص بالا باید تهیه شود. برای این کار از تجزیه حرارتی هالیدهای اورانیوم روی رشتهای داغ استفاده میکنند.
اورانیوم فلزی تقریبا با تمام عناصر غیرفلزی و ترکیبهای آنها واکنش میدهد و واکنشپذیری آن با دما افزایش مییابد. اسیدهای هیدروکلریک و نیتریک، اورانیوم را در خود حل میکنند، اما اسیدهای غیراکسنده، به جر هیدروکلریک اسید، بسیار آهسته به این عنصر حمله میکنند. اورانیوم پس از تقسیم شدن به قطعات بسیار کوچک با آب سرد واکنش میدهد. اورانیوم پس از تماس با هوا با لایه تیرهای از اکسید اورانیوم پوشانده میشود. این عنصر با مهمترین حالتهای اکسایش خود، ترکیبها و آلیاژهای مختلفی را تشکیل میدهد.
اورانیوم چه کاربردهایی دارد ؟
عنصر اورانیوم به طور طبیعی رادیواکتیو است. بنابراین، به طور معمول از این عنصر به شکل دیاکسید اورانیوم در صنعت انرژی هستهای برای تولید الکتریسیته استفاده میشود. اورانیوم به طور طبیعی از سه ایزوتوپ تشکیل شده است: اورانیوم ۲۳۴، اورانیوم ۲۳۵ و اورانیوم ۲۳۸. گرچه هر سه ایزوتوپ اورانیوم رادیواکتیو هستند، تنها اوررانیوم ۲۳۵ مادهای شکافتپذیر است و میتوان از آن در نیروگاه هستهای استفاده کرد.

هنگامی که مادهای شکافتپذیر در معرض برخورد با نوترون قرار میگیرد، هسته آن پس از تقسیم شدن به قطعههای کوچکتر، مقدار قابلتوجهی انرژی آزاد میکند. اگر بخشی از قطعههای ایجاد شده نوترون باشند، به اتمهای دیگر برخورد میکنند و سبب تقسیم شدن آنها به قطعههای دیگر میشوند. ماده شکافتپذیری مانند اورانیوم ۲۳۵ مادهای است که قادر به تولید نوترونهای آزاد کافی برای تشکیل واکنش زنجیرهای هستهای است. تنها ۰/۷۲۰۴ درصد اورانیوم طبیعی، اورانیوم ۲۳۵ است. این مقدار برای تشکیل واکنش زنجیرهای هستهای کافی نیست. بنابراین، از مادهای به عنوان تعدیلکننده برای تشکیل واکنشهای زنجیرهای استفاده میشود. ماده تعدیلکننده مادهای است که بدون جذب نوترون میتواند سرعت آن را کاهش دهد. نوترونهای آهسته با احتمال بیشتری با اورانیوم ۲۳۵ واکنش میدهند. در رآکتورهایی که از اورنیوم طبیعی استفاده میکنند، مواد تعدیلکننده به طور عمده آب سنگین و گرافیت هستند. روشهایی برای تلغیظ اورانیوم ۲۳۵ وجود دارند. هنگامی که سطح اورانیوم ۲۳۵ به ۳ درصد افزایش یافت، از آب معمولی نیز میتوان به عنوان تعدیلکننده استفاده کرد.
اورانیوم ۲۳۸ یکی از فراوانترین ایزوتوپهای اورانیوم است. این ایزوتوپ میتواند به پولونیوم ۲۳۹ تبدیل شود. از این ماده شکافتپذیر میتوان به عنوان سوخت در رآکتورهای هستهای استفاده کرد. برای تولید پلوتونیوم ۲۳۹، اتمهای اورانیوم ۲۳۹ باید هدف نوترونهای زیادی قرار بگیرند. اورانیوم ۲۳۸ با جذب یک نوترون به اورانیوم ۲۳۹ تبدیل میشود. نیمهعمر اورانیوم ۲۳۹ در حدود ۲۳ دقیقه است و پس از آن از طریق واپاشی بتا به نپتونیوم ۲۳۹ تبدیل میشود. نیمهعمر نپتونیوم ۲۳۹ در حدود ۲/۴ روز است و از طریق واپاشی بتا به پلوتونیوم ۲۳۹ تبدیل خواهد شد.

اورانیوم ۲۳۳ به طور طبیعی وجود ندارد، اما مادهای شکافتپذیر است و میتواند به عنوان سوخت در رآکتورهای هستهای مورد استفاده قرار گیرد. برای تولید اورانیوم ۲۳۳ باید مراحل زیر انجام شوند:
- اتمهای توریوم ۲۳۲ هدف بمباران نوترونی قرار میگیرند.
- توریوم ۲۳۲ پس از جذب یک نوترون به توریوم ۲۳۳ تبدیل میشود.
- نیمهعمر توریوم ۲۳۳ در حدود ۲۲ دقیقه است. پس از این مدت، این عنصر از طریق واپاشی بتا به پروتاکتینیوم تبدیل میشود.
- نیمهعمر پروتوتاکتینیوم ۲۳۳ در حدود ۲۷ روز است. پس از این مدت، این عنصر از طریق واپاشی بتا به اورانیوم ۲۳۳ تبدیل میشود.
۰/۴۵ کیلوگرم از اورانیوم ۲۳۳ پس از شکافت کامل، مقدار انرژی معادل سوختن ۱۳۵۰۰۰۰ کیلوگرم زغالسنگ تولید میکند. اورانیوم فلزی چگال است که بیرون از صنعت انرژی هستهای نیز استفادههایی دارد. به عنوان مثال، از آن به عنوان هدف برای تولید اشعه ایکس استفاده میشود. قرنها از ترکیبهای اورانیوم برای رنگ کردن شیشه استفاده کردهاند. نیمهعمر اورانیوم ۲۳۸ در حدود ۴ میلیون و ۴۶۸ هزار سال است. این ایزوتوپ از طریق واپاشی آلفا به توریوم ۲۳۴ تبدیل میشود.
در قرون وسطا و روم باستان از اورانیوم به عنوان عامل اصلی رنگآمیزی در لعابهای سرامیکی و شیشهای استفاده میشد. این عنصر رنگهای نارنجی مایل به قرمز تا زرد لیمویی تولید میکند. امروزه بیشتر از خواص منحصربهفرد هستهای این عنصر بهره میبرند. اورانیوم ۲۳۵ تنها ایزوتوپ شکافپذیری است که به طور طبیعی وجود دارد. این بدان معنا است که این ایزوتوپ توسط نوترونهای گرمایی میتواند به دو یا سه بخش مختلف تقسیم شود. اورانیوم ۲۳۳ نیز یکی دیگر از ایزوتوپهای شکافتپذیر اورانیوم است که از توریوم تولید میشود و نقش مهمی در تکنولوژی هستهای ایفا میکند.

اگر غلظت ایزوتوپهای گفته شده به اندازه کافی بالا باشد، واکنشهای زنجیرهای هستهای حفظ میشوند. حفظ این واکنشها منجر به تولید گرما در رآکتورهای هستهای و تولید ماده شکافتپذیر برای تسلیحات هستهای میشود. اورانیوم ۲۳۸ شکافتپذیر نیست، اما ایزوتوپی بارور است، زیرا پس از فعالیت نوترونی میتواند پلوتونیوم ۲۳۹ تولید کند.
تا اینجا با اورانیوم یکی از عناصر رادیواکتیو مهم آشنا شدیم. در ادامه، در مورد یکی دیگر از عناصر رادیواکتیو مهم به نام برکلیوم صحبت میکنیم.
برکلیوم
در مطالب بالا گفتیم که عناصر رادیو اکتیو به دو صورت وجود دارند:
- عناصری که به صورت طبیعی رادیواکتیو هستند، مانند اورانیوم.
- عناصری که در آزمایشگاه سنتز شدهاند و به صورت طبیعی در پوسته زمین وجود ندارند، مانند برکلیوم.
عنصر برکلیوم برای نخستین بار در سال ۱۹۴۹ میلادی توسط گروهی از دانشمندان در دانشگاه کالیفرنیا تولید شد. آنها یکی از ایزوتوپهای عنصر امریکیوم، امریکیوم ۲۴۱، را با ذرات آلفا در وسیلهای به نام سیکلوترون، بمباران کردند. در اثر این بمباران، برکلیوم ۲۴۳ و دو نوترون آزاد ایجاد شدند. برکلیوم ۲۴۷ یکی از پایدارترین ایزوتوپهای برکلیوم است و نیمهعمر آن در حدود ۱۳۸۰ سال است. این ایزوتوپ از طریق واپاشی آلفا به ایزوتوپ امریکیوم ۲۴۳ تبدیل میشود.
نخستین ترکیب قابلمشاهده برکلیوم، یعنی برکلیوم کلرید ($$BkCl_ 3 $$)، در سال ۱۹۶۲ میلادی تولید شد و وزن آن در حدود ۳ میلیاردم گرم بود. برکلیوم اکسیکلرید ($$BkOCl $$)، (فلورید برکلیوم ($$BkF_ 3 $$)، برکلیوم دیاکسید ($$Bk O _ 2$$) و برکلیوم تریاکسید ($$BkO_3$$) با استفاده از پراش اشعه ایکس شناسایی و مطالعه شدند.این عنصر، هشتمین عنصر از سری اکتینیدها است.
چهارده ایزوتوپ برکلیوم شناخته و از عدد جرمی ۲۳۸ تا ۲۵۱ سنتز شدهاند. این عنصر، همانند دیگر عنصرهای سری اکتینیدها، تمایل به تجمع در سیستم اسکلتی دارد. این عنصر بسیار کمیاب است، بنابراین استفاده تجاری از آن به صرفه نیست. برکلیوم ۲۴۹ به دلیل نیمهعمر زیاد و دسترسی به آن در حدود میکروگرم، به صورت گسترده به عنوان هدف برای سنتز عناصر سنگینتر مورد استفاده قرار میگیرد. برخی از مهمترین ویژگیهای برکلیوم عبارت هستند از:
- آرایش الکترونی آن به صورت $$[ Rn ] 7 s ^ 2 5 f ^ 9$$ نوشته میشود.
- شعاع اتمی واندروالس آن برابر ۲۴۴ پیکومتر است.
- حالتهای اکسایش آن برابر ۴+ و ۳+ است.
- انرژی یونش آن در حدود ۶/۲۳ الکترونولت است.
- الکترونگاتیوی مقیاس پائولی آن برابر ۱/۳ است.
- این عنصر به صورت جامد وجود دارد.
- در دستهبندی عناصر جدول تناوبی در گروه فلزات قرار میگیرد.
- در گروه آکتینیدها در جدول تناوبی قرار دارد.
- چگالی آن برابر ۱۴ گرم بر سانتیمتر مکعب است.
- دمای ذوب آن برابر ۱۳۲۳ کلوین یا ۱۰۵۰ درجه سلسیوس است.
- دمای جوش آن برابر ۲۶۲۶ درجه سلسیوس است.
رادیوم
رادیوم یکی دیگر از عناصر رادیواکتیو مهم در جهان است. این عنصر شیمیایی با نماد Ra و عدد اتمی ۸۸، در گروه فلزات قلیایی خاکی طبقهبندی میشود و در دمای اتاق در حالت جامد قرار دارد. مهمترین مشخصههای این عنصر رادیواکتیو عبارت هستند از:
- آرایش الکترونی آن به صورت $$[ R n ] 7s ^ 2$$ نوشته میشود.
- شعاع اتمی واندروالس آن برابر ۲۸۳ متر است.
- حالت اکسایش آن برابر ۲+ است.
- انرژی یونش این عنصر کمتر از انرژی یونش اورانیوم و برکلیوم و در حدود ۵/۲۷۹ الکترونولت است.
- الکترونگاتیوی مقیاس پائولی این عنصر برابر ۰/۹ است.
- در دمای اتاق به شکل جامد است.
- رادیوم در طبقهبندی عناصر جدول تناوبی در گروه فلزات قرار میگیرد.
- چگالی آن برابر ۵ گرم بر سانتیمتر مکعب است.
- دمای ذوب آن برابر ۹۷۳ کلوین یا ۷۰۰ درجه سلسیوس است.
- دمای جوش آن برابر ۱۴۱۳ کلوین یا ۱۱۴۰ درجه سلسیوس است.
- فراوانی آن در پوسته زمین در حدود $$9.0 \times 10 ^ { - 7 }$$ میلیگرم بر کیلوگرم است.
- فراوانی آن در اقیانوس در حدود $$8.9 \times 10 ^ { - 11 } $$ میلیگرم بر لیتر است.
رادیوم توسط «ماری کوری» (Marie Sklodowska Vurie)، شیمیدان لهستانی، و «پیر کوری» (Pierre Curie)، شیمیدان فرانسوی، در سال 1898 کشف شد. این عنصر به صورت تجاری به شکلهای برومید و کلرید است. همانطور که در جدول بالا دیده میشود، علاوه بر اورانیوم و رادیوم، عناصر رادیواکتیو دیگری نیز وجود دارند. در ادامه، در مورد برخی دیگر از این عناصر رادیواکتیو صحبت میکنیم.
پلونیوم
این عنصر به صورت طبیعی در پوسته زمین وجود دارد و مقدار بسیار زیادی انرژی آزاد میکند. بر طبق نظر بسیاری از دانشمندان، پلونیوم یکی از رادیواکتیوترین عناصر در جهان است. این عنصر به اندازهای رادیواکتیو است که به رنگ آبی میدرخشد. یک میلیگرم پلونیوم به اندازه ۵ گرم رادیوم، ذرات آلفا تابش میکند. نرخ واپاشی یا رهاسازی انرژی در این عنصر به اندازهای بالا است که دمای نیم گرم از آن میتواند به بیش از ۵۰۰ درجه سلسیوس افزایش یابد. پلونیوم با تابش ذرات آلفا واپاشیده میشود. انرژی این ذرات به اندازهای زیاد است که میتوانند منجر به تخریب سلولهای بافت زنده شوند.
پلونیوم ۲۱۰ محصول واپاشی رادیواکتیو اورانیوم ۲۳۸ است. اورانیوم ۲۳۸ ابتدا به رادون ۲۲۲ و سپس به پلونیوم تبدیل میشود. نیمهعمر پلونیوم ۲۱۰، ۱۳۸ روز است. این عنصر به صورت طبیعی در خاک وجود دارد، ولی غلظت آن به اندازهای کوچک است که آسیبی به حیوانات و انسان نمیرساند. پلونیوم در منابع آب زیرزمینی و در مقدارهای متفاوت یافت شده است.

سوالی که ممکن است مطرح شود آن است که آیا پلونیوم برای انسان زیانآور است. تشعشع پلونیوم ۲۱۰ تنها هنگامی برای بدن خطرناک است که از طریق تنفس، بلعیدن یا ورود به زخم، وارد بدن انسان شود. اگر مقدار زیادی از این عنصر استنشاق یا مقدار قابلتوجهی از آن در بازه زمانی بسیار کوتاهی مصرف شود، آلودگی داخلی ناشی از آن اثرات غیر قابلجبرانی بر اندامهای حیاتی داخلی میگذارد و منجر به علائم جدی یا مرگ میشود. اگر مدت زمان قرار گرفتن در برابر این عنصر زیاد باشد، اما خیلی زیاد نباشد و در بازه زمانی مشخصی رخ دهد، احتمال ابتلا به سرطان افزایش قابلتوجهی مییابد. شاید از خود بپرسید پس از قرار گرفتن در معرض پلونیوم ۲۱۰ چه کارهایی باید انجام داد. بهترین راه پس از قرار گرفتن در معرض این عنصر رادیواکتیو تماس با مرکز اورژانس و درخواست کمک از آنها است.
اثرات بیولوژیکی مواد رادیواکتیو
تشعشع رادیواکتیو شبیه کیک شکلاتی است. اگر هوس کیک شکلاتی کرده باشید و یک عدد بخورید با مشکل حادی روبرو نمیشوید. اما خوردن هزار کیکی شکلاتی در مدت زمان کوتاه، شما را با مشکلاتی زیادی روبرو خواهد کرد. به طور حتم فیلمها یا مستندهای پخش شده در تلویزیون در مورد قرار گرفتن افراد در برابر تشعشعات رادیواکتیو را تماشا کردهاید. در آنها افراد زیادی را مشاهده میکنید که باندپیچی شدهاند و هیچ ایدهای در مورد اتفاقات رخ داده برای آنها ندارید. تشعشعات مختلفی مانند تشعشع گرمایی یا نورانی، در اطراف ما وجود دارند. اما تشعشعی که به بافتهای زنده آسیب میرساند، تابش یونیزه شده نام دارد. تابش یونیزه شده به شکل امواج با انرژی بسیار زیاد منتشر میشود. این انرژی ممکن است به دلیل پرتوهای ایکس، واپاشی آلفا، بتا یا گاما ناشی شود. در این قسمت، اثر واپاشی عناصر رادیواکتیو بر بافتهای زنده بررسی میشود. این نوع تشعشع میتواند به اتم آسیب برساند. در نتیجه، کل مولکول، مانند DNA، و سلول آسیب میبینند.
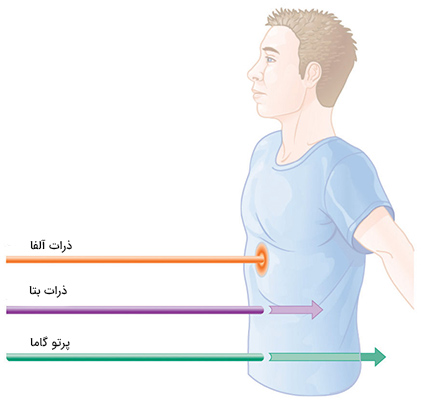
بدن انسان از آب تشکیل شده است. مولکولهای آب در صورتی که در تماس با واپاشی رادیواکتیو قرار بگیرند به شکل $$O _ 2$$ و $$H_ 2$$ یا $$H_ 2 O _ 2$$ تجزیه شوند. مقدار آسیب سلولهای بافت زنده به میزان تشعشع رادیواکتیو بستگی دارد. اگر فردی در نیروگاههای هستهای کار کند یا در تماس با عناصر رادیواکتیو باشد، ریسک ابتلا به سرطان در او به میزان قابلتوجهی افزایش مییابد. اما اگر در زمان بسیار کوتاهی در معرض تشعشع بسیار زیادی قرار بگیریم، اتفاقات بسیار حاد و ناگواری رخ خواهند داد که به چهار مرحله تقسیم میشوند:
- نخستین نشانههای آغاز بیماری، حالت تهوع، استفراغ، بیحالی هستند. هرچه میزان تماس با تشعشعات رادیواکتیو بیشتر باشد، این نشانهها شدیدتر خواهند بود.
- مرحله بعد، مرحله نهفته نام دارد. در این مرحله احساس بهتری دارید و این تصور به وجود میآید که نشانههای ظاهر شده موقت بودهاند. اما شرایط ناگوارتر از آنچه هست به نظر میرسد. انجام آزمایش در این مرحله، مسمومیت با تشعشعات رادیواکتیو را تایید خواهد کرد.
- چند هفته پس از مرحله نهفته، بیماری اصلی با علائم جدی آغاز میشود.
- مرحله آخر یا بهبودی حاصل میشود یا با مرگ به پایان میرسد.

اگر مقدار تشعشع رادیواکتیو وارد شده به بدن خیلی زیاد نباشد، احتمال بهبودی بسیار زیاد خواهد بود، اما احتمال ابتلا به سرطان در سالهای آینده افزایش مییابد. اگر میزان تشعشع رادیواکتیو از مقدار مشخصی بیشتر باشد، باید به مرگ سلام گفت. از آنجا که تشعشعات رادیواکتیو به DNA سلول آسیب میرسانند، درمان بسیار سخت خواهد بود. قرار گرفتن در معرض تشعشعات رادیواکتیو ممکن است تمام بدن را تحتتاثیر قرار دهد یا تنها به تخمکها و اسپرم آسیب برساند. اثرات این تشعشع در سلولهایی که به سرعت تکثیر میشوند مانند سلولهای غشای معده، فولیکولهای مو، مغز استخوان و جنینها، آشکارتر هستند. به همین دلیل، بیمارانی که تحت پرتودرمانی قرار میگیرند احساس تهوع یا درد معده دارند، موهای خود را از دست میدهند و دردهای شدیدی در استخوانهایشان احساس میکنند. همچنین، زنان بارداری که تحت پرتودرمانی قرار میگیرند باید تحت مراقبتهای ویژه قرار داشته باشند.
در مطالب بالا گفتیم که هستههای ناپایدار به ۳ صورت به حالت پایدار میرسند:
- تابش ذرات آلفا یا یون هلیوم
- تابش ذرات بتای منفی (الکترون) یا بتای مثبت (پوزیترون)
- تابش گاما
عمق نفوذ هر تابش در مواد، متفاوت است. به طور معمول، مانعی با ضخامت بسیار نازک مانند ورقه کاغذ یا لایه بیرونی سلولهای پوستی، ذرات آلفا را متوقف میکنند. بنابراین، منابع ذره آلفا اگر بیرون بدن باشند هیچ خطری نخواهند داشت، اما در صورت بلعیده شدن یا استنشاق بسیار خطرناک خواهند بود. ذرات بتا میتوانند از دست یا لایه بسیار نازکی از مادهای مانند کاغذ یا چوب عبور کنند، اما به هنگام برخورد با لایه نازکی از فلز متوقف میشوند. پرتوهای گاما عمق نفوذ بالایی دارند و از لایههای ضخیم مواد مختلف به راحتی عبور میکنند.
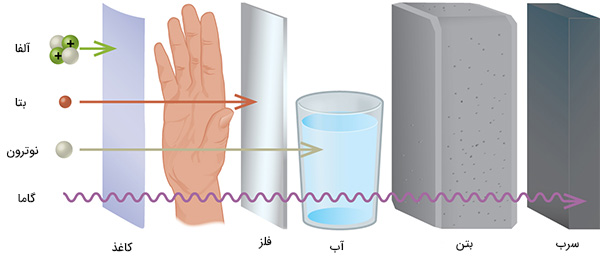
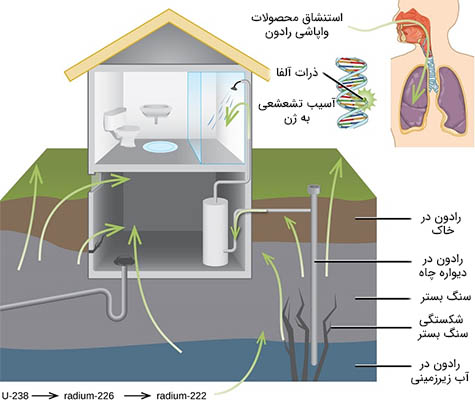
عناصری چگال و با عدد اتمی بالا، مانند سرب، به طور موثری سبب تضعیف تشعشع گاما میشوند، بنابراین از آنها میتوان به عنوان محافظ در برابر نفوذ پرتوهای گاما استفاده کرد. توانایی تشعشعات مختلف در ایجاد یونش بسیار متفاوت است، حتی برخی از ذرات هیچ تمایلی به ایجاد یونش ندارند. قدرت یونیزه کردن ذرات آلفا در حدود دو برابر نوترونهای پر سرعت، در حدود ۱۰ برابر ذرات بتا و در حدود ۲۰ برابر پرتوهای گاما و ایکس است. یکی از بزرگترین منابع قرار گرفتن در معرض تشعشع از گاز رادون ($$Rn-222$$) ناشی میشود. رادون ۲۲۲ ساطعکننده آلفا و نیمهعمر آن برابر ۳/۸۲ روز است. رادون ۲۲۲ یکی از محصورات واپاشی رادیواکتیو اورانیوم ۲۳۸ است که در خاک و سنگها یافت میشود. گاز رادون ایجاد شده به آهستگی از زمین فرار میکند و به داخل خانهها و ساختمانهای بالایی رسوخ میکند. از آنجا که چگالی این گاز در حدود هشت برابر چگالی هوا است، داخل طبقاتی تحتانی و در زیرزمینها جمع میشود و به آهستگی به داخل ساختمانها نفوذ میکند. مقدار رادون یافت شده در ساختمانها به محل ساختمان بستگی دارد.
اندازه گیری میزان تشعشع
وسیلههای مختلفی برای تشخیص و اندازهگیری تشعشع وجود دارند:
- «شمارنده گایگر» (Geiger cointers)
- «شمارنده سوسوزن» (Scintillation counters or scintillators)
- «دزیمترهای تشعشع» (Radiation dosimeters)
واحدهای مختلفی برای اندازهگیری جنبههای مختلف تابش وجود دارند. واحد SI برای نرخ واپاشی رادیواکتیو «بکرل» (Becquerel | Bq) است. کوری و میلیکوری واحدهای اندازهگیری بسیار بزرگتری هستند و اغلب در پزشکی استفاده میشوند. واحد SI برای اندازهگیری میزان یا دوز تشعشع «گرِی» (Gray | Gy) است. در کاربردهای پزشکی، میزان تشعشع جذب شده یا rad بیشتر استفاده میشود. واحد SI برای اندازهگیری میزان آسیب بافتی توسط تشعشع، «سیورت» (Sievert | Sv) است. جدول زیر هر یک از این واحدها، تعریف آنها و هدف اندازهگیری را نشان میدهد.
| واحد | کمیت اندازهگیری شده | توصیف |
| بکرل | واپاشی رادیواکتیو یا تشعشعات | مقدار نمونهای که تحت یک واپاشی بر ثانیه قرار میگیرد. |
| کوری | واپاشی رادیواکتیو یا تشعشعات | مقدار نمونهای که تحت $$3.7 \times 10 ^ { 10 }$$ واپاشی بر ثانیه قرار میگیرد. |
| گرِی | انرژی جذب شده به ازای هر کیلوگرم بافت | $$1 Gy = 1 \frac { J} { kg }$$ بافت |
| تشعشع جذب شده (rad) | انرژی جذب شده به ازای هر کیلوگرم بافت | $$1 Gy = 1 \frac { J} { kg }$$ بافت |
| سیوت | آسیب بافتی | $$Sv = RBE \times Gy$$ |
| «معادل رونتگن برای انسان» (Roentgen Equivalent for man | rem) | آسیب بافتی | $$Rem = RBE \times rad$$ |
rem واحدی برای آسیب پرتوزایی است و در بیشتر موارد در پزشکی استفاده میشود. توجه به این نکته مهم است که واحدهای آسیب بافتی شامل انرژی دوز تابش (rad یا Gy) و عامل بیولوژیکی (Relative Biological Effectiveness | RBE) است. این واحدها تقریبی از میزان آسیب ایجاد شده توسط تشعشع در بافت را به ما میدهند.
$$number \of rems = RBE \times number \of rads$$

مثال میزان تشعشع
کبالت ۶۰ با نیمهعمر ۵/۲۶ سال برای درمان سرطان مورد استفاده قرار میگیرد. دلیل استفاده از این عنصر رادیواکتیو در درمان سرطان، تابش پرتوهای گاما توسط آن است. با استفاده از این پرتوها میتوان سلولهای سرطانی را با دقت بالایی مورد هدف قرار داد. فرض کنید ۵/۰۰ گرم کبالت ۶۰ برای درمان سرطان داریم. مطلوب است:
- فعالیت آن بر حسب بکرل چیست؟
- فعالیت آن بر حسب کوری چیست؟
پاسخ
فعالیت به صورت زیر محاسبه میشود:
$$Activity = \lambda N = (\frac {\ln 2 } { t _ { \frac { 1} { 2 } }}) N = (\frac { \ln 2 } { 5.26 y } ) \times 5.00 g = 0.659 \frac { g } {y } \of ^{60} Co that decay $$
عدد بهدست آمده را به صورت زیر به واپاشی بر ثانیه تبدیل میکنیم:
$$0.659 \frac { g } { y } \times \frac { y } { 350 days} \times \frac { 1 day } { 24 hours} \times \frac { 1 h } { 3600 s } \times \frac {1 mol } { 59.9 g } \times \frac {6.02 \times 10 ^ { 23 } atoms}{1 mol } \times \frac { 1 decay } { 1 atom } = 2.10 \times 10 ^ { 14 } \frac { decay } { s }$$
قسمت ۱: از آنجا که یک بکرل برابر یک واپاشی بر ثانیه است، فعالیت برحسب بکرل برابر است با:
$$2.10 \times 10 ^ { 14 } \frac { decay } { s } \times ( \frac {1 Bq } { 1 \frac { decay } { s }}) = 2.10 \times 10 ^ { 14 } Bq $$
قسمت 2: از آنجا که یک کوری برابر $$3.7 \times 10 ^ { 11 }$$ واپاشی بر ثانیه است، فعالیت برحسب کوری برابر است با:
$$2.10 \times 10 ^ { 14 } \frac { decay } { s } \times ( \frac {1 Ci } { 3.7 \times 10 ^ { 11 } \frac { decay } { s }}) = 5.7 \times 10 ^ { 2 } Ci$$
رادیواکتیو در پزشکی
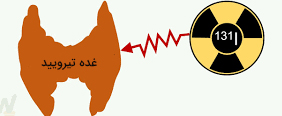
رشته پزشکی هستهای، به خصوص در بخش تصویربرداری، در ۲۰ سال گذشته بسیار گسترش یافته است. پرتودرمانی با استفاده از ید ۱۳۱ رادیواکتیو شامل تصویربرداری و درمان غده تیروئید است. غده تیروئید، غدهای داخل گردن است که دو هورمون برای تنظیم متابولیسم بدن ترشح میکند. در برخی افراد، این غده پرکار میشود و هورومونهای لازم را بیش از حد ترشح میکند. برای درمان این مشکل از پرتودرمانی توسط ید ۱۳۱ رادیواکتیو استفاده میکنند. ید ۱۳۱ در رآکتورهای شکافت یا توسط بمباران نوترونی هستههای دیگر تولید میشود.
غده تیروئید برای ترشح هورمونها از عنصر ید استفاده میکند. یدِ داخل هر غذا پس از ورود به جریان خون توسط غده تیروئید جذب میشود. هر فردی که از بیماری پرکاری تیروئید رنج میبرد قرصهایی متشکل از ید ۱۳۱ رادیواکتیو را مصرف میکند. پس از مصرف هر قرص، ید ۱۳۱ همانند ید عادی توسط جریان خون جذب و در غده تیروئید مصرف میشود. انتشار متمرکز تشعشعات هستهای در غده تیروئید سبب از بین رفتن برخی سلولهای غده و بهبود عملکرد تیروئید پرکار میشود. برای تصویربرداری از غده تیروئید، بیمار باید مقدار بسیار کمی ید ۱۳۱ مصرف کند.
اسکن «برشنگاری با گسیل پوزیترون» (Positron Emission Tomography | PET) نوعی تصویربرداری پزشکی هستهای است. با توجه به ناحیهای از بدن که تصویربرداری میشود، سه راه برای استفاده از ایزوتوپ رادیواکتیو وجود دارد:
- تزریق داخل رگ
- بلعیدن
- استنشاق به صورت گاز
پس از تجمع ایزوتوپ رادیواکتیو در ناحیه موردنظر داخل بدن، تشعشعات پرتو گاما توسط اسکن PET آشکار میشوند. تصویر ناحیه موردنظر توسط برنامههای ویژه در کامپیوتر ایجاد خواهد شد. از اسکن PET برای تشخیص سرطان، تعیین گسترش سرطان در بدن، ارزیابی تاثیر درمانهای استفاده شده، تعیین جریان خون به ماهیچه قلب، تعیین اثرات حمله قلبی، تشخیص ناهنجاریهای مغزی مانند تومورها یا اختلالات حافظه و تهیه نقشه از مغز و عملکرد قلب استفاده میشود.
«پرتودرمانی خارجی» (External Beam Therapy | EBT) روشی است که در آن پرتویی با انرژی بسیار بالا به محل دقیق تومور در بدن بیمار تابانده میشود. این پرتوها تنها سلولهای سرطانی را از بین میبرند و به سلولهای سالم آسیبی وارد نمیکنند. از این روش برای درمان سرطانهایی مانند سرطان سینه، سرطان روده بزرگ، سرطان سر و گردن، سرطان ریه و سرطان پروستات استفاده میشود.
تا اینجا با مفهوم رادیواکتیو و برخی عناصر رادیواکتیو طبیعی و سنتز شده آشنا شدیم. در مفهوم رادیواکتیو از عبارتی به نام نیمهعمر استفاده کردیم. در ادامه، در مورد این مفهوم با جزییات بیشتری صحبت میکنیم.
رادیواکتیو طبیعی و نیمه عمر
در طی واپاشی رادیواکتیو طبیعی، تمام اتمهای عنصر رادیواکتیو به طور خودبهخودی به اتمهای عنصر دیگر تبدیل نمیشوند. فرایند واپاشی زمان میبرد و برای بیان نرخ رخ دادن فرایند از مقدارهای مشخصی میتوان استفاده کرد. مفیدترین مفهوم برای بیان نرخ واپاشی، نیمهعمر نام دارد. نیمهعمر مدت زمانی است که در طی آن نیمی از ماده آغازین تغییر میکند یا واپاشیده میشود. نیمهعمرها میتوانند از اندازهگیریهای انجام شده بر روی تغییرات جرم هسته و مدت زمان این اتفاق، محاسبه شوند. تنها چیزی که میدانیم آن است که در مدت زمان نیمهعمر ماده، نیمی از هسته اولیه تجزیه خواهد شد.
گرچه تغییرات شیمیایی به دلیل عاملهایی مانند دما و غلظت، سریع یا آهسته میشوند، این عاملها هیچ تاثیری روی نیمهعمر ماده ندارند. هر ایزوتوپ رادیواکتیو نیمهعمر منحصربهخود دارد و نیمهعمر آن مستقل از دما، غلظت و عاملهای مشابه است. نیمهعمر بسیاری از ایزوتوپهای رادیواکتیو محاسبه شدهاند. مقدار نیمهعمرهای اندازهگیری شده از ۱۰ میلیارد سال تا کسری از ثانیه متغیر هستند. به عنوان مثال، نیمهعمر اورانیوم ۲۳۸ برابر ۴/۵ میلیارد سال، نپتونیوم ۲۴۰ برابر یک ساعت، پلوتونیوم ۲۴۳ برابر ۵ ساعت، امریکیوم ۲۴۵ برابر ۲۵ دقیقه، و نوبلیوم ۲۵۴ برابر ۳ ثانیه است.
مقدار هسته رادیواکتیو در هر زمان داده شده پس از یک نیمهعمر به نصف کاهش مییابد. به عنوان مثال، اگر ۱۰۰ گرم کالیفورنیوم ۲۵۱ در زمان مشخصی داشته باشیم، پس از گذشت ۸۰۰ سال، مقدار آن به ۵۰ گرم کاهش خواهد یافت. پس از گذشت ۸۰۰ سال دیگر (در مجموع ۱۶۰۰ سال)، تنها ۲۵ گرم از کالیفورنیوم اولیه باقی خواهد ماند. این نکته را همواره به یاد داشته باشید که نیمهعمر مدت زمانی است که نیمی از نمونه ما پس از گذشت این زمان باقی میماند. بنابراین، مقدار اولیه ماده مهم نیست.
مثال ۱
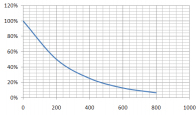
نمودار واپاشی ایزوتوپی رادیواکتیو برحسب زمان به صورت زیر نشان داده شده است. نیمهعمر این ایزوتوپ چه مقدار است؟
پاسخ
همانطور که در مطالب بالا گفتیم نیمهعمر مدت زمانی است که طی آن نیمی از ماده اولیه تغییر میکند یا واپاشیده میشود. از روی نمودار باید ببینیم در چه زمانی نیمی از ایزوتوپ رادیواکتیو واپاشیده شده است. برای انجام این کار ابتدا روی نمودار عمودی، عدد ۵۰٪ را انتخاب میکنیم و از آن خطی افقی و موازی محور زمان رسم میکنیم. خط افقی را تا جایی ادامه میدهیم که نمودار واپاشی را قطع کند. از محل تقاطع خط افقی و نمودار واپاشی، خطی عمودی رسم میکنیم. محل تقاطع این خط با محور زمان، نیمهعمر ایزوتوپ رادیواکتیو را میدهد. پس از انجام کارهای گفته شده، نیمهعمر در حدود ۲۰۰ سال بهدست میآید. به این نکته توجه داشته باشد که پس از گذشت ۲۰۰ سال دیگر، ۲۵٪ درصد ماده باقی میماند (نصف ۵۰٪).
مثال ۲
۶۰ گرم نپتونیوم ۲۴۰ موجود است. پس از گذشت ۴ ساعت چه مقدار از این ایزوتوپ رادیواکتیو باقی میماند. (نیمهعمر نپتونیوم ۲۴۰، برابر یک ساعت است)
پاسخ
نیمهعمر هر ایزوتوپ رادیواکتیو مدت زمانی است که نیمی از ایزوتوپ واپاشیده میشود. از آنجا که نیمهعمر نپتونیوم ۲۴۰ برابر یک ساعت است، پس از گذشت این مدت، ۳۰ گرم از ۶۰ گرم ماده اولیه باقی میماند. با گذشت یک ساعت دوم (دو ساعت)، ۵۰ درصد ۳۰ گرم واپاشیده میشود. بنابراین، پس از گذشت دو ساعت، ۱۵ گرم از نپتونیوم ۲۴۰ باقی میماند. پس از گذشت یک ساعت سوم ( ۳ ساعت)، نیمی از ۱۵ گرم واپاشیده میشود و ۷/۵ گرم نپتونیوم ۲۴۰ باقی خواهد ماند. سرانجام، پس از گذشت یک ساعت چهارم (۴ساعت)، نیمی از ۷/۵ گرم ماده باقیمانده از بین میرود. در نتیجه، پس از گذشت ۴ ساعت، ۳/۷۵ گرم نپتونیوم ۲۴۰ باقی میماند.
مثال ۳
در آزمایشگاه ۸۰ گرم اکتینیوم ۲۲۵ موجود بود. پس از ۵۰ روز، تنها ۲/۵۵ گرم از این ماده باقی ماند. نیمهعمر این ماده را بهدست آورید.

پاسخ
برخلاف مثال ۲، در این مثال باید نیمهعمر ماده داده شده را بهدست آوریم. مقدار اولیه اکتینیوم ۲۲۵ برابر ۸۰ گرم و مقدار نهایی آن برابر ۲/۵۵ گرم است. از آنجا که پس از گذشت هر نیمهعمر، نیمی از ماده اولیه واپاشیده میشود، پس از گذشت یک نیمهعمر مقدار ماده به ۴۰ گرم کاهش مییابد. پس از گذشت نیمهعمر دوم، مقدار ماده به ۲۰ گرم، پس از گذشت نیمهعمر سوم، مقدار ماده به ۱۰ گرم، پس از گذشت نیمهعمر چهارم، مقدار ماده به ۵ گرم و پس از گذشت نیمهعمر پنجم، مقدار ماده به ۲/۵ گرم کاهش یافته است. از آنجا که این اتفاق در مدت زمان ۵۰ روز رخ داده است، بنابراین نیمهعمر اکتینیوم ۲۲۵ برابر ۱۰ روز است.
به احتمال زیاد از خود پرسیدهاید آیا رابطهای ریاضی برای محاسبه نیمهعمر عنصر رادیواکتیو وجود دارد یا خیر. پاسخ به این پرسش، بله است. مقدار ایزوتوپ رادیواکتیو باقیمانده پس از گذشت تعداد مشخصی نیمهعمر با استفاده از رابطه زیر محاسبه میشود:

n در رابطه بالا، تعداد نیمهعمرهای داده شده است.
زباله رادیواکتیو چیست ؟
به مواد رادیواکتیوی که به شکل گاز، مایع یا جامد هستند و هیچ استفادهای در آینده برای آنها پیشبینی نشده است، زباله رادیواکتیو گفته میشود. برای تعیین راهکارهای مناسب برای مدیریت و دفع زبالههای رادیواکتیو، این زبالههای به چند دسته تقسیمبندی شدهاند. توجه به این نکته مهم است که هیچ قرارداد بینالمللی برای قبول یا رد این تقسیمبندی وجود ندارد. اما در حالت کلی، دستهبندی زبالهها براساس مواد رادیواکتیو داخل زباله و نیمهعمر آنها انجام میشود. زبالههایی که از مواد با نرخ واپاشی بالا تشکیل شدهاند، مقدار قابلتوجهی گرما تولید میکنند. از اینرو، به هنگام دفع این زبالهها به این نکته باید توجه شود. در سال ۲۰۰۹، زبالههای رادیواکتیو به ۶ گروه زیر طبقهبندی شدند:
- زبالههای معاف: مقدار مواد رادیواکتیو در این زبالهها بسیار کم است، به گونهای که لازم نیست توسط مرجع نظارتی کنترل شود. به محض پاکسازی زبالهها توسط مرجع نظارتی، دیگر به آنها به عنوان ضایعات رادیواکتیو نگاه نمیکنیم.
- زبالههای کوتاه مدت: این زبالهها را میتوان برای مدت زمانی محدود حتی تا چند سال ذخیره کرد. در این صورت، مقدار مواد رادیواکتیو توسط واپاشی رادیواکتیو کاهش مییابد. این دسته از زبالههای رادیواکتیو شامل هستههای رادیواکتیو با نیمهعمر بسیار کوتاه هستند. این دسته از هستههای رادیواکتیو بیشتر در پژوهشهای دانشگاهی، صنعتی و پزشکی استفاده میشوند.
- زبالههای بسیار سطح پایین: این دسته از زبالهها رادیواکتیو به طور معمول فعالیت رادیواکتیو بیشتری نسبت به زبالههای معاف دارند، اما ممکن است به مهار و جداسازی نیاز نداشته باشند. این زبالهها برای دفع در تاسیسات دفع زباله نزدیک به سطح با کنترل نظارتی محدود مناسب هستند. زبالههای معمول در این دسته شامل خاک و خردهسنگهایی هستند که سطح بسیار اندکی مواد رادیواکتیو دارند.
- زبالههای سطح پایین: سطح رادیواکتیو این زبالهها به نسبت بالا است، اما از مقدار محدودی هستههای رادیواکتیو با نیمهعمر بالا تشکیل شدهاند. این دسته از زبالههای رادیواکتیو به جداسازی و مهار قوی برای دوره زمانی تا چند صد سال نیاز دارند و برای دفع در تاسیسات مهندسی نزدیک سطح مناسب هستند.
- زبالههای سطح متوسط: این دسته از زبالهها به دلیل سطح بالای رادیواکتیو هستههای رادیواکتیو با نیمهعمر بالا نیاز به مهار و جداسازی سطح بالایی در مقایسه با زبالههای سطح پایین دارند.
- زبالههای سطح بالا: این دسته از زبالههای رادیواکتیو به دلیل سطح فعالیت رادیواکتیو بسیار بالا، گرمای قابلتوجهی تولید میکنند. بنابراین، برای دفع آنها باید تدبیرهای امنیتی ویژهای استفاده شود.

جمعبندی
در این مطلب از مجله فرادرس، به پرسش رادیواکتیو چیست به زبان ساده پاسخ دادیم و در مورد برخی عناصر رادیواکتیو صحبت کردیم. رادیواکتیو مشخصه رفتاری هسته اتمهای ناپایدار است. هسته اتم ناپایدار با تابش ذرات آلفا، بتا یا تابش مقدار قابلتوجهی انرژی به شکل پرتوهای گاما، به حالت پایدار میرسد. عناصر رادیواکتیو یا به صورت طبیعی در پوسته زمین وجود دارند یا به صورت آزمایشگاهی سنتز شدهاند. اورانیوم، عنصری رادیواکتیو است که به صورت طبیعی در پوسته زمین وجود دارد، اما عنصری مانند برکلیوم در سال ۱۹۴۹ میلادی توسط گروهی از دانشمندان در آزمایشگاهی در دانشگاه کالیفرنیا سنتز شد. قرار گرفتن در برابر تشعشعات رادیواکتیو میتواند صدمات جبرانناپذیری بر بدن انسان وارد کند. بنابراین، به هنگام کار با مواد رادیواکتیو باید از تجهیزات پیشرفتهای استفاده کرد. در پایان، در مورد مفهوم نیمهعمر و چگونگی محاسبه آن و انواع زبالههای رادیواکتیو صحبت کردیم.











در مثال ها گاهی اوقات عدد جرمی رو بالا و عدد اتمی رو پایین نوشته بودید لطفا ایرادات رو برطرف کنید ممنون
با سلام،
متن بازبینی و اصلاح شد،
با تشکر از همراهی شما با مجله فرادرس