ایمنی ذاتی چیست؟ – به زبان ساده + تفاوت با ایمنی اکتسابی
بدن انسان روزانه با میلیاردها میکرواورگانیسم مختلف برهمکنش دارد. پاتوژنها گروهی از این میکرواورگانیسمها هستند که ورود آنها به بخشهای داخلی بدن با به هم ریختن عملکرد فیزیولوژیک بخشهای مختلف و ایجاد بیماری همراه است. به همین دلیل سیستم ایمنی بدن در چند لایه و به کمک مکانیسمهای مختلف از ورود این اورگانیسمها بدن جلوگیری یا پاتوژن ورودی را از بین میبرد. ایمنی ذاتی یکی از بخشهای سیستم ایمنی است که در این مطلب مکانیسمهای مختلف آن را توضیح میدهیم.
- یاد میگیرید ایمنی ذاتی چیست و چگونه عمل میکند.
- اجزای اصلی و سدهای دفاعی ایمنی ذاتی را میآموزید.
- خواهید آموخت تفاوتهای کلیدی ایمنی ذاتی و اکتسابی چیست.
- مسیرهای فعالسازی و نقش سیستم کمپلمان را یاد خواهید گرفت.
- نقش سایتوکاینها، کموکاینها و اینترلوکینها را میآموزید.
- با انواع سلولهای ایمنی ذاتی و کارکرد آنها آشنا میشوید.
ایمنی ذاتی چیست ؟
ایمنی ذاتی یکی از مکانیسمهای دفاعی جانوران و گیاهان برای محافظت از خود در برابر عوامل بیماریزا (پاتوژنها) است. در این روش بدن انسان پاسخ یکسانی به انواع باکتریها، قارچها، انگلها و ویروسهای مزاحم ایجاد میکند. ایمنی ذاتی یا دفاع غیر اختصاصی از بدو تولد در بدن فرد وجود دارد و اولین سدی است که از ورود پاتوژنها به بدن جلوگیری میکند. مکانیسمهای این نوع ایمنی تشخیص نمیدهند که پاتوژن برای بار اول وارد بدن شما شده است یا قبلا با آن مواجه شدهاید. به همین دلیل گفته میشود ایمنی ذاتی برخلاف ایمنی اکتسابی حافظه ندارد. مکانیسم اصلی این ایمنی فراخوانی گلبولهای سفید به محل عفونت و ایجاد التهاب است.
اجزای ایمنی ذاتی کدامند؟
سد آناتومی (پوست و غشای مخاطی)، سد فیزیولوژیک (تب، pH اسیدی و مولکولهای شیمیایی)، سلولهای ایمنی (اندوسیتوز و فاگوسیتوز) و التهاب چهار جز اصلی ایمنی ذاتی هستند. نقش سدهای ایمنی ذاتی در جدول زیر خلاصه شده است. در بعضی تقسیمبندیها سدهای فیزیکی و شیمیایی را مرحله پیش از دفاع ذاتی (پاسخهای عمومی سلولی و التهاب) در نظر میگیرند.
| سد دفاعی | مکانیسم |
| سد آناتومی یا فیزیکی | |
| پوست | سد فیزیکی و بدون سلول خارجی برای جلوگیری از ورود پاتوژنها
توقف یا کاهش رشد میکروبها به دلیل pH اسیدی |
| غشای مخاطی | رقابت فلور نرمال بدن (باکتریهای مفید) با پاتوژنها برای سطح چسبنده در دسترس
به دام افتادن میکروبهای خارجی در مخاط خارج کردن میکروبها از بدن بهوسیله حرکت مژکها |
| سد فیزیولوژیک یا شیمیایی | |
| دما | جلوگیری از رشد میکروبها با افزایش دما و تب |
| pH اسیدی | کاهش رشد میکروب به دلیل pH اسیدی معده و واژن |
| مولکولهای شیمیایی | تجزیه دیواره سلولی باکتری بهوسیله آنزیمی لیزوزیم
ترشح آنتیویروس اینترفرون بهوسیله سلولهای سالم لیز شدن سلول یا افزایش کارایی فاگوسیتوز بهوسیله فعالیت پروتئینهای مکمل |
| سلولهای ایمنی | |
| اندوسیتوز و تجزیه آنتیژنها بهوسیله سلولهای مختلف | |
| فاگوسیتوز و تجزیه پاتوژنها بهوسیله فاگوسیتها | |
| التهاب | |
| فراخوانی سلولهای ایمنی و ترشح پروتئینهای آنتیباکتریال در محل عفونت | |
تفاوت ایمنی ذاتی و اکتسابی
ایمنی اکتسابی بخشی از سیستم ایمنی بدن و وابسته به لنفوسیتها است. نامگذاری این دو بخش سیستم ایمنی انسان به دلیل نوع مکانیسمهایی است که برای از بین بردن میکروبها به کار میگیرند.
ایمنی ذاتی از سه سد فیزیکی، شیمیایی و سلولی تشکیل شده است که پاسخ یکسانی به تمام پاتوژنها دارند و بخشی از آنها قبل از ورود پاتوژن، در بدن وجود دارد. اما مکانیسمهای ایمنی اکتسابی پس از ورود پاتوژن به بدن فعال میشوند و برای پاسخی منحصر به فرد ایجاد میکنند. تفاوتهای این دو بخش سیستم ایمنی در جدول زیر خلاصه شده است.
| ایمنی ذاتی | ایمنی اکتسابی | |
| اجزا | پوست، غشای مخاطی، پروتئینهای محلول پلاسما، نوتروفیل، ماکروفاژ، سلولهای دندریتی، ائوزینوفیل، بازوفیل و سلولهای کشنده طبیعی | سلولهای ارائهدهنده آنتیژن، لنفوستیهای B و T |
| سرعت ایجاد پاسخ | سریع (چند ساعت پس از عفونت) | آهسته (چند روز پس از عفونت) |
| اختصاصی بودن | اختصاصی نیست. | اختصاصی است. |
| خاطره | ندارد. | دارد. |
| تنوع | پاسخ مشترک به انواع پاتوژن | پاسخ منحصر به فرد به هر پاتوژن |
| شدت پاسخ | محدود و کم | زیاد و متنوع |
سد فیزیکی ایمنی ذاتی
راحتترین روش مبارزه با میکروبها جلوگیری از ورود آنها به بخشهای داخلی بدن است. لایه شاخی پوست بدن سدی نفوذناپذیر در برابر بسیاری از پاتوژنها ایجاد میکند. اما هر عاملی که یکپارچگی این بافت را به هم بزند (خراش، بریدگی یا سوختگی) با افزایش احتمال عفونت همراه است. به علاوه ترشح لاکتیکاسید و اسیدهای چرب از غدد عرق این زیرپوستی و غدد چربی یا «سبوسه» (Sebaceous) pH این بافت و سرعت رشد میکروبها را کاهش میدهد. با این وجود استافیلوکوکوس اورئوس یکی از باکتریهای استثنایی است که در فولیکولهای مو رشد میکند.
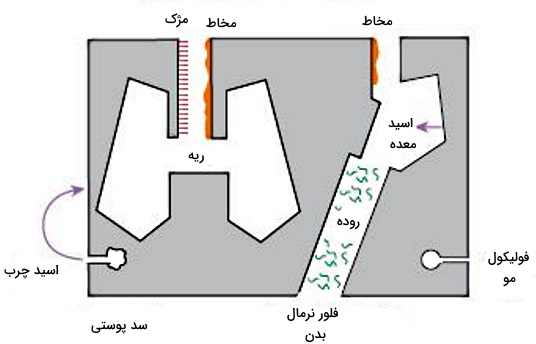
مخاط، موکوس یا موکوز ترکیبی چسبنده، لزج و با گرانروی (ویسکوزیته) زیاد است که سطح پوشش ایپتیال لولههای تنفسی، لوله گوارش، مجاری ادراری و سیستم بینایی-شنوایی را میپوشاند. این ماده از ترکیبی از نمکهای معدنی، آنزیمهای ضدمیکروبی (ازجمله لیزوزیم)، ایمونوگلوبینهای ترشحی (به ویژه آنتیبادی A)، گلیکوپروتئینها (لاکتوفرین) و موسین (پروتئینی با وزن مولکولی و شاخههای قندی فراوان) تشکیل شده است که بهوسیله سلولها جامی غشای مخاطی و غدد زیرمخاطی ترشح میشود. ذرات خارجی (ذرات معلق هوا، گرد و غبار یا پاتوژنها) به دام افتاده در این ترکیب بهوسیله حرکت مژکهای سطح اپیتلیوم، سرفه یا عطسه از بدن خارج میشوند.
علاوه بر لایه موکوزی مجاری بدن، اسید معده (HCl)، اسپرمین و روی مایع منی، لاکتوپروکسیداز شیر مادر و لیزوزیم موجود در اشک، ترشحات بینی و بزاق، با از بین بردن ساختارهای مولکولی میکروبها به دفاع ذاتی بدن کمک میکنند.
سد فیزیولوژیک بدن
رقابت بین فلور نرمال، باکتریهای مفید یا همسفره بدن انسان با باکتریهای پاتوژن یکی دیگر از مکانیسمهای دفاع ذاتی برای محافظت از انسان است. این باکتریها با رقابت برای مواد غذایی ضروری یا ترشح مولکولهای مهاری از رشد باکتریها و قارچهای پاتوژینیک جلوگیری میکنند. برای مثال لاکتیکاسید ترشح شده بهوسیله باکتریهای تجزیهکننده گلیکوژن در واژن، با کاهش pH این اندام از رشد باکتریهای پاتوژنی جلوگیری میکنند. مصرف آنتیبیوتیک بدون تجویز پزشک، با از بین بردن این باکتریها احتمال ایجاد عفونت باکتریایی به ویژه «کاندیا» (Candida) و «کلستریدیوم دفیسیل» (Clostridium difficile) را افزایش میدهد.
ترشح پروتئینهای باکتریوسیدال (کشنده باکتری) بهوسیله باکتریهای مفید روده، یکی دیگر از مکانیسمهای فیزیولوژیک ایمنی ذاتی برای دفاع از بدن است. کولیسین یکی از این پروتئینهای هیدروفوب است که پس از اتصال به مولکولهای سطحی (با بار منفی) باکتریها، تشکیل کانال ولتاژی و تغییر پتانسیل غشای باکتری، منجر به لیز شدن سلول میشود.
سایتوکاین های ایمنی ذاتی
یکی از ویژگیهای مهم سیستم ایمنی بدن (ذاتی و اکتسابی) توانایی برقراری ارتباط بین سلولهای آن است. این سلولها با مکانیسم سیگنال-گیرنده سلولهای دیگر را از وجود پاتوژن باخبر میکنند و پاسخ ایمنی را افزایش میدهند. سایتوکاینها و کموکاینها دو دسته مولکولهای پروتئینی مهمی هستند که در شروع پاسخ ایمنی (فراخوانی گلبول سفید به بافت)، ارتباط سلولهای ایمنی با هم (فعال یا غیرفعال شدن سلولها) و افزایش شدت پاسخ نقش دارند. این پروتئینها، هورمونهای سیستم ایمنی هستند.
- سایتوکاینها: سایتوکاینها مولکولهای پروتئینی هستند که دامنه وسیعی از مسیرهای سیستم ایمنی را تنظیم میکنند. اتصال این مولکولها به گیرنده سلولهای ایمنی با فعال شدن، تمایز سلولها و ترشح مولکولهای آنتیباکتریال همراه است. این مولکولها معمولا پس از اتصال PAMPs و DAMPs به گیرندههای ویژه سلولهای ایمنی ترشح میشوند. سایتوکاینهای پیشالتهابی یا التهابی، گروهی از سایتوکاینها هستند که از بهوسیله ماکروفاژها یا سلولهای T کمککننده ترشح میشوند و پاسخ التهابی ایمنی ذاتی را افزایش میدهند.
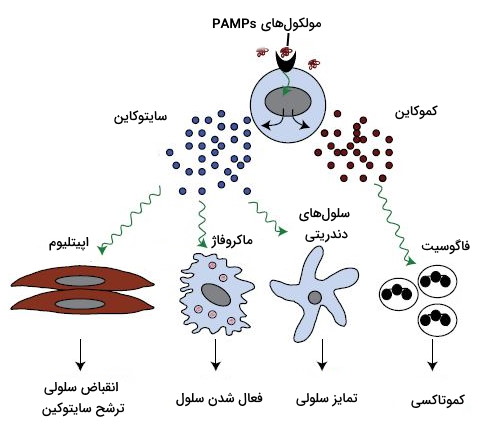
- کموکاینها: این پروتئینها مثل سایتوکاینها پس از اتصال مولکولهای PAMPs و DAMPs به گیرنده غشایی ویژه در گلبولهای سفید ترشح میشود. این مولکولها مسیری برای حرکت گلبولهای سفید (در جهت افزایش شیب غلظت) به محل عفونت ایجاد میکنند. به این فرایند «کموتاکسی» (Chemotaxis) گفته میشود.

اینترلوکین ها
اینترلوکینها خانواده مهمی از سایتوکاینها هستند که بر اساس تاریخچه شناسایی در ۴۰ گروه (IL1-IL40) شمارهگذاری میشوند. وظیفه اصلی این مولکولها انتقال پیام بین سلولهای ایمنی است. اما بر سایر بافتهایی که در ایجاد پاسخ ایمنی نقش دارند ازجمله اندوتلیال مویرگها، هیپوسیتهای کبد، سلولهای اپیتلیال، سلولهای بنیادی مغز استخوان، فیبروبلاست و نورونهای سیستم عصبی مرکزی نیز اثر میگذارند.
اینترلوکینها بر اساس سلول ترشحکننده، سلول هدف و اثر همزمان سایر سایتوکاینها میتوانند مکانیسمهای سلولی متفاوتی را فعال یا غیرفعال کنند. بنابراین همانطور که در روز اثرپذیریهای مختلف از همکاران، دوستان، خانواده و رسانه تصمیمات مهمی میگیریم، گلبولهای سفید بدن ما با ادغام اثر سایتوکاینهای مختلف تصمیمی به تقسیم سلولی، تمایز، فاگوسیتوز ذره خارجی، ترشح وزیکولهای ذخیرهای، مهاجرت یا مرگ برنامهریزی شده (آپوپتوز) میگیرند.
- اینترلوکینها ۱ و ۶ (IL1 و IL6) دو اینترلوکین ایمنی ذاتی و سیتوکینهای پیشالتهابی هستند که با افزایش نفوذپذیری سلولهای اندوتلیال مویرگ و فراخوانی لنفوسیتها به محل عفونت در شروع پاسخ التهابی شرکت میکنند. به علاوه این مولکولها با اثر بر سلولهای مغز استخوان، تمایز سلولهای میلوئیدی به سلولهای ایمنی ذاتی (به ویژه نوتروفیلها) را افزایش میدهند.
- اینترلوکینهای ۱۸ و ۱۲ (IL18 و IL12) گروه دپیگری از سایتوکاینهای دفاع غیراختصاصی و مولکولهای فعالکننده دفاع غیراختصاصی بدن هستند. این سایتوکاینها بهوسیله ماکروفاژها و سلولهای دندریتی فعال شده پس از اتصال آنتیژن ترشح میشوند. اتصال این مولکولها به گیرنده لنفوسیت T با تمایز این سلولهای ایمنی به سلولهای کشنده همراه است.
- اینترلوکین ۱۰ (IL10) یکی از سایتوکینهای ضدالتهابی است. ترشح این مولکول از ماکروفاژها و سلولهای دندریتی فعال منجر به مهار ماکروفاژها و تولید سایتوکاینهای پیشالتهابی بهوسیله سایر گلبولهای سفید میشود. ترشح این مولکول در طول زمان، شدت پاسخ التهابی حاصل از آسیب بافتی را کاهش میدهد.
- اینترلوکین ۸ (IL8) یا CXCL8 یکی از اولین کموکاینهایی است که در پاسخ به آنتیژنها یا مولکولهای بافت آسیبدیده بهوسیله ماکروفاژها، سلولهای دندریتی، اندوتلیال مویرگ و سلولهای اپیتلیال ترشح میشود. این مولکولها با اتصال به گیرنده غشایی نوتروفیلها کوتاکسی و خروج این گلبولهای سفید از مویرگ به بافت عفونی (دیاپدز | Diapedesis) را تحریک میکنند.
فاکتور نکروز تومور
فاکتور نکروز تومور آلفا () یکی دیگر از سایتوکاینهای پیشالتهابی است که با اتصال به گیرنده غشایی پلاسمایی ماکروفاژها این سلولها را فعال میکند. در نتیجه فعالیت فاگوسیتوزی ماکروفاژها و تولید سایتوکاینهای ضدمیکروبی در آنها افزایش مییابد. اتصال این مولکولها به سلولها توموری با فعال شدن مسیرهای مولکولی آپوپتوز همراه است.
اینترفرون های ایمنی ذاتی
اینترفرونها یکی دیگر از پروتئینهای ضدمیکروبی هستند که بر اثر اتصال PAMPs به گیرنده سلولهای ایمنی بیان میشوند. این پروتئینهای ضدویروسی ایمنی ذاتی بهوسیله سلولهای آلوده به ویروس و سلولهای سالم ترشح میشوند.
- سلولهای آلوده به ویروس: اتصال آنتیژنهای درونسلولی ویروسها (RNA یا DNA ویروسی) به گیرندههای شناساییکننده الگو در سلولهای آلوده شده با فعال شدن فاکتور رونویسی IRF و بیان ژنهای اینترفرون (IRF) همراه است.
- سلولهای سالم: گیرندههای TLR در غشای پلاسمایی یا اندوزومی سلولهای سالم، آنتیژنهای خارج سلولی ویروسها را شناسایی میکند. اتصال آنتیژن-گیرنده در این سلولها با فعال شدن مسیر فاکتورهای رونویسی IRF و بیان اینترفرون آلفا و بتا همراه است.
پلاسماسیتوئیدها گروهی از سلولهای دندریتی هستند که ویروسها را فاگوسیتوز میکنند. گیرندههای اندوزومی TLR7 (شناسایی RNA تکرشتهای) و TLR9 (شناسایی DNA) در سیتوپلاسم این سلولها به آنتیژنهای ویروسی متصل میشود و فعال کردن فاکتور رونویسی IRF بیان انواع اینترفرون نوع I را تحریک میکند.
ایترفرون آلفا و بتا مثل بسایری از سایتوکاینهای ایمنی ذاتی، پروتئینهای دیمری هستند که گیرنده آنها در غشای اکثر سلولها وجود دارد. اتصال اینترفرون-گیرنده با دیمری شدن رسپتورها و فعال شدن مسیر JAK-ATAT همراه است. در این مسیر گیرنده دیمر، کینارهای جوناس JAK1 و TYK2 را فعال میکند. این کینازها با اضافه کردن فسفات به ساختار پروتئینی، فاکتورهای رونویسی STAT را فعال میکنند. فاکتور رونویسی فعال با عبور از غشای هسته چهار ژن مهار تقسیم ویروس را فعال میکند.
- پروتئین کیناز R: این پروتئین پس از اتصال به RNA دورشتهای فعال میشود. پروتئین کیناز R سنتز پروتئینهای سلولی و ویروسی را با مهار فاکتور شروع رونویسی eIFa مهار میکند.
- اولیگوآدنیلات A سنتتاز: این آنزیم نوکلئوتیدیل ترانسفراز پس از بیان به RNA دورشتهای ویروسی در سیتوپلاسم متصل و فعال میشود. آنزیم فغعال ATP را به ۲،۵-اولیگوآدنیلات تبدیل میکند. اتصال اولیگوآدنیلات به آنزیم RNase L با فعال شدن آنزیم و تجزیه RNA ویروسی همراه است.
- پروتئینهای گروه MAX: این پروتئینها رونویسی ژنهای ویروسی و تشکیل ویروسهای جدید را مهار میکنند.
- پروتئینهای IFIT: این پروتئنها به RNA دورشتهای متصل و بیان ژنهای ویروسی را مهار میکنند. به علاوه اتصال این پروتئینها به فاکتور شروع رونویسی eIF3 با مهار بیان ژنهای وابسته به این فاکتور همراه است.
شناسایی پاتوژن در ایمنی ذاتی
فعالیت هر دو بخش سیستم ایمنی بدن به دو بخش اصلی شناسایی پاتوژن و از بین بردن آن تقسیم میشود. این دو فعالیت بهوسیله رابطه مکملی بین گیرندههای سطح سلولهای ایمنی و مولکولهای سطحی پاتوژنها (آنتیژن) که عاملی اصلی بیماریزایی هستند، انجام میشود. «الگوی مولکولی همراه پاتوژن» (Pathogen-associated Molecular Patterns | PAMPs) ساختار مکملی است که گیرندههای ایمنی ذاتی آن را شناسایی و پاسخ ایمنی را شروع میکنند. کربوهیدراتهای غشای سلولهای میکروبی، DNA یا RNA ویروسی، فلاژلین باکتری (پروتئین تاژک)، لیپوپلیساکارید باکتریهای گرم منفی و لیپوتایکوئیکاسید باکتریهای گرم مثبت ازجمله آنتیژنهایی هستند که سیستم ایمنی ذاتی به آنها پاسخ میدهد.
علاوه بر پاتوژنها، سلولهای خودی بافت آسیب دیده مولکولهایی آزاد میکنند که در به طور طبیعی در ماتریکس خارج سلولی وجود ندارد (مثل آزاد شدن DNA میتوکندریایی در سیتوپلاسم). به این مولکولها که بهوسیله نکروز و مرگ بافت آزاد میشوند، الگوی مولکولی همراه خطر یا DAMPs گفته میشود. اتصال PAMPs و DAMPs به گروه متنوعی از گیرندههای غشایی و اندوزومی در سلولهای ایمنی به نام «گیرندههای شناساییکننده الگو» (Pattern Recognition Receptors | PRRs) با شروع واکنشهای سلولی پاسخ ایمنی همراه است.
گیرنده های شناسایی کننده الگو
گیرندههای شناساییکننده الگو، مولکولهایی را شناسایی میکنند که به طور طبیعی در مایعات یا سلولهای بدن وجود ندارد. «گیرندههای تول-لایک» (Toll‐like Receptors | TLRs)، «گیرندههای لکتین سی» (C‐type Lectin Receptors| CTLRs)، «گیرندههای نود-لایک» (NOD‐like Receptors | NLRs)، «گیرندههای RIG-I-لایک» (RIG‐I‐like Receptors | RLRs) انواع گیرندههای شناییکننده الگو هستند که با فعال کردن مکانیسمهای سلولی متفاوت، در ایجاد پاسخ ایمنی شرکت میکنند.
گیرندههای شناساییکننده الگو علاوه بر نوع مولکول PAMPs (باکتریایی، ویروسی، قارچی یا انگلی) محل قرارگیری این مولکول (خارج سلولی،درونسلولی، اندوزومی، غشایی یا هستهای) را تشخیص میدهند. برای مثال گیرندههای گیرندههای RIG-I-لایک فقط به RNA دورشتهای ویروس در ستوپلاسم سلول میزبان متصل میشوند. این گیرندهها پس از اتصال به PAMPs با فعال کردن یکی از مکانیسمهای زیر به از بین بردن پاتوژنها کمک میکنند.
- لیز شدن سلول
- اپسونیزاسیون و افزایش فاگوسیتوز
- فاگوسیتوز پاتوژن
- افزایش فعالیت فاگوسیتوزی سلول ایمنی
- ترشح پروتئینهای ضدمیکروبی
- ترشح سایتوکاینها و کموکاین
- تمایز سلولهای عملکننده به سلولهای فعالتر
گیرنده های TLR
گیرندههای TLR، گیرندههای اصلی در سیستم ایمنی ذاتی هستند که در غشای پلاسمایی، اندوزومی و لیزوزومی سلولهای ایمنی قرار دارند. ۱۳ گروه TLR در انسان بیان میشوند که دومین خارج سلولی همه آنها از توالیهای تکراری لوسینی تشکیل شده است. این ساختار نعلی همودیمر (TLR3/3) یا هترودیمر (TLR1/3)، محل اتصال PAMPs و DAMPs است. هر یک از این گیرندهها به گروه خاصی از مولکولهای قارچی، انگلی، ویروسی یا باکتریایی متصل میشوند.
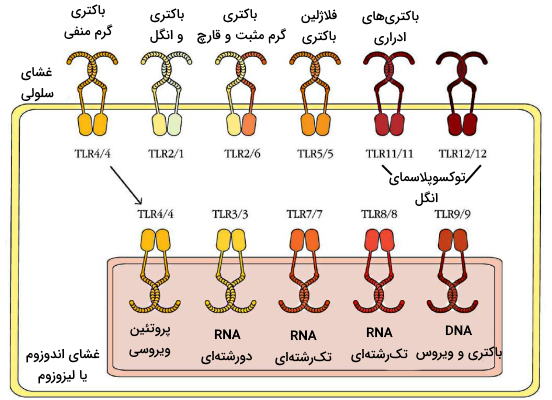
اتصال این گیرندهها به مولکولهای PAMPs از دو مسیر سلولی واکنشهای آنزیمی سلول و بیان پروتئینها را تغییر میدهد.
- مسیر وابسته به پروتئین MyD88: پروتئین MyD88 با فعال کردن مسیرهای مولکولی MAP کیناز و NF-kB به انتقال پیام در تمام گیرندههای TLR غشایی و تعدادی از گیرندههای اندوزومی کمک میکند. این مسیر رونویسی و بیان پروتئینهای ضدمیکروبی و فاکتورهای پیشالتهابی را تحریک میکند.
- مسیر وابسته به پروتئین TRIF: پروتئین TRIF به انتقال پیام در گیرندههای اندوزومی TLR4 و TLR3 کمک میکند. این مسیر در پاسخ به اتصال گیرنده-RNA دورشتهای ویروس فعال میشود و بیان ژن اینترفرونهای آلفا و گاما را تحریک میکند.
گیرنده لکتین نوع C
گیرنده لکتین نوع C گروه دوم گیرندههای شناساییکننده الگو هستند که با اتصال به PAMPs پاسخ التهابی ایمنی ذاتی را فعال میکنند. این گیرندهها در غشای پلاسمایی نوتروفیلها، ماکروفاژها، سلولهای دندریتی، لنفوسیتB و لنفوسیت T قرار دارد. این گیرندهها کربوهیدرات غشای قارچ، مایکوباکتری، ویروس، انگل و بعضی آلرژنها (بادام زمینی) متصل متصل میشوند. ۱۵ نوع CLRs در بدن انسان بیان میشود که زیرواحدهای مانوز، فروکتوز و گلایکان در غشای پاتوژنها را شناسایی میکنند. اتصال آنتیژن به این گیرندهها با دیمر شدن گیرنده و فعال شدن تیروزین کیناز آن همراه است. تیروزین کیناز با فعال کردن فسفولیپاز C و افزایش یون کلسیم سیتوپلاسم، فاکتورهای رونویسی ژنهای سایتوکاسنهای پیشالتهابی ازجمله IL3 و TNF را فعال میکند.
گیرنده های NOD-Like
گیرندههای NOD-Like یا NLR خانواده بزرگی از گیرندههای سیتوزولی هستند که به PAMPs داخل سلولی (اسیدنوکلئیک یا گلایکانهای دیواره سلولی باکتری) و ترکیبات آزاد شده از سلولهای آسیبدیده (DAMPs) پاسخ میدهند. ۲۳ ژن NLR در ژنوم انسان وجود دراد که بر اساس ساختار دومین به سه گروه اصلی تقسیم میشوند.
- NLRC: این گیرندهها دومین فراخوانی کاسپاز (آنزیم آپوپتوزی) دارند.
- NLRB: در دومین این گیرندهها از توالی تکراری مهار ویروس باکولو وجود دارد.
- NLRP: این گیرندهها دومین اتصالی به پیرین دارند.
گیرنده های RLR
گیرندههای RLR انواعی از گیرندههای شناساییکننده الگو هستند که در غشای اندوزومهای سیتوپلاسمی قرار دارد و RNA دورشتهای ویروس را شناسایی میکنند. این گیرندهها با فعال کردن کینازهای سیتوزولی و فسفوریلاسیون متوالی پروتئینهای تنظیمی، فاکتورهای رونویسی اینترفرونها (NF-kB، IRF3 و IRF7) را فعال میکنند. در نتیجه بیان اینترفرونها و القای مسیرهای وابسته به آنها افزایش مییابد.
سلول های ایمنی ذاتی
سلولهای ایمنی ذاتی گروه متنوعی از گلبولهای سفید یا لوکوسیتهای خون هستند که از میتوز و تمایز سلولهای بنیادی مشترک در مغز استخوان به وجود میآیند. ماکروفاژها (مونوسیتهای بافتی)، ماستسلها، سلولهای دندریتی، نوتروفیلها، بازوفیلها و ائوزینوفیلها انواع گلبولهای سفید دفاع اختصاصی هستند که از سلولهای میلوسیدی اجدادی به وجود میآیند. همه این سلولها درجات مختلفی از فعالیت فاگوسیتی دارند و پاتوژنها بهوسیله گیرندههای غشایی یا اندوزومی (وزیکولهای سیتوپلاسمی) شناساگر الگو شناسایی میکنند. سلولهای ایمنی ذاتی را میتوان در سه گروه ماستسل و ماکروفاژ، گرانولوسیتها و سلولهای دندریتی بررسی کرد.
ماست سل و ماکروفاژ
ماستسل و ماکروفاژ، سلولهایی ایمنی مستقر در بافت و اولین سلولهایی هستند که با پاتوژن برخورد میکنند. این سلولها با ترشح مولکولهای سایتوکاین، کموکاین و مولکولهای محلول دیگر (ازجمله آمینهای فعال رگ و لیپیدها) بهوسیله اثر بر اندوتلیوم مویرگ محل عفونت و فراخوانی لوکوسیتهای بیشتر، شدت پاسخ ایمنی به پاتوژن را افزایش میدهند.
- ماستسل: نقش اصلی این گلبولهای سفید افزایش قطر و نفوذپذیری مویرگ کجا عفونت بهوسیله ترشح هیستامین است. تعداد این سلولها در بافتهای زیری پوست، نزدیک مویرگهای خونی، رگهای لنفاوی و اعصاب اندامها، ریه و روده بسیار زیاد است و با ترشح مولکولهای مختلف پاسخ التهابی دفاع غیراختصاصی را شروع میکنند. به علاوه این گلبولهای سفید نقش اصلی در ایجاد واکنشهای حساسیت (آلرژی) دارند.
- ماکروفاژ: این گلبولهای سفید مونوسیتهایی هستند که از خون خارج شده و آلوئولهای ریه، کبدی (سلولهای کوپر)، کلیه (سلولهای مزانشیال)، بافت عصبی مرکزی (میکروگلیا)، استخوان (استئوکلاست) و طحال تمایز مییابند.
گرانولوسیت ها
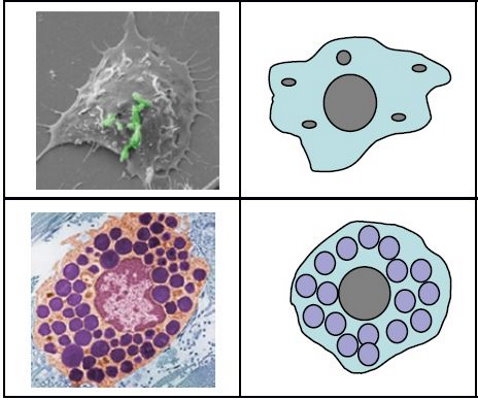
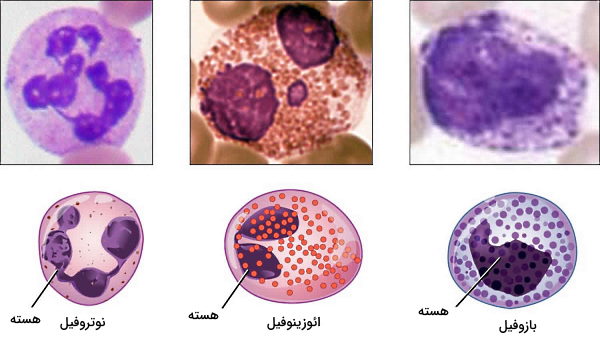
گرانولوسیتها گروهی از گلبولهای سفید هستند که به دلیل وزیکولهای ذخیرهای زیاد، سیتوپلاسم آنها در رنگآمیزیهای سلولی دانهدار دیدیه میشود. به همین دلیل گرانولوسیت (دانهدار) نام دارند. نوتروفیل، بازوفیل و ائوزینوفیل گرانولوسیتهای سیستم ایمنی ذاتی بدن هستند که برخلاف ماکروفاژ و ماستسل در خون قرار دارند، اما پس دریافت سیگنال ورود پاتوژن از مویرگ خارج میشوند. به همین دلیل وجود گرانولوسیتها در بافت نشانه قطعی وجود عفونت در بدن است. این سلولها نیمه عمر کوتاهی (بین یک تا دو روز) دارند.
- نوتروفیل: نوتروفیلها فراوانترین گلبولهای سفید خون و اولین سلولهای ایمنی هستند که با سیگنال حضور پاتوژن از مویرگ خارج میشوند. هسته این سلولها از چند لوب تشکیل شده که بهوسیله رشتههای کروماتینی به هم متصل میشوند. به همین دلیل به انها سلولهای هسته چندشکلی یا پلیمورفو نوکلیئر (Polymorphonuclear | PMNs) گفته میشود. این سلولها فعالیت فاگوسیتوزی زیادی دارند و با فاگوسیتوز باکتریها و مخمرها در ایمنی ذاتی بدن شرکت میکنند.
- بازوفیل و ائوزینوفیل: این گلبولهای سفید با ترشح گرانولها سیتوپلاسمی حاوی هیستامین، آنزیمهای هیدرولیز دیانای(DNAase)، لیپپازها، پروکسیدازها، پروتئازها و پروتئینهای آنتیباکتریال کوتیکول خارجی کرمهای انگلی را از بین میبرند. از آنجا که این پاتوژنها چندسلولی و بزرگ هستند، امکان فاگوسیتوز آنها وجود ندارد. به همین دلیل بدن از مکانیسم بمباران آنزیمی یا «رهایش گرانولها» (Degranulation) برای از بین بردن آنها استفاده میکند. به علاوه این سلولهای ایمنی ذاتی با ترشح سایتوکاینها ازجمله IL-4 نقش مهمی در شروع دفاع اختصاصی بدن دارند.
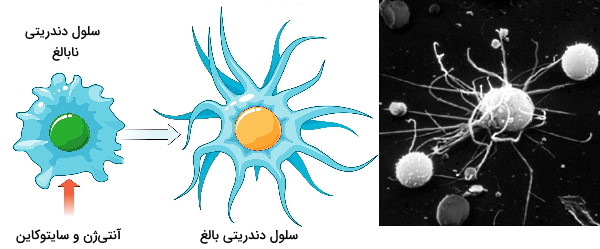
سلول های دندریتی
سلولهای دندریتی از اولین سلولهای ایمنی کشف شده هستند. وجود زائدههای سیتوپلاسمی فراوان (شبیه دندریت نورونهای عصبی) مهمترین تفاوت مورفولوژی این سلولها با سایر گلبولهای سفید است. با وجود اینکه بیشتر سلولهای دندریتی مثل ماکروفاژها در بافت مستقر هستند، وظیفه اصلی انها فاگوسیتوز میکروبها نیست.
این سلولها با پینوسیتوز و فاگوسیتوز مواد ماتریکس خارج سلولی، در حفظ هومئوستازی این بخش بافت نقش دارند. اتصال گیرنده-آنتیژن (PRR-PAMP) در این سلولها با فعال شدن مکانیسمهای بالغ شدن سلول دندریتی و تبدیل شدن آن از یک فاگوسیت فعال به سلول ارائهدهنده آنتیژن همراه است. این سلولها یکی دیگر از پلهای ارتباطی ایمنی ذاتی و اکتسابی بدن هستند.
لنفوسیت های ایمنی ذاتی
«سلولهای کشنده طبیعی» (Natural killer cells | NKCs) تنها لنفوسیتهایی هستند که در ایمنی ذاتی شرکت میکنند. گیرنده این سلولها (CD16) با لنفوسیتهای B و T متفاوت است و مولکولهای MHC غشای پلاسمایی سلولهای غیرخودی را شناسایی میکند. سلولهای کشنده طبیعی برخلاف لنفوسیتهای ایمنی اکتسابی که به چند روز زمان برای تکثیر و فعال شدن نیاز دارند، سلولهای کشنده طبیعی بلافاصله پس از مواجه با سلول هدف فعال میشوند. سلولهای کشنده پس از برهم کنش با MHC سطح سلولهای آلوده به ویروس، توموری یا آسیبدیده با آزاد کردن پرفورین و گرانزیم این سلولها را از بین میبرند.
اتصال اینترفرون آلفا به گیرندههای NKCs فعالیت این سلولها را افزایش میدهد. این لنفوسیتها علاوه بر از بین بردن پاتوژنها، با ترشح سایتوکاینهای پیشالتهابی و در فعال شدن ماکروفاژها و لنفوسیتهای ایمنی اکتسابی نقش دارند. به طور کلی این سلولها وظیفه دفاع از بدن در برابر ویروسها را تا زمانی که لنفوسیتهای B و T آماده ایجاد پاسخ ایمنی شوند، بر عهده دارند.
واکنش های عمومی ایمنی ذاتی
واکنشهای عمومی ایمنی ذاتی مجموعهای از مکانیسمهای غیراختصاصی است که برای دفاع از بدن در برابر میکروبها طراحی شده است. این مکانیسمها دومین خط دفاعی بدن انسان را تشکیل میدهند و با همکاری سلولها و مولکولهای ایمنی انجام میشود. پاسخ التهابی، سیستم کمپلمان (پروتئینهای مکمل) و فاگوسیتوز سه مکانیسم اصلی هستند که پاتوژنها را از بین میبرند.
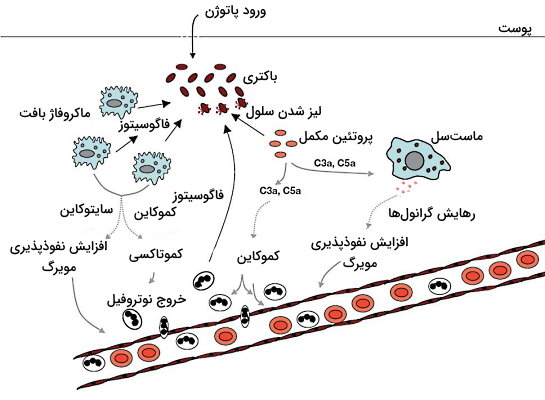
پاسخ التهابی
التهاب موضعی مجموعهای از واکنشهای متوالی است که به از بین رفتن پاتوژن، تورم (ادم)، قرمز شدن (به دلیل افزایش جریان خون به بافت)، درد و گرما در بافت عفونی یا آسیبدیده همراه است. با ورود پاتوژن به بدن یا آزاد شدن باقیماندههای سلولی حاصل از نکروز بافتی و اتصال آنها به گیرندههای شناسایی الگو در غشای ماستسلها و ماکروفاژهای مستقر در بافت، این گلبولهای سفید فعال میشود. هیستامین ترشح شده از ماستسلهای فعال به گیرندههای سلولی اندوتلیال مویرگ متصل میشوند و با افزایش فاصله بینسلولی در این بافت شرایط لازم برای خروج پلاسما (دلیل ادم) و لوکوسیتها از خون را فراهم میکنند. به علاوه اتصال این مولکول به انتهای اعصاب بافت عفونی یا آسیبدیده دلیل ایجاد درد در واکنشهای التهابی است.
IL1 و ترشح شده از ماکروفاژهای فعال بیان پروتئینهای غشایی سلکتین P و E در سلولهای اندوتلیال را افزایش میدهد. این پروتئینها با لیگاند کربوهیدراتی در غشای نوتروفیلها خون برهمکنش و سرعت حرکت آنها در خون را کاهش میدهند. کموکاینهای ترشح شده از این سلولها یا پروتئینهای مکمل به کموتاکسی نوتروفیلها و عبور آنها از مویرگ کمک میکند. اتصال کموکاین-گیرنده در غشای نوتروفیل با تغییر کونفورماسیون اینتگرینها (پروتئینهای چسبنده سلولی) و برهمکنش محکمتر این مولکولها با سلکتینهای غشای اندوتلیال همراه است. در نتیجه با تغییر اسکلت سلولی و کاهش قطر نوتروفیل از فاصله بین سلولهای اندوتلیال عبور کرده و وارد بافت میشود.
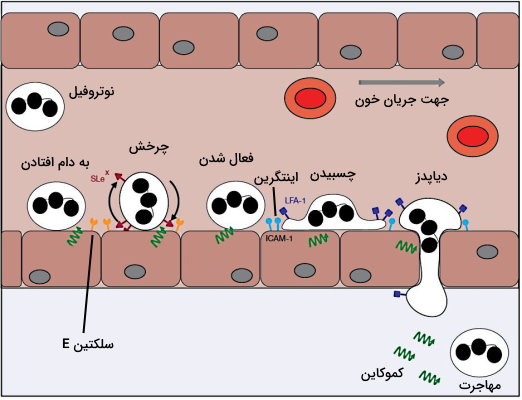
مونوسیتها با استفاده از مکانیسم مشابه نوتروفیل به محل عفونت میرسند و پس از عبور از اندوتلیال مویرگ به ماکروفاژ تمایز مییابند. اما این فرایند ۶ تا ۸ ساعت پس از خروج نوتروفیلها و در اثر ترشح پروتئین کموتاکتیک مونوسیت-۱ (Monocyte Chemotactic Protein‐1 | MCP‐1) انجام میشود. این سلولها با فاگوسیتوز بقایای نوتروفیل، میکروبها و سلولهای آسیب دیده بدن، فرایند ترمیم زخم را شروع میکنند.
تنظیم پاسخ التهابی
پاسخ التهابی یکی از مکانیسمهای مهم ایمنی ذاتی برای حذف پاتوژنها است. اما اگر بهدرستی تنظیم نشود، به بافتهای سالم بدن آسیب میرساند. به همین دلیل دو دسته مکانیسمهای فیدبک مثبت و منفی القا، مدت زمان و نوع این مکانیسم را کنترل میکنند.
- مکانیسمهای تنظیمی مثبت: این مکانیسمها با افزایش بیان گیرندههای شناساییکننده الگو، حساسیت سیستم سلولهای ایمنی به سایتوکاینها و پاسخ التهابی ایمنی ذاتی را افزایش میدهند.
- مکانیسمهای تنظیمی منفی: در این مکانیسمها پروتئینهای مهاری واکنشهای آنزیمی درونسلولی پس از اتصال آنتیژن به گیرندههای شناساییکننده الگو را فعال میکنند. به علاوه اینترلوکین-۱-بتا و TNF دو سایتوکاینی هستند که بیان گیرندههای یا پروتئینهای شبه گیرندهای را القا میکنند که پس از اتصال به این مولکولها، اثر آنها در واکنشهای التهابی را مهار میکند. همچنین IL10 که در پاسخ به PAMPs از ماکروفاژ ترشح میشود، ترشح و اثر التهابی سایتوکاینها را مهار میکند.
سیستم کمپلمان
سیستم کمپلیان یا پروتئینهای مکمل ایمنی ذاتی مجموعهای (بیش از ۲۰ مولکول) از پروتئین محلول در پلاسما است که پس از برهمکنش با پلیساکاریدهای غشای باکتری فعال میشوند. تعدادی زیادی از این پروتئينها آنزیمهای پروتئاز غیرفعالی هستند که پس از برهمکنش با PAMs فعال شده و پروتئینهای مرحله بعد را فعال میکنند. پروتئینها مکمل فعال از چهار مسیر در ایمنی ذاتی بدن شرکت میکنند.
- پروتئینهای مکمل فعال به آنتیژنهای سطحی باکتری متصل میشوند (اوپسونیزاسیون). غشای پلاسمایی فاگوسیتها برای این پروتئینها گیرنده وجود دارد. به همین دلیل اوپسونیزاسیون باکتری بهوسیله پروتئینهای مکمل با احتمال شناسایی و فاگوسیتوز این پاتوژنها را افزایش میدهد.
- فعال شدن آبشاری این پروتئینها با تشکیل ساختارهای پروتئنی در غشای باکتری و لیز شدن سلول همراه است.
- برای فعال شدن پروتئازهای سیستم کمپلان بخشی از این پروتئینها هیدرولیز میشود. بخش هیدرولیز شده مثل کموکاینهای آزادشده از لوکوسیت، فراخوانی گلبولهای سفید به محل عفونت و فاگوسیتوز باکتریها را افزایش میدهد.
- پروتئینهای مکمل فعال با فعال کردن ماستسلهای بافت واکنشهای التهابی و فراخوانی نوتروفیلها به محل عفونت را افزایش میدهند.
مسیرهای سیستم کمپلمان بر اساس نوع اولین گیرندهای که آنتیژنها را شناسایی میکند به سه دسته تقسیم میشوند که در هر سه این مسیرها با فعال شدن کانورتاز و تجزیه C3 به زیرواحدهای C3a و C3b همراه است.
- مسیر کلاسیک: مسیر کلاسیک از دو روش وابسته به آنتیبادی و مستقل از آنتیبادی انجام میشود. ترتیب اتصال پروتئینهای مکمل به مولکول هدف در این مسیر است.
- در این مسیر وابسته به آنتیبادی پروتئین C1q به آنتیبادی کمپلکس آنتیژن-آنتیبادی M یا رسوبات آنتیژن-آنتیبادی G متصل میشود.
- در این روش پلیآنیونها (هپارین، پروتامین، DNA یا RNA آزاد شده از سلول آپوپتوزی)، باکتری گرم منفی یا پروتئین C فعال (اوپسونین اتصالی به فسفوکولین یا کربوهیدراتهای غشایی باکتری، قارچ یا انگل)، مستقیم به C1q متصل میشود.
- مسیر لکتین: در این روش لکتین متصل شونده به مانوز (پروتئین محلول در پلاسما) به مانوز، فروکتوز یا گروههای N-استیل آمین دیواره باکتری، مخمر یا ویروس متصل میشود. ساختار و عملکرد پروتسینهای این مسیر شبیه مسیر کلاسیم است. ترتیب اتصال پروتئینهای مکمل به مولکول هدف در این مسیر است.
- مسیر جایگزین: این مسیر با تجزیه پروتئین C3 بهوسیله یکی از ترکیبات غشای پاتوژن (دیواره سلولی باکتری و قارچ یا اندوتوکسین باکتریهای گرم منفی) یا ایمونوگلوبینهای (فاکتور کلیه یا IgA) سیستم ایمنی فعال میشود. پروپردیبن، فاکتور H و «فاکتور افزایشدهنده تخریب» (Decay-accelerating Factor | CD55) تنظیم میشود. C3b، فاکتور B و C3 ترتیب اتصال پروتئینهای مکمل به مولکول هدف در این مسیر است.
لیز شدن پاتوژن
پروتئینهای C1-C5 در مکانیسمهای ایمنی ذاتی شرکت میکنند. C3 یکی از پروتئازهای این مسیر است که پیوند تیواستری ساختار آن در شرایط طبیعی بدن در یک واکنش آهسته و خودبهخودی با مولکولهای آب یا پروتئازهای ضغیف پلاسما تجزیه و مولکول C3i یا C3(OH) تشکیل میشود میشود. این مولکول در حضوز یون منیزیم با فاکتور B (پروتئین دیگر سیستم کمپلمان) برهمکنش میدهد. در ادامه فاکتور D (پروتئاز محلول در پلاسما ) با تجزیه این کمپلس، آنزیم C3bBb را به وجود میآورد. این آنزیم کانورتازی است که تجزیه C3 به C3a و C3b را کاتالیز میکند. این آنزیم به کربوهیدراتهای غشای بسیاری از باکتریها متصل شده و غلظت C3b خون پس از عفونت را افزایش میدهد.
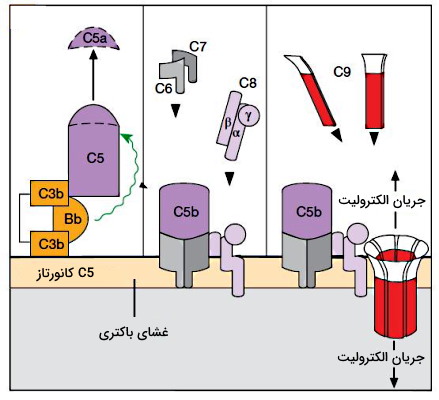
C3b کانورتاز C5 را فعال و پروتئين C5 را به دو زیرواحد C5a و C5b تبدیل میکند. زیرواحد C5b به C3b (در غشای باکتری) متصل باقیمیماند. اتصال متوالی پروتئینهای C6 و C7 به C5b کمپلکس پروتئینی تشکیل میدهد که از عرض غشای باکتری عبور میکند. C8 پروتئین بعدی این آبشار است که زنجیره بتای آن به C7 متصل شده و زنجیره آلفای آن با ایجاد تغییر در کنفورماسیون، پروتئین C9 را به مولکولی آمفوتر تبدیل میکند. در نتیجه زیرواحدهای C9 از غشای دولایه باکتری عبور کرده و کانالی نفوذپذیر به الکترولیتها تشکیل میدهند. عبور یونهای سدیم از این کانال با تغییر فشار اسمزی سیتوپلاسم باکتری و لیز شدن این سلول همراه است.
افزایش فاگوسیتوز و التهاب
زیرواحدهای C3a، C4a و C5a آزاد شده از فعالیت کانورتازها، «توکسینهای آنافیلاکسی» (Anaphylatoxins) یا پیشدفاعی هستند که اتصال آنها به گیرندههای G پروتئینی در غشای فاگوسیتها به ویژه نوتروفیل، مسیر تولید رادیکالهای آزاد اکسیژن و بیان گیرندههای C3b در این سلولها را افزایش میدهند. به علاوه این پروتئینها کموکاینهایی هستند که ترشح گرانولهای ماستسل و بازوفیلها را تحریک میکنند. پروتئین C3a کموکاین ویژه ائوزینوفیل و پروتئین C5a کوکاین ویژه نوتروفیل است که کموتاکسی که لوکوسیتها را تحریک میکنند. به علاوه C5a با اثر مستقیم بر سلولهای اندوتلیال، نفوذپذیری و قطر مویرگهای بافت عفونی را افزایش میدهد.
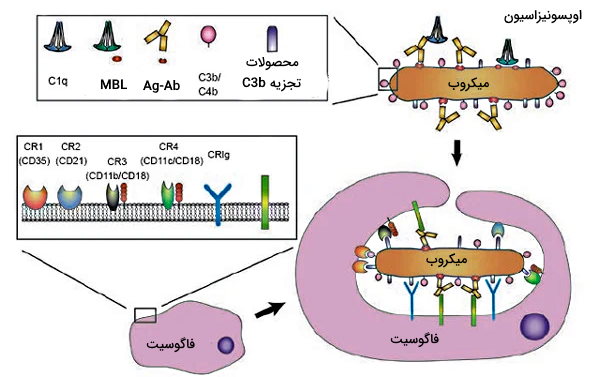
اوپسونیزاسیون
تشکیل C3b در هر سه مسیر سیستم کمپلمان پاتوژنها را برای شناسایی گیرندههای مکمل ۱ تا ۴ (CR1-4) در غشای فاگوسیتها (به ویزه نوتروفیل و ماکروفاژ) نشانهدار میکند.
فاگوسیتوز
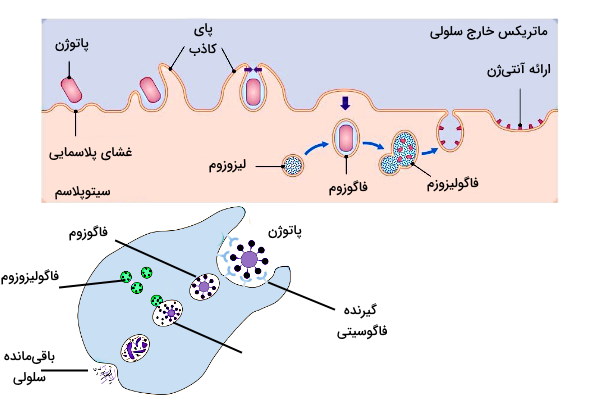
نوتروفیل، ماکروفاژ و سلولهای دندریتی سه دسته از گلبولهای سفیدی هستند که با فاگوسیتوز میکروبها از بدن انسان دفاع میکنند. این لوکوسیتها توانایی اندوسیتوز سلولهایی با قطر بیشتر از ۰٫۵ میکرومتر را دارند. فاگوسیتوز با اتصال PAMPs به گیرندههای شناساییکننده الگو و سایتوکاینها به گیرندههای اوپسونیزاسیون شروع میشود. گیرندههای لکتین تایپ C و «گیرندههای اسکونجر» (Scavenger Receptors) انواع گیرنده فاگوسیتی شناساییکننده الگو هستند که به آنتیژنهای سطحی سلول متصل میشوند. گیرندههای دومین کلاژن، پروتئینهای مکمل و Fc ایمونوگلوبین از انواع گیرنده اوپسونیزاسیون هستند که به آنتیژنهای محلول متصل میشوند. CD32 و CD16 دو گیرنده غشایی فاگوسیتوزی فراوان در غشای لوکوسیتها و از نوع هستند که مسیر انفجار اکسیژن را فعال میکنند.
اتصال آنتیژن-گیرنده در فاگوسیتها با بازآرایی اکتینها، تغییر ساختار اسکلت سلولی و تشکیل پاهای کاذب همراه است. پای کاذب ذره خارجی را کامل در بر میگیرد و ذره بهوسیله فاگوزوم (وزیکول فاگوسیتوزی با pH اسیدی) وارد سیتوپلاسم میشود. فاگوزوم در سیتوپلاسم با لیزوزوم ادغام شده و فاگولیزوزوم تشکیل میدهد. pH این وزیکول از فاگوزوم کمتر (۴٫۵-۵) و حاوی آنزیمهای هیدرولازی اندامک لیزوزوم است. پاتوژن فاگوسیتوز شده از دو مسیر تجزیه میشود.
- مسیر وابسته به اکسیژن: مسیرهای وابسته به اکسیژن یا انفجار اکسیژنی با تولید رادیکالهای فعال اکسیژن (ROS) ازجمله رادیکالهای سوپراکسیداز () و هیدروژن پراکسیداز () ساختارهای سلولی پاتوژن را از بین میبرد. در ساختار این رادیکالها الکترون جفتنشدهای وجود دارد که پس از برهمکنش با مولکولهای زیستی پاتوژن (پروتئینها، لیپیدها و اسیدهای نوکلئوئیک) کنفورماسیون این مولکولها و ساختارهای غشایی میکروب را به هم میریزد. رادیکالهای سوپراکسید بهوسیله واکنشهای آنزیمی NDPH اکسیداز تشکیل میشوند و آنزیم سوپراکسید دسموتاز آنها را به هیدروژن پروکسیداز تبدیل میکند.
- مسیر مستقل از اکسیژن: در این مسیر آنزیمهای هیدرولازی لیزوزوم ازجمله پروتئازها، فسفولیپازها، نوکلئازها و لیزوزیم (هیدرولاز پپتیدوگلایکان دیواره سلولی باکتری) با تجزیه ساختارهای سلولی مهم، باکتری را از بین میبرند.
فاگوسیتوز در سلولهای ارائهکننده آنتیژن مثل نوتروفیل متفاوت است. در این سلولها تمام ساختارهای باکتری به جز مولکول آنتیژن در فاگولیزوزوم از بین میرود. در این سلولها آنتیژن همراه مولکولهای سازگاری بافت یا MHCها در غشای سلولی فاگوسیت قرار میگرد تا شناسایی آن بهوسیله لنفوسیتهای دفاع اکتسابی راحتتر انجام شود.
پاتوژن ها چگونه از سیستم ایمنی ذاتی فرار می کنند؟
بسیاری از پاتوژنها مکانیسمهایی برای فرار یا مهار پاسخ ایمنی ذاتی دارند. بسیاری از باکتریها، قارچها و ویروسها با سرعت زیادی تقسیم میشوند و گونههای جهشیافتهای ایجاد میکنند که سیستم ایمنی قادر به شناسایی آنها نیست. فرار از گیرندههای شناسایی الگو، مهار مسیرهای سلولی گیرندههای شناسایی الگو و فرار از فاکتورهای مهار تقسیم سلولی، سه مکانیسم اصلی پاتوژنها برای فرار از سیستم ایمنی ذاتی است.
- فرار از گیرندههای شناسایی الگو: جهش ژنتیکی در آنتیژنهای پروتئینی و تولید پروتئینهای مهاری گیرندهها دو مکانیسمی است که برای فرار از گیرندههای شناساییکننده الگو به کار گرفته میشود.
- جهش در ژن فلاژلین پروتئوباکتریا از شناسایی این پروتئین بهوسیله TLR جلوگیری میکند.
- TLR4 نمیتواند LPS تغییریافته در دیواره سلولی باکتریهای کوآکسیلا، هلیکوباکتر و لژیونلا را شناسایی کند.
- پروتئین p30 ویروس HIV-1 رونویسی و بیان ژن TLR4 را مهار میکند.
- پروتئین محافظتی در ویروسهای ابولا، آنفولانزا و واسینیا با اتصال به RNA دورشتهای ویروس از شناسایی آن بهوسیله گیرندهها جلوگیری میکند.
- مهار مسیرهای سلولی گیرندههای شناسایی الگو: بیان پروتئینهای مختلف در ویروسها و باکتریها با مهار فاکتورهای رونویسی سلول، بیان سایتوکاینها و اینترفرونها را مهار میکند.
- فرار از فاکتورهای مهار تقسیم سلولی: در این روش پاتوژنها از مکانیسمهایی استفاده میکنند که فاگوسیتوز را مهار میکند.
- باکتری لیستریا با بهمریختن غشای فاگوزوم وارد سیتوزول میشود.
- مایکوباکتریوم توبرکلوزیس ادغام فاگوزوم با لیزوزوم را مهار میکند.
- مایکوباکتریوم توبرکلوزیس و استافیلوکوکوس اورئوس با تولید پروتئینهای محافظتی، اثر رادیکالهای آزاد اکسیژن و نیتروژن را مهار میکنند.
- ویروس واسینا پروتئین با تولید پروتئین همولوگ اینترفرون از اتصال این مولکولها به گیرنده جلوگیری میکند.
- ویروس هرپس و آبله مرغان با تولید پروتئین همولوگ اینترلوکین ۱۰، التهاب موضعی و فعال شدن لنفوسیتهای T را مهار میکند.
ایمنی ذاتی گیاهان
برخلاف ایمنی اکتسابی، ایمنی ذاتی ریشه تکاملی مشترک دارد و تقریبا در تمام پرسلولیها به محافظت در برابر عوامل بیماریزا کمک میکند. برای مثال تمام بعضی از گونههای قارچ و تمام گونههای گیاهی و جانوری پروتئینهای ضدمیکروبی شبیه دیفنسین وجود دارد. گیرندههای شناساییکننده توالی لوسین (LRPs) در بسیاری و گیرندههای شناساییکننده در بعضی از خانوادههای موجودات پرسلولی وجود دارد.
باکتریها، ویروسها و قارچها میتوانند از پوسته محکم، لایه کوتیکولی و دیواره سلولی گیاهان عبور کنند. اما سلولهای ایمنی در گیاهان وجود ندارند تا با فاگوسیتوز یا لیز کردن پاتوژن از بیمار شدن این موجودات جلوگیری کنند و ایمنی ذاتی تنها راه دفاع آنها است. گیرندههای شناساییکننده توالی لوسین در غشای پلاسمایی سلولهای گیاهی، الگو مولکولی همراه میکروبها ازجمله فلاژین باکتریها، فاکتور رونویسی طویل شدن پروتئین باکتری و مولکولهای مختلف دیواره سلولی باکتری و قارچی را شناسایی میکند. به علاوه گیرندههای شناساییکننده الگو در این سلولها، مولکولهای باقیماندههای از تخریب دیواره سلولی گیاهی را شناسایی میکنند.

اگر پاتوژن یا آنتیژن آن از دیواره سلولی عبور کرده و وارد سیتوپلاسم شود، پروتئینهای R که همتای پروتئینهای NLR در سلو.لهای جانوری است، به پاتوژن متصل میشوند. این اتصال با فعال شدن مسیر پیامرسانی و فاکتورهای رونویسی ایمنی ذاتی همراه است.
- اولین مکانیسم ایمنی ذاتی در گیاهان تولید رادیکالهای آزاد اکسیژن، ترکیبات نیتروژنی، افزایش pH داخلی، القای پروتئینهای ضدمیکروبی ازجمله دیفنسین و آنزیمهای تجزیه دیواره سلولی باکتری (بی-۱،۳،گلوکاناز) و قارچ (کیتیناز) است.
- تولید مولکولهای آلی ازجمله آنتیبیوتیک فیتوآلکسین یکی دیگر از مکانیسمهای دفاع ذاتی گیاهان است.
- تغییر ساختارهای گیاهی مکانیسم دیگر ایمنی ذاتی گیاهان است. برای مثال در عفونتهای برگ، سلولهای نگهبان با بستن روزنهها از ورود میکروبهای بیشتر جلوگیری میکنند. به علاوه افزایش ضخامت دیواره سلولی با جدا کردن سلول آلوده از انتشار آلودگی جلوگیری میکند.
جمع بندی
در این مطلب توضیح دادیم که ایمنی ذاتی بخشی از سیستم دفاعی بدن است که با واکنشهای غیراختصاصی از بدن محافظت میکند. این سیستم ایمنی از سدهای فیزیکی، شیمیایی، فیزیولوژیک و پاسخهای سلولی تشکیل میشود. همچنین توضیح دادیم که مولکولهای شیمیایی ترشح شده در این سیستم ایمنی در فعال کردن ایمنی اکتسابی نقش دارند.