یون چیست؟ + توضیح نحوه تشکیل به زبان ساده
در جدول تناوبی تنها گازهای نجیب هستند که در لایه ظرفیت خود ۸ الکترون دارند. سایر عناصر برای اینکه الکترونهای ظرفیت خود را به این تعداد برسانند ناچار هستند الکترون از دست بدهند یا دریافت کنند. در حالت اولی بار ذره مثبت و در حالت دومی بار ذره منفی میشود. یونهای با بار مثبت را «کاتیون» و یونهای با بار منفی را «آنیون» مینامند. یونها اساس بسیاری از واکنشهای شیمیایی هستند که در زمینههای مختلفی کاربرد دارند به عنوان مثال یون آهن، سدیم و کلسیم برای سلامتی انسان بسیار ضروری هستند. به عبارتی میتوان یونها را الفبای شیمی در نظر گرفت که برای ورود به دنیای شیمی باید با آنها آشنایی کامل داشته باشیم. در پایان این مطلب یاد میگیریم که یون چیست و چگونه تشکیل میشود، همچنین با انواع یونها و ویژگیهای ترکیبات یونی که از کنار هم قرار گرفتن کاتیون و آنیون به وجود میآیند آشنا میشویم.
- یاد میگیرید تعریف یون و تفاوت آن با اتم را توضیح دهید.
- میآموزید چگونه یونها با تبادل الکترون پایدار میشوند.
- نمونههای انواع یون از جمله تکاتمی، چنداتمی، آلی و چندظرفیتی را تشخیص میدهید.
- مراحل تشکیل ترکیبات یونی و سازوکار شبکه بلوری را یاد خواهید گرفت.
- اصول فرمولنویسی و نامگذاری ترکیبات یونی را یاد میگیرید.
- نقش و کاربردهای یونها در زندگی روزمره و فناوری را خواهید شناخت.

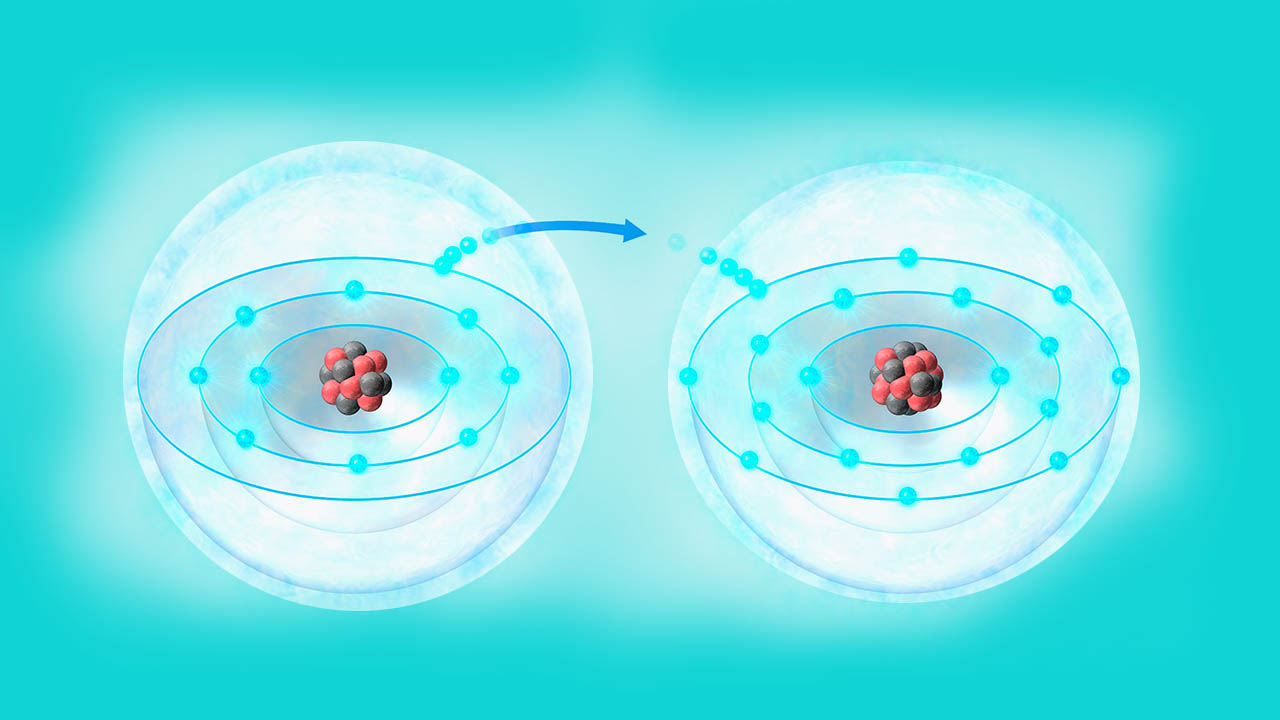
یون چیست ؟
واژه «یون» میتواند برای اتمها یا مولکولهایی به کار برود که بار خالص آنها صفر نیست به عبارتی از لحاظ بار الکتریکی خنثی نیستند. بنابراین در ساختار مولکولی/ اتمی همه یونها دو حالت وجود دارد:
- تعداد پروتونهای داخل هسته از تعداد الکترونهای اطراف آن بیشتر است. در این حالت بار خالص یون مثبت خواهد بود که کاتیون نامیده میشود.
- تعداد الکترونها از تعداد پروتونها بیشتر است. در این حالت بار خالص یون منفی بوده و آنیون نام دارد.
دلیل تشکیل یون به این خاطر است که اتمها تمایل دارند به حالت پایدار برسند. حالت پایدار یعنی تعداد الکترونهای ظرفیت عناصر در لایه ظرفیت آنها برابر ۸ باشد که تنها آرایش الکترونی عناصر گروه ۱۸ یعنی گازهای نجیب یا بیاثر پایدار به این گونه است. از آنجا که بقیه عناصر در لایه ظرفیت خود الکترونهایی کمتر یا بیشتر از این مقدار را دارند بنابراین طبق قانون اکتت برای رسیدن به آرایش الکترونی پایدار الکترون از دست میدهند یا دریافت میکنند و به این صورت یون به وجود میآید.
نیروهای جاذبه الکترواستاتیکی که در بین کاتیون و آنیونها وجود دارند نیروی محرکهای برای ایجاد پیوند یونی به منظور تشکیل ترکیب یونی به شمار میروند. اگر یون (کاتیون و آنیون) تنها از یک نوع اتم تشکیل شده باشد، یون تک اتمی و در صورتیکه دارای دو یا چند نوع اتم باشد یون مورد نظر، چند اتمی یا یون مولکولی خواهد بود.
تفاوت اتم و یون چیست ؟
همانطور که در قسمت قبلی اشاره کردیم بار الکتریکی یونها خنثی نبوده، به عبارتی بار یون با توجه به بیشتر بودن تعداد پروتون نسبت به الکترون یا بالعکس به دو صورت مثبت (کاتیون) و منفی (آنیون) تقسیمبندی میشود. اما در اتم به دلیل برابری تعداد الکترون و پروتون بار خالص آن صفر خواهد بود یعنی اتم از لحاظ الکتریکی خنثی است. یونها به دلیل رسیدن به آرایش الکترونی پایدار در مقایسه با اتمهایشان واکنشپذیری کمتری دارند.
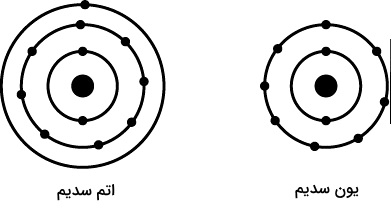
برای اینکه بهتر درک کنید یون چیست و چه تفاوتی با اتم دارد در ادامه مهمترین تفاوتهای اتم و یون به صورت خلاصه در جدول زیر فهرست شدهاند.
| اتم | یون |
| کوچکترین واحد عنصر | تک ذره یا مجموعی از ذرات |
| جزء وابسته در محلول | جزء مستقل در محلول |
| تشکیلدهنده مولکولها | تشکیلدهنده پیوند یونی |
| الکترونها و پروتونهای برابر | الکترونها و پروتونهای نابرابر |
| ناپایدار | پایدار |
یونها چگونه تشکیل میشوند ؟
روشهای مختلفی برای تشکیل یون وجود دارد. برای مثال برخوردهای خودبخودی بین مولکولهای مایع یا گاز میتوانند منجر به جدا شدن الکترون از اتم یا مولکول شوند. در این حالت بار خالص ذره مثبت خواهد شد و الکترون آزاد به وجود میآید. این نوع از یونش معمولا به عنوان یونش فیزیکی تلقی میشود. الکترون آزاد میتواند حرکت کند که در اثر این حرکت با اتم یا مولکول دیگری ترکیب و باعث تشکیل بار جدید منفی (آنیون) شود.
روش مهم دیگری که برای نحوه تشکیل یونها میتوان به آن اشاره کرد، واکنشهای شیمیایی است. یکی از این واکنشهای شیمیایی حل شدن یک ترکیب یونی مانند نمک در حلالی مناسب (مانند آب) است. در اثر حل شدن نمک در آب، اتمهای تشکیلدهنده نمک از هم تفکیک میشوند و یونهای آزاد را به وجود میآورند. بهترین مثال برای این حالت میتواند حل شدن سدیم کلرید یا نمک طعام در آب باشد. در اثر حل شدن سدیم کلرید در آب یونهای تشکیل دهنده آن یعنی یونهای سدیم و کلر در آب دچار جدایش میشوند.
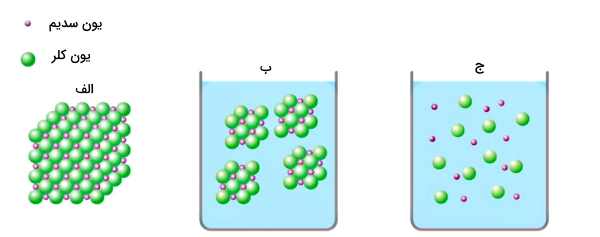
همچنین یکی دیگر از راههایی که از طریق آن یون به وجود میآید، عبور دادن جریان الکتریکی مستقیم از طریق محلولهای رسانا و انحلال آندها توسط فرایند یونش ازجمله دیگر روشهایی هستند که سبب تولید یون میشوند.
بار یون چیست ؟
در صورتی که اتم برای رسیدن به آرایش الکترونی پایدار الکترون از دست دهد بار آن مثبت و در صورتی که الکترون دریافت کند بار آن منفی خواهد بود. برای نشان دادن یون و بار آن در ابتدا باید فرمول شیمیایی یون نوشته شود. سپس مقدار یون و در نهایت علامت بار (بار برای کاتیونها و بار برای آنیونها) در بالای نماد شیمیایی یون همانند توان نوشته میشود.
به خاطر داشته باشید که مقدار بار (مقدار بار یعنی تعداد الکترونهایی که اتم از لایههای بیرونی خود از دست میدهد یا دریافت میکند) بعد از علامت بار میآید. در صورتی که اتم یک الکترون دریافت میکند یا از دست میدهد میتوان تنها علامت مثبت یا منفی را در بالای نماد شیمیایی عنصر گذاشت (مانند یا ).
انواع یون
یونها با توجه به اینکه از یک یا چند اتم تشکیل شده باشند به یون تک اتمی یا یونهای چند اتمی تقسیمبندی میشوند. همچنین یونهای مولکولی که حداقل شامل یک پیوند کربن - هیدروژن یا کربن-نیتروژن باشند یونهای آلی نام دارند. همه این یونها به دو گروه آنیون و کاتیون تبدیل میشوند. بنابراین کاتیون و آنیونها به سه دسته زیر تقسیمبندی میشوند که عبارتند از:
- یونهای تک اتمی
- یونهای چند اتمی
- یونهای آلی
- یونهای چند ظرفیتی
۱. یون های تک اتمی
یونهای تک اتمی همان عناصر جدول تناوبی بوده که برای رسیدن به آرایش هشتتایی الکترون از دست میدهند یا دریافت میکنند.
مثال هایی از کاتیون های تک اتمی
۵ مثال رایج برای کاتیونهای تک اتم عبارتند از:
- کاتیون آلومینیوم
- کاتیون کلسیم
- کاتیونهای آهن (II) و آهن (III)
- کاتیونهای منگنز ، و
- کاتیون هیدروژن که معمولا به عنوان پروتون شناخته میشود.
مثال هایی از آنیون های تک اتمی
۵ مثال رایج برای آنیونهای تک اتم به صورت زیر هستند:
- آنیون فلوئورید
- آنیون کلرید
- آنیون برمید
- آنیون یدید
- آنیون سولفید
آنیونهای فلوئورید تا یدید مربوط به یونهای هالید هستند.
2. یون های چند اتمی
یونهای چند اتمی یونهایی هستند که از ترکیب چند اتم تشکیل میشوند به همین دلیل به آنها یونهای مولکولی نیز میگویند.
مثال هایی از کاتیون های چند اتمی
ازجمله مثالهای رایج برای کاتیونهای چند اتمی می توان به کاتیون و آنیونهای زیر اشاره کرد:
- کاتیون هیدرونیوم با فرمول شیمیایی
- کاتیون آمونیوم با فرمول شیمیایی
مثال هایی از آنیون های چند اتمی
ازجمله مثالهای مهم برای آنیونهای چند اتمی عبارتند از:
- آنیون نیترات با فرمول شیمیایی
- آنیون نیتریت با فرمول شیمیایی
- آنیون هیدروکسید با فرمول شیمیایی
- آنیون کربنات با فرمول شیمیایی
- آنیون سولفات با فرمول شیمیایی
- آنیون فسفات با فرمول شیمیایی
۳. یون های آلی
یونهای آلی به یونهایی گفته میشوند که شامل حداقل یک پیوند کربن - هیدروژن یا کربن - نیتروژن هستند. در صورتیکه بار یون آلی بر روی کربن مرکزی قرار بگیرد مثبت باشد به آن «کربوکاتیون» و اگر منفی باشد به آن «کربانیون» میگویند. از جمله مثالهای رایج برای یونهای آلی میتوان به ، و (یون سیانید) اشاره کرد.
۴. یونهای چند ظرفیتی
اغلب عناصر جدول تناوبی با از دست دادن یا دریافت تعداد مشخصی الکترون به کاتیون و آنیونهایی با بار الکتریکی مشخص تبدیل میشوند. در حالیکه برخی عناصر به ویژه عناصر واسطه با توجه به اینکه از کدام لایه و چند الکترون از دست میدهند میتوانند کاتیونهایی با بارهای مختلف را به وجود بیاورند. آهن ازجمله یونهای چند ظرفیتی به شمار میرود که آرایش الکترونی آن برابر است با:
با توجه به آرایش الکترونی آهن، میتوان متوجه شد که این عنصر به دو طریق میتواند الکترون از دست دهد. حالت اول این است که دو الکترون از اوربیتال s از دست بدهد که در این صورت به کاتیون تبدیل میشود. حالت دوم حالتی است که آهن علاوه بر از دست دادن دو الکترون اوربیتال s یک الکترون از لایه d نیز از دست میدهد که کاتیون آهن در این حالت به صورت خواهد بود. این کاتیون نسبت به کاتیون پایدارتر است زیرا اوربیتال d در این حالت آرایش نیمهپایدار دارد.
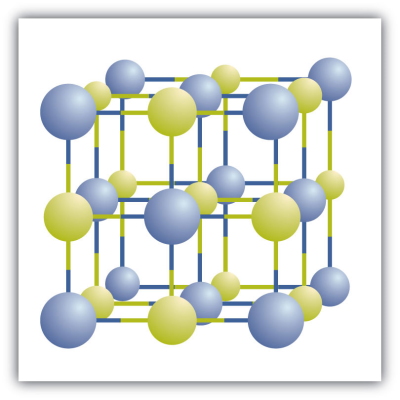
ترکیب یونی چیست ؟
ترکیب یونی ترکیبی است که در اثر در کنار هم قرار گرفتن یونهای با بار ناهمنام (کاتیون و آنیون) به وجود میآید. بین این یونهای ناهمنام نیروی جاذبه الکترواستاتیکی وجود دارد بنابراین پیوند شیمیایی یونی در این ترکیبات است که شبکههای بلوری را تشکیل میدهند. تصویر زیر یک شبکه بلوری را نشان میدهد که یونهای زرد و آبیرنگ یون هایی با بار ناهمناماند.
زمانی که یک فلز الکتروپوزیتیو با یک نافلز الکترونگاتیو ترکیب میشود به دلیل تمایل فلزات به از دست دادن الکترون، نافلزات که تمایل به دریافت الکترون دارند این الکترونها را به خود جذب میکنند. بنابراین ترکیب یونی را میتوان در یک جمله خلاصه کرد:
« در اثر کنار هم قرار گرفتن کاتیونها و آنیونها به دلیل نیروی جاذبه الکترواستاتیک شبکههای بلوری به وجود میآیند که بار الکتریکی آنها معمولا خنثی است. به این ترکیبات، ترکیبات یونی میگویند.»
رایجترین مثال برای ترکیب یونی نمک طعام یا سدیم کلرید است، در این ترکیب یونهای سدیم و کلر جذب هم میشوند. در اثر جذب یونهای ناهمنام سدیم و کلر ساختار سه بعدی یونهای سدیم و کلر همانند تصویر زیر به دست میآید.
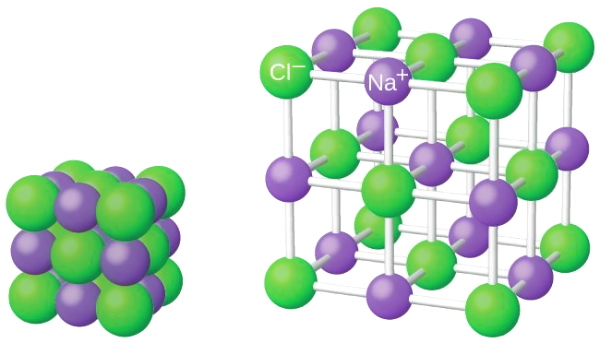
بار خالص سدیم کلرید صفر (خنثی) است زیرا تعداد یونهای سدیم با یونهای کلر برابرند. نیروهای جاذبه بین یونهای سدیم و کلر این شبکه سه بعدی را حفظ میکند.
چند نمونه ترکیب یونی
برای مثال، ترکیب میان کلر و منیزیم از نوع پیوند یونی است. بیرونیترین لایه یا همان لایه ظرفیت اتم منیزیم دو الکترون دارد. با از دست دادن دو الکترون از لایه M، لایه L بیرونیترین لایه میشود که بر اساس قانون اکتت پایدار خواهد بود. هسته اتم منیزیم۱۲ پروتون دارد و تعداد الکترونهای آن نیز در این حالت از ۱۲ به ۱۰ کاهش پیدا میکند. بنابراین بار الکتریکی این اتم ۲بار مثبت خواهد بود که کاتیون آن به صورت تعریف میشود.
از طرف دیگر اتم کلر در لایه ظرفیت خود هفت الکترون دارد بنابراین برای پر کردن اکتت خود تنها نیاز به یک الکترون دارد. کلر میتواند این یک الکترون را از الکترونهایی که منیزیم از دست میدهد دریافت کند. از آنجا که با از دست دادن دو الکترون منیزیم یک الکترون از آنها را تنها کلر دریافت میکند برای برقراری موازنه بار، دو اتم کلر با یک اتم منیزیم برای تشکیل منیزیم سولفید واکنش میدهند. سدیم فلوئورید، نقره کلرید، کلسیم کلرید، کادیم سولفید، منیزیم اکسید و مثالهایی از این قبیل مثالهایی برای ترکیب یونی هستند.
ویژگی های ترکیب یونی
به دلیل اینکه در ترکیبات یونی، یونهایی با بار ناهمنام وجود دارد اغلب آنها ویژگیهای مشابهی دارند، از جمله ویژگیهای ترکیب یونی میتوان به ویژگیهای فیزیکی و شیمیایی زیر اشاره کرد:
-
استحکام پیوند یونی
به دلیل حضور یونهای ناهمنام و جاذبه الکترواستاتیکی که بین یونهای مثبت و منفی وجود دارد ترکیبات یونی جامداتی با اتصالات یونی قوی به شمار میروند که این پیوند به راحتی شکسته نمیشوند. جامدهای بلوری معمولا زمانی شکسته میشوند که فشار بالایی بر روی آنها اعمال شود به همین دلیل اغلب آنها چکش خوارند.
-
نقطه ذوب و جوش ترکیب های یونی
همانطور که در قسمت قبلی اشاره کردیم به دلیل قوی بودن نیروی جاذبه میان کاتیون و آنیونها انرژی بالایی نیاز است تا پیوند میان آنها شکسته شوند. از این رو، جامدهای یونی نقطه ذوب و جوش بالایی دارند و در دماهای بالا به مایع یا بخار تبدیل میشوند.
-
انحلال پذیری ترکیبات یونی
ترکیبات یونی اغلب در حلالهای قطبی مانند آب انحلالپذیرند در حالیکه انحلالپذیری این ترکیبات در حلالهای ناقطبی مانند بنزین و گازوئیل پایین است.
-
رسانایی الکتریکی
ترکیبات یونی در حالت جامد عایق هستند اما همین ترکیبات در حالت مذاب رساناهای خوبی به شمار میروند. یکی از حالتهایی که سبب ایجاد رسانایی الکتریکی میشود جابجایی یونهاست. در حالت جامد به دلیل اینکه یونها امکان جابهجایی و تحرک ندارند به عبارتی موبیلیته آنها بسیار کم است رساناهای خوبی نیستند. در حالیکه در حالت مذاب به دلیل افزایش حجم و شکسته شدن پیوند میان یونها، یونها به راحتی میتوانند حرکت کنند و از نقطهای به نقطه دیگر جابهجا شوند.
بنابراین در حالت مذاب، رسانایی به دلیل جابهجایی یونهای باردار مثبت و منفی (به دلیل غلبه بر نیروی جاذبه میان یونها در اثر حرارت) رساناهای خوبی هستند. به گونهای که الکترولیت آبنمک در اثر ایجاد یونهای مثبت و منفی سدیم و کلر این قابلیت روشن کردن یک لامپ را دارد.
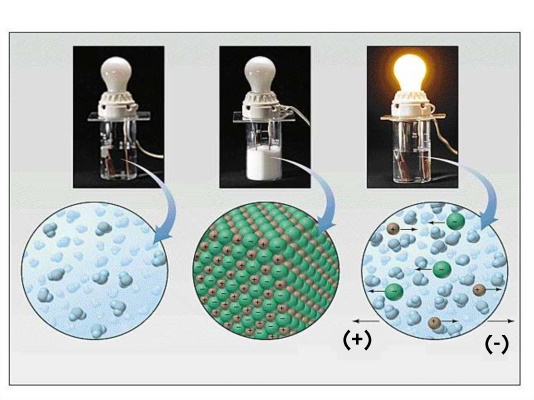
فرمول نویسی ترکیبات یونی
برای فرمولنویسی ترکیبات یونی نماد کاتیون و آنیون به همراه بارهایشان در کنار هم نوشته میشوند. باید ممطمئن شوید که این ترکیب از لحاظ بار الکتریکی خنثی است یا خیر. چنانکه بار کل ترکیب خنثی نبود باید تعداد اتمهای تشکیل دهنده ترکیب را به صورت اندیس زیرنویس تغییر دهید. به عنوان مثال ترکیب پتاسیم برمید را در نظر بگیرید. این ترکیب از کاتیون و آنیون پتاسیم و برم تشکیل شده که بار خالص آنها به ترتیب برابر ۱+ و ۱- است. بنابراین زمانی که این دو کاتیون به صورت کنار هم قرار میگیرند به دلیل توازن بار الکتریکی، این ترکیب خنثی بوده و فرمول آن نیز به صورت نوشته میشود.
ترکیب آلومینیوم اکسید (آلومینا) از کاتیون آلومینیوم و آنیون اکسیژن تشکیل شده که ترکیب این کاتیون و آنیون در کنار هم به صورت خواهد بود. این ترکیب در این حالت از لحاظ بار الکتریکی خنثی نیست. برای اینکه توازن بار ایجاد شود کافی است که به آلومینیوم اندیس ۲ و اکسیژن اندیس ۳ را بدهیم. در این صورت مجموع بارهای الکتریکی () برابر صفر خواهد شد یعنی ترکیب خنثی است. در نتیجه فرمول شیمیایی این ترکیب یونی برابر است با:
.
برای ترکیب یونی که از کاتیونها یا آنیونهای چند اتمی تشکیل شده نیز به همین صورت خواهد بود به طور مثال ترکیب سدیم فسفات را در نظر بگیرید. برای این ترکیب، کاتیون سدیم و آنیون فسفات بوده که در کنار هم به صورت قرار میگیرند در این حالت یک بار مثبت و ۳ بار منفی داریم. پس اگر برای سدیم زیرنویس ۳ قرار دهیم توازن بار برقرار میشود. در این صورت به ازای هر فسفات، ۳ اتم سدیم وجود دارد و ترکیب موردنظر از لحاظ بار الکتریکی خنثی خواهد شد. فرمول این ترکیب به صورت نمایش داده میشود.
همچنین برای نامگذاری ترکیبات یونی کافی است که اسم کاتیون را در ابتدا نوشته و بعد از آن نام آنیون را به همراه پسوند «-ید» بیاورید(مانند سدیم کلرید، منیزیم هیدروکسید). البته کاتیون و آنیونهای چنداتمی اینگونه نیستند و اسامی منحصر به فرد خود را دارند که در قسمتهای قبلی برخی از آنها را معرفی کردیم.
جفت یون چیست ؟
جفت یون در شیمی و فیزیک به معنای ذرات باردار دوگانه (معمولا اتمها یا مولکولهای باردار) که یکی بار مثبت و دیگری بار منفی دارد است. برای فیزیکدانها جفت یون متشکل از یون مثبت و منفی است که این یونهای با بار ناهمنام به طور همزمان از طریق وارد کردن انرژی کافی به اتم یا مولکول خنثی برای جداسازی بارهای آن به وجود میآیند. بنابراین با نزدیک یا وارد شدن الکترون پرانرژی به داخل ساختار مولکول اکسیژن ممکن است یک الکترون از آن جدا شود. در این صورت جفت یون شامل یون مثبت اکسیژن و الکترون جدا شده منفی $$$$ خواهد بود.
در مفهوم شیمی، جفت یون شامل یون مثبت و منفی است که به صورت موقت توسط نیروی جاذبه الکترواستاتیک با هم پیوند برقرار میکنند. جفت یونها در محلولهای غلیظ الکترولیتها وجود دارند، بنابراین در محلولهای غلیظ سدیم کلرید، برخی از یونهای مثبت سدیم و یونهای منفی کلر با یکدیگر جفت هستند.
کلام آخر
اتمها یا مولکولها برای رسیدن به پایداری و آرایش هشتتایی در لایه ظرفیت خود الکترون از دست میدهند یا دریافت میکنند. در هر صورت ذرات خنثی به ذرات باردار مثبت یا منفی تبدیل میشوند. به یونهای مثبت «کاتیون» و به یونهای منفی «آنیون» میگویند. با توجه به قانون دورهای عنصرها اغلب فلزات برای رسیدن به پایداری الکترون از دست میدهند و کاتیونها را به وجود میآورند. در حالیکه نافلزات با دریافت الکترون و تبدیل شدن به آنیون به پایداری میرسند.
در کنار هم قرار گرفتن یونهای مثبت و منفی ترکیبات یونی به وجود میآیند که پیوند میان آنها به دلیل نیروی جاذبه الکترواستاتیک قوی بوده از این رو نقطه ذوب و جوش بالایی دارند. یونها به انواع مختلف یونهای تک اتمی، چند اتمی، یونهای آلی و چند ظرفیتی دستهبندی میشوند. یونهای پایدار یونهایی هستند که با از دست دادن الکترون یا دریافت الکترون به آرایش گازهای نجیب که پایدارترین حالت است میرسند.
اغلب فلزات واسطه و برخی از عناصر دیگر به دلیل همپوشانی الکترونهای اوربیتالهای s و d از هر دو اوربیتال میتوانند الکترون از دست دهند بنابراین به کاتیونهایی با بارهای الکتریکی متفاوتی میتوانند تبدیل شوند. یونهای آهن و مس دو مثال رایج برای یونهای چند ظرفیتی هستند. یونها میتوانند در حالت محلول یا مذاب رساناهای بسیار خوبی برای الکتریسیته باشند، همچنین یون سدیم برای بدن یک یون بسیار ضروری به شمار میرود. باتریهای لیتیومی به دلیل حضور یونهای لیتیوم نسل جدیدی از باتریها به شمار میروند که کاربردهای متنوع آنها اغلب در زمینه وسایل الکترونیکی است. بنابراین یونها وظایف و کاربردهای متعددی دارند.
سوالات متداول مرتبط با یون چیست
برای اینکه به طور کامل و جامع یاد بگیریم یون چیست در این قسمت به سراغ سوالات متداول و پاسخ آنها در رابطه با یون میرویم.
یون پایدار چیست ؟
پایداری یک یون به عوامل بسیار متعددی ازجمله آرایش الکترونی، تعداد پیوندها، الکترونگاتیوی اتمهای متصل شده، ساختار یون، رزونانس و غیره بستگی دارد. اما به طور کلی یون پایدار به یونی گفته میشود که با از دست دادن یا دریافت الکترون به آرایش هشتتایی میرسد.
پسوندهای «-اید» و «-ات» در نامگذاری یونها چه مفهومی دارند؟
پسوند «-اید» معمولا برای ترکیبات نافلزی به کار میرود. برای مثال اتمهای کلر یون هالید کلرید را به وجود میآورند. از آنجا که اغلب نافلزات به دلیل الکترونگاتیوی بالا برای تبدیل شدن به یون الکترون دریافت میکنند برای نامگذاری کردن آنیون آنها در ترکیبات یونی از این پسوند استفاده میشود. در مورد پسوند «-ات» باید گفت که این پسوند زمانی به کار میرود که در یون تعداد زیادی اکسیژن (اغلب ) به کار رفته باشد مانند نیترات یا فسفات. البته لازم به ذکر است در نیتریت از پسوند «-ایت» استفاده شده زیرا که تعداد اکسیژن در این یون چند اتمی برابر ۲ است .
تعریف یون چیست ؟
یون زمانی به وجود میآید که عنصر، الکترون از دست میدهد یا دریافت میکند و باردار میشود یعنی دیگر خنثی نیست. به این ذرات باردار، «یون» میگویند.
یونهای فلزی و نافلزی چه یون هایی هستند؟
اغلب فلزات برای رسیدن به پایداری و آرایش هشتتایی الکترون از دست میدهند. در این حالت بار ذرات فلزی مثبتتر شده و به کاتیون تبدیل میشوند. در مقابل، اغلب نافلزات برای پر کردن اکتت لایه ظرفیت خود الکترون دریافت میکنند پس بار ذرات منفیتر شده و به آنیون تبدیل میشوند. بنابرای یونهای فلزی و نافلزی کاتیونها و آنیونهایی هستند که بار الکتریی آنها به ترتیب مثبت و منفی است. این خصلت از دست دادن و دریافت الکترون به ترتیب از خاصیت الکتروپوزیتیوی و الکترونگاتیوی سرچشمه میگیرد.
وظیفه اصلی یون چیست ؟
یونها وظایف متعددی دارند و در زمینههای مختلفی مورد استفاده قرار میگیرند. ازجمله وظایف یون میتوان به آزاد شدن یون آهن با مصرف مواد غذایی مانند گوشت و غیره برای ساخت هموگلوبین، حضور یونها در محلول به عنوان رساناهای الکتریکی، باتریها (باتریهای لیتیومی)، برخی از طیفسنجیها، مفید بودن یون سدیم و کلسیم برای سلامتی انسانها و غیره اشاره کرد.
تفاوت یون و رادیکال آزاد در چیست؟
در یونها الکترونها جفت شده هستند اما رادیکالهای آزاد یک یا چند الکترون جفت نشده دارند. بنابراین تفاوت یون و رادیکال آزاد در الکترونهای جفت نشده است و به همین دلیل یونها نسبتا پایدار بوده اما رادیکالهای آزاد بسیار ناپایدار هستند.
آزمون سنجش یادگیری
۱. یون چیست و چه تفاوتی با اتم خنثی دارد؟
یون ذرهای است که بار الکتریکی خالص آن صفر نیست و تعداد پروتونها و الکترونها برابر نیست.
یون ذرهای است که همیشه از چند اتم مختلف تشکیل شده است.
یون ذرهای است که تنها شامل پروتون و نوترون میشود و الکترون ندارد.
یون ذرهای است که تعداد پروتون و الکترون آن برابر است و بار خالص ندارد.
یون به ذرهای گفته میشود که به دلیل عدم توازن میان تعداد پروتون و الکترون، بار الکتریکی خالص آن صفر نیست. در حالی که اتم خنثی همیشه تعداد پروتون برابر با الکترون دارد و بار ندارد، اگر این توازن به هم بخورد، یون شکل میگیرد.
۲. کدام عامل الکترونی تعیین میکند یک اتم به کاتیون یا آنیون تبدیل شود؟
تعداد کل نوترونهای هسته
میزان انرژی پیوند بین اتمها
حجم اتم مرکزی در مولکول
تعداد الکترونها نسبت به پروتونها
عامل اصلی تبدیل یک اتم به کاتیون یا آنیون، «تعداد الکترونها نسبت به پروتونها» است. زمانی که یک اتم الکترون از دست میدهد و تعداد پروتون از الکترون بیشتر میشود، کاتیون تشکیل میشود و اگر الکترون دریافت کند و تعداد آن از پروتون بیشتر شود، آنیون شکل میگیرد.
۳. طبق قانون اکتت، دلیل اصلی تمایل عناصر به از دست دادن یا گرفتن الکترون چیست؟
برای افزایش اندازه اتم و کاهش انرژی لایه ظرفیت
برای تبدیل به یونهای چنداتمی و انجام واکنشهای سریعتر
برای رسیدن به پایداری شیمیایی بیشتر و آرایش پایدار
برای حفظ تعداد پروتونهای ثابت در هسته اتم
بر اساس قانون اکتت، عناصر به این دلیل الکترون از دست میدهند یا دریافت میکنند که به پایداری شیمیایی بالاتر برسند و آرایش الکترونی شبیه گازهای نجیب پیدا کنند. رسیدن به آرایش پایدار همان هدف اصلی شکل گیری یون است.
۴. یونها چگونه موجب پایداری ترکیبات یونی میشوند؟
یونهای با بار مخالف با هم شبکه بلوری منظم میسازند.
یونها با پیوند کووالانسی ساختار ترکیب را نگه میدارند.
یونهای همنام فراهمکننده رسانایی بیشتر هستند.
یونها با از دست دادن پروتون ترکیبات را پایدار میکنند.
پایداری ترکیبات یونی به دلیل قرار گرفتن یونهای با بار مخالف در کنار هم و شکلگیری نیروی جاذبه قوی بین آنهاست که منجر به تشکیل شبکه بلوری منظم میشود. این جاذبه الکترواستاتیکی اصلیترین عامل حفظ ساختار و پایداری ترکیب است.
۵. وجود یونها چه تاثیری بر ویژگیهای فیزیکی ترکیب یونی مانند رسانایی یا نقطه ذوب دارد؟
نقطه ذوب ترکیب یونی معمولا پایین است چون یونها حرکت آزاد دارند.
ترکیبات یونی جامد همیشه رسانای الکتریسیته هستند.
وجود یونها اثری بر خواص فیزیکی ترکیب ندارد.
یونها باعث بالا رفتن استحکام شبکه و افزایش نقطه ذوب میشوند.
یونها با تشکیل شبکه بلوری باعث ایجاد پیوندهای قوی در ترکیبات یونی میشوند که نتیجه آن استحکام بالا و افزایش نقطه ذوب و جوش است. برعکس، ترکیبات یونی جامد در حالت عادی رسانای الکتریسیته نیستند اما در حالت مذاب یا محلول امکان انتقال جریان دارند.
۶. فرض کنید اتمی با عدد اتمی ۱۱ یک الکترون را از دست میدهد. بار یون حاصل چیست و چگونه باید فرمول یونی آن را نوشت؟
بار یون منفی شده و به صورت Na2- نوشته میشود.
بار یون مثبت شده و به صورت Na2+ نوشته میشود.
بار یون منفی شده و به صورت Na- نوشته میشود.
بار یون مثبت شده و به صورت Na+ نوشته میشود.
وقتی اتمی با عدد اتمی ۱۱ یک الکترون از دست میدهد، تعداد پروتونها از الکترونها بیشتر میشود و یون دارای بار مثبت خواهد بود، بنابراین به عنوان یک کاتیون شناخته میشود. بر اساس قواعد نمایش یونها، نماد شیمیایی سدیم (Na) همراه با علامت مثبت قرار میگیرد و به صورت "Na+" نوشته میشود.
۷. در محلول آبی سدیم کلرید (NaCl)، علت اصلی رسانایی الکتریکی چیست و کدام یونها این نقش را بر عهده دارند؟
فقط مولکولهای آب عامل رسانایی محلولاند و یونها نقشی ندارند.
فقط یونهای سدیم (Na+) مسئول انتقال بار الکتریکی هستند.
یونهای سدیم (Na+) و کلرید (Cl-) هر دو الکترون را حمل و جریان را برقرار میکنند.
فقط یونهای کلرید (Cl-) میتوانند جریان برق را عبور دهند.
یونهای سدیم (Na+) و کلرید (Cl-) در آب آزادانه حرکت میکنند و هر دو با انتقال بار الکتریکی باعث رسانا شدن محلول میشوند، چون نمک در آب به یونها تجزیه میشود و این یونها عامل انتقال جریاناند.
۸. در مورد ترکیب یونی منیزیم کلرید ()، کدام مورد درباره فرمول، توازن بارها و نامگذاری آن درست است؟
فرمول صحیح و نام آن منیزیم کلرید است.
فرمول صحیح و نام آن کلرید منیزیم است.
فرمول صحیح Mg2Cl و نام آن منیزیم دیکلرید است.
فرمول صحیح MgCl و نام آن کلرید منیزیم است.
در ترکیب منیزیم کلرید، فرمول شیمیایی آن طبق توازن بار مثبت منیزیم دو بار مثبت و دو یون کلر یک بار منفی برابر با است. در نامگذاری نیز ابتدا نام کاتیون (منیزیم) و سپس آنیون (کلرید) بدون اشاره به تعداد یون آورده میشود.












سلام ممنون از مطالب مفیدتون
زنجیره های کربنی که یک سر باردار دارن (مثل بخش آنیونی صابونها و همینطور مولکولهای آمفیفیلیک) هم یون آلی محسوب میشن؟!
سلام و روز شما بهخیر؛
بله، بخش آنیونی ساختار صابونها نیز به دلیل داشتن یک سر باردار، یون آلی به حساب میآید.
خوشحالیم که با مجله فرادرس همراه هستید.
با سلام و وقت بخیر
تشکر بابت مطالب خوب شما
لطفاً نحوه تشخیص نوع یون از روی اسم فارسی آن را هم توضیح دهید
مثلاً در سولفات که آخر آن (ات) است به چه معناست
چگونه میتوان از روی نام فارسی یون ها فرمول شیمیایی آن ها را نوشت
مثلا کلرید که آخرش (اید )دارد یا کلرات آخرش(ات) دارد ، این اید و ات به چه معناست؟؟؟
با عرض سلام و خسته نباشید خدمت مسئولین محترم فرادرس که زحمت میکشند و آموزش هایی به این خوبی رو در اختیار ما قرار میدهند.
فیلم آموزشی بسیار بسیار مفید بود
فقط جسارتاً من یه نکتهای رو گوشزد کنم
در قسمتی که ساختار لوئیس عناصر رو آقای محمدیان توضیح میدادند، عنصر بور را به اشتباه بِرُم گفتند
مطمئناً حواسشون نبوده
من فقط این نکته رو گفتم که دوستان حین دیدن فیلم دچار مشکل نشوند
با سلام؛
از توجه شما بسیار سپاسگزاریم. در حقیقت، اتم «Br» همان برم (بروم) و اتم «B» همان اتم «بور» (Boron) است که در یک بخش از متن، به جای برم از بور استفاده شده بود. متن بازبینی و اصلاح شد.
با تشکر
سلام یه سوال داشتم اگه میشه جواب بدید
چرا برای بعضی از یون ها ی چند اتمی مثل AL CL4 یک بار منفی ساختار لوئیس رسم میکنن؟
مگه این ترکیب یه ترکیب یونی نیست؟
ممنون میشم جواب بدید
سلام میشه گفت هر یون یک ترکیب است؟
از توجه شما بسیار سپاسگزاریم؛
به طور کلی، ترکیبی که به آن اشاره کردهاید، شامل AlCl3+ و Cl− است. پیوند بین این دو ترکیب نیز از نوع کووالانسی کوردینانسی است به این معنی که Cl− برای پیوند، هر دو الکترون را تامین میکند. برای درک بهتر این نوع از پیوندها پیشنهاد میکنیم مطلب «ترکیبات کوئوردیناسی — از صفر تا صد» را مطالعه کنید.
با تشکر