ایمنی اکتسابی چیست؟ – به زبان ساده + تفاوت با ایمنی ذاتی
سیستم ایمنی انسان از چندین لایه محافظتی برای جلوگیری از ورود میکروبها به بدن و گسترش آنها استفاده میکند. سد فیزیکی اولین مکانیسم این سیستم برای جلوگیری از ورود پاتوژنها است. اگر میکروبی از این سطح عبور کند، سلولهای ایمنی ذاتی برای حذف این میکرواورگانیسمهای مزاحم دست به کار میشوند. اگر پاتوژنها با مکانیسمهای محافظتی خود از این سد عبور کنند، لنفوسیتهای ایمنی اکتسابی فعال میشود. در این مطلب سلولها، مکانیسمها، ارتباط و تفاوت ایمنی اکتسابی با ایمنی ذاتی را توضیح میدهیم.
- میآموزید سلولها و مسیرهای کلیدی ایمنی اکتسابی چگونه نقش دارند.
- یاد میگیرید تفاوت عملکرد ایمنی اکتسابی و ذاتی را تحلیل کنید.
- با فرایند شناسایی آنتیژن توسط لنفوسیتهای T و B آشنا میشوید.
- یاد خواهید گرفت که ایمنی هومورال با تولید آنتیبادی چگونه عمل میکند.
- درک میکنید نقش CTLها در حذف سلولهای آلوده به چه صورت است.
- یاد میگیرید اصول ایمنی فعال، غیرفعال و عملکرد واکسنها را تشریح کنید.
ایمنی اکتسابی چیست ؟
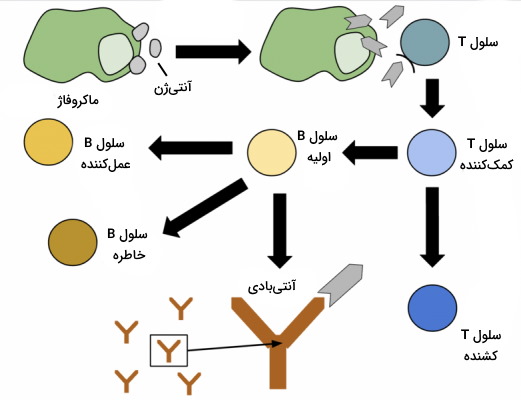
ایمنی اکتسابی، اختصاصی یا تطبیقی بخشی از مکانیسمهای سیستم بدن انسان است که در پاسخ به آنتیژنهای خارجی (باکتری، قارچ، انگل و ویروس) و آنتیژنهای داخلی (سلولهای توموری) فعال میشود. این بخش از سیستم ایمنی به فعالیت لنفوسیتهای T و B وابسته است و در پاسخ به هر آنتیژن پاسخ منحصر به فردی ایجاد میکند.
سلول های ایمنی اکتسابی
برخلاف ایمنی ذاتی که با مشارکت بیشتر گلبولهای سفید انجام میشود، تنها لنفوسیتهای B و T در ایجاد پاسخ ایمنی اکتسابی شرکت میکنند. این سلولها مثل لوکوسیتهای سیستم ایمنی از میتوز و تمایز سلولهای بنیادی در مغز استخوان تشکیل میشوند. اما رشد و تمایز آنها در بخشهای مختلف سیستم لنفاوی ادامه مییابد. لنفوسیتهای T اولیه پس از تولید در مغز قرمز استخوان بهوسیله جریان خون به غده تیموس (غده لنفاوی پس قفسه سینه) منتقل میشوند.
لنفوسیت T
لنفوسیتهای T در تمام طول عمر ما تولید میشوند اما به دلیل کوچکتر شدن تیموس پس از سن بلوغ، تعداد آنها کاهش مییابد. این سلولها در تیموس برای شناسایی آنتیژنهای خودی از آنتیژنهای بیماریزا و شناسایی انواع مختلف آنتیژنهای بیماریزا آماده میشوند. مرحله اول تکامل لنفوسیتهای T وابسته به گیرندههای CD در غشای این سلولها است. در این مرحله سلولهایی که ژن این دو گیرنده CD را دارند به تقسیم سلولی ادامه میدهند و سلولهای فاقد ژن گیرنده از بین میروند.
سپس سلولهایی که گیرنده سلول T آنها (TCR) آنتیژنهای MHC خودی را شناسایی میکنند، انتخاب میشوند. اما لنفوسیتهایی که گیرنده آنها پیوند محکمی با آنتیژنهای MHC خودی دارد، حذف میشوند. در مرحله بعد سلولهایی که یکی از گیرندههای CD4 یا CD8 در غشای آنها وجود دارد، انتخاب و سایر سلولها حذف میشوند. لنفوسیتهای T برای اساس این پروتئینهای غشایی به سه دسته کمککننده (T Helper | Th)، کشنده سلول (Cytotoxic T Cell | CTC) و تنظیمی (Regulatory | Treg) تقسیم میشوند که عملکرد متفاوتی دارند.
- سلولهای T کمککننده: در غشای این سلولها گیرنده CD4 وجود دارد. این سلولها به ماکروفاژها، سلولهای B و سلولهای T کشنده برای ایجاد پاسخ ایمنی کمک میکنند. ویروس HIV با تغییر ساختار این گیرنده منجر به کاهش سلولهای T در خون میشود.
- سلولهای T کشنده: در غشای این سلولها گیرنده CD8 وجود دارد. این سلولها با آزاد کردن وزیکولهای ذخیره حاوی آنزیم، سلولهای آلوده را از بین میبرند.
- سلولهای T تنظیمی: در غشای این سلولها گیرندههای CD4 و CD25 قرار دارد. این سلولها با مهار سلولهای B و سایر سلولهای T، از ایجاد پاسخ ایمنی در نبود پاتوژنها یا ادامه یافتن پاسخ ایمنی پس از تجزیه پاتوژن جلوگیری میکنند.
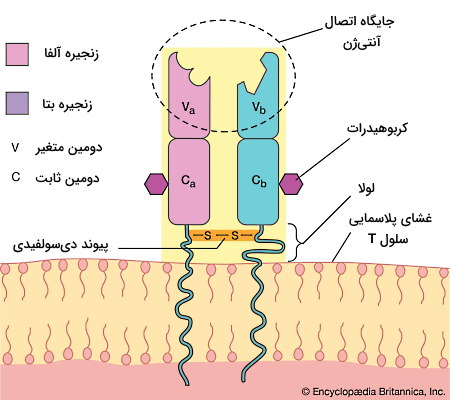
گیرنده لنفوسیت T
گیرنده لنفوسیت T یا TCR مجموعهای از پروتئینهای عرض غشایی است که آنتیژن متصل به مولکولهای MHC را شناسایی میکند. این گیرنده در بیشتر لنفوسیتهای انسانی از دو زنجیره پلیپپتیدی آلفا و بتا تشکیل میشود که با پیوند دیسولفیدی کنار هم قرار گرفتهاند. هر زنجیره پلیپپتیدی از یک بخش ثابت (C) و یک بخش متغیر (V) تشکیل میشود. بخشهای متغیر این گیرنده تیروزین کینازی جایگاه اتصال به آنتیژن-پپتید را ایجاد میکنند.
فعال شدن لنفوسیت T
فعال شدن لنفوسیتها به برهمکنش TCR و پروتئین CD با پپتیدهای MHC و مولکولهای کمی غشای سلولهای ارائهدهنده آنتیژن بستگی دارد. اگر این هماهنگی وجود نداشته باشد، پاسخ ایمنی ایجاد شده بهوسیله سلولهای T بسیار ضعیف است.
لنفوسیت B
لنفوسیتهای B دسته دوم سلولهای ایمنی هستند که در ایمنی اکتسابی بدن شرکت میکنند. این سلولها مثل لنفوسیتها T از تقسیم و تمایز سلولهای لنفوئیدی مغز قرمز استخوان تولید میشوند. اما برخلاف لنفوسیتهای T، تکامل آنها به جای تیموس در مغز استخوان انجام میگیرد. این سلولها با ترشح آنتیبادی در خون به از بین بردن عوامل بیماریزا کمک میکنند. تکامل این سلولها در مغز استخوان در دو مرحله انتخاب مثبت و منفی انجام میشود.
- انتخاب مثبت: این مرحله مستقل از آنتیژن و وابسته به پیشساز گیرنده سلول B و خود این گیرنده است. اگر گیرنده اتصال محکمی با لیگاند نداشته باشد، سلول B تکامل نمییابد و از بین میرود.
- انتخاب منفی: در این مرحله سلول B برای تشخیص آنتیژنهای خودی از بیگانه آماده میشود. اگر اتصال BCR به آنتیژنهای خودی محکم باشد، سلول B وارد یکی از چهار مسیر زیر خواهد شد.
- حذف کلونی: فعال شدن مسیرهای آپوپتوزی منجر به مرگ سلول B میشود.
- ویرایش گیرنده: ایجاد تغییر در توالیهای V و J زنجیره سبک آنتیبادیهای سطحی سبب فرار سلول B از مسیرهای آپوپتوزی میشود.
- آنرژی: آنرژی یا کاهش حساسیت سلول B به آنتیژن سبب میشود این سلول توانایی ایجاد پاسخ ایمنی در مواجه با آنتیژنهای داخلی را نداشته باشد.
- نادیده گرفتن: ممکن است سلول B بدون توجه به پیامهای تنظیمی تکامل یابد. این شرایط با افزایش احتمال بیماریهای خودایمنی در فرد همراه است.
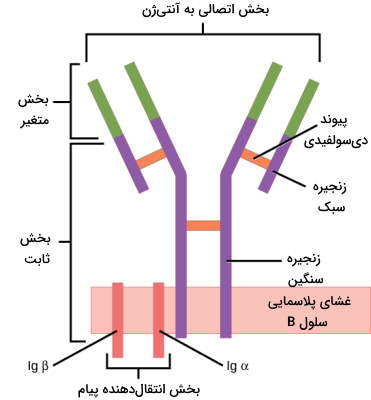
گیرنده لنفوسیت B
گیرنده لنفوسیت B از یک بخش شناساییکننده آنتیژن (عرض غشایی) و یک بخش انتقال پیام (درون غشایی) تشکیل شده است.
- بخش شناساییکننده آنتیژن: این بخش یکی از پنج آنتیبادی لنفوسیت B است که زنجیره سنگین آن بین فسفولیپیدهای غشا و جایگاه اتصال به آنتیژن خارج از سلول قرار میگیرد.
- بخش انتقال پیام: این هترودیمر از زیرواحدهای ایمونوگلوبین آلفا و بتا تشکیل شده است که با پیوند دیسولفیدی به هم متصل شدهاند و به آن CD79 گفته میشود. بخش سیتوپلاسمی این هترودیمر فعالیت تیروزینکینازی دارد.
فعال شدن لنفوسیت B
لنفوسیت B در مغز استخوان تکامل مییابد، اما برای فعال شدن به اندامهای لنفاوی ثانویه ازجمله طحال و گرههای لنفاوی (محل تجمع آنتیژنهای محلول) منتقل میشود. فعال شدن این سلولها از دو مسیر وابسته و مستقل از سلولهای T انجام میشود.
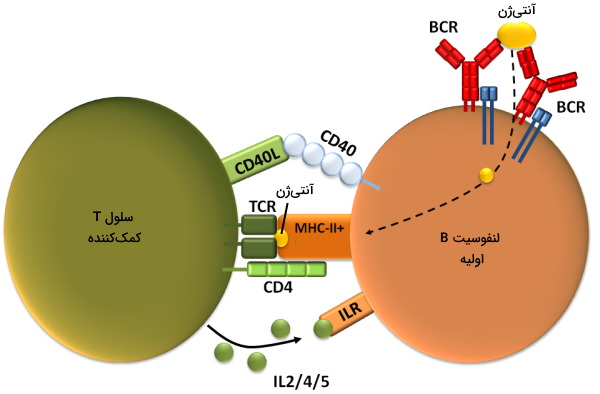
- مسیر وابسته به لنفوسیت T: در این روش سلولهای B به کمک سلولهای Th آنتیژنهای محلول را شناسایی میکنند. فعال شدن لنفوسیتها B و تولید آنتیبادی در این روش به چند وز زمان نیاز دارد و نوع آنتیبادیهای آن با آنتیبادیهای مسیر مستقل متفاوت است. این مسیر در چند مرحله انجام میشود.
- سلول B آنتیژن محلول را بهوسیله BCR شناسایی و آنتیژن وارد سیتوپلاسم میشود.
- آنتیژن بیگانه در سیتوپلاسم با مولکول MHCII ترکیب شده و در غشای سلولی قرار میگیرد.
- سلول T کمککننده آنتیژن-MHC II را بهوسیله گیرنده TCR شناسایی و به آن متصل میشود.
- اتصال گیرنده-آنتیژن سبب فعال شدن مسیر رونویسی و بیان پروتئین CD4L و سایتوکاینها (IL4 و IL21) میشود.
- مولکول CD4L به گیرنده CD4 در غشای سلول B متصل میشود. در نتیجه تقسیم، تغییر کلاس ایمونوگلوبینها و جهش ژنهای آنتیبادی را فعال میکند.
- اتصال سایتوکاینها به گیرنده سایتوکاین سلول B با تقسیم، تغییر کلاس ایمونوگلوبینها، جهش ژنهای آنتیبادی و تمایز را فعال میکند.
- مسیر مستقل از لنفوسیت T: آنتیژنها پلیساکاریدی و توالی CpG متیله نشده، بدون نیاز به کمک Th سلولهای B را فعال میکنند. پاسخ ایمنی ایجاد شده در این مسیر، از مسیر وابسته به لنفوسیت T سریعتر اما تمایل آنتیبادی به آنتیژن و تنوع آنتیبادیهای ترشحی آن کمتر است. فعال شدن این لنفوسیتها در این مسیر با اتصال آنتیژنهای باکتریایی به TCR کامل میشود.
نقش کمپلکس سازگازی بافت در دفاع اکتسابی
کمپلکس سازگاری بافت اصلی (Major Histocompatibility Complex | MHC) یکی از لوکوسهای ژنی بزرگ در DNA مهرهداران است که مولکولهای MHC را بیان میکند. در انسان این لوکوس روی بازوی کوتاه کروموزوم ۶ قرار دارد. پروتئینهای این ژن در غشای پلاسمایی سلول قرار میگیرند و نقش مهمی در ایجاد ایمنی اکتسابی و تشخیص سلولهای خودی از آنتیژنهای بیماریزا ایفا میکنند. به علاوه این پروتئینها یکی از فاکتورهایی هستند که احتمال رد پیوند را افزایش میدهند. این مولکولها به سه دسته تقسیم میشوند.
- مولکولهای MHC I: ژن این پروتئین در تمام سلولهای بدن به جز گلبولهای قرمز وجود دارد. سلولهای آلوده به باکتری (باکتریهای ال فرم، مایکوپلاسما و ریکتسیا) یا ویروس ، اپیتوپ آن را همراه این مولکولها برای برهمکنش با گیرنده سلولهای T کشنده، به غشا انتقال میدهند. MHC I در انسان از سه مولکول HLA-A، HLA-B و HLA-C (آنتیژنهای لوکوسیت انسان | Human Leukocyte Antigen) تشکیل شده است.
- مولکولهای MHC II: ژن این پروتئینها در سلولهای ارائهدهنده آنتیژن (ماکروفاژ، سلول B و سلولهای دندریتی) وجود دارد. این سلولها آنتیژن یا پاتوژن کامل را بهوسیله اندوسیتوز یا فاگوسیتوز وارد سیتوپلاسم میکنند. آنتیژن پس از پردازش در لیزوزوم همراه مولکولهای MHC II به غشای سلول ایمنی منتقل میشود. اتصال MHC II-اپیتوپ به گیرندههای سلول Th با فعال شدن این سلول و رهایش سایتوکاینها همراه است.
- مولکولهای MHC III: بیشتر این مولکولها برخلاف MHC I و MHC II در انتقال پیامهای خارج از سیستم ایمنی شرکت میکنند.
مکانیسم های دفاع اکتسابی
ایمنی سلولی و ایمنی هومورال دو مکانیسم ایمنی اکتسابی برای از بین بردن پاتوژنها هستند. لنفوسیتهای B با تولید و ترشح آنتیبادیها در ایمنی هومورال و لنفوسیتهای T با فعال کردن مسیرهای آپوپتوزی در ایمنی سلولی شرکت میکنند.
ایمنی هومورال
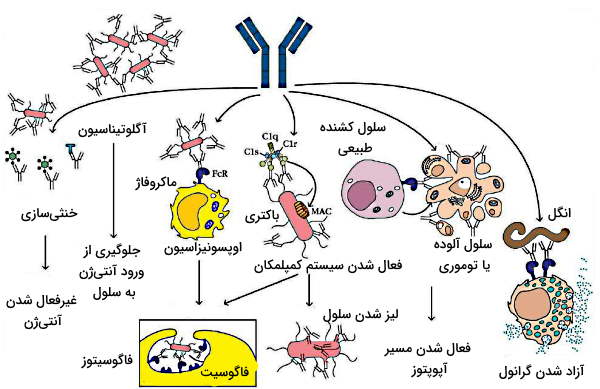
ایمنی هومورال وابسته به آنتیبادیهای ترشح شده در مایعات بدن است. این مکانیسم ایمنی اکتسابی با فعال شدن، تقسیم سلولی و تمایز لنفوسیتهای B در برخورد آنتیژنها شروع میشود. اتصال آنتیژن-آنتیبادی در این سلول با تقسیم سریع و تشکیل کلونی سلولهای B همراه است. این کلونی به سلولهای B خاطره و سلولهای پلاسما، پلاسموسیت یا لنفوسیت B عملکننده تمایز مییابد. سلولهای B خاطره غیرفعال باقی میمانند تا در برخورد دوم با آنتیژن، پاسخ ایمنی سریعتر ایجاد شود. اما سلولهای پلاسما با ترشح آنتیبادی از شش مسیر متفاوت در حذف عامل بیماریزا شرکت میکنند.
- «خنثیسازی» (Neutralization): در این روش آنتیبادیها با اتصال به آنتیژنهای سطح پاتوژن یا توکسینهای محلول از اتصال این مولکولها به گیرندههای سلولی و شروع بیماری جلوگیری میکنند. هر پنج ایزوتوپ آنتیبادی در روش خنثیسازی عامل بیماریزا شرکت میکنند.
- «بههم چسبیدگی یا آگلوتیناسیون» (Agglutination): از آنجا که هر آنتیبادی چند جایگاه اتصال به آنتیژن دارد، هر آنتیبادی میتواند همزمان به چند آنتیژن متصل شده و این مولکولها را کنار هم نگه دارد. در این روش همزمان تعداد زیادی از آنتیژن ها خنثی میشوند. آگلوتیناسیون پاتوژنها در روده با به دام افتادن آنها در مخاط و پاکسازی راحتتر آنها بهوسیله حرکات دودی همراه است.
- «اوپسونیزاسیون» (Opsonization): اوپسونیزاسیون فرایندی است که فاگوسیتوز پاتوژنها را افزایش میدهد. در این فرایند بخش متغیر آنتیبادیها به آنتیژن و بخش ثابت آنها به گیرنده Fc فاگوسیتها متصل میشود.
- فعال کردن سیستم کمپلمان: کمپلکس آنتیژن-آنتیبادی میتواند مسیر کلاسیک سیستم کمپمان را فعال کند. IgM و IgG دو آنتیبادی هستند که در مسیر شرکت میکنند.
- لیز کردن سلول: اتصال آنتیبادی به آنتیژنهای خارج سلولی در غشای سلولهای خودی مثل آنتیژنهای توموری یا پروتئینهای ویروسی سلولهای آلوده، با فعال کردن سلولهای کشنده طبیعی و گرانولوسیتها به حذف پاتوژنها کمک میکند. در غشای سلولهای کشنده طبیعی، گیرندهای برای بخش Fc آنتیبادی g وجود دارد که اتصال آن به آنتیابدی-آنتیژن با ترشح پروتئینهای ضدمیکروبی همراه است.
- رهایش گرانولها: در غشای گرانولوسیتها (نوتروفیل، ماستسل، بازوفیل و ائوزینوفیل) گیرنده بخش Fc آنتیبادی وجود دارد. اتصال آنتیبادی به این گیرندهها آزاد شدن وزیکولهای ذخیرهای حاوی پروتئینهای ضدمیکروبی را تحریک میکند.
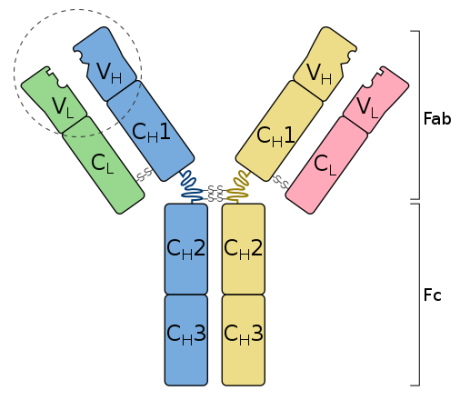
آنتی بادی ایمنی هومورال
آنتیبادیها گلیکوپروتئینهای Y شکل بزرگی (با وزن تقریبی ۱۵۰ کیلودالتون و اندازه ۱۰ نانومتر) هستند که از دو زنجیره متفاوت تشکیل میشوند. جایگاه پاراتوپ (قفل) این پروتئینهای مثل جایگاه فعال آنزیم با مدل قفل و کلید به اپیتوپهای آنتیژن (کلید) متصل میشود. هر آنتیبادی از چهار زنجیره پلیپپتیدی (دو زنجیره سبک و دو زنجیره سنگین) تشکیل شده است که بهوسیله پیوند دیسولفیدی به هم وصل میشوند. هر یک یاز این زنجیرهها از یک ناحیه متغیر برای اتصال به آنتیژنهای متفاوت و یک ناحیه ثابت برای اتصال به غشای سلولهای B یا پروتئین های مکمل تشکیل شده است.
پنج کلاس یا ایوتیپ مختلف از آنتیبادیها بهوسیله لنفوسیتهای B انسان تولید میشود که زیرگروههای آنها در مکانیسمهای مختلف سیستم ایمنی شرکت میکنند.
| آنتیبادی | تعداد زیرگروه - ساختار | نوع زنجیره سنگین | جایگاه | عملکرد |
| IgA | ۲ - دیمر | آلفا | مخاط لوله گوارش، دستگاه تنفسی، مجاری ادراری، شیر مادر، بزاق و اشک | خنثیسازی و مهار تشکیل کلونی پاتوژن |
| IgD | ۱ - مونومر | دلتا | گیرنده غشایی سلول B غیرفعال | فعالسازی و تحریک ترشح پروتئینهای ضدمیکروبی در بازوفیل و ماستسل |
| IgE | ۱ - مونومر | اپسیلون | مخاط | تحریک ترشح هیستامین از ماستسلها و بازوفیلها در پاسخ به آلرژن و کرمهای انگلی |
| IgG | ۴ - مونومر | گاما | خون | ایجاد پاسخ ایمنی به پاتوژن |
| IgM | ۱ - پنتامر | مو | گیرنده غشای سلول (مونومر) و مایعات بدن (پنتامر) | ایجاد پاسخ ایمنی هومورال قبل از تولید IgG |
ایمنی سلولی چیست ؟
ایمنی سلولی بخشی از دفاع اختصاصی بدن است که با همکاری لنفوسیتهای T کشنده و سلولهای کشنده طبیعی پاتوژنها را از بین میبرد. CTLs با از بین بردن سلولهای آلوده به ویروس، سلولهای توموری و سلولهای آسیبدیده بهوسیله دمای بالا یا ضربات فیزیکی از پخش شدن آلودگی و آسیب سلولی در بافتهای سالم جلوگیری میکنند. لنفوسیتهای T کشنده در دو مرحله فعال میشوند.
- فعال شدن اولیه: در این مرحله CTL آنتیژن متصل به مولکول MHC I در غشای سلول دندریتی را به کمک Th1 شناسایی میکند. این مرحله معمولا در اندامهای لنفاوی ثانویه مثل گرههای لنفاوی و طحال انجام میشود.
- فعال شدن ثانویه: در این مرحله CLT آنتیژن متصل به مولکول MHC I در غشای سلولهای محیطی (برای مثال سلولهای توموری یا سلول آلوده به ویروس) را شناسایی میکند.
اتصال آنتیژن-گیرنده مسیرهای تقسیم سلولی و تمایز CLT را فعال میکند. در نتیجه کلونی از سلولهای T عملکننده و خاطره تشکیل میشود سلولهای T عملکننده با آزاد کردن گرانولهای پرفورین-گرانزیم یا مسیر پروتئین Fas سلول هدف را از بین میبرند. هر دو این مسیرها منجر آپوپتوز سلول هدف یک ساعت پس از مواجه با لنفوسیت T میشود. سپس لنفوسیت T از سلول هدف شده و به آنتیژن سلول جدید متصل میشود.
مرگ سلولی وابسته به پرفورین و گرانزیم
گرانولهای سیتوپلاسمی حاوی پروتئینهای پرفورین و سرین پروتئاز گرانزیم با فعال شدن CLT ها تشکیل میشود. اتصال آنتیژن به گیرندههای سلول T مکانیسمهای اگزوسیتوز این وزیکولها را فعال میکند. کنفورماسیون پرفورینها پس از برهمکنش با غشای سلول هدف تغییر کرده و پلیمریزاسیون آنها در حضور یون کلسیم شروع میشود. این پروتئینها آمفوتر با قرار گرفتن در غشای سلول هدف کانالی تشکیل میدهند. گرانزیم B بهوسیله اندوسیتوز وابسته به گیرندههای مانوز ۶-فسفات وارد سلول هدف شده و با عبور از پرفورین وارد سیتوپلاسم میشود. گرانزیم B با فعال کردن آپوپتوز، DNA میزبان را به قطعات ۲۰۰ جفتبازی تبدیل میکند.
مرگ سلولی وابسته به پروتئین Fas
پروتئینهای عرض غشایی Fas یا CD95 یکی از اعضای خانواده گیرندههای TNF است که در بسیاری از سلولها بیان میشود. اتصال این گیرنده با پروتئین FasL مسیرهای آپوپتوزی را در سلول هدف فعال میکند. این پروتئین در گرانولهای CLT فعال جود دارد و پس از آزاد شدن وزیکول به گیرندههای سلول آلوده متصل میشود.
سندروم نقص ایمنی اکتسابی
«سندروم نقص ایمنی اکتسابی» (Acquired immunodeficiency syndrome | AIDS) یکی از بیماریهای مزمن سیستم ایمنی انسان است که بهوسیله ویروس نقص ایمنی یا HIV ایجاد میشود. این ویروس با آلوده کردن لنفوسیتهای T با مولکولهای غشایی CD4، ماکروفاژها و سلولهای دندریتی و تضعیف سیستم ایمنی بدن احتمال ابتلا به انواع عفونتهای ویروسی، باکتریایی و قارچی را افزایش میدهد. این رتروویروس سلولهای Th را به شکل مستقیم و غیرمستقفیم از بین میبرد. ارتباط جنسی محافظت نشده اصلیترین ورش انتقال این ویروس از فرد مبتلا به فرد است. به علاوه این ویروس ممکن است از مادر به جنین منتقل شود.
ویروس HIV
ویروس HIV ویروسی پوششدار با RNA تکرشتهای است. پس از ورود به سلولهای ایمنی، آنزیم رونویسی معکوس یا ویورس ترانسکریپتاز که همراه ویروس وارد سلول هدف شده، RNA تکرشتهای ویروس را با استفاده از نوکلئوتیدهای میزبان به DNA دو رشتهای تبدیل میکند. DNA ویروسی به هسته سلول میزبان منتقل میشود و بهوسیله آنزیم اینتگراز ویروسی و پروتئینهای کمکی میزبان با DNA سلولهای ایمنی ادغام میشود.
DNA ویروسی ممکن است همراه سیستم همانندسازی میزبان تکثیر شود اما ژنهای پوشش پروتئینی آن بیان نشده و ویروس کامل تشکیل نشود (فاز کمون یا پنهان) یا پس از چند بار همانندسازی DNA تمام پروتئینهای آن بیان، ویروس کامل تشکیل و با لیز شدن سلول میزبان در بدن پخش شود (فاز فعال). دو گروه ویروس HIV انسانی وجود دارد. HIV1 ویروسی با قدرت انتقال و آلودگی بیشتر و HIV2 ویروسی با قدرت انتقال و آلودگی کمتر است.

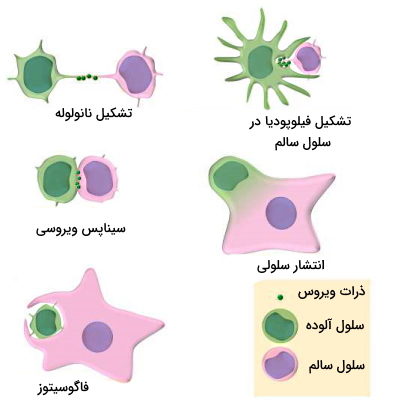
ویروس HIV از دو روش برای آلوده کردن سلولهای سالم از دو روش وابسته به سلول و مستقل از سلول استفاده میکند. در روش مستقل از سلول، ذرات ویروسی (پروتئین، RNA یا گلیکوپروتئینهای غشا و کپسید) با کمک سیستم انتقالی میزبان بستهبندی شده و پس از جوانه زدن از غشا بهوسیله جریان خون به سلولهای دیگر منتقل میشود. در روش وابسته به سلول، ویروس کامل با فاگوسیتوز، سیناپس، لولههای نانو، فیلوپودیا یا انتشار سلولی به سلول سالم منتقل میشود.
- فاگوسیتوز: فاگوسیتوز یکی از روشهای انتقال ویروس HIV از سلولهای T آلوده به ویروس به ماکروفاژها است. این روش به کمک تغییرات آرایش اکتینهای اسکلت سلولی انجام میشود.
- سیناپس: تشکیل سیناپس به اتصال گیرندههای CD در غشای ماکروفاژ، لنفوسیتهای و سلول های دندریتی به گلیکوپروتئین پوشش ویروس که پس از بیان در غشای سلولهای آلوده به ویروس قرار میگیرد، بستگی دارد. اتصال این دو مولکولها با انتقال مولکولهای کمکی به غشای سلول آلوده و محکم شدن اتصال دو سلول، جوانه زدن وزیکولهای حاوی ویروس، ادغام جوانه با غشای سلول سالم و آلوده شدن سلول جدید همراه است.
- لولههای نانو: دو دسته نانولولههای انتها باز و بسته (TNTs) برای انتقال مستقیم مواد بین سلولهای یوکاریوتی تشکیل میشود. این ساختارهای شکننده و پویا بیرونزدگیهای غشای پلاسمایی هستند که به دلیل تغییر آرایش فیلامنتهای اکتینی ایجاد میشوند و سلولها را برای چند دقیقه تا چند ساعت متصل نکه میدارند. طول این لولهها حداکثر ۱۰۰ میکرومتر و قطر آنها بین ۵۰ تا ۲۰۰ میکرومتر است و با ساختارهای اسکلت سلولی اتصالی ندارند. انتقال HIV1 در سلولهای T و ماکروفاژها در انتقال سریع ویروس به سلولهای سالم نقش دارد.
- فیلوپودیا: فیلوپودیا یا پای کاذب یکی دیگر از زوائد سیتوپلاسمی است که به دلیل تغییر آرایش رشتههای اکتین ایجاد میشود. این زواید در کموتاکسی سلولها، اتصال به سطوح و انتقال بین سلولی مستقیم شرکت میکنند. ایم روش یکی از راههای انتقال HIV از سلول دندریتی آلوده به سلول دندریتی سالم است.
- انتشار سلولی: ادغام غشای پلاسمایی سلولهای T آلوده یا یکی سلول T آلوده با سلول T سالم، با تشکیل یک سلول بزرگ چند هستهای یا «سینسیتیوم» (Syncytia) و پخش شدن ویروس در بدن همراه است. انتشار سلولی به برهمکنش گلیکوپروتئین ویروسی غشای سلول آلوده و گیرنده CD4 بستگی دارد.
تکثیر ویروس در بدن و کاهش تعداد لنفوسیتهای در خون با فعال شدن سلولهای T کشنده و کند شدن سرعت تکثیر ویروس همراه است. اما بدن نمیتواند بدون کمک در برابر تکثیر ویروسها مقاومت کند. در نتیجه تعداد لنفوسیتهای T به کاهش توانایی بدن در فعالسازی لنفوسیتهای B (ایمنی هومورال)، از بین بردن سلولهای توموری و سایر پاتوژنها میشود. سندروم نقص ایمنی را بر اساس میزان آلودگی بدن به پنج سطحح تقسیم میکنیم.
- آلودگی HIV اولیه: این مرحله ممکن است بدون علائم یا با علائم حاد سندروم رتروویروس همراه باشد.
- مرحله ۱: در این مرحله بیمار علائمی ندارد و تعداد سلولهای بیشتر از ۵۰۰ عدد در هر میکرولیتر خون است. این مرحله ممکن است با تورم غدد لنفاوی همراه باشد.
- مرحله ۲: در این مرحله بیمار علائم خفیفی ازجمله افزایش ترشح مخاط و ابتلای مکرر به عفونتهای تنفسی نشان میدهد. تعداد سلولهای به کمتر از ۵۰۰ عدد در هر میکرولیتر خون کاهش مییابد.
- مرحله ۳: در این مرحله علائم شدیدی ازجمله اسهال مزمنی که بیش از یک ماه طول میکشد و عفونتهای باکتریایی شدید به خصوص سل در بیمار ظاهر میشود. تعداد سلولهای در این مرحله به کمتر از ۳۵۰ سلول در هر میکرولیتر خون کاهش مییابد.
- مرحله ۴ یا AIDS: تاکسوپلاسموسیس مغز (عفونت انگلی)، افزایش عفونت باکتریهای کاندیدا در مری، نای، برونشها و ریه، کاپوسیس سارکوما (تومور فراگیر در بافت پوست، غدد لنفاوی و دهان) علائم شدیدی هستند که در این مرحله از سندروم نقص سیستم ایمنی ایجاد میشوند. در این مرحله تعداد سلولهای T به کمتر از ۲۰۰ عدد در هر میکرولیتر خون کاهش مییابد.
ایمنی اکتسابی فعال و غیر فعال
ایمنی اکتسابی به دو شکل فعال و غیرفعال در بدن انسان ایجاد میشود. در ایمنی اکتسابی غیرفعال آنتیبادیهای آزمایشگاهی و تشکیل شده در بدن فرد دیگر (انسان یا حیوان) به انسان تزریق میشود که با تحریک سیستم ایمنی از ابتلای فرد سالم به بیماری پیشگیری میکند. در ایمنی اکتسابی فعال لنفوسیتهای فعال شده فرد از بدن محافظت میکنند. هر یک از این مکانیسمهای ایمنی به دو روش طبیعی و غیرطبیعی انجام میشود.
ایمنی اکتسابی طبیعی
ایمنی اکتسابی طبیعی فعال با ورود پاتوژنها به بدن و فعال شدن سلولهای ایمنی شروع میشود. در این آنتیبادیهای سیستم ایمنی بهوسیله لنفوسیتهای B فعال شده در بدن فرد تولید میشود. انتقال آنتیبادیهای بدن مادر از راه جفت به جنین (IgG که معمولا ۴ تا ۶ هفته پس از تولد در بدن نوزاد فعال است) و شیر پس از تولد (IgG و IgM) روشهای ایمنی اکتسابی طبیعی غیرفعال هستند. علاوه بر آنتیبادیها موسین، لاکتوفرین، پروتئین اتصالی به ویتامین B12، فیبرونکتین، اینترفرون گاما و لیزوزیم شیر مادر به تقویت سیستم ایمنی نوزاد کمک میکند.
ایمنی اکتسابی غیر طبیعی چیست ؟
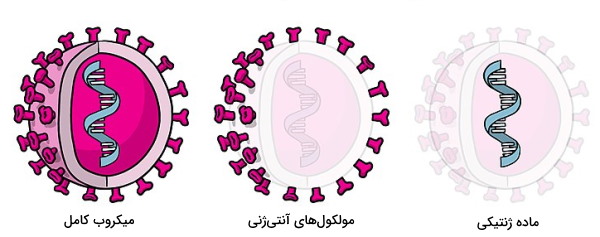
ایمنی اکتسابی غیر طبیعی فعال با ورود آنتیژنهای ایمن به بدن برای جلوگیری از ابتلا به عفونتهای ویروسی یا باکتریایی ایجاد میشود. در این روش آنتیژن ورودی با فعال کردن سیستم ایمنی، افزایش آنتیبادیهای محلول در خون و سلولهای خاطره بدن را برای موجه با پاتوژنهای مختلف آماده میکند. میکروب ضعیف شده، میکروب کشته شده، ذرات میکروبی (پروتئینها یا اسید نوکلئیک) و توکسوئید باکتری، پاتوژنهایی هستند که برای ایجاد ایمنی اکتسابی غیر طبیعی و فعال یا واکسیناسیون استفاده میشوند.
- میکروب ضعیف شده: میکروبهای ضعیفشده گونههای باکتریایی و ویروسی هستند که سیستم ایمنی انسان را فعال اما فرد را بیمار نمیکنند. برای ایجاد ویروس های ضعیفشده این میکروبها را در سلولهای غیرانسانی کشت میدهند تا جهشهای ایجاد شده پس از چند دوره تقسیم سلولی، بیماریزایی ویروس در بدن انسان از بین برود. به علاوه استفاده از روشهای DNA نوترکیب به ایجاد ویروسهای ضعیفشده کمک میکند. کاهش سرعت تکثیر ویروس در این روش سبب میشود بدن برای مدت طولانیتری در معرض آنتیژن قرار بگیرد و آنتی بادی بیشتری تولید کند. به علاوه مجموعه آنتیژن-MHCI با تحریک تمایز سلولهای T اولیه به لنفوسیت T کشنده، در تقویت سیستم ایمنی نقش دارد. واکسن تب زرد و فلج اطفال در این گروه قرار میگیرند.
- میکروب کشته شده یا ذرات میکروبی: در این روش بخش آنتیژنی میکروب (پلیساکارید، پروتئین، پپتیدها یا اسید نوکلئوئیک ویروسی) و معمولا به شکل کانجوگه با پروتئینها (ادجوانت) وارد بدن فرد سالم میشود. فعال شدن سیستم ایمنی در این روش با تولید آنتیبادیهای اوپسونیزاسیون همراه است. واکسن هپاتیت A و هاری ازجمله واکسنهای میکروب کشته شده و واکسنهای آنفولانزای B (کپسول پلیساکاریدی) و مننژیت (کپسول پلیساکارید چهار سویه نایسریا) ازجمله واکسنهای باقیماندههای سلولی هستند.
- توکسوئید: واکسنهای توکسوئید، اگزوتوکسینهای باکتریایی ضعیف شده هستند که با فعال کردن لنفوسیتهای B تولید آنتیبادیها خنثیکننده توکسین را تحریک میکنند. برای افزایش پاسخ ایمنی این پروتئینها معمولا همراه ادجوانتهای آلومینیومی (هیدروکسید یا سولفات آلومینیوم) وارد بدن فرد میشوند. ادجوانتها اثر ایمونوژنیک بسیار خفیفی دارند اما ایمنیزایی در برابر آنتیژن را افزایش میدهند. واکسنهای کزاز و دیفتری (DTaP و Td) در این گروه قرار میگیرند.
ایمنی اکتسابی غیر طبیعی غیر فعال
ایمنی اکتسابی غیرطبیعی و غیرفعال بر اثر تزریق سرم حاوی آنتیبادی یا ایمونوگلوبولینهای آماده ایجاد میشود. از آنجا که سلولهای B خاطره در این روش تولید نمیشوند، ایمنی ایجاد شده کوتاهمدت و شدت آن از روشهای فعال کمتر است. به علاوه وجود پروتئینهای سرم، احتمال افزایش واکنسهای حساسیت را افزایش میدهد.
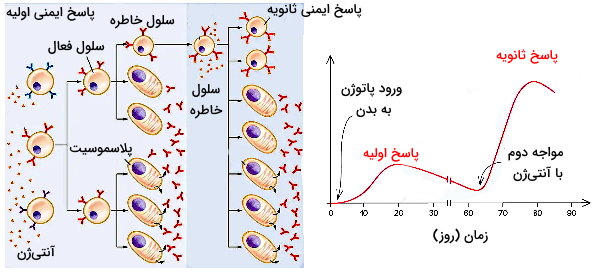
پاسخ ایمنی اولیه و ثانویه
یکی از مهمترین ویژگیهای ایمنی اکتسابی تفاوت شدت و سرعت ایجاد پاسخ ایمنی اولیه (اولین مواجه بدن با آنتیژن) و ثانویه (چندمین مواجه بدن با آنتیژن) است. در بخش قبلی توضیح دادیم که فعال شدن سلولهای B و T پس از اتصال آنتیژن-گیرنده با تقسیم سلولی این لنفوسیتها و تشکیل کلونی از سلولهای عملکننده و خاطره همراه است. سلولهای عملکننده در ایجاد پاسخ ایمنی اولیه و سلول های خاطره در ایجاد پاسخ ایمنی ثانویه شرکت میکنند.
- پاسخ ایمنی اولیه: برای ایجاد پاسخ ایمنی اولیه سلولهای B و T اولیه باید در مرحله اول آنتیژن را شناسایی کنند، سپس تکثیر شوند و در نهایت پاسخ ایمنی متناسب با آنتیژن جدید ایجاد کنند. به همین دلیل این پاسخ مععمولا با تاخیر (بین ۱۰ تا ۱۷ روز پس از ایجاد عفونت) ایجاد میشود. سلولهای عملکننده این پاسخ (پلاسموسیت و لنفوسیتهای T کشنده) نیمه عمر کوتاهی دارند و پس از حذف پاتوژن از بین میروند.
- پاسخ ایمنی ثانویه: در مواجه دوم با پاتوژن یکسان، سلولهای B و T خاطرهای که در ایمنی اولیه تولید شدهاند، مولکولهای آنتیژن را شناسایی میکنند. به همین دلیل پاسخ ایمنی سریعتر از ایمنی اولیه ایجاد میشود و افزایش تعداد سلولهای فعال میزان آنتیبادی تولید شده را افزایش میدهد. در نتیجه پاتوژن قبل از ایجاد علائم از بدن شما حذف خواهد شد. به علاوه سلولهای خاطره T (کمککننده و کشنده) در پاسخ ایمنی ثانویه سریع تر فعال میشوند. نیمه عمر سلولهای خاطره برخلاف سلولهای عملکننده چندین سال است.
ارتباط و تفاوت سیستم ایمنی اکتسابی با ایمنی ذاتی
با وجود اینکه سیستم ایمنی ذاتی و اکتسابی از مکانیسمهای مختلفی برای دفاع از بدن استفاده میکنند و در زمانهای متفاوتی فعال میشوند، بخشی از پاسخ آنها به عملکرد سلولها و مولکولهای شیمیایی مشترک وابسته است.
- سلولهای ایمنی ذاتی (ماکروفاژ و سلولهای دندریتی) علاوه بر فاگوسیتوز پاتوژنها، آنتیژن این سلولها را برای شناسایی راحتتر سیستم ایمنی اکتسابی در غشا قرار میدهند. در نتیجه به فعال شدن سریعتر ایمنی اکتسابی کمک میکنند.
- سلولهای ایمنی ذاتی با ترشح سایتوکاینهای مختلف (IL-12، IL4، IL10 و IL3) در فعالیت شدن و تمایز لنفوسیتهای T نقش دارند.
- آنتیبادیهای ایمنی اکتسابی با اوپسونیزاسیون مولکول آنتیژن، فعالیت فاگوسیتها و پروتئینهای مکمل ایمنی ذاتی را تسهیل میکنند.

با این وجود تفاوتهای اساسی بین این دو سیستم ایمنی وجود دارد. تنوع سلولهای ایمنی ذاتی (نوتروفیل، ماستسل، ائوزینوفیل، ماکروفاژ، بازوفیل، سلولهای کشنده طبیعی و سلولهای دندریتی) بیشتر از سلولهای ایمنی اکتسابی (لنفوسیتهای B و T) است. بسیاری از مکانیسمهای ایمنی ذاتی قبل از ورود پاتوژن در بدن وجود دارد (سد فیزیکی پوست، مخاط، لیزوزیم و پروتئینهای ضدمیکروبی)، اما مکانیسمهای دفاع اکتسابی پس از ورود پاتوژن به بدن فعال میشوند. پاسخ ایمنی اکتسابی منحصر به فرد و آنتیبادیهای ایجاد شده در آن بر اساس نوع آنتیژن متفاوت است. با این وجود سرعت ایجاد پاسخ ایمنی در ایمنی ذاتی بسیار بیشتر از ایمنی اکتسابی است.
جمع بندی
در این مطلب توضیح دادیم که ایمنی اختصاصی بخشی از سیستم ایمنی را بدن انسان را تشکیل میدهد که وظیفه ایجادد پاسخ اختاصی در برابر آنتیژنهای بیگانه و سلولهای توموری را بر عهده دارد. این سیستم به کمک ایمنی ذاتی بدن فعال میشود و تولید آنتیبادی یا القای آپوپتوز سلولهای آلوده به پاتوژن را از بین میبرد.