انواع کروماتوگرافی — از صفر تا صد

کروماتوگرافی روشی آزمایشگاهی است که برای جداسازی ترکیبات موجود در یک مخلوط گازی یا مایع استفاده میشود. در این روش، نمونه در سیالی حل و وارد دستگاه کروماتوگرافی میشود. در داخل دستگاه مولکول هدف با فاز ساکن برهمکنش میکند و در نتیجه این برهمکنش از سایر مولکولهای موجود در ترکیب جدا میشود. انواع مختلفی از کروماتوگرافی وجود دارد و در این مطلب سعی شده است توضیحاتی در خصوص انواع کروماتوگرافی از صفر تا صد ارائه شود.
کروماتوگرافی چیست ؟
«کروماتوگرافی» (Chromatography) یک روش مهم بیوفیزیکی است که اجزای تشکیلدهنده یک مخلوط را جداسازی، شناسایی و خالصسازی میکند. برای انجام آن، مخلوط گازی یا مایع در یک محلول که «فاز متحرک» (Mobile Phase) نام دارد حل میشوند، سپس از «فاز ساکن» (Stationary Phase) سیستم عبور میکنند.
ویژگیهای متفاوت ترکیبات موجود در نمونه باعث رفتار متفاوت آنها در فاز ساکن میشود، که در نتیجه آن اجزای مختلف نمونه از یکدیگر جدا میشوند.
تاریخچه کروماتوگرافی
نخستین بار «تسوت» (Mikhail Tsvet) در سال 1900 میلادی برای جداسازی رنگدانههای مختلف گیاه که شامل «کلروفیل» (Chlorophyll)، «کاروتن» (Carotenes) و «زانتوفیل» (Xanthophylls) هستند، روش کروماتوگرافی را ابداع کرد. نامگذاری کروماتوگرافی (به معنای رنگنگاری) به این دلیل بود که این رنگدانهها به صورت نوارهای مختلف رنگی (سبز، نارنجی و زرد) از یکدیگر جدا میشدند.
پیشرفت روشهای کروماتوگرافی را مدیون دو دانشمند به نامهای «مارتین» (Archer John Porter Martin) و «سینج» (Richard Laurence Millington Synge) هستیم. این دو دانشمند اصول و مبانی کروماتوگرافی جداسازی را پایهگذاری کردند و به همین دلیل جایزه نوبل شیمی را در سال 1952 دریافت کردند.
نتایج کار این دو دانشمند باعث به وجود آمدن انواع کروماتوگرافی شد که امروزه در آزمایشگاهها برای جداسازی مواد استفاده میشوند.

اصطلاحات کاربردی در انواع کروماتوگرافی
وقتی مطالب مربوط به کروماتوگرافی را مطالعه میکنیم با اصطلاحات تخصصی و مختلفی روبرو میشویم. برای راحتی بیشتر مطالعه این مطلب، برخی از اصطلاحات کاربردی در ادامه توضیح داده شدهاند.
- جزء سازنده یا «آنالیت» (Analyte): به ترکیبی که توسط کروماتوگرافی از سایر ترکیبات نمونه جدا میشود. همان مولکول هدف است.
- «کروماتوگرام» (Chromatogram): بخش دیداری کروماتوگرافی است. نموداری است که اجزای مختلف جدا شده از نمونه را به صورت پیک نشان میدهد. محور افقی در این نمودار نشاندهنده زمان بازداری است.
- «زمان بازداری» (Retention Time): به مدت زمانی گفته میشود که آنالیت از ستون کروماتوگرافی عبور میکند.
- «حجم بازداری» (Retention Volume): به حجمی از فاز متحرک گفته میشود که از زمان ورود نمونه تا زمان خروج مولکول هدف در ستون جریان داشته است.
- فاز متحرک یا حامل (Mobile phase or Carrier): محلولی که درون سیستم کروماتوگرافی حرکت میکند.
- فاز ساکن یا جاذب (Stationary Phase or Adsorbent): موادی که درون سیستم کروماتوگرافی در جای خود ساکن باقی میمانند.
- «شوینده» (Eluent): ترکیب شیمیایی خاصی از فاز متحرک است که به داخل دستگاه کروماتوگرافی وارد میشود و مولکولهای هدف را از ستون خارج میکند. برای مثال در کروماتوگرافی میل ترکیبی نیکل، «ایمیدازول» (Imidazole) شوینده است.
- «محصول شویش» (Eluate): سیالی که از ستون کروماتوگرافی خارج میشود و برای وجود آنالیت مورد بررسی قرار میگیرد.
تفاوت کروماتوگرافی مقدماتی با کروماتوگرافی تحلیلی چیست؟
«کروماتوگرافی مقدماتی» (Preparative Chromatography) به جداسازی و خالصسازی مولکول هدف گفته میشود و در آزمایشگاهها کاربرد دارد. در مقابل «کروماتوگرافی تحلیلی» (Analytical Chromatography) ابتدا مولکولها را جداسازی و شناسایی میکند، سپس میزان کمی آنها را نیز محاسبه میکند.
انواع کروماتوگرافی
انواع مختلفی از کروماتوگرافی بر اساس تفاوت در فاز ساکن و متحرک وجود دارد که در ادامه به توضیح آن میپردازیم.
- انواع کروماتوگرافی بر مبنای شکل بستر
- کروماتوگرافی ستونی (Column Chromatography)
- کروماتوگرافی سطحی (Planar Chromatography)
- کروماتوگرافی کاغذی (Paper Chromatography)
- کروماتوگرافی لایه نازک (Thin-layer Chromatography)
- انواع کروماتوگرافی بر اساس حالت فیزیکی فاز متحرک
- کروماتوگرافی گازی (Gas Chromatography)
- کروماتوگرافی مایع (Liquid Chromatography)
- کروماتوگرافی اندازه طردی یا ژل تراوایی (Gel-permeation Chromatography)
- کروماتوگرافی تبادل یونی (Ion-exchange Chromatography)
- کروماتوگرافی میل ترکیبی (Affinity Chromatography)
- کروماتوگرافی برهمکنش آبگریز (Hydrophobic Interaction Chromatography)
- کروماتوگرافی ترکیبی (Mixed-mode Chromatography)
- انواع کروماتوگرافی براساس روش جداسازی
- کروماتوگرافی تبادل یونی
- کروماتوگرافی اندازه طردی
- کروماتوگرافی جذب بستر گسترده (Expanded-bed Adsorption Chromatography)
کروماتوگرافی ستونی
پروتئینها در اندازه، شکل، بار خالص و ظرفیت اتصال متفاوت هستند. هر یک از این ویژگیها را میتوان بر اساس روشهای متفاوت کروماتوگرافی از یکدیگر تفکیک کرد. در میان روشهای مختلف، کروماتوگرافی ستونی بیشتر از سایرین مورد استفاده قرار میگیرد.
در این روش فاز ساکن درون یک ستون قرار گرفته است. ذرات تشکیلدهنده فاز ساکن میتوانند به صورت متراکم در داخل ستون قرار بگیرند تا بخش سیال از لابهلای آنها عبور کند یا در اطراف دیوارهها باشند تا یک مسیر برای عبور بخش سیال در وسط ستون وجود داشته باشد.
در روش کروماتوگرافی ستونی آنالیتهای مختلف نمونه براساس تفاوت در زمان بازداری از یکدیگر تفکیک میشوند.

کروماتوگرافی سطحی چیست ؟
این نوع کروماتوگرافی که به دو دسته لایه نازک و کاغذی تقسیم میشود، روشی است که آنالیتها براساس خاصیت مویینگی توسط حلال روی فاز ساکن حرکت میکنند و براساس برهمکنشی که با فاز ساکن دارند از یکدیگر جدا میشوند.
کروماتوگرافی لایه نازک
کروماتوگرافی لایه نازک (TLC) یکی از انواع کروماتوگرافیهای مایع است که در آن فاز ساکن (معمولا از جنس سیلیکون، آلومینیوم اکسید یا سلولز) به صورت یک لایه نازک روی یک بستر خنثی از جنس شیشه، فلز یا پلاستیک قرار گرفته است.
این روش یکی از ارزانترین انواع کروماتوگرافی را تشکیل میدهد چون بدون نیاز به دستگاههای گران قیمت تعداد زیادی نمونه (تا 70 نمونه) را در هربار استفاده از هم جدا میکند.
در این روش هم همانند روش کروماتوگرافی کاغذی، نمونه به صورت یک نقطه (معمولا بین 1 تا 5 میکرولیتر) روی لایه نازک قرار میگیرد سپس لایه نازک درون ظرفی که حاوی مقدار کمی حلال است ریخته میشود. حلال به دلیل خاصیت مویینگی از لایه نازک بالا میبرد و در مسیر خود نمونه را نیز حمل میکند.
در صورت استفاده از ژل سیلیکون در لایه نازک ترکیبات قطبی نمونه به آن متصل میشوند و در لایه حرکت نمیکنند اما بخش غیر قطبی توسط حلال حرکت میکند و بالا میرود. بر این اساس انالیتهای قطبی و غیرقطبی نمونه از هم جدا میشوند.
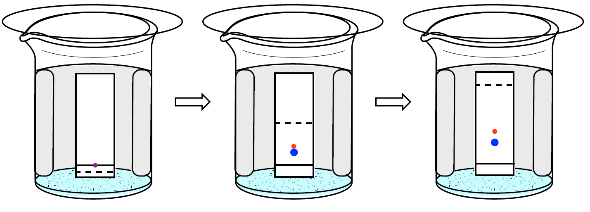
کروماتوگرافی کاغذی
در این روش نمونه به صورت یک نقطه روی کاغذ کروماتوگرافی قرار میگیرد سپس درون ظرفی حاوی مقدار کمی حالا گذاشته میشود. حلال کاغذ را خیس میکند و به سمت بالا حرکت میکند و در حین حرکت نمونه را هم با خود حمل میکند.
کاغذهای کروماتوگرافی معمولا از جنس سلولز یا ترکیبات قطبی هستند به همین دلیل ترکیبات قطبی نمونه در ابتدای مسیر به آنها متصل میشوند و در کاغذ حرکت نمیکنند ولی ترکیبات ناقطبی نمونه به سمت بالا همراه حلال حرکت میکنند و به این ترتیب از یکدیگر جدا میشوند.
کروماتوگرافی گازی
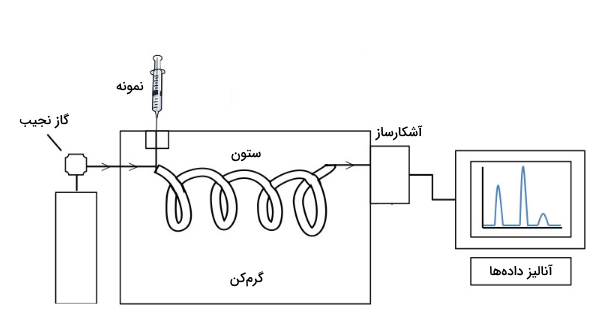
در کروماتوگرافی گازی (GC) ، فاز متحرک گاز نجیب (با گازهای درون نمونه واکنش نمیدهد.) است و فاز ساکن بستر مایع یا جامد است. آنالیت در ترکیب گازی باید جنبش لازم برای حرکت در ستون را داشته باشد. همچنین آنالیت باید نسبت به دمایی که در دستگاه کروماتوگرافی اعمال میشود، مقاوم باشد.
در کروماتوگرافی گازی مبنای جداسازی براساس جذب یا طبقهبندی کردن است. مبنای جذب وقتی استفاده میشود که آنالیتها به صورت متفاوت توسط فاز ساکن جامد جذب میشوند. این روش کروماتوگرافی گاز-جامد (GSC) نامیده میشود.
کروماتوگرافی گازی بر مبنای طبقهبندی کردن نیز به نام کروماتوگرافی گاز-مایع (GLC) شناخته میشود. در این حالت فاز ساکن مایعی غیرفرار است و آنالیتها بر اساس تفاوت در انتشار میان فاز ساکن و متحرک از یکدیگر جدا میشوند.
کروماتوگرافی مایع
در این نوع کروماتوگرافی آنالیتهای موجود در فاز متحرک مایع توسط ذرات جامد فاز ساکن از یکدیگر جدا میشوند. کروماتوگرافی مایع میتواند در ستون و یا یک سطح صاف انجام شود ولی در این بخش تمرکز ما روی انواع کروماتوگرافی مایع در ستون است.
کروماتوگرافی تبادل یونی
این نوع کروماتوگرافی براساس انجام پیوندهای الکترواستاتیک بین آنالیت مدنظر و فاز ساکن انجام میشود. بار الکتریکی فاز ساکن مخالف بار آنالیت است و به همین خاطر آنالیت با پیوند یونی به آن متصل میشود. وقتی آنالیت مورد نظر به فاز ساکن متصل شد، سایر مولکولها از ستون کروماتوگرافی شسته میشوند و تنها آنالیت هدف در ستون باقی میماند.
سپس با تغییر pH، مقاومت یونی و نمکهای یونی محلول درون ستون میتوان پیوند یونی بین آنالیت و ذرات فاز ساکن را از بین برد و آنالیت را جدا کرد. ذرات فاز ساکن که بار مثبت دارند، ماتریکس «تعویض آنیون» (Anion Exchanger) و ذرات فاز ساکن که بار منفی دارند ماتریکس «تعویض کاتیون» (Cation Exchanger) نامگذاری میشوند.
بار ترکیبات موجود در بافرهای مورد استفاده در این نوع کروماتوگرافی باید مشابه بار رزینها باشد. برای مثال بافرهای فسفات که برای خالصسازی پروتئینها استفاده میشوند به دلیل تفاوت در بار با رزینهای تعویض آنیون تداخل دارند.
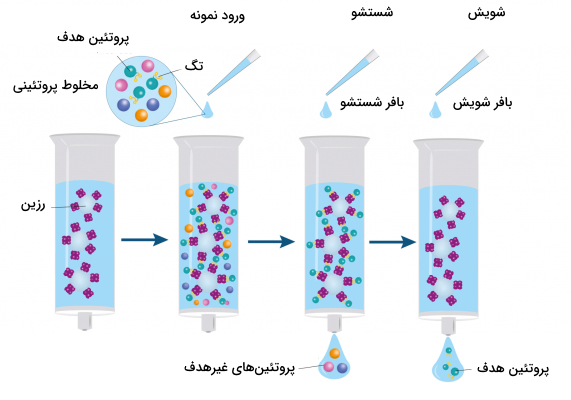
کروماتوگرافی میل ترکیبی
از این نوع کروماتوگرافی برای خالصسازی آنزیمها، هورمونها، آنتیبادی، نوکلئیکاسید و پروتئینهای خاص استفاده میشود. در این روش لیگاندهایی مکمل آنالیت هدف بر روی ذرات فاز ساکن قرار داده میشود که وقتی نمونه از روی آن عبور میکند آنالیت مورد نظر به لیگاند متصل شود و سایر مواد داخل نمونه از ستون کروماتوگرافی بیرون بیایند. پس از آن نیز آنالیتهای هدف با تغییر pH، مقاومت یونی و نمکهای یونی محلول درون ستون از لیگاند جدا میشوند.
کروماتوگرافی میل ترکیبی به دو نوع «زیستی» (Biospecific) و «غیرزیستی» (Nonbiospecific) تقسیم میشوند. در روش زیستی از لیگاندهایی استفاده میشود که به طور طبیعی وجود دارند. برای مثال اتصال آنتیبادی به پروتئین A یا اتصال هورمون به گیرندهاش واکنش زیستی و اتصال پروتئین به سوبسترا رنگی اتصال غیرزیستی است.
مثالهایی از کروماتوگرافی میل ترکیبی در بخش زیر آمده است.
- اتصال پلیهیستیدین به یون نیکل
- اتصال DNA به هپارین
- اتصال بیوتین به آویدین
کروماتوگرافی اندازه طردی
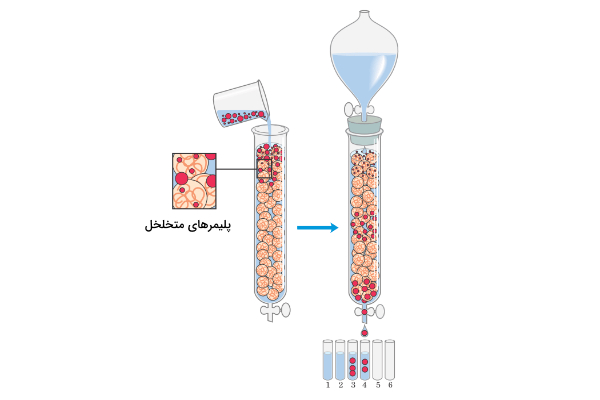
در این کروماتوگرافی مولکولها براساس تفاوت در اندازه از یکدیگر جدا میشوند. ژل موجود در فاز ساکن ستون متخلخل است و وقتی نمونه از روی آن عبور میکند، آنالیتهای کوچک به داخل منافذ میروند و از سرعت خروج آنها از ستون کاسته میشود. در حالیکه آنالیتهای بزرگتر بدون وارد شدن به منافذ از ستون خارج میشوند. سرعت خروج آنالیتهای بزرگ از کوچک بیشتر است و بر همین اساس تفکیک صورت میگیرد.
از این نوع کروماتوگرافی بیشتر برای نمکزدایی پروتئین و نوکلئیک اسید استفاده میکنند. مولکول هدف سریع خارج میشود ولی نمکهای کوچک درون منافذ رزین قرار میگیرند و دیر از ستون خارج میشوند. عوامل زیر در نحوه انجام کروماتوگرافی اندازه طردی تاثیر میگذارند.
- اندازه رزینها و منافذ آنها: به طور کلی هرچه اندازه منافذ کوچکتر باشد میزان تفکیک افزایش مییابد.
- ابعاد ستون: با افزایش طول ستون میزان تفکیک افزایش مییابد.
- متراکم بودن ستون: بیش از حد متراکم کردن ستون منجر به نشست و جمعشدن منافذ میشود که قدرت تفکیک را کاهش میدهد. ستونی که به اندازه کافی متراکم نشده باشد نیز باعث به وجود آمدن پیکهای پهن میشود که باز هم قدرت تفکیک را کاهش میدهد.
- سرعت جریان: سرعت جریان متوسط بیشترین میزان تفکیک را ایجاد میکند. سرعت متوسط به مولکولها زمان کافی میدهد که در منافذ رزینها وارد شوند و تفکیک به خوبی انجام شود. سرعت جریان خیلی پایین نیز به دلیل گسترده شدن پیکها تفکیک را کاهش میدهد.
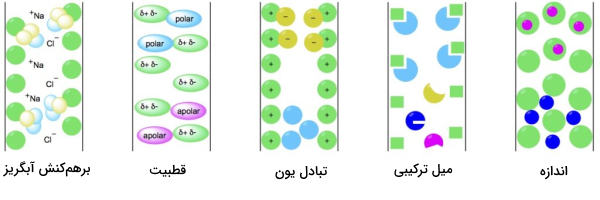
کروماتوگرافی برهمکنش آبگریز
در این روش آنالیتهای نمونه که دارای گروههای آبدوست و آبگریز هستند در بافر نمکی قرار میگیرند و به داخل ستون وارد میشوند. نمک موجود در بافر حلالیت املاح نمونه را کاهش میدهد. وقتی حلالیت کاهش پیدا کند بخشهای آبگریز آنالیتها ظاهر میشوند و جذب ذرات فاز ساکن ستون میشوند.
هر چه مولکول آبگریزتر باشد به نمک کمتری برای اتصال نیاز دارد. بر همین اساس شیب غلظتی از نمک در بافر ایجاد میکنند و آنالیتها را براساس میزان آبگریز بودن از یکدیگر جدا میکنند. عوامل زیر فاکتورهای مهم در انجام کروماتوگرافی برهمکنش آبگریز هستند.
- لیگاند: جذب پروتئین به لیگاند به نوع لیگاند قرار گرفته در فاز ثابت بستگی دارد. به طور کلی، زنجیره آلکیل لیگاند باعث پیوند آبگریز میشود در صورتی که گروههای آریل لیگاند، هم پیوند «آروماتیک» (Aromatic) و هم آبگریز را ممکن میکند.
- pH: بخش متحرک کروماتوگرافی برهمکنش آبگریز معمولا در بازه pH 5 تا 7 قرار دارد و با پتاسیم و سدیم فسفات خاصیت بافری گرفته است. به طور کلی، با افزایش میزان pH، قدرت برهمکنش بین پروتئین و لیگاند به دلیل تیتراسیون گروههای اسیدی و افزایش باز پروتئین، کاهش مییابد.
- دما: میزان تمایل به برهمکنش آبگریز بین پروتئین و لیگاند با افزایش دما، بالا میرود. البته به دلیل اینکه اثر دما روی پیوندهای آبگریز قابل پیشبینی نیست، معمولا این عامل را ثابت نگه میدهند.
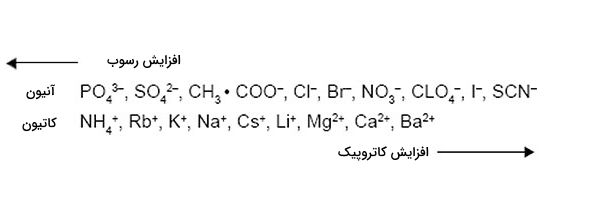
- غلظت نمک: اضافه کردن نمکهای ساختاری به بافر متعادلسازی و نمونه میزان برهمکنشهای بین لیگاند و پروتئین را افزایش میدهد. البته با افزایش میزان نمک میزان اتصال پروتئینهای متصل شده افزایش مییابد و احتمال رسوب پروتئین بالا میرود. تصویر زیر سری «هافمیستر» (Hofmeister) است که تاثیر برخی از آنیونها و کاتیونها را روی رسوب پروتئین نشان میدهد.
کروماتوگرافی ترکیبی
در روش کروماتوگرافی ترکیبی (MM) لیگاند با انواع متفاوتی از برهمکنشها شامل تمایلی، آبگریز و تعویض یونی به آنالیت متصل میشود. ترکیب کردن این روشها با هم در کروماتوگرافی باعث خالصسازی بهتر پروتئین میشود.
روشهای شناسایی در انواع کروماتوگرافی
شناسایی ترکیباتی که از ستون کروماتوگرافی خارج میشوند توسط آشکارسازها صورت میگیرد. این آشکارها میتوانند به صورت عمومی تمامی ترکیبات را حس کنند (بدون تشخیص نوع آنها) یا میتوانند به صورت اختصاصی تعداد کمی از ترکیبات را به طور کامل شناسایی کنند.
بعضی از آشکارسازها به صورت غیرمخرب وجود ترکیبات را آشکار کنند که در این صورت از ترکیبات میتوان دوباره استفاده کرد. برای مثال آشکارسازهایی که جذب نور را توسط ترکیبات اندازهگیری میکنند. بعضی از آشکارسازها نیز برای شناسایی ترکیبات موجود آنها را به طور کامل تخریب میکنند.
ویژگی آشکارسازها در انواع کروماتوگرافی
سه ویژگی برای آشکارسازها وجود دارد.
- «کمترین بازه شناسایی» (Lower Limit of Detection): کمترین میزانی از ماده که آشکارساز قدرت تشخیص آن را دارد و آن را از نویزهای موجود در دستگاه جدا میکند.
- «حساسیت آشکارساز» (Sensitivity): میزانی از تغییرات در شدت سیگنال آشکارساز که در نتیجه تغییر در میزان آنالیت به وجود میآید.
- «بازه خطی» (Linear Range): شدتی از سیگنال که به نسبت میزان آنالیت تغییر میکند. برای مثال اگر میزان آنالیت دوبرابر شد شدت سیگنال نیز دوبرابر شود.
آشکارسازهای کروماتوگرافی گازی
آشکارسازهای کروماتوگرافی گازی بخار مولکولها را در فاز متحرک تشخیص میدهند. رایجترین آشکارسازهای گازی به شرح زیر هستند.
- آشکارساز «رسانای گرمایی» (Thermal Conductivity): رایجترین آشکارساز کروماتوگرافی گازی است که میتواند آنالیتهای گازی و ترکیبات آلی را تشخیص دهد. حساسیت بالایی ندارد.
- آشکارساز «شعله یونیزان» (Flame Ionization): این آشکارساز در هنگام کار با ترکیبات آلی حساسیت بالایی دارد.
- آشکارساز «ترموآیکونیک» (Thermo Iconic): برای بررسی وجود و میزان ترکیبات گازی که دارای اتمهای فسفر یا نیتروژن هستند مورد استفاده قرار میگیرد.
- آشکارساز «شعله فتومتریک» (Flame Photometric): ترکیبات گازی که دارای اتمهای فسفر یا گوگرد هستند را تشخیص میدهد.
آشکارسازهای کروماتوگرافی مایع
اگر مولکولهایی که از ستون کروماتوگرافی مایع خارج میشوند، دارای ساختارهایی باشند که نور را در طول موج خاصی جذب میکند، آشکارساز میتواند نور در طول موج خاص را به محلول خارجشده از ستون بتاباند. در این صورت، کاهش شدت نوری که از محلول میگذرد، نشاندهنده میزان مولکول خاص است.
- شرایط استفاده از آشکارسازهای نوری به شرح زیر است.
- مولکول هدف باید دارای ساختاری باشد که طولموج خاص را جذب کند.
- فاز متحرک باید شفاف باشد که نور از آن عبور کند.
- منبع نور باید بتواند طول موجی که توسط مولکول هدف جذب میشود را تولید کند و آشکارساز بتواند طول موج را تفسیر کند.
گاهی اوقات مولکول هدف طول موج خاصی را دریافت میکند و طول موج دیگری را بازتاب میکند. در این موارد بهتر است که از آشکارسازهای فلورسنتی استفاده کرد. به طور کلی، آشکارسازهای مورد استفاده در کروماتوگرافی مایع به شرح زیر هستند.
- آشکارساز «فرابنفش» (Ultraviolet): رایجترین آشکارساز است که میزان جذب مولکولهای خروجی از ستون را به طور پیوسته در یک یا چند طولموج خاص در بازه فرابنفش ارزیابی میکند.
- آشکارساز «فلورسنت» (Fluorescence): یک یا چند طول موج خاص را به مولکولها میتابانند و طولموج فلورسنتی بازتاب شده از مولکول را ارزیابی میکنند.
- آشکارساز «ضریب شکست» (Refractive Index Detector | RI): این آشکارساز کمترین دقت را دارد و بیشتر برای بررسی پلیمرها در کروماتوگرافی اندازه طردی استفاده میشود. در این روش به صورت پیوسته ضریب شکست محلول خروجی از ستون اندازهگیری میشود.
- آشکارساز «جریان رادیو» (Radio Flow): رادیواکتیویتی محلول خروجی از ستون را میسنجد. در صورتی که «کوکتل درخشان» (Scintillation Cocktail) به طور پیوسته به محلول اضافه شود مولکولها را تخریب میکند.
- آشکارساز «کایرال» (Chiral): زاویه چرخش نوری را بررسی میکند. فقط زمانی استفاده میشود که مولکول هدف خاصیت کایرال داشته باشد.
- «بررسی رسانایی» (Conductivity Monitor): رسانایی محلول را میسنجد و وقتی استفاده میشود که محلول رسانایی داشته باشد (آب یا الکل).
کروماتوگرافی همراه با طیف سنج جرمی
«طیف سنجی جرمی» (Mass Spectrometry) یک ابزار تحلیلی است و مولکولهای خارجشده از ستون کروماتوگرافی را بررسی میکند. این ابزار محلول خروجی را با گرمکن بخار میکند، سپس مولکولها را درون یک اتاقک با فشار پایین با الکترون بمباران میکند تا ذرههای بارداری ایجاد کند که در جرم با یکدیگر متفاوت هستند.
این ذرات باردار تحت میدان مغناطیسی منحرف میشوند. میزان انحراف ذرات باتوجه به جرم و بار آنها متفاوت است و از روی آن میتوان ذرات را شناسایی کرد.
کروماتوگرافی مایع به چه صورتی انجام میشود؟
به طور کلی انواع روشهای کروماتوگرافی مایع به ترتیب از مراحل زیر برای جداسازی آنالیتها از یکدیگر استفاده میکنند.
- متعادلسازی ستون
- ورود نمونه
- شستن ستون (Washing)
- استفاده از شوینده برای جداسازی مولکول هدف از ستون (Elution)
- شستن نهایی ستون
- بازسازی ستون

متعادلسازی ستون
اغلب روشهای کروماتوگرافی مایع با متعادلسازی ستون شروع میشوند. بافری که با آنالیت هدف و رزینهای درون ستون (فاز ساکن) سازگار است، از ستون عبور داده میشود. روش مرسوم متعادلسازی عبور دادن بافر متعادلسازی به میزان 5 تا 10 برابر حجم ستون است.
برای مثال، برای اتصال پروتئینها به رزین در کروماتوگرافی برهمکنش آبگریز، به بافری با قدرت یونی بالا نیاز است. به همین دلیل قبل از اضافه کردن نمونه به ستون، رزینها با بافری با قدرت یونی بالا متعادلسازی میشوند.
ورود نمونه
پس از مرحله متعادلسازی نمونه به ستون اضافه میشود. معمولا نمونه در بافری با ترکیباتی مشابه بافر متعادلسازی حل میشود تا میزان برهمکنش پروتئین هدف با رزینهای ستون به بیشترین حد خود برسد.
نمونه میتواند به صورت دستی یا با استفاده از پمپ به ستون وارد شود. نکتهای که در خصوص غلظت نمونه وجود دارد این است که رزینها ظرفیت محدودی برای اتصال به نمونه دارند و بالا بردن غلظت نمونه الزاما باعث بهبود نتایج نمیشود.
شستشوی ستون
پس از اینکه نمونه به ستون اضافه شد و اتصالات بین آنالیت هدف و رزینها برقرار شد، برای جدا کردن مولکولهایی که هدف کاربر نیست و اتصالات ضعیفی با رزین دارند از بافر شستشو استفاده میشود.
این بافر میتواند از جنس بافر متعادلسازی باشد یا شامل ترکیباتی باشد که پیوندهای ضعیف را از بین ببرد. شستشوی ستون با چندین برابر حجم ستون انجام میشود تا جایی که هیچ مولکولی از نمونه در محلول خروجی از ستون شناسایی نشود.
اگر از کروماتوگرافی استفاده میکنید که آشکارساز UV دارد و آنالیت از جنس پروتئین است، شستشوی ستون تا مرحلهای انجام میشود که جذب پروتئین در طول موج 280 نانومتر به خط پایه برگردد.
جداسازی از ستون
پس از اینکه تمام برهمکنشهای غیراختصاصی و ضعیف با رزین از بین رفت، تنها آنالیتهایی که پیوند قوی با رزین داشته باشند به آن متصل باقی میمانند. در این مرحله با تغییر ترکیبات بافر، اتصالات قوی بین آنالیت هدف و رزین از بین میرود و آنالیت از ستون خارج میشود.
- در کروماتوگرافی تعویض یونی، اتصال قوی بین پروتئینها و رزین با تغییر قدرت یونی بافر یا تغییر pH تخریب میشود.
- در کروماتوگرافی برهمکنش آبگریز این پیوندهای قوی با کاهش قدرت یونی بافر از بین میروند.
- در کروماتوگرافی میل ترکیبی، با افزودن لیگاند رقابتی به بافر پیوند قوی بین آنالیت و لیگاند از بین میرود.همچنین در صورت اتصال با تگ اتصال (Affinity Tag) افزودن نمک یا تغییر pH، آنالیت هدف جدا میشود.
شرایط جداسازی میتواند به صورت یک مرحلهای یا به صورت تدریجی ایجاد کرد. معمولا برای جداسازی آنالیت از رزین ابتدا از روش تدریجی استفاده میکنند تا میزانی از تغییر بافر که باعث جداشدن آنالیت از رزین میشود را دریابند. پس از آن برای کروماتوگرافیهای بعدی از تغییر یکمرحلهای بافر در شرایط بهینه استفاده میکنند.
توجه کنید که در بین کروماتوگرافیهای مایع، از آنجایی که تفکیک در روش کروماتوگرافی اندازه طردی براساس برقراری پیوند بین رزین و آنالیت نیست، نیازی به استفاده از بافر جداسازی نیست.
شستن نهایی ستون
پس از اینکه آنالیت هدف از ستون خروج شد، با افزایش قدرت یونی بافر شستشو، تمامی پیوندهایی که همچنان بین رزین و اجزای نمونه وجود دارد، از بین میرود. این مرحله ستون را برای استفاده مجدد آماده میکند.
بازسازی ستون
در مرحله آخر ستون دوباره با بافر متعادلسازی برای استفاده مجدد پر میشود یا در صورت عدم نیاز به ستون، بافر نگهداری به آن اضافه میشود.
به چه عواملی در حین انجام انواع کروماتوگرافی مایع باید توجه کرد؟
چهار عامل مهم در هنگام خالصسازی پروتئینها با استفاده از انواع کروماتوگرافی مایع وجود دارد که در ادامه توضیح داده میشوند.
- «قدرت تفکیک» (Resolution): به میزان جداشدن پیکها از هم در کروماتوگرام گفته میشود. هدف کروماتوگرافی جدا کردن مولکول هدف است و که با تفکیک پیکها از هم به آن میرسیم. عواملی مثل نوع رزین، ترکیبات بافر شستشو، بافر جداکننده، بافر متعادلسازی، میزان سرعت جریان، و حجم نمونه روی تفکیک پیکها تاثیر میگذارد.
- «یکپارچگی نمونه» (Sample Integrity): در برخی موارد پس از جداسازی نمونه از آن برای مصارفی مثل واکنش آنزیمی یا کریستالوگرافی استفاده میکنند. پروتئینی که برای این اهداف جدا میشود باید شکل طبیعی خود را حین کروماتوگرافی حفظ کند. عواملی مثل انتخاب بافر صحیح، اضافه کردن مهارکننده پروتئاز و سرعت بالای انجام کروماتوگرافی میتواند به حفظ ساختار پروتئین کمک کند.
- «بازدهی» (Yield): اگر هدف از کروماتوگرافی خالصسازی پروتئین برای استفاده بعدی از آن است، بازده جداسازی پروتئین هدف اهمیت پیدا میکند.
- «خلوص نمونه» (Sample Purity): در برخی موارد هدف از کروماتوگرافی دریافت نمونه خاص است. باید توجه داشت در مواردی که دو یا چند ترکیب همراه هم از ستون جدا میشوند، نمیتوان به نمونه خالص دسترسی پیدا کرد. یکی از روشهای خلوص نمونه بعد از کروماتوگرفی استفاده از روش آزمایشگاهی ژل الکتروفورز است.
جمعبندی
در این مطلب با انواع کروماتوگرافی به عنوان یک روش تشخیصی برای جداسازی اجزای یک ترکیب آشنا شدیم. روشهای کروماتوگرافی براساس نحوه جداسازی مواد، نوع بستر و همچنین حالت فیزیکی به انواع مختلفی تقسیم میشوند. از روشهای کروماتوگرافی میتوان برای خالصسازی مواد و همچنین شناسایی و اندازهگیری میزان یک ماده خاص در ترکیب استفاده کرد. برای شناسایی مولکول هدف بعد از انجام کروماتوگرافی آشکارسازهایی در سیستم قرار داده میشوند که وجود مولکول هدف را بررسی کند.









ممنونم خانم دکتر؛ بسیار معلومات مفید.
بسیار معلومات مفید