پیوند پپتیدی چیست؟ – فرمول، ویژگی و انواع – به زبان ساده
پروتئینها مهمترین مولکولهای عملکردی و ساختاری در موجودات زنده هستند. تقریبا تمام واکنشهای زیستی وابسته به پروتئينها و تشکیل پروتئينها وابسته به ایجاد پیوند پپتیدی بین آمینواسیدها است. این مولکولهای زیستی از کنار هم قرار گرفتن آمینواسیدها بهوسیله پیوند پپتیدی تشکیل می شوند. در این مطلب علاوه بر پاسخ به این سوال که پیوند پپتیدی چیست به نحوه تشکیل و ویژگیهای آن نیز میپردازیم.
- یاد میگیرید چگونه آمینواسیدها با پیوند پپتیدی به هم متصل میشوند.
- میآموزید واکنش آبگیری و مکانیسم الکترونی برای تشکیل پیوند پپتیدی چگونه است.
- میتوانید نقش ژنوم، ریبوزوم و «rRNA» در ساخت زنجیرههای پپتیدی را تشریح کنید.
- با ویژگیهای فیزیکوشیمیایی پیوند پپتیدی و اهمیت رزونانس آن آشنا میشوید.
- نقش آنزیمها و مکانیسم هیدرولیز در شکستن پیوند پپتیدی را یاد خواهید گرفت.
- میآموزید ساختار ثانویه پروتئینها چگونه با زاویههای پپتیدی شکل میگیرد.
پیوند پپتیدی چیست ؟
پیوند پپتیدی نوعی از پیوند کووالانسی است که بین دو آمینواسید تشکیل میشود. موجودات زنده از این پیوند برای کنار هم قرار دادن تعداد زیادی آمینواسید و تشکیل پروتئین - مهمترین مولکول زیستی عملکردی - استفاده میکنند. به همین دلیل تشکیل پیوند پپتیدی برای ادامه حیات تمام موجودات زنده ضروری و نحوه تشکیل آن تقریبا یکسان است.
پیوند پپتیدی چگونه تشکیل می شود ؟
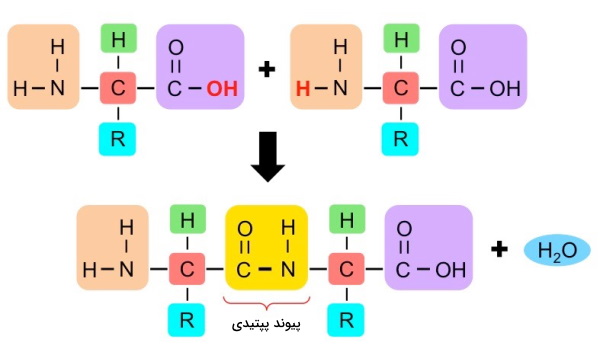
پیوند پپتیدی مهمترین پیوند در تشکیل ساختار اول و خطی پروتئین است و در واکنش تراکمی «آبگیری» (Dehydration Reaction) ایجاد میشود. در تشکیل این پیوند گروه عاملی کربوکسیل از یک آلفا آمینواسید با گروه آمین آمینواسید دیگر وارد واکنش میشود و هیدروژن (H) گروه آمین با هیدروکسیل (OH)، یک مولکول آب تشکیل میدهد. به همین دلیل تعداد مولکولهای آب تشکیل شده از سنتز یک پلیپپتید n-1 (n تعداد آمینواسیدها) است. از آنجا که آمینواسیدها تعدادی از اتمهای خود را در تشکیل پیوند از دست میدهند به آنها باقیمانده آمینواسید گفته میشود. چهار اتم شرکتکننده در تشکیل این پیوند () گروه پپتیدی نام دارند.
واکنش تشکیل پیوند پپتیدی چیست ؟
دو اتم اکسیژن متصل به کربن کربوکسیل، الکترونهای این اتم را به سمت خود میکشند. به همین دلیل اتم کربن بار جزئی مثبت دارد. از طرفی نیتروژن در لایه ظرفیت خود الکترونهایی دارد که درگیر پیوند نیستند. در نتیجه حمله نوکلئوفیل نیتروژن به کربوکسیل سبب جدا شدن هیدروکسیل و تشکیل پیوند بین نیتروژن و کربن میشود.
تشکیل پیوند پپتیدی در ریبوزوم
اساس تمام پروتئينها، تشکیل پیوند پپتیدی بین ۲۰ نوع آمینواسید و نحوه قرارگرفتن آنها کنار هم است. اما سنتز این پلیمرهای زیستی از زیرواحدهای آمینواسیدی بدون دخالت آنزیمها کار دشواری است. به همین دلیل برای استفاده بهینه از انرژی زیستی، سیستم دقیقی در سلول برای تشکیل این پیوند برنامهریزی شده است.
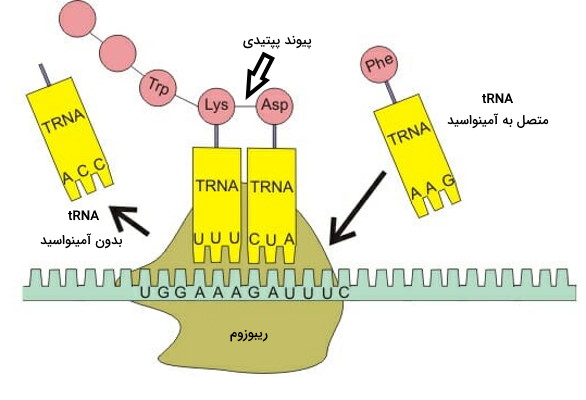
- کدونهای موجود در ژنوم تمام موجودات زنده، نوع آمینواسیدهای موجود در پروتئينها را مشخص میکند.
- کدونها، بازهای آلی موجود در DNA هستند که طی فرایند رونویسی به mRNA تبدیل میشوند.
- در مرحله بعد و طی فرایند ترجمه، هر آمینواسید به وسیله tRNA مخصوص خود به جایگاه فعال ریبوزوم منتقل میشود.
- ریبوزوم یک ماشین مولکولی است که از پروتئين و rRNA تشکیل میشود و کمک میکند هر tRNA به بخش مکمل خود در مولکول mRNA متصل شود.
- rRNA در ریبوزم، بخش آنزیمی این مولکول است که تغییر کنفورماسیون آن تشکیل پیوند پپتیدی بین دو آمینواسید در جایگاه P ریبوزوم را تسهیل میکند. پس از تشکیل هر پیوند ریبوزوم به اندازه یک کدون روی mRNA جابهجا میشود.
- تشکیل پیوند پپتیدی بین آمینواسیدها تا رسیدن به یکی از کدونهای پایان ادامه دارد و در نهایت پلیپپتید تولید شده از ریبوزوم خواهد شد.
ویژگی های پیوند پپتیدی چیست ؟
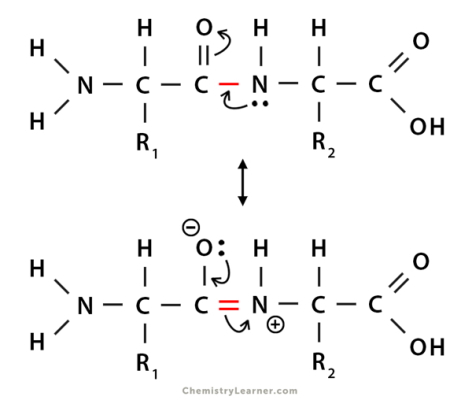
پیوند بین کربن و نیتروژن در پیوند پپتیدی با پیوند این عناصر در بخشهای دیگر آمینواسید (زنجیره جانبی) تفاوت دارد. در این پیوند الکترونگاتیوی نیتروژن بیشتر از کربن است و تمایل دارد الکترونهای لایه ظرفیت کربن را به سمت خود بکشد. به همین دلیل پیوند دوگانه بین کربن و اکسیژن رزونانس دارد و پیوند پپتیدی (CO-NH) ویژگیهای یک پیوند دوگانه را نشان میدهد.
- طول پیوند C-N در پیوند پپتیدی کوتاهتر از طول C-N معمولی و بلندتر از طول است.
- پیوند پپتیدی انعطاف کمتری نسبت به پیوند یگانه دارد و حول محور کربن-نیتروژن نمیچرخد.
- گروههای پپتیدی در یک صفحه قرار دارند.
- این پیوند قوی بهوسیله گرما یا نمک غلیظ شکسته نمیشود. به همین دلیل در تکنیکهای مولکولی برای بازکردن ساختار سوم و دوم پروتئين از محلول نمک و افزایش دما استفاده میکنند.
- این پیوند را میتوان بهوسیله اسید یا باز قوی در حضور گرما و زمان بسیار طولانی، در محیط آزمایشگاه شکست. در بدن موجودات زنده، آنزیمهای پروتئاز وظیفه تجزیه پیوند پپتیدی را بر عهده دارند.
- اتمهای نیتروژن و اکسیژن درگیر در پیوند پپتیدی، به ترتیب بار مثبت و منفی نسبی دارند.
- هیدروژن و اکسیژن متصل به نیتروزن و کربن درگیر پیوند پپتیدی، به حالت ترانس (در دو جهت مختلف) قرار میگیرند.
شکستن پیوند پپتیدی
پروتئولیز به فرایند تجزیه پروتئين به پپتیدهای کوچک و آمینواسیدهای سازنده آن گفته میشود. اضافه کردن آب یا هیدرولیز واکنشی است که بهوسیله آن میتوان پیوند پپتیدی بین آمینواسیدها را شکست. انرژی گیبس آزاد شده از شکسته شدن هر پیوند در این فرایند ۸ تا ۱۶ است.
اما نیمهعمر هیدرولیز پیوند پپتیدی در دمای ۲۵ و بدون حضور آنزیمها ۳۵۰ تا ۶۰۰ سال است! به همین دلیل در بدن موجودات زنده، از پروتئازها برای شکستن این پیوند استفاده میکنند.
آنزیمهای تجزیه کننده پپتیدها در بدن
در بدن موجودات زنده آنزیمهای متعددی وجود دارند که تجزیه پروتئینها به اولیگوپپتیدها و آمینواسیدها را کاتالیز میکنند. پپسین، تریپسین، کموتریپسین و الاستاز ازجمله آنزیمهایی هستند که پروتئینها را به پپتیدهای کوچک تجزیه میکنند و کربوکسیپپتیدازها، آمینوپپتیدازها و دیپپتیدازها آنزیمهایی هستند که با شکستن پیوند پپتیدی، پپتیدهای کوچک را به زیرواحدهای آمینواسیدی تجزیه میکنند.
- تریپسین: پیوند پپتیدی پس از آرژینین و لیزین (دارای بار مثبت) را میشکند.
- کموتریپسین: پیوند پپتیدی پس از فنیل آلانین، تیروزین و تریپتوفان (آروماتیک) را میشکند.
- الاستاز: پیوند پپتیدی پس از آمینواسیدهای ناقطبی و کوچک ازجمله گلایسین و آلانین را میشکند.
روشهای شیمیایی تجزیه پیوند پپتیدی
سیانوژن بروماید (BrCN) یکی از ترکیبهای شیمیایی و غیرآلی است که برای تجزیه پیوند پپتیدی و شکستن پروتئین به قطعات کوچکتر از آن استفاده میشود. این ترکیب پیوند باقیمانده متیونین در انتهای C پپتیدها را تجزیه میکند.
انواع پپتید
پپتیدها زنجیرهای آمینواسیدهایی هستند که بهوسیله پیوند پپتیدی به هم متصل میشوند. به کربوکسیل آزاد پپتید انتهای C و به آمین آزاد آن انتهای N میگویند. گروهبندی پپتیدها بر اساس تعداد آمینواسیدهایی که در ساختار آنها شرکت میکنند.
- دیپپتید: دو آمینواسید
- تریپپتید: سه آمینواسید
- تتراپپتید: چهار آمینواسید
- اولیگوپپتید: کمتر از ۱۰ آمینواسید
- پلیپپتید: بین ۱۰ تا ۱۰۰ آمینواسید
- ماکروپپتید: بیش از ۱۰۰ آمینواسید
پپتیدهای طبیعی بر اساس نوع و تعداد آمینواسیدهایی در ساختار آنها شرکت میکنند انواع مختلفی دارند. در بدن انسان علاوه بر پروتئینها اولیگوپپتیدها و پلیپپتیدهای متنوعی وجود دارند که در فرایندهای زیستی سلولها شرکت میکنند.
- گلوتاتیون: ترپپتیدی است که از گلوتامیکاسید، سیستئن و گلایسین در کبد تشکیل و به بافتهای دیگر منتقل میشود. این پپتید در ترمیم بافت نقش دارد و به واکنشهای سیستم ایمنی کمک میکند. نکته قابل توجه در این پپتید این است که گروه کربوکسیل زنجیره جانبی گلوتامیکاسید در تشکیل پیوند پپتیدی با سیستئين شرکت میکند. این تریپپتید علاوه بر پستانداران در باکتری ای کولی وجود دارد.
- هورمون آزادکننده تریتروپین (Thyrotropin-Releasing Hormone | TRH): این تریپپتید یکی از هورمونهای ترشح شده از هیپوتالاموس است که از گلوتامیکاسید، هیستیدین و پرولین تشکیل شده است. این هورمون، ترشح هورمون تحریککننده غده تیروئید را تنظیم میکند. این هورمون ۲ دقیقه پس از ترشح از بین میرود و بر سلولهای نزدیک اثر می گذارد.
- آنژیوتانسین II: اولیگوپپتید ۸ آمینواسیدی است که از آسپارتات، آرژینین، تیروزین، ایزو.لوسین، هیستیدین، پرولین و فنیل آلانین تشکیل میشود. این هورمون به همراه رنین در تنظیم فشار اسمزی بدن و جذب آب از نفرونهای کلیه نقش دارد.
- «برادی کینن» (Bradykinen): اولیگوپپتید است که از دو آرژینین، دو پرولین، دو فنیل آلانین و یک سرین، پرولین و گلایسین تشکیل میشود. این پپتید پاسخ التهابی در بدن را افزایش میدهد.
- اکسیتوسین: یکی از هورمونهای پپتیدی است که از ۹ آمینواسید تشکیل میشود. ترشح این هورمون از هیپوتالاموس انقباض ماهیچه رحم را تنظیم میکند.
- سوماتوستاتین: اولیگوپپتید ۱۴ آمینواسیدی و مهارکننده ترشح هورمون رشد است.
- اندوتلین: ساختار این اولیگوپپتید ۲۱ آمینواسیدی شبیه سم برخی گونههای مار است و سبب انقباض ماهیچه صاف دیواره رگها میشود.
- گلوکاگون: یکی از هومونهای پپتیدی است که بهوسیله سلولهای آلفا در پانکراس تولید میشود. این اولیگوپپتید ۲۹ آمینواسیدی همراه انسولین به تنظیم قند خون کمک میکند. گلوکاگون سه عملکرد اصلی در بدن دارد.
- تجزیه گلوکاگون به گلوکز در سلولهای کبدی را تحریک میکند.
- مسیرهای گلیکوژنزِ تبدیل آمینواسید به گلوکز را فعال میکند.
- آنزیمهای تجزیهکننده تریگلیسیریدها به اسید چرب را فعال میکند.
پپتیدهای حلقوی
تشکیل پیوند پپتیدی بین کربوکسیل یا آمین زنجیره جانبی و گروه آمین یا کربوکسیل اصلی آمینواسیدها سبب تشکیل پپتیدهای حلقوی میشود. پپتیدهای حلقوی معمولا در میکروبها تشکیل میشوند و علاوه بر L آمینواسیدها، ایزمرهای D و آمینواسیدهای غیراستاندارد ازجمله اورنیتین در ساختار آنها شرکت میکنند.
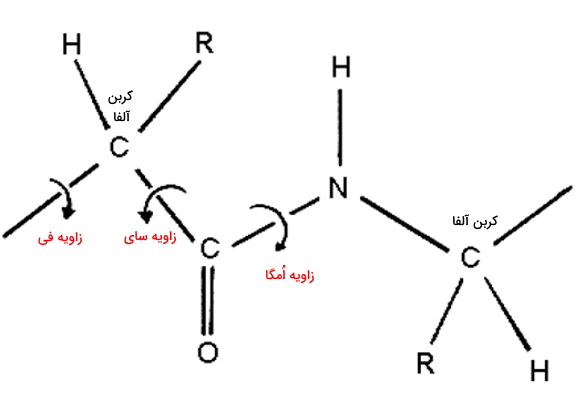
زوایای گروههای پپتیدی
سه «زاویه چرخشی» (Torsion Angles) اصلی در تشکیل پپتیدها دخالت دارند. فی ()، سای () و امگا به ترتیب زاویه چرخشی پیوند کربن-نیتروژن در پیوند پپتیدی، پیوند بین کربن متصل به اکسیژن و کربن آلفا، و کربن آلفا با آمینواسید کناری هستند. زاویه امگا تقریبا در تمام پپتیدها ۱۸۰ درجه است به جز در مواقعی که یکی از آمینواسیدهای شرکتکننده در پیوند پپتیدی پرولین باشد. در این صورت زاویه امگا صفر خواهد بود. تغییر زوایای فی و سای منجر به ساختارهای دوم آلفا هلیکس و صفحات بتا در پپتیدها میشود.
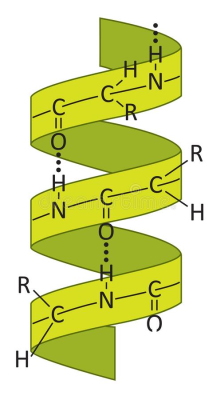
هلیکس آلفا
ساختار اولیه پروتئینها با کنار هم قرار گرفتن آمینواسیدها و تشکیل پیوند پپتیدی تشکیل میشوند. در مرحله بعدی پیوندهای درون مولکولی از جمله پیوندهای هیدروژنی ساختارهای دوم را تشکیل میدهند. هلیکس آلفا یکی از ساختارهای دوم است که بر اثر تغییر زوایای سای (زاویه چرخشی پیوند کربوکسیل و کربن آلفا) و فی (زاویه چرخشی پیوند کربن آلفا و آمین) و به کمک پیوندهای هیدروژنی تشکیل میشود. در این زنجیره مارپیچی بین هیدروژن گروه کربوکسیل با آمین چهارمین آمینواسید کناری، پیوند هیدروژنی تشکیل میشود. این ساختار ویژگیهای منحصر به فردی دارد.
- معمولا در اولیگوپپتیدهای ۴ تا ۴۰ آمینواسیدی تشکیل می شود.
- در هر پیچ از ۳٫۶ آمینواسید وجود دارد.
- آمینواسیدهایی که زنجیره جانبی بسیار بزرگ (تیروزین و تریپتوفان) یا بسیار کوچک (گلایسین) دارند منجر به ناپایداری مارپیچ میشوند.
- آلانین، گلوتامین، لوسین و متیونین آمینواسیدهایی هستند که بیشتر در ساختارهای آلفا هلیکس وجود دارند.
- پرولین به دلیل ساختار صفحهای معمولا در آلفا هلیکس وجود ندارد.
- باقیماندههای آمینواسیدی که در این ساختار شرکت میکنند، زاویه سای و فی یکسانی دارند. این زوایا معمولا بین ۶۰- تا ۵۰- درجه است.
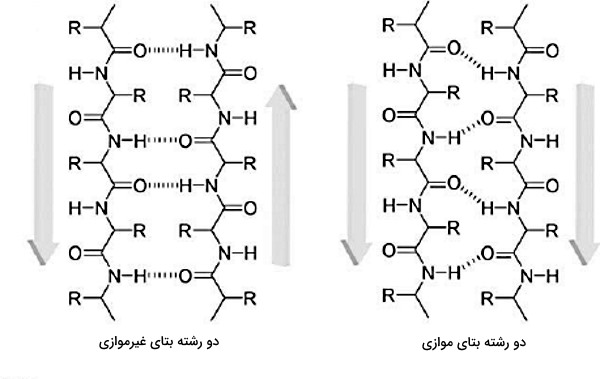
صفحات بتا
صفحات بتا یا بتا شیت گروه دیگری از ساختارهای دوم در پلیپپتیدها هستند. در این ساختارها زاویه فی ۱۴۰- و زاویه سای ۱۳۰ درجه است. این زوایای مثبت و منفی سبب میشود آمینواسیدها به شکل زیگزاگ کنار هم قرار بگیرند و رشته بتا تشکیل شود. با تشکیل پیوند هیدروژنی بین رشتههای بتا در دو یا چند پلیپپتید، صفحات بتا ایجاد خواهند شد. در این ساختار، زنجیره جانبی آمینواسیدهای کنار هم در دو جهت مخالف هم قرار میگیرند. سه نوع بتا شیت در ساختار پروتئینها وجود دارد.
- بتا شیت موازی: در این ساختارها همه رشتههای بتا انتهای C و N یکسانی دارند و پیوندهای هیدروژنی در فواصل مشخصی تشکیل میشود.
- بتا شیت غیرموازی: در این ساختارها انتهای C یک رشته بتا مقابل انتهای N رشته کناری قرار میگیرد و این تناوب در تمام صفحه تکرار میشود.
- بتا شیت مخلوط: این ساختارها از ترکیب رشتههای بتای موازی و غیرموازی تشکیل می شوند.
تشکیل پیوند پپتیدی در آزمایشگاه
پپتیدها برای بررسی برهمکنش آنتیبادی-آنتیژن، دارو-رسپتور یا آنزیم-سوبسترا در آزمایشگاههای زیستشناسی و داروسازی تولید میشوند. اولین مرحله در سنتز پپتیدها، تشکیل پیوند پپتیدی بین گروه کربوکسیل و آمین است. تصور کنید، قصد داریم دیپپتیدی آلانین-گلایسین در محیط آزمایشگاه بسازیم. اما با مخلوط کردن این دو اسیدآمینه ممکن است دیپپتیدهای گلایسین-گلایسین، آلانین-آلانین، گلایسین-آلانین و آلانین گلایسین تشکیل شود که تنها آخرین ترکیب، دیپپتید هدف ما است. از طرفی هر آمینواسید یک گروه کربوکسیل (نوکلئوفیل) و یک گروه آمین (الکتروفیل) دارد که ممکن است باهم واکنش دهند و ترکیبات جانبی ایجاد کنند. در سیستمهای زیستی این مشکل با وجود ریبوزوم و tRNA برطرف شده است. چراکه گروه کربوکسی هر آمینواسید با پیوند استری به tRNA متصل میشود و تنها انتهای N آن برای شرکت در پیوند پپتیدی آزاد است. به همین دلیل برای تشکیل پیوند پپتیدی در آزمایشگاه چهار مرحله کلی دارد.
- محافظت گروههای عاملی: برای جهتدهی به تشکیل پیوند پپتیدی و به حداقل رساندن واکنشهای جانبی، گروههای عاملی واکنشپذیر باید غیرفعال شوند.
- محافظت انتهای N: در این مرحله برای غیرفعال کردن و کاهش خاصیت نوکلئوفیل در آمین، از آسیل کلریدها یا انیدریدها ازجمله تیبوتوکسیکربونیل (BOC)، دیتیبوتیلدیکربونیل و بنزیل کلروفورمات، در pH بیشتر از ۱۰ استفاده میشود. در این حالت تنها گروه عاملی در دسترس برای شرکت در واکنش کربوکسیل متصل به کربن آلفا است.
- محافظت انتهای C: برای سنتز پپتید در فاز مایع، گروه کربوکسیل اولین آمینواسید باید غیرفعال شود.
- محافظت زنجیره جانبی: زنجیره جانبی آمینواسیدها گروههای عاملی متنوعی دارند که برای جلوگیری از واکنشهای جانبی در سنتز پلیپپتید، باید غیرفعال شوند. ترکیبات محافظ زنجیره جانبی، بر پایه بنزیل و ترتیوبوتیل هستند، با این تفاوت که تا پایان واکنش از زنجیره جانبی جدا نمیشوند.
- فعال کردن انتهای C: در این مرحله از ترکیباتی مثل دیسیکلوهکسیل کاربومید (DCC) برای فعال کردن و افزایش خاصیت الکتروفیلی آمینواسید استفاده میشود.
- جفت شدن آمینواسید: در مرحله آخر دو آمینواسید برای تشکیل پیوند پپتیدی کنار هم قرار میگیرند.
- جدا کردن پپتید: با وجود اینکه روشهای سنتز پپتیدها بهینهسازی شده است اما کامل نیست و ممکن است ترکیبات جانبی و ناخواسته همراه پپتیدهای هدف تولید شود. برای جداسازی پپتیدهای هدف میتوان بر اساس توالی آمینواسیدها، بار، اندازه و آبگریزی ترکیب از کروماتوگرافیهای مختلف برای جداسازی پپتید بهره برد. کروماتوگرافی فاز معکوس یکی از متنوعترین روشهای جداسازی پپتیدها است.

در انتهای این فرایند گروه آمیدی محافظ انتهای N باید برداشته شود. شرایطی که برای شکستن این پیوند نیاز است، ممکن است منجر به شکستن پیوند پپتیدی تازه تشکیل شده شود. به همین دلیل انتخاب گروههای محافظ آمین یکی از مهمترین مراحل کلیدی در سنتز پپتیدهای آزمایشگاهی است. گروه محافظ آمین باید سه ویژگی اصلی داشته باشد.
- بهراحتی با آمینواسید پیوند برقرار کند.
- در شرایط تشکیل پیوند پپتیدی کاملا غیرفعال باشد و وارد واکنش نشود.
- باید بهراحتی از پپتید تشکیل شده جدا شود.
سنتز پپتید در بستر جامد
سنتز پپتیدهای طولای (بیش از ۱۰ آمینواسید) با این روش نیاز به مراحل و زمان زیادی دارد. به علاوه ترکیب حاصل از هر مرحله نیاز به خالصسازی دقیقی دارد تا تمام ترکیبات جانبی از مخلوط خارج شوند. «سنتز مریفیلد» (Merrifield Synthesis) یکی از روشهایی است که برای افزایش کارایی این مکانیسم و کاهش زمان سنتز، طراحی شده است. در این روش انتهای C زنجیره پپتیدی به یک ذره پلیمری (رزین) متصل میشود و محافظ انتهای C، در این روش کاربردی ندارد. به این روش سنتز پپتید در بستر جامد نیز گفته میشود. با روشهای جداسازی مربوط به پلیمر استفاده شده در این روش بهراحتی میتوان پپتید تشکیل شده در هر مرحله را جدا کرد.
سوالات متدوال
در این بخش به تعدادی از سوالات متدوال پیرامون پیوند پپتیدی و ویژگیهای آن پاسخ میدهیم.
پیوند پپتیدی اشتراکی است ؟
رزونانس الکترونهای موجود در اتمهای درگیر پیوند (نیتروژن، هیدروژن متصل به نیتروژن، کربن و اکسیژن متصل به کربن) این الکترونها را به الکترونهای اشتراکی بین اتمها تبدیل میکند.
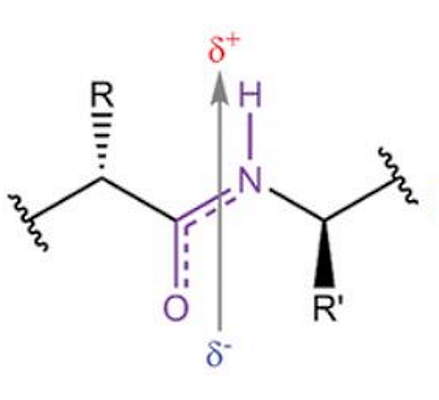
نام دیگر پیوند پپتیدی چیست ؟
پیوند پپتیدی نوعی پیوند کووالانسی است که به دلیل اتصال نیتروژن به کربونیل به آن پیوند آمیدی نیز گفته میشود.













عالی بود