عنصر کلسیم چیست؟ – خواص + کاربرد – به زبان ساده
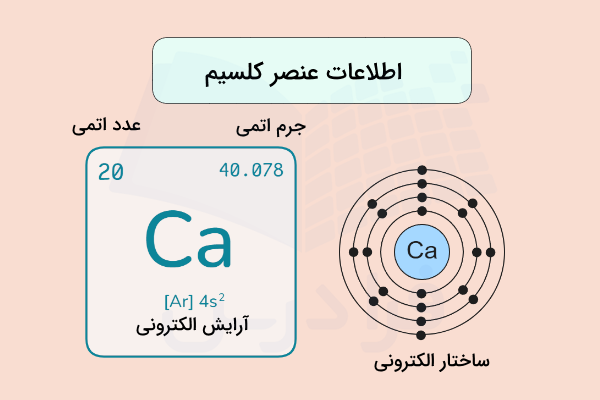
کلسیم (Calcium | Ca) یکی از عنصرهای شیمیایی با عدد اتمی ۲۰ و از گروه فلزات قلیایی خاکی است. این فلز، رنگ خاکستری مایل به سفید دارد و نسبتا سخت است. عنصر کلسیم بهصورت خالص در طبیعت وجود ندارد و پنجمین عنصر فراوان در پوسته زمین است. وجود این عنصر برای بسیاری از گونههای زیستی حیاتی بوده و نقش بسیار مهمی در فیزیولوژی سلولی دارد.
- میآموزید عنصر کلسیم چیست و چه خواص فیزیکی و شیمیایی دارد.
- با ایزوتوپهای عنصر کلسیم آشنا میشوید.
- ترکیبات مشتق شده از کلسیم و ویژگیهای آنها را میشناسید.
- با منابع معدنی و خوراکی کلسیم آشنا میشوید.
- میتوانید کاربردهای صنعتی و دارویی کلسیم را تشخیص دهید.
- با نوع عنصر کلسیم و یون آن آشنا میشوید.


عنصر کلسیم چیست؟
کلسیم با نماد شیمیایی یکی از عنصرهای شیمیایی است. این عنصر با عدد اتمی ۲۰ در گروه دوم و تناوب چهارم جدول تناوبی قرار دارد. نام کلسیم از واژه لاتین «calx» به معنای آهک گرفته شده است. این عنصر مانند منیزیم (Mg)، استرانسیم (Sr) و باریم (Ba) نخستین بار توسط «همفری دیوی» (Humphry Davy) از برقکافت یا الکترولیز اکسید آن به دست آمد. به همراه بریلیوم، منیزیم، استرانسیم، باریم و رادیم، گروه فلزهای قلیایی خاکی را تشکیل میدهند.

فلز کلسیم، عنصری واکنشپذیر است و در صورت قرار گرفتن در هوای آزاد اکسید شده و لایهای سیاهرنگ روی آن شکل میگیرد. این عنصر از نظر ویژگیهای فیزیکی و شیمیایی شبیه استرانسیم و باریم است. پس از آهن و آلومینیم، کلسیم سومین فلز و پنجمین عنصر فراوان در پوسته زمین است.
خواص فیزیکی کلسیم
کلسیم رنگی نقرهای و شکلپذیری بالایی دارد. نقطه ذوب این فلز ۸۴۲ و نقطه جوش آن ۱۴۹۴ درجه سلسیوس است و در آزمون شعله با رنگ زرد مایل به سرخ میسوزد. این عنصر میتواند آرایش بلوری مکعبی تشکیل دهد. اما در دمای بیش از ۴۵۰ درجه سلسیوس آرایش شبکه کریستالی هگزاگونال فشرده به خود میگیرد.
بین فلزات قلیایی خاکی، این عنصر با چگالی ۱٫۵۵ کمترین چگالی دارد.

۲۰ الکترونِ اتم این فلز با آرایش الکترونی در مدارهای اطراف هسته مرتب شدهاند. این فلز در بیرونیترین لایه الکترونی خود در اوربیتال ، دو الکترون ظرفیت دارد که پس از شرکت در واکنشهای شیمیایی به یون با آرایش الکترونی پایدار تبدیل میشود. عنصر در بیشتر ترکیبات خود به شکل دو ظرفیتی است.
ویژگی های شیمیایی
واکنش این عنصر با آب، خودبهخودی و سریعتر از منیزیم است. در مقایسه با استرانسیم، عنصر هم گروه آن، با سرعت کمتری کلسیم هیدروکسید و گاز هیدروژن تولید میکند. اکسیژن و نیتروژنی که در هوا هستند با آن وارد واکنش شده و مخلوطی از ترکیبات کلسیم اکسید و کلسیم نیترید را ایجاد میکنند. این فلز به صورت پودر و ریز ریز شده در هوا میسوزد اما به شکل فله واکنشپذیری کمتری دارد. در هوای مرطوب هیدارته میشود ولی در محیطهایی با رطوبت کمتر از ۳۰ درصد و در دمای اتاق قابل نگهداری و ذخیره کردن است.
واکنش آن با اکسیژن به جز پراکسید ترکیبات دیگری مانند کلسیم پراکسید و احتمالا کلسیم سوپراکسید با فرمول شیمیایی را ایجاد میکند. کلسیم کربنات و کلسیم سولفات از منابع معدنی فراوان این عنصر هستند. واکنش با آب و اسید گرماده است. این فلز در صورت تماس با بدن به دلیل جذب رطوبت پوست خورندگی شدیدی دارد و خوردن و بلعیدن آن میتواند کشنده باشد.
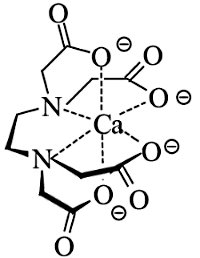
این فلز مانند استرانسیم و باریم و لانتانیدهای دوظرفیتی مانند «یوروپیم» (Europium | Eu) و ایتربیم (Ytterbium| Yb) و و همچنین عناصر گروه اول جدول تناوبی (فلزات قلیایی) در آمونیاک مایع حل شده و محلولی با رنگ آبی تیره تولید میکند. «اعداد همآرایی یا کوردیناسیون» (Coordination Numbers) ۶ تا ۸ برای یون رایج است. این فلز توسط اکسیژنِ EDTA و پلی فسفاتها تشکیل کمپلکس میدهد. از این ویژگی برای حذف یونهای کلسیم در آب سخت استفاده میکنند.
بر خلاف منیزیم دیگر عنصر گروه دوم، که ترکیبات آلی بسیاری تشکیل داده و کاربردهای زیادی دارد، ترکیبات آلی کلسیم به دلیلی سختی تولید آنها رایج نیستند. واکنش مستقیم فلز با «سیکلوپنتادین» (Cyclopentadiene) ترکیب آلی کلسیم دیسیکلوپنتادینیل با فرمول شیمیایی را ایجاد میکند. بیشتر ترکیبات ارگانوکلسیوم در دماهای پایین تهیه میشوند.
ایزوتوپ های عنصر کلسیم
کلسیم در طبیعت از شش ایزوتوپ غیرپرتوزا زیر تشکیل شده و سبکترین عنصر با ۶ ایزوتوپ طبیعی است.
| ایزوتوپهای طبیعی | ||
|---|---|---|
| ایزوتوپ | درصد فراوانی | نیمهعمر |
| ۰٫۶۴۷ درصد | پایدار | |
| ۰٫۱۳۵ درصد | پایدار | |
| ۲٫۸۰۶ درصد | پایدار | |
| ۰٫۰۰۴ درصد | پایدار | |
| ۰٫۱۸۷ درصد | سال | |
| پرتوزای ناچیز | سال | |
| ایزوتوپهای مصنوعی پرتوزا | ||
| پرتوزای مصنوعی | ۱۶۲٫۶ روز | |
| پرتوزای مصنوعی | ۴٫۵ روز | |
به دلیل نیمهعمر طولانی ایزوتوپ ، از آن برای پژوهش علمی استفاده میشود. رایجترین ایزوتوپ این عنصر با درصد فراوانی ۹۶٫۹۴۱ درصد و پس از آن با ۲٫۸۰۶ درصد است. چهار ایزوتوپ طبیعی دیگر کمتر از یک درصد فراوانی دارند. ایزوتوپهای پرتوزای بسیار این عنصر از تا نیز وجود دارد.
ترکیبات شیمیایی
استفاده از ترکیبات به شکل مصالح ساختمانی هزاران سال قدمت دارد. گچ و آهک از شناخته شدهترین شکلهای استفاده شده این فلز در ساخت و ساز هستند. کلسیم کربنات که در سنگ آهک و بقایای فسیلی پیدا میشود و رایجترین ترکیب این عنصر روی زمین است. سنگ گچ، انیدریت، فلئوریت و آپاتیت مهمترین منابع این فلز هستند.
کلسیم هیدروکسید
کلسیم هیدروکسید با فرمول شیمیایی ترکیبی معدنی به شکل بلور بیرنگ یا پودر سفید است که از ترکیب آهک زنده با آب تشکیل میشود. این ترکیب با نامهای آهک سوخته، آهک بنایی، آهک خشک شده و آهک هیدارته نیز شناخته میشود. تماس مستقیم و بدون محافظت با میتواند باعث التهاب شدید پوستی، سوختگی شیمیایی، کوری و آسیب دیدن ریه شود.
واکنش با آب به صورت زیر است که محلولی بازی با pH حدود ۱۲٫۵ تولید میکند.
محلولهای آبی آن با اسیدها واکنش میدهند و میتوانند موجب خوردگی بعضی از فلزات مانند آلومینیم شوند، در حالی که از فلزات دیگر مانند آهن و فولاد در برابر خوردگی محافظت میکنند. آب آهک در حضور کربن دیاکسید به دلیل تشکیل کلسیم کربنات به رنگ شیری درمیآید که به آن «کربناته شدن یا کربناتاسیون» (Carbonatation) میگویند و میتواند باعث آسیب رساندن و خوردگی میلگرد یا سایر سازههای آهنی شود.
تهیه «ملات آهک» (Lime Mortar) از مهمترین کاربردهای است. از دیگر کاربردهای مهم آن در نقش لختهساز در فاضلاب و تصفیه آب است که به حذف ذرات کوچکتر از آب کمک کرده و در نتیجه فراورده شفافتری ایجاد میکند. از همچنین برای تصفیه آب شیرین و بالا بردن pH آب استفاده میشود. از دیگر کاربردهای این ترکیب تهیه گاز آمونیاک، طبق واکنش زیر است.
کلسیم هیدروکسید در صنعت کاغذسازی در نقش واسط شیمیایی برای تولید سدیم هیدروکسید عمل میکند و در باغهای میوه برای از بین بردن قارچها کاربرد دارد. دیگر کاربردهای این ترکیب عبارتند از:
- شفافسازی عصاره نیشکر یا چغندرقند در صنعت
- برای فراوری آب برای نوشیدنیها
- در فرایند تولید ذرت
- حذف کربناتهای کلسیم و منیزیم، در تولید نمک خوراکی و دارویی
- در شیرخشک نوزادان
- کمککننده گوارشی
- در تهیه بسترهای پرورش قارچ

کلسیم پراکسید
کلسیم پراکسید ترکیبی معدنی با رنگ سفید و نامحلول در آب است. این ترکیب میتواند از واکنش نمکهای با هیدروژن پراکسید بر اساس واکنش زیر و اکسایش مستقیم در فشار بسیار بالای اکسیژن تولید شود.
ترکیب به عنوان اکسیدکننده برای افزایش استخراج فلزات گرانبها از سنگ معدن کاربرد دارد. در صنایع غذایی در ترکیبات افزودنی غذا و سفیدکننده آرد استفاده میشود. در کشاورزی در فرایند کاشت برنج و همچنین در پرورش آبزیان برای برای اکسیژنرسانی و ضدعفونی کردن آب و در احیا زیستبومها برای احیا و تصفیه خاک و آبهای زیرزمینی آلوده به نفت کاربرد دارد.
کلسیم فلوئورید
ترکیبهای این فلز با هالوژنها ترکیبات شناخته شدهای هستند. کلسیم فلوئورید از ترکیبات معدنی و جامدی نامحلول به رنگ سفید است. اگرچه در دسته ماده غیرسیمی و بیخطر دستهبندی شده، اما واکنش آن با سولفوریک اسید و هیدروفلوئوریک اسید بسیار سمی است. این ماده در طبیعت به شکل فلئوریت فراوان است و انگیزه زیادی برای تولید صنعتی آن وجود ندارد. با خلوص بالا از واکنش هیدروفلوئوریک اسید با کلسیم کربنات تولید میشود.
کلسیم فلوئورید در تولید شیشه و لنزهای به کار رفته در سیستمهای تصویربرداری حرارتی، طیفسنجی، تلسکوپها و «لیزر برانگیختهپار یا اگزایمر» (Excimer Laser) استفاده میشود. شیشه و لنزهای تولید شده از این ترکیب در طیف وسیعی از فرکانسهای فرابنفش تا فروسرخ شفافیت خود را حفظ میکند و به دلیل ضریب شکست پایین خود، موجب کاهش پوشش ضدبازتاب میشود.

کلسیم کلرید
کلسیم کلرید ترکیبی معدنی و از نمکهای با انحلالپذیری بسیار بالا در آب است. این ترکیب در دمای اتاق، جامد و به شکل بلورهای سفید رنگ است. معمولا جامدی هیدراته با فرمول شیمیایی است که در آن میتواند باشد. به صورت هیدارته و در مقادیر کم خطری ندارد ولی به دلیل ویژگی جذب آب زیاد و گرماده بودن واکنش نمک بدون آب آن، در صورت تماس با پوست میتواند رطوبت پوست را گرفته و موجب خشک شدن آن شود. در صورت خورده شدن نیز موجب سوختگی دهان و مری میشود. این نمک از «فرایند سلوی» ( Solvay Process) طبق واکنش زیر به دست می آید.
ترکیب برای یخزدایی و کنترل گرد و غبار نیز کاربرد دارد. به صورت جامد بدون آب، به عنوان خشککننده استفاده میشود. بیشتر کاربرد برای جلوگیری از یخزدگی و یخزدایی است. محلولهای این ماده تا دمای مانع از تشکیل یخ میشوند. از کلسیم کلرید در خوراکیها، نوشیدنیها و سبزیجات کنسرو شده نیز استفاده میشود. به دلیل طعم شور آن، برای طعم دادن غذا بدون افزایش میزان سدیم استفاده میشود.

برخی دیگر از کاربردهای این ترکیب عبارتند از:
- برای حفظ بافت میوهها
- برای تأمین کلسیم پوسته نرمتنان و برخی از ماهیها در آکواریومها
- بهبود عملکرد مخمر در طول تخمیر
- برای حفظ تعادل طبیعی بین کلسیم و پروتئین در تولید پنیر
- استفاده در بستهبندیهای خشک یا بدون رطوبت
- سرعت بخشیدن به فرایند تولید مخلوطهای بتن و اندازهگیری رطوبت آن
- ترکیب افزودنی در پلاستیکها و کپسولهای آتشنشانی
- در نرمکننده پارچه
- افزایش چگالی آب نمک در صنعت نفت
- جلوگیری از متورم شدن خاک رس در «گل حفاری» (Drilling Fluid) پایهآبی
- کاهش نقطه ذوب در «فرایند دیوی« (Davy Process) برای تولید صنعتی فلز سدیم
- در تولید کربن فعال
- برای رسوب یونهای فلورید از آب
- به عنوان الکترولیت در تولید تیتانیم

کلسیم کربنات
کلسیم کربنات با فرمول از ترکیات پر کاربرد است. به شکل کانیهای کلسیت ، آراگونیت و واتریت (Vaterite) در سنگها وجود دارد. سنگ آهک، گچ، مرمر و «تراورتن» (Travertine) از دیگر منابع معدنی این ماده هستند. ضداسید بوده و کاربردهای پزشکی فراوانی دارد. واکنش آن با اسید موجب تولید کربنیک اسید شده که به سرعت به کربن دیاکسید و آب تجزیه میشود.
«تجزیه حرارتی یا تکلیس» (Calcination) آن در دمای بالاتر از ۸۴۰ درجه سلسیوس طبق واکنش زیر با آزاد شدن کربن دیاکسید و تولید آهک زنده همراه است.
نمک خالص برای مصرف خوراکی یا دارویی معمولا از سنگ مرمر و حجم زیاد آن از معادن استخراج میشود.
مراحل تولید کلسیم اکسید از سنگ مرمر به صورت زیر است:
- با اضافه شدن آب به کلسیم اکسید، واکنش بین آنها موجب تولید کلسیم هیدروکسید میشود.
- افزون کربن دیاکسید به کلسیم هیدروکسید تولید شده باعث تولید به شکل رسوب میشود که در صنعت به آن «کلسیم کربنات رسوبی» (Precipitated Calcium Carbonate | PCC) میگویند.
ساختار موجودات زنده مانند پوسته تخم پرندگان، صدف حلزون و صدفهای دریایی بیشتر از تشکیل شده است. سبزیجات برگدار با رنگ سبز تیره مانند کلم بروکلی و کلم پیچ نیز حاوی مقادیر زیادی از این ترکیب هستند.
منابع معدنی عنصر کلسیم
نزدیک به ۳ درصد از پوسته زمین را کلسیم تشکیل میدهد. رسوبات کربنات این فلز به شکل سنگهای رسوبی «کلسیت» (Calcite) و «آراگونیت» (Aragonite) وجود دارند. سنگ آهک، «دولومیت» (Dolomite)، سنگ مرمر، گچ از دیگر ترکیبات معدنی این عنصر در طبیعت هستند. مرجانها، صدفهای دریایی و مرواریدها نیز از کلسیم کربنات تشکیل شدهاند.

ترکیبات زیر نیز از دیگر منابع معدنی مهم این فلز هستند.
| نام ترکیب | عنوان انگلیسی | فرمول شیمیایی |
|---|---|---|
| سنگ گچ | Gypsum | |
| انیدریت | Anhydrite | |
| فلئوریت | Fluorite | |
| آپاتیت | Apatite |
منابع غذایی کلسیم
کلسیم بهطور گستردهای در بسیاری از غذاها موجود است و تنها شامل محصولات لبنی مانند شیر یا ماست نمیشود. میوهها، سبزیجات برگدار، لوبیا و آجیل منابع خوبی برای این عنصر هستند. در زیر برخی از خوراکیهای غنی از کلسیم فهرست شده است.
- لبنیات
- شیرهای گیاهی بادام، سویا، برنج
- پنیر
- ماست
- کدوی حلوایی
- لوبیای سبز
- توفو
- ساردین و سالمون
- بادام
- سبزیجات برگ دار مانند کلمبرگ، خردل، شلغم، کلم پیچ، کلم سبز، اسفناج

پیشنهاد می کنیم برای درک بهتر این منابع و نقش این عنصر در بدن، فیلم آموزش اهمیت کلسیم در بدن فرادرس که لینک آن در ادامه آورده شده است را مشاهده کنید.
کاربردهای عنصر کلسیم
فلز خالص کلسیم به دلیل واکنشپذیری زیاد، کاربرد کمی دارد و بیشتر از ترکیبات آن در صنایع گوناگون استفاده میشود. کلسیم در ترکیبات سفیدکننده مورد استفاده در صنعت کاغذسازی و در ساخت سیمان و عایقهای الکتریکی کاربرد دارد. همچنین مکملهای کلسیم در ترکیبات صنایع غذایی و دارویی به کار میرود. فلز خالص آن کاربردهای محدودی دارد. از مقادیر کم آن در صنعت فولادسازی و برای ساخت آلیاژ کلسیم-سرب در باتریهای خودرو استفاده میشود.
در برخی از مواد سفیدکننده بهداشتی نیز وجود دارد. کلسیم در نقش «گازبر» (Getter) اکسیژن و نیتروژن را جذب میکند، این ویژگی برای حذف نیتروژن از گاز آرگون به کار میرود. همچنین در نقش عامل کاهنده در تولید عناصری مانند کروم (Cr)، زیرکونیوم (Zr)، توریم (Th) و اورانیوم (U) استفاده میشود.
کاربرد برخی از ترکیبهای کلسیم در زیر فهرست شده است.
- تریکلسیم فسفات : سفیده کننده و ضداسید در خمیر دندان
- کلسیم فسفات : عامل خمیر مایه
- کلسیم سولفیت : سفیدکننده و ضدعفونیکننده در کاغذسازی
- کلسیم سیلیکات : عامل تقویتکننده در لاستیک
- کلسیم استات : جزء رزین آهک و برای ساخت صابونهای فلزی و رزینهای مصنوعی
عنصر کلسیم در صنعت فولاد
استفاده فلزی این عنصر در صنعت فولادسازی بیشترین کاربرد را دارد که به دلیل میل ترکیبی شیمیایی کلسیم با اکسیژن و گوگرد است. تشکیل اکسیدها و سولفیدهای آن در فرایند تصفیه باعث بهبودی ریختهگری و خواص مکانیکی آلیاژها میشوند. استفاده آلیاژهای کلسیم- سرب ۰٫۱ درصد این عنصر در باتریهای خودرو موجب کاهش هدر رفت آب میشود. از فلز کلسیم در تقویت آلیاژهای آلومینیم که برای ساخت یاتاقان استفاده میشود و کنترل کربن گرافیتی در چدن کاربرد دارد. از این فلز همچنین برای خارج کردن بیسموت از سرب استفاده میکنند.
مکمل کلسیم
ترکیبات نمک این عنصر در شرایط مشخص، به شکلهای گوناگونی مصرف میشود. مکملها برای رژیمهای غذایی فاقد کلسیم تجویز میشوند و از طریق دهان یا تزریق وریدی استفاده میشوند. این ترکیبات برای درمان یا پیشگیری «هیپوکلسمی» (Hypocalcemia)، که کاهش کلسیم در خون است، پوکی استخوان و راشیتیسم کاربرد دارد. تزریق وریدی آن نیز برای رفع اسپاسم عضلانی که به دلیل کاهش کلسیم خون ایجاد میشود و «هایپرکالمی» (Hyperkalemia) یا سمیت پتاسیم و منیزیم خون استفاده میشود.
مصرف زیاد کلسیم میتواند عوارضی چون یبوست و تهوع به همراه داشته باشد و باعث افزایش خطر ابتلا به سنگ کلیه نیز شود. میزان مورد نیاز کلسیم در بزرگسالان یک گرم است که اهمیت بالایی برای استخوانها، ماهیچهها و اعصاب دارد.
جهت رفع کمبود این عنصر در برخی از غذاها، ترکیباتی مانند کلسیم لاکتات ، کلسیم پیروفسفات و تریکلسیم فسفات به آنها افزوده میشود.

فواید عنصر کلسیم چیست ؟
در بدن انسان و موجودات زنده یونهای کلسیم نقش حیاتی دارد. این عنصر فراوانترین فلز و پنجمین عنصر فراوان در بدن انسان است. در عملکرد اندامها، بافتها و سلولهای موجودات یونهای کلسیم به شکل الکترولیت در انتقال سیگنال بین مولکولی، آزادسازی انتقال دهندههای عصبی از نورونها، انقباض سلولهای عضلانی، به شکل کوفاکتور در برخی از آنزیمها و لقاح نقش مهمی دارند. همچنین یونهای کلسیم برای سنتز پروتئین و تشکیل استخوان مهم هستند.

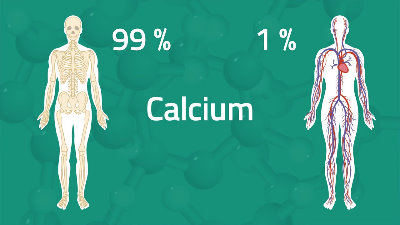
کلسیم فراوانترین عنصر فلزی در بدن است که ۱ تا ۲ درصد از وزن انسان را تشکیل میدهد. این فلز بیشتر در استخوانها ذخیره میشود که بخشی جدایی ناپذیر از آن است و به شکلگیری دندانها و حفظ سلامت آنها کمک میکند. حدود ۹۹ درصد کلسیم بدن در استخوانها ذخیره میشود و ۱ درصد باقیمانده در خون، ماهیچهها و سایر بافتها یافت میشود. بدن کلسیم مورد نیاز خود را از طریق خوردن غذاها یا مکملهای حاوی کلسیم و با جذب کلسیم در بدن دریافت میکند. کاهش بیش از حد کلسیم دریافتی و همچنین افزایش دفع آن موجب پوکی استخوان در بزرگسالان، راشیتیسم در کودکان و افزایش خطر مسمومیت با سرب را به همراه دارد. کلسیم همچنین نقش اساسی در لخته شدن خون، حفظ فشار خون و انقباض عضلانی از جمله قلب و عملکردهای عصبی عضلانی ایفا میکند. این عنصر همچنین در عملکرد بسیاری از فرآیندهای آنزیمی نقش دارد.
سوالات متداول
برخی از پرسشهاس رایج در مورد کلسیم در این بخش پاسخ داده شده است.
کلسیم در چه چیزهایی وجود دارد ؟
علاوه بر لبنیات، ماهی ساردین، لوبیای سبز، بادام و سبزیجات برگ داری مانند کلمبرگ، شلغم، کلم پیچ، کلم سبز و اسفناج از منابع گیاهی کلسیم هستند.
عنصر کلسیم چند ایزوتوپ دارد ؟
به طور طبیعی این عنصر ۶ ایزوتوپ پایدار دارد.
عدد اتمی عنصر کلسیم چند است ؟
عدد اتمی کلسیم ۲۰ است.
کلسیم فلز است یا نافلز ؟
این عنصر از گروه فلزات قلیایی خاکی است و نافلز نیست.
یون عنصر کلسیم چیست ؟
یون رایجترین شکل این عنصر است.
محل ذخیره عنصر کلسیم در بدن کجاست ؟
بیش از ۹۰ درصد کلسیم بدن در استخوانها ذخیره میشود.












