تشکیل رسوب در واکنش شیمیایی – به زبان ساده + مثال
در واکنشهای شیمیایی شاهد تغییراتی شیمیایی هستیم که طی آن ترکیباتی جدید در شرایط مشخصی به وجود میآیند. برای درک راحتتر این تغییرات و چگونگی جابهجایی اتم از مولکولی به مولکول دیگرمراجعه به معادله شیمیایی آن بسیار راهگشا است. معادله شیمیایی نشاندهنده مواد اولیه و محصولهای بهوجود آمده طی واکنش شیمیایی است. به رسوبهای به وجود آمده در یک واکنش، واکنشدهنده میگوییم. یک واکنش شیمیایی میتواند توسط موادی با حالتهای فیزیکی گوناگون گاز، مایع و جامد به وقوع بپیوندد. در این مطلب شرایط تشکیل رسوب در واکنش شیمیایی و چند نمونه بسیار پرکاربرد از آن را بررسی میکنیم.
- توانایی تشخیص واکنشهای رسوبی و محصولات نامحلول آنها را کسب میکنید.
- مهارت نوشتن و موازنه معادله یونی خالص برای واکنشهای رسوبی را تقویت میکنید.
- عوامل مؤثر بر تشکیل رسوب مانند دما، غلظت و نقش یونها را خواهید آموخت.
- روشهای جداسازی و خالصسازی رسوب از محلول را فرا میگیرید.
- کاربردهای واکنش رسوبی در صنایع، آزمایشگاه و محیط زیست را خواهید شناخت.
- نقش قوانین انحلالپذیری در پیشبینی تشکیل رسوب را بهخوبی یاد میگیرید.


واکنش شیمیایی چیست ؟
در زندگی روزمره ما واکنشهای شیمیایی زیادی انجام میشود که این واکنشها پایههای حیات هستند. در زیر چند مثال از این موارد را مشاهده میکنید.
- واکنش سوختن
- هضم غذا
- پختن غذا
- خوردگی فلزات
یکی از زیرشاخههای مهم این واکنشهای شیمیایی واکنشهای رسوبی است. در تشکیل رسوب در واکش شیمیایی دو نمک محلول در آب با یکدیگر ترکیب شده و محصولهایی را به وجود میآورند. یکی از این محصولها در آب نامحلول است و در نتیجه تشکیل رسوب میدهد.

تشکیل رسوب چیست ؟
واکنش رسوبی را میتوان به عنوان واکنشی شیمیایی تعریف کرد که در محلول آبی انجام میشود و در آن دو پیوند یونی با یکدیگر همراه میشوند و نمکی غیرمحلول در آب را به وجود میآورند. به این نمکهای غیرمحلول تولید شده طی این واکنش رسوب گفته میشود.
راه دیگری که برای تشکیل رسوب در واکنش شیمیایی وجود دارد تغییر دما است زیرا دما بر حلالیت مواد تاثیر میگذارد و با کنترل آن میتوان رسوبی را به دست آورد یا حل کرد. همچنین با افزایش غلظت یک ماده محلول از حد مشخصی، رسوب به جا میماند.
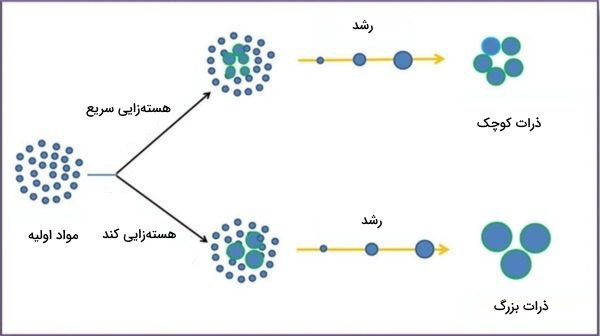
هسته زایی
در تشکیل رسوب مرحلهای وجود دارد به نام هستهزایی که بسیار مهم است. به وجود آمدن ذره جامد باعث به وجود آمدن سطح تماسی بین این ذره با محلول میشود. این مرحله شامل تغییراتی در انرژی است که بستگی به انرژی آزاد واکنش انحلال (فرایند گرماگیر یا گرماده همراه با افزایش آنتروپی هستند) و انرژی نسبی سطح بین جامد تشکیل شده و محلول دارد. اگر این تغییرات انرژی مطلوب نباشند و یا هستههای اولیه مناسبی تشکیل نشده باشد، رسوبی تشکیل نمیشود و محلول فوقاشباع باقی میماند.
هستهزایی زمانی اتفاق میافتد که ذرات کوچک نامحلول کنار هم تجمع میکنند و به تجمع ذرات بعدی و تشکیل رسوب میانجامند.
اجزای واکنش تشکیل رسوب
گفتیم که واکنش تشکیل رسوب واکنشی است که طی آن ترکیبی نامحلول تبدیل به جامد میشود. به جامد به دست آمده در این واکنش رسوب و به مایع شفاف فاقد رسوب که در جداسازی به روش سانتریفیوژ بالای ظرف است مایع رویی میگوییم.
رنگ رسوب
بسیاری از ترکیبات حاوی یونهای فلزی رسوبهایی را تشکیل میدهند که رنگ منحصر بهفردی دارند. در جدول زیر به برخی از این موارد اشاره میکنیم. توجه داشته باشید که در آزمایشگاه و تحت شرایط متفاوت امکان تغییر این رنگها وجود دارد.
| نام فلز | نماد عنصر | رنگهای مورد انتظار |
| کروم | Cr | آبی، سبز سیر، آبی تیره، نارنجی، زرد و قهوهای |
| کبالت | Co | صورتی (در فرم آبپوشیده) |
| مس | Cu | آبی |
| آهن (II) | Fe | سبز لجنی |
| آهن (III) | Fe | آجری |
| منگنز | Mn | صورتی روشن |
| نیکل | Ni | سبز |
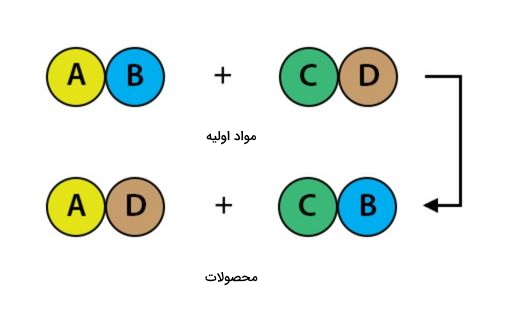
واکنش جانشینی دوگانه
بسیاری از واکنشهای تشکیل رسوب از نوع جانشینی دوگانه هستند. در ته ظرف این واکنش جامدی تهنشین میشود که همان رسوب مد نظر ماست. همچنین این واکنش در حضور دو نمک محلول نیز قابل انجام است. پیشروی این واکنش جانشینی، نمکی تولید خواهد کرد که در آب نامحلول است و از خود رسوبی برجا میگذارد.
این واکنش زمانی صورت میگیرد که دو ماده اولیه یونی وارد واکنش شوند و در پیشرفت واکنش زوج آنیون و کاتیون خود را با یکدیگر عوض کنند. یعنی ابتدا کاتیون یا آنیون همراه خود را از دست میدهند، سپس با آنیون یا کاتیون ماده دیگر همراه میشوند.
چند مثال از تشکیل رسوب در واکنش شیمیایی
واکنشهای رسوبی بسیاری در دنیای شیمی وجود دارد که در ادامه به برخی از آنها اشاره میکنیم.
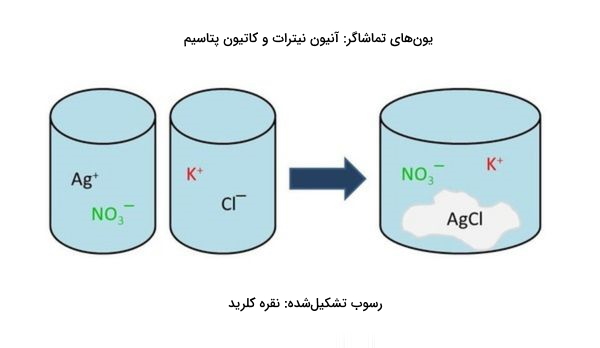
واکنش رسوبی تشکیل نقره کلرید
از بهترین مثالهای این نوع واکنش، واکنش بین دو مادهی پتاسیم کلرید و نقره نیترات است. محصول این واکنش رسوب نقره کلرید است که نمکی نامحلول است. در زیر واکنش شیمیایی این دو ماده را مشاهده میکنید.
در واکنش بالا رسوبی سفید رنگ به نام نقره کلرید با فرمول شیمیایی تولید میشود. این رسوب در آب حل نمیشود. از واکنشهای رسوبی میتوان برای بررسی حضور یا عدم حضور یونی خاص استفاده کرد.
واکنش رسوبی تشکیل کلسیم هیدروکسید
مثالی دیگر از واکنش شیمیایی که در آن محصول رسوبی تشکیل میشود واکنش بین دو ماده کلسیم کلرید و پتاسیم هیدروکسید است. این واکنش به تشکیل رسوب کلسیم هیدروکسید میانجامد. واکنش تشکیل این رسوب سفید رنگ را به صورت زیر نشان میدهند.
مثال های بیشتر
چند مورد زیر نیز منجر به تشکیل رسوب در واکنش شیمیایی میشوند.
واکنش تشکیل نقره کلرید از نقره نیترات و سدیم کلرید
محصول واکنش بین نقره نیترات و سدیم کلرید، رسوب سفید رنگ نقره کلرید است.
واکنش تشکیل منیزیم کلرید از منیزیم هیدروکسید و هیدروژن کلرید
محصول واکنش بین دو ماده منیزیم هیدوکسید و هیدروژن کلرید، رسوب سفید رنگ منیزیم کلرید است.
واکنش تشکیل باریم سولفات از باریم کلرید و سولفوریک اسید
محصول واکنش بین باریم کلرید و سولفوریک اسید به تشکیل رسوب سفید رنگ باریم سولفات میانجامد.
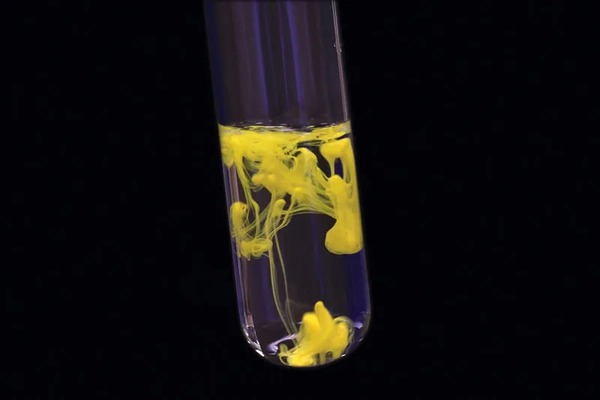
واکنش تشکیل کادمیوم سولفید از پتاسیم سولفید و کادمیوم سولفات
محصول واکنش بین کادمیوم سولفات و پتاسیم سولفید، رسوب زرد-نارنجی رنگ کادمیوم سولفید است.
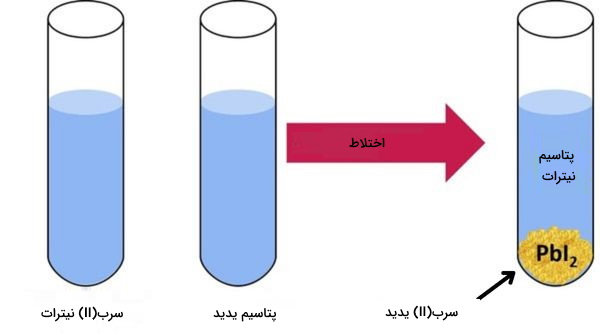
واکنش تشکیل سرب(ΙΙ) یدید از پتاسیم یدید و سرب(ΙΙ) نیترات
محصول واکنش بین دو ماده پتاسیم یدید و سرب(ΙΙ) نیترات، رسوب زرد رنگ سرب(ΙΙ) یدید است.
واکنش تشکیل رسوب در صنایع
از پرکاربردترین واکنشهای رسوبی در صنایع میتوان به واکنش تشکیل هیدوکسیدهای فلزی اشاره کرد. از جمله مهمترین محصولهای این واکنش میتوان به دو ماده زیر اشاره کرد.
- سدیم هیدروکسی (سودسوزآور)
- کلسیم هیدروکسید
واکنش تشکیل رسوب در زندگی روزمره
واکنش تشکیل رسوب در تصفیه فاضلاب به کار گرفته میشود. زمانی که آلایندهای قابلیت تشکیل رسوب را داشته باشد میتوان از این واکنش برای جدا کردن آن از فاضلاب استفاده کرد.
همچنین در فاضلاب فلزات سنگین به فرم سولفیدی و هیدروکسیدی وجود دارند. میتوان با اضافه کردن منبع هیدروکسید محلول مثلا برای تشکیل یا ، فلزات سنگین آلاینده را به صورت رسوب جدا کرد.
معادله یونی خالص
واکنش جانشینی دوگانه و مثالهایی که در بالا زدیم نمونهای از واکنشهای یونی خالص هستند. در این قسمت نحوه درست نوشتن این نوع معادلات را با هم بررسی میکنیم. میتوان حالت فیزیکی ترکیبات را نیز در نوشتن این معادله لحاظ کرد. به معادله زیر خوب نگاه کنید.
اولین مرحله برای نوشتن یک معادله یونی خالص این است که مواد اولیه و محصولهای محلول را در دو طرف واکنش به یونهای تشکیل دهنده تفکیک کنیم. از آنجا که رسوبها در آب حل نمیشوند نیاز به جداسازی آنها نیست. معادله حاصله به این صورت نوشته میشود.
با دقت به واکنش بالا متوجه میشویم که یونهای و در هر دو طرف معادله حضور دارند. به این یونها به اصطلاح یونهای تماشاگر میگوییم. دلیل این نامگذاری این است که در طول واکنش دستنخورده باقی میمانند و به همین جهت میتوانیم برای سادهتر شدن کار آنها را از دو طرف خط بزنیم. معادله به دست آمده به صورت زیر خواهد شد.
مشاهده میکنیم که معادله یونی خالص تنها تشکیل رسوب را نشان میدهد. معادله یونی خالص هم از نظر تعداد و نوع اتمها و هم از نظر بار الکتریکی باید در دو طرف برابر باشد. در بسیاری موارد برای سادهتر شدن واکنش تشکیل رسوب را با معادله یونی خالص نشان میدهند. اگر تمامی مواد در این واکنش محلول باشند امکان نوشتن معادله خالص یونی وجود ندارد زیرا همه یونها به عنوان یون تماشاگر قابل حذف از دو طرف واکنش هستند.
برای درک بهتر نوشتن این معادله به تصویر زیر دقت کنید. در مرحله اول تمامی مواد درگیر در واکنش را به آنیونها و کاتیونهای تشکیلدهنده تفکیک کردیم به صورتی که واکنش از نظر بار و تعداد اتمهای هر عنصر در دو طرف موازنه باشد. سپس یونهای تماشاگر را که در طول واکنش دستنخورده باقی میمانند از دو طرف حذف میکنیم. معادلهای که به دست میآید همان معادله یونی خالص است که تشکیل رسوب را به خوبی نشان میدهد.
معادله یونی کامل:
یونهای تماشاگر حذف میشوند:
معادله یونی خالص:
قوانین انحلال پذیری
این قوانین میتوانند تشکیل یا عدم تشکیل رسوب در واکنش شیمیایی را تعیین کنند. در واقع این قوانین به ما میگوید که چه یونهایی در آب حل میشوند و چه یونهایی نه. توجه داشته باشید که این قوانین از ابتدا به انتها ارجحیت دارند. به یاد داشتن موارد این قانون ضروری است زیرا در نوشتن معادله یونی خالص کمک میکند تا حدس بزنیم هر محصول به چه حالتی در واکنش وجود دارد. در زیر این قانون را که شامل ۶ بند است مشاهده میکنید.
- نمکهای حاوی کاتیونهای گروه ۱ جدول تناوبی عناصر و محلول هستند. تنها برخی از نمکهای استثنا هستند.
- استاتها ()، نیتراتها () و پرکلراتها () محلول هستند.
- برمیدها، کلریدها و یدیدها محلول هستند.
- سولفاتها () بهجز آنهایی که همراه با ، و باشند، محلول هستند.
- نمکهای حاوی نقره، سرب و جیوه(I) نامحلول هستند.
- کربناتها ()، فسفاتها ()، سولفیدها، اکسیدها و هیدروکسیدها () نامحلول هستند. سولفیدها در همراهی با کاتیونهای گروه ۲ و هیدوکسیدها در همراهی با کلسیم، استرانسیوم و باریم استثنا هستند.

جدا کردن رسوب از محلول
رسوبهای تشکیل شده توسط فرآیندی که به آن تهنشینی میگوییم از محلول جدا میشوند. بعد از جدا کردن رسوب محلول باقیمانده شامل تمام ترکیباتی است که در واکنش حضور داشتند اما تشکیل رسوب ندادهاند.
برای جدا کردن محلول از رسوب باید به اندازه ذرههای رسوب دقت کنیم. گاهی بیشتر مقدار رسوب تولید شده به راحتی توسط کاغذهای صافی قابل جدا کردن است. اگر ذرات رسوب کوچک و در محلول پخش باشند میتوان از سانتریفیوژ استفاده کرد. در بخشهای پیشرو جزئیات هر روش را به تفضیل بررسی خواهیم کرد.
صاف کردن
در این روش محلول حاوی رسوب را از کاغذ صافی رد میکنیم. حالت ایدهال این است که کل رسوب بر روی کاغذ صافی بماند و از محلول زیری جدا شود. برای اطمینان از اینکه ذرات رسوب در ظرف اصلی واکنش باقی نمانده باشد، آن را کر داده و دوباره روی کاغذ صافی خالی میکنیم. در این روش همیشه احتمال اینکه مقداری از رسوب از دست برود وجود دارد و دو دلیل را برای این هدررفت ذکر میکنند.
- مقداری از رسوب از در محلول حل شده و از فیلتر عبور میکند.
- مقداری از رسوب به کاغذ صافی میچسبد و دورریز میشود.

سانتریفیوژ
سانتریفیوژ به فرایندی گفته میشود که در آن محلول مورد نظر با سرعت بالایی چرخانده میشود. برای اینکه بتوان از این روش برای جداسازی رسوب از محلول استفاده کرد باید رسوب از محلول چگالتر باشد. سپس رسوب ته ظرف سانتریفیوژ جمع شده و به آرامی محلولی رویی را سرریز میکنیم. معمولا هدررفت این روش از صاف کردن کمتر است. این روش برای رسوبهایی که ذرات بسیار کوچکی دارند کارآمد است.

سرریز کردن
در این روش به آرامی به صورتی که رسوب از ته ظرف جدا نشود آن را سرریز کرده و محلول رویی را خالی میکنیم. از این روش هم به تنهایی و هم بعد از سانتریفیوژ کردن استفاده میشود.
تکامل استوالد
در برخی موارد رسوب را به مدت زمان زیادی دستنخورده باقی میگذارند. این زمان به رسوب کمک میکند ذراتی با اندازه بزرگتر و خلوص بالاتر تشکیل دهد. به فرایند باقی گذاشتن رسوب در محلول، تکامل استوالد گفته میشود.
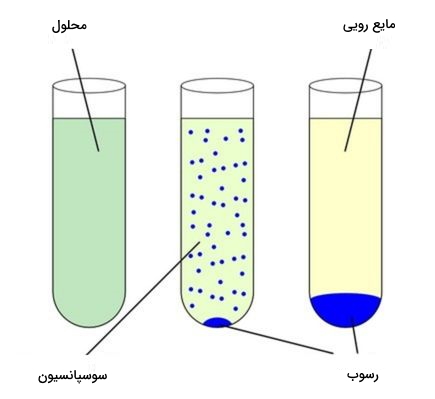
سوسپانسیون چیست ؟
در حالتی که ذرههای تشکیل دهنده رسوب خیلی کوچک باشند و جاذبه کافی برای جمع کردن آنها در ته ظرف واکنش وجود نداشته باشد، این ذرهها در کل محلول به صورت کلوئید پخش میشوند که به آن سوسپانسیون میگوییم. تفاوت رسوب و سوپانسیون در تصویر زیر به خوبی نمایش داده شده است.
عوامل موثر بر تشکیل رسوب در واکنش شیمیایی
عوامل موثر بر تشکیل رسوب از واکنشی به واکنش دیگر متغیر است. بعضی از واکنشها به دما وابسته هستند در حالیکه در بعضی دیگر فقط غلظت مواد اولیه تاثیرگذار است. بعد از تشکیل رسوب به محلول باقیمانده در ظرف واکنش اصطلاحا مایع رویی گفته میشود.
ویژگی های واکنش تشکیل رسوب
بسیاری از واکنشهایی که بعد از تکمیل از خود محصولی رسوبی به جا میگذارند ویژگیهای مشترکی دارند. در ادامه به برخی از این ویژگیها اشاره میکنیم.
- واکنشهای رسوبی در محیط آبی انجام میشوند.
- این واکنش بین یونهای موجود در محیط واکنش صورت میگیرد و محصول را به وجود میآورد.
- محصول واکنش رسوبی نامحلول در آب است.
- به واکنش رسوبی واکنش یون نیز گفته میشود زیرا یونها در آن مهمترین نقش را ایفا میکنند.
- این واکنشها وابسته به دما، غلظت محلول و بافر هستند.
- خلوص بالای رسوب به تشکیل بلورهای آن میانجامد.

کاربرد واکنش رسوبی
واکنش رسوبی کارکردهای بسیاری دارد که چند نمونه را در ادامه میآوریم.
- این واکنشها برای پی بردن به حضور یا عدم حضور عنصری خاص در محیط واکنش مفید هستند.
- از آنجا که بیشتر فلزها در رسوب دارای رنگ هستند میتوان از این واکنش برای شناسایی آنها استفاده کرد.
- از واکنشهای رسوبی برای استخراج منیزیم از آب دریا استفاده میشود.
- در بدن انسان این واکنش بین آنتیژن و آنتیبادی صورت میگیرد.
- از این واکنش برای تولید رنگدانهها استفاده میشود.
- در متالورژی از این واکنش برای تقویت استحکام آلیاژها بهره میگیرند.
در چند مورد استفاده عمده و مهم این نوع واکنش را به طور کامل بررسی میکنیم.
کاربرد در تجزیه کیفی
تشکیل رسوب در واکنش شیمیایی روشی پرکاربرد برای شناسایی حضور یا عدم حضور کاتیونی خاص در نمک است به این صورت که مثلا فلزهای قلیایی گروه اول با نمک مجهولی وارد واکنش میشوند و هیدروکسید فلزی مجهولی رسوب میدهد. برای شناسایی این کاتیون باید به رنگ آن توجه کرد.
مثالی از این مورد استفاده را با هم بررسی میکنیم. محلول باریم نیترات با یونهای سولفات وارد واکنش میشود و رسوب سفید رنگی که همان باریم سولفات است به دست میآید. مشاهده این رسوب سفید رنگ دلیلی بر حضور یونهای سولفات در محیط واکنش است.

کاربرد در سنتر ترکیبات معدنی
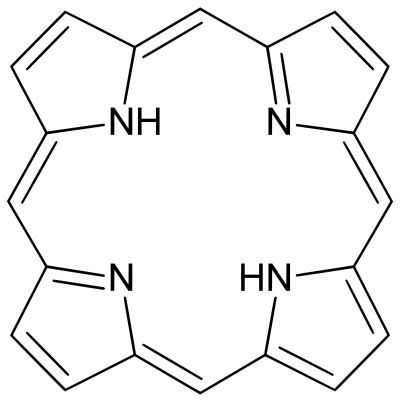
همانطور که اشاره کردیم واکنش تشکیل رسوب در دنیای شیمی آلی بسیار مهم و پرکاربرد است اما باید بدانیم که در شیمی معدنی نیز از این واکنش بهره گرفته میشود. استفاده این واکنش در جداسازی محصولات به دست آمده در سنتز مواد معدنی است. در بهترین حالت محصول واکنش در حلال نامحلول است در نتیجه رسوب تشکیل میشود و بلورهای خالص محصول به دست میآید.
در اینجا مثالی را بررسی میکنیم. سنتز پورفیرین در پروپانوئیک اسید را در نظر بگیرید. با سرد کردن محیط واکنش و رساندن آن به دمای اتاق بلورهای پورفیرین مشاهده میشود و با رد کردن از صافی به کمک قیف بوخنر محصول جداسازی میشود.
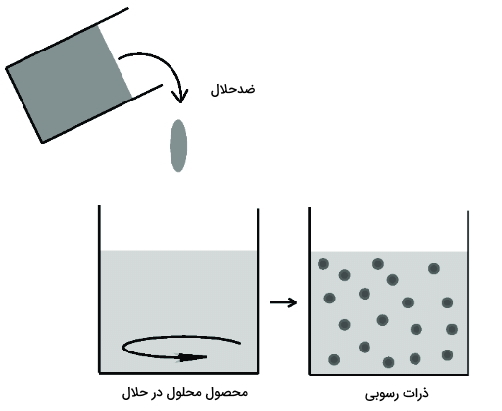
استفاده از ضد حلال
ضدحلال ترکیبی است که محصول واکنش در آن نامحلول باشد. از افزودن ضدحلال برای داشتن رسوب ترکیبات مورد نظر میتوان استفاده کرد. سپس با استفاده از یکی از روشهای جداسازی رسوب را از محلول جدا میکنیم.
مثالی از این مورد سنتز کروم(III) تترافنیل پورفورین کلرید است. این واکنش سنتزی در دیمتیل فرمالدهید انجام میشود و از آب به عنوان ضدحلال استفاده میکنیم. با افزودن آب به محیط واکنش محصول رسوب میکند و قابل جداسازی است.
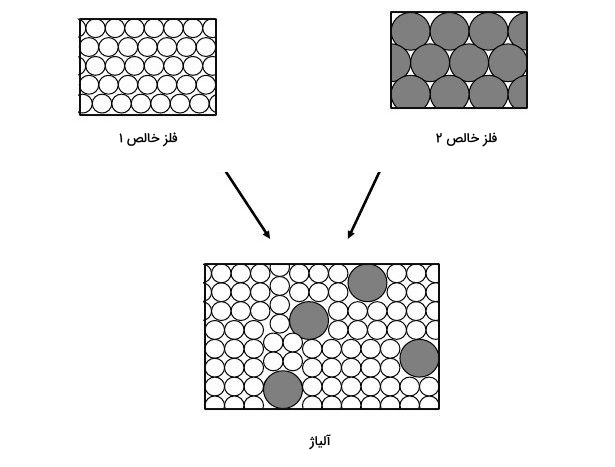
کاربرد در متالورژی
تشکیل رسوب در فاز جامد نیز ممکن است. این اتفاق زمانی میافتد که غلظت یک جامد از حد انحلالپذیری جامد مهمان، بر اثر خنک شدن سریع، بیشتر شود. از این واکنشها برای سنتز نانوکلاسترها استفاده میشود. همچنین در متالورژی از این روش برای استحکام بخشیدن به آلیاژها کمک میگیرند.
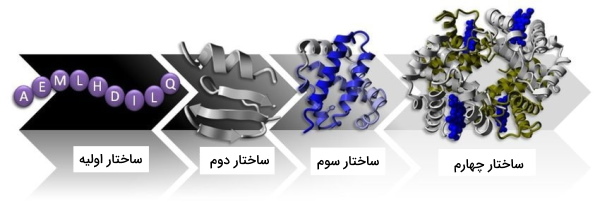
کاربرد در بیوشیمی
جداسازی و خالصسازی پروتئینها را میتوان با تغییر حلال یا مقدار ثابت دیالکتریک آن، مثلا تعویض آب با متانول، و یا با افزایش قدرت یونی محلول انجام داد. مولکولها ساختارهای سهگانه و چهارگانه پیچیده و برهمکنشهای بین مولکولی ضعیف از نوع پیوند هیدروژنی دارند. اینها همه میتوانند تغییر کنند و باعث عوض شدن پروتئین شوند.
کاربرد در طبیعت
واکنشی تشکیل رسوب بهوفور در طبیعت یافت میشود. در اعماق دریا و مجاورت «چاههای گرمابی» (Hydrothermal Vent) بسیاری از مواد معدنی به فرم رسوبی دیده میشوند. نمونهای از این رسوبات سولفیدها هستند که باعث به وجود آمدن ترک و حفره عمیق در کف اقیانوس میشوند.

هم رسوبی چیست؟
همرسوبی عکس واکنش تشکیل رسوب است. در این واکنش با روشهایی رسوب ایجاد شده را دوباره حل میکنند. در حالیکه ممکن است در نگاه اول این واکنش نامطلوب به نظر بیاید اما در شیمی تجزیه کاربرد بسیاری دارد. در تجزیههای وزنی وجود ناخالصیها کار را دچار مشکل میکند و وزن را بیشتر از آنچه هست نشان میدهد. از این واکنش در رادیوشیمی که با ترکیبات با مقادیر بسیار جزئی سرو کار دارد نیز استفاده میشود.
سوالهایی پیرامون تشکیل رسوب در واکنش شیمیایی
در این قسمت به چند سوال رایج و کاربردی در مورد تشکیل رسوب پاسخ میدهیم.
آیا نمک رسوب است ؟
بله، نمک رسوب است. به نمک نامحلولی که بتوان آن را از محلول واکنش جدا کرد رسوب گفته میشود. از این واکنش میتوان به حضور یونهای خاصی در محیط واکنش پی برد.
آیا تشکیل رسوب نشاندهنده انجام واکنش شیمیایی است ؟
بله، با تشکیل رسوب میتوان به این نتیجه رسید که واکنشی شیمیایی انجام شده است. مثلا با افزودن محلول نقره نیترات به محلول سدیم کلرید، رسوب سفید رنگ نقره کلرید تشکیل شده و واکنشی شیمیایی صورت میپذیرد.
چرا رسوب تشکیل میشود ؟
وقتی محلولی که حاوی کاتیون خاصی است با محلول دیگری حاوی آنیون مخلوط میشود، تشکیل رسوب ممکن خواهد بود. رسوب در واقع ترکیب نامحلولی است که در این فرایند به وجود میآید.
جمعبندی
تشکیل رسوب زمانی اتفاق میافتد که در نتیجه انجام یک واکنش و جابهجایی یون، ترکیبی نامحلول تشکیل شود. این ترکیب قابل جدا شدن از محیط واکنش است. برای این جداسازی از روشهای متنوعی استفاده میشود که هرکدام دقت و کاربرد خاص خودشان را دارند.
تمرین نوشتن چند معادله یونی خالص
در این بخش به سراغ چند نمونه واکنش میرویم و آن را تا مرحله معادله یونی خالص پیش میبریم. توجه داشته باشید که برای درک بهتر این قسمت به یاد داشتن چگونگی انجام واکنش جانشینی دوگانه و قوانین مربوط به انحلالپذیری که در بالا به آنها کامل پرداختهایم، مورد نیاز است.
تمرین اول
معادله زیر را در نظر بگیرید.
ابتدا طرف دوم واکنش را با توجه به مواد اولیه و دانش خود از واکنش جانشینی دوگانه حدس میزنیم. این نکته را به یاد داشته باشید که کاتیون و آنیون زوج خود را در این واکنش با یکدیگر عوض میکنند.
در مرحله بعد با کمک قوانین انحلالپذیری که در این مطلب آن را بررسی کردیم، تعیین میکنیم که هر محصول چه فرمی دارد. با توجه به قانون اول و سوم کاتیونهای و کلریدها محلول هستند بنابراین به فرم محلول در آب است. با توجه به قانون ششم هیدروکسیدها در آب نامحلول هستند بنابراین تشکیل رسوب میدهد. پس میتوانیم واکنش بالا را به صورت کاملتر بنویسیم.
در مرحله سوم نیاز است که تمامی واکنشدهندهها را به فرم کاتیونی و آنیونی تبدیل کنیم. در واقع واکنشدهندهها در محلول به این صورت هستند. نکتهای که در این مرحله مهم است رعایت موازنه بار و تعدا اتمهای هر عنصر در دو طرف است.
در انتها باید یونهای تماشاگر را از دو طرف واکنش حذف کنیم. منظور از یون تماشاگر آنهایی هستند که در دو طرف واکنش بدون هیچ تغییری حضور دارند. در این واکنش یونهای سدیم و کلر تماشاگر هستند. حاصل این مرحله معادله یونی خالص مد نظر است.
تمرین دوم
معادله زیر را در نظر بگیرید.
با توجه به موارد گفته شده در این مطلب میتوان حدس زد که محصولات این واکنش و هستند. پس طرف دوم واکنش به صورت زیر نوشته میشود.
در مرحله بعد با توجه به قوانین انحلالپذیری مشخص میکنیم که در محلول به چه صورتی حضور دارند. با توجه به قانون چهارم محلول است زیرا سولفاتها محلول هستند. به همین شکل متوجه میشویم که نیز با توجه به قانون اول و سوم محلول است. بنابراین واکنش به صورت زیر درمیآید.
در مرحله بعد هر واکنشدهنده را به کاتیونها و آنیونهای تشکیلدهندهاش تفکیک میکنیم. فراموش نکنید که در این مرحله موازنه کردن بار الکتریکی و تعداد اتمهای هر عنصر باید رعایت شود.
احتمالا حدس زدهاید که در این واکنش رسوبی تشکیل نمیشود و تمامی کاتیونها و آنیونها از دو طرف واکنش خط میخورند. این به معنای آن است که واکنش این تمرین، نمونهای از واکنش تشکیل رسوب نیست.
تمرین سوم
معادله زیر را در نظر بگیرید.
در وهله اول باید طرف دوم واکنش را بنویسیم. با توجه به مواردی که مرور کردیم محصولهای این واکنش، دو ماده و هستند. پس طرف دوم را به صورت زیر میتوانیم کامل کنیم.
با توجه به قوانین انحلالپذیری از آنجا که طبق مورد دوم، نیتراتها در آب محلول هستند نیز محلول است. اما محصول دوم، نامحلول است زیرا طبق قانون ششم هیدرکسیدها نامحلول هستند و فلز آهن جزء موارد استثنای این مورد نیست. در این مرحله اطلاعات جدید را وارد واکنش میکنیم.
در مرحله بعد باید هر واکنشدهنده محلول را به اجزای آن یعنی کاتیون و آنیون تفکیک کنیم. توجه داشته باشید که تمام اجزا باید از نظر بار الکتریکی و تعداد اتمهای عناصر در دو طرف واکنش موازنه باشند.
در این مرحله یونهای تماشاگر را یعنی آنهایی که در دو طرف واکنش یکسان هستند، حذف میکنیم.
محصول واکنش هیدروکسید آهن است که به صورت جامد باقی میماند.
تمرین چهارم
واکنش زیر را در نظر بگیرید.
با در نظر داشتن واکنش جانشینی دوگانه محصول این واکنش دو ماده و هستند. پس طرف دوم واکنش به صورت زیر نوشته میشود.
حالا باید با توجه به قوانین انحلالپذیری حالت فیزیکی هر محصول را بنویسیم. با توجه به قانون سوم انحلالپذیری به دلیل داشتن یون کلرید محلول است اما نامحلول است زیرا وجود یون باعث نامحلول شدن سولفاتها میشود. این یون استثنایی بر قانون چهارم انحلالپذیری است. حالا واکنش را با در نظر گرفتن حالت فیزیکی هر محصول مینویسیم.
مرحله بعد به تفکیک کاتیونها و آنیونهای موجود در واکنش میپردازیم. همانطور که پیش از این اشاره کردیم باید دو طرف واکنش از نظر بار و تعداد اتمهای هر عنصر موازنه باشند. این واکنش به صورت زیر نوشته میشود.
در مرحله بعد با حذف یونهای تماشاگر در دو طرف واکنش به معادله خالص یونی به صورت زیر دست پیدا میکنیم.
تمرین پنجم
واکنش زیر را در نظر بگیرید.
محصولهای این واکنش جانشینی دوگانه دو ماده و هستند. پس واکنش بدون در نظر گرفتن حالت فیزیکی طرف دوم به صورت زیر نوشته میشود.
برای نوشتن این مرحله باید به قوانین انحلالپذیری تسلط کافی داشته باشید. با توجه به قانون اول NaCl محلول و با توجه به قانون ششم نامحلول است. پس میتوان واکنش را به صورت کاملتر اینگونه نوشت.
در این مرحله با در نظر داشتن این نکته که دو طرف واکنش باید از نظر بار الکتریکی و تعداد اتمهای هر عنصر موازنه باشد آن را به کاتیونها و آنیونهای تشکیلدهنده تفکیک میکنیم. نتیجه این کار واکنشی به صورت زیر را به دست میدهد.
مانند تمرینهای قبلی در این مرحله یونهای تماشاگر را یعنی آنهایی که در دو طرف واکنش دستنخورده و بدون تغییر باقی میمانند حذف میکنیم. حاصل این کار معادله خالص یونی زیر است.
تمرین ششم
واکنش زیر را در نظر بگیرید.
با توجه به واکنش جانشینی دوگانه محصولهای این واکنش دو ماده و خواهند بود. بنابراین واکنش را به صورت زیر کامل میکنیم.
در این مرحله با توجه به قوانین انحلالپذیری حالت فیزیکی هر محصول را مینویسیم و واکنش را کامل میکنیم. برای نوشتن حالت فیزیکی به قانون دوم مراجعه میکنیم. طبق این قانون نیتراتها محلول هستند. با توجه به قانون سوم میدانیم که یدیدها نیز محلول هستند پس حالت فیزیکی ماده دوم را نیز داریم. واکنش کامل به صورت زیر نوشته میشود.
با دانستن حالت فیزیکی هر محصول میتوانیم آنها را به کاتیونهای و آنیونهای تشکیل دهنده تفکیک کنیم. رعایت موازنه دو طرف واکنش از نظر بار الکتریکی و تعداد اتمهای هر عنصر را نباید فراموش کنیم. پس از تفکیک واکنش به صورت زیر خواهد شد.
همانطور که مشاهده میکنید تمامی مواد در دو طرف واکنش به صورت محلول هستند که نتیجه میگیریم طی این واکنش رسوبی تشکیل نمیشود.
تمرین هفتم
واکنش زیر را در نظر بگیرید.
ابتدا باید طرف دوم واکنش را حدس بزنیم و واکنش را کامل کنیم. با در نظر داشتن این نکته که در این نوع واکنشها یونهای زوجهای همراه خود را تبادل میکنند میتوان واکنش را به صورت زیر نوشت.
در این مرحله با مراجعه به قوانین انحلالپذیری حالت فیزیکی هر محصول را مینویسیم. با توجه به قانون چهارم به فرم محلول خواهد بود زیرا سولفات است. محصول دوم یعنی نیز با توجه به قانون چهارم و داشتن نیترات محلول است. پس واکنش را به صورت زیر کامل میکنیم.
در این مرحله هر ماده را به آنیونها و کاتیونهای سازنده تفکیک میکنیم. در نوشتن این مرحله در نظر داشته باشید که دو طرف واکنش باید از نظر بار الکتریکی و تعداد اتمهای هر عنصر موازنه باشد. بعد از تفکیک واکنش به صورت زیر در میآيد.
مشاهده میکنید که تمامی یونهای در دو طرف واکنش یکسان و به عبارتی یونهای تماشاگر هستند در نتیجه از دو طرف واکنش حذف میشوند. در این واکنش نیز رسوبی تشکیل نمیشود.












باسلام و خسته نباشید به حضور استاد محترم برای رسوب دادن طلا و نقره از چه چیزهایی استفاده کنیم که بهتر بتونیم رسوب دهیم با تشکر
با سلام.
برای رسوبدهی نقره و طلا از روشهای بسیاری استفاده میشود. عمومیترین روش رسوبگیری از طلا و نقره افزودن یک عامل کاهنده به محلول این مواد است. از عوامل کاهنده این عناصر فلزی میتوان به عنصر کلر و سدیم متا بی سولفیت اشاره کرد.
با تشکر از همراهی شما با مجله فرادرس