واکنش دهنده و فرآورده در شیمی — به زبان ساده

یک دانشجوی شیمی به هنگام مطالعه مطالب مختلف شیمی همچون استوکیومتری یا بررسی ثابت تعادل و سینتیک شیمیایی و همچنین بررسی نتایج آزمایش در آزمایشگاه شیمی، با واکنش دهنده و فراورده های بسیاری روبرو میشود که باید به کمک روشهای مختلف جداسازی در شیمی همچون انواع روشهای کروماتوگرافی مانند کروماتوگرفی گازی و TLC، فرآوردههای حاصل را تحلیل کند. در این آموزش قصد داریم با واکنش دهنده و فرآورده در شیمی آشنا شویم تا بتوانیم تفاوت آنها را از یکدیگر تشخیص دهیم.
واکنش دهنده و فرآورده
اگر بخواهیم واکنش دهنده و فرآورده را در شیمی بررسی کنیم باید در ابتدا با واکنش شیمیایی و معادله واکنش آشنا باشیم. به طور مثال، واکنش بین روی و گوگرد را در نظر بگیرید که حاصل آن سولفید روی خواهد بود.
سولفید روی $$\rightarrow$$ گوگرد + روی
راه بهتری که برای نمایش واکنش بالا وجود دارد این است که از نماد مواد شرکت کننده در واکنش استفاده کنیم. در نتیجه میتوان واکنش بالا را به شکل زیر نوشت:
$$\begin{equation}
\mathrm{Zn}+\mathrm{S} \rightarrow \mathrm{ZnS}
\end{equation}$$
به معادله واکنش بالا دقت کنید. در سمت چپ فلش، عناصر روی و گوگرد قرار دارند که در اثر واکنش با یکدیگر، به ترکیبی به نام سولفید روی تبدیل میشوند. ماده یا مواد سمت چپ در یک معادله واکنش را با نام «واکنشدهنده» (Reactant) و مواد حاصل از واکنش را که در سمت راست قرار دارند با نام «فرآورده» (Products) میشناسند. بنابراین، واکنش دهنده و فرآورده در واکنش بالا به ترتیب روی و گوگرد - به عنوان واکنش دهنده - و سولفید روی هستند.
شکل استانداردی برای نوشتن یک معادله شیمیایی وجود دارد که در آن، واکنش دهنده و فرآورده به ترتیب در سمت چپ و راست معادله واکنش نوشته میشوند. یک فلش نیز از سمت فرآورده (ها) به سمت واکنشدهنده (ها) قرار دارد تا جهت انجام واکنش، مشخص باشد.
فرآوردهها $$\rightarrow$$ واکنشدهندهها

به هنگام نمایش واکنش دهنده و فرآورده در معادله شیمیایی، در صورت نیاز، برای توضیحات بیشتر، نمادهایی در بالا یا پایین فلش نوشته میشوند. به طور مثال در واکنشی که باید به آن گرما بدهیم از نماد «$$\Delta$$» استفاده میشود. البته خوب است بدانید که برای واکنشهای تعادلی که در هر دو جهت رفت و برگشت انجام میگیرند، از فلشهای دوطرفه بهره میگیرند.

واکنش دهنده و فرآورده سوختن شمع
آیا تا کنون به سوختن شمع دقت کردهاید که ببینید چه اتفاقی در این میان رخ میدهد. سوختن شمع را میتوان به عنوان یک تغییر شیمیایی توصیف کرد که در آن، یک یا چند ماده، به شکل دیگری از ماده یا مواد مختلف تبدیل میشوند. واکنش دهنده و فرآورده سوختن شمع را میتوان به شکل زیر تعریف کرد. واکنشدهنده به ماده یا موادی میگویند که شروع یک واکنش شیمیایی را در صورت وجود آنها انجام میگیرد. فرآورده نیز به موادی میگویند که در طول یک واکنش شیمیایی به تولید میرسند.
در نتیجه، برای بررسی واکنش دهنده و فرآورده در سوختن شمع باید ماده یا مواد شرکت کننده در واکنش را مورد بررسی قرار دهیم. به هنگام سوختن شمع، واکنشدهندهها شامل نخ شمع و موم به همراه اکسیژن خواهند بود و فرآوردهها نیز گاز دیاکسید کربن و بخار آب هستند. برای چرایی مشخص شدن واکنش دهنده و فرآورده سوختن شمع باید به طور کلی به واکنش سوختن اشاره کنیم. در حالت کلی به واکنش اکسایش و کاهش در دمای بالا بین یک سوخت (کاهنده) و یک اکسنده (به طور معمول اکسیژن اتمسفری)، واکنش سوختن میگویند. حال اگر این سوخت، مادهای آلی مثل آلکانها یا هیدروکربنهای آروماتیک و شامل کربن باشد، فرآورده حاصل در اثر سوختن کامل یعنی سوخت با بازده واکنش ۱۰۰ درصدی، دیاکسید کربن و بخار آب خواهد بود.
مثال برای واکنش دهنده و فرآورده
در ادامه، مثالهایی را برای درک بهتر واکنش دهنده و فرآورده مطرح میکنیم. به طور مثال، واکنش متان و اکسیژن را در نظر بگیرید.
$$\begin{equation}
\mathrm{CH}_{4}+2 \mathrm{O}_{2} \rightarrow \mathrm{CO}_{2}+2 \mathrm{H}_{2} \mathrm{O}
\end{equation}$$
واکنش بالا با توجه به تعاریف ارائه شده، نوعی واکنش سوختن است و برای تعیین واکنش دهنده و فرآورده آن باید به معادله واکنش دقت کنیم. در این واکنش، متان با اکسیژن واکنش میدهد و دیاکسید کربن و آب به تولید میرسد. در طرف چپ معادله، واکنشدهندهها یعنی متان و اکسیژن قرار دارند و فرآوردهها یعنی دیاکسید کربن و بخار آب نیز در طرف راست قرار گرفتهاند.
معرفی فیلم آموزش علوم تجربی پایه هشتم - بخش شیمی
بررسی واکنش دهنده و فرآورده در شیمی از جمله دروسی است که در شیمی مقطع دبیرستان مورد توجه قرار میگیرد. به همین منظور، «فرادرس» دورهای ۵ ساعته شامل شش درس را تدوین کرده است که در ادامه به توضیح این دروس میپردازیم.
در درس یکم این آموزش، مخلوطها مرور میشوند که از مباحث مهم آن میتوان به محلولها، کلوئید، سوسپانسیون و شناساگرهای اسید و باز اشاره کرد. درسهای دوم و سوم به تعریف تغییر شیمیایی و فیزیکی اختصاص دارند و انواع واکنشهای شیمیایی، مثلث آتش و اجزای تشکیل دهنده هوا از جمله مباحث مهم آن به شمار میآیند.
در درس چهارم، عدد اتمی، اتم و مولکول بررسی میشوند و نظریههای اتمی و ایزوتوپها در درس پنجم مرور خواهند شد. در انتها نیز درس ششم به آموزش یونها، کاتیون و آنیون و نحوه تشکیل نمک طعام اختصاص دارد.
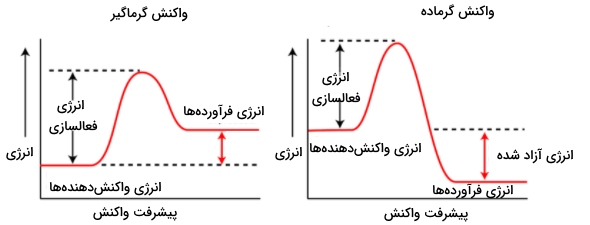
سطح انرژی واکنش دهنده و فرآورده
برای بررسی سطح انرژی واکنش دهنده و فرآورده باید نوع واکنش یعنی واکنش گرماده یا گرماگیر مشخص باشد. به طور مثال به تصویر زیر دقت کنید. در تصویر سمت چپ، سطح انرژی واکنش دهنده و فرآورده در یک واکنش گرماگیر نشان داده شده است و در تصویر سمت راست نیز سطح انرژی این مواد را در واکنشی گرماگیر مشاهده میکنید.

انرژی فعال سازی
تمامی واکنشهای شیمیایی حتی واکنشهای گرماده برای شروع واکنش به مقداری انرژی نیاز دارند. به این انرژی، انرژی اکتیواسیون یا فعالسازی میگویند. نمودار زیر، تغییرات انرژی را برای واکنشهای گرماده و گرماگیر مشخص میکند که در آن، سطوح انرژی واکنش دهنده و فرآورده با در نظر گرفتن انرژی فعالسازی نشان داده شده است.












ممنون خیلی خوب بود فقط میشه به این سوالم پاسخ بدید لطفا
اگر انرژی فراورده بیشتر از واکنش دهنده باشد یک واکنش گرما گیر است و واکنش دهنده انرژی از دست داده؟
و اگر انرژی واکنش دهنده بیشتر از فراورده باشد واکنش گرماده و واکنش دهنده انرژی گرفته؟
با سلام؛
خوشحالیم که مطالعه مطلب برای شما مفید بوده است. برای درک بهتر این موضوع، مطالعه مطلب «واکنش گرماده و گرماگیر | به زبان ساده» پیشنهاد میشود.
با تشکر از همراهی شما با مجله فرادرس
واقعا مفید بود و واضح و کامل،ممنونم
با سلام؛
خوشحالیم از اینکه این مطلب برای شما مفید بوده است.
با تشکر از همراهی شما با مجله فرادرس
ممنون عالی بود خیلی کمکم کرد
با سلام؛
از لطف شما سپاسگزاریم.
با تشکر از همراهی شما با مجله فرادرس