احتراق در ترمودینامیک — از صفر تا صد

احتراق فرآیندی اکسایشی است که معمولا در گازها رخ میدهد. در اکثر مواقع در نتیجه این فرآیند، نور، حرارت و دود تولید میشود. معمولا از مشخصههای فرآیند احتراق، دمای بالای آن است. البته مواردی نیز وجود دارند که در آن احتراق در دمای به نسبت پایینتری رخ میدهند. بخش مهمی از صنعت حمل و نقل و تولید انرژی وابسته به این فرآیند است. برای نمونه شکل زیر لحظه احتراق در موشکهای حمل کننده شاتل فضایی را نشان میدهد.

هدف اصلی از مطالعه فرآیند احتراق، دستیابی به فرآیندی زمانبندی شده، ایمن و پاک است. به طور کلی احتراق، فرآیندی شیمیایی-ترمودینامیکی است که ما در این مطلب بیشتر به جنبه ترمودینامیکی آن اشاره میکنیم. بهمنظور تحلیل فرآیند احتراق میتوان رخ دادن آن را به دو بخش تقسیمبندی کرد:
- رفتار در حالت تعادل (حالتی که در انتهای فرآیند به آن نیاز داریم)
- رفتار سینماتیک (وضعیت احتراق در هنگام رخ دادن آن تا رسیدن به حالت تعادل)
ترمودینامیک احتراق مواردی همچون نسبت سوخت به هوا، سرعت فرآیند، بیشترین کار انجام شده، ترکیب گاز خروجی و غیره را مورد بررسی قرار میدهد. این در حالی است که سینماتیک احتراق در مورد فرآیند ترکیب شدن اجزاء ورودی، شکل شعله، پایداری و توسعه آن صحبت میکند.
مطالعه فرآیند احتراق در زیر شاخهای از ترمودینامیکِ فرآیندهای شیمیایی، تحت عنوان «ترموشیمی» (Thermochemistry) انجام میشود. در حالت کلی احتراق در حالات مختلفی از مواد صورت میگیرد. اما در این قسمت تمرکز ما روی فرآیندهایی است که در نتیجه ترکیب سوخت و هوا، در حالت گازی است.
در ابتدا مطابق مدل ارائه شده در شکل زیر، بستری ایدهآل را در نظر بگیرید که عمل احتراق در آن انجام میشود.
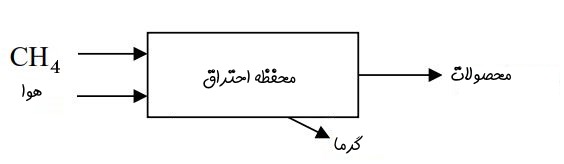
مطابق با شکل بالا اجزاء ورودی (هوا+سوخت) در حالت پایا به سیستم نشان داده شده وارد میشوند. روش ارائه شده در این مطلب تحت عنوان احتراقِ جعبه سیاه شناخته میشود. این نامگذاری به این دلیل است که در حقیقت، درون جعبه مورد بررسی قرار نمیگیرد؛ برای نمونه در این روش نحوه ترکیب سوخت و هوا مد نظر ما نیست. یا اینکه کاری به شکل و شدت شعله درون جعبه نداریم. فرض مهم دیگر این است که حجم جعبه به اندازهای بزرگ در نظر گرفته شده که محصولات خروجی در حالت پایا فرض میشوند.
فرض بالا را در ذهن داشته باشید. جهت بررسی ترمودینامیکی یک سیستم احتراقی، در ابتدا بایستی با اصولی از ترمودینامیک آشنا باشیم که در ادامه به آنها اشاره خواهیم کرد.
اصول ترمودینامیک
برای سیستمی به حجم V، انرژی E و تعداد مول ni در مورد هر جز شیمیایی، اصول ترمودینامیک را میتوان به طور خلاصه و به شکل زیر بیان کرد:
- قانون صفرم: میتوان عبارتی تحت عنوان تابع حالت ((T(E,V,ni) تعریف کرد که سطح ترمودینامیکی سیستم را نشان میدهد. در حالتی که دو سیستم در تماس با یکدیگر قرار گیرند، دو سیستم به نحوی با یکدیگر تبادل انرژی میکنند که مقدار این تابع برای هر دوی آنها برابر میشود [در حقیقت دمای دو جسم که در ارتباط با یکدیگر قرار گرفتهاند، در حالت پایا برابر است].
- قانون اول: تغییرات انرژی کل یک سیستم، برابر با برآیند انرژی حرارتی مبادله شده با سیستم و کار جابجا شده از مرزهای سیستم است. در حقیقت اگر به سیستم به اندازه Q انرژی داده شود و به اندازه W روی آن کار انجام شود، قانون اول رابطه Q=ΔE-W را ارائه میدهد.
- قانون دوم: تابع حالتی تحت عنوان آنتروپی یا (S(E,V,ni وجود دارد که توزیع انرژیِ درونِ سیستم را نشان میدهد. قانون دوم بیان میکند که یک فرآیند همواره در مسیری جلو میرود که این خاصیت افزایش مییابد.
- قانون سوم: اگر انرژی سیستمی به حداقل مقدار خود برسد، آنتروپی سیستم به صفر نزدیک میشود.
اصول بیان شده در بالا امکان فرمولبندی مورد نیاز جهت تحلیل فرآیندها را فراهم میآورد.
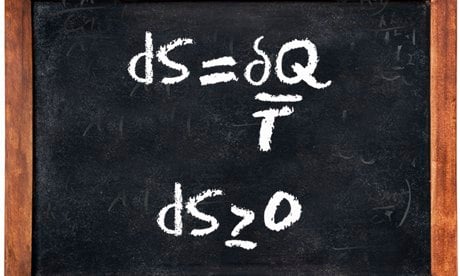
احتراق
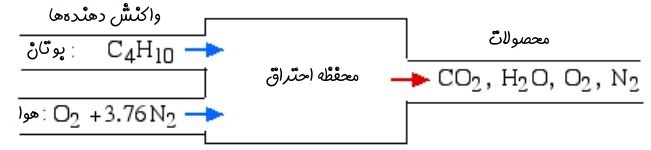
در این قسمت فرآیند احتراق و تحلیل ورودیها و خروجیها را در قالب مثال توضیح خواهیم داد. همچنین توجه داشته باشید که سوخت ورودی به سیستم به شکل CxHy در نظر گرفته شده است. لازم به ذکر است که سوخت به هر صورتی میتواند باشد.
از نظر حجمی ۲۱ درصد از هوا را، اکسیژن تشکیل میدهد. بخشی عمده از مقدار باقیمانده را نیتروژن تشکیل میدهد. از این رو جهت تحلیل احتراق، هوا را به صورت ۷۹ درصد نیتروژن و ۲۱ درصد اکسیژن در نظر میگیریم. بنابراین هر مول اکسیژن به همراه ۳.۷۶=79/21 مول از نیتروژن، با هیدروکربن در نظر گرفته شده (CxHy) واکنش میدهد. با استفاده از جرم مولکولی نیتروژن و اکسیژن، جرم مولکولی هوا برابر با $$29 \enspace kg/kmol$$ محاسبه میشود. همچنین در این فرآیند فرض شده که نیتروژن در واکنش شرکت نمیکند.
واکنش احتراق
در حالت کلی فرآیند احتراق را میتوان در دو بخش واکنشِ واکنشدهندهها (Reactant) و تولید محصولات (Product) دستهبندی کرد. واکنشدهندهها از دو بخش «اکسید کننده» (Oxidizer) و سوخت تشکیل شدهاند. در سادهترین حالت، واکنش اکسیژن با هیدروکربن را احتراق استوکیومتری مینامند. در شکل زیر نمونهای از این واکنش نشان داده شده است.
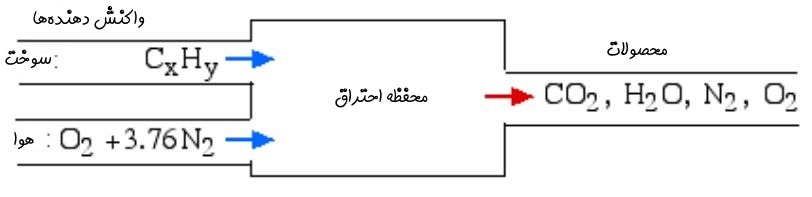
در این نوع احتراق تمامی کربن موجود در واکنشدهندهها با دیاکسید کربن و تمامی هیدروژنها در تشکیل آب شرکت میکنند. از این رو میتوان واکنش شیمیایی را به شکل زیر بیان کرد:
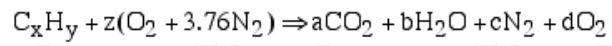
توجه داشته باشید که ضرایب ثابت a ,b ,c ,d و z را میتوان با استفاده از برابر قرار دادن تعداد اتمهای یک عنصر در سمت چپ و راست معادله، بدست آورد. با برابر قرار دادن ضرایب O در دو طرف معادله، d برابر با صفر بدست میآید. با برابر فرض کردن بقیه عناصر معادلاتی بدست میآیند که در جدول زیر ارائه شدهاند.
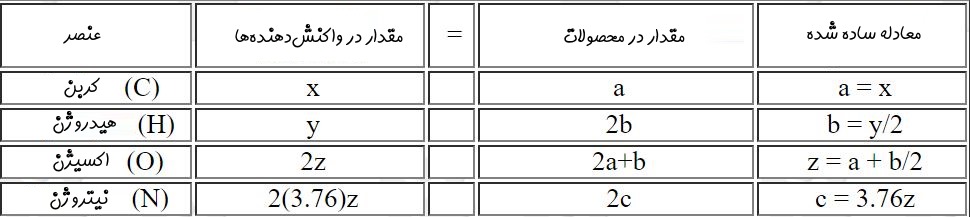
توجه داشته باشید که H2O تولید شده میتواند به صورت مایع یا بخار باشد که به دما و فشار محصولات وابسته است. برای درک بهتر، مطابق با شکل زیر حالتی را فرض کنید که در آن متان (CH4) با اکسیژن واکنش میدهد. به حداقل مقداری از هوا که جهت احتراق کامل نیاز است، «هوای تئوری» گفته میشود. در حالتی که سوختی با هوای تئوری واکنش میدهد، اکسیژنی در محصولات تولید نمیشود. اگر مقداری کمتر از هوای تئوری با سوخت واکنش دهد، در محصولات، کربن مونوکسید تولید میشود. از این رو همواره تلاش میشود تا هوای بیشتری به محفظه احتراق تزریق شود تا از تولید مونوکسید کربن جلوگیری شود. هوای بیشتر از مقدار تئوری نیز منجر به تولید اکسیژن در محصولات میشود.
معمولا میزان هوای استفاده شده جهت واکنش را با استفاده از ضریب سوخت-هوا (AF) نشان میدهند. این ضریب برابر با نسبت زیر تعریف میشود.
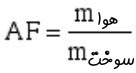
با فرض اینکه واکنش دهندهها با هوای تئوری واکنش دهند، ضریب AF به ترتیب زیر بدست میآید.

همچنین در حالتی که بوتان (C4H10) به عنوان سوخت در نظر گرفته میشود، مقدار هوای تئوری را میتوان به صورت زیر بدست آورد.
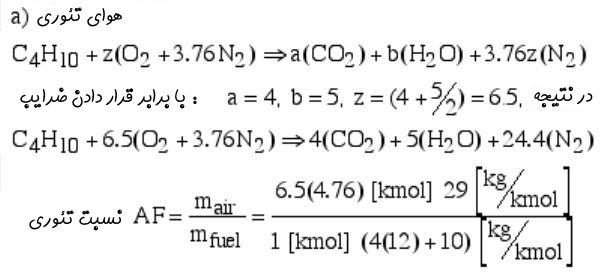
با توجه به اینکه محصولات در اکثر واکنشها در دمای بسیار بالایی قرار دارند، بنابراین فرض گاز کامل برای محصولات خروجی صحیح است. از این رو معادلات گاز کامل برای محصولات خروجی را میتوان به صورت زیر بیان کرد:
P.V=m.R.T=(m/M)R.M.T
در رابطه بالا m ,V ,P و T به ترتیب برابر با فشار، حجم، جرم و دما هستند. از طرفی R و M نشان دهنده ثابت گازها و جرم مولی ماده هستند. رابطه بین R و M به صورت زیر است.
R=Ru/M=۸.۳۱۴ kj/[kmol.k]
همچنین تعداد مول هر ماده را میتوان با استفاده از رابطه زیر بدست آورد.
N=m/M
ثابتهای مخلوط مواد
موارد ذکر شده در بالا از اصول مهم احتراق هستند. یکی از این اصول قانون پایستگی است که میگوید جرم ورودی به محفظه و خروجی از آن با یکدیگر برابر هستند. همچنین این فرآیند در جهتی حرکت میکند که آنتروپی مجموع، افزایش مییابد. این عبارت نیز در نتیجه قانون دوم ترمودینامیک است.
در یک فرآیند احتراق مقدار عناصر، قبل و بعد از فرآیند با یکدیگر برابر هستند. برای نمونه مولکول CH4 به محفظه وارد میشود و یکی از خروجیها CO2 است. در این فرآیند تعداد اتمهای کربن در ورودی و خروجی برابر با ۱ است. جهت توصیف درست تغییرات شیمیایی رخ داده بایستی ثوابتی تعریف کرد که در زیر آنها را بیان میکنیم.
کسر مولی
برای یک سیستم که از چند عنصر مختلف تشکیل شده ثوابت زیر را تعریف میکنیم:
- مول: ۱۰۲۳×۶.۰۲۳۶ مولکول
- تعداد مول: ni
- تعداد کل مولها: $$n_s= \Large \sum_{i=1}^{k} n_i$$
- کسر مولی جزء iام: $$X_i \equiv \Large \frac {n_i}{n_s}$$
همین مقادیر را میتوان در مورد جرم نیز تعریف کرد. در ادامه این موارد ارائه شده.
کسر جرمی
با فرض اینکه Wi نشان دهنده جرم مولکولی جزء iام باشد، جرم جزء iام را میتوان با استفاده از رابطه زیر بیان کرد:
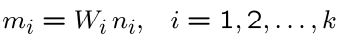
در نتیجه جرم کل اجزاء (یا مولکولها) مخلوط، با استفاده از رابطه زیر قابل توصیف است:
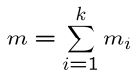
همانند کسر مولی، کسر جرمی را نیز میتوان به صورت زیر تعریف کرد:
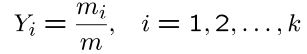
با توجه به مفهوم تعریف شده برای کسر مولی و کسر جرمی، جرم مولکولی برای کل اجزا به شکل زیر قابل تعریف است.
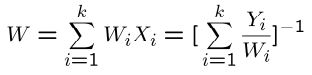
جرم مولی عناصر
استفاده از مفهوم جرم مولی عناصر در محاسبات مربوط به احتراق میتواند بسیار مفید باشد. توجه داشته باشید که جرم اجزا در نتیجه واکنش شیمیایی عوض میشود، اما مجموع جرم یک عنصر در قبل و پس از واکنش ثابت میماند. جرم مولکولی و جرم تمامی اتمهای قرار گرفته در یک عنصر به ترتیب برابر با mj ,Wj است.
تعداد اتمهای عنصر jامِ قرار گرفته در مولکولِ جزء iام برابر است با: aij
جرم تمامی اتمهای jام سیستم برابر است با:
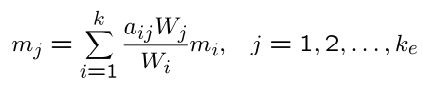
در رابطه بالا ke نشان دهنده تعداد تمامی عناصر شرکت کننده در واکنش است. با توجه به تعریفهای انجام شده در بالا، کسر جرمی عنصر jام را میتوان به شکل زیر بیان کرد:
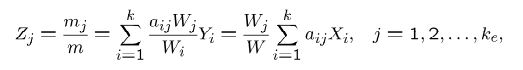
بدیهی است که حاصل جمع کسرهای تعریف شده برابر با ۱ است. در حقیقت میتوان گفت:
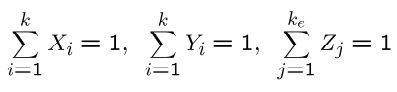
چگالی مولی جزئی
تعداد مول در واحد حجمِ V را چگالی مولی جزئی مینامند و مقدار آن برابر است با:
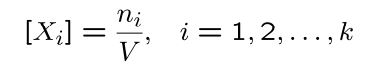
از این رو چگالی مولی کل سیستم را میتوان به شکل زیر تعریف کرد:
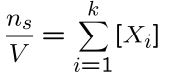
چگالی جزئی
چگالی و چگالی جزئی جرم iام به شکل زیر تعریف میشود.
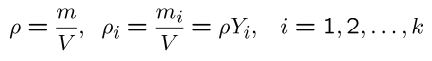
همچنین چگالی مولی جزئی را میتوان با استفاده از چگالی جزئی و کسر جرمی، به صورت زیر نشان داد.
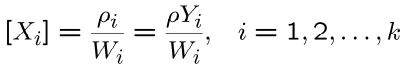
قدم بعدی استفاده از پارامترهای تعریف شده بالا در معادلات پایهای ترمودینامیک است که در ادامه بیان شده.
معادله حالت گاز ایدهآل
در اکثر مواردی که با فرآیند احتراق مواجه هستیم، قانون گاز ایدهآل نیز صادق خواهد بود. این قانون در حالتهایی که با فشار بالا مواجهایم نیز اعتبار دارد چرا که دمای احتراق نیز بسیار بالا است. در مخلوطی از گازهای ایدهآل، مولکولهای بخش iامِ کل سیستم به دیواره حجم کنترل فشاری برابر با مقدار زیر وارد میکنند.
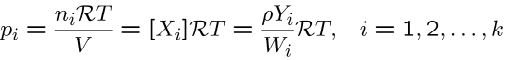
در رابطه بالا R، ثابت جهانی گازها را نشان میدهد که مقدار آن برابر است با:
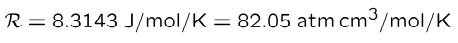
قانون دالتون
در این بخش میخواهیم به معرفی و بررسی قانون دالتون در مورد گازها بپردازیم. برای یک گاز ایدهآل، فشار کل سیستم برابر با فشار جزئی هرکدام از بخشهای سیستم است. در نتیجه معادله حالت برای مخلوطی از گازهای ایدهآل برابر است با:
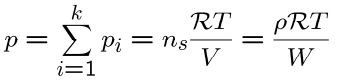
همچنین فشار جزئی یک سیستم را میتوان با استفاده از حاصلضرب کسر مولی در فشار کل و به صورت زیر بیان کرد:
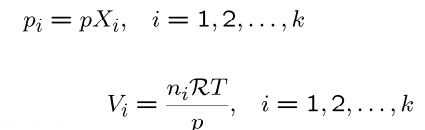
از این رو حجم جزئی هر بخش را نیز میتوان به طور مشابه و مطابق با رابطه زیر ارائه کرد.
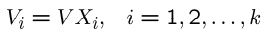
در مسائل پیچیدهتر مفاهیم بالا کاربرد دارند. اما در حالت کلی میتوان با تعاریف ساده مولاریته و فقط با استفاده از قانون گاز کامل به سوالات مربوط به احتراق پاسخ داد.
مثال
فرض کنید که مطابق با شکل زیر پروپان با ۶۱ درصد هوای اضافی میسوزد.
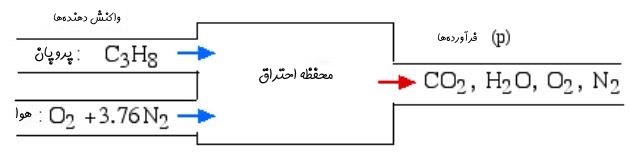
هوای مفروض در دمای ۲۵ درجه وارد مخزن میشود. فرض کنید احتراق کامل در فشار ۱ اتمسفر رخ میدهد. با این فرضیات موارد زیر مطلوب است:
- نسبت هوا به سوخت
- درصد کربن دیاکسید موجود در محصولات
در ابتدا بایستی معادله شیمیایی واکنش نوشته شود و ضرایب واکنشدهندهها و محصولات در دو سمت بدست آید. توجه داشته باشید که ضریب هوای ورودی بایستی برابر با ۱.۶۱ قرار داده شود. بنابراین رابطه شیمیایی واکنش به صورت زیر نوشته میشود.
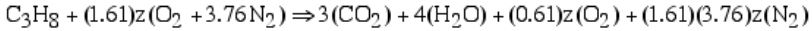
با برابر قرار دادن تعداد اتمهای اکسیژن در دو سمت معادله، مقدار z برابر با ۵ بدست میآید. در نتیجه شکل نهایی رابطه بالا برابر است با:
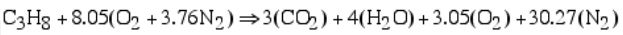
با بدست آمدن ضریب نیتروژن و اکسیژن ورودی، نسبت سوخت به هوا برابر است با:

با توجه به مفاهیم بالا و اینکه محصولات خروجی به صورت گاز کامل در نظر گرفته میشوند، از این رو درصد کربن دیاکسید در محصولات خروجی برابر است با:

تحلیل قانون اول ترمودینامیک در فرآیند احتراق
همانطور که در ابتدای مطلب نیز بیان شد، از مهمترین نتایج احتراق، تولید حرارت است. این حرارت در نتیجه افت آنتالپی واکنشدهندهها ایجاد میشود. برای تحلیل این موضوع حجم کنترلی مطابق با شکل زیر در نظر بگیرید به نحوی که کاری انجام نشده و انرژی پتانسیل و جنبشی ثابت باشد.
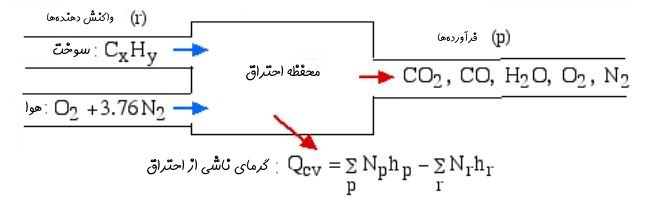
توجه داشته باشید که h در روابط نشان دهنده آنتالپی است. با توجه به اینکه چندین جزء در واکنش شرکت میکنند، از این رو بایستی مرجعی یکسان برای تمامی آنها در نظر گرفت. معمولا دمای ۲۵ درجه و فشار ۱ اتمسفر به عنوان مرجع در نظر گرفته میشود. جداول ترمودینامیکی مشخصی جهت اطلاع از آنتالپی یک ماده در شرایط استاندارد وجود دارد. برای نمونه جدول زیر آنتالپی کربن مونوکسید را در دماهای مختلف نشان میدهد.
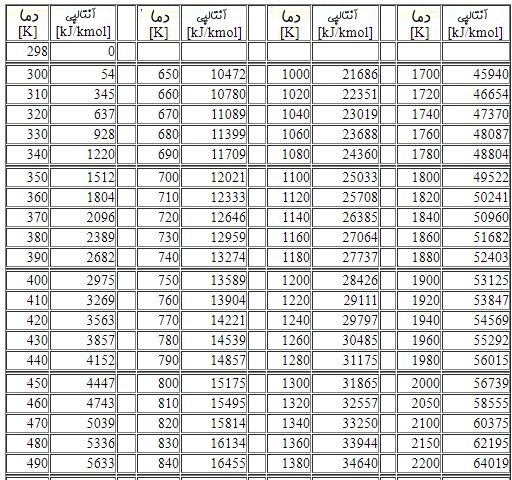
احتراق متان
برای تحلیل قانون اول مطابق با شکل زیر فرض کنید گاز متان به محفظه احتراقی وارد میشود و با هوای تئوری واکنش میدهد.
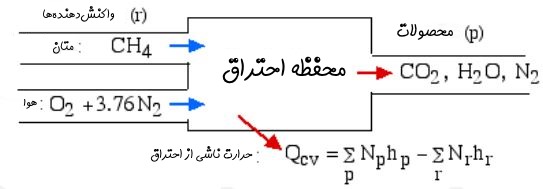
معادله واکنش برای سیستم بالا به صورت زیر است:
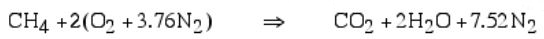
اجزا پایهای رابطه بالا O2 , CH4, CO2 و H2O هستند. هنگامی که مخلوط ایجاد شود، به تغییرات آنتالپی، آنتالپی تشکیل گفته میشود که با hfo گفته میشود. در این مثال آنتالپی تشکیل اجزا مطابق با جدول زیر هستند.
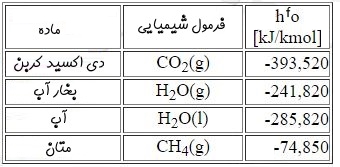
علامت منفی مقادیر جدول بالا به این معنی است که فرآیند تشکیل این مواد گرماده است. در حقیقت جهت تشکیل آنها حرارت از سیستم خارج میشود. توجه داشته باشید که آنتالپی تشکیلِ عناصر پایهای مثل O2 و N2 همواره صفر است.
اختلاف آنتالپیِ تشکیلِ ورودیها و خروجیها مقدار انتقال حرارت فرآیند را نشان میدهد. قبل از محاسبه انتقال حرارت بایستی بگوییم که فرض بر این است که دما و فشار واکنشدهندهها و محصولات به ترتیب برابر با ۲۵ درجه و ۱ اتمسفر است. با توجه به مفاهیم بیان شده، مقدار انتقال حرارت و همچنین انتقال حرارت به ازای ۱ کیلوگرم سوخت در این فرآیند برابر است با:

به مقدار حرارت بدست آمده در بالا «آنتالپی واکنش» گفته میشود. در حالتی که از حرارت آزاد شده، استفاده خارجی (مثلا جهت فوق گرم کردن آب در سیکل رانکین) شود، محصولات در دمای کمتری قرار میگیرند. در ادامه حالتی آدیاباتیک را بررسی خواهیم کرد که در آن محفظه به صورت عایق در نظر گرفته میشود. در نتیجه حرارت تولید شده صرف تغییرات دما و حالت محصولات واکنش میشود.
دمای آدیاباتیک شعله
فرض کنید فرآیند احتراقی به صورت آدیاباتیک رخ دهد. در حقیقت حرارت تولید شده در این فرآیند به محصولات منتقل میشود. در چنین حالتی دمای محصولات بسیار زیاد خواهد شد. به چنین دمایی، «دمای آدیاباتیک شعله» (Adiabatic Flame Temperature) گفته میشود. این دما را میتوان با افزایش نسبت هوا به سوخت، کاهش داد. به مثال زیر توجه کنید.
مثال
دمای آدیاباتیک شعله را در حالتی که متان با ۲۵۰ درصد هوای تئوری واکنش میدهد، بدست آورید.
در ادامه شماتیک فرآیند احتراق و رابطه شیمیایی واکنش مفروض ارائه شدهاند.
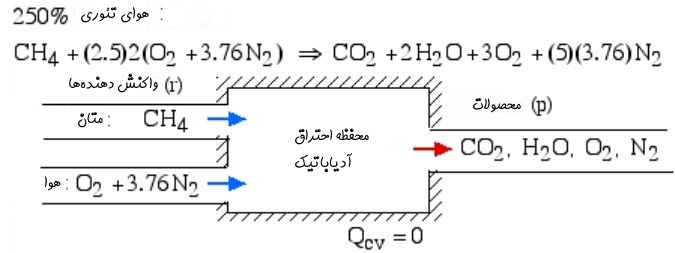
بدیهی است که تغییرات آنتالپی محصولات و واکنشدهندهها برابر با انتقال حرارت رخ داده در این فرآیند است. با صفر قرار دادن انتقال حرارت مذکور داریم:
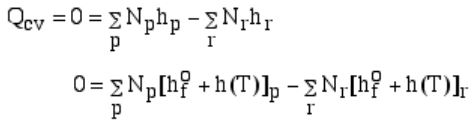
در رابطه بالا (h(T تغییرات آنتالپی مواد نسبت به شرایط استاندارد را نشان میدهد. از طرفی میدانیم که واکنشدهندهها در حالت استاندارد قرار دارند. از این رو اجزا رابطه بیان شده در بالا به شکل زیر هستند.
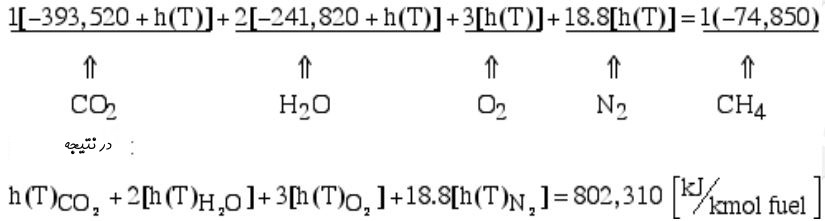
توجه داشته باشید که رابطه بین آنتالپی و دما به صورت خطی نیست. در نتیجه بایستی با استفاده از آزمون و خطا، همچنین با بهکارگیری جدول آنتالپی بر حسب دما، دمای آدیاباتیک را یافت که کار مشکلی است. در روش دیگری که توسط Potter و Somerton ارائه شد، تمامی محصولات را به صورت هوا در نظر گرفتند. با این فرض و با استفاده از مفهوم ضریب انتقال حرارت در فشار ثابت، دمای آدیاباتیک شعله، به شکل زیر بدست میآید.

جهت تمرین بیشتر میتوانید دمای آدیاباتیک شعله را در واکنش پروپان با ۲۵۰ درصد هوای تئوری بدست آورید. پیشنهاد میکنیم جهت تسلط هرچه بیشتر به فرآیند احتراق میتوانید به این لینک مراجعه کنید. همچنین در صورت علاقهمندی به مباحث مرتبط در زمینه مهندسی آموزشها زیر به شما پیشنهاد میشود:
- مجموعه آموزشهای دروس مهندسی مکانیک
- مجموعه آموزشهای دروس مهندسی شیمی
- آموزش ترمودینامیک ۲
- مجموعه آموزشهای مهندسی شیمی
- آنتالپی چیست؟ -- ار صفر تا صد
^^










سلام ضمن علمی بودن عملی هم هست